La disfunción tiroidea durante la gestación repercute sobre la salud materno-fetal y puede influir en el desarrollo neurocognitivo del niño. La fisiología tiroidea cambia en el embarazo y obliga a establecer valores de referencia (VR) para cada población y método. Los objetivos fueron determinar dichos VR de hormonas tiroideas (HT) empleando 2 inmunoanálisis, estimar el estado nutricional de yodo y la prevalencia de autoinmunidad tiroidea en nuestra población.
Pacientes y métodosSe seleccionó a 378 gestantes de los sectores sanitarios de Zaragoza y Huesca, con determinación de yoduria, anticuerpos antitiroideos y HT mediante 2 inmunoanálisis diferentes (Beckman y Siemens).
ResultadosYoduria media 187μg/L, mediana 146μg/L. El 78% tomaba suplemento (yoduro potásico) y su consumo se relacionó con mayores niveles de yoduria. El 10,8% tenían anticuerpos antiperoxidasa positivos, el 4,4% antitiroglobulina, el 2,4% ambos y el 4,1% anti-TSHr. No hubo asociación entre yoduria y TSH ni T4L. Los VR de TSH en el primer trimestre fueron Beckman 0,2-4 y Siemens 0,2-3,4 mUI/L.
ConclusiónLos VR de HT fueron claramente diferentes a los propuestos por la ATA 2011 pero prácticamente iguales a los descritos en población española utilizando los mismos inmunoanálisis, como propone la ATA 2017. La autoinmunidad tiroidea fue similar a la publicada a nivel nacional e internacional. La media y la mediana de yodurias son de las más elevadas publicadas en España hasta el momento y dependen principalmente de la toma de yoduro potásico para alcanzar los objetivos de la OMS, lo que avala las recomendaciones de suplementación con al menos 150μg de yodo.
Thyroid dysfunction during pregnancy affects maternal and foetal health, which may influence the child's neurocognitive development. The thyroid physiology changes during pregnancy, requiring reference values (RV) to be established for each population and method. The objectives were to determine these thyroid hormone (TH) RV using 2 immunoassays and to estimate the nutritional status of iodine and the prevalence of thyroid autoimmunity in our population.
Patients and methodsA total of 378 pregnant women from the health sectors of Zaragoza and Huesca, whose urinary iodine, antithyroid antibody and TH levels were assessed by 2different immunoassays (Beckman and Siemens), were enrolled.
ResultsThe mean urinary iodine concentration was 187μg/l, with a median concentration of 146μg/l. From them, 78% took potassium iodide supplements and their consumption was related to higher levels of urinary iodine; 10.8% were positive for antithyroid peroxidase antibodies, 4.4% for anti-thyroglobulin antibodies, 2.4% for both and 4.1% for anti-TSHr. There was no association between urinary iodine and TSH or T4L. The reference values of TSH in the first trimester were Beckman: 0.2-4 and Siemens 0.2-3.4 mIU/l.
ConclusionThe thyroid hormone reference values were markedly different from those proposed by the ATA-2011 guidelines but practically identical to those described in the Spanish population using the same immunoassays, as proposed by the ATA-2017 guidelines. Thyroid autoimmunity was similar to that published nationally and internationally. The mean and median urinary iodine levels are among the highest published in Spain to date and depend mainly on supplementation with potassium iodide to reach the WHO objectives, supporting the recommendations for supplementation with at least 150μg of iodine.
El hipotiroidismo franco en el embarazo, definido por el aumento de TSH con disminución de tiroxina libre (T4L), o por una concentración de TSH>10 mUI/L, independientemente de la T4L1-3, se asocia a efectos nocivos en la gestación4,5 y en el desarrollo neurocognitivo fetal6. Por esta razón, se recomienda realizar un diagnóstico y tratamiento precoces de dicho proceso1-3,7. El hipotiroidismo subclínico, definido como el aumento de TSH entre 10 mUI/L y el límite superior de normalidad específico para cada trimestre, población e inmunoanálisis, con concentración de T4L normal1-3, se relaciona también con efectos adversos en el embarazo en algunos estudios8,9, pero no en otros, con resultados opuestos10 y, de forma más dudosa, con el desarrollo neurocognitivo fetal en trabajos a favor de esta asociación11 o en contra12. Aún con un grado de evidencia bajo, las principales guías clínicas contemplan el tratamiento con levotiroxina de las gestantes con hipotiroidismo subclínico tanto con autoinmunidad positiva como negativa y asumen que los beneficios potenciales del tratamiento sobrepasan el riesgo de efectos adversos2,3,7.
Durante el embarazo se producen importantes cambios en la fisiología tiroidea, entre los que destacan un descenso de TSH en el primer trimestre por aumento de HCG, un incremento de la globulina fijadora de tiroxina, un aumento del aclaramiento renal de yodo y una disminución sustancial de las concentraciones séricas de T4L según avanza la gestación13. La medición de T4L en gestantes es compleja por el aumento de la globulina fijadora de tiroxina y la disminución de albúmina, lo que puede ocasionar que los diferentes inmunoanálisis reporten valores falsamente disminuidos de dicha hormona13,14. Los cambios mencionados determinan variaciones significativas de parámetros bioquímicos tiroideos según la edad gestacional, lo que hace que los valores de referencia de los diversos kits comerciales para hormonas tiroideas no sean válidos durante el embarazo, al ser obtenidos mayoritariamente en población general. Pero, a su vez, es importante resaltar la marcada diferencia reportada en estos intervalos en población gestante según el fabricante de cada inmunoanálisis empleado15,16.
Todo ello conlleva la necesidad de establecer valores de referencia de función tiroidea específicos para el embarazo, preferiblemente por trimestres, para cada población y método. En caso de no tener disponibles estos valores específicos, las principales sociedades científicas ATA, ETA y AAEE en sus directrices de 2011, 2012 y 20141,3,7, respectivamente, recomendaban emplear unos límites superiores de normalidad para TSH de 2,5 en el primer trimestre, de 3 en el segundo y de 3-3,5 mUI/L en el tercero. Pero esta recomendación tampoco parecía muy precisa, dado que la gran mayoría de las publicaciones posteriores, tanto nacionales como internacionales, con los diferentes inmunoanálisis actuales, reportaban valores de normalidad significativamente superiores. Esto elevaba de forma importante el diagnóstico de hipotiroidismos subclínicos, con las consiguientes repercusiones económicas, laborales y médicas. Esta misma apreciación ha sido puesta de manifiesto en la nueva guía de la ATA para el diagnóstico y manejo de la enfermedad tiroidea durante del embarazo y el posparto, publicada en enero de 2017, que recomienda, en primer lugar, establecer valores de referencia específicos y por trimestres para cada población y método, pero en caso de no disponer de ellos aconseja emplear los intervalos aportados por estudios en poblaciones similares que hayan empleado el mismo inmunoanálisis de TSH que el utilizado en cada uno de nuestros laboratorios correspondientes. Estos valores, según la guía, suelen corresponder a un descenso de entre 0,5 y 1 mUI/L del límite superior del ensayo para población no gestante, con un valor medio de 4 mUI/L para la mayoría de los métodos2. Esta última recomendación, si bien parece ser bastante más precisa que la de 2011, puede no corresponderse con determinados inmunoanálisis.
El objetivo de nuestro estudio es determinar los valores de referencia de TSH, T4L y T3L por trimestres en 2 muestras poblacionales de mujeres gestantes de Aragón, cada una mediante un inmunoanálisis diferente, establecer el estado nutricional de yodo mediante medición de yoduria y encuesta nutricional en el primer trimestre, y estimar la prevalencia de la autoinmunidad tiroidea.
Material y métodosSe estudió una muestra de gestantes sanas de los diferentes sectores sanitarios de Zaragoza y Huesca incluyendo tanto a población urbana como rural, mediante el empleo de 2 inmunoanálisis diferentes para la determinación de TSH, T4L y T3L: grupo A (Beckman Coulter) y grupo B (Siemens Centaur) con los siguientes criterios de inclusión y exclusión:
Criterios de inclusión: gestantes sanas, sin enfermedad tiroidea conocida que acepten voluntariamente su participación mediante la firma del consentimiento informado y que se encuentren en el primer trimestre de gestación, entre las semanas 8 y 12.
Criterios de exclusión: antecedentes personales conocidos de disfunción tiroidea clínica o subclínica, de cirugía tiroidea, de radioterapia cervical o de administración de 131I. Toma de medicamentos que afecten a la función tiroidea o que puedan interferir en el resultado bioquímico.
Se seleccionó desde los servicios de obstetricia de los diferentes hospitales y centros de especialidades entre junio de 2014 y julio de 2015 a un total de 378 pacientes, 252 procedentes de los sectores Zaragoza I y II con el inmunoanálisis Beckman Coulter y 126 procedentes del sector Zaragoza III y sector Huesca con el inmunoanálisis ADVIA Centaur XP de Siemens. Tras la selección inicial, las gestantes fueron valoradas por los diferentes servicios de endocrinología, se les realizó historia clínica y exploración cervical más ecografía, si se consideraba oportuno, junto con encuesta nutricional, y se les proporcionó volante para determinación analítica entre las semanas 9-12, la 22-26 y la 32-36. La edad gestacional fue evaluada ecográficamente. Las variables estudiadas en los 3 trimestres fueron TSH, T4L, T3L, tiroglobulina, anticuerpos antitiroglobulina y antiperoxidasa. En el primer trimestre se determinó adicionalmente HCG, anticuerpos antirreceptor de TSH y yoduria.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de Aragón adscrito al Departamento de Sanidad del Gobierno de Aragón. Se obtuvo el consentimiento informado por escrito en todas las pacientes incluidas.
Métodos de laboratorioBeckman CoulterLas determinaciones de TSH, T4L, T3L, anticuerpos antiperoxidasa y anticuerpos antitiroglobulina se realizaron mediante los inmunoanálisis de quimioluminiscencia con partículas paramagnéticas en 3autoanalizadores UniCel DxI 800 Access (Beckman Coulter, Brea, CA, EE. UU.). La sensibilidad analítica para TSH, T4L, T3L es de 0,003 mUI/L, 0,25 ng/dL y 0,88 pg/mL, respectivamente, y la sensibilidad funcional para TSH es de 0,015 mUI/L. Los intervalos de referencia con este método para hombres y mujeres adultos, no gestantes, son los siguientes: TSH 0,38-5,33 mUI/L; T4L 0,58-1,64 ng/dL y T3L 2,06-4,01 pg/mL.
Siemens CentaurLas determinaciones de TSH, T4L, T3L se realizaron mediante inmunoanálisis de quimioluminiscencia con partículas paramagnéticas en un autoanalizador ADVIA Centaur XP de Siemens (Siemens Healthcare Diagnostics, Erlangen, Alemania). La determinación de los anticuerpos antiperoxidasa y anticuerpos antitiroglobulina se realizó mediante enzimoinmunoanálisis en un analizador Quanta-Lyser 160, todo ello de Inova (Inova Diagnostics, San Diego, CA, EE. UU.). La sensibilidad analítica para TSH, T4L, T3L es de 0,003 mUI/L, 0,10 ng/dL y 0,2 pg/mL, respectivamente, y la sensibilidad funcional para TSH es de 0,008 mUI/L. Los intervalos de referencia empleados con este método para hombres y mujeres adultos, no gestantes, son los siguientes: TSH 0,55-4,78 mUI/L, T4L 0,89-1,76 ng/dL y T3L 2,3-4,2 pg/mL.
La yoduria, analizada mediante cromatografía líquida de alta resolución, con un límite de detección, es de 0,04μmol/L y tiene una precisión intra- e interserial de 4,5 y 7,9%, respectivamente, a una concentración de 0,43μmol/L.
Análisis estadísticoLos datos fueron analizados mediante el programa estadístico SPSS v. 18. La normalidad de la distribución de las variables cuantitativas incluidas, las hormonas tiroideas (TSH, T4L y T3L), se estudió mediante la prueba de Kolmogorov-Smirnov. La TSH no seguía una distribución normal y precisó una transformación logarítmica para ajustarla a una distribución paramétrica.
Los resultados descriptivos se realizaron para cada variable individualmente y por trimestres. Fueron expresados en media, mediana y en percentiles del 2,5 al 97,5, siguiendo las recomendaciones de la International Federation of Clinical Chemistry17,18, para cada inmunoanálisis empleado. El contraste de hipótesis entre 2muestras, incluida la comparación de características basales entre los grupos A y B, se realizó mediante las pruebas t de Student, U de Mann-Whitney o Chi-cuadrado (χ2), según el tipo de variable y su distribución. En la evaluación de posibles diferencias en los test de función tiroidea según el trimestre de gestación se emplearon test paramétricos (ANOVA de un factor) o no paramétricos (Kruskal-Wallis) en función del tipo de distribución de las variables comparadas. La dependencia entre variables se determinó mediante los coeficientes de correlación (r de Pearson o R de Sperman), según el ajuste a la normalidad.
En todos los casos la decisión estadística se hizo para un nivel de rechazo de H0 de α=0,05, de 2colas.
ResultadosSe ha estudiado a 378 gestantes con una edad media de 32,3 años (límites: 18-43), índice de masa corporal de 24,1 y raza predominantemente caucásica (98,6%). El 44,2% refirió estudios universitarios y el 17,9% fumaba durante el embarazo una media de 6,3 cigarrillos al día. En referencia al estado nutricional de yodo, la media de yoduria fue 187μg/L y la mediana 146μg/L; el 49% presentó una yoduria superior a 150μg/L. Un 56,2% consumía sal yodada en su dieta habitual, pero este consumo no se relacionó con unos niveles superiores de yoduria media (186 vs. 188μg/L del grupo con y sin sal yodada, respectivamente; p=0,86). No hubo diferencias en la toma de suplemento con yodo entre ambos grupos. Sin embargo, el 78% de las embarazadas tomaba suplemento (dosis media de 201μg de yoduro potásico al día) y su consumo sí se relacionó con mayores niveles de yoduria media (200 vs. 141μg/L del grupo con y sin suplemento, respectivamente; p=0,001). No hubo diferencias en el consumo de sal yodada entre estos grupos.
Respecto a la presencia de autoinmunidad tiroidea en cualquiera de los trimestres, el 10,8% de las gestantes tenían anticuerpos antiperoxidasa positivos, el 4,4% antitiroglobulina, el 2,4% ambos y el 4,1% antirreceptor de TSH.
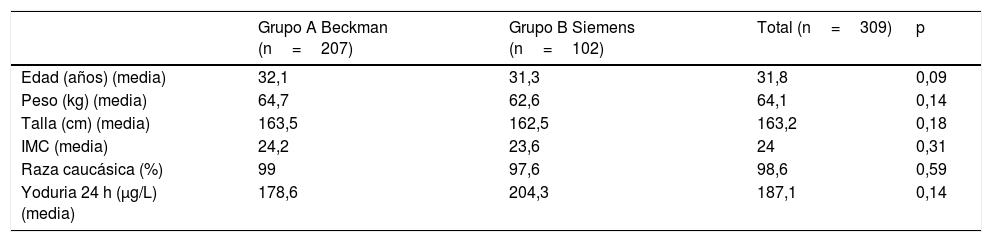
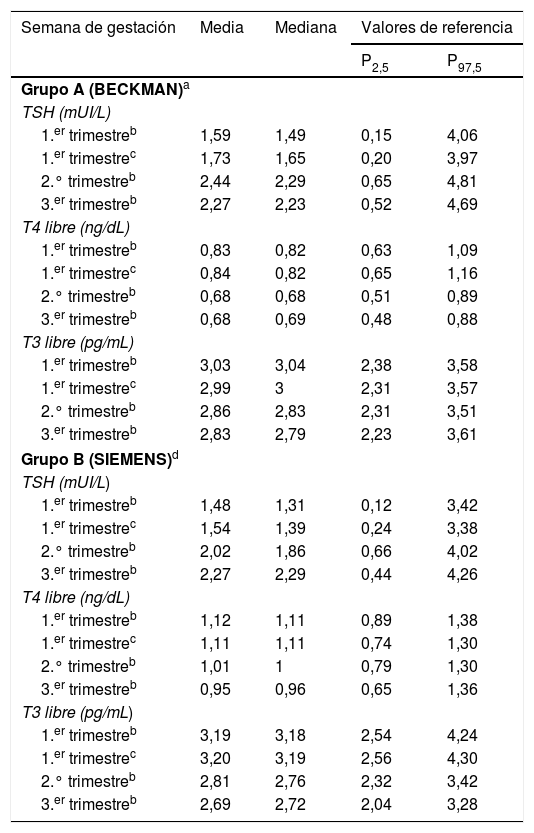
Para la obtención de los valores de referencia se descartó a aquellas mujeres con autoinmunidad tiroidea positiva (antiperoxidasa o antitiroglobulina o antirreceptor de TSH) (57; 15,1%) en cualquiera de los trimestres, o presencia de bocio a la exploración inicial del primer trimestre (12; 3,2%): quedaron 309 gestantes, 207 del grupo A (Beckman Coulter) y 102 del grupo B (Siemens Centaur). Las características basales de estas mujeres se detallan en la tabla 1 y las medidas de centralización, dispersión e intervalos de referencia de los 2 inmunoanálisis de función tiroidea empleados se expresan en la tabla 2.
Descripción de la población con autoinmunidad negativa, según inmunoanálisis
| Grupo A Beckman (n=207) | Grupo B Siemens (n=102) | Total (n=309) | p | |
|---|---|---|---|---|
| Edad (años) (media) | 32,1 | 31,3 | 31,8 | 0,09 |
| Peso (kg) (media) | 64,7 | 62,6 | 64,1 | 0,14 |
| Talla (cm) (media) | 163,5 | 162,5 | 163,2 | 0,18 |
| IMC (media) | 24,2 | 23,6 | 24 | 0,31 |
| Raza caucásica (%) | 99 | 97,6 | 98,6 | 0,59 |
| Yoduria 24 h (μg/L) (media) | 178,6 | 204,3 | 187,1 | 0,14 |
IMC: índice de masa corporal.
Medidas de centralización y valores de referencia de los test de función tiroidea
| Semana de gestación | Media | Mediana | Valores de referencia | |
|---|---|---|---|---|
| P2,5 | P97,5 | |||
| Grupo A (BECKMAN)a | ||||
| TSH (mUI/L) | ||||
| 1.er trimestreb | 1,59 | 1,49 | 0,15 | 4,06 |
| 1.er trimestrec | 1,73 | 1,65 | 0,20 | 3,97 |
| 2.° trimestreb | 2,44 | 2,29 | 0,65 | 4,81 |
| 3.er trimestreb | 2,27 | 2,23 | 0,52 | 4,69 |
| T4 libre (ng/dL) | ||||
| 1.er trimestreb | 0,83 | 0,82 | 0,63 | 1,09 |
| 1.er trimestrec | 0,84 | 0,82 | 0,65 | 1,16 |
| 2.° trimestreb | 0,68 | 0,68 | 0,51 | 0,89 |
| 3.er trimestreb | 0,68 | 0,69 | 0,48 | 0,88 |
| T3 libre (pg/mL) | ||||
| 1.er trimestreb | 3,03 | 3,04 | 2,38 | 3,58 |
| 1.er trimestrec | 2,99 | 3 | 2,31 | 3,57 |
| 2.° trimestreb | 2,86 | 2,83 | 2,31 | 3,51 |
| 3.er trimestreb | 2,83 | 2,79 | 2,23 | 3,61 |
| Grupo B (SIEMENS)d | ||||
| TSH (mUI/L) | ||||
| 1.er trimestreb | 1,48 | 1,31 | 0,12 | 3,42 |
| 1.er trimestrec | 1,54 | 1,39 | 0,24 | 3,38 |
| 2.° trimestreb | 2,02 | 1,86 | 0,66 | 4,02 |
| 3.er trimestreb | 2,27 | 2,29 | 0,44 | 4,26 |
| T4 libre (ng/dL) | ||||
| 1.er trimestreb | 1,12 | 1,11 | 0,89 | 1,38 |
| 1.er trimestrec | 1,11 | 1,11 | 0,74 | 1,30 |
| 2.° trimestreb | 1,01 | 1 | 0,79 | 1,30 |
| 3.er trimestreb | 0,95 | 0,96 | 0,65 | 1,36 |
| T3 libre (pg/mL) | ||||
| 1.er trimestreb | 3,19 | 3,18 | 2,54 | 4,24 |
| 1.er trimestrec | 3,20 | 3,19 | 2,56 | 4,30 |
| 2.° trimestreb | 2,81 | 2,76 | 2,32 | 3,42 |
| 3.er trimestreb | 2,69 | 2,72 | 2,04 | 3,28 |
Trimestres: 1.°: 9-12, 2.°: 22-26, 3.°: 32-36 semanas.
Para ambos grupos estudiados según el inmunoanálisis empleado, A y B, los niveles medios de TSH fueron inferiores, con significación estadística en el primer trimestre de embarazo con respecto al segundo y tercero (A y B p<0,001), con una correlación entre HCG y TSH en el primer trimestre de −0,213 (p <0,01) en el grupo A y de −0,298 (p=0,012) en el grupo B. No se apreció diferencia de TSH entre el segundo y el tercer trimestres (A y B p> 0,2). Respecto a la T4L, y también en ambos grupos A y B, los niveles medios fueron inferiores, con significación estadística en el segundo y tercer trimestres respecto al primero (A y B p<0,001), sin diferencias entre segundo y tercero (A: p=0,99; B: p=0,06) (tabla 2).
En el grupo A de Beckman Coulter, el 14,5% de las gestantes sanas, con autoinmunidad tiroidea negativa y sin antecedentes personales de disfunción tiroidea, presentó un valor de TSH superior a 2,5 mUI/L en el primer trimestre y del 26,5 y el 20,8% en el segundo y tercer trimestres, respectivamente, superior a 3 mUI/L. En el grupo B de Siemens Centaur, el 14,1% presentó un valor de TSH superior a 2,5 mUI/L en el primer trimestre y del 11,3 y el 27,1% en el segundo y tercer trimestres, respectivamente, superior a 3 mUI/L.
DiscusiónDebido a los cambios fisiológicos del embarazo en la función tiroidea, no se pueden emplear para su evaluación los valores de referencia obtenidos a partir de población general. Además, es importante resaltar la marcada diferencia en dichos límites de normalidad en población gestante en función del inmunoanálisis empleado15,16. Todo ello —añadido al enorme incremento de hipotiroidismos subclínicos teóricos detectados en caso de aplicar las recomendaciones ATA, ETA y AAEE en sus directrices de 2011, 2012 y 20141,3,7, respectivamente— nos motivó para realizar el presente estudio en población propia, como recomiendan las principales sociedades científicas1-3,7.
Para la obtención de los valores de referencia, se realizó una trasformación a la normalidad de las variables no paramétricas (TSH), para lograr una mayor precisión con una muestra poblacional menor.
Los límites superiores de referencia de TSH en los 3trimestres (percentil 97,5) fueron considerablemente superiores, con ambos métodos, a los recomendados por ATA 20111; sin embargo, se aproximaron mucho a los descritos en población española utilizando los mismos inmunoanálisis que los nuestros, como propone la ATA 20172. Con Beckman Coulter en Jaén19, percentil 97,5 de TSH en el 1.er trimestre: 4,18 vs. 4,06 mUI/L en nuestro grupo A. Con Siemens Centaur en el Bierzo (León)20, percentil 97,5 de TSH en el 1.er trimestre: 3,59 vs. 3,42 mUI/L en nuestro grupo B.
Es la primera vez que en nuestro país se realiza un diseño de estudio con 2inmunoanálisis diferentes en 2muestras poblacionales homogéneas y pertenecientes a la misma región, en las que podemos observar la importancia fundamental del método bioquímico y como los valores de referencia son mucho más próximos entre 2poblaciones de diferentes ciudades, comunidades autónomas e incluso países16,20,21 si se emplea el mismo método, que entre una población homogénea de la misma ciudad o región con métodos diferentes, siempre y cuando no existan grados extremos de yododeficiencia, como puede ocurrir en países en vías de desarrollo, o en poblaciones con predominio de razas diferentes.
Consideramos interesante resaltar que, en nuestro estudio, entre un 14 y un 27% de las gestantes sanas, dependiendo del trimestre y del inmunoanálisis, serían diagnosticadas erróneamente de hipotiroidismo subclínico si aplicáramos las recomendaciones ATA, ETA y AAEE de 2011, 2012 y 2014, respectivamente1,3,7, en caso de no tener realizado el presente trabajo.
En general, se pone especial atención a los valores de referencia de TSH, pero creemos que también es fundamental conocer los intervalos de T4L, principalmente en el 2.° y 3.er trimestres, por los cambios fisiológicos propios de la gestación, que hacen que difieran de forma muy significativa respecto a la población no embarazada, debido sobre todo a modificaciones en la unión a proteínas trasportadoras. Debemos recordar que los métodos habituales no determinan T4L de forma directa y se ven claramente afectados por estas circunstancias. En nuestro estudio, podemos observar como los valores de T4L descienden de forma importante y con significación estadística en el 2.° y 3.er trimestres, y como los límites de normalidad, tanto superior como inferior, en estos trimestres son hasta un 46 y un 27% inferiores, respectivamente, comparados con los de población no gestante, en función del método empleado. Conocer estos intervalos es indispensable para no diagnosticar de forma errónea una hipotiroxinemia aislada, para diferenciar un hipertiroidismo franco de uno subclínico, para un ajuste preciso de medicación antitiroidea en caso de ser necesaria, así como para el manejo de algunos casos de hipotiroidismo como el hipofisario, y evitar de este modo complicaciones materno-fetales importantes6.
La presencia de autoinmunidad tiroidea durante la gestación oscila entre el 2 y el 17% según diferentes estudios19,22. En nuestro caso, el 10,8% de las gestantes tenían anticuerpos antiperoxidasa positivos, el 4,4% antitiroglobulina y el 2,4% ambos. Cabe reseñar que la prevalencia de anticuerpos varía en función de la raza, la edad o la ingesta de yodo23,24.
Respecto al estado nutricional de yodo, cabe destacar que los niveles de yoduria de nuestra población en el primer trimestre (media: 187; mediana: 146μg/L) fueron mayores que los publicados por otros estudios en nuestro país: Vila et al. en Cataluña (2010)23 con media de 163μg/L; Santiago et al. en Jaén (2010)19 con media de 129 y mediana de 110μg/L; González et al. en Castilla y León (2011)25 con media de 151 y mediana de 121μg/L y Lombardo et al. en El Bierzo (León)20 en 2013, con mediana de 118μg/L, pero fueron considerablemente inferiores a los reportados en otros países como Japón por Orito et al. en 2009 (mediana: 328μg/L). Otro dato observado en nuestro trabajo es que el porcentaje de gestantes que tomaban suplemento con yodo (una media de 201μg/día) era del 78%, considerablemente superior al de otros estudios como el de González et al. (16%)25 o Vila et al. (13,4%)23. Además existe, en nuestra serie, una estrecha relación de la yoduria con la toma de suplementos de yoduro potásico durante el primer trimestre y no con la ingesta de sal yodada, con unos niveles de yoduria media de 200μg/L con suplemento vs. 141μg/L sin suplemento (p=0,001), independientemente del consumo o no de sal yodada. Por lo tanto, solo las yodurias medias de las mujeres que consumían suplementos durante la gestación se encontraban en el rango de yodosuficiencia, establecido por la Organización Mundial de la Salud (OMS) en 150-249μg/l26.
Estos resultados avalan la necesidad de prescribir a casi todas las gestantes un complemento de yoduro potásico para alcanzar unos niveles óptimos de yoduria y van claramente en la línea de las directrices del Grupo de Trabajo de Trastornos relacionados con la Deficiencia de Yodo y Disfunción Tiroidea de la Sociedad Española de Endocrinología y Nutrición27, la American Thyroid Association for the Diagnosis and Management of Thyroid Disease during Pregnancy and the Postpartum Thyroid2, la European Thyroid Association3 y la OMS26, que recomiendan una ingesta de unos 250μg de yodo al día. Para ello, en la mayoría de países, incluidos los occidentales, se precisa suplementar la dieta con un preparado que contenga al menos 150μg de yodo en forma de yoduro potásico, preferiblemente 3 meses antes de planificar la gestación2. Recordamos que 131μg de yoduro potásico equivalen a 100μg de yodo. Como ha sido reflejado por varios estudios, la adición de 150μg de yodo al día es segura durante el embarazo, e incluso en mujeres con un adecuado estado nutricional de yodo se podría llegar a una ingesta diaria total de 500μg20,28. También existen estudios de seguridad con dosis superiores, entre 500 y 1.000μg28,29.
Concluimos que es fundamental disponer de valores de referencia específicos por trimestres para cada inmunoanálisis y, si es posible, en población gestante propia para evitar diagnosticar erróneamente de hipotiroidismo subclínico a un porcentaje muy elevado de mujeres sanas. En caso de no disponer de esos valores, aconsejamos seguir las recomendaciones actuales de la ATA 2017 y no las del 2011. También resaltamos la importancia de conocer los límites de normalidad de T4L en el embarazo, que difieren de la población general en igual o mayor medida que la TSH. Y, por último, destacamos unos valores de yoduria medios superiores a los descritos en otras comunidades autónomas, aunque claramente inferiores a los registrados en los países con mayor grado de yodosuficiencia, e insistimos en la necesidad de suplementar la dieta con un preparado de al menos 150μg de yodo en forma de yoduro potásico, como recomiendan las principales guías de práctica clínica2,3,27 y la OMS26.
FinanciaciónEste trabajo ha sido financiado parcialmente por una beca/ayuda de la Sociedad Aragonesa de Endocrinología y Nutrición (SADEN).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos especialmente a los profesionales de los servicios de Ginecología y Obstetricia de los diferentes centros sanitarios implicados en el estudio su colaboración en la selección de pacientes.