La infección por Helicobacter pylori (H. pylori) desempeña un papel fundamental en el desarrollo de diversas enfermedades digestivas, por lo que su diagnóstico y tratamiento representa un capítulo de gran relevancia clínica. Se han organizado hasta el momento diversas conferencias de consenso sobre el diagnóstico y tratamiento de la infección por este microorganismo en América, Europa y Asia. En el año 1999 se organizó la primera Conferencia Española de Consenso sobre la infección por H. pylori1,2 y en 2004, la segunda3,4. Ya en aquel momento se destacó que el rápido avance de los conocimientos hace que este tipo de reuniones de consenso pueda perder actualidad en periodos relativamente breves, por lo que se preveía su actualización permanente. Ocho años más tarde, en noviembre de 2012, se ha organizado la tercera Conferencia Española de Consenso sobre la infección por H. pylori, en la que se han planteado los siguientes objetivos: a) establecer las indicaciones precisas de su diagnóstico y tratamiento; b) clarificar la utilización de los diferentes métodos diagnósticos, y c) evaluar el tratamiento más adecuado de la infección por H. pylori.
MetodologíaParticipantes en el consensoSe invitó a todos los profesionales que hubieran participado en alguno de los 2 consensos nacionales previos. Además, puesto que la última conferencia de consenso se había celebrado en 2004, se identificó (mediante la estrategia de búsqueda «pylori AND Spain» en PubMed) a los investigadores que durante los últimos 5 años hubieran publicado algún artículo sobre la infección por H. pylori. Dos gastroenterólogos (JPG y XC) actuaron de coordinadores. Participaron gastroenterólogos, microbiólogos, médicos de atención primaria y expertos en metodología científica y medicina basada en la evidencia.
Búsquedas bibliográficasSe ha priorizado la identificación de revisiones sistemáticas y otros documentos de síntesis crítica de la literatura científica. Se han consultado las siguientes bases de datos electrónicas: TRIP Database, NHS National Library of Guidelines, National Guideline Clearinghouse, Cochrane Database of Systematic Reviews (The Cochrane Library), Database of Abstracts of Reviews of Effects (DARE) y MEDLINE (accedido mediante PubMed). En una segunda fase, se ha llevado a cabo una búsqueda de estudios individuales, ensayos clínicos aleatorizados y estudios observacionales.
Clasificación de la evidencia científica y fuerza de las recomendacionesPara clasificar la evidencia científica y la fuerza de las recomendaciones se utilizó el sistema Grading of Recommendations Assessment, Development and Evaluation Working Group (GRADE) (http://www.gradeworkinggroup.org/) en lugar del sistema propuesto por el Centro de Medicina Basada en la Evidencia (Centre for Evidence Based Medicine de Oxford), que se había empleado en las conferencias de consenso previas. El sistema GRADE es una propuesta de clasificación estructurada y explícita que está siendo adoptada de manera generalizada en el ámbito internacional. Uno de los objetivos de la propuesta GRADE es superar las limitaciones de los sistemas previos y conseguir consolidar un sistema homogéneo para todas las instituciones que formulan recomendaciones5.
Evaluación de las recomendaciones por el grupo de consensoLas recomendaciones fueron elaboradas inicialmente por los coordinadores, y revisadas posteriormente por al menos uno de los participantes en el Consenso. Posteriormente, las recomendaciones fueron sometidas a un proceso de votación mediante metodología Delphi6. Los participantes establecieron si consideraban la recomendación adecuada, emitieron su grado de acuerdo mediante una escala de Likert de 6 grados (1: totalmente en desacuerdo; 2: bastante en desacuerdo; 3: algo en desacuerdo; 4: algo de acuerdo; 5: bastante de acuerdo; 6: totalmente de acuerdo) e hicieron sugerencias de modificación o de nuevas recomendaciones. Tras la primera votación, los 2 coordinadores revisaron las recomendaciones de acuerdo a los comentarios recibidos, procediéndose a una segunda votación. Las recomendaciones resultantes de la segunda votación se discutieron y aprobaron durante una reunión presencial. La reunión presencial se realizó en Madrid en noviembre de 2012, moderada por los 2 coordinadores (JPG y XC). Durante la reunión se revisaron, modificaron (cuando fue necesario) y votaron nuevamente las recomendaciones. Una recomendación era aprobada si más del 75% de los participantes estaba de acuerdo (puntación de 4 a 6 en la escala de Likert).
Aspectos éticosEl consenso se ajustó a las recomendaciones éticas establecidas7.
RecomendacionesCada recomendación se acompaña del resultado de la votación (porcentaje de acuerdo), el grado de recomendación (GR; fuerte o débil), la calidad de la evidencia (CE; alta, moderada, baja o muy baja) y de la discusión de la evidencia correspondiente.
Sección A: Indicaciones de tratamiento de la infección por Helicobacter pyloriEn la tabla 1 se incluyen las recomendaciones aprobadas por el consenso español sobre las indicaciones de tratamiento de la infección por H. pylori. En la tabla 2 se resumen las indicaciones aceptadas.
Recomendaciones sobre las indicaciones de tratamiento de la infección por Helicobacter pylori
| Recomendación A1: En los pacientes con úlcera péptica e infección por H. pylori se recomienda administrar tratamiento erradicador |
| Recomendación A2: En los pacientes con dispepsia no investigada menores de 55 años y sin síntomas ni signos de alarma se recomienda la estrategia test and treat como primera opción, por delante del tratamiento antisecretor empírico o la endoscopia |
| Recomendación A3: En los pacientes con dispepsia funcional e infección por H. pylori se recomienda tratamiento erradicador como estrategia terapéutica |
| Recomendación A4: En aquellos pacientes que van a requerir tratamiento con AINE o AAS de manera continuada no se recomienda investigar y tratar sistemáticamente la infección por H. pylori. En aquellos pacientes con antecedentes de úlcera que van a requerir tratamiento con AINE o AAS de manera continuada se recomienda investigar la infección por H. pylori y realizar tratamiento |
| Recomendación A5: En pacientes con linfoma MALT gástrico de bajo grado se recomienda investigar la infección por H. pylori y realizar tratamiento erradicador como primera opción terapéutica |
| Recomendación A6: En pacientes con resección quirúrgica o endoscópica de un cáncer gástrico se recomienda investigar y tratar la infección por H. pylori como prevención de la recidiva neoplásica |
| Recomendación A7: En los familiares de primer grado de los pacientes con cáncer gástrico se recomienda investigar y tratar la infección por H. pylori |
| Recomendación A8: En pacientes con atrofia mucosa gástrica o metaplasia intestinal asociada a infección por H. pylori se recomienda tratamiento erradicador |
| Recomendación A9: En pacientes que van a requerir tratamiento con IBP de manera continuada no se recomienda investigar sistemáticamente la infección por H. pylori |
| Recomendación A10: En pacientes con anemia ferropénica de causa no aclarada se recomienda investigar y tratar la infección por H. pylori |
| Recomendación A11: En pacientes con púrpura trombocitopénica idiopática se recomienda investigar y tratar la infección por H. pylori |
| Recomendación A12: En pacientes con déficit de vitamina B12 no explicable por otras causas se recomienda investigar y tratar la infección por H. pylori |
| Recomendación A13: En pacientes con rosácea no se recomienda investigar y tratar la infección por H. pylori |
| Recomendación A14: En pacientes con urticaria crónica no se recomienda investigar y tratar la infección por H. pylori |
| Recomendación A15: A todo paciente diagnosticado de infección por H. pylori se recomienda ofrecerse tratamiento erradicador |
Indicaciones de tratamiento de la infección por Helicobacter pylori
| Úlcera péptica |
| Dispepsia no investigada < 55 años y sin síntomas/signos de alarma (estrategia test and treat) |
| Dispepsia funcional |
| Antecedentes de úlcera que van a requerir tratamiento con AINE o AAS de manera continuada |
| Linfoma MALT gástrico de bajo grado |
| Resección quirúrgica o endoscópica de un cáncer gástrico |
| Familiares de primer grado de pacientes con cáncer gástrico |
| Atrofia mucosa gástrica o metaplasia intestinal |
| Anemia ferropénica de causa no aclarada |
| Púrpura trombocitopénica idiopática |
| Déficit de vitamina B12 no explicable por otras causas |
| A todo paciente diagnosticado de infección por H. pylori se recomienda ofrecer tratamiento erradicador |
En los pacientes con úlcera péptica e infección por H. pylori se recomienda administrar tratamiento erradicador. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La utilidad de la erradicación de H. pylori en el tratamiento de las úlceras gastroduodenales es bien conocida desde hace muchos años8. Una revisión sistemática de la Colaboración Cochrane publicada en 2006 por Ford et al. confirma la gran eficacia del tratamiento erradicador para la curación de la úlcera9. Referencias posteriores constatan también la utilidad de la erradicación en la úlcera gástrica10 y en la prevención de distintas complicaciones como, por ejemplo, la recidiva de la hemorragia por úlcera11,12, la estenosis pilórica13 o la perforación14. Por tanto, se recomienda la erradicación de la infección por H. pylori en todos los pacientes tanto con úlcera activa como con antecedentes de esta. La duodenitis erosiva se asocia con la infección por H. pylori en la práctica totalidad de los casos, y la erradicación del microorganismo previene su recidiva15, por lo que esta lesión debe considerarse, al igual que la úlcera duodenal, indicación de tratamiento erradicador.
Recomendación A2En los pacientes con dispepsia no investigada menores de 55 años y sin síntomas ni signos de alarma se recomienda la estrategia test and treat como primera opción, por delante del tratamiento antisecretor empírico o la endoscopia. Acuerdo 100%; votos: totalmente de acuerdo (69%); bastante de acuerdo (19%); algo de acuerdo (12%). GR: fuerte. CE: alta.
No existe acuerdo unánime sobre cuál debe ser la alternativa diagnóstica o terapéutica inicial de elección en el paciente con dispepsia (para más detalles sobre la definición de dispepsia y otros aspectos, se recomienda consultar la guía de práctica clínica sobre el manejo del paciente con dispepsia, elaborada por la Asociación Española de Gastroenterología y la Sociedad Española de Medicina de Familia y Comunitaria16,17). Las 3 aproximaciones a la dispepsia no investigada que se han mostrado más eficaces son la realización de una endoscopia inicial, el tratamiento empírico antisecretor y la denominada estrategia test and treat. Esta última opción consiste en la realización de una prueba «no invasiva» (que no precisa de una endoscopia) para H. pylori y el tratamiento erradicador consiguiente si se demuestra la infección18,19. La estrategia test and treat sería aplicable únicamente a pacientes dispépticos jóvenes (la edad de corte es variable, véase más adelante) y sin síntomas de alarma.
Diversos estudios prospectivos no aleatorizados han demostrado que la estrategia test and treat es efectiva y viable en la práctica clínica20–24. A modo de ejemplo, un reciente estudio de cohortes realizado en un amplio grupo de 736 pacientes españoles comprobó que la estrategia test and treat era aplicable en nuestro medio24. No obstante, la evidencia de mayor calidad a favor de esta opción diagnóstico-terapéutica proviene de los ensayos clínicos aleatorizados y de los metaanálisis, como se resume a continuación.
Test and treat frente a endoscopia inicial. Hasta el momento, 8 ensayos clínicos aleatorizados han comparado la estrategia test and treat frente a la endoscopia inicial25–32. Ninguno de ellos, por separado, ha demostrado diferencias en cuanto a la mejoría de los síntomas dispépticos con ambas opciones. Una reciente revisión sistemática llevada a cabo por la Colaboración Cochrane33 incluyó los estudios que comparaban ambas estrategias. El metaanálisis de estos mostró que la eficacia terapéutica de la estrategia test and treat y la endoscopia inicial era similar y que el ahorro en endoscopias con la primera opción se situaba alrededor del 70%. Con posterioridad a la citada revisión Cochrane, se ha publicado un metaanálisis de datos de pacientes individuales que ha comparado de nuevo la estrategia test and treat frente a la endoscopia inicial34, demostrando que esta última se asocia con un pequeño –aunque estadísticamente significativo– beneficio clínico en cuanto a la mejoría de los síntomas dispépticos (riesgo relativo [RR] de persistir los síntomas a los 12 meses=0,95; intervalo de confianza del 95% (IC 95%)=0,92-0,99); no obstante, la relevancia clínica de esta diferencia es dudosa. En cualquier caso, la conclusión de este metaanálisis es que el coste de la realización rutinaria de una endoscopia como técnica de primera elección en los pacientes con síntomas dispépticos (sin síntomas de alarma) es prohibitiva en la práctica clínica, y que por tanto debe preferirse la estrategia test and treat34. Por otro lado, se ha publicado un número considerable de análisis de coste-efectividad y diversos modelos de análisis de decisión comparando ambas opciones diagnósticas, y todos ellos coinciden en que la estrategia test and treat es notablemente más coste-efectiva que la realización de una endoscopia inicial.
Test and treat frente a tratamiento antisecretor empírico. Cuatro ensayos clínicos han comparado, con un diseño aleatorizado, el tratamiento erradicador frente al antisecretor en pacientes dispépticos32,35–37. Ninguno de ellos demuestra claras diferencias en cuanto a la mejoría sintomática entre las estrategias mencionadas. Más recientemente se ha publicado un metaanálisis de datos de pacientes individuales que ha comparado la estrategia test and treat frente al tratamiento antisecretor empírico38 y ha confirmado que ambas opciones son igualmente eficaces desde el punto de vista de la mejoría sintomática. Los costes del tratamiento empírico con antisecretores fueron discretamente superiores a los de la estrategia test and treat, aunque sin alcanzar diferencias estadísticamente significativas, si bien parece lógico pensar que el beneficio del tratamiento erradicador de H. pylori sobre el tratamiento antisecretor empírico debería aumentar con el paso del tiempo, al ser el efecto del primero estable y el del segundo meramente transitorio38.
La relación coste-efectividad de la estrategia test and treat frente al tratamiento antisecretor empírico depende de la prevalencia de la infección por H. pylori en los pacientes dispépticos. Así, la eficacia de la estrategia test and treat se basa en la resolución de los síntomas fundamentalmente en los pacientes con enfermedad ulcerosa, ya que únicamente un porcentaje limitado de los sujetos con dispepsia funcional mejorará con el tratamiento erradicador39,40. De este modo, donde la infección por H. pylori es frecuente, la prevalencia de úlcera péptica también lo es, y el coste-efectividad de la estrategia test and treat será más adecuado. Por el contrario, en áreas de baja prevalencia de infección por H. pylori deberán realizarse más pruebas diagnósticas para detectar a un paciente infectado y tratarlo, redundando todo ello en un aumento de los costes y una menor efectividad. En este sentido, múltiples estudios de coste-efectividad muestran que en condiciones de prevalencia de H. pylori media o alta la estrategia test and treat resulta más coste-efectiva que el tratamiento antisecretor19. Por el contrario, el tratamiento antisecretor empírico inicial resulta más coste-efectivo cuando la prevalencia de infección por H. pylori es menor del 10-20%19. En nuestro país, la prevalencia de infección por H. pylori en la población general y, en concreto, en pacientes dispépticos, es de alrededor del 50%41,42; y aproximadamente un 20% de los pacientes a los que se les practica una endoscopia precoz por dispepsia presenta una úlcera, aumentando esta proporción hasta el 30% si se consideran únicamente los sujetos infectados por H. pylori43. En estas condiciones, parece evidente concluir que en nuestro medio la estrategia test and treat resultaría más coste-efectiva que el tratamiento antisecretor empírico.
El punto de corte de edad en el que debemos basarnos para elegir entre aplicar la estrategia test and treat o realizar inicialmente una gastroscopia no está bien establecido, y oscila en general entre los 45 y los 55 años. Inicialmente se consideraba como límite de edad los 45 años, pero actualmente parece razonable incrementar dicho límite hasta los 50 e incluso los 55 años. Así, un reciente estudio europeo (procedente de un área geográfica como Escocia, con una elevada incidencia de neoplasias del tracto digestivo superior) ha demostrado que la aparición de cáncer gástrico es excepcional en pacientes menores de 55 años, concluyendo que la realización de una gastroscopia con la intención de descartar una neoplasia gástrica no se justifica en los pacientes con dispepsia que no presenten datos de alarma44. Estos resultados confirman los obtenidos por otros autores, que también clasifican como seguro el punto de corte de los 55 años para realizar o no gastroscopia28,45,46. Además, un estudio español reciente ha demostrado que la clasificación de los pacientes según tuvieran más o menos de 45 años no se relacionaba con los hallazgos endoscópicos de malignidad, que fueron similares en ambos grupos47. Estos datos concuerdan con los de otro estudio llevado a cabo en Estados Unidos48.
Este punto de corte situado en los 55 años ha sido valorado en otro estudio en el que precisamente se evaluaba la estrategia test and treat, con buenos resultados (es decir, sin que se dejara de diagnosticar ningún cáncer gástrico)28. En otro estudio posterior, se confirmó la seguridad de la estrategia test and treat en atención primaria incluso cuando esta se aplicaba a pacientes de hasta 60 años23. Más aún, en otros 2 estudios (uno de ellos llevado a cabo en atención primaria) que evaluaban dicha estrategia no se tuvo siquiera en cuenta la edad de los pacientes sino únicamente la presencia o no de síntomas de alarma, y ninguno de los pacientes incluidos en el grupo test and treat sufrió un cáncer durante el seguimiento27,49. No obstante, parece prudente por el momento situar el punto de corte no más allá de los 55 años19. Por último, diversas guías de práctica clínica, como la británica50 o la americana51,52, han modificado recientemente sus recomendaciones para los pacientes con dispepsia, recomendando actualmente la aplicación de la estrategia test and treat en pacientes menores de 55 años (sin datos de alarma). En cualquier caso, la selección final del punto de corte en una población en concreto podría verse modificada en función del riesgo de cáncer gástrico descrito en cada área geográfica.
En relación a cuál es el método diagnóstico de elección para confirmar o descartar la infección por H. pylori en la estrategia test and treat, se considera que la prueba del aliento con 13C-urea es preferible y más coste-efectiva que la serología; el test de antígeno de H. pylori en heces podría representar una alternativa válida, aunque se precisan más estudios que lo validen específicamente en la estrategia test and treat53–57.
Recomendación A3En los pacientes con dispepsia funcional e infección por H. pylori se recomienda tratamiento erradicador como estrategia terapéutica. Acuerdo 94%; votos: totalmente de acuerdo (63%); bastante de acuerdo (19%); algo de acuerdo (13%); algo en desacuerdo (5%). GR: fuerte. CE: alta.
En primer lugar, es preciso señalar que la clasificación de una dispepsia como «funcional» requiere un estudio diagnóstico adecuado que incluya, al menos, una endoscopia normal, y que excluya cualquier enfermedad orgánica, sistémica o metabólica que justifique los síntomas58. Puesto que la infección por H. pylori es una causa demostrada de gastritis crónica, en sentido estricto, y basándonos en la definición de Roma III, se requeriría excluir esta infección antes de poder etiquetar una dispepsia como verdaderamente funcional58.
Por otra parte, múltiples estudios han comparado la erradicación de H. pylori frente a placebo (o no tratamiento) en el manejo de la dispepsia funcional (empleando la definición clásica, en la que la infección no precisaba ser excluida). Los estudios coinciden en que la erradicación de H. pylori induce una mejoría prolongada de los síntomas dispépticos en un porcentaje de pacientes que oscila entre el 8 y el 14%, con un número necesario a tratar (NNT) para conseguir la mejoría en un paciente de aproximadamente 10. Estos datos han sido confirmados por diversos metaanálisis en poblaciones distintas59,60. Un estudio reciente controlado con placebo y realizado en un área de alta prevalencia de H. pylori –situación similar a la española– describió una tasa de curación de los síntomas dispépticos del 49%, con una reducción absoluta del 14% sobre el placebo, y un NNT de 861. Estas tasas de mejoría sintomática son similares a las descritas con los fármacos actualmente más efectivos para la dispepsia funcional, que son los inhibidores de la bomba de protones (IBP). Sin embargo, los efectos beneficiosos del tratamiento erradicador persisten al año de haber administrado dicho tratamiento, mientras que la mayoría de los pacientes presentan recidiva al suspender la medicación antisecretora (IBP).
Como argumento adicional a favor del tratamiento erradicador de H. pylori estaría el hecho de que la curación de la infección reduce el riesgo posterior de desarrollar una úlcera y sus complicaciones y que puede prevenir a largo plazo la aparición de una neoplasia gástrica.
Recomendación A4En aquellos pacientes que van a requerir tratamiento con antiinflamatorios no esteroideos (AINE) o ácido acetilsalicílico (AAS) de manera continuada no se recomienda investigar y tratar sistemáticamente la infección por H. pylori. Acuerdo 87%; votos: totalmente de acuerdo (50%); bastante de acuerdo (31%); algo de acuerdo (6%); algo en desacuerdo (13%). GR: débil. CE: baja. En aquellos pacientes con antecedentes de úlcera que van a requerir tratamiento con AINE o AAS de manera continuada se recomienda investigar la infección por H. pylori y realizar tratamiento. Acuerdo 94%; votos: totalmente de acuerdo (88%); bastante de acuerdo (6%); algo en desacuerdo (6%). GR: fuerte. CE: baja.
Los estudios epidemiológicos muestran que la infección por H. pylori y los AINE son factores de riesgo independientes para la úlcera péptica y sus complicaciones62. Un metaanálisis publicado en 2005 analizó los ensayos clínicos que evaluaban la utilidad del tratamiento erradicador para evitar la úlcera y sus complicaciones63. El análisis de los 5 estudios detectados señalaba que la erradicación era eficaz para la prevención de la úlcera endoscópica en pacientes que iniciaban tratamiento con AINE, pero carecía de efecto en pacientes que ya recibían tratamiento crónico con estos fármacos. Desde la publicación de este metaanálisis, se ha detectado solamente un estudio relevante adicional64 que señala así mismo que la erradicación no reduce el riesgo de úlcera (evaluado mediante endoscopia) en pacientes que ya están en tratamiento con AINE.
Hay que señalar, además, que los estudios publicados evalúan el desarrollo de úlcera mediante endoscopia y no sus complicaciones, y que ningún paciente en estos estudios recibió tratamiento gastroprotector, por lo que desconocemos el efecto de la erradicación de H. pylori en pacientes que van a recibir tratamiento antisecretor asociado a AINE. Tampoco disponemos de datos sobre la utilidad de la erradicación en pacientes que reciben o van a recibir tratamiento con un inhibidor selectivo de la COX-2. Por otro lado, el efecto de la erradicación de H. pylori es limitado, e inferior al empleo de gastroprotección adecuada63. Por último, es preciso recordar que el tratamiento erradicador previo no modifica las indicaciones de gastroprotección en aquellos pacientes que requieren AINE y presentan factores de riesgo para complicaciones gastrointestinales. Por ello, la recomendación más razonable es evaluar y tratar la infección por H. pylori en los pacientes con una indicación clara de erradicación (esto es, antecedentes de úlcera previa) y valorar individualmente la necesidad de diagnóstico y tratamiento de H. pylori en el resto de pacientes que van a iniciar AINE. En este sentido, podría no ser necesario en un paciente de edad avanzada que requerirá gastroprotección y, en cambio, sería adecuado erradicar la infección en un paciente joven que no tiene indicación de gastroprotección y va a requerir AINE de manera prolongada.
En el caso del AAS, la erradicación previene la gastropatía65–67, por lo que también se ha recomendado el tratamiento erradicador en los pacientes que van a recibir este fármaco, aunque sea a dosis bajas, si bien un metaanálisis reciente señala que no existe evidencia suficiente para concluir que la infección por H. pylori es un factor de riesgo de hemorragia digestiva en los pacientes que reciben AAS de manera continuada68. De nuevo, debido a que la evidencia es limitada, se considera necesaria la erradicación de H. pylori únicamente en casos de antecedente de úlcera.
Recomendación A5En pacientes con linfoma MALT (tejido linfoide asociado a mucosas) gástrico de bajo grado se recomienda investigar la infección por H. pylori y realizar tratamiento erradicador como primera opción terapéutica. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
Si bien no existen estudios aleatorizados que comparen la terapia erradicadora de H. pylori frente al tratamiento convencional (cirugía, quimioterapia o radioterapia) en el manejo del linfoma gástrico MALT, la fuerza de la evidencia científica es suficientemente sólida como para respaldar plenamente el empleo de tratamiento erradicador, basándose en los siguientes argumentos:
- 1)
Las características epidemiológicas del linfoma gástrico y de la infección por H. pylori comparten notables similitudes69,70.
- 2)
Se ha demostrado la presencia de la bacteria en la mucosa gástrica o un resultado serológico positivo en la mayoría de los pacientes con linfoma gástrico, con cifras en torno al 90%, y en algunos casos incluso del 100%71,72.
- 3)
La asociación es sólida, pues múltiples investigadores han obtenido resultados concordantes69,72–75.
- 4)
Parece observarse una relación temporal, avalada fundamentalmente por la demostración de que la infección por H. pylori es un hecho previo al desarrollo del linfoma gástrico69,70. Así, diversas observaciones apoyan la progresión desde una gastritis asociada a H. pylori −pasando por una hiperplasia linfoide− hasta un linfoma MALT69,72–75.
- 5)
También se le puede atribuir un significado biológico a esta relación, al interpretar la infección por el microorganismo, y la consiguiente respuesta inflamatoria, como los requisitos necesarios para el ulterior desarrollo de la mayor parte de los linfomas MALT69.
- 6)
El efecto de la intervención –la erradicación de H. pylori– sobre la regresión histológica de los linfomas MALT supone el argumento de mayor peso para establecer esta relación causal. Así, la erradicación de la infección induce la remisión histológica en la mayoría de los linfomas MALT gástricos de bajo grado en estadio inicial (E-I, es decir, que afecta solo al estómago; y especialmente en estadio E-I1, en el que el linfoma está confinado a la mucosa y submucosa). Además, la remisión tumoral tras la erradicación parece permanecer estable a lo largo del tiempo en la mayoría de los casos, aunque los períodos de seguimiento son aún limitados69,72–76.
Por todo lo anterior, se debe considerar al tratamiento erradicador de H. pylori como de primera elección en el manejo de los linfomas MALT de bajo grado y estadios iniciales. En el resto de los linfomas MALT gástricos (alto grado o estadios más avanzados), la erradicación constituye solo una parte del tratamiento, debiendo recurrirse a otras terapias complementarias.
Recomendación A6En pacientes con resección quirúrgica o endoscópica de un cáncer gástrico se recomienda investigar y tratar la infección por H. pylori como prevención de la recidiva neoplásica. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
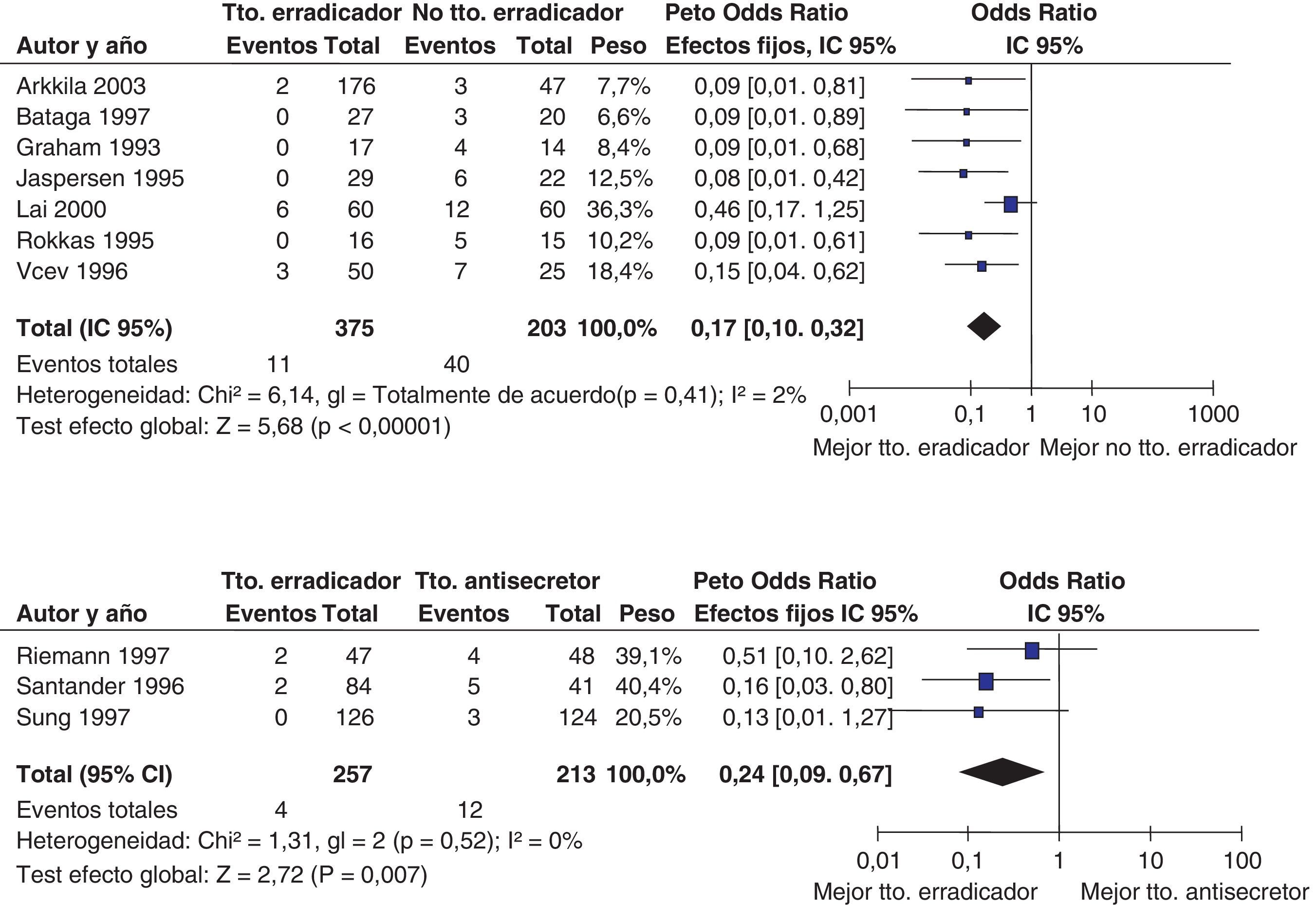
La evidencia de alta calidad a favor de administrar tratamiento erradicador de H. pylori proviene en este caso de un único estudio aleatorizado llevado a cabo por Fukase et al.77. En dicho estudio, 544 pacientes con cáncer gástrico precoz fueron aleatorizados a erradicación de H. pylori o control clínico tras la resección endoscópica. A los 3 años, 9 pacientes en el grupo tratado mediante erradicación frente a 24 del grupo control presentaron una recidiva de la neoplasia (odds ratio [OR]=0,35; IC 95%=0,16-0,77).
Además, la fuerza de la recomendación aumenta por varios motivos:
- 1)
Existe una clara evidencia epidemiológica que confirma la relación entre la infección por H. pylori y el cáncer gástrico78.
- 2)
La erradicación de H. pylori parece ser eficaz en la prevención del cáncer gástrico a nivel poblacional79.
- 3)
Los pacientes con cáncer gástrico habitualmente son portadores de cepas especialmente agresivas de H. pylori80; eliminar estas cepas puede ser importante tanto desde la perspectiva del propio paciente como desde el punto de vista epidemiológico.
- 4)
Existen datos de estudios no aleatorizados con resultados coherentes con el estudio de Fukase et al. previamente mencionado81,82.
Por último, es preciso recordar que la curación de la infección reduce, pero no evita totalmente, la recidiva tumoral en estos pacientes de alto riesgo, por lo que la erradicación debe ir acompañada del seguimiento endoscópico de estos pacientes77.
Recomendación A7En los familiares de primer grado de los pacientes con cáncer gástrico se recomienda investigar y tratar la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (82%); bastante de acuerdo (18%). GR: fuerte. CE: muy baja.
No existen estudios que demuestren la eficacia de la erradicación de H. pylori en la prevención del cáncer gástrico en familiares de pacientes con adenocarcinoma o linfoma MALT. La recomendación se basa en parte en datos fisiopatológicos, en parte en datos epidemiológicos (que muestran que los familiares de primer grado de pacientes con cáncer gástrico presentan un riesgo 2-3 veces superior de presentar esta neoplasia que los controles83–88 y tienen también más alteraciones histológicas consideradas preneoplásicas89) y en parte en la opinión de los expertos (basada en el escaso coste y el bajo riesgo de la intervención, y en el mal pronóstico de la neoplasia que se pretende prevenir). No disponemos, sin embargo, de datos sobre la eficacia o la relación coste-efectividad de esta medida.
Recomendación A8En pacientes con atrofia mucosa gástrica o metaplasia intestinal asociada a infección por H. pylori se recomienda tratamiento erradicador. Acuerdo 94%; votos: totalmente de acuerdo (71%); bastante de acuerdo (18%); algo de acuerdo (6%); algo en desacuerdo (5%). GR: fuerte. CE: moderada.
Tanto la atrofia gástrica como la metaplasia intestinal se consideran lesiones preneoplásicas asociadas a la infección por H. pylori79,90. Ambas se han asociado con un aumento significativo del riesgo de cáncer gástrico90,91. Existen dudas sobre si la atrofia gástrica puede mejorar con la erradicación92 y un consenso general sobre que la metaplasia intestinal es, salvo excepciones, irreversible y representa un punto de no retorno, a partir del cual no desaparece el riesgo de cáncer gástrico a pesar de que se haya erradicado la infección por H. pylori93–95. Sin embargo, los datos en pacientes con lesiones más avanzadas (neoplasia in situ intervenida mediante endoscopia, que en su mayoría tienen metaplasia extensa) muestran que tras la resección de la neoplasia gástrica, el tratamiento erradicador se asocia con una reducción importante del riesgo de sufrir una segunda neoplasia (probablemente debido a la reducción de los fenómenos inflamatorios y de la proliferación celular asociados a la infección persistente por H. pylori)77,96. Basándose en este efecto preventivo se recomienda erradicar la infección por H. pylori en caso de detectarse metaplasia intestinal. Si bien es posible que el tipo de metaplasia (completa o incompleta) se relacione con distintos riesgos de neoplasia97, este hecho no afectaría a la recomendación general de tratar la infección en pacientes con metaplasia intestinal.
Por último, es preciso tener en cuenta que la atrofia gástrica es un fenómeno frecuente y que a menudo se describe en pacientes de edad avanzada y comorbilidad asociada, en los que la esperanza de vida es relativamente corta; en estas circunstancias, es razonable pensar que la erradicación de H. pylori no se seguiría de beneficio alguno y, por tanto, la abstención terapéutica parecería una opción más sensata.
Recomendación A9En pacientes que van a requerir tratamiento con IBP de manera continuada no se recomienda investigar sistemáticamente la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (65%); bastante de acuerdo (24%); algo de acuerdo (11%). GR: débil. CE: moderada.
La supresión ácida mantenida contribuye al desarrollo de una gastritis de predominio en el cuerpo gástrico98. Este hecho puede acelerar el proceso de pérdida de glándulas especializadas y conlleva el desarrollo de una gastritis atrófica98. Un estudio en pacientes tratados de manera crónica con IBP por esofagitis constató que hasta un 30% de los pacientes que presentaban infección por H. pylori y recibían IBP desarrollaban gastritis atrófica tras 5 años de tratamiento, mientras que ni los controles no infectados tratados con IBP ni los controles infectados por H. pylori que no recibieron IBP desarrollaron cambios de gastritis atrófica durante el período del estudio99. Por otro lado, Yang et al. aleatorizaron pacientes con esofagitis tratados con esomeprazol a recibir o no tratamiento erradicador de H. pylori100. El grupo que recibió tratamiento erradicador mostró una tasa de regresión más alta y una tasa de progresión más baja tanto de atrofia gástrica como de metaplasia intestinal. Finalmente, en un modelo animal se ha demostrado que la administración de IBP a roedores infectados por H. pylori incrementa de manera muy importante la aparición de adenocarcinoma gástrico (60% de los animales tratados con IBP frente al 7% de aquellos que no recibieron estos fármacos)101.
No obstante, carecemos de datos sobre si la asociación de H. pylori e IBP puede inducir la aparición de cáncer gástrico en humanos. Además, el número de pacientes que en la actualidad recibe IBP de manera continuada es ingente, y muchos de ellos son ancianos, con una importante comorbilidad asociada y, consecuentemente, con una limitada esperanza de vida102. Por otra parte, el uso inadecuado de IBP es muy frecuente en la práctica clínica102,103, lo que hace aconsejable llevar a cabo estudios de coste-beneficio antes de poder recomendar la investigación y el tratamiento sistemático de la infección por H. pylori en todos los pacientes que reciben estos fármacos. Sin embargo, parece prudente recomendar la erradicación de H. pylori en pacientes jóvenes en los que se plantea efectuar un tratamiento prolongado con IBP, como es el caso de aquellos con enfermedad por reflujo gastroesofágico.
Recomendación A10En pacientes con anemia ferropénica de causa no aclarada se recomienda investigar y tratar la infección por H. pylori. Acuerdo 95%; votos: totalmente de acuerdo (59%); bastante de acuerdo (24%); algo de acuerdo (12%); algo en desacuerdo (5%). GR: fuerte. CE: alta.
H. pylori no es la causa única, ni siquiera la fundamental, de la anemia ferropénica. La investigación y tratamiento de la infección no sustituye a un adecuado estudio y tratamiento de las etiologías más frecuentes104,105. Sin embargo, existen diversos estudios que demuestran que la infección por H. pylori a menudo contribuye al desarrollo de la anemia ferropénica, y ocasionalmente puede ser el factor casual de esta. Ello permite recomendar la erradicación de H. pylori en casos de anemia ferropénica de causa no aclarada tras estudio adecuado, especialmente si no responden al tratamiento con hierro oral.
La asociación entre la infección por H. pylori y la anemia ferropénica de causa no filiada ha sido demostrada por 4 metaanálisis106–109.
El primero de ellos, realizado por Muhsen et al.106 en 2008, incluyó 19 estudios observacionales y 6 ensayos clínicos, y demostró la existencia de una asociación entre infección por H. pylori y anemia ferropénica (OR=2,8; IC 95%=1,9-4,2) y ferropenia (OR=1,38; IC 95%=1,16-1,65).
Un segundo metaanálisis, llevado a cabo por Qu et al.107 en 2010, incluyó 15 estudios observacionales y 5 ensayos clínicos aleatorizados, confirmando dicha asociación (OR=2,22; IC 95%=1,52-3,24), si bien los resultados fueron heterogéneos. Al considerar los ensayos clínicos únicamente, el metaanálisis demostró una elevación de las cifras de hemoglobina y de ferritina tras la erradicación de H. pylori, aunque esta mejoría no alcanzó significación estadística.
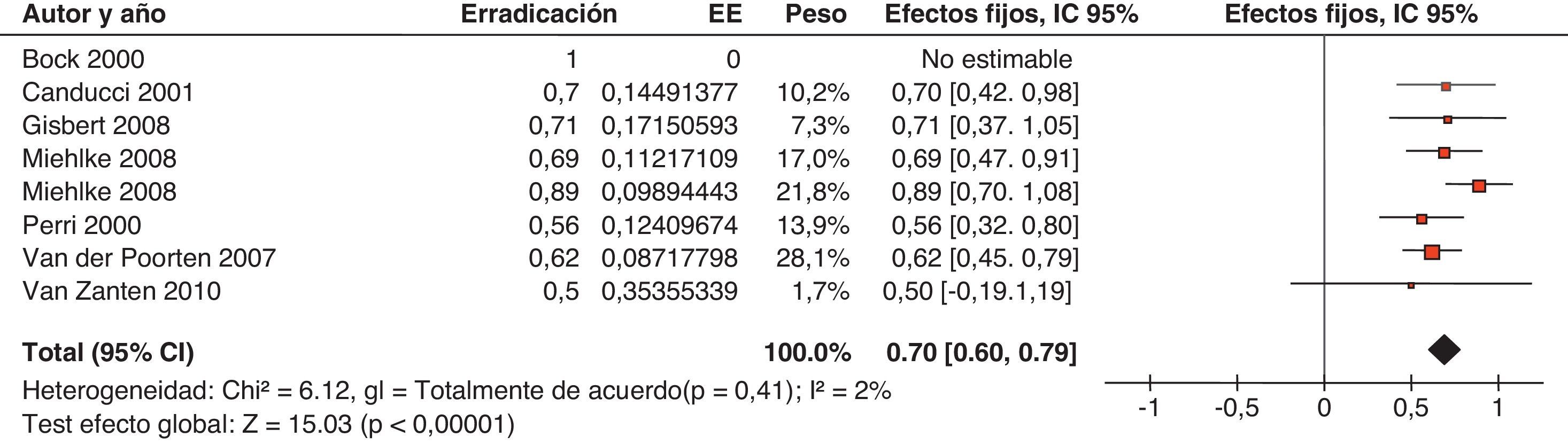
El tercer metaanálisis, realizado por Huang et al.108, se centró en el efecto del tratamiento erradicador sobre los parámetros analíticos al evaluar 8 ensayos clínicos, todos ellos realizados en Asia (un área con una elevada prevalencia tanto de infección por H. pylori como de anemia ferropénica). En este caso, el incremento en las concentraciones de hemoglobina y ferritina tras la erradicación de H. pylori sí alcanzó significación estadística, concluyendo que el tratamiento erradicador combinado con la administración de hierro es más efectivo que este último tratamiento aisladamente.
El cuarto y último metaanálisis fue llevado a cabo por Yuan et al.109, incluyó 16 ensayos clínicos (956 pacientes), y confirmó la superioridad del tratamiento combinado (erradicador y hierro) sobre la monoterapia con hierro oral (el beneficio se estimó en un incremento de 1,48g/dl de hemoglobina), fundamentalmente en los pacientes con anemia moderada o grave.
Finalmente, cabe mencionar que la infección por H. pylori es una causa reconocida de enteritis linfocítica (enteropatía linfocítica o duodenitis linfocítica), un tipo de lesión cuya patogenia se relaciona tanto con la infección por este microorganismo como con la enteropatía inducida por gluten. En este sentido, erradicar la infección por H. pylori en un paciente con anemia ferropénica puede ayudar a diferenciar entre ambas condiciones clínicas. Así, la persistencia de anemia y de enteritis linfocítica tras la erradicación de H. pylori aumenta notablemente la probabilidad de que la etiología de aquella guarde relación con una enteropatía inducida por gluten.
Recomendación A11En pacientes con púrpura trombocitopénica idiopática (PTI) se recomienda investigar y tratar la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (82%); bastante de acuerdo (12%); algo de acuerdo (6%). GR: fuerte. CE: moderada.
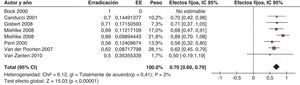
Diversos estudios han demostrado un efecto beneficioso de la erradicación de H. pylori sobre la PTI, una entidad de etiología desconocida110,111. Un primer metaanálisis, realizado por Franchini et al.112 en 2007, incluyó 16 estudios prospectivos y un único ensayo clínico aleatorizado con pacientes con PTI. Se demostró un incremento significativo en el número de plaquetas en los pacientes que recibieron tratamiento erradicador comparado con el grupo control (pacientes sin tratamiento erradicador o con tratamiento fallido).
Más recientemente, Arnold et al.113 han llevado a cabo una revisión sistemática para evaluar el efecto de la erradicación de H. pylori en los pacientes con PTI, incluyendo 11 estudios y 282 pacientes. La respuesta de la PTI fue claramente superior en los pacientes que recibieron tratamiento erradicador de H. pylori (51 vs. 8,8%). Como cabía esperar, en los pacientes negativos para H. pylori el tratamiento erradicador tuvo un escaso beneficio terapéutico.
Una última revisión sistemática ha sido realizada por Stasi et al.114, que incluyeron 25 estudios y 696 pacientes en los que se pudo evaluar el efecto de la erradicación de H. pylori sobre el número de plaquetas. La tasa de respuesta completa (plaquetas > 100 × 109/l) y parcial (plaquetas > 30 × 109/l, duplicando al menos el número basal) fue del 43 y del 50%, respectivamente.
Recomendación A12En pacientes con déficit de vitamina B12 no explicable por otras causas se recomienda investigar y tratar la infección por H. pylori. Acuerdo 88%; votos: totalmente de acuerdo (18%); bastante de acuerdo (47%); algo de acuerdo (23%); algo en desacuerdo (12%). GR: fuerte. CE: moderada.
Se ha apuntado que la infección por H. pylori puede causar malabsorción de diferentes micronutrientes115. Más concretamente, se ha señalado que aun sin ser la causa principal, H. pylori puede producir un déficit de vitamina B12116–118. Debido a que hasta un 60% de las deficiencias de cobalamina son de causa desconocida116,119 y a que la relación entre H. pylori y vitamina B12 no ha sido completamente aclarada, es obvio que se precisan más estudios que permitan evaluar el efecto de la infección y su erradicación sobre los niveles de esta vitamina.
Una reciente revisión sistemática y metaanálisis120 que evaluó la asociación entre H. pylori y los niveles de cobalamina en 17 estudios (incluyendo 2.454 pacientes) demostró unos niveles de vitamina B12 significativamente menores en los pacientes infectados (diferencia de medias estandarizadas=−0,74; IC 95%=−1,15 a −0,34). En este mismo estudio se metaanalizó el efecto de la erradicación de la infección en pacientes positivos para H. pylori (5 estudios), demostrando un aumento estadísticamente significativo de los niveles de cobalamina tras el tratamiento erradicador (diferencia de medias estandarizadas=−1,91; IC 95%=−3,36 a −0,46). Esta revisión, por tanto, apoya la recomendación de evaluar y erradicar la infección por H. pylori en los pacientes con déficit de vitamina B12. No obstante, esta conclusión ha de tomarse con precaución, ya que los resultados del mencionado metaanálisis son notablemente heterogéneos (lo que puede ser debido, al menos en parte, al empleo de diferentes métodos de diagnóstico de la infección y de medición de los niveles de cobalamina).
Recomendación A13En pacientes con rosácea no se recomienda investigar y tratar la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (53%); bastante de acuerdo (41%); algo de acuerdo (6%). GR: débil. CE: baja.
La rosácea es una dermatosis inflamatoria crónica y recurrente, caracterizada por la presencia persistente o transitoria de eritema centrofacial, telangiectasias y a menudo pápulas y pústulas. Algunos autores han relacionado la aparición y gravedad de estas lesiones con la infección por H. pylori, mientras que otros han descrito la mejoría de las mismas tras la erradicación121–124, pero los resultados de los estudios son controvertidos125. Así, los estudios de mayor tamaño muestral que han evaluado la prevalencia de H. pylori y su relación con la rosácea no evidencian una asociación estadísticamente significativa126,127 ni señalan que la infección sea un factor de riesgo para esta enfermedad128.
Aunque el tratamiento erradicador de H. pylori se asocia en algunos estudios con una mejoría en las manifestaciones clínicas de la rosácea122,129–131, es preciso tener en cuenta que el tratamiento recomendado para este proceso incluye antibióticos (orales y tópicos)132, por lo que no puede descartarse que dicho beneficio se deba a un efecto inespecífico (no relacionado con la erradicación de H. pylori) del tratamiento antibiótico126.
Finalmente, los ensayos clínicos comparativos y doble ciego muestran que, aunque puede existir una disminución de las lesiones durante el tratamiento antibiótico, la erradicación de H. pylori no se asocia con una mejoría clínica de la rosácea a más largo plazo126,127.
Recomendación A14En pacientes con urticaria crónica no se recomienda investigar y tratar la infección por H. pylori. Acuerdo 94%; votos: totalmente de acuerdo (53%); bastante de acuerdo (35%); algo de acuerdo (6%); bastante en desacuerdo (6%). GR: débil. CE: baja.
La urticaria crónica es un proceso inflamatorio de la zona superficial de la piel que algunos autores han relacionado con la infección por H. pylori133,134, aunque esta asociación constituye un tema notablemente controvertido. La mayoría de publicaciones incluyen series de casos y estudios no comparativos con tamaños muestrales reducidos133–136. Los 2 únicos estudios comparativos sufren importantes limitaciones metodológicas y llegan a conclusiones opuestas137,138. En general, los estudios que evalúan la posible asociación entre urticaria crónica e infección por H. pylori obtienen resultados contradictorios: a favor133,134,138–140 o en contra135–137,141–146.
Esta heterogeneidad de resultados ha sido puesta de manifiesto por Shakouri et al.147 en su revisión de la literatura médica realizada en 2010; aunque los autores establecen una recomendación débil (con nivel de evidencia bajo) a favor del tratamiento erradicador de H. pylori en la urticaria crónica, los estudios evaluados (19 en total) tienen limitaciones metodológicas importantes, tamaños muestrales reducidos y gran heterogeneidad en sus resultados. La mitad de los estudios, y uno de los 2 ensayos aleatorizados137, no evidencian asociación. El otro ensayo aleatorizado138 sí concluye que existe asociación entre infección por H. pylori y urticaria crónica, aunque sus resultados no alcanzan la significación estadística (p=0,19). Además, la mayoría de los estudios observacionales que señalan la existencia de asociación entre ambas entidades son descriptivos o solo encuentran tendencias −no estadísticamente significativas− combinando respuesta parcial y completa de la urticaria crónica. Así, los estudios favorables incluyen 237 pacientes, frente a los 265 de los desfavorables; así mismo, estos últimos tienen un período de seguimiento que en la mayoría de los casos es superior a los 6 meses, mientras que el seguimiento en los estudios favorables es en todos los casos inferior a los 6 meses.
Se han publicado 2 estudios observacionales con posterioridad a la revisión de Shakouri et al.147. El estudio de Campanati et al.148 evalúa 11 pacientes y encuentra una mejoría en las lesiones 4 semanas después de la erradicación de H. pylori, pero a falta de controles posteriores no se puede asegurar que dicha mejoría no sea debida al efecto inespecífico de los antibióticos. El otro estudio, llevado a cabo por de Akashi et al.146, incluyó 17 pacientes con un seguimiento de entre 1 y 4 meses, y no pudo encontrar diferencias entre el grupo con éxito y fracaso erradicador.
Debido a la falta de ensayos clínicos aleatorizados adecuados, a las limitaciones de los estudios observacionales, al reducido número de pacientes incluidos, a las diferentes metodologías empleadas y, en especial, al corto seguimiento de los estudios favorables, no se puede establecer una recomendación a favor de la investigación y tratamiento sistemático de la infección por H. pylori en los pacientes con urticaria crónica en la práctica clínica.
Recomendación A15A todo paciente diagnosticado de infección por H. pylori se recomienda ofrecerse tratamiento erradicador. Acuerdo 88%; votos: totalmente de acuerdo (70%); bastante de acuerdo (12%); algo de acuerdo (6%); algo en desacuerdo (6%); bastante en desacuerdo (6%). GR: fuerte. CE: moderada.
La infección por H. pylori es un factor de riesgo bien conocido para la úlcera péptica149. Así, la presencia de infección multiplica el riesgo de sufrir una úlcera gástrica 3 veces y el de úlcera duodenal casi 20 veces150. El riesgo de cáncer gástrico aumenta de 2 a 10 veces en los individuos infectados, siendo este incremento más marcado en pacientes jóvenes151. Estudios de cribado poblacional muestran que la erradicación, incluso en individuos asintomáticos, reduce las consultas por dispepsia152 y, realizada precozmente, puede prevenir el cáncer gástrico153. Por otro lado, a pesar de que siguen existiendo defensores de los beneficios de la infección, no ha sido claramente demostrado ningún efecto beneficioso concreto de esta154. De acuerdo con los datos disponibles, una vez detectada la infección no parece justificable no ofrecer tratamiento erradicador. No obstante, este ofrecimiento debe ir acompañado de una información detallada y ponderada de los posibles beneficios y riesgos asociados al tratamiento erradicador de la infección por H. pylori, para que el paciente pueda decidir adecuadamente.
Sección B: Diagnóstico de la infección por H. pyloriEn la tabla 3 se incluyen las recomendaciones aprobadas por el consenso español sobre el diagnóstico de la infección por H. pylori.
Recomendaciones sobre el diagnóstico de la infección por Helicobacter pylori
| Recomendación B1: Para el diagnóstico no invasivo de la infección por H. pylori, se recomienda la prueba del aliento con urea marcada con 13C utilizando el protocolo europeo, que incluye la administración previa de ácido cítrico |
| Recomendación B2: Se recomienda la prueba de antígeno en heces como alternativa a la prueba del aliento para el diagnóstico no invasivo de la infección por H. pylori siempre que se utilice un método de ELISA monoclonal |
| Recomendación B3: No se recomienda el uso sistemático de la serología para el diagnóstico de la infección por H. pylori |
| Recomendación B4: Tanto si se realiza una prueba no invasiva como si se lleva a cabo una prueba diagnóstica invasiva, se recomienda suspender los IBP al menos 2 semanas antes de la evaluación de la infección por H. pylori |
| Recomendación B5: Tanto si se realiza una prueba invasiva como si se lleva a cabo una prueba diagnóstica no invasiva, se recomienda evitar cualquier tratamiento antibiótico durante al menos 4 semanas antes de la evaluación de la infección por H. pylori |
| Recomendación B6: Se recomienda comprobar la curación de la infección tras el tratamiento en todos los casos |
| Recomendación B7: Como prueba no invasiva para confirmar la erradicación se recomienda la prueba del aliento con urea marcada con 13C, utilizando el protocolo europeo, que incluye la administración previa de ácido cítrico |
| Recomendación B8: No se recomienda el uso de la serología para la confirmación de la erradicación tras el tratamiento |
| Recomendación B9: Se recomienda que las pruebas diagnósticas para comprobar la curación de la infección se realicen al menos 4 semanas después de finalizar el tratamiento |
Para el diagnóstico no invasivo de la infección por H. pylori, se recomienda la prueba del aliento con urea marcada con 13C utilizando el protocolo europeo, que incluye la administración previa de ácido cítrico. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La prueba del aliento con urea marcada con 13C es sencilla, tiene un coste moderado y es la prueba no invasiva más sensible y específica53,155. Se recomienda aplicar el protocolo europeo, que incluye la administración previa de ácido cítrico156, dado que en caso contrario parece que aumenta el riesgo de resultados falsamente positivos y/o negativos de la prueba53,155,157. Así, al administrar previamente una solución de ácido cítrico se obtienen unas concentraciones máximas de 13CO2 en aliento más elevadas y precoces156,158,159. Se ha señalado que el ácido cítrico es una fuente adicional de H+, que podría incrementar la actividad de la ureasa de H. pylori. El ácido cítrico produce también un enlentecimiento del vaciamiento gástrico158,159, lo que aumentaría adicionalmente la actividad de la ureasa y consiguientemente la sensibilidad de la prueba. Por otro lado, la sustitución del ácido cítrico por agua disminuye el poder de discriminación entre los individuos H. pylori positivos y negativos158. El ácido cítrico también es superior a las «comidas de prueba» semilíquidas o al zumo de naranja156,160. Así, cuando se empleó ácido cítrico se alcanzó una sensibilidad del 100%, mientras que esta fue de tan solo el 88% cuando se administró zumo de naranja160.
El reciente consenso europeo de Maastricht IV recomienda también el uso de las pruebas en heces monoclonales, aunque requiere su validación local95. Por otra parte, como se señala más adelante, la fiabilidad diagnóstica de los distintos métodos de detección en heces varía en función del fabricante y de los aspectos técnicos, y los resultados en nuestro medio son ligeramente inferiores a los observados con la prueba del aliento157,161,162. Por esto y por la necesidad de validación local, se prefiere la prueba del aliento a las pruebas en heces como técnica de elección para diagnosticar de forma no invasiva la infección por H. pylori161,162.
Recomendación B2Se recomienda la prueba de antígeno en heces como alternativa a la prueba del aliento para el diagnóstico no invasivo de la infección por H. pylori siempre que se utilice un método de ELISA monoclonal. Acuerdo 100%; votos: totalmente de acuerdo (82%); bastante de acuerdo (18%). GR: fuerte. CE: alta.
El reciente consenso de Maastricht IV recomienda al mismo nivel la prueba del aliento con urea marcada con 13C y las pruebas en heces monoclonales para el diagnóstico inicial de la infección por H. pylori, aunque requiere la validación local de estas últimas95. De hecho, la fiabilidad de las pruebas diagnósticas para H. pylori en heces es alta, siempre que se utilicen pruebas monoclonales y se eviten las pruebas inmunocromatográficas rápidas54,157,161,162. Sin embargo, como se ha mencionado previamente, la fiabilidad diagnóstica de los distintos métodos de detección en heces varía en función del fabricante y la técnica empleada, y los resultados en nuestro medio son ligeramente inferiores a los que se han descrito con la prueba del aliento utilizada en condiciones óptimas157,161,162. Dos inconvenientes adicionales son que las pruebas en heces son menos aceptadas tanto por los pacientes como por el personal sanitario y que la mayoría de pruebas en heces actualmente disponibles no han sido suficientemente validadas en nuestro medio. En resumen, la prueba de antígeno en heces con un método de ELISA monoclonal es una alternativa válida a la prueba del aliento para el diagnóstico no invasivo de la infección por H. pylori, si bien este último método se considera de elección.
Recomendación B3No se recomienda el uso sistemático de la serología para el diagnóstico de la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La serología detecta anticuerpos IgG frente a H. pylori en el suero del paciente. Múltiples estudios muestran que la fiabilidad de la serología varía de manera muy marcada según el método comercial que se emplee y es, en general, inferior a la de otras técnicas diagnósticas55. Por ello, no se recomienda su uso si no se ha validado previamente en la población en la que se va a utilizar. Además, la serología no es útil para evaluar la erradicación, ya que los anticuerpos circulantes pueden persistir durante años95.
No obstante, la serología puede ser útil en pacientes con procesos que se sabe reducen marcadamente la densidad de la infección por H. pylori (como son la atrofia o metaplasia intestinal extensas, o el linfoma MALT) o en pacientes que han recibido recientemente antibióticos o no pueden suspender el tratamiento con IBP. En este grupo de pacientes −y en ausencia de tratamiento erradicador previo− una serología positiva debe interpretarse como signo de infección activa163,164, especialmente si se observa además la presencia de infiltrado polimorfonuclear (o, lo que es lo mismo, gastritis «activa») en las biopsias gástricas165. Su uso también sería justificable en el improbable caso de que no se disponga de ninguna otra prueba diagnóstica y siempre que se haya realizado una validación local del método comercial utilizado.
Recomendación B4Tanto si se realiza una prueba no invasiva como si se lleva a cabo una prueba diagnóstica invasiva, se recomienda suspender los IBP al menos 2 semanas antes de la evaluación de la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
En pacientes infectados por H. pylori, la administración de un IBP negativiza las pruebas invasivas y no invasivas −excepto la serología− para H. pylori en un porcentaje considerable de los casos. Esto es debido a que estos fármacos reducen la densidad de la infección por H. pylori, probablemente como consecuencia del aumento del pH gástrico155,166–170. En este sentido, Laine et al., en un estudio de cohortes, observaron que el 33% de los pacientes inicialmente infectados y tratados posteriormente con lansoprazol durante 28 días tenía finalmente una prueba del aliento negativa171; los porcentajes de pacientes en los que la prueba fue, de nuevo, positiva tras finalizar el tratamiento con el IBP fueron: 91% a los 3 días, 97% a los 7 días y 100% a los 14 días171. Por ello, salvo situaciones excepcionales en las que no se pueda interrumpir el tratamiento con IBP, deben siempre suspenderse estos fármacos al menos 2 semanas antes de la evaluación de la infección por H. pylori.
Recomendación B5Tanto si se realiza una prueba invasiva como si se lleva a cabo una prueba diagnóstica no invasiva, se recomienda evitar cualquier tratamiento antibiótico durante al menos 4 semanas antes de la evaluación de la infección por H. pylori. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: baja.
Los primeros estudios terapéuticos utilizando un único antibiótico frente a H. pylori observaron un «aclaramiento» inicial de la bacteria. Sin embargo, también detectaron una alta tasa de recurrencia de la infección, que típicamente ocurría durante las primeras 4 a 6 semanas172,173. En función de estos datos, las revisiones iniciales sobre diagnóstico y tratamiento de la infección por H. pylori recomendaban el control de la erradicación tras «varias semanas»174 o «un mes» de haber finalizado el tratamiento antibiótico175. Más recientemente, un interesante estudio ha evaluado la recurrencia de la infección tras el tratamiento en función del momento en que se comprobaba la erradicación, y no detectó ninguna diferencia entre la realización de la prueba de control a las 4 y a las 8 o más semanas176. Por tanto, un período de 4 semanas tras suspender el tratamiento antibiótico parece suficiente para que, en caso de fracaso erradicador, H. pylori recolonice la mucosa gástrica y sea, de este modo, detectable por los métodos diagnósticos convencionales.
Recomendación B6Se recomienda comprobar la curación de la infección tras el tratamiento en todos los casos. Acuerdo 94%; votos: totalmente de acuerdo (82%); bastante de acuerdo (12%); algo en desacuerdo (6%). GR: fuerte. CE: muy baja.
Las recomendaciones sobre si es necesario o no determinar la curación de la infección por H. pylori provienen básicamente de opiniones de expertos. Las recomendaciones varían desde la realización de control sistemático95 a otras más laxas que señalan que debe comprobarse la erradicación únicamente en enfermedades graves (úlcera péptica y úlcera complicada, cáncer gástrico precoz y linfoma MALT) y que, en cambio, el control tras la erradicación es opcional en casos de dispepsia177.
Los argumentos a favor de comprobar la erradicación tras el tratamiento son que la determinación mediante prueba del aliento es sencilla y no invasiva y que, en el actual contexto de una elevada tasa de fracasos del tratamiento, una prueba positiva permite la detección rápida de la infección persistente y la evaluación de nuevas alternativas terapéuticas. Los argumentos a favor de no realizar tratamiento sistemático se basan en algunos estudios de cohortes que muestran que la desaparición de los síntomas dispépticos se correlaciona bien con la curación de la infección178,179 y en estudios de coste-efectividad180.
Considerando los pros y los contras de la confirmación de la curación de la infección tras el tratamiento, se recomienda comprobar esta en todos los casos. Aunque hubo acuerdo en aprobar esta recomendación para todas las indicaciones de tratamiento, los resultados de las votaciones variaron discretamente, como se resume a continuación: úlcera complicada (acuerdo 100%; votos: totalmente de acuerdo [100%]), linfoma MALT (acuerdo 100%; votos: totalmente de acuerdo [100%]), úlcera gástrica no complicada (en este caso se subrayó la necesidad de confirmar la cicatrización ulcerosa y descartar un cáncer gástrico [acuerdo 100%; votos: totalmente de acuerdo {94%}; bastante de acuerdo {6%}]), úlcera duodenal no complicada (acuerdo 94%; votos: totalmente de acuerdo [76%]; bastante de acuerdo [12%]; algo de acuerdo [6%]; algo en desacuerdo [6%]), atrofia, metaplasia intestinal y displasia (acuerdo 100%; votos: totalmente de acuerdo [88%]; bastante de acuerdo [12%]), dispepsia no investigada (acuerdo 100%; votos: totalmente de acuerdo [76%]; bastante de acuerdo [18%]; algo de acuerdo [6%]), dispepsia funcional (acuerdo 94%; votos: totalmente de acuerdo [88%]; bastante de acuerdo [6%]; algo en desacuerdo [6%]).
Recomendación B7Como prueba no invasiva para confirmar la erradicación se recomienda la prueba del aliento con urea marcada con 13C, utilizando el protocolo europeo, que incluye la administración previa de ácido cítrico. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La prueba del aliento con urea marcada con 13C tiene una alta sensibilidad y especificidad para la confirmación de la erradicación de H. pylori tras el tratamiento53,155. Los consensos internacionales recientes recomiendan su uso en esta situación95. El reciente consenso de Maastricht recomienda también el uso de las pruebas en heces monoclonales para comprobar la erradicación, aunque requiere que estos estén validados localmente95. Sin embargo, como se ha mencionado previamente, la fiabilidad diagnóstica de los distintos métodos de detección en heces varía en función del fabricante y la técnica, y los resultados en nuestro medio son ligeramente inferiores a los observados con la prueba del aliento157,161,162. En resumen, aunque la prueba del antígeno en heces (con un método de ELISA monoclonal) es una alternativa válida a la prueba del aliento, este último método diagnóstico (utilizando el protocolo europeo, con ácido cítrico) se considera de elección para comprobar de forma no invasiva la respuesta al tratamiento erradicador. No obstante, cuando sea necesaria la realización de una endoscopia de control (en la úlcera gástrica para descartar una neoplasia incipiente, y en el linfoma MALT para evaluar la regresión tumoral), la erradicación de H. pylori podrá comprobarse mediante métodos basados en la biopsia gástrica.
Recomendación B8No se recomienda el uso de la serología para la confirmación de la erradicación tras el tratamiento. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La serología puede permanecer positiva durante meses o años tras la erradicación, por lo que no es útil para confirmar la curación de la infección por H. pylori181. Se ha descrito que un determinado descenso de los niveles de anticuerpos podría correlacionarse con la erradicación182; esto requiere disponer de muestras apareadas tomadas antes y unos meses después del tratamiento. Además de que la implementación de este procedimiento es extremadamente difícil, los datos de eficacia parecen ser inferiores a los de la prueba del aliento183–187.
Recomendación B9Se recomienda que las pruebas diagnósticas para comprobar la curación de la infección se realicen al menos 4 semanas tras finalizar el tratamiento. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La recomendación de los distintos consensos de comprobar la erradicación a las 4 semanas de finalizar el tratamiento erradicador tiene una base absolutamente empírica y descansa en consideraciones teóricas sobre el tiempo necesario para que H. pylori recolonice la cavidad gástrica después de un tratamiento erradicador fallido95. Una revisión sistemática mostró que las tasas de recrudescencia (reaparición de la misma cepa que infectaba inicialmente al paciente) o reinfección (infección por una cepa distinta de la inicial) eran discretamente inferiores en los estudios que realizaban el control a las 8 semanas de haber finalizado el tratamiento (tasa de reinfección anual del 3,5%) que en los que evaluaban la curación a las 4 semanas (tasa de reinfección anual del 4,6%)188. En este sentido, algunos autores han propuesto períodos más dilatados (de 6 y 8 semanas) tras la finalización de la terapia. Sin embargo, la eficacia de prolongar el tiempo de espera hasta el control del tratamiento para detectar los fracasos erradicadores es, como mucho, limitada. Así, un estudio reciente ha analizado 419 pacientes tras la administración del tratamiento erradicador, y no detectó diferencia alguna entre la realización de la prueba de confirmación a las 4 y a las 8 semanas176. Por ello, se recomienda confirmar la erradicación como mínimo a las 4 semanas de haber finalizado el tratamiento. No obstante, se puede retrasar el control más allá de este período en función de las preferencias del médico y de la disponibilidad local de las pruebas diagnósticas.
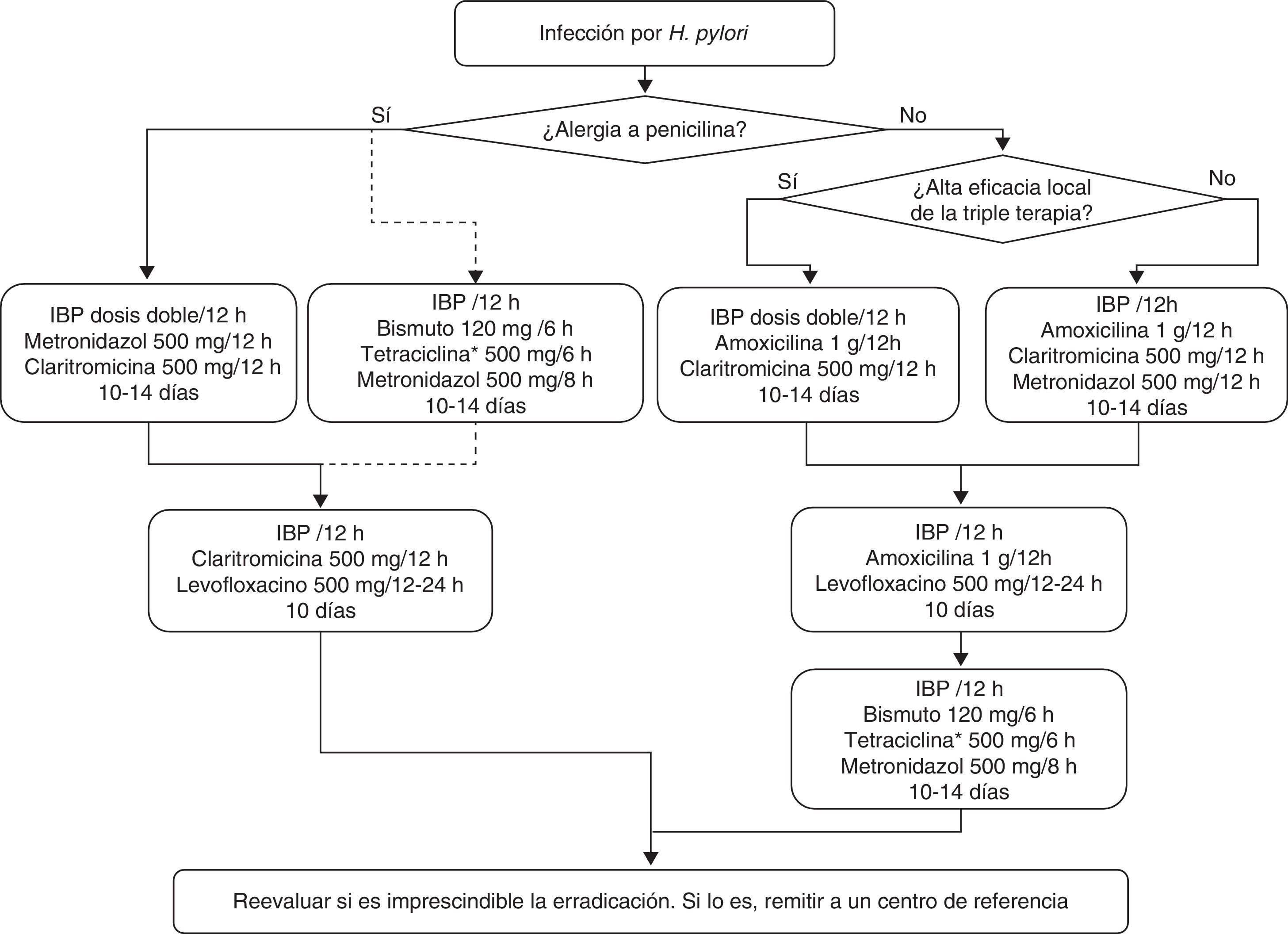
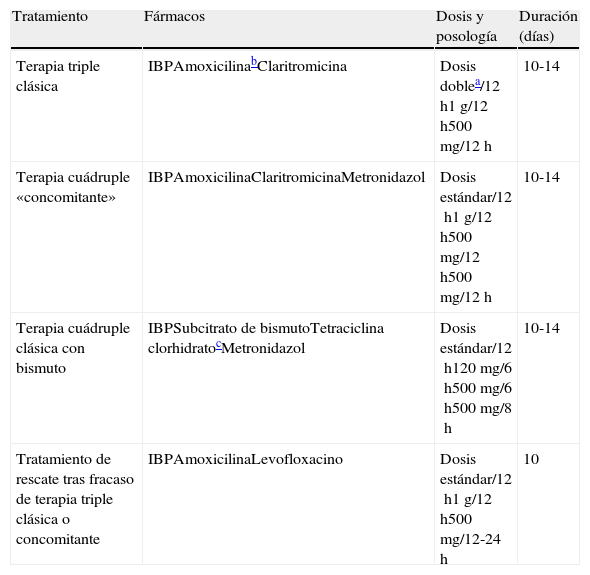
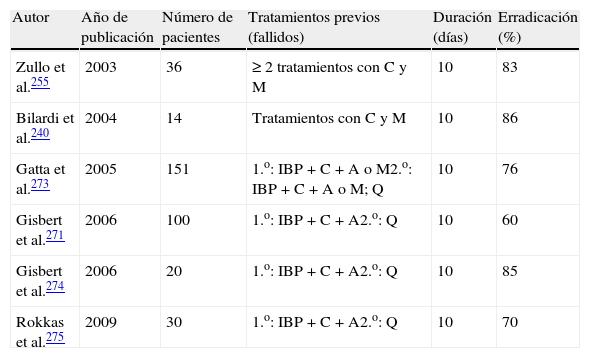
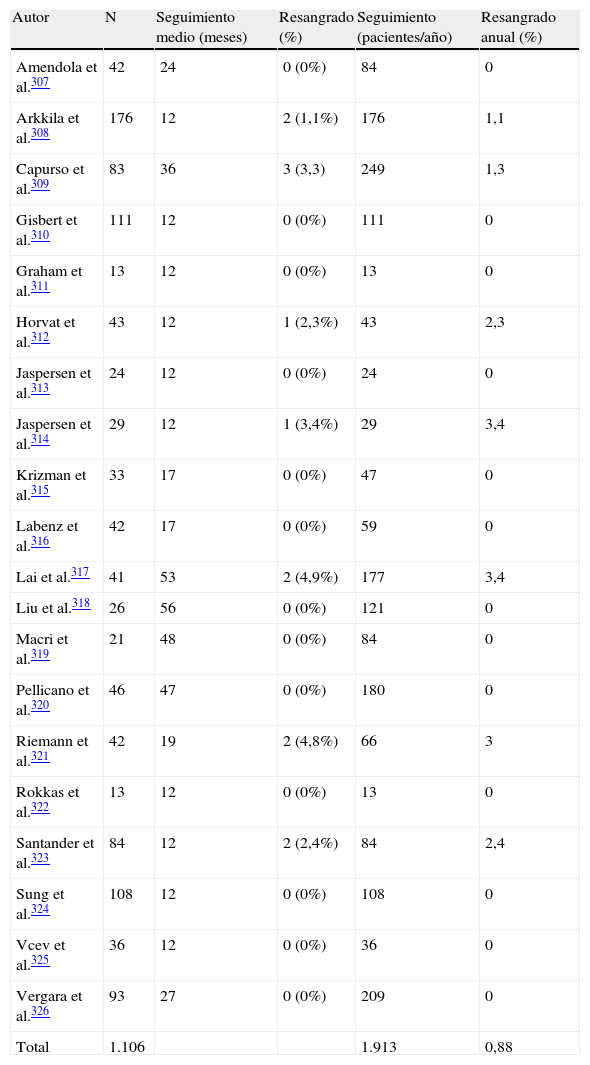
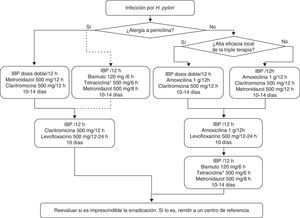
Sección C: Tratamiento de la infección por Helicobacter pyloriEn la tabla 4 y en la figura 1 se incluyen las recomendaciones aprobadas por el consenso español sobre el tratamiento de la infección por H. pylori. Se reconoce la utilidad de guiar el tratamiento mediante el estudio de la susceptibilidad antimicrobiana de la cepa de H. pylori, pero debido a que este estudio no es generalmente accesible, los comentarios incluidos en esta sección se basarán en el supuesto de que dicha susceptibilidad es desconocida.
Recomendaciones sobre el tratamiento de la infección por Helicobacter pylori
| Recomendación C1: Como tratamiento de primera línea de la infección por H. pylori se sugiere una pauta cuádruple concomitante con un IBP, claritromicina, amoxicilina y metronidazol durante al menos 10 días. La pauta inicial triple con un IBP, claritromicina y amoxicilina se sugiere también como aceptable en áreas donde se mantenga una efectividad por encima del 80% |
| Recomendación C2: En caso de elegir una pauta triple con claritromicina y amoxicilina, se recomienda administrarla durante 10 a 14 días |
| Recomendación C3: En caso de elegir una pauta triple con claritromicina y amoxicilina, se recomienda administrar dosis altas del IBP |
| Recomendación C4: No se recomienda el uso de prebióticos asociado al tratamiento erradicador |
| Recomendación C5: No se recomienda el uso generalizado de probióticos asociado al tratamiento erradicador |
| Recomendación C6: Tras el fracaso de un primer tratamiento que incluya claritromicina, se recomienda una pauta triple con un IBP, amoxicilina y levofloxacino durante 10 días |
| Recomendación C7: Tras el fracaso de un primer tratamiento que incluya claritromicina y una pauta triple con levofloxacino de segunda línea, se recomienda una terapia cuádruple clásica con bismuto (IBP, bismuto, tetraciclina y metronidazol) al menos durante 10 días |
| Recomendación C8: Tras el fracaso de un primer tratamiento que incluya claritromicina y de una terapia cuádruple clásica con bismuto de segunda línea, se recomienda una pauta triple con levofloxacino durante 10 días |
| Recomendación C9: Tras el fracaso de un tercer tratamiento se sugiere considerar la necesidad de remitir al paciente a un centro con experiencia en el tratamiento de la infección por H. pylori multirresistente |
| Recomendación C10: En pacientes alérgicos a la penicilina se sugiere de primera línea una pauta triple combinando un IBP, claritromicina y metronidazol o una cuádruple terapia con bismuto (IBP, bismuto, tetraciclina y metronidazol) al menos durante 10 días |
| Recomendación C11: Tras el fracaso del tratamiento de primera línea en pacientes alérgicos a la penicilina se sugiere una terapia triple con un IBP, levofloxacino y claritromicina durante 10 días |
| Recomendación C12: En los pacientes con úlcera duodenal no complicada, tras haber finalizado el tratamiento erradicador de H. pylori, no se recomienda mantener el tratamiento antisecretor |
| Recomendación C13: En los pacientes con una úlcera gástrica, tras haber finalizado el tratamiento erradicador de H. pylori se recomienda mantener el tratamiento antisecretor durante 4-8 semanas, al menos en las úlceras mayores de 1cm |
| Recomendación C14: En pacientes que requieren AINE o AAS se recomienda que la indicación de tratamiento gastroprotector se realice en función de la presencia de los factores de riesgo de complicación, independientemente de si se trata o no la infección por H. pylori |
| Recomendación C15: En los pacientes con hemorragia digestiva por úlcera péptica la erradicación de H. pylori elimina la práctica totalidad de las recidivas hemorrágicas, por lo que una vez confirmada la desaparición del microorganismo, y en ausencia de toma de AINE/AAS, se recomienda no administrar tratamiento de mantenimiento con antisecretores |
Tratamiento inicial y de rescate de la infección por H. pylori.
IBP: inhibidor de la bomba de protones.
*La tetraciclina clorhidrato/hidrocloruro puede ser difícil de obtener, por lo que, en caso necesario, se puede emplear en su lugar doxiciclina (100mg/12h), aunque la experiencia es mucho más limitada.
Como tratamiento de primera línea de la infección por H. pylori se sugiere una pauta cuádruple concomitante con un IBP, claritromicina, amoxicilina y metronidazol durante al menos 10 días. Acuerdo 76%; votos: totalmente de acuerdo (35%); bastante de acuerdo (6%); algo de acuerdo (35%); algo en desacuerdo (6%); bastante en desacuerdo (18%). GR: débil. CE: moderada. La pauta inicial triple con un IBP, claritromicina y amoxicilina, se sugiere también como aceptable en áreas donde se mantenga una efectividad por encima del 80%. Acuerdo 100%; votos: totalmente de acuerdo (59%); bastante de acuerdo (24%); algo de acuerdo (17%). GR: débil. CE: moderada.
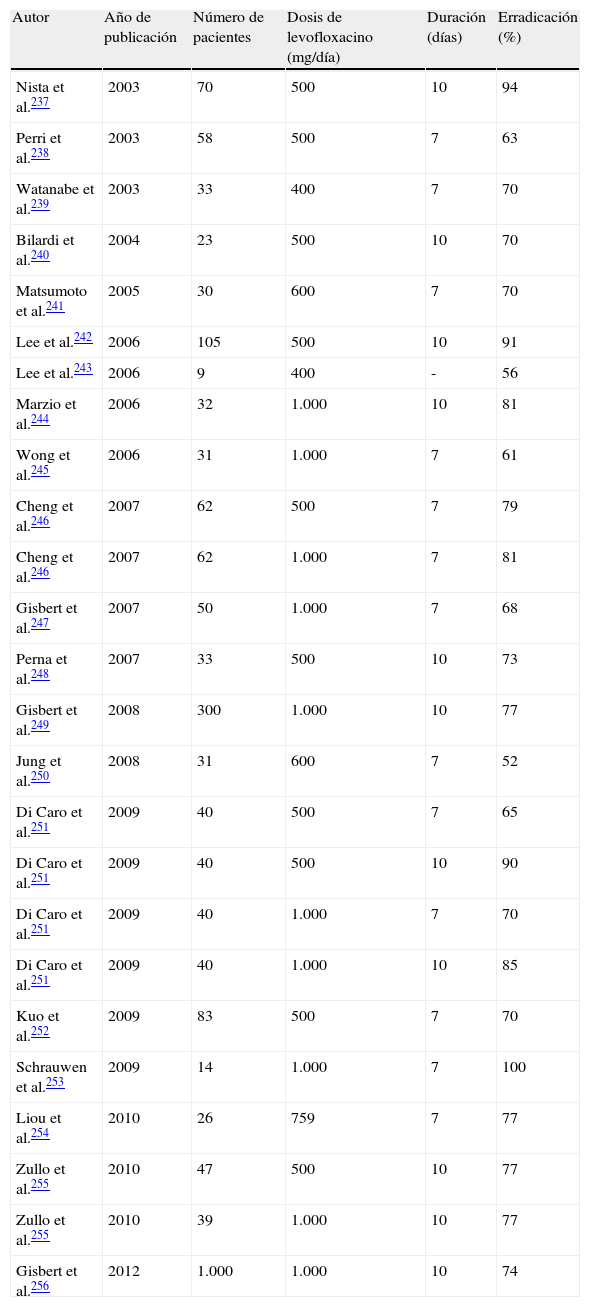
La combinación de un IBP junto con claritromicina y amoxicilina (tabla 5) ha sido la terapia más ampliamente utilizada en España4. No obstante, su eficacia parece ir en descenso. Recientemente se han publicado diversos estudios en los que la tasa de erradicación se encuentra por debajo del 80%189. Este descenso en la eficacia de las terapias basadas en claritromicina se relaciona fundamentalmente con el incremento en la tasa de resistencias de H. pylori a dicho antibiótico189,190.
Tratamientos erradicadores de Helicobacter pylori
| Tratamiento | Fármacos | Dosis y posología | Duración (días) |
| Terapia triple clásica | IBPAmoxicilinabClaritromicina | Dosis doblea/12h1g/12h500mg/12h | 10-14 |
| Terapia cuádruple «concomitante» | IBPAmoxicilinaClaritromicinaMetronidazol | Dosis estándar/12h1g/12h500mg/12h500mg/12h | 10-14 |
| Terapia cuádruple clásica con bismuto | IBPSubcitrato de bismutoTetraciclina clorhidratocMetronidazol | Dosis estándar/12h120mg/6h500mg/6h500mg/8h | 10-14 |
| Tratamiento de rescate tras fracaso de terapia triple clásica o concomitante | IBPAmoxicilinaLevofloxacino | Dosis estándar/12h1g/12h500mg/12-24h | 10 |
IBP: inhibidor de la bomba de protones.
Si las tasas locales de resistencia de H. pylori a claritromicina son bajas (< 15-20%) se podría recomendar, todavía, la terapia triple95. En España, las tasas globales de resistencia a la claritromicina en un reciente estudio multicéntrico eran de aproximadamente el 12%191,192, por lo que teóricamente se podría recomendar el uso del tratamiento triple. Sin embargo, la terapia triple estándar logra cifras de erradicación de tan solo el 80% aproximadamente193,194. Por ello, parece evidente que deben evaluarse otras opciones de primera línea.
Las alternativas al tratamiento triple con claritromicina son las siguientes: a) terapia cuádruple clásica incluyendo bismuto; b) terapia cuádruple «secuencial», y c) terapia cuádruple «concomitante».
La terapia cuádruple clásica (bismuto junto con un IBP, tetraciclina y metronidazol; tabla 5) ha obtenido como tratamiento de primera línea resultados similares a los de la triple terapia tanto en eficacia como en seguridad195–197. No obstante, un reciente ensayo clínico aleatorizado realizado en 39 centros europeos ha comparado la eficacia y la seguridad del tratamiento, durante 10 días, con omeprazol más una cápsula con 3 componentes (subcitrato de bismuto, metronidazol y tetraciclina) conformando la terapia cuádruple, frente a 7 días de omeprazol, amoxicilina y claritromicina (tratamiento estándar). Las tasas de curación «por intención de tratar» fueron del 55% para la terapia triple y del 80% para la cuádruple clásica198. Los resultados indican, por tanto, que aunque la terapia cuádruple podría ser considerada como una opción de primera línea, especialmente en vista de la creciente resistencia a la claritromicina, las tasas de erradicación no pueden considerarse excelentes. Además, aunque el empleo de una única cápsula que combina el bismuto y los antibióticos permitiría superar parcialmente las desventajas de la complejidad de la administración del tratamiento con bismuto, dicha formulación todavía no está comercializada en España. Finalmente, una desventaja adicional de la terapia cuádruple clásica es que, actualmente, es difícil obtener algunos de sus componentes, específicamente la tetraciclina clorhidrato/hidrocloruro y las sales de bismuto.
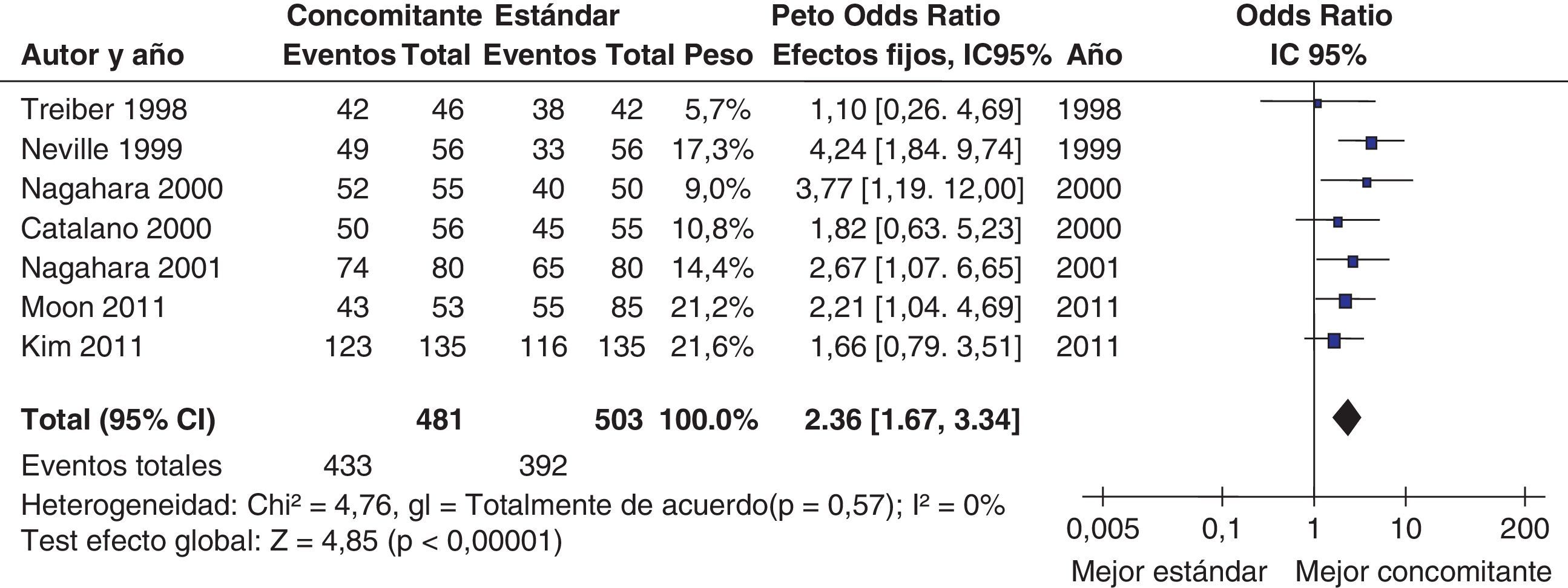
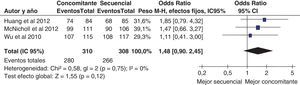
La terapia cuádruple «secuencial» consiste en una fase de inducción de 5 días con un tratamiento dual (un IBP y amoxicilina), seguido inmediatamente por una terapia triple durante 5 días (con un IBP, claritromicina y metronidazol)199. Los resultados iniciales fueron satisfactorios, con tasas de erradicación significativamente superiores a las de la terapia triple200. No obstante, cuando existe resistencia doble frente a la claritromicina y el metronidazol la eficacia de la terapia cuádruple «secuencial» disminuye considerablemente199. Una revisión sistemática de 25 estudios (2.482 pacientes) evidenció una tasa media de erradicación «por intención de tratar» del 91% con la terapia «secuencial»199. También confirmó que este tratamiento era más efectivo que el triple clásico: 92 vs. 77%. La OR para esta comparación fue de 3,1 (IC 95%: 2,2-4,3) a favor del tratamiento «secuencial».
Una reciente revisión sistemática y metaanálisis de la colaboración Cochrane en la que se incluyeron los estudios que comparaban la terapia cuádruple «secuencial» frente a la triple terapia clásica identificó 35 ensayos clínicos aleatorizados, con un total de 11.036 pacientes tratados201. El análisis global demostró que la terapia cuádruple «secuencial» era significativamente más eficaz que la triple terapia clásica (84 vs. 77%; OR=1,53; IC 95%=1,39-1,68). No obstante, los resultados fueron heterogéneos y 11 estudios no demostraron diferencias significativas entre ambas terapias. Se observó también una menor eficacia en los estudios más recientes. Por otra parte, un primer estudio realizado en nuestro medio mostró una eficacia inferior (84%)202. Más recientemente, un segundo estudio español ha confirmado estos datos: aunque la terapia cuádruple «secuencial» fue más eficaz que la triple clásica, los resultados fueron subóptimos, con cifras de erradicación de tan solo el 77%203. Por tanto, la ventaja del tratamiento cuádruple «secuencial» sobre el triple estándar debería confirmarse en nuestro medio antes de recomendar un cambio generalizado en la elección del tratamiento erradicador de primera línea.
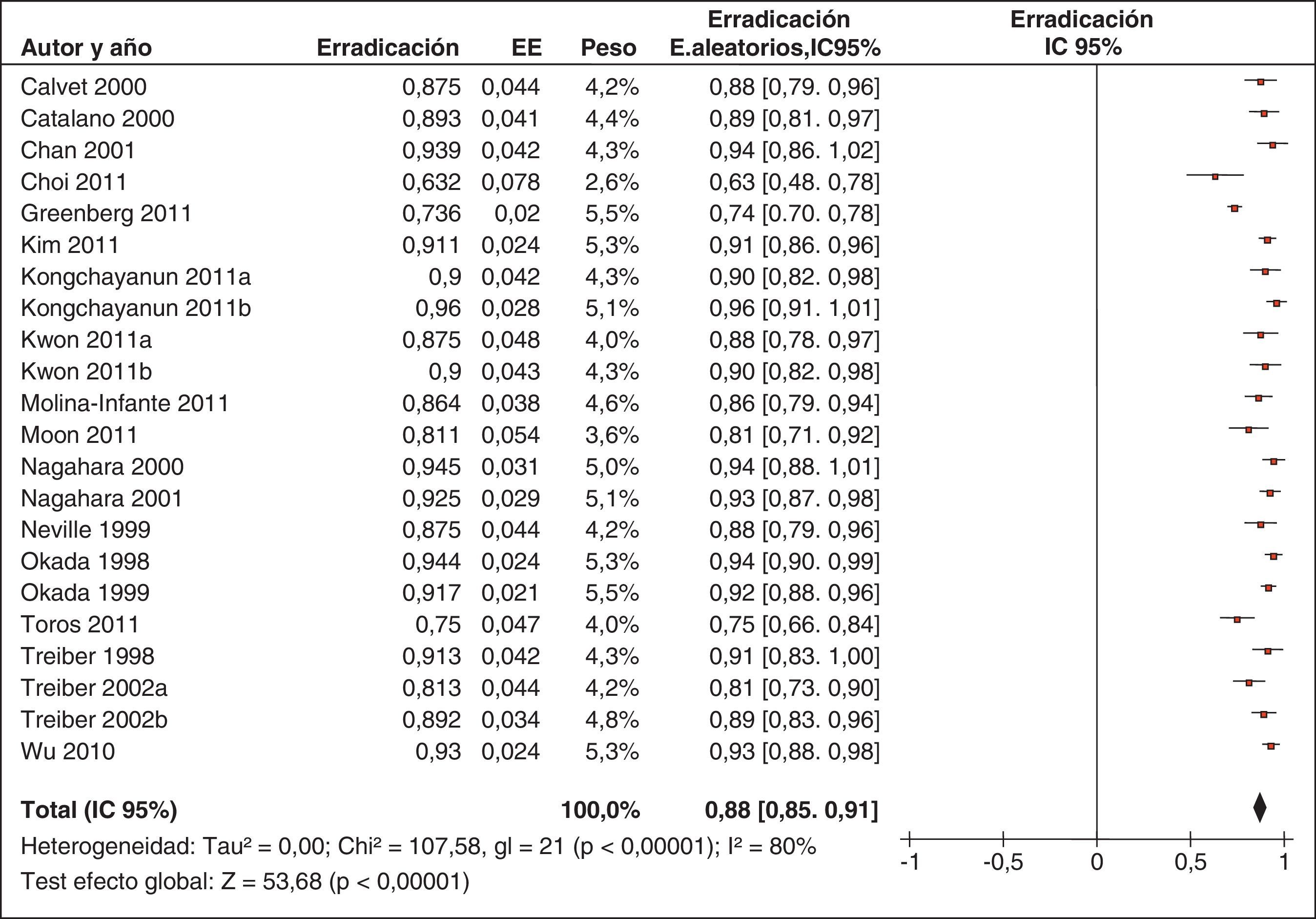
Con respecto al tratamiento «concomitante», una revisión sistemática de la literatura médica incluyendo los estudios que habían administrado IBP, amoxicilina, claritromicina y metronidazol de forma concomitante (tabla 5) en lugar de secuencialmente ha demostrado que con tan solo 5 días de tratamiento (la mitad de los que precisa la terapia cuádruple «secuencial») se puede lograr una tasa de erradicación del 90%204.
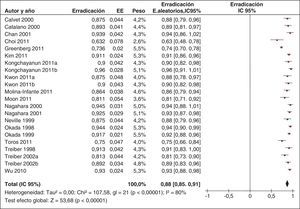
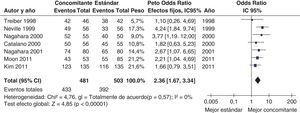
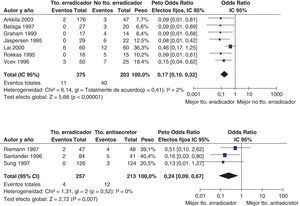
Más recientemente, se ha publicado una revisión sistemática y un metaanálisis205,206. A partir del metaanálisis de los 19 estudios (incluyendo 2.070 pacientes) que evaluaban el tratamiento «concomitante», se calculó una tasa de erradicación media («por intención de tratar») del 88% (IC 95%=85-91%) (fig. 2). Por su parte, el metaanálisis de los estudios aleatorizados que comparaban el tratamiento «concomitante» (481 pacientes) frente al triple estándar (503 pacientes) demostró una eficacia mayor con el primero (90%) que con el segundo (78%) («por intención de tratar»). Los resultados fueron homogéneos (I2=0%). La OR para esta comparación fue de 2,36 (IC 95%=1,67-3,34) (fig. 3). Se observó una tendencia hacia unos mejores resultados con los tratamientos más largos (7-10 vs. 3-5 días), por lo que parece razonable recomendar la duración que se asocia con la mayor eficacia (10 días).
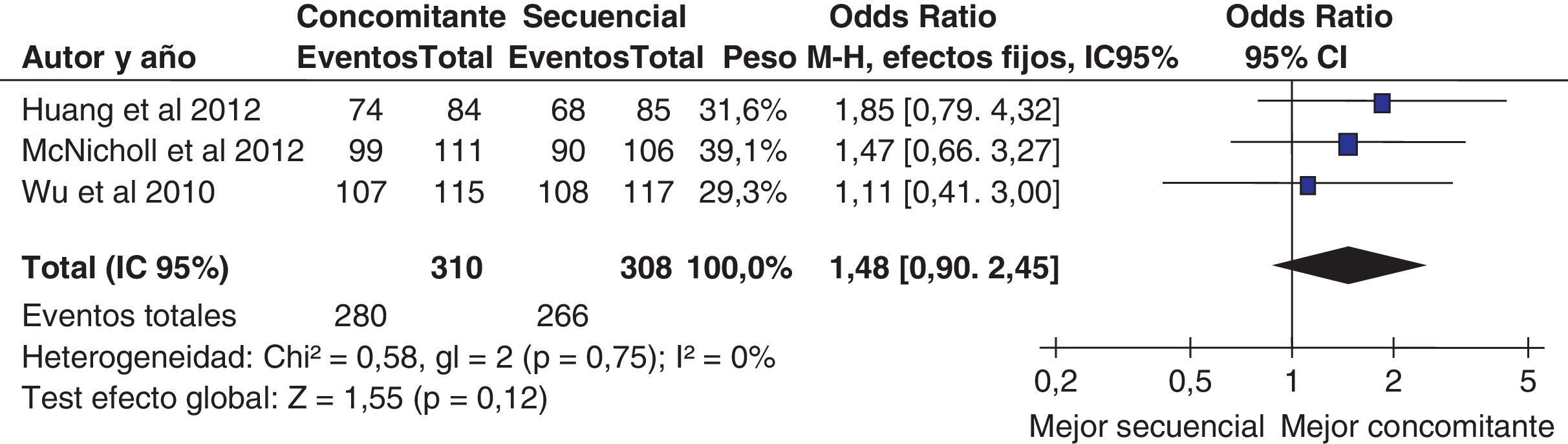
Un reciente ensayo clínico aleatorizado incluyendo 232 pacientes demostró unas tasas de curación muy similares en los grupos tratados con terapia «secuencial» y «concomitante» (92 y 93%, respectivamente)207. Más recientemente, un estudio prospectivo español ha evaluado la eficacia del tratamiento cuádruple «concomitante» en un área geográfica donde previamente la terapia cuádruple «secuencial» obtuvo resultados subóptimos (tasa de erradicación del 77%) y ha logrado una tasa de curación aproximadamente del 90% con la administración concomitante del IBP, amoxicilina, claritromicina y metronidazol durante 10 días208.
Por último, un estudio multicéntrico español ha comparado la eficacia y seguridad de las 2 modalidades fundamentales de terapia cuádruple: «secuencial» y «concomitante»209. Los pacientes fueron aleatorizados a recibir tratamiento «secuencial» (omeprazol 20mg/12h, y amoxicilina 1g/12h durante 5 días, seguido de 5 días más con omeprazol 20mg/12h, metronidazol 500mg/12h y claritromicina 500mg/12h) o «concomitante» (los mismos 4 medicamentos tomados concomitantemente durante 10 días). Los resultados muestran que la erradicación «por intención de tratar» fue del 87% con el tratamiento «concomitante» y algo inferior (aunque sin alcanzar significación estadística), del 81%, con el «secuencial».
En resumen, hasta el momento se han realizado 4 estudios en los que se compara, mediante un diseño aleatorizado, el tratamiento «secuencial» frente al «concomitante»207,209–211. Si únicamente se consideran los 3 estudios que comparan ambos tratamientos con una duración de 10 días (excluyendo por tanto el estudio de Greenberg et al.210, en el que se prescribe el tratamiento «concomitante» durante solo 5 días), el metaanálisis de estos demuestra una tendencia homogénea a una mayor eficacia («por intención de tratar») con el tratamiento «concomitante», aunque sin alcanzar diferencias estadísticamente significativas (OR=1,48; IC 95%=0,90-2,45) (fig. 4).
Por otra parte, algunos estudios han demostrado una ventaja del tratamiento «concomitante» frente al «secuencial» cuando ambos son utilizados frente a cepas resistentes a la claritromicina (75 vs. 57%207, 100 vs. 75%208, 100 vs. 60%211) y frente a cepas con doble resistencia a la claritromicina y al metronidazol (75 vs. 33%207, 75 vs. 60%208, 100 vs. 50%211). No obstante, dado el escaso número de pacientes (n=37) con cepas de H. pylori resistentes a la claritromicina incluidos en los 3 estudios mencionados previamente, es evidente que se precisa más experiencia para extraer conclusiones definitivas.
Finalmente, una ventaja adicional de la terapia «concomitante» es que es más sencilla de explicar al paciente que la «secuencial», dado que únicamente se debe añadir metronidazol 500mg cada 12h a la terapia triple clásica.
En conclusión, la terapia cuádruple sin bismuto («concomitante») representa una opción válida en áreas geográficas donde la eficacia del tratamiento triple clásico es inaceptablemente baja; no obstante, la pauta inicial triple con un IBP, claritromicina y amoxicilina sigue siendo una opción aceptable en áreas donde se mantenga una efectividad por encima del 80%.
Recomendación C2En caso de elegir una pauta triple con claritromicina y amoxicilina, se recomienda administrarla durante 10 a 14 días. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
Un primer metaanálisis212, que incluía 13 estudios, demostró que la prolongación del tratamiento de 7 a 14 días incrementaba la tasa de erradicación de H. pylori en un 9%, mientras que la diferencia entre 7 y 10 días era solo del 3%. De este modo, el incremento en las cifras de curación era estadísticamente significativo al aumentar la duración a 14 días (OR=0,62; IC 95%=0,45-0,84) pero no a 10 días. En un segundo metaanálisis213 se observaron diferencias aún mayores (12%) al comparar 7 frente a 14 días (RR=0,88; IC 95%=0,83-0,93).
Más recientemente, otro metaanálisis en el que se incluyeron 21 estudios para la erradicación de H. pylori214 estimó un RR de 1,05 (IC 95%=1,01-1,10) al comparar 7 frente a 10 días, y un RR de 1,07 (IC 95%=1,02-1,12) al comparar 7 frente a 14 días. En términos de porcentajes, el incremento en la tasa de curación fue del 4% para los tratamientos de 10 días, y del 5% para los de 14 días. Aunque los autores de esta última revisión sistemática ponen en duda la relevancia clínica de este incremento, lo cierto es que las diferencias alcanzaron significación estadística. Finalmente, un último metaanálisis muy reciente215 ha incluido 26 estudios y ha obtenido resultados muy similares, demostrando un beneficio de 14 frente a 10 días, y de 10 frente a 7 días.
Recomendación C3En caso de elegir una pauta triple con claritromicina y amoxicilina, se recomienda administrar dosis altas del IBP. Acuerdo 100%; votos: totalmente de acuerdo (94%); bastante de acuerdo (6%). GR: fuerte. CE: alta.
Un reciente metaanálisis de Villoria et al.216 pone de manifiesto cómo el aumento de la dosis de IBP –habitualmente utilizando dosis dobles– incrementa las tasas de curación en un 6-10% cuando se compara con dosis estándar. Un subanálisis de este estudio muestra que cuanto mayor es el grado de inhibición ácida más aumenta la eficacia, y que, cuando se comparan 40mg de esomeprazol (2 veces al día) con un IBP de primera generación a dosis estándar (también 2 veces al día), la ganancia en cuanto a tasas de erradicación es máxima, con un aumento de las cifras de curación de entre el 8 y el 12%216.
Aunque el número de estudios incluidos en el mencionado metaanálisis de Villoria et al. es limitado, disponemos de datos procedentes de otros metaanálisis y de estudios no comparativos que son coherentes. Así, el metaanálisis de Vallvé et al.217 demostró claramente que las tasas de curación de H. pylori eran superiores cuando los IBP se administraban cada 12 h que cuando se prescribían una vez al día. Por su parte, Padol et al.218 constataron en un reciente metaanálisis que la terapia triple era significativamente menos efectiva en pacientes metabolizadores (CYP2C19) rápidos de los IBP. Las diferencias en las tasas de curación estarían justificadas por las marcadas diferencias en los niveles sanguíneos entre metabolizadores lentos y rápidos219. En este sentido, un reciente estudio ha calculado que para conseguir los mismos niveles sanguíneos, la dosis de IBP en pacientes metabolizadores rápidos ha de ser 6 veces superior a la de los metabolizadores lentos220.
Esto concuerda con los resultados de un metaanálisis muy reciente en el que se concluye que los tratamientos triples que emplean IBP de nueva generación (esomeprazol y rabeprazol) muestran una tasa de erradicación global de H. pylori más elevada que los que utilizan IBP de primera generación, y que este beneficio clínico es más pronunciado en los tratamientos que emplean esomeprazol, 40mg/12h221. De este modo, en pacientes metabolizadores rápidos, los nuevos IBP eran más efectivos que los de primera generación221. No obstante, la recomendación general de emplear IBP de nueva generación sistemáticamente en todas las situaciones no está establecida, y son precisos estudios farmacoeconómicos.
Recomendación C4No se recomienda el uso de prebióticos asociado al tratamiento erradicador. Acuerdo 100%; votos: totalmente de acuerdo (88%); bastante de acuerdo (6%); algo de acuerdo (6%). GR: fuerte. CE: baja.
La terapia adyuvante más utilizada ha incluido el prebiótico lactoferrina. Se han publicado 2 metaanálisis con resultados similares: el uso de lactoferrina aumenta la eficacia y reduce los efectos adversos de la terapia triple222,223. Sin embargo, la fuerza de la evidencia está limitada por: a) la baja calidad de gran parte de los estudios incluidos en dicho metaanálisis; b) que la mayoría de los estudios provienen del mismo grupo, y c) que los resultados de dichos estudios no han sido consistentemente reproducidos. En conclusión, el uso de lactoferrina como cuarto fármaco asociado a la terapia triple para la erradicación de H. pylori parece prometedora, pero la evidencia es actualmente insuficiente para poder recomendar su uso generalizado.
Recomendación C5No se recomienda el uso generalizado de probióticos asociado al tratamiento erradicador. Acuerdo 88%; votos: totalmente de acuerdo (59%); bastante de acuerdo (24%); algo de acuerdo (6%); algo en desacuerdo (11%). GR: fuerte. CE: baja.
Los metaanálisis que han evaluado el papel de Lactobacillus sp. en la erradicación de H. pylori son de mala calidad y combinan los resultados de cepas distintas e incluso de mezclas de bacterias223–226. Los resultados indican que algunos de estos probióticos podrían ser efectivos para aumentar las tasas de erradicación o disminuir los efectos adversos, pero los datos son insuficientes para recomendar un uso generalizado. Tras la publicación de los mencionados metaanálisis han aparecido estudios adicionales con resultados heterogéneos, pero predominantemente negativos227–233. Finalmente, un metaanálisis muy reciente234 muestra resultados muy prometedores con el uso de Saccharomices boulardii como adyuvante a la triple terapia. El uso concomitante de este probiótico aumentó las tasas de curación del 64 al 80% y disminuyó los efectos adversos (OR=0,46; IC 95%=0,3-0,7). Sin embargo, el número de estudios es demasiado limitado como para establecer una recomendación firme.
En resumen, actualmente la opción más prudente parece la recomendación de realizar estudios adicionales para determinar qué cepa, qué dosis y durante cuánto tiempo deberían utilizarse los probióticos para el tratamiento de la infección por H. pylori, antes de recomendar su uso generalizado en la práctica clínica235.
Recomendación C6Tras el fracaso de un primer tratamiento que incluya claritromicina, se recomienda una pauta triple con un IBP, amoxicilina y levofloxacino durante 10 días. Acuerdo 100%; votos: totalmente de acuerdo (88%); bastante de acuerdo (12%). GR: fuerte. CE: moderada.
Cuando ha fracasado el tratamiento de primera línea habitual (IBP, claritromicina y amoxicilina) se ha recomendado tradicionalmente como rescate la terapia cuádruple clásica (IBP, bismuto, tetraciclina y metronidazol; tabla 5)236. Más recientemente se han llevado a cabo diversos estudios empleando levofloxacino (tabla 5) como tratamiento de rescate tras el fracaso de un primer intento erradicador, con resultados alentadores (tabla 6)237–256.
Estudios que evalúan la eficacia («por intención de tratar») de un tratamiento de rescate con un inhibidor de la bomba de protones, amoxicilina y levofloxacino para la erradicación de Helicobacter pylori
| Autor | Año de publicación | Número de pacientes | Dosis de levofloxacino (mg/día) | Duración (días) | Erradicación (%) |
| Nista et al.237 | 2003 | 70 | 500 | 10 | 94 |
| Perri et al.238 | 2003 | 58 | 500 | 7 | 63 |
| Watanabe et al.239 | 2003 | 33 | 400 | 7 | 70 |
| Bilardi et al.240 | 2004 | 23 | 500 | 10 | 70 |
| Matsumoto et al.241 | 2005 | 30 | 600 | 7 | 70 |
| Lee et al.242 | 2006 | 105 | 500 | 10 | 91 |
| Lee et al.243 | 2006 | 9 | 400 | - | 56 |
| Marzio et al.244 | 2006 | 32 | 1.000 | 10 | 81 |
| Wong et al.245 | 2006 | 31 | 1.000 | 7 | 61 |
| Cheng et al.246 | 2007 | 62 | 500 | 7 | 79 |
| Cheng et al.246 | 2007 | 62 | 1.000 | 7 | 81 |
| Gisbert et al.247 | 2007 | 50 | 1.000 | 7 | 68 |
| Perna et al.248 | 2007 | 33 | 500 | 10 | 73 |
| Gisbert et al.249 | 2008 | 300 | 1.000 | 10 | 77 |
| Jung et al.250 | 2008 | 31 | 600 | 7 | 52 |
| Di Caro et al.251 | 2009 | 40 | 500 | 7 | 65 |
| Di Caro et al.251 | 2009 | 40 | 500 | 10 | 90 |
| Di Caro et al.251 | 2009 | 40 | 1.000 | 7 | 70 |
| Di Caro et al.251 | 2009 | 40 | 1.000 | 10 | 85 |
| Kuo et al.252 | 2009 | 83 | 500 | 7 | 70 |
| Schrauwen et al.253 | 2009 | 14 | 1.000 | 7 | 100 |
| Liou et al.254 | 2010 | 26 | 759 | 7 | 77 |
| Zullo et al.255 | 2010 | 47 | 500 | 10 | 77 |
| Zullo et al.255 | 2010 | 39 | 1.000 | 10 | 77 |
| Gisbert et al.256 | 2012 | 1.000 | 1.000 | 10 | 74 |
Tres metaanálisis han comparado una pauta triple incluyendo levofloxacino con la terapia cuádruple clásica y han demostrado una mayor eficacia y una menor incidencia de efectos adversos con la terapia triple basada en levofloxacino257–259. Recientemente se ha actualizado dicho metaanálisis, incluyéndose 13 estudios con un total de 1.709 pacientes (1.011 con tratamiento triple con levofloxacino y 698 con terapia cuádruple de bismuto)260. Un primer análisis con todos los estudios seleccionados reveló una tendencia no significativa a una mayor eficacia erradicadora del tratamiento triple con levofloxacino frente al cuádruple con bismuto (79 vs. 70%; OR=1,43; IC 95%=0,88-2,31), con una tasa significativamente menor de efectos adversos (14 vs. 32%; OR=0,30; IC 95%=0,19-0,50) y de efectos adversos graves (0,7 vs. 7,8%; OR=0,15; IC 95%=0,04-0,59). Dos de los estudios238,245 mostraban que la terapia cuádruple era más efectiva, lo cual podría deberse a que en ambos casos el tratamiento con levofloxacino se administraba durante 7 días en lugar de 10. Excluyendo estos 2 estudios discordantes, la heterogeneidad se redujo y aumentó la eficacia erradicadora de la terapia triple con levofloxacino. La triple terapia con levofloxacino de 10 días demostró ser más eficaz que la de 7 días (89 vs. 70%). Un subanálisis incluyendo únicamente estudios con tratamiento triple de 10 días con levofloxacino, amoxicilina y un IBP demostró aún una mayor eficacia con este tratamiento en comparación con el cuádruple con bismuto (89 vs. 66%; OR=4,22; IC 95%=2,84-6,26).
Estos alentadores resultados con levofloxacino han sido confirmados recientemente en un amplio estudio multicéntrico español, en el que 1.000 pacientes en los que había fracasado un primer tratamiento erradicador con IBP-claritromicina-amoxicilina recibieron durante 10 días levofloxacino (500mg/12h), amoxicilina (1g/12h) y omeprazol (20mg/12h)256. La erradicación se logró en el 74% de los pacientes y, aunque se describieron efectos adversos en una quinta parte de los casos, ninguno de ellos fue grave. En este estudio se valoró también si la eficacia disminuía con el paso del tiempo, pues las resistencias a las quinolonas en España parecen estar incrementándose con rapidez. Sin embargo, las tasas de erradicación fueron del 76% en el año 2006, del 68% en 2007, del 70% en 2008, del 76% en 2009, del 74% en 2010 y del 81% en 2011, por lo que se concluye que, al menos de momento, la eficacia de este tratamiento se mantiene estable con el paso del tiempo256.
Por lo tanto, se puede concluir que la terapia de rescate con levofloxacino durante 10 días tiene una elevada eficacia en la erradicación de H. pylori y representa una alternativa a la cuádruple terapia tras el fracaso de un primer intento erradicador con la terapia triple estándar, con la ventaja de ser un régimen sencillo y bien tolerado.
Los tratamientos cuádruples sin bismuto, que incluyen un IBP, amoxicilina, claritromicina y un nitroimidazol, administrados tanto de forma «secuencial» como «concomitante», son cada vez más utilizados como primera línea. Es un reto encontrar tratamientos de rescate tras el fracaso de estas terapias, que emplean antibióticos clave como la claritromicina y los nitroimidazoles. El objetivo de un estudio multicéntrico español fue evaluar la eficacia de un tratamiento triple con levofloxacino (IBP, amoxicilina y levofloxacino) como segunda línea tras el fracaso de una terapia cuádruple sin bismuto261. Las tasas de erradicación tras el fracaso de la terapia «secuencial» y «concomitante» fueron, respectivamente, del 76 y del 79%. Estos alentadores resultados han sido confirmados por otros autores248,262–264. Por tanto, la terapia triple con levofloxacino durante 10 días parece ser también una prometedora alternativa de segunda línea en pacientes con fracaso erradicador previo a los tratamientos cuádruples «secuencial» y «concomitante».
Recomendación C7Tras el fracaso de un primer tratamiento que incluya claritromicina y una pauta triple con levofloxacino de segunda línea, se recomienda una terapia cuádruple clásica con bismuto (IBP, bismuto, tetraciclina y metronidazol) al menos durante 10 días. Acuerdo 100%; votos: totalmente de acuerdo (82%); bastante de acuerdo (12%); algo de acuerdo (6%). GR: fuerte. CE: muy baja.
Tras el fracaso de la combinación de un IBP, amoxicilina y claritromicina –la más empleada en nuestro medio–, actualmente se recomienda administrar una terapia triple con un IBP, amoxicilina y levofloxacino236,265. En ocasiones, este segundo tratamiento también fracasa, y en estos casos habitualmente se prescribe la denominada cuádruple terapia con bismuto (IBP, bismuto, tetraciclina y metronidazol; tabla 5)265. La elección del tratamiento de rescate depende de los fármacos que se hayan empleado en los intentos erradicadores previos. Ya que la repetición del mismo antibiótico no es recomendable, la terapia cuádruple con bismuto parece actualmente la opción más adecuada, pues evita fundamentalmente la readministración de claritromicina. Por ello es la estrategia que se utiliza habitualmente en la práctica clínica en nuestro medio265.
No obstante, la experiencia con esta pauta tras el fracaso de 2 tratamientos erradicadores es aún muy escasa. Recientemente se ha realizado un estudio multicéntrico nacional en el que se evaluó la eficacia de la terapia cuádruple con bismuto como tercera línea266. Así, se incluyeron pacientes consecutivos en los que había fracasado un primer tratamiento con IBP, claritromicina y amoxicilina, y un segundo con IBP, amoxicilina y levofloxacino. Se administró un tercer tratamiento erradicador con un IBP (a dosis estándar cada 12h), subcitrato de bismuto (120mg/6h o 240mg/12h), tetraciclina (entre 250mg/8h y 500mg/6h) y metronidazol (entre 250mg/8h y 500mg/6h) durante 7 a 14 días. Se incluyeron 200 pacientes, 2 de los cuales no finalizaron el seguimiento. La erradicación «por intención de tratar» fue del 65% (IC 95%=58-72%). Se describieron efectos adversos en el 22% de los casos, ninguno de ellos grave.
Evidentemente, una posibilidad ante el fracaso de 2 tratamientos erradicadores es realizar cultivo y antibiograma para, en función de la susceptibilidad bacteriana, seleccionar la combinación antibiótica más adecuada. Aunque esta opción de tratamiento «dirigido» es la habitualmente recomendada, su utilidad no ha sido suficientemente confirmada en la práctica clínica. Así, 3 estudios (2 de ellos españoles) que han evaluado la eficacia de una tercera línea de tratamiento cuádruple basada en el cultivo (omeprazol, bismuto, tetraciclina y, finalmente, amoxicilina o claritromicina dependiendo de la sensibilidad bacteriana) han obtenido tasas de erradicación de tan solo el 36 y el 47% con claritromicina y del 67, 73 y 90% con amoxicilina267–269. La tasa de erradicación obtenida con el tratamiento cuádruple empírico en el estudio multicéntrico nacional previamente mencionado266 fue similar a la descrita en los 2 estudios españoles en los que se administraba tratamiento en función del cultivo bacteriano267,268.
Por otra parte, pueden esgrimirse una serie de argumentos para no realizar cultivo antes de indicar un tercer tratamiento erradicador y, por el contrario, recomendar la administración de un tratamiento empírico tras el fracaso de un segundo intento. Así, el cultivo de H. pylori es una técnica disponible en pocos centros, que precisa realizar una prueba invasiva (endoscopia digestiva alta), con una sensibilidad inferior al 90% y con una discordancia notable entre los resultados obtenidos in vitro y la tasa de erradicación in vivo270. Además, el cultivo únicamente proporciona información útil acerca de algunos antibióticos ya utilizados en tratamientos erradicadores previos de primera línea (claritromicina y metronidazol) y de segunda línea (levofloxacino), los cuales, por definición, no se deberían volver a emplear.
Por tanto, aunque habitualmente se ha recomendado que ante el fracaso de 2 tratamientos erradicadores es preciso llevar a cabo cultivo y antibiograma para, en función de la susceptibilidad bacteriana, seleccionar la combinación antibiótica más adecuada, otra opción igualmente válida es el empleo de un tratamiento empírico sin necesidad de realizar cultivo bacteriano. No obstante, se considera muy recomendable que en algunos centros especializados se realice cultivo sistemáticamente tras el fracaso erradicador y se diseñen estudios donde se administre tratamiento de rescate en función del antibiograma, comparando esta estrategia con la prescripción empírica de una terapia de tercera línea.
En resumen, se concluye que el tratamiento de rescate cuádruple con bismuto constituye una alternativa (empírica) de tercera línea válida tras el fracaso de un tratamiento con claritromicina y otro con levofloxacino.
Recomendación C8Tras el fracaso de un primer tratamiento que incluya claritromicina y de una terapia cuádruple clásica con bismuto de segunda línea, se recomienda una pauta triple con levofloxacino durante 10 días. Acuerdo 100%; votos: totalmente de acuerdo (71%); bastante de acuerdo (29%). GR: fuerte. CE: moderada.
Tras el fracaso de la combinación de un IBP, amoxicilina y claritromicina, tradicionalmente se ha recomendado administrar una terapia cuádruple con un IBP, bismuto, tetraciclina y metronidazol236,265. En ocasiones, este segundo tratamiento también fracasa, y en estos casos, con la intención de no readministrar ni claritromicina ni metronidazol, se ha sugerido prescribir una pauta triple con levofloxacino y amoxicilina265.
No obstante, la experiencia con esta pauta tras el fracaso de 2 tratamientos erradicadores es aún escasa. Hace unos años se publicó un estudio multicéntrico español en el que se evaluaba la eficacia de la triple terapia con levofloxacino como tercera línea, con resultados prometedores (erradicación de aproximadamente el 70%)271. Recientemente, estos resultados han sido confirmados en un estudio multicéntrico nacional más amplio, incluyendo un total de 200 pacientes272. Así, se incluyeron pacientes consecutivos en los que había fracasado un primer tratamiento con un IBP, claritromicina y amoxicilina, y un segundo con una pauta cuádruple (IBP, bismuto, tetraciclina y metronidazol). Se administró un tercer tratamiento erradicador con un IBP (a dosis estándar cada 12h), amoxicilina (1g/12) y levofloxacino (500mg/12h) durante 10 días. Se incluyeron 200 pacientes, 12 de los cuales no finalizaron el seguimiento. La erradicación «por intención de tratar» fue del 68% (IC 95%=61-75%). Se describieron efectos adversos en el 19% de los casos, ninguno de ellos grave.
Otros autores han obtenido también buenos resultados con este tratamiento triple de tercera línea240,255,271,273–275, con tasas de erradicación que han oscilado entre el 60 y el 86%, como se resume en la tabla 7. Así, la tasa de erradicación media, calculada a partir de dichos estudios, es del 73%.
Estudios que evalúan la eficacia («por intención de tratar») de un tercer tratamiento con un inhibidor de la bomba de protones, amoxicilina y levofloxacino tras 2 fracasos erradicadores
| Autor | Año de publicación | Número de pacientes | Tratamientos previos (fallidos) | Duración (días) | Erradicación (%) |
| Zullo et al.255 | 2003 | 36 | ≥ 2 tratamientos con C y M | 10 | 83 |
| Bilardi et al.240 | 2004 | 14 | Tratamientos con C y M | 10 | 86 |
| Gatta et al.273 | 2005 | 151 | 1.o: IBP + C + A o M2.o: IBP + C + A o M; Q | 10 | 76 |
| Gisbert et al.271 | 2006 | 100 | 1.o: IBP + C + A2.o: Q | 10 | 60 |
| Gisbert et al.274 | 2006 | 20 | 1.o: IBP + C + A2.o: Q | 10 | 85 |
| Rokkas et al.275 | 2009 | 30 | 1.o: IBP + C + A2.o: Q | 10 | 70 |
A: amoxicilina; C: claritromicina; IBP: inhibidor de la bomba de protones; M: metronidazol; Q: terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Por tanto, se concluye que el tratamiento (empírico) de rescate con levofloxacino constituye una prometedora alternativa de tercera línea tras el fracaso de 2 terapias erradicadoras previas conteniendo antibióticos clave como amoxicilina, claritromicina, metronidazol y tetraciclina.
Recomendación C9Tras el fracaso de un tercer tratamiento se sugiere considerar la necesidad de remitir al paciente a un centro con experiencia en el tratamiento de la infección por H. pylori multirrefractaria. Acuerdo 89%; votos: totalmente de acuerdo (59%); bastante de acuerdo (24%); algo de acuerdo (6%); algo en desacuerdo (6%); totalmente en desacuerdo (5%). GR: débil. CE: baja.
En ocasiones, la infección por H. pylori persiste a pesar de haber administrado 3 tratamientos erradicadores consecutivos270. Se desconoce hasta qué punto merece la pena (en cuanto a eficacia y seguridad) intentar un cuarto tratamiento erradicador en estos casos especialmente resistentes. Por ello, en esta situación parece sensato reevaluar cuidadosamente la necesidad de erradicación y la posibilidad de dejar tratamiento antisecretor de mantenimiento (especialmente en pacientes con úlcera péptica no complicada).
Una reciente revisión de la literatura médica ha evaluado el papel de la rifabutina −un antibiótico que posee una elevada actividad in vitro frente a H. pylori276− en el tratamiento de esta infección277. La tasa media de resistencia de H. pylori a la rifabutina (calculada a partir de 11 estudios, incluyendo 2.982 pacientes) fue de solo el 1,3% (IC 95%=0,9-1,7%). Cuando únicamente se consideraron aquellos estudios que incluían pacientes sin tratamiento erradicador previo, esta cifra fue incluso menor (0,6%). Globalmente, la tasa media de erradicación de H. pylori (análisis «por intención de tratar») con las combinaciones que incluían rifabutina (1.008 pacientes incluidos) fue del 73% (IC 95%=67-79%). Específicamente, las cifras correspondientes para los tratamientos con rifabutina de cuarta/quinta línea (95 pacientes) fueron del 79% (IC 95%=60-79%) (fig. 5)271,278–283. Para el tratamiento de la infección por H. pylori, la mayoría de los estudios han empleado 300mg/día de rifabutina, dosis que parece ser más efectiva que la de 150mg/día. La duración óptima del tratamiento no está establecida, pero generalmente se recomienda administrarlo durante 10-12 días. La incidencia media de efectos adversos fue del 22%. La mielotoxicidad fue el más relevante, aunque excepcional; hasta este momento, todos los pacientes se han recuperado de la leucopenia sin problemas en unos pocos días tras la finalización del tratamiento, y no se han descrito infecciones ni otras complicaciones asociadas.
Estos resultados han sido confirmados muy recientemente en un estudio multicéntrico español, en el que se evaluó la eficacia de un cuarto tratamiento de rescate empírico con rifabutina en pacientes en los que habían fracasado previamente 3 intentos erradicadores (el primero con un IBP, claritromicina y amoxicilina; el segundo con una cuádruple terapia con un IBP, bismuto, tetraciclina y metronidazol; y el tercero con un IBP, amoxicilina y levofloxacino)284. Se administró un cuarto tratamiento erradicador con rifabutina (150mg/12h), amoxicilina (1g/12h) y un IBP (dosis estándar/12h) durante 10 días. Se incluyeron 100 pacientes consecutivos. Ocho pacientes no tomaron la medicación correctamente (en 6 casos debido a efectos adversos). La tasa de erradicación «por intención de tratar» fue del 50% (IC 95%=40-60%). Se describieron efectos adversos en 30 pacientes (30%). La mielotoxicidad se resolvió espontáneamente en todos los casos tras la finalización del tratamiento. Por tanto, se concluye que incluso tras el fracaso de 3 tratamientos previos, una cuarta terapia de rescate empírica con rifabutina puede ser efectiva para erradicar la infección por H. pylori en aproximadamente la mitad de los casos.
En resumen, tras el fracaso de un tercer tratamiento se recomienda evaluar cuidadosamente la necesidad de erradicación y la posibilidad de dejar tratamiento antisecretor de mantenimiento. En caso de que se considere necesaria la erradicación se recomienda remitir al paciente a un centro de referencia con experiencia en el tratamiento de la infección por H. pylori multirresistente (donde se valorará, por ejemplo, administrar un tratamiento con rifabutina, bajo estricto control).
Recomendación C10En pacientes alérgicos a la penicilina se sugiere de primera línea una pauta triple combinando un IBP, claritromicina y metronidazol, o una cuádruple terapia con bismuto (IBP, bismuto, tetraciclina y metronidazol) al menos durante 10 días. Acuerdo 100%; votos: totalmente de acuerdo (65%); bastante de acuerdo (29%); algo de acuerdo (6%). GR: débil. CE: baja.
Hasta el momento, la experiencia en el tratamiento erradicador de los pacientes alérgicos a la penicilina es muy escasa, aunque esta circunstancia se describe con relativa frecuencia en la práctica clínica. En los pacientes con alergia a los betalactámicos se recomienda generalmente un tratamiento triple con un IBP, claritromicina y metronidazol4,95. En un estudio prospectivo español inicial se administró este régimen durante 7 días a 12 pacientes alérgicos a la penicilina y se obtuvo una tasa de erradicación («por intención de tratar») del 58%285. En otro estudio español posterior, en este caso multicéntrico, se alcanzaron cifras de erradicación del 55% al emplear este mismo tratamiento en 50 pacientes286. Por último, muy recientemente se han actualizado los resultados de dicho estudio multicéntrico nacional, en el que se planteaba si el tratamiento erradicador de H. pylori de primera línea con claritromicina y metronidazol en pacientes alérgicos a la penicilina era una opción aceptable en nuestro medio287. Se trata de un estudio prospectivo en el que se incluyeron 114 pacientes consecutivos alérgicos a la penicilina, a los que se administró tratamiento con un IBP (a las dosis habituales/12h), claritromicina (500mg/12h) y metronidazol (500mg/12h) durante 7 días. La tasa de erradicación «por intención de tratar» fue del 56% (IC 95%=47-66%). Los autores concluyeron que, si bien los pacientes alérgicos a los betalactámicos pueden recibir como tratamiento de primera línea una combinación con un IBP, claritromicina y metronidazol, su eficacia parece ser insuficiente. Por tanto, aunque esta combinación se ha considerado clásicamente como un tratamiento relativamente efectivo288, con una eficacia ≥ 80%, las tasas de curación en los estudios españoles (en pacientes alérgicos a la penicilina) son inferiores al 60%. Esto probablemente se debe, al menos en parte, a una relativamente elevada frecuencia de resistencia a la claritromicina en nuestro medio191,289.
Una terapia cuádruple con IBP, bismuto, tetraciclina y metronidazol podría ser una opción más adecuada en áreas con una alta tasa de resistencia a la claritromicina. En este sentido, un estudio donde se administró a 17 pacientes alérgicos a la penicilina un tratamiento durante 10 días con un IBP, tetraciclina y metronidazol, comprobó la erradicación de H. pylori en el 85% de los casos («por intención de tratar»)290. Estos resultados señalan que esta combinación triple (o incluso mejor, añadiendo bismuto y convirtiéndola en una cuádruple) puede representar una alternativa más adecuada para el tratamiento de los pacientes alérgicos a penicilina, aunque esto deberá ser confirmado en futuros estudios. De hecho, es conocido que la terapia cuádruple con bismuto ha logrado resultados satisfactorios a pesar de existir resistencia tanto a la claritromicina como al metronidazol196.
En conclusión, en pacientes alérgicos a la penicilina se sugiere de primera línea una pauta triple combinando un IBP, claritromicina y metronidazol, o una cuádruple terapia con bismuto. Esta última opción probablemente sea más adecuada en áreas con alta tasa de resistencia a claritromicina o baja eficacia del tratamiento triple, aunque es evidente que se precisan estudios comparativos entre ambas pautas para poder decidir cuál de ellas es más efectiva.
Recomendación C11Tras el fracaso del tratamiento de primera línea en pacientes alérgicos a la penicilina se sugiere una terapia triple con un IBP, levofloxacino y claritromicina, al menos durante 10 días. Acuerdo 100%; votos: totalmente de acuerdo (47%); bastante de acuerdo (41%); algo de acuerdo (12%). GR: débil. CE: muy baja.
Como se ha mencionado previamente, en los pacientes con alergia a los betalactámicos se recomienda generalmente un tratamiento triple con un IBP, claritromicina y metronidazol4,95. Por tanto, la erradicación de H. pylori es un reto en los pacientes alérgicos a la penicilina en general, y muy especialmente en aquellos en los que ha fracasado un primer tratamiento con antibióticos clave como la claritromicina y el metronidazol.
En un estudio piloto, 15 pacientes alérgicos a la penicilina en los que había fracasado un primer tratamiento con un IBP, claritromicina y metronidazol, recibieron un segundo tratamiento con un IBP, claritromicina y levofloxacino durante 10 días286. El cumplimiento del tratamiento fue completo en todos los casos. Se describieron efectos adversos en el 20% de los pacientes, todos ellos leves. La tasa de erradicación («por intención de tratar») fue del 73%. Estos resultados han sido actualizados recientemente tras la inclusión de 106 pacientes, confirmando una tasa de erradicación «por intención de tratar» del 67%291. Aunque teóricamente se podrían plantear otras alternativas de tratamiento de rescate tras el fracaso de un IBP, claritromicina y metronidazol, como una terapia cuádruple con IBP, bismuto, tetraciclina y metronidazol, hasta el momento no disponemos de estudios que confirmen su eficacia y, por tanto, no pueden ser actualmente recomendadas. Por último, cabe señalar que la mencionada terapia de rescate con levofloxacino (junto con un IBP y claritromicina) podría también plantearse, teóricamente, en pacientes alérgicos a la penicilina en los que ha fracasado un primer tratamiento cuádruple con bismuto.
Recomendación C12En los pacientes con úlcera duodenal no complicada, tras haber finalizado el tratamiento erradicador de H. pylori no se recomienda mantener el tratamiento antisecretor. Acuerdo 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
Inicialmente, la mayoría de los autores que empleaban IBP en las terapias erradicadoras prolongaban estos fármacos durante 2-4 semanas tras la conclusión del tratamiento antibiótico149. Sin embargo, para obtener una elevada tasa de cicatrización ulcerosa duodenal es suficiente con el empleo de un IBP durante el período de administración de los antibióticos.
Así, una revisión sistemática de la literatura médica identificó 24 estudios, incluyendo un total de 2.378 pacientes, en los que se evaluaba la cicatrización ulcerosa con un IBP más 2 antibióticos durante 7 días8. La tasa de cicatrización media («por intención de tratar») fue del 86% al considerar todos los pacientes (tanto con éxito como con fracaso erradicador de H. pylori). Esta cifra ascendió al 95% cuando únicamente se incluyeron aquellos pacientes en los que se había erradicado la infección. En la figura 6 se representa el metaanálisis de los 6 estudios aleatorizados292–297 que comparan la eficacia en cuanto a la cicatrización ulcerosa al administrar un tratamiento con un IBP más 2 antibióticos durante 7 días frente a ese mismo tratamiento asociado a IBP durante 2-4 semanas más8. Se demostró la cicatrización de la úlcera en el 91 y 92% de los casos, respectivamente. La OR para esta comparación fue de 1,11 (IC 95%=0,71-1,74), siendo los resultados homogéneos. Por último, cuando se efectuó un subanálisis incluyendo únicamente los pacientes con úlcera duodenal, los resultados fueron similares (OR de 1,14, con un IC 95% de 0,71 a 1,84). Posteriormente a la publicación de este metaanálisis se ha llevado a cabo otro estudio aleatorizado con resultados similares298.
En resumen, se concluye que para obtener una elevada tasa de cicatrización de la úlcera duodenal es suficiente el empleo de IBP durante el período de administración de los antibióticos. No obstante, parece prudente que en una úlcera duodenal que haya sufrido complicaciones (por ejemplo, hemorragia digestiva) se administren antisecretores hasta confirmar la erradicación de H. pylori.
Recomendación C13En los pacientes con una úlcera gástrica, tras haber finalizado el tratamiento erradicador de H. pylori se recomienda mantener el tratamiento antisecretor durante 4-8 semanas, al menos en las úlceras mayores de 1cm. Acuerdo 100%; votos: totalmente de acuerdo (94%); algo de acuerdo (6%). GR: fuerte. CE: moderada.
Existen 2 revisiones de la literatura médica publicadas que proporcionan argumentos a favor de no prolongar el tratamiento antisecretor en los pacientes con úlcera gástrica. La primera de ellas concluye que «la erradicación de H. pylori induce una mayor cicatrización de las lesiones ulcerosas independientemente de que estas sean duodenales o gástricas»299. La otra revisión sistemática llega a la conclusión de que «la erradicación de H. pylori cicatriza tanto la úlcera duodenal como la gástrica, con un porcentaje de curación similar»300.
Uno de los escasos estudios que aportan información relevante sobre este tema es el llevado a cabo por Higuchi et al.301, en el que se evaluó la cicatrización de la úlcera gástrica en función del tamaño de la misma, al administrar tratamiento con un IBP y 2 antibióticos durante una semana. De este modo, se pudo constatar cómo en las úlceras gástricas pequeñas (menores de 1cm) dicho tratamiento era suficiente para cicatrizar aproximadamente el 90% de las lesiones. Sin embargo, según se incrementaba el tamaño de la úlcera disminuía exponencialmente la tasa de cicatrización, de modo que esta era del 54% para las úlceras de entre 1 y 1,4cm, y de tan solo el 5% para aquellas iguales o mayores de 1,5cm. Otro estudio que proporciona información sobre la influencia del tamaño de la úlcera gástrica sobre la eficacia cicatrizadora del tratamiento erradicador es el realizado por Lai et al.302, en el que se constató la cicatrización del 100% de las úlceras gástricas menores de 1cm, si bien en este caso el tratamiento erradicador (incluyendo IBP) se administró durante 2 semanas en lugar de una. En cualquier caso, la tasa de cicatrización disminuyó también considerablemente cuando las úlceras fueron mayores de 1cm.
Más recientemente se ha publicado un estudio aleatorizado en el que se comparaba la administración de terapia erradicadora aislada frente a dicha terapia seguida de IBP durante 3 semanas10. La cicatrización de la úlcera gástrica fue inferior en los pacientes tratados solo con triple terapia, sin IBP posterior (64 vs. 82%). Así mismo, en los pacientes con úlcera gástrica no cicatrizada a las 4 semanas, un ciclo de 4 semanas adicionales de IBP (esomeprazol) incrementó el porcentaje de cicatrización hasta el 89-96%. Por tanto, los resultados de este estudio apoyan la administración de IBP tras la terapia erradicadora en los pacientes con úlcera gástrica. No obstante, el estudio posee algunas limitaciones relevantes: no estratifica los resultados de cicatrización por el tamaño de la úlcera (de hecho, no incluye úlceras mayores de 2cm), y el control endoscópico −realizado a las 4 semanas− es tal vez demasiado precoz para una úlcera gástrica (algunas de ellas en las que haya tenido éxito la terapia erradicadora posiblemente podrían llegar a cicatrizar en las semanas posteriores).
En resumen, la escasa evidencia disponible indica que, tras haber finalizado el tratamiento erradicador, se debe prolongar el tratamiento antisecretor (por ejemplo, entre 4 y 8 semanas más) en las úlceras gástricas, al menos en aquellas mayores de 1cm.
Recomendación C14En pacientes que requieren AINE o AAS se recomienda que la indicación de tratamiento gastroprotector se realice en función de la presencia de los factores de riesgo de complicación, independientemente de si se trata o no la infección por H. pylori. Acuerdo 100%; AINE: votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta. AAS: votos: totalmente de acuerdo (82%); bastante de acuerdo (18%). GR: fuerte. CE: moderada.
Múltiples estudios epidemiológicos muestran que la infección por H. pylori y los AINE son factores de riesgo independientes para la úlcera péptica y sus complicaciones151. Por tanto, los AINE aumentan el riesgo de úlcera y sus complicaciones con independencia de la presencia o ausencia de H. pylori151. Un metaanálisis publicado en 2005 evaluó el empleo de IBP frente al tratamiento erradicador para la prevención de la úlcera péptica en pacientes infectados por H. pylori y con ingesta de AINE63 e identificó 2 estudios (que incluían 385 pacientes). La incidencia de úlceras pépticas al final del seguimiento fue superior en el grupo que recibió terapia erradicadora (2,6%) que en los pacientes tratados con IBP (0%), y esta diferencia fue estadísticamente significativa (OR=7,34; IC 95%=1,27-43,6)63.
Los factores de riesgo para complicaciones gastrointestinales en pacientes tratados con AINE están bien definidos e incluyen: a) factores de muy alto riesgo como el antecedente de complicación ulcerosa previa y el tratamiento con anticoagulantes, y b) otros factores de riesgo como la enfermedad ulcerosa previa no complicada, el empleo concomitante de AINE y AAS, la prescripción de antiagregantes plaquetarios, corticoides o un segundo AINE, la edad y la enfermedad grave de base. En estos pacientes, el empleo de IBP ha demostrado reducir de manera significativa el riesgo de complicaciones ulcerosas secundarias a los AINE. Por otro lado, en los pacientes de muy alto riesgo se recomienda una estrategia de protección más intensiva, combinando un inhibidor selectivo de la COX-2 con un IBP, dado que en estos pacientes tanto el empleo de un AINE clásico más un IBP como el uso aislado de un inhibidor selectivo de la COX-2 confieren un grado de protección insuficiente303,304.
Recomendación C15En los pacientes con hemorragia digestiva por úlcera péptica la erradicación de H. pylori elimina la práctica totalidad de las recidivas hemorrágicas, por lo que una vez confirmada la desaparición del microorganismo, y en ausencia de toma de AINE/AAS, se recomienda no administrar tratamiento de mantenimiento con antisecretores. Acuerdo 100%; votos: totalmente de acuerdo (88%); bastante de acuerdo (12%). GR: fuerte. CE: alta.
La úlcera péptica es la primera causa de hemorragia digestiva alta y la infección por H. pylori es el factor etiológico principal en la enfermedad ulcerosa gastroduodenal305. La terapia antisecretora de mantenimiento a largo plazo ha sido el tratamiento estándar para prevenir la recidiva hemorrágica en los pacientes con un episodio previo de sangrado digestivo por úlcera péptica. Aunque es sobradamente conocido que la erradicación de H. pylori se asocia con una drástica disminución de las recidivas ulcerosas, hasta hace poco tiempo se desconocía la eficacia del tratamiento erradicador en la prevención de la recidiva hemorrágica por úlcera péptica. Recientemente se ha publicado un metaanálisis, siguiendo la metodología de la colaboración Cochrane, en el que se compara la eficacia del tratamiento erradicador de H. pylori frente al tratamiento antisecretor para la prevención de la recidiva hemorrágica por úlcera péptica11,306. En un primer subanálisis se incluyeron 7 estudios con un total de 578 pacientes: el porcentaje promedio de recidiva hemorrágica en el grupo de tratamiento erradicador fue del 2,9% y en el grupo de tratamiento no erradicador sin administrar posteriormente antisecretores de mantenimiento fue del 20% (OR=0,17; IC 95%=0,10-0,32) (fig. 7, panel superior). En un segundo subanálisis se incluyeron 3 estudios con un total de 470 pacientes: el porcentaje promedio de recidiva hemorrágica en el grupo que recibió tratamiento erradicador fue del 1,6% y en el grupo en el que se prescribió tratamiento no erradicador seguido de antisecretores de mantenimiento fue del 5,6% (OR=0,24; IC 95%=0,09-0,67) (fig. 7, panel inferior).
En la tabla 8 se recoge la incidencia de recidiva hemorrágica en diversos estudios que incluyen pacientes con éxito erradicador de H. pylori confirmado y que fueron seguidos sin administrar tratamiento antisecretor de mantenimiento307–326. Dado que la duración del seguimiento oscila notablemente entre los diversos estudios, se han incluido también en la tabla 8 los períodos de seguimiento de cada uno y se ha calculado la incidencia de recidiva hemorrágica anual respectiva (por paciente y año de seguimiento). Así, considerando todos los estudios, se ha llevado a cabo un seguimiento global de 1.913 pacientes-año. Se encontraron 13 recidivas hemorrágicas entre los pacientes con erradicación exitosa de la bacteria, a partir de lo cual se puede calcular una recurrencia anual del 0,88% (por paciente y año de seguimiento).
Incidencia de recidiva hemorrágica en pacientes con éxito erradicador de Helicobacter pylori y sin tratamiento antisecretor de mantenimiento
| Autor | N | Seguimiento medio (meses) | Resangrado (%) | Seguimiento (pacientes/año) | Resangrado anual (%) |
| Amendola et al.307 | 42 | 24 | 0 (0%) | 84 | 0 |
| Arkkila et al.308 | 176 | 12 | 2 (1,1%) | 176 | 1,1 |
| Capurso et al.309 | 83 | 36 | 3 (3,3) | 249 | 1,3 |
| Gisbert et al.310 | 111 | 12 | 0 (0%) | 111 | 0 |
| Graham et al.311 | 13 | 12 | 0 (0%) | 13 | 0 |
| Horvat et al.312 | 43 | 12 | 1 (2,3%) | 43 | 2,3 |
| Jaspersen et al.313 | 24 | 12 | 0 (0%) | 24 | 0 |
| Jaspersen et al.314 | 29 | 12 | 1 (3,4%) | 29 | 3,4 |
| Krizman et al.315 | 33 | 17 | 0 (0%) | 47 | 0 |
| Labenz et al.316 | 42 | 17 | 0 (0%) | 59 | 0 |
| Lai et al.317 | 41 | 53 | 2 (4,9%) | 177 | 3,4 |
| Liu et al.318 | 26 | 56 | 0 (0%) | 121 | 0 |
| Macri et al.319 | 21 | 48 | 0 (0%) | 84 | 0 |
| Pellicano et al.320 | 46 | 47 | 0 (0%) | 180 | 0 |
| Riemann et al.321 | 42 | 19 | 2 (4,8%) | 66 | 3 |
| Rokkas et al.322 | 13 | 12 | 0 (0%) | 13 | 0 |
| Santander et al.323 | 84 | 12 | 2 (2,4%) | 84 | 2,4 |
| Sung et al.324 | 108 | 12 | 0 (0%) | 108 | 0 |
| Vcev et al.325 | 36 | 12 | 0 (0%) | 36 | 0 |
| Vergara et al.326 | 93 | 27 | 0 (0%) | 209 | 0 |
| Total | 1.106 | 1.913 | 0,88 |
Estos favorables resultados han sido confirmados en un reciente estudio multicéntrico español, en el que se incluyeron prospectivamente 1.000 pacientes con hemorragia digestiva por úlcera gastroduodenal en los que se erradicó la infección por H. pylori y, posteriormente, no se prescribió tratamiento antisecretor12. Se describieron 3 episodios de recidiva hemorrágica al año de seguimiento (en 2 casos tras la ingesta de AINE y en uno tras la reinfección por H. pylori), y otros 2 episodios de resangrado a los 2 años (uno tras la ingesta de AINE y otro tras la reinfección por H. pylori). La incidencia acumulada de resangrado fue del 0,5% (IC 95%=0,16-1,16%) y la tasa de incidencia del 0,15% por paciente-año de seguimiento (IC 95%=0,05-0,36%).
De los resultados mencionados se deduce que el tratamiento de la infección por H. pylori es más efectivo que el tratamiento antisecretor (ya sea con o sin antisecretores de mantenimiento) para prevenir la recidiva hemorrágica por úlcera péptica. Consecuentemente, debe evaluarse la presencia de infección por H. pylori en todos los pacientes con hemorragia digestiva por úlcera péptica y prescribirse tratamiento erradicador a aquellos que estén infectados. Una vez confirmada la erradicación no es preciso administrar tratamiento de mantenimiento con antisecretores (si el paciente no requiere AINE), ya que la erradicación de H. pylori elimina la práctica totalidad de las recidivas hemorrágicas. No obstante, parece prudente que en una úlcera péptica que haya sufrido complicaciones (por ejemplo, hemorragia digestiva) se administren antisecretores hasta confirmar la erradicación de H. pylori.
FinanciaciónLa conferencia cuenta con el patrocinio científico del Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD). Este documento de consenso ha sido avalado por la Asociación Española de Gastroenterología y por la Sociedad Española de Patología Digestiva, las cuales se han adherido y dan soporte a las recomendaciones del consenso. Los aspectos logísticos de la reunión presencial fueron financiados por Laboratorios Almirall S.A., que no participó en la elaboración de las recomendaciones ni en su revisión, ni en ninguna reunión u otro aspecto científico del consenso.
Conflicto de interesesJavier P. Gisbert. Asesoramiento científico, soporte para investigación y actividades formativas: Almirall, Janssen-Cilag, Nycomed, AstraZeneca, Pfizer.
Xavier Calvet. Asesoramiento científico, soporte para investigación y actividades formativas: Almirall, Janssen-Cilag, AstraZeneca, Pfizer.
E. Dominguez-Muñoz. Asesoramiento científico: Aptalis Pharma.
A. Lanas. Asesoramiento científico, soporte para investigación y actividades formativas: AstraZeneca, Pfizer y Bayer.
F. Mearin. Asesoramiento científico, soporte para investigación y actividades formativas: Almirall, Janssen-Cilag, AstraZeneca.
El resto de autores no refiere conflicto de intereses.
Deseamos agradecer la inestimable colaboración de Ariadna Figuerola y Silvia Rodríguez en la recogida de datos y análisis de los resultados de las votaciones del consenso.