Las inmunodeficiencias primarias pueden presentar manifestaciones digestivas aún no bien definidas.
ObjetivoAnalizar la patología digestiva que se asocia a las inmunodeficiencias primarias.
Material y métodosEstudio retrospectivo que incluyó a los pacientes diagnosticados de deficiencias primarias de anticuerpos en un hospital de tercer nivel. Fueron divididos en 2 grupos: déficit aislado de IgA (Def-IgA) y síndrome de inmunodeficiencia común variable (SICV). Se analizaron el momento de presentación y tipo de sintomatología digestiva.
ResultadosSe recogieron 57 pacientes: 20 con SICV (35%) y 37 con Def-IgA (65%). El diagnóstico fue realizado en edad pediátrica en 17 casos, de los cuales 13 cursaban con Def-IgA. El diagnóstico de inmunodeficiencia fue previo a las manifestaciones digestivas en el 84% de los casos. La clínica digestiva se presentaba en un 74% de los pacientes, la diarrea fue el síntoma más frecuente. La patología se confirmó en el 46% de los casos principalmente mediante endoscopia. La enfermedad celiaca-like, gastritis crónica atrófica, colitis ulcerosa-like y enfermedad de Crohn fueron más comunes en el SICV. Mientras que en el Def-IgA predominaron la gastritis crónica con Helicobacter positivo. La edad media fue significativamente mayor (36 vs. 24 años, p=0,02) y el título de IgA menor (17 vs. 34UI/ml; p=0,008) en los pacientes que presentaban patología digestiva asociada.
ConclusionesLos síntomas digestivos son frecuentes y se llega al diagnóstico en la mitad de los pacientes con inmunodeficiencias primarias mediante estudio endoscópico. La colitis ulcerosa, Crohn y celiaca-like son entidades atípicas y propias del SICV.
Primary immunodeficiencies can lead to gastrointestinal manifestations that are still not well defined.
ObjectiveTo analyze gastrointestinal manifestations associated with primary immunodeficiencies.
Material and methodsWe performed a retrospective study that included patients diagnosed with primary antibody deficiencies in a third-level hospital. The patients were divided into two groups: isolated IgA deficiency and common variable immunodeficiency syndrome (CVIS). The timing of presentation and type of gastrointestinal symptoms were analyzed.
ResultsThere were 57 patients: 20 with CVIS (35%) and 37 with isolated IgA deficiency (65%). Diagnosis was made in the pediatric age in 17 patients, of whom 13 had isolated IgA deficiency. In 84% of the patients, diagnosis of immunodeficiency was made before the development of gastrointestinal manifestations. Digestive symptoms were found in 74% of the patients, the most frequent being diarrhea. In 46% of the patients, digestive disease was confirmed, mainly through endoscopy. Celiac-like lesions, chronic atrophic gastritis, ulcerative colitis-like disease and Crohn's disease were more common in CVIS. In isolated IgA deficiency, Helicobacter pylori-positive chronic gastritis predominated. Mean age was significantly higher (36 vs. 24 years, p=0.02) and IgA titer significantly lower (17 vs. 34UI/ml; p=0.008) in patients with associated gastrointestinal disease.
ConclusionsGastrointestinal symptoms are frequent and lead to endoscopic diagnosis in half of patients with primary immunodeficiencies. Ulcerative colitis, and celiac- and Crohn's-like disease are atypical entities that occur in CVIS.
Las inmunodeficiencias primarias por déficit de anticuerpos comprenden un grupo de trastornos bien diferenciados. El más común es el déficit selectivo de IgA, que afecta aproximadamente a 1/500 sujetos de raza caucásica y cursa con frecuencia de forma asintomática1. El síndrome de inmunodeficiencia común variable (SICV) presenta, además, una alteración más profunda en la función de los linfocitos B, que condiciona una disminución de todos los isotipos de inmunoglobulinas, especialmente IgG e IgA, y es el que mayor significado clínico tiene2. La aparición de fenómenos y enfermedades autoinmunes refleja la profunda disregulación del sistema inmune que presentan estos sujetos3. Esta inmunodeficiencia condiciona también la aparición de infecciones recurrentes. El aparato respiratorio constituye, quizás, el órgano más afectado, principalmente por las infecciones, y su afectación suele llevar al diagnóstico de la inmunodeficiencia3.
El tracto gastrointestinal constituye el mayor órgano inmunológico en el cuerpo humano. En el se encuentran el mayor número de linfocitos del organismo y se generan grandes cantidades de IgA. De una forma fisiológica se encuentra permanentemente activado por la continua exposición a los antígenos ingeridos. Por lo tanto, es frecuente que las alteraciones del sistema inmune se asocien con manifestaciones a nivel gastrointestinal. Aunque los gastroenterólogos no participan en el manejo inicial de estos pacientes, sí necesitan conocer las patologías digestivas asociadas a estas inmunodeficiencias4,5.
Aunque la clínica respiratoria suele acompañar a estos pacientes, el síntoma digestivo de debut más frecuente suele ser la diarrea asociada o no a un síndrome de malabsorción. Además, es conocido que en el SICV se observan patologías a nivel intestinal específicas de esta inmunodeficiencia como la enfermedad celiaca-like, colitis-like o Crohn-like6. Este tipo de trastornos presenta un comportamiento y precisan de un manejo distinto de los que se observan en sujetos sin inmunodeficiencia7. Por otra parte, no se conoce bien como es su presentación ni su evolución a largo plazo.
Hay pocos estudios que describan cual es el momento de la manifestación a nivel gastrointestinal así como su relación con el tipo de inmunodeficiencia y con la edad. El uso cada vez más común de las exploraciones endoscópicas y la toma de biopsias están incrementando el conocimiento sobre la patología digestiva que presentan estos pacientes.
El objetivo de este estudio fue analizar la patología digestiva que se asocia a las inmunodeficiencias primarias, que cursan con déficit de anticuerpos, y su relación con la edad, tipo de inmunodeficiencia y momento del diagnóstico.
Pacientes y métodosSe realizó un estudio retrospectivo en la sección de Inmunología y sección de Aparato Digestivo de un hospital de tercer nivel. Se incluyeron a los pacientes diagnosticados de trastornos inmunológicos primarios que cursan con predominio de déficit de anticuerpos desde 1995 hasta 2009.
El diagnóstico de déficit selectivo de IgA (Def-IgA) fue realizado cuando se encontraban niveles séricos de IgA menores de 7mg/dl (0,07g/l) con normalidad en IgG e IgM. La edad para el diagnóstico definitivo del déficit aislado de IgA se consideró a partir de los 6 años, para excluir un retraso madurativo. El diagnóstico de SICV se realizó en base a la disminución en los niveles séricos de IgG e IgA (al menos 2 desviaciones estándar por debajo de la media para su edad), junto con: presentación por encima de los 2 años, ausencia de isohemaglutininas o falta de respuesta a la vacunación. En todos los casos se habían excluido otras causas secundarias de hipogammaglobulinemia8. Se excluyeron pacientes con otras inmunodeficiencias primarias asociadas y con inmunodeficiencias secundarias.
Se definió el momento de la manifestación digestiva como anterior o posterior al diagnóstico de la inmunodeficiencia, y el tiempo transcurrido entre uno y otro. El síntoma digestivo principal se consideró aquel que se recogía en la historia y que llevaba a la realización de estudios complementarios. El diagnóstico final digestivo fue considerado aquel derivado de dichos estudios, principalmente endoscopia digestiva, y que se confirmaba con el estudio anatomopatológico de las biopsias tomadas. También se recogió la clínica respiratoria que presentaban en todos los casos.
Las variables cualitativas se describen en forma de número absoluto y porcentaje. Las variables cuantitativas se describen como media y desviación estándar (DE). El análisis de las posibles diferencias entre variables cualitativas fue realizado mediante el test de la chi-cuadrado. Para el análisis de las diferencias entre variables cuantitativas se empleó el test de la t de Student o el test no paramétrico de la U de Mann-Whitney, cuando se consideraba que la muestra se alejaba de la curva normal por el pequeño número de sujetos. Se consideró estadísticamente significativo un valor de p<0,05.
Las variables fueron analizadas mediante el programa estadístico SPSS versión 17.0 para Windows.
ResultadosSe incluyeron 57 pacientes diagnosticados de inmunodeficiencia primaria entre los años 1995 y 2009 (tabla 1). En 20 pacientes el diagnóstico fue de SICV (35,1%) y en los 37 restantes Def-IgA (64,9%). Predominaban los varones con un 59,6% de los casos. La edad media de toda la serie al diagnóstico era 30 años, con un rango de 1–88. En los niños la edad media fue de 5 años (DE=3,7; rango=1–13) y en los adultos 40,6 años (DE=18; rango=15–86). El diagnóstico fue realizado en edad pediátrica en 17 pacientes (30%), de los cuales 13 cursaban con Def-IgA.
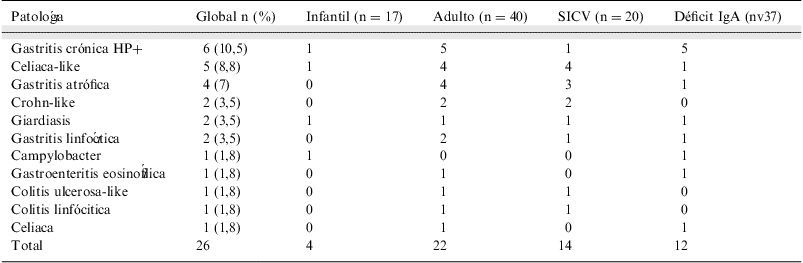
Patología digestiva diagnosticada en los subgrupos de inmunodeficiencias y según la edad de diagnóstico
| Patología | Global n (%) | Infantil (n=17) | Adulto (n=40) | SICV (n=20) | Déficit IgA (nv37) |
| Gastritis crónica HP+ | 6 (10,5) | 1 | 5 | 1 | 5 |
| Celiaca-like | 5 (8,8) | 1 | 4 | 4 | 1 |
| Gastritis atrófica | 4 (7) | 0 | 4 | 3 | 1 |
| Crohn-like | 2 (3,5) | 0 | 2 | 2 | 0 |
| Giardiasis | 2 (3,5) | 1 | 1 | 1 | 1 |
| Gastritis linfocítica | 2 (3,5) | 0 | 2 | 1 | 1 |
| Campylobacter | 1 (1,8) | 1 | 0 | 0 | 1 |
| Gastroenteritis eosinofílica | 1 (1,8) | 0 | 1 | 0 | 1 |
| Colitis ulcerosa-like | 1 (1,8) | 0 | 1 | 1 | 0 |
| Colitis linfócitica | 1 (1,8) | 0 | 1 | 1 | 0 |
| Celiaca | 1 (1,8) | 0 | 1 | 0 | 1 |
| Total | 26 | 4 | 22 | 14 | 12 |
Todos los pacientes presentaron patología respiratoria asociada, siendo la neumonía el evento más frecuente (49,1%), seguido por el catarro de vías altas (19,3%) y otitis (19,3%). De los 57 pacientes incluidos, 41 (71,9%) presentaron en algún momento sintomatología digestiva. El síntoma más frecuente fue la diarrea en el 73% de los pacientes sintomáticos, seguida de la dispepsia en el 10%.
De los 41 pacientes que presentaban sintomatología digestiva, se encontró patología en 26 de ellos (63%). En total, se realizaron 34 estudios de endoscopia digestiva: 21 gastroscopias, y 13 colonoscopias. Se realizó gastroscopia al 50% de los pacientes con SIVC y en el 11% de los pacientes con Def-IgA (p=0,1). El 50% de los pacientes con SIVC se sometieron a colonoscopia frente a un 3% de los pacientes con Def-IgA (p=0,001). En 7 casos, la enfermedad digestiva precedió al diagnóstico de la inmunodeficiencia, 2 casos presentaron ambas enfermedades de forma simultánea y los 17 restantes fueron diagnosticados en primer lugar de la inmunodeficiencia. El tiempo medio transcurrido desde el diagnóstico de la enfermedad inmunológica hasta el diagnóstico de la enfermedad digestiva era 240 meses (DE=55 meses).
La edad media de los pacientes con Def-IgA era significativamente menor que la del grupo de SICV (24 vs. 40 años; p=0,007). Los casos diagnosticados de patología digestiva asociada presentaban una edad media superior a los no diagnosticados de esta patología asociada (36 vs. 24 años; p=0,02). También se encontraban unos niveles menores de IgA en los casos con patología digestiva (17 vs. 34UI/ml; p=0,008), mientras que los niveles de IgG e IgM no presentaban diferencias entre ambos grupos. Se observó patología digestiva en el 70% de los pacientes con SICV frente al 32% del Def-IgA (p=0,01). Además, en el SICV la patología digestiva precedió al diagnóstico de la enfermedad inmune en el 30% de los casos frente al 8% de los casos en el grupo de Def-IgA (p=0,04).
En la tabla 1 se observan las diferentes patologías digestivas encontradas en función de la edad y del tipo de enfermedad inmune. Las enfermedades «like», excepto 1 caso de celiaca-like diagnosticado en un niño con Def-IgA, son prácticamente exclusivas de presentación en el SICV y en la edad adulta. También se aprecia como la gastritis atrófica es más frecuente en el SICV mientras que la gastritis relacionada con Helycobacter pylori ocurre más en el Def-IgA. El resto de patologías presenta una distribución variable entre los 2 grupos de inmunodeficiencias y, dado el pequeño número de casos, no es posible hacer comparaciones.
DiscusiónLas inmunodeficiencias primarias que cursan con déficit de anticuerpos se caracterizan por presentar infecciones recurrentes que afectan de forma principal al tracto respiratorio2. También es conocida la afectación del tracto gastrointestinal en estos pacientes, sobre todo en el SICV6,7,9. Las manifestaciones digestivas se pueden presentar en más de la mitad de los pacientes a lo largo del desarrollo de la enfermedad o previo al diagnóstico de la inmunodeficiencia.
Dado que no son patologías frecuentes, la mayoría de las series son de carácter retrospectivo como la que aquí se presenta. En el presente trabajo se ha intentado comparar las manifestaciones digestivas según el tipo de inmunodeficiencia de anticuerpos: global en el caso del SICV y parcial en el Def-IgA. Los resultados deben tomarse con las limitaciones de todo estudio retrospectivo, aunque la serie aquí analizada corresponde a un único centro y los pacientes son seguidos en una Unidad de Inmunología especializada. Otro hecho a tener en cuenta es el posible sesgo de selección en los pacientes con Def-IgA incluidos dado que son aquellos que tenían sintomatología y eran remitidos a estudio en Inmunología.
Como cabe suponer, existen diferencias en la forma de presentación de estos dos grupos de inmunodeficiencias. Así, el SICV predomina en adultos y el Def-IgA es más frecuente en la edad pediátrica. Nuestros resultados muestran una elevada presencia de síntomas digestivos que llevan al diagnóstico de patología digestiva en casi la mitad de ellos. Los pacientes eran sometidos a pruebas diagnósticas cuando presentaban sintomatología, pero no en todos lo casos se realizaban pruebas y tampoco había un protocolo de actuación. Por ejemplo, en los casos de diarrea, siendo el síntoma más frecuente, no se realizaba de forma rutinaria la toma de biopsia duodenal para evaluar la presencia de Giardia lamblia o atrofia vellositaria, que son causas conocidas de este síntoma en este tipo de pacientes10 El hecho de no observar lesiones duodenales durante la realización de la endoscopia, no descarta la presencia de patología cuando se toman biopsias9.
En el SICV se observó patología digestiva en un porcentaje muy elevado de casos (70%), superior al observado en el déficit de IgA-G (32%). En el SICV existe una inmunodepresión mayor que afecta tanto a células B como T, lo cual explicaría esta mayor asociación con patología digestiva9. Además, la edad y el título de IgA también están relacionados con la presencia asociada de patología digestiva.
En nuestra serie la patología digestiva se observó antes que la inmunológica en un 30% del grupo de SICV. El hecho de que el primer contacto de estos pacientes sea con el gastroenterólogo en un elevado porcentaje de casos, obliga a éste a pensar en un problema inmunológico asociado cuando se ven algunas de estas patologías digestivas. La patología respiratoria asociada en la práctica totalidad de estos sujetos debería aumentar el índice de sospecha de un trastorno inmunológico subyacente, cuando también se presenta clínica digestiva10. La enfermedad digestiva a diferencia de la respiratoria, se suele presentar a lo largo de la evolución del trastorno inmunológico. En este estudio la media de evolución de la enfermedad inmune fue de 20 años hasta que presentaron una enfermedad digestiva asociada. Al ser un estudio retrospectivo, no tenemos datos para saber si durante la evolución clínica presentaron de forma intermitente síntomas digestivos, que no fueron consultados o estudiados.
Los pacientes con inmunodeficiencias primarias tienen más riesgo de desarrollar tumores, sobre todo linfoma no hodgkiniano y cáncer gástrico11–14. En nuestra serie no se detectó ningún caso de cáncer gástrico, probablemente porque es una serie pequeña y con una edad media baja. Es conocido que la infección por H. pylori se asocia con un mayor riesgo de cáncer14. En este estudio un 10,5% de los pacientes presentó gastritis crónica con Hp +, mientras que otras series encuentran gastritis asociada a H. pylori hasta en un 41% de los casos de SICV14. De nuevo, al no hacer una toma de biopsia sistemática en antro-cuerpo gástrico, buscando esta bacteria, puede ser la causa de la baja prevalencia que encontramos, sobre todo en el SICV donde solo había una gastritis por H. pylori diagnosticada y ésta era mucho más frecuente en el Def-IgA. Sin embargo, sí se observó gastritis atrófica en 3 casos de SICV, la cual puede ser precursora de cáncer gástrico y obliga a establecer una vigilancia a estos sujetos. Es conocida la presencia de aclorhidria asociada a un síndrome de anemia perniciosa-like en los pacientes con SICV. Este síndrome fue descrito en 1969 y engloba la aclorhidria con gastritis atrófica, ausencia de factor intrínseco y malabsorción de vitamina B-12. Se distingue de la anemia perniciosa clásica por su presentación precoz, ausencia de anticuerpos antifactor intrínseco o anticélulas parietales y no presentar infiltrado de células plasmáticas en la lámina propia7. En nuestra serie no se realizó estudio de secreción ácida gástrica ni evaluación de anticuerpos anticélulas parietales o antifactor intrínseco, por lo cual desconocemos si pueden pertenecer a este síndrome.
El intestino delgado se encuentra afectado en aproximadamente la mitad de los pacientes con SICV provocando diarrea y síndrome de malabsorción. En la mayoría de estos casos se observa una atrofia de las vellosidades similar a la de la enfermedad celiaca. Sin embargo, se diferencia de la celiaca clásica en la típica ausencia de células plasmáticas en la biopsia con la consiguiente ausencia de anticuerpos y en la falta de respuesta a la retirada del gluten en la mitad de los casos15. Los mecanismos patogénicos de esta atrofia vellositaria parecen ser diferentes a los que se conocen en la celiaca clásica, aunque no están bien definidos. Nuestros resultados muestran la presencia de esta entidad en 4 adultos con SICV y en 1 niño con Def-IgA.
La presencia de G. lamblia en intestino delgado puede detectarse hasta en un 30% de los pacientes con SICV y también en casos de déficit aislado de IgA-G7. En muchos de estos casos está relacionada con la presencia de diarrea. Este parásito se muestra resistente a los tratamientos habituales sobre todo en el SICV, probablemente debido al déficit inmune asociado. Nosotros hemos observado esta infección en ambos grupos de inmunodeficiencia, aunque en un porcentaje bajo, probablemente, porque no se realizó una búsqueda dirigida de esta infección.
La enfermedad inflamatoria intestinal suele presentarse con elevada frecuencia en el SICV, probablemente mediada por las alteraciones en los linfocitos T. También la colitis ulcerosa y la enfermedad de Crohn que se observan en el SICV tienen características distintas que las definen como «like». Principalmente son la ausencia de células plasmáticas y granulomas lo que las diferencia9. Estas entidades se describen solamente en el SICV y no en el déficit aislado de IgA-G como nosotros también hemos observado. Los corticoides e inmunosupresores se utilizan para controlar estos trastornos inflamatorios, aunque su eficacia y tolerabilidad no están bien documentadas7.
En resumen, la patología digestiva se presenta con frecuencia en las inmunodeficiencias primarias por déficit de anticuerpos, principalmente en el SICV. Las enfermedades digestivas «like» son comunes en estos pacientes y deberían obligar a la toma sistemática de biopsias para su confirmación y el conocimiento de las mismas por parte del inmunólogo y el gastroenterólogo. Sería interesante establecer protocolos diagnósticos en estos enfermos para su manejo interdisciplinar y contribuir al conocimiento que tenemos sobre estas patologías.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.