Clostridium difficile es la causa más frecuente de diarrea nosocomial y da lugar a una morbimortalidad significativa en los pacientes hospitalizados. La inflamación se produce por la respuesta no específica a las toxinas de la bacteria. En los últimos años se ha descrito una cepa hipervirulenta, NAP1/BI/027. Los síntomas habituales que produce son diarrea y dolor abdominal. El diagnóstico se debe sospechar en los pacientes con diarrea durante un tratamiento antibiótico o tras 6–8 semanas después de éste. El diagnóstico se confirma mediante la detección de toxina en las heces y la colonoscopia en situaciones especiales. El tratamiento de elección es metronidazol o vancomicina. En algunos pacientes que no responden o que tienen complicaciones, está indicada la colectomía subtotal. Las recidivas son frecuentes y hay que diferenciarlas de las reinfecciones. La prevención requiere una atención especial.
Clostridium difficile is the most frequent cause of nosocomial diarrhea and is a significant cause of morbidity among hospitalized patients. The inflammation is produced as a result of a non-specific response to toxins. In the last few years, a hypervirulent strain, NAP1/BI/027, has been reported. Symptoms usually consist of abdominal pain and diarrhea. The diagnosis should be suspected in any patient who develops diarrhea during antibiotic therapy or 6–8 weeks after treatment. Diagnosis should be confirmed by the detection of CD toxin in stool and by colonoscopy in special situations. The treatment of choice is metronidazole or vancomycin. In some patients who do not respond to this therapy or who have complications, subtotal colectomy may be required. Relapse is frequent and must be distinguished from reinfection. Prevention and control in healthcare settings requires careful attention.
Clostridium difficile (CD) es uno de los patógenos entéricos más comunes en los pacientes hospitalizados. La infección por CD es la causa más habitual de la diarrea nosocomial en adultos. En 1983, Finney1 describió el primer caso de colitis seudomembranosa (CSM) como Diphteritic colitis en una paciente resecada de un cáncer del antro gástrico. En 1935, Hall y O’Toole2 identificaron la bacteria en la flora intestinal de las heces de recién nacidos sanos. En 1974, Todesco et al3 la relacionaron con el consumo de antibióticos. En este ensayo prospectivo llevado a cabo en 200 pacientes tratados con clindamicina, los autores observaron la aparición de diarrea en el 21% de los casos y de CSM por endoscopia en el 10%. Rifkin et al4, en 1977, demostraron la presencia de una citotoxina que era neutralizada por el antisuero de Clostridium sordelli. George et al5 detectaron la toxina de CD en los pacientes con CSM asociada a la toma de antibióticos y su ausencia en los sujetos controles.
Durante las décadas de los ochenta y los noventa, la incidencia de diarrea asociada a CD (DACD) aumentó en los países desarrollados por la utilización de las cefalosporinas de segunda y de tercera generación. Actualmente se ha producido un incremento considerable del número de casos y de su gravedad en ciertas zonas geográficas, como Canadá, Estados Unidos y oeste de Europa, atribuible al uso masivo y la duración de la terapia con antibióticos de amplio espectro, así como a la aparición de una cepa hipervirulenta (NAP1/BI/027) de CD.
EpidemiologíaLa diarrea nosocomial se inicia al tercer día de hospitalización de un paciente, que por lo general tiene una enfermedad grave de base y en la que se aísla CD o no se identifica ningún patógeno. El término DACD se emplea para describir las manifestaciones sintomáticas asociadas a CD. El uso indiscriminado de antibióticos se relaciona con un aumento de resistencias y constituye el factor de riesgo más importante para el desarrollo de DACD. Su incidencia en los diferentes hospitales varía entre 35 y 156 casos por 105 pacientes/año6. CD se encuentra en el 3% de las heces de sujetos sanos7. Un 10–30% de los pacientes que ingresan en un hospital general con cultivo negativo para el CD se infecta durante el ingreso8.
Se desconoce la situación real de CD en España, aunque se han comunicado algunos brotes epidémicos nosocomiales de DACD en servicios de medicina interna, nefrología y cirugía vascular9,10. La media de casos anuales podría estar entre 6 y 8 pacientes por cada 1.000 ingresos hospitalarios.
CD es un microorganismo esporulado, capaz de persistir en el medio ambiente durante mucho tiempo, transmisible, que en los pacientes internados y tratados con antibióticos causa brotes epidémicos de diarrea nosocomial. También suele afectar a personas fuera de los centros hospitalarios que viven en otras instituciones dedicadas al cuidado de niños, ancianos o pacientes crónicos. CD forma parte de la flora intestinal de recién nacidos y adultos sanos, así como de la de diferentes animales (caballos, perros, gatos y aves acuáticas)11. En los hospitales se transmite de un paciente a otro por vía fecal-oral. El material y los instrumentos sanitarios, el mobiliario del hospital y los uniformes y el calzado del personal sanitario constituyen los elementos principales de la diseminación de este microorganismo tan difícil de erradicar.
Los principales factores de riesgo asociados a la diarrea por CD son la exposición a antibióticos, la hospitalización y la predisposición del huésped (tabla 1). Los antibióticos se relacionan con el desarrollo de enfermedad por CD en el 96% de los casos. En general, los antimicrobianos que con más frecuencia causan DACD son los que menos se absorben por vía oral o tienen mayor excreción hepatobiliar, lo que permite la alteración de la flora del colon y la pérdida de la resistencia a la colonización. Se ignora el mecanismo de la DACD en sujetos sin tratamiento antibiótico previo o en los que toman antibióticos activos frente a CD. Todos los agentes antimicrobianos pueden conducir a la DACD, incluso la vancomicina y el metronidazol utilizados en el tratamiento de esta infección. Los antibióticos que con más frecuencia la producen son: ampicilina (10% de los casos), amoxicilina (15%), cefalosporinas de segunda y de tercera generación (20%) y clindamicina (25%). Los menos habituales son: aminoglucósidos, sulfamidas, macrólidos, tetraciclinas, penicilinas y quinolonas. La aparición de resistencias a las fluoroquinolonas durante los últimos años hizo que surgiesen numerosos casos de diarrea grave, a veces mortal, en hospitales de Canadá, Estados Unidos, Reino Unido, Bélgica y Francia12, originados por la cepa NAP1/BI/027 de CD, ya identificada desde 198413. En un estudio prospectivo llevado a cabo en 12 hospitales de Québec, el riesgo relativo (RR) de presentar diarrea por NAP1/BI/027 en los pacientes que recibieron fluoroquinolonas fue de 3,9 (intervalo de confianza [IC] del 95%, 2,3–6,6) y de 3,8 (IC del 95%, 2,2–6,6) en los que recibieron cefalosporinas, respecto a los sujetos controles14. La administración de agentes antineoplásicos también ha sido implicada en la diarrea por CD según diferentes estudios15. No hay acuerdo sobre si los inhibidores de la bomba de protones (IBP) y los antiinflamatorios no esteroideos (AINE) aumentan la susceptibilidad a la infección por CD16.
Factores de riesgo de la diarrea asociada a Clostridium difficile
| Fármacos |
| Tratamiento antibiótico (ampicilina, amoxicilina, cefalosporinas de segunda y de tercera generación, clindamicina, aminoglucósidos, sulfamidas, macrólidos o tetraciclina) |
| Administración de agentes antineoplásicos (metotrexato, doxorubicina, fluoracilo, ciclofosfamida, cisplatino, clorambucil) |
| Otros fármacos (inhibidores de la bomba de protones, antiinflamatorios no esteroideos) |
| Hospitalización |
| Pacientes encamados, hospitalización prolongada, unidades de cuidados intensivos |
| Procedimientos endoscópicos y quirúrgicos |
| Instrumentos sanitarios (sondas nasogástricas, termómetros, material de enfermería) |
| Huésped |
| Edad avanzada (>64 años), enfermedades graves asociadas |
| Disminución de anticuerpos antitoxina CD |
| Inmunodepresión (pacientes con infección avanzada por el virus de la inmunodeficiencia humana, trasplantados de órganos sólidos) |
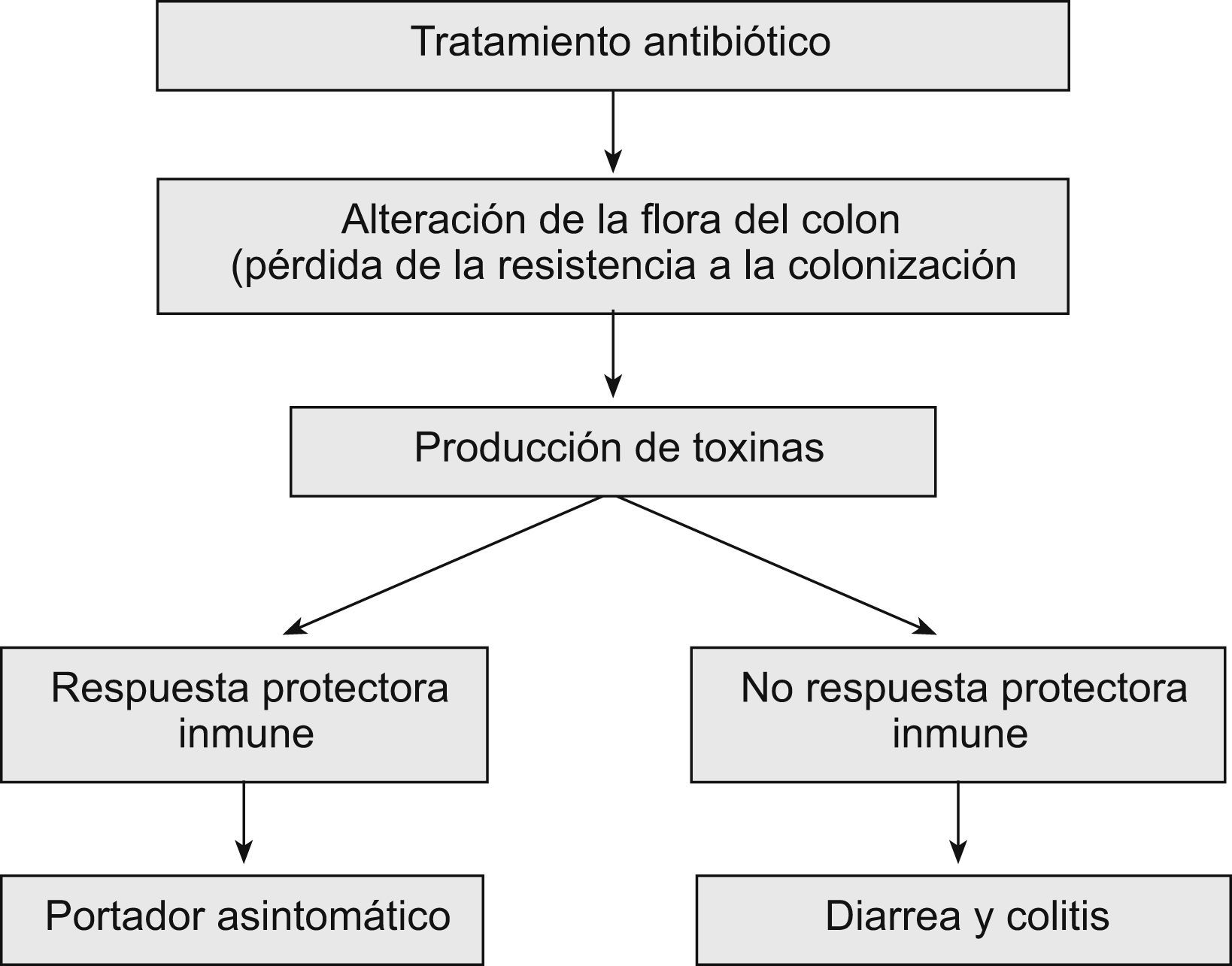
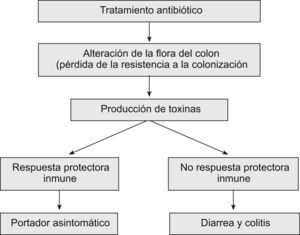
En la patogenia de la colitis asociada a CD se distinguen varias etapas: ingestión de este microorganismo o de sus esporas, alteración de la flora bacteriana habitual del colon, liberación de toxinas producidas por CD y respuesta inmune del huésped (fig. 1). Las esporas no producen toxinas ni se destruyen por los agentes antimicrobianos pero al llegar al intestino se convierten en formas vegetativas que elaboran toxinas y son sensibles a los antibióticos. Algunas cepas de CD no las producen, aunque la mayoría liberan dos toxinas diferentes: A (enterotoxina) y B (citotoxina). La cepa NAP1/BI/027 produce 15–20 veces más cantidad de toxinas que las cepas comunes. Además, esta cepa libera una tercera toxina, llamada binaria, que es similar a la toxina de Clostridium perfringens17,18, lo que incrementa notablemente su virulencia. También se han aislado en diversas áreas geográficas cepas que corresponden al patrón toxina A negativa/toxina B positiva19,20.
Las cepas no toxigénicas (el 25% de los casos) no causan colitis y carecen de los genes para las toxinas A y B. El microorganismo por sí mismo no da lugar a colitis, sino sus toxinas. Los genes para la toxina A (tcdA) y B (tcdB) se encuentran en el cromosoma de CD separados por 1,2kb. Las toxinas A (proteína de 308kD) y B (proteína de 270–279kD) se adhieren a los receptores glucoproteínicos de la membrana del enterocito, penetran en él y dan lugar a necrosis.
En los animales de experimentación, la toxina A induce una diarrea aguda con infiltración significativa de neutrófilos y monocitos de la mucosa intestinal. Los mediadores responsables de la respuesta inflamatoria aguda son: prostaglandinas, leucotrienios, factor activador de las plaquetas, interleucina 8 e histamina. En estos ensayos la toxina B no muestra actividad, por lo que se cree que la toxina A es la responsable de la expresión clínica de la enfermedad. Sin embargo, en células intestinales humanas se ha comprobado que la toxina B es 10 veces más potente que la A para provocar cambios morfológicos y de permeabilidad21. Por este motivo, se admite que tanto la toxina A como la B intervienen en la colitis asociada a CD en el hombre, como sucede en los casos de diarrea nosocomial en los que se aíslan cepas de CD con patrón toxina A negativa/toxina B positiva.
La resistencia a las fluoroquinolonas durante la última década favoreció la virulencia de una cepa de CD. Ésta se caracterizó por técnicas moleculares como toxinotipo III Norteamérica PFGE tipo 1 (NAP-1), análisis de restricción enzimática tipo BI y PCR-ribotipo 027 (NAP1/BI/027) y se relacionó con brotes graves de la enfermedad22. El mecanismo posible de la producción en exceso de toxinas por NAP1/BI/027 sería una deleción parcial en el gen tcdD, que codifica un regulador putativo de la expresión de las toxinas A y B17.
Manifestaciones clínicasEl espectro de las manifestaciones clínicas es muy amplio23: desde el estado de portador asintomático, diarrea sin colitis y colitis sin seudomembranas, hasta CSM y su forma más grave de colitis fulminante.
Estado de portadorLa colonización asintomática por CD se ha descrito en el 15–70% de los neonatos sanos de edad inferior a un año y en menos del 5% de los adultos sanos. La duración del tiempo de hospitalización se relaciona con la colonización. Ésta se lleva a cabo durante la primera semana en el 20% de los casos, y después de la cuarta en el 50%. Solamente el 30% de los pacientes que han sido colonizados de nuevo desarrollan DACD8. El estado de portador asintomático se debe a la presencia de anticuerpos séricos IgG contra la toxina A de CD, que protege de la diarrea y de la colitis. Los portadores son un reservorio importante para la transmisión nosocomial de CD y, por ello, se precisan medidas de aislamiento e higiénicas para evitar su propagación.
Diarrea sin colitisLa diarrea asociada a antibióticos sin colitis se produce en el 25% de las personas que toman agentes antimicrobianos. De este grupo, el 15–25% se debe a CD. Los pacientes infectados por cepas toxigénicas de CD presentan diarrea leve o moderada que se resuelve, en la mayoría de los casos, al suprimir la administración de los antibióticos. Este cuadro se caracteriza por la ausencia de síntomas asociados, salvo dolor abdominal en alguna ocasión, y de signos en la exploración física. La colonoscopia es normal.
Colitis sin seudomembranasEsta forma grave de diarrea cursa con 5–15 deposiciones diarias, dolor, distensión abdominal, fiebre, náuseas, vómitos, malestar y deshidratación. En las heces se pueden observar sangre y leucocitos. En la colonoscopia se visualiza una mucosa eritematosa, de manera difusa o parcheada, inespecífica y sin membranas. En algunos pacientes se han descrito ciertas complicaciones, como reacción leucemoide, megacolon tóxico y perforación colónica.
Colitis seudomembranosaLa CSM se presenta en el 41% de los casos de DACD. Las manifestaciones clínicas son semejantes a las de la colitis sin seudomembranas. La colonoscopia permite poner de manifiesto numerosas placas amarillentas, adherentes, de tamaño variable (2–10mm), que a veces se unen y cubren áreas extensas de la mucosa colónica. Estas seudomembranas se localizan en un 30% de los pacientes, exclusivamente, en el colon proximal.
Colitis fulminanteEs la forma de presentación de mayor gravedad y se produce en el 3–8% de los pacientes con infección por CD24. No hay consenso sobre los parámetros predictores para valorar la gravedad de la DACD (tabla 2). La diarrea suele ser un síntoma predominante pero su ausencia (en el 20% de los casos de este subgrupo) sugiere la presencia de megacolon tóxico24. Éste se acompaña de síntomas sistémicos y, a veces, de distensión de las asas del intestino delgado. La mortalidad en estos casos varía entre el 30 y el 90%, en la mayoría de los pacientes por shock séptico y fallo multiorgánico. Los pacientes mayores con tumores malignos, fallo renal o inmunodeprimidos son los más propensos a desarrollar colitis fulminante.
Criterios de gravedad de la diarrea asociada a Clostridium difficile según diferentes autores
| Uno de los siguientes (modificado de Pepin25): |
| Insuficiencia renal |
| Leucocitos superior a 20.000/mm3 |
| Presencia de seudomembranas en la colonoscopia |
| Ingreso en unidades de cuidados intensivos por deterioro general |
| Al menos dos de los siguientes (modificado de Zar26): |
| Edad superior a 60 años. |
| Temperatura mayor de 38,3°C |
| Albúmina sérica inferior a 2,5mg/dl |
| Leucocitosis superior a 15.000/mm3 |
Se considera evolución fulminante cuando la enfermedad grave no responde a tratamiento médico en 48h.
Se han comunicado, además de la DACD, otras manifestaciones infecciosas asociadas a CD, como septicemia, osteomielitis, abscesos, pleuritis, enteritis con o sin perforación, peritonitis, apendicitis, celulitis, infecciones de tejidos blandos y del tracto urinario, y artritis reactiva27. También puede agravar la evolución de pacientes con enfermedad inflamatoria intestinal y con enfermedades graves de base asociadas con alteraciones del tracto digestivo.
DiagnósticoEl diagnóstico de la DACD se debe sospechar en pacientes ingresados que comiencen durante su hospitalización con diarrea, sobre todo si hay factores de riesgo (tabla 1). Para establecer el diagnóstico, la mayoría de los autores acepta al menos uno de los criterios siguientes: demostración de toxinas de CD o hallazgos compatibles con CSM en la endoscopia junto con una biopsia compatible. Para el diagnóstico de sospecha puede ayudar la presencia de leucocitosis, hipoalbuminemia y leucocitos fecales.
Los hallazgos radiológicos son inespecíficos y se pueden observar en la mitad de las formas graves o fulminantes de DACD. En la radiografía simple de abdomen se puede mostrar una distorsión de las haustras y una distensión del colon. En ocasiones, en las radiografías de perfil se observan pequeñas irregularidades que representan seudomenbranas. Los estudios con contraste de bario pueden mostrar defectos de relleno redondeados que delinean las placas. Otro signo, llamado del «acordeón», aparece cuando el contraste de bario queda atrapado entre los pliegues intestinales. La tomografía computarizada (TC) puede mostrar alteraciones que sugieren la enfermedad en el 50% de los pacientes. Los signos más habituales son el engrosamiento de la pared colónica, que puede ser segmentaria o pancólica, y la distensión intestinal. En un 64% de los pacientes con DACD fulminante se pueden encontrar hallazgos radiológicos en la radiografía simple de abdomen y en el 78% en la TC28.
La colonoscopia es el método ideal para visualizar las lesiones típicas y para tomar biopsias. Debe ser completa, ya que en un tercio de los pacientes las lesiones afectan sólo al colon derecho. En el resto de los casos las lesiones se localizan en el recto y/o sigma. Las lesiones características son las seudomembranas que se observan en el 20–50% de los pacientes. Este porcentaje asciende al 87% si los brotes son graves o fulminantes28. Otras lesiones inespecíficas que se pueden observar en la DACD son eritema, erosiones o úlceras. La colonoscopia se debe realizar cuando hay alta sospecha de enfermedad y los tests diagnósticos en heces son negativos. No está indicada en la forma fulminante por el riesgo de perforación. Siempre se deben tomar biopsias para el estudio microbiológico. En la mucosa del colon se encuentra infiltración de polimorfonucleares, áreas de necrosis epitelial difusa cubierta por polimorfonucleares, fibrina o detritus celulares.
El diagnóstico de CD se hace mediante el aislamiento en cultivo y el crecimiento de la bacteria de las heces o de las biopsias. El aislamiento permite realizar estudios con interés epidemiológico y valorar la sensibilidad a diferentes antibióticos. En los cultivos pueden crecer cepas de CD productoras de toxinas y bacterias no toxigénicas. El cultivo consiste en aislar CD en un medio sólido (durante 24–36h) y posteriormente cultivarlo en un medio líquido enriquecido (3–5 días). Después, estos caldos se inoculan en monocapas de fibroblastos humanos. El CD productor de toxina se confirma mediante neutralización con antitoxina de CD. A pesar de ser una técnica sensible y específica, esta prueba presenta el inconveniente de que muchos laboratorios no realizan cultivos de tejidos y los resultados tardan varios días.
Hay otro método alternativo que reduce notablemente el tiempo, que consiste en la detección de toxina B de las colonias aisladas en el medio sólido, sin necesidad de hacer cultivo en medio líquido. El resultado de esta técnica tarda aproximadamente 48h. La sensibilidad y la especificidad se aproximan al 100%. Esta técnica es la preferida en algunos hospitales de nuestro país29,30.
Hasta ahora, el método escogido por la mayoría de los laboratorios es la determinación de la toxina A y/o B en las heces por enzimoinmunoanálisis (EIA). La sensibilidad oscila entre el 77 y el 95%, y varía considerablemente según el método y el material utilizado. Es una técnica barata y rápida (menos de 2h). Su precisión aumenta notablemente cuando se realiza en varias muestras23,29.
La reacción en cadena de la polimerasa (PCR) permite detectar el fragmento del gen que codifica la toxina A y/o B, y los resultados son prometedores. Esta prueba es más sensible que el EIA y se lleva a cabo en menos de 24h. Sin embargo, los reactivos son caros y se necesitan instrumentos e infraestructuras especiales31. Algunos autores consideran que es la técnica de elección en la actualidad.
En resumen, cualquiera de estas tres últimas técnicas (detección de citotoxina directa de colonias, EIA y PCR) podrían considerarse de elección para el diagnóstico de CD (tabla 3), aunque las dos primeras son las más coste-efectivas.
Estudio comparativo de las diferentes técnicas diagnósticas para la detección de Clostridium difficile
| Sensibilidad | Especificidad | VPP | VPN | |
| EIA | 73 | 98 | 73 | 98 |
| PCR en heces | 93 | 97 | 76 | 99 |
| Detección de citotoxina directamente de colonias | 100 | 96 | 68 | 100 |
| Cultivo de C. difficile y detección de toxina | 100 | 96 | 68 | 100 |
EIA: enzimoinmunoanálisis; PCR: reacción en cadena de la polimerasa; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Modificado de Peterson31.
En el paciente con sospecha de DACD se aconseja seguir medidas higiénicas de contacto para evitar su propagación. Es fundamental que el personal, sobre todo sanitario, se lave las manos con agua y jabón antes y después del contacto con el paciente, así como el uso adecuado de guantes. Se debe eliminar el desencadenante y retirar el antibiótico prescrito. La mayoría de los pacientes presentan una resolución espontánea de la diarrea al retirarlo. Si no es posible, se debe sustituir por otro que se asocie con menor riesgo de DACD. También se deben evitar los fármacos antiperistálticos tipo loperamida, corregir la hipoalbuminemia y realizar una correcta reposición hidroelectrolítica.
Los pacientes con síntomas o signos clínicos compatibles con DACD, test diagnóstico positivo y diarrea persistente a pesar de la suspensión del antibiótico deben tratarse con antibióticos. El tratamiento empírico también está indicado cuando hay una elevada sospecha diagnóstica, a pesar de que el test diagnóstico sea negativo. También se utilizan antibióticos en los pacientes con edad avanzada o enfermedades graves asociadas. No esta indicado el tratamiento en individuos asintomáticos con test diagnóstico positivo.
El tratamiento antibiótico de elección es el metronidazol 250mg cada 6h o 500mg cada 8h por vía oral durante 10–14 días. La vancomicina, 125mg cada 6h por vía oral durante 10–14 días, se usa cuando hay fracaso del metronidazol o en situaciones graves26. Las razones que justifican la utilización del metronidazol como primera elección son su menor precio (4,2 euros al realizar 14 días de tratamiento con metronidazol y 323,19 euros con vancomicina), una efectividad en los casos leves-moderados similar a la vancomicina y la disminución de resistencias del enterococo a la vancomicina. Entre las desventajas que desaconsejan su uso están los efectos secundarios (neuropatía periférica, náuseas, neutropenia, cefalea y sabor metálico) y la mayor probabilidad de recurrencias. Con ambos antibióticos, metronidazol y vancomicina, la diarrea y la fiebre desaparece en pocos días. Si no hay mejoría en 3–4 días, se puede pensar en una falta de respuesta al tratamiento seleccionado. La eficacia de curación de la DACD, definida como ausencia de clínica y tests diagnósticos negativos, es superior al 90% con metronidazol y vancomicina. En las embarazadas o en los niños menores de 10 años el tratamiento de primera elección es la vancomicina32. La vancomicina por vía oral no se absorbe en el intestino o en mínimas concentraciones. La teicoplamina (100mg cada 12h) es una alternativa al metronidazol y a la vancomicina. Otras opciones terapéuticas incluyen el ácido fusídico y la bacitracina.
Cuando el antibiótico no se puede administrar por vía oral, el tratamiento de elección es metronidazol por vía intravenosa, 500mg cada 8h. El metronidazol por esta vía se excreta a la luz intestinal y consigue altas concentraciones. La vancomicina intravenosa no se excreta, y por tanto, no tiene concentraciones dentro del colon, por lo que pierde su eficacia. En los casos graves (tabla 2) se recomienda trasladar el paciente a unidades de cuidados intensivos y asociar vancomicina 125 o 500mg cada 6h por vía oral. Por otro lado, algunos autores añaden vancomicina en enemas en los casos graves. El enema se prepara con 0,5–1g de vancomicina disuelto en 1–2l de suero salino isotónico administrado entre 2 y 3 veces al día. Se intenta retener el enema al menos durante 60min33.
Es importante conocer que un 50% de los pacientes tratados tienen muestras en heces positivas para toxina de CD y pueden permanecer hasta 6 semanas después de finalizar el tratamiento, por lo que no se recomienda realizar ninguna prueba tras finalizarlo34.
La cirugía está indicada cuando hay sepsis con afectación de otros órganos, perforación, megacolon tóxico o evolución fulminante. La técnica es la colectomía con preservación del recto y la ileostomía. En un segundo tiempo se realiza la anastomosis ileorrectal. La hemicolectomía se asocia a una mortalidad alta. En el estudio de Lamontagne et al28 se observa que en los pacientes con DACD grave que fueron intervenidos la mortalidad era menor que en los tratados sin cirugía (el 58% sin cirugía frente al 34% con cirugía). Estos autores aconsejan la cirugía en la DACD fulminante cuando no haya contraindicación por otras enfermedades asociadas. Este grupo recomienda la cirugía en pacientes mayores de 75 años, con leucocitosis superiores a 20.000/mm3 o lactato entre 2,2 y 4,9mmol/l. También se recomienda la cirugía cuando los pacientes necesitan fármacos vasoactivos para mantener estable hemodinámicamente al paciente.
Entre las complicaciones de la DACD están el shock séptico, el megacolon tóxico y la perforación intestinal. Entre los factores asociados a mal pronóstico están la edad, la leucocitosis y la insuficiencia renal25. Otros factores que se asocian a un pronóstico peor de la enfermedad son la hiponatremia y la presencia de vómitos35, la albúmina sérica menor de 3mg/dl, la presencia de gas intramural y/o ascitis por TC abdominal, la inmunodepresión, la disminución del título de anticuerpos séricos contra la toxina A y el aumento de la lactoferrina fecal. En los últimos años se ha descrito una nueva cepa de CD hipervirulenta, llamada NAP1/027, que se asocia a una mayor morbilidad y mortalidad. Así, en el estudio de Lamontagne et al28 referido a dos hospitales de Québec, se observó que la mortalidad de los pacientes con DACD que ingresaban en las unidades de cuidados intensivos era del 52,7% (87 muertes de 165 casos) en los 30 días siguientes a su ingreso en estas unidades. La mortalidad general del brote de DACD en estos dos hospitales de Québec entre 2003 y 2005 era del 16,7%. En otro estudio realizado en Canadá la mortalidad dentro de los 6 meses posteriores a la infección era del 34%36.
RecidivaHay que diferenciar la recidiva de la reinfección. La reinfección supone la erradicación de CD que se vuelve a adquirir por contagios nuevos a través de otros pacientes, personal sanitario o por las esporas que puede haber en la casa del paciente.
Se considera que hay recidiva o recurrencia de la DACD cuando reaparece la diarrea y el dolor abdominal entre una semana y 3 meses tras concluir la terapia antibiótica. La recidiva se produce cuando no se ha eliminado el CD o sus esporas y este agente vuelve a producir clínica. Cuando esto ocurre, no es necesario realizar pruebas diagnósticas. Se considera que éstas se producen porque el CD no es eliminado por el tratamiento antimicrobiano debido a la esporulación. Las esporas revierten a formas vegetativas que producen toxinas cuando se interrumpen los antibióticos dirigidos contra CD. En estos casos la flora fecal es inefectiva para controlar la multiplicación de CD. Las recidivas ocurren en el 15–25% de los casos tratados con antibióticos. El riesgo llega al 65% cuando ha habido al menos un episodio de recidiva. En los últimos años han aparecido varios estudios que apuntan que los pacientes con DACD tratados con metronidazol tienen más probabilidad de recidiva14; sin embargo, en otros estudios no se observan diferencias26. Otros factores de riesgo son el uso prolongado de antibióticos, las estancias hospitalarias largas, la edad superior a 65 años, la enfermedad diverticular del colon, la cirugía intestinal previa y las enfermedades asociadas graves. Los individuos con al menos un factor de riesgo tienen un 50–65% más de posibilidades de presentar una recidiva. Cuando hay más de una recidiva es obligado descartar otras afecciones, como la enfermedad inflamatoria intestinal, u otras, mediante la realización de una colonoscopia. La gravedad de la recidiva no guarda relación con los episodios previos.
El tratamiento de la recidiva es el metronidazol o la vancomicina por vía oral, con los que se obtienen buenos resultados en el 60–70% de los casos. El tratamiento no depende del antibiótico utilizado durante el primer episodio. Si hay más de una recidiva, se aconsejan diferentes alternativas, como las siguientes:
ProbióticosLos probióticos previenen las infecciones por CD37. En un metaanálisis reciente38 se observa que los probióticos previenen la diarrea asociada a antibióticos (odds ratio [OR]=0,43) y la DACD (OR=0,59). Entre las cepas que tienen efecto beneficioso están Saccharomyces boulardii y Lactobacillus rhamnosus GG. En otro estudio se constata que los pacientes que ingresan en un hospital y son tratados con antibióticos se benefician de la administración cada 12h de una bebida (97ml) que contiene Lactobacillus casei, Lactobacillus bulgaricus y Streptococcus thermophilus. El riesgo de DACD se redujo en un 17%. Había que tratar a 6 pacientes para prevenir un episodio de DACD39. Es importante destacar la existencia de una gran heterogenicidad en las cepas administradas, concentraciones de organismos e intervalos de administración en los diferentes estudios publicados. Los probióticos actúan restableciendo la microflora. Algunos autores recomiendan la administración de Lactobacillus casei o Lactobacillus acidophilus o Saccharmyces boulardii de forma continua durante al menos un mes tras realizar el tratamiento agudo del primer episodio. Hasta el momento no se han reportado efectos secundarios por mutaciones de las bacterias, bacteriemias o fungemias.
AntibióticosContinuar con vancomicina 125mg al día durante 6 meses y luego suspenderla40. Otra posibilidad es administrar 125mg de vancomicina cada 2 días. Algunos autores administran rifaximina durante 2 semanas, seguida de vancomicina41.
ResinasAdministrar resinas como la colestiramina (4g cada 8h) que neutralizan las toxinas. Las resinas no se deben administrar con la vancomicina, ya que se unen al antibiótico neutralizando su actividad. Por este motivo, en caso de administrar resinas y vancomicina, las resinas deben tomarse al menos 2 o 3h antes que la vancomicina. El tolevamer, otra resina que se une a las toxinas de CD, se encuentra en fase de estudio. En animales ha mostrado una mayor capacidad de neutralizar las toxinas de CD que la colestiramina42,43.
InmunoglobulinasAdministrar inmunoglobulinas por vía intravenosa en casos graves o con muchas recurrencias. Se administra 0,3 g/kg en un día o durante 5 días44,45. Los resultados en series de casos son buenos, pero faltan más estudios que avalen este tratamiento46. Otra variante es la administración de calostro bovino hiperinmune obtenido tras administrar en vacas una vacuna inactivada de CD. Este calostro se administró a 16 pacientes con recurrencia de la DACD y logró la curación en 15 de ellos47.
VacunaInmunización activa mediante una vacuna que contiene las toxinas de CD inactivadas. Su efecto es la producción de anticuerpos antitoxina. En un estudio en el que se inoculó la vacuna por vía intramuscular en 4 dosis administradas durante 8 semanas a 3 pacientes con DACD recidivante, se observó que éstos interrumpían el antibiótico y no presentaban recidiva en los 6 meses posteriores a la inoculación48. Esta vacuna debe ser validada por otros estudios.
BacterioterapiaEn los últimos años han aparecido estudios que ensayan la bacterioterapia en pacientes con enfermedad grave y recidivante por CD. Se basa en la hipótesis de que al restaurar la flora anormal del intestino de pacientes con DACD desaparece el CD. Con esta hipótesis se obtiene y administra flora intestinal de individuos sanos tras realizar diferentes procedimientos que evitan la transmisión de infecciones. La administración se realiza habitualmente con enemas o a través de una sonda nasogástrica, evitando las recidivas. En los estudios realizados no hubo efectos secundarios graves49.
PrebióticosLos prebióticos son ingredientes no digeribles que favorecen el crecimiento selectivo de bacterias intestinales. Los dos prebióticos más estudiados son los fructooligosacáridos, como la oligofructosa y la inulina. Están presentes en vegetales como el ajo, la cebolla, el puerro, el espárrago, la alcachofa, la raíz de achicoria, el tomate y el plátano, entre otros. La oligofructosa parece disminuir las recurrencias por CD50.
En la tabla 4 se exponen las medidas de prevención.
Medidas de prevención de la DACD
| La aplicación de medidas de contacto y el uso de guantes por parte del personal sanitario |
| La desinfección de las habitaciones donde han estado pacientes con DACD. Las soluciones con hipoclorito sódico (lejía o agua de Javel) son las más recomendables |
| La restricción de ciertos antibióticos, como clindamicina, quinolonas o cefalosporinas |
| La elaboración de protocolos para la utilización de antibióticos y una política racional en la utilización de estos fármacos |
| Realizar o contribuir a programas de vigilancia epidemiológica específica |
| Medidas de prevención de eficacia dudosa: |
| Tratar a los portadores asintomáticos de C. difficile |
| Vacunar con toxinas A y B inactivadas a las personas sanas |
| Evitar la toma de inhibidores de la bomba de protones, la alimentación enteral y el uso de antiinflamatorios no esteroideos |
DACD: diarrea asociada a Clostridium difficile.