El objetivo del presente trabajo es analizar la evidencia disponible sobre la eficacia de la estrategia de inducción mantenimiento con inhibidores de proteasa potenciados con ritonavir en pacientes adultos VIH respecto al tratamiento convencional.
MétodosSe realizó un meta-análisis de ensayos aleatorizados y controlados en pacientes VIH para comparar la eficacia de una estrategia de monoterapia con inhibidores de proteasa potenciados frente al tratamiento antirretroviral convencional. La búsqueda bibliográfica se realizó en PubMed, EMBASE (septiembre 1999–septiembre 2009) y en resúmenes de congresos de los últimos 5 años. Se calcularon los Odds Ratio del fracaso terapéutico y sus intervalos de confianza del 95%. Para combinar los resultados de los estudios individuales seleccionados, se empleó un modelo de efectos fijos basado en el método de Mantel-Haenszel o de efectos aleatorios, en función de que exista o no heterogeneidad en los resultados.
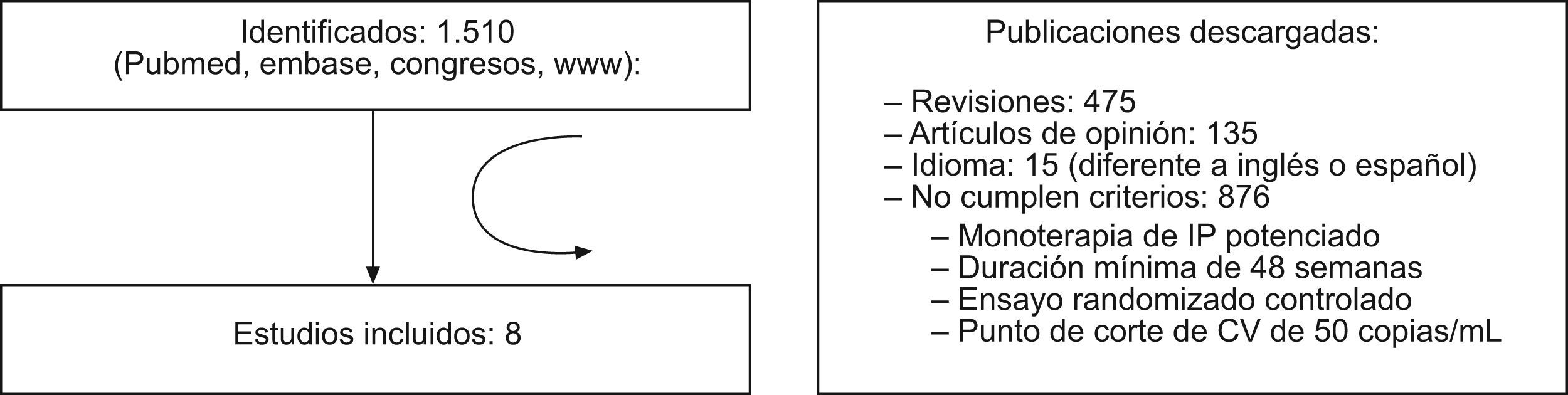
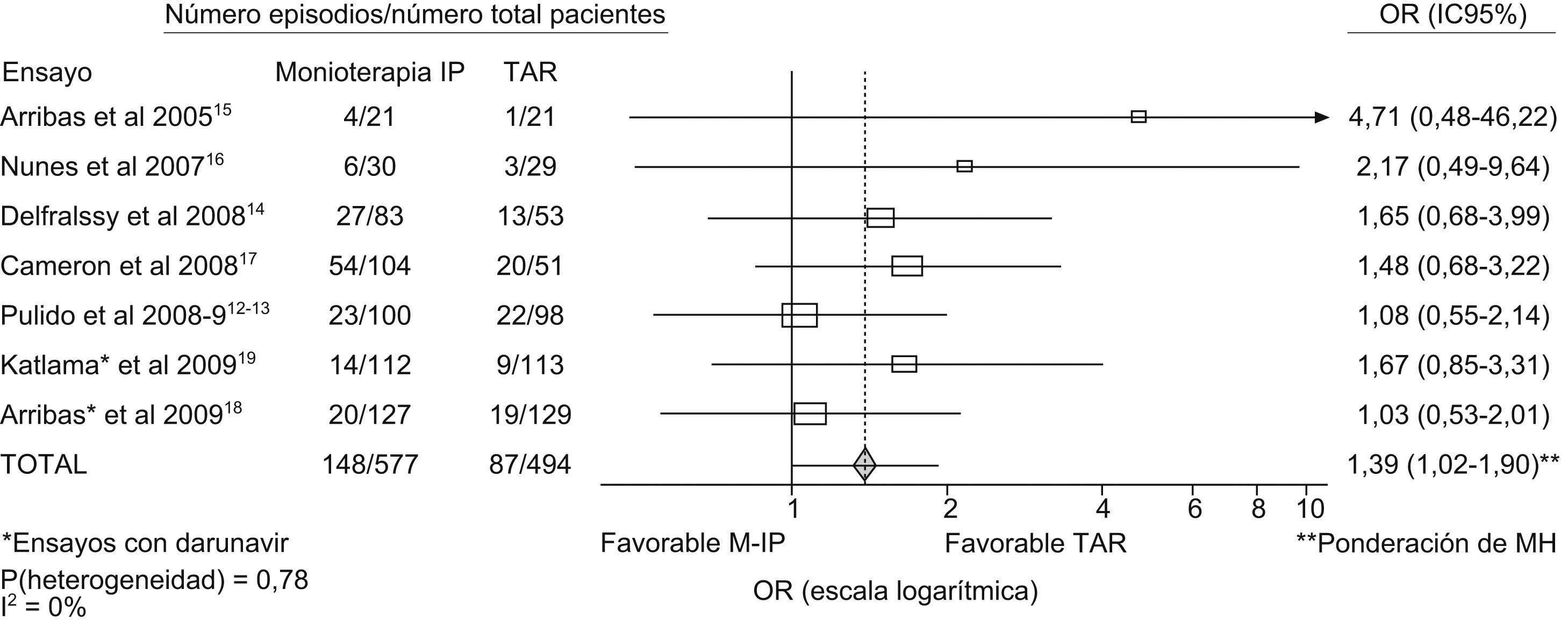
ResultadosSe localizaron inicialmente un total de 1.510 publicaciones, de las que solo 8 estudios cumplieron los criterios de inclusión en el meta-análisis. El Odds Ratio combinado de los 8 estudios es de 1,39 (IC 95% 1,02–1,90) a favor del grupo de tratamiento con tratamiento antirretroviral convencional, pero con un intervalo de confianza cercano a los límites de la no significación estadística.
ConclusiónLos resultados del análisis de eficacia combinado en el meta-análisis no encuentran diferencias significativas entre la estrategia convencional y la monoterapia. Esta estrategia se considera recomendable (nivel A de evidencia) en pacientes sin historia de fracaso previo a inhibidores de la proteasa, con carga viral plasmática indetectable y signos o síntomas de toxicidad por análogos de nucleósidos/nucleótidos.
The objective of this study is to analyse the available evidence regarding the effectiveness of the strategy of induction maintenance with boosted protease inhibitors with ritonavir in adult HIV patients as compared to conventional treatment.
MethodsWe performed a meta-analysis of randomised controlled trials in HIV patients to compare the efficacy of a monotherapy strategy of boosted protease inhibitors as compared with conventional antiretroviral therapy. The literature search was conducted in PubMed, EMBASE (September 1999–September 2009) and in conference abstracts of the last 5 years. The Odds Ratio of treatment failure and their 95% confidence intervals were calculated. To combine the results of individual studies selected, a fixed effects model based on the Mantel-Haenszel method or random effects was used, depending on whether or not the results were heterogeneous.
ResultsInitially a total of 1510 publications were found, of which just 8 studies met the criteria for inclusion in the meta-analysis. The combined Odds Ratio of the 8 studies is 1.39 (95% CI 1.02–1.90) for the treatment group with conventional antiretroviral treatment, but with a confidence interval close to the limits of statistical non-significance.
ConclusionThe results of the combined effectiveness analysis in the meta-analysis found no significant differences between the conventional strategy and monotherapy. This strategy is considered recommended (level A evidence) in patients with no history of previous failure of protease inhibitor, with undetectable plasma viral load and signs or symptoms of nucleoside/nucleotide toxicity.
Después de más de 20 años de estudios clínicos con fármacos antirretrovirales efectuados en todos los estadios evolutivos de la infección por el virus de la inmunodeficiencia humana (VIH), y utilizando los fármacos en monoterapia o en combinaciones de 2, 3 o más fármacos, está claramente establecido que el tratamiento antirretroviral (TAR) con combinaciones de al menos 3 fármacos es el tratamiento de elección de la infección por el VIH. Hay una sólida evidencia de que esta estrategia de tratamiento retrasa la progresión clínica, disminuye los ingresos hospitalarios y los costes asociados y aumenta de forma significativa la supervivencia1.
No obstante y al lado de estas indudables ventajas, el tratamiento antirretroviral de combinación indefinido plantea un escenario terapéutico rígido y no exento de problemas. En primer lugar, la adherencia al TAR representa un papel primordial en el grado y duración de la respuesta antiviral2. Por otro lado, la aparición de resistencias es un fenómeno inevitable cuando el virus VIH se expone a la presión selectiva de los fármacos que no consiguen suprimir la replicación viral3,4. Finalmente, la toxicidad de los fármacos antirretrovirales a medio y largo plazo es también un factor limitante que obliga a buscar nuevas opciones terapéuticas manteniendo la misma potencia antiviral5.
La realidad actual, por tanto, es que un porcentaje amplio de los pacientes que inician tratamiento antirretroviral se ven abocados a una situación de fracaso terapéutico (virológico, inmunológico o clínico) que obliga a un cambio de tratamiento rápido para evitar mutaciones y la elevación de la carga viral plasmática. El objetivo terapéutico es alcanzar, de nuevo, la máxima supresión viral instaurando una nueva combinación antiviral con dos o tres fármacos plenamente activos junto con otros fármacos ya empleados en el paciente pero que conserven actividad (estudios de resistencias) y sean bien tolerados. Este curso de evolución clínica ha hecho que, en la actualidad y a pesar de disponer de cerca de 25 fármacos antirretrovirales distintos, con también diferentes mecanismos de acción (a nivel del ciclo replicativo viral), se mantenga la imperiosa necesidad de seguir buscando nuevos fármacos que permitan el control duradero de la replicación viral.
Frente a esta forma de empleo convencional de los fármacos antirretrovirales se han intentado otras estrategias diferentes, más dinámicas y que pudieran permitir una mayor adaptación del TAR al estado inmunológico del paciente y consiguiendo ventajas añadidas en términos de toxicidad y adherencia al TAR.
Una de las estrategias que intentan emplear los fármacos antirretrovirales de una forma diferente es la denominada estrategia de inducción-mantenimiento, que puede definirse como la utilización de los medicamentos antirretrovirales en dos esquemas distintos aplicados de forma secuencial: a) fase de inducción, que coincide con el inicio del TAR, y tiene como objetivo alcanzar una respuesta virológica (carga viral plasmática indetectable), minimizando el riesgo de resistencias y favoreciendo una rápida reconstitución inmunitaria, y b) fase de mantenimiento, en la que, tras alcanzar el objetivo de la fase de inducción, se procede a modificar el TAR, y se simplifica mediante la reducción de este a dos o, preferiblemente, un único fármaco, pero con el objetivo de mantener la respuesta virológica, inmunológica y clínica.
En la historia del tratamiento antirretroviral, los primeros ensayos clínicos que estudiaron la posible eficacia de esta estrategia se tradujeron en fracasos notorios6–8 y pusieron de evidencia que no se puede llevar a cabo una estrategia de inducción-mantenimiento con fármacos de barrera genética baja (lamivudina) y/o farmacocinética (nelfinavir e indinavir). La aparición posterior de los inhibidores de la proteasa (IP) potenciados con ritonavir volvió a replantear la hipótesis de que la monoterapia con alguno de estos fármacos (mantenimiento) pudiera ser suficiente para mantener el control de la replicación viral de forma eficaz y segura, una vez alcanzado dicho control con un TAR de combinación clásico (inducción).
De todos los IP potenciados, lopinavir potenciado con ritonavir (LPV/r) ha sido el fármaco de referencia, con elevada potencia y barreras genética y farmacocinética también elevadas. Por ello, fue el mejor situado para probar, de forma experimental, la estrategia de monoterapia. La reciente incorporación a la práctica clínica de darunavir potenciado con ritonavir (DRV/r) y la investigación de su utilidad en la estrategia comentada le ha hecho también candidato a ser empleado en la misma. Los resultados de los estudios y ensayos clínicos realizados han permitido que, en las recomendaciones actuales de tratamiento antirretroviral del grupo de expertos de GESIDA y el Plan Nacional sobre el SIDA1, se considere la simplificación a monoterapia con lopinavir/ritonavir o darunavir/ritonavir como una opción utilizable en pacientes sin historia de fracaso previo a IP, con carga viral plasmática indetectable durante más de 6 meses y signos o síntomas de toxicidad por análogos de nucleósidos/nucleótidos, siendo calificada esta recomendación como de nivel A (procedencia de los datos de estudios aleatorizados y controlados).
El éxito de esta estrategia y su incorporación como una recomendación de tratamiento permiten ser considerada como la única, en el momento actual, nueva estrategia de tratamiento que supone una alternativa al TAR indefinido y rígido, solo modificable en caso de toxicidad o fracaso terapéutico.
Por tanto, el objetivo de la presente revisión sistemática y metaánalisis es analizar la evidencia disponible sobre la eficacia de la estrategia basada en monoterapia con IP potenciados respecto al tratamiento antirretroviral convencional en el paciente VIH.
MétodosCriterios de selecciónSe realizó una búsqueda bibliográfica de estudios aleatorizados y controlados en los que se comparaba una estrategia de monoterapia con IP potenciados frente al TAR. En el análisis se incluyeron aquellos estudios en los que la información relativa a eficacia estuviera disponible en forma de publicación o comunicación a congreso. Los criterios de selección de los estudios fueron:
- a)
Tener un diseño randomizado y controlado,
- b)
Duración mínima del ensayo de 48 semanas,
- c)
Punto de corte de eficacia virológica en un valor de carga viral menor a 50copias/ml.
Para identificar los estudios de interés, se llevó a cabo una búsqueda en la bases de datos de PubMed y EMBASE, utilizando como descriptores «HIV protease inhibitors or ritonavir boosted and (HIV or HIV infections) and (monotherapy or single agent or single drug or alone or simplified) and humans». La búsqueda bibliográfica se realizó entre septiembre de 1999 y septiembre de 2009.
Además se revisaron los resúmenes de congresos de los últimos 5 años del Conference on Retroviruses and Opportunistic Infections (CROI), de la European AIDS Clinical Society y de la Internacional AIDS Society. También se realizo una búsqueda en fuentes de información disponibles en internet sobre los resultados de ensayos clínicos en marcha (www.cliniclatrials.gov).
Asimismo, se identificaron las revisiones y artículos editoriales de interés publicados en las principales revistas médicas (AIDS, JAIDS, J Infect Dis, N Engl J Med, Lancet) en el último año y se examinó su contenido para identificar la posible información sobre ensayos de interés. En aquellos estudios que fueron objeto de varias publicaciones, utilizamos los datos de mayor tiempo de tratamiento.
Los artículos seleccionados se limitaron a aquellos publicados en español y en inglés.
Selección de los estudiosTres revisores (SFJ, SDA y SGC) revisaron independientemente las fuentes de información disponibles, seleccionando los estudios en función de los criterios de inclusión y exclusión definidos previamente. Para la selección final se requirió el consenso total entre los tres revisores.
Variables y población del estudioLa variable de valoración principal de la eficacia en el análisis combinado fue el fracaso terapéutico. El análisis de la eficacia se realizó por intención de tratar (ITT), incluyendo a todos los pacientes de cada rama de tratamiento que reciben al menos una dosis y considerando fracaso terapéutico aquellos con CV >50copias/ml, que abandonen el estudio por cualquier causa o que tengan un cambio de tratamiento.
La población objetivo del estudio fue el paciente infeccion por el VIH sin ninguna limitación inicial que condicionase la inclusión en el meta-análisis, únicamente considerando diferencias en cuanto a paciente naive o pretratado en el análisis de sensibilidad. Como grupo control se considero a la rama de TAR convencional que incluye 2 o 3 antirretrovirales en combinación.
Análisis estadísticoA partir de los datos tabulados se calcularon los Odds Ratio (OR) y sus intervalos de confianza (IC) del 95%. Para combinar los resultados de los estudios individuales seleccionados, se empleó un modelo de efectos fijos basado en el método de Mantel-Haenszel o de efectos aleatorios, en función de que exista o no heterogeneidad estadísticamente significativa (p<0,1) en los resultados. Para estimar y cuantificar la heterogeneidad entre los diferentes estudios se emplearon el estadístico Q de Cochran y el estadístico I2, de tal manera que los valores del 25%, el 50% y el 75% correspondían a grados bajo, moderado y alto de heterogeneidad, respectivamente9. La posible existencia del sesgo de publicación10 se evaluó visualmente mediante un gráfico de embudo, que enfrenta el efecto de los estudios (OR) con sus errores estándar11. Por último se llevaron a cabo tres análisis de sensibilidad repitiendo el análisis combinado primero sin aquellos estudios con diferentes criterios de inclusión de pacientes, segundo eliminando los de menor tamaño muestral y por último separando los estudios en función del IP utilizado. El análisis estadístico se realizó con el programa informático SPSS statistics®, versión 17.0 y con el programa Review Manager, versión 5.0 (Cochrane Collaboration).
ResultadosSelección de estudios y características principalesSe localizaron inicialmente un total de 1.510 publicaciones, de las que solo 8 estudios12–19 cumplieron los criterios de inclusión en el meta-análisis, como queda recogido en la figura 1. En los ensayos randomizados y controlados (ERC) incluidos en el meta-análisis, participaron un total de 1.071 pacientes, 577 (53,9%) en el grupo de tratamiento con monoterapia y 494 (46,1%) en el de TAR de combinación. Los datos del ensayo de Pulido et al12 están incluidos en el estudio de Arribas et al13 debido a que forman parte del mismo trabajo publicado a 48 y 96 semanas. El IP utilizado en monoterapia durante la fase de mantenimiento fue lopinavir/ritonavir en seis de los estudios12–17 y darunavir/ritonavir en dos18,19.
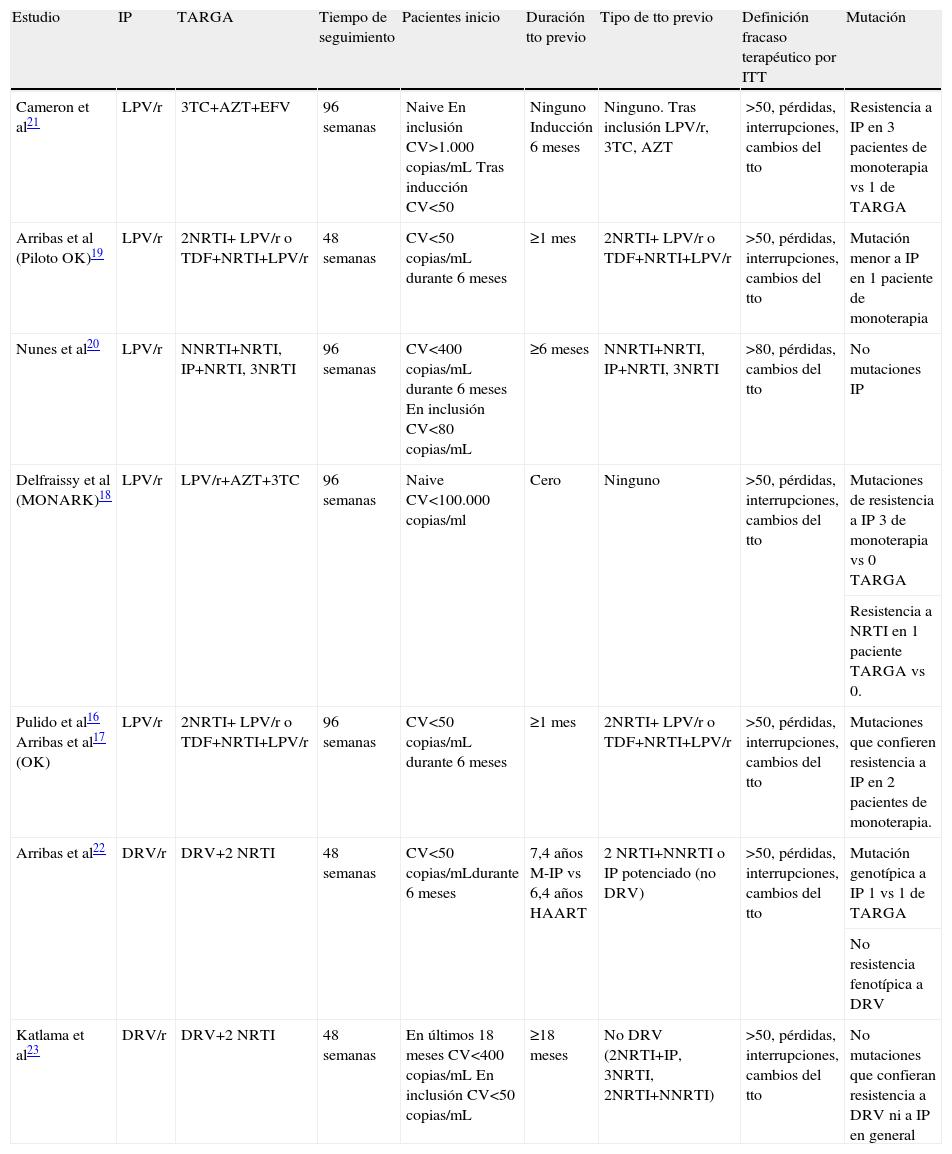
Las características principales y los criterios de inclusión de estos ensayos se resumen en la tabla 1. Las diferencias en los diseños de los estudios son principalmente: diferente duración del tratamiento, que va de 48 a 96 semanas, diferentes características basales de los pacientes en el momento de la inclusión en el ensayo y, por último, la existencia o no, así como su duración, de una fase de tratamiento de inducción con TAR previa a la randomización a monoterapia. Teniendo en cuenta el periodo de inducción, únicamente el estudio de Delfraissy et al14 incluye pacientes naive sin tratamiento previo de inducción con TAR.
Características principales de los estudios incluidos en el metaanálisis
| Estudio | IP | TARGA | Tiempo de seguimiento | Pacientes inicio | Duración tto previo | Tipo de tto previo | Definición fracaso terapéutico por ITT | Mutación |
| Cameron et al21 | LPV/r | 3TC+AZT+EFV | 96 semanas | Naive En inclusión CV>1.000copias/mL Tras inducción CV<50 | Ninguno Inducción 6 meses | Ninguno. Tras inclusión LPV/r, 3TC, AZT | >50, pérdidas, interrupciones, cambios del tto | Resistencia a IP en 3 pacientes de monoterapia vs 1 de TARGA |
| Arribas et al (Piloto OK)19 | LPV/r | 2NRTI+ LPV/r o TDF+NRTI+LPV/r | 48 semanas | CV<50copias/mL durante 6 meses | ≥1 mes | 2NRTI+ LPV/r o TDF+NRTI+LPV/r | >50, pérdidas, interrupciones, cambios del tto | Mutación menor a IP en 1 paciente de monoterapia |
| Nunes et al20 | LPV/r | NNRTI+NRTI, IP+NRTI, 3NRTI | 96 semanas | CV<400copias/mL durante 6 meses En inclusión CV<80copias/mL | ≥6 meses | NNRTI+NRTI, IP+NRTI, 3NRTI | >80, pérdidas, cambios del tto | No mutaciones IP |
| Delfraissy et al (MONARK)18 | LPV/r | LPV/r+AZT+3TC | 96 semanas | Naive CV<100.000copias/ml | Cero | Ninguno | >50, pérdidas, interrupciones, cambios del tto | Mutaciones de resistencia a IP 3 de monoterapia vs 0 TARGA |
| Resistencia a NRTI en 1 paciente TARGA vs 0. | ||||||||
| Pulido et al16 Arribas et al17 (OK) | LPV/r | 2NRTI+ LPV/r o TDF+NRTI+LPV/r | 96 semanas | CV<50copias/mL durante 6 meses | ≥1 mes | 2NRTI+ LPV/r o TDF+NRTI+LPV/r | >50, pérdidas, interrupciones, cambios del tto | Mutaciones que confieren resistencia a IP en 2 pacientes de monoterapia. |
| Arribas et al22 | DRV/r | DRV+2 NRTI | 48 semanas | CV<50copias/mLdurante 6 meses | 7,4 años M-IP vs 6,4 años HAART | 2 NRTI+NNRTI o IP potenciado (no DRV) | >50, pérdidas, interrupciones, cambios del tto | Mutación genotípica a IP 1 vs 1 de TARGA |
| No resistencia fenotípica a DRV | ||||||||
| Katlama et al23 | DRV/r | DRV+2 NRTI | 48 semanas | En últimos 18 meses CV<400copias/mL En inclusión CV<50copias/mL | ≥18 meses | No DRV (2NRTI+IP, 3NRTI, 2NRTI+NNRTI) | >50, pérdidas, interrupciones, cambios del tto | No mutaciones que confieran resistencia a DRV ni a IP en general |
AZT: zidovudina; CV: carga viral (copias/ml); DRV/r: darunavir potenciado con ritonavir; ITT: intención de tratar; IP: inhibidor de la proteasa; LPV/r: lopinavir potenciado con ritonavir; M-IP: monoterapia con IP; NNRTI: inhibidor de transcriptasa inversa no análogo de nucleósido; NRTI: inhibidor de transcriptasa inversa análogo de nucleósido; TARGA: terapia antiretroviral de alta actividad; 3TC: lamivudina; TDF: tenofovir; Tto: tratamiento.
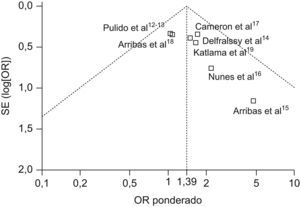
Los OR del fracaso terapéutico de los diferentes estudios quedan reflejados en la figura 2. En ningún estudio se alcanza la significación estadística, encontrando una gran dispersión en el intervalo de confianza de los estudios de Arribas et al15 y Nunes et al16, debido a su reducido tamaño muestral. El análisis estadístico de la heterogeneidad no es significativo (fig. 2), con lo que se utiliza el método de ponderación de Mantel-Haenszel. El OR combinado de los 8 estudios es de 1,39 (IC 95% 1,02–1,90) a favor del grupo de tratamiento con TAR convencional, pero con un intervalo de confianza cercano a los límites de la no significación estadística.
Análisis de sensibilidadSe llevaron a cabo tres análisis de sensibilidad para evaluar la validez de los resultados.
- •
En el primero se elimino del análisis el estudio de Delfraissy et al14 por ser el único que incluye a pacientes sin tratamiento previo. El OR ponderado es 1,37 (IC 95% 0,98–1,92), fuera del margen de la significación estadística, con un análisis de la heterogeneidad no significativo.
- •
En el segundo análisis de sensibilidad se elimino los estudios de menor tamaño muestral15,16. El OR ponderado es 1,32 (IC 95% 0,96–1,83) con un análisis de la heterogeneidad entre los estudios no significativo.
- •
Por último se separaron los estudios en función del IP utilizado en monoterapia, obteniendo un OR ponderado de 1,27 (IC95% 0,74 a 2,17) para darunavir/ritonavir y de 1,46 (IC95% 0,99 a 2,14) para lopinavir/ritonavir, con análisis de la heterogeneidad no significativos en ambos casos.
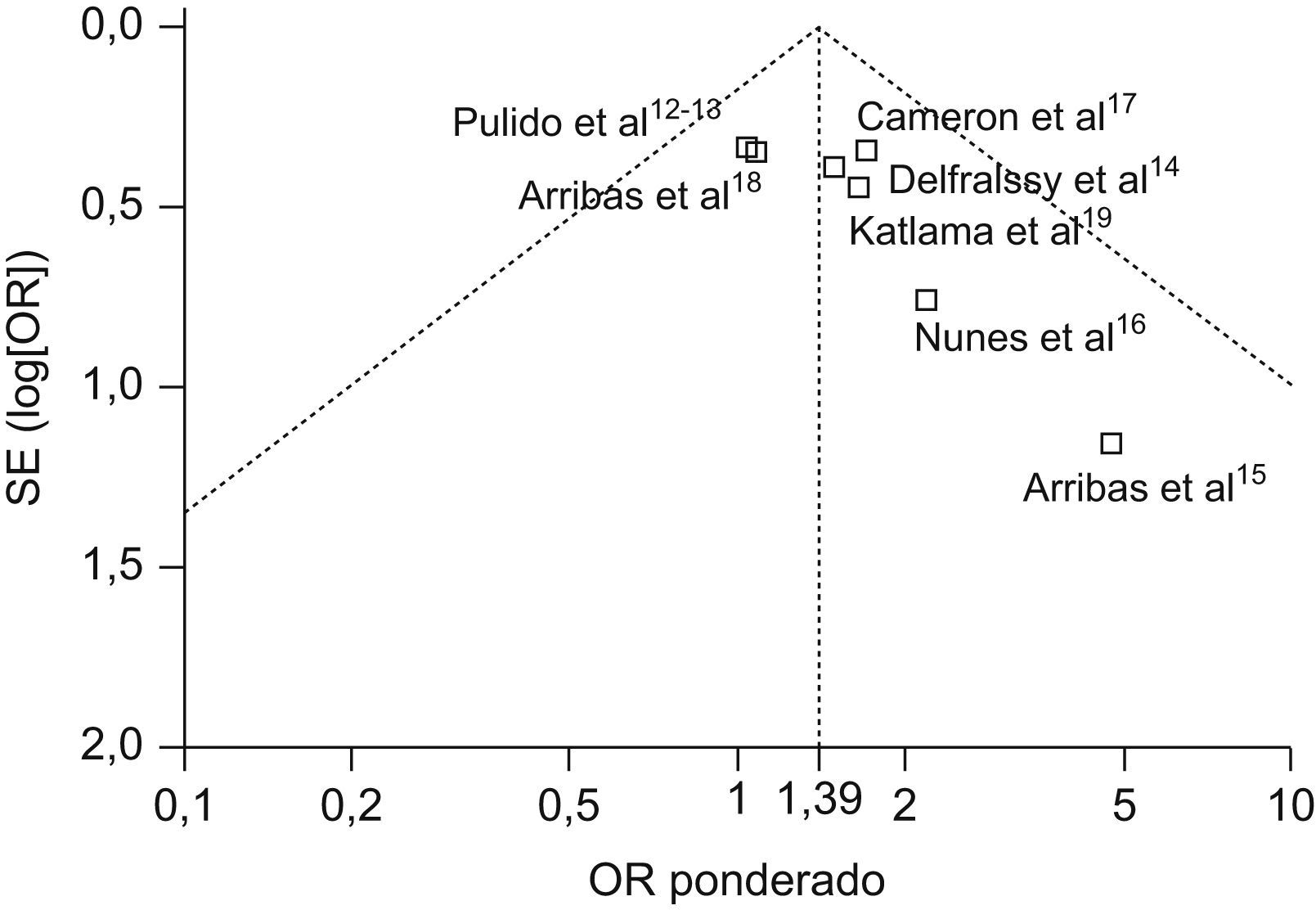
Los resultados del análisis del sesgo de publicación mediante el gráfico de embudo muestran una distribución ligeramente asimétrica que parece indicar la posible existencia del denominado «efecto del los estudios pequeños», que supone una variabilidad entre el efecto encontrado en los estudios pequeños frente a los grandes (fig. 3). Estos estudios de menor tamaño muestral15,16, que aparecen dispersos en el grafico, son los eliminados en el segundo análisis de sensibilidad.
DiscusiónLos resultados del análisis de eficacia combinado en el metanalisis no encuentran diferencias significativas entre la estrategia convencional y la monoterapia. El OR ponderado solo es ligeramente superior, con un IC95% rondando los límites de la no significación, que al llevar a cabo el análisis de sensibilidad comentado anteriormente pasa a ser no significativo. Los resultados del análisis establecen que, tanto la estrategia de simplificación a LPV/r como a DRV/r consigue mantener la CVP suprimida en un gran número de pacientes y, para el caso de LOP/r durante un período largo de tiempo.
Esta forma de simplificación tiene ventajas, en aspectos relacionados con la eficacia clínica y la seguridad y también en términos de eficiencia (relación entre el coste y la eficacia).
Respecto a la eficacia, solo cabe mencionar como cierta limitación y en el caso de los estudios con LOP/r, la mayor incidencia de viremia de bajo grado (50–500copias/ml) lo que hace que esta estrategia solo esté recomendada, a fecha actual, como una alternativa para los casos con toxicidad o intolerancia a los fármacos acompañantes1. Todos los estudios muestran que el aumento de linfocitos CD4 no es menor en pacientes en monoterapia con LOP/r que en los que mantienen la triple terapia estándar, por lo que, en cualquier caso, esta baja viremia no parece afectar a la recuperación inmunológica de estos pacientes. Además, en la mayoría de los casos, la baja viremia no conllevó la aparición de mutaciones de resistencia. No parece, en el caso de LOP/r, que esta viremia de bajo grado esté relacionada con una potencia farmacológica insuficiente. El origen de esta viremia de bajo nivel no está del todo aclarado, pero parece que la adherencia inadecuada podría desempeñar un papel importante, más del que desempeña en pacientes en tratamiento con triple terapia estándar, ya que la corta vida media de LPV/r hace que el fallo en una toma de medicación en pacientes en monoterapia conlleve más riesgo de rebote viral. En cualquier caso, la validez de esta estrategia también se ha confirmado en estudios de efectividad en la práctica clínica real20.
La estrategia de monoterapia con IP potenciados ha recibido críticas debido a un posible aumento en la incidencia de resistencias a IP encontrado en el análisis de subgrupos del estudio de Delfraissy et al14,21. Como comentamos anteriormente, dicho estudio se diferencia del resto por reclutar pacientes naive, con lo que sus resultados no pueden ser considerados equivalentes a los del resto de ensayos. Otros análisis de subgrupos de distintos trabajos muestran la adherencia al tratamiento como el principal predictor de respuesta virológica, seguido de niveles de CD4 nadir inferiores a 100células/μl22,23. En nuestro estudio el análisis de las resistencias debidas a mutaciones frente a IP no ha sido posible debido a la variabilidad de los datos presentados en los estudios dependiendo de su metodología. De esta forma algunos estudios llevan a cabo análisis de resistencias a todos los pacientes con fracaso terapéutico, mientras que otros únicamente a una muestra incompleta de los fracasos o solo a los pacientes en monoterapia (tabla 1).
Respecto a la seguridad, los estudios han confirmado que los pacientes tratados con LPV/r en monoterapia han mejorado su calidad de vida y reducido los efectos adversos, entre ellos la lipodistrofia17,24.
En cuanto a la eficiencia, hay dos ventajas que tienen una relación indudable en términos de costes: a) la primera, al disminuir el riesgo de efectos adversos a medio o largo plazo de los ITIAN, se reducen sus costes asociados, y b) la segunda, reducir los costes directos asociados al TAR. Respecto a la primera, en el estudio de Libre Codina et al25, se ha cuantificado en nuestro medio que los costes promedio totales provocados por los acontecimientos adversos asociados a los ITIAN, durante un período de 12 meses, ascendieron a 2.223euros/año, y los de impacto económico más elevado son los derivados de la lipoatrofia, la lipodistrofia mixta y la neuropatía periférica. La supresión de los análogos de los nucleósidos en un esquema de TAR, con el mantenimiento del control de la replicación viral, debe contribuir a disminuir estos costes asociados a su toxicidad. En cuanto a la reducción de costes directos totales, es evidente que la reducción del número de fármacos que forman el TAR redundará en un descenso del coste final del tratamiento; habiéndose cuantificado la magnitud cuantitativa de la diferencia, tanto en el estudio piloto como en alguno de los ensayos clínicos26,27.
Las limitaciones del presente trabajo son el reducido número de ERC actualmente publicados, la falta de homogeneidad entre los protocolos, así como la escasez de datos aportados por los estudios en relación a análisis de resistencias y a otros factores que faciliten la selección de los subgrupos de pacientes que se verán más beneficiados con esta estrategia.
En resumen, la simplificación a monoterapia, reintroduciendo los fármacos acompañantes al LPV/r en caso de rebrote viral, ha demostrado una eficacia similar al tratamiento combinado tanto en ensayos clínicos como en la práctica clínica habitual. La falta de adherencia es el mayor condicionante de los fracasos virológicos de esta pauta. En el caso de emplear esta misma estrategia con DRV/r, ya está demostrada en ensayos clínicos la validez de la misma y es necesario estudios concretos que pongan de manifiesto sus posibles limitaciones, si las hubiere, así como el mantenimiento de la eficacia a largo plazo.