Numerosos estudios epidemiológicos y prospectivos han mostrado una relación directa entre el colesterol total y el colesterol unido a lipoproteinas de baja densidad (cLDL) y la morbilidad y mortalidad cardiovascular (ECV). Las estatinas han demostrado en numerosos estudios de intervención, que engloban más de 100.000 sujetos, una potente y significativa reducción de los episodios cardiovasculares y de la mortalidad por enfermedad coronaria y por todas las causas, muy superior a cualquier otro grupo hipolipemiante.
Por esto, las estatinas se consideran seguras y bien toleradas y son el fármaco de elección en el tratamiento de las hipercolesterolemias y en la prevención cardiovascular. Cuando con ellas no se consiguen los objetivos se deben asociar a otros grupos farmacológicos (resinas, ácido nicotínico, ezetimiba, fibratos, etc) o cuando la hipercolesterolemia se asocia a colesterol unido a lipoproteinas de alta densidad (cHDL) bajo y TG elevados debe considerarse la asociación de estatinas a ácido nicotínico, fibratos u omega3.
Quedan algunos aspectos pendientes de definir: ¿qué concentraciones de cLDL son deseables en prevención secundaria?, ¿qué sujetos pueden beneficiarse del tratamiento en prevención primaria?, ¿qué fármaco es el más adecuado, en cada situación, para asociar a estatinas y disminuir el riesgo cardiovascular? En este trabajo revisamos estos importantes puntos.
Numerous epidemiological and prospective studies have shown a direct relationship between total cholesterol and low-density lipoprotein cholesterol (LDL-C) and cardiovascular disease (cardiovascular morbidity and mortality). In many intervention studies with more than 100,000 subjects, statins have shown a powerful and significant reduction of cardiovascular events and a decrease in cardiovascular and overall mortality, far superior to those produced by any other lipid-lowering group.
Consequently statins are considered to be safe and well tolerated and are the first choice in the treatment of hypercholesterolemia and in cardiovascular disease prevention. If targets are not reached, other pharmacological groups must be associated (resins, nicotinic acid, ezetimibe, fibrates, etc.). Moreover, when hypercholesterolemia is associated with low concentrations of high-density lipoprotein (HDL)-cholesterol and high triglyceride levels, the association of statins with nicotinic acid, fibrates or omega-3 should be considered.
Some questions remain to be answered: what LDL-C levels are desirable in secondary prevention? Which individuals might benefit from treatment in primary prevention? Which lipid-lowering drug is the most suitable to combine with statins and diminish cardiovascular risk in each situation? The present article reviews these important points.
El tratamiento de la hipercolesterolemia tiene como objetivo fundamental disminuir la morbilidad y mortalidad cardiovascular (ECV), que sigue siendo la primera causa de muerte en los países desarrollados. La importancia de la hipercolesterolemia en el proceso arterioscleroso y en la ECV es bien conocida. Por cada aumento de 1mmol/l (39mg/dl) del colesterol unido a lipoproteinas de baja densidad (cLDL) se eleva un 57% el riesgo de episodios cardiovasculares, mientras que un incremento de 0,1mmol/l (4mg/dl) de colesterol unido a lipoproteinas de alta densidad (cHDL) disminuye un 12% los episodios cardiovasculares1. Sigue abierta la controversia respecto al papel de los TG plasmáticos, mientras que algunas hipertrigliceridemias cursan con aumento del riesgo de ECV, en otros estudios tras ajustar por otros factores de riesgo cardiovascular (FRCV) pierden su poder predictivo para la ECV2,3.
El objetivo primario en el tratamiento de la hipercolesterolemia y en la prevención cardiovascular se ha basado en los valores de cLDL y en la asociación con otros FRCV o en la existencia de ECV o de los equivalentes de ECV4 (tabla 1). En situaciones de alto riesgo el objetivo es una concentración de cLDL<100mg/dl y el objetivo ideal en prevención primaria es cLDL <130mg/dl. Cuando los TG están aumentados, situación frecuente en la población actual con una elevada prevalencia de consumo de dieta hipercalórica e inactividad física, obesidad, síndrome metabólico y diabetes, el objetivo debe establecerse en el colesterol no HDL (c-no-HDL) o diferencia entre el colesterol total y cHDL. Los objetivos de c-no-HDL son 30mg/dl más que el correspondiente objetivo cLDL (tabla 1). Este parámetro c-no-HDL muestra una importante relación con la mortalidad cardiovascular en el PSC5 (Prospective Studies Collaboration) que engloba 61 estudios prospectivos con 55.000 muertes vasculares. Debemos recordar que el objetivo en el tratamiento de las hipercolesterolemias se basa en un parámetro de laboratorio, por lo que debemos tener en cuenta la variabilidad de la muestra y de la metodología empleada6.
Objetivos del colesterol LDL (cLDL) mg/dl
| Situación de riesgo cardiovascular | Objetivo | |
| cLDL | c-no-HDL | |
| Bajo | ||
| 0-1 FRCV | <160 | <190 |
| RCV según tablas Framingham <10% | ||
| RCV según tablas SCORE o CEIPC <3% | ||
| Moderado | ||
| 2 o más FRCV | <130 | <160 |
| RCV según tablas Framingham 10–20% | ||
| RCV según tablas SCORE o CEIPC 3–5% | ||
| Alto | ||
| Prevención secundaria (Enfermedad coronaria) | <100 | <130 |
| Equivalentes de prevención secundaria | ||
| ||
| RCV según tablas Framingham >20% | ||
| RCV según tablas SCORE o CEIPC >5% | ||
| Muy alto | ||
| Síndrome coronario agudo | <70 | <100 |
| Diabetes con ECV | ||
c-no-HDL: colesterol total menos chal; cLDL: colesterol de las lipoproteinas de bala densidad; FRCV: factores de riesgo cardiovascular. Se consideran: fumar, hipertensión o sujeto en tratamiento por hipertensión, descenso de cHDL, historia familiar de enfermedad cardivascular prematura (<55 años en hombres y <65 años en mujeres), edad >45 años en hombres y >55 en mujeres o menopausia. El cHDL >60mg/dl se considera un factor protector; RCV: riesgo cardiovascular.
Tablas Framingham. D’Agostino RB, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General Cardiovascular Risk Profile for Use in Primary Care. The Framingham Heart Study. Circulation 2008; 117:743–53.
Tablas SCORE (tablas europeas de riesgo cardiovascular). Conroy R, Pyörälä K, Fitzgerald T, Sans S, Menotti A, De Backer G, et al. Estimation of ten-year risk of fatal CVD in Europe: the SCORE Project. Eur Heart J. 2003; 24:987-1003.
Tablas CEIPC (adaptación española de la guía europea de prevención cardiovascular). Brotons C, Royo MA, Alvarez-SAla L, Armario P, Artiago R, Conthe P, et al. Adaptación española de la guía europea de prevención cardiovascular. Rev Esp Salud Pública 2004; 78:435–8.
El tratamiento de la hipercolesterolemia debe iniciarse con cambios en el estilo de vida que deben incluir la modificación dietética con restricción de grasas saturadas, grasas trans y colesterol dietético, y aumento de la fibra, de los esteroles vegetales, la proteína de soja y frutos secos, especialmente nueces. Con estas medidas su puede conseguir hasta un 27% de reducción del cLDL7. Además, hay que aumentar el ejercicio físico y corregir otros FRCV existentes. Tras los cambios en el estilo de vida, si es necesario, estableceremos el tratamiento farmacológico hipocolesterolemiante, como las estatinas, resinas, ácido nicotínico y ezetimiba.
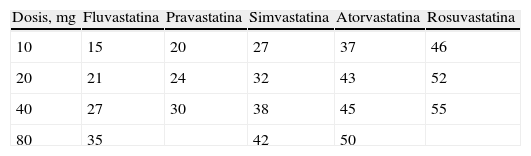
EstatinasLas estatinas o inhibidores de la hidroximetilglutaril coenzima A (HMGCoA) reductasa (lovastatina, simvastatina, pravastatina, fluvastatina, atorvastatina, pitavastatina no aprobada en Europa y rosuvastatina) inhiben, fundamentalmente a nivel hepático, la síntesis del colesterol y activan la síntesis de receptores LDL y, por ello, el aclaramiento de las LDL, disminuyendo su concentración plasmática. Reducen el cLDL un 20–55% dependiendo de la estatina y dosis utilizada, la respuesta terapéutica es dosis dependiente (tabla 2)8, la respuesta puede depender de otros factores como el sexo, fenotipo apo E, tipo de mutación del receptor en la hipercolesterolemia familiar, etc9,10. También descienden los TG un 7–30% y elevan el cHDL un 5–10%. La rosuvastatina es la estatina más potente sobre el descenso del cLDL y el incremento del cHDL11.
Las estatinas son en general bien toleradas. Los efectos secundarios más frecuentes son cefalea, flatulencia, dispepsia, prurito y rash cutáneo. Puede haber elevación de las transaminasas hepáticas de forma discreta y transitoria, no es necesario interrumpir la medicación salvo cuando se tripliquen las cifras del límite superior de la normalidad, lo que ocurre en menos del 1% de casos. También pueden aparecer elevaciones leves y transitorias de la creatinfosfo cinasa, no es necesario monitorizar regularmente la creatinfosfo cinasa. La miopatía con elevación de la creatinfosfo cinasa hasta 10 veces por encima de sus límites normales es rara y aparece en menos del 0,1% de los sujetos tratados. La asociación con ciclosporina, eritromicina, fibratos, ácido nicotínico y antifúngicos pueden elevar hasta el 5% las probabilidades de la miopatía. Estos efectos por interferencia con otros fármacos son menores con la pravastatina, fluvastatina y rosuvastatina, ya que solo en una pequeña proporción es metabolizada por el sistema enzimático del citocromo P450 (CYP450)12.
Las estatinas han demostrado importantes beneficios en la prevención y tratamiento de las enfermedades cardiovasculares de origen arteriosclerótico13–16. El estudio CARDS (Collaborative Atorvastatin Diabetes Study)17, realizado en pacientes diabéticos sin manifestaciones clínicas previas de ECV, demostró beneficios similares al de los no diabéticos. La reducción de la morbilidad y mortalidad cardiovascular con estatinas, tanto en prevención primaria como en secundaria, es aproximadamente del 30%18.
Un metaanálisis del Cholesterol Treatment Trialists’ Collaborators19 de 14 estudios randomizados con 90.056 sujetos demostró que por cada mmol/l (39mg/dl) de descenso de las concentraciones séricas de cLDL con estatinas se conseguía un 21% de reducción de ACV mayores y un 23% de episodios coronarios. Estos beneficios eran encontrados en todas las poblaciones: prevención primaria, prevención secundaria, diabéticos, jóvenes y ancianos, hipertensos, etc.
Un importante punto de discusión son los llamados efectos pleiotrópicos de las estatinas, ¿son clínicamente importantes o no?
En diferentes estudios con estatinas se ha descrito una serie de efectos independientes de la acción hipolipemiante que se han llamado efectos pleiotrópicos20. Así, las estatinas actúan normalizando la disfunción endotelial, mejoran la perfusión miocárdica, inhiben la activación de los macrófagos y la proliferación de las células musculares lisas, protegen a las LDL de la oxidación, inducen una disminución de la activación del factor de activación nuclear NF-kB y por ello de la producción de citocinas, factores de crecimiento y de la proteína C reactiva21. A través de muchas de estas acciones podría explicarse la rapidez con que las estatinas modifican las alteraciones vasomotoras presentes en los síndromes coronarios agudos y en las intervenciones coronarias percutáneas con un beneficio clínico significativo y precoz, que no se puede explicar exclusivamente por la reducción del cLDL22,23. Por otro lado, en los transplantados cardíacos, las estatinas reducen el porcentaje de rechazos y mejoran significativamente la supervivencia durante el primer año24.
Un meta-análisis con más de 80.000 participantes con enfermedad coronaria estable mostró que por cada reducción de un 1% del colesterol total se asociaba una reducción de un 1% del riesgo cardiovascular. Esta relación fue consistente tanto en los estudios de intervención con estatinas como en aquellos sin estatinas, lo que pone en discusión la importancia clínica de los efectos pleiotrópicos25.
Así, falta por establecer claramente el beneficio de los efectos pleiotrópicos, aunque posiblemente son importantes en la enfermedad coronaria inestable o aguda, como los síndromes coronarios agudos y las intervenciones coronarias percutáneas donde el inicio precoz de tratamiento intensivo con estatinas ha demostrado efectos beneficiosos relacionados con los efectos antiinflamatorios de las estatinas.
Hoy no hay dudas en que los sujetos en prevención secundaria o con equivalentes de ECV deben ser tratados con estatinas. Pero en prevención primaria el tratamiento se establece dependiendo del calculo del riesgo cardiovascular (tabla 1). Actualmente hay dudas razonables de cuándo y a quiénes tratar.
En el meta-análisis Cholesterol Treatment Trialists’ Collaborators con 90.056 sujetos se demostró que los beneficios del tratamiento con estatinas eran independientes de las concentraciones previas de cLDL, encontrando similar descenso de episodios cardiovasculares en los sujetos con cLDL <135mg/dl, con cLDL entre 135–175mg/dl o >175mg/dl16. Otro estudio reciente, JUPITER (Justification for the Use of Statins in Prevention-an Intervention Trial Evaluating Rosuvastatin)26, realizado con 17.802 sujetos, hombres >50 años y mujeres >60 años, sin historia de ECV, con concentraciones de cLDL <130mg/dl y de proteína C reactiva >2mg/l, mostró una reducción del cLDL del 50% y un descenso de la proteína C reactiva del 37% y se acompañó de una reducción del objetivo primario (combinado de muerte cardiovascular, infarto no mortal, ictus no mortal, angina inestable y resvascularización) de un 44% y de la mortalidad total del 20%. Demostrando en sujetos en prevención primaria con cLDL bajo o normal y riesgo cardiovascular medio un importante beneficio cardiovascular, este grupo de sujetos según las principales guías no requieren tratamiento con estatinas.
Estos estudios plantean los posibles beneficios y necesidad de tratamiento en sujetos en prevención primaria con niveles bajos de cLDL, fundamentalmente cuando tienen más de 50 años o tienen síndrome metabólico u obesidad abdominal, en el JUPITER los participantes tenían más de 50 años y más del 40% tenían síndrome metabólico.
Otro punto de discusión está relacionado con la intervención en sujetos de alto riesgo ¿Objetivo cLDL <100 vs. <70mg/dl? ¿Dosis altas contra bajas?
Diversos estudios prospectivos en sujetos con alto riesgo cardiovascular, como el TNT (Treating to New Targets)27, IDEAL (Incremental Decrease In End-points Through Aggressive Lipid-lowering)28, A-to-Z (Aggrastat to Zocor)29, utilizando dosis elevadas de estatinas contra dosis bajas, demostraron una reducción significativa de episodios cardiovasculares o muerte vascular al bajar el cLDL de 100–70mg/dl. En el estudio AVERT (Atorvastatin Versus Revascularization Treatments)30 realizado en sujetos con cardiopatía estable o angor moderado, el grupo tratado solo con atorvastatina 80mg/d mostró similares resultados a los del grupo donde se realizó una revascularización percutánea. Estos, y otros, estudios han llevado a establecer que en sujetos con muy alto riesgo cardiovascular el objetivo debe ser cLDL <70mg/dl31.
Dos importantes estudios, REVERSAL (Reversal of Atherosclerosis with Aggressive Lipid Lowering)32 y ASTEROID (A Study to Evaluate the Effect of Rosuvastatin on Intravascular Ultrasound-Derived Coronary Atheroma Burden)33, han demostrado que con concentraciones de cLDL <70mg/dl hay una significativa reducción de la placa de ateroma coronaria, medida por ecografía intavascular (IVUS).
Existen datos para mantener que hay una fuerte relación entre las concentraciones de cLDL y la progresión y regresión de la arteriosclerosis y se podría mantener que buscar el objetivo cLDL <70mg/dl no solo es adecuado en los sujetos con muy alto riesgo cardiovascular, sino en cualquier sujeto con enfermedad coronaria buscando la regresión y estabilización de la placa34. Además, la utilización de dosis altas no se relaciona con un importante incremento de los efectos secundarios, la elevación de las enzimas hepáticas 3 veces por encima del límite superior de la normalidad es del 0,5–3%, aumento discretamente más elevado que con dosis bajas y la incidencia de miopatía fue <0,02%, en más de 40 estudios con altas dosis35.
La importancia de la teoría lipídica ha sido claramente establecida con los estudios de intervención. Aunque el tema es conocido desde hace años, en 1962 en estudios realizados en Japón encontraron que la mortalidad cardiovascular era <10% de la observada en EE.UU. En Japón la población tenía unas concentraciones de cLDL aproximadamente de 80mg/dl36, esta menor mortalidad planteó el dilema si era una protección por factores genéticos o por las concentraciones de colesterol. En los años siguientes estudiando población japonesa emigrada a EE.UU. encontraron que las diferencias en la mortalidad no eran explicadas por diferencias genéticas, si no que una parte importante era atribuida a las concentraciones de colesterol total y de cLDL37. Actualmente, las guías del ATP III (Adult Treatment Panel III) recomiendan reducir el cLDL <70mg/dl en sujetos con muy alto riesgo. ¿Pero hasta donde debemos bajarlo?, no tenemos claramente resuelta esta pregunta. Los datos para contestarla son escasos, en un subgrupo del PROVE-IT (Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction)38 encuentran beneficio al disminuir cLDL entre 40–60mg/dl y en un trabajo de Leeper et al39 han demostrado tras 2 años de tratamiento con estatinas que los sujetos con cLDL <40mg/dl, tienen menor mortalidad por todas las causas.
Ante estos hallazgos hay claras discrepancias, muchos piensan que el colesterol muy bajo es perjudicial y peligroso para nuestro organismo. Se ha relacionado con un aumento de la incidencia de cáncer, y los datos al respecto son contradictorios40,41. Sin embargo, hay datos para pensar que esto no es así. El primero surge de los estudios de Goldstein y Brown42 el receptor de las LDL tiene una alta afinidad y sensibilidad, funcionado correctamente con concentraciones de cLDL <40mg/dl y con cifras más elevadas comienza su saturación y la captación de LDL es menor. En segundo lugar, todos los RN tienen bajas concentraciones de colesterol total y cLDL y además algunos sujetos con hipobetalipoproteinemia tienen concentraciones de cLDL <20mg/dl, sin ningún problema clínico y pueden ser longevos. Por otro lado, O’Keefe et al43 describen que la cifra de colesterol total en sociedades primitivas de cazadores y recolectores y en primates superiores, oscila generalmente entre 70–140mg/dl, que corresponden a concentraciones de cLDL de aproximadamente 35–70mg/dl, apuntando que las cifras optimas de cLDL pueden estar alrededor de 50mg/dl. Falta por definir qué cifras debemos considerar beneficiosas y de seguridad.
Actualmente las estatinas son, sin duda, el tratamiento de elección en las hipercolesterolemias y en la prevención cardiovascular. El tipo y dosis a utilizar dependerá fundamentalmente de la reducción sobre el cLDL que necesitemos conseguir para llegar a los objetivos recomendados en cada caso (ver tabla 2). Pero algunos puntos siguen en discusión, como la importancia de los efectos pleiotrópicos en general y especialmente en la ECV aguda, la prevención cardiovascular en prevención primaria, hasta donde disminuir el colesterol total y el cLDL. Aunque cada vez parecen más claros estos puntos, la mayor parte de autores piensan que en prevención secundaria y en sujetos de alto riesgo el colesterol cuanto más bajo mejor, que las estatinas deben establecerse precozmente tras un episodio cardiovascular. Donde aún hay más discusión es en el tratamiento con estatinas en prevención primaria.
Resinas de intercambioSon polímeros, insolubles en agua, resistentes a las enzimas digestivas y capaces de unirse a los ácidos biliares y al colesterol en la luz intestinal, aumentando su excreción fecal y reduciendo el contenido hepático de colesterol, lo que estimula la síntesis de receptores LDL y acelera el aclaramiento plasmático de estas lipoproteínas. Las más antiguas son la colestiramina, el colestipol y el filicol.
Al no absorberse carecen de toxicidad sistémica y son consideradas como los hipolipemiantes más seguros, pero muy frecuentemente provocan una grave intolerancia digestiva (estreñimiento, flatulencia, náuseas) e interfieren la absorción de algunos fármacos (ácido fólico, tiroxina, digoxina, warfarina, vitaminas liposolubles y amiodarona) que deberán administrarse 4 horas antes o después de la toma de las resinas. Las resinas pueden ejercen efectos adversos sobre el metabolismo de los TG, provocando un aumento de su síntesis hepática.
La colestiramina y el colestipol han demostrando eficacia en la reducción del cLDL y de la morbilidad y mortalidad coronaria. En el estudio LRC-CPPT (Lipid Research Clinics Coronary Primary Prevention Trial)44, hubo una reducción del 19% de episodios cardiovasculares y en el subgrupo que toleró y tomó la dosis completa de colestiramina, hubo un descenso de la colesterolemia de un 25% y de la morbilidad y mortalidad coronaria de un 50%.
El empleo de las resinas se ha reducido, por la mala tolerancia a las dosis altas requeridas. En los últimos años han aparecido nuevas resinas como la colestimida o colesevelam, que han sido modificadas en su estructura para aumentar su tolerancia y tienen un importante efecto sobre la reducción del cLDL y la hemoglobina A1c (HbA1c) que llega a reducir casi 1 punto (0,9%), considerándolas útiles en el tratamiento del sujeto diabético con hipercolesterolemia45. La administración de colesevelam 625mg/d, en forma de comprimidos, disminuye el cLDL entre 15–21%, aumentando cHDL 3–9% y los TG un 2–16%. Al asociarlo a estatinas aumenta el descenso del cLDL un 10–16%46. Son mejor tolerados y no tiene efectos sobre la biodisponibilidad de otros fármacos como la digoxina, fenofibrato, anticoagulantes, estatinas, etc.
Las resinas se utilizan en el tratamiento de las hipercolesterolemias en monoterapia fundamentalmente ante la intolerancia de estatinas o en combinación con estatinas cuando con las estatinas no se consigue el objetivo terapéutico, la asociación ha demostrado su sinergia sin interacciones47.
Ácido nicotínicoEs el hipolipemiante más antiguo de los actualmente disponibles en el mercado. Es el ácido 3 carboxil piridina (C6H5NO2) o vitamina B3 o PP que en dosis elevadas (2g/d) tiene un importante efecto hipolipemiante. El ácido nicotínico se une al receptor GPR109A en la pared de los adipocitos disminuyendo la liberación de ácidos grasos libres al torrente sanguíneo y su aporte al hígado, con disminución de la síntesis de TG y de lipoproteínas de muy baja densidad (VLDL). En el hígado incrementa la degradación intracelular de apo B48 y la síntesis de apo A1. Recientemente se ha demostrado un aumento de la captación de colesterol desde los macrófagos a través de la vía de la ABCA1 que contribuiría a sus efectos antiaterogénicos49.
El ácido nicotínico (niacina) es, en la actualidad, el agente más potente para elevar el cHDL (aumento del 15–35%) y reduce los TG un 15–50%. Dependiendo del tipo y gravedad de la hipertrigliceridemia tratada, la reducción media se encuentra alrededor del 20%, reduce el cLDL entre 5 y 25%, también disminuye la lipoproteína (a) (Lp[a]) un 20%. El ácido nicotínico demostró en el estudio CDP (Coronary Drug Project)50 una disminución del 21% de la incidencia de infarto de miocardio no mortal.
El ácido nicotínico ha sido mal tolerado por la frecuente aparición de crisis de sofocos o rubefacción cutánea, debido a la liberación dérmica de prostaglandina D2 (PGD2) que actúa a través de los receptores del subtipo 1 (DP1) de la musculatura lisa vascular51. Actualmente al ácido nicotínico se ha asociado el laropiprant, un antagonista selectivo del receptor DP1, que bloquea dichos receptores e impide la unión de las PGD2, inhibiendo la vasodilatación inducida por el ácido nicotínico y mejorando significativamente la tolerancia y el uso clínico de la niacina52,53. Entre los efectos secundarios hay que destacar el aumento de la glucemia basal que es alrededor de 4mg/dl y un aumento de la HbA1c del 0,2–0,3%, lo que en algunos casos obliga a modificar el tratamiento en sujetos con diabetes.
La asociación de estatinas y ácido nicotínico debe considerarse en sujetos con hipercolesterolemia primaria o grave que no se controla con estatinas o en hipercolesterolemia con concentraciones bajas de cHDL. En algunos estudios, la asociación de niacina LP (2g/d) y simvastatina (40mg/d) produjo elevaciones del cHDL del 30% y descensos del cLDL 43%, TG 44% y Lp(a) 15%54,55. En el estudio HATS (HDL-Atherosclerosis Treatment Study)56, asociación de ácido nicotínico con estatinas mostró un aumento del cHDL del 26% y una disminución del 90% de los episodios de muerte, infarto de miocardio, ictus o revascularización comparado con el grupo placebo. Más recientemente el estudio ARBITER 6 (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol 6)57 demostró en 208 sujetos en prevención secundaria o con equivalentes de prevención secundaria con cLDL <100mg/dl con tratamiento con estatinas y aleatorizados a 2 ramas, una con ezetimiba y una segunda con ácido nicotínico, mostró en este último grupo una disminución significativa del engrosamiento de la íntima-media carotídea, no ocurrió en el grupo con ezetimiba a pesar de una mayor disminución del cLDL. Además hubo una disminución significativa de los episodios cardiovasculares al compararlo con el grupo de ezetimiba, lo que indica la importancia de aumentar el cHDL en sujetos con cLDL <100mg/dl con mejores resultados que disminuir más el cLDL.
Un estudio prospectivo en fase III (HPS2-THRIVE)58 está valorando si niacina/laropiprant combinada con simvastatina es superior a simvastatina y placebo para reducir la morbimortalidad cardiovascular en aproximadamente 25.000 pacientes con ECV (infarto de miocardio, ictus o enfermedad arterial periférica) y concentraciones de colesterol LDL optimizadas con estatinas. Sus resultados estarán disponibles en 2012.
EzetimibaLa ezetimiba es un fármaco que inhibe selectivamente la absorción intestinal de colesterol actuando sobre el receptor Niemann-Pick CI. Este mecanismo disminuye el aporte de colesterol al hígado, aumentando la sobreexpresión de receptores hepáticos de LDL y conduce a una reducción del cLDL de un 18–20%, con mínimos cambios sobre cHDL (aumento 1–3%) y una reducción de los TG menor del 10%59. La ezetimiba añadida a las estatinas contribuye a potenciar el descenso del cLDL60. La ezetimiba es un fármaco bien tolerado y ampliamente utilizado al no aumentar el riesgo de miopatía de las estatinas.
La combinación con estatinas es bien tolerada, pero no existen todavía datos suficientes para poder afirmar que su empleo sea más efectivo en la prevención de las enfermedades cardiovasculares que la monoterapia con estatinas61. Persisten algunas dudas acerca de posibles efectos secundarios, como relación con el cáncer. Faltan estudios para confirmar sus efectos beneficiosos cardiovasculares sin riesgos añadidos sobre la salud62.
Tratamiento combinadoSurge, como hemos comentado, como necesidad ante dos situaciones: A) no conseguir los objetivos con monoterapia (estatinas, salvo intolerancia) o B) el enfoque del llamado riesgo residual o riesgo persistente tras tratamiento con estatinas. En los diferentes estudios con estatinas se demostró una reducción de la morbilidad y mortalidad coronaria de aproximadamente del 30%, pero queda un alto porcentaje, el 70% sin beneficio, planteándose la necesidad de utilizar tratamiento combinado de estatinas y otros hipolipemiantes o fármacos que estabilicen la placa.
Algunos autores opinan que el riesgo residual, tiene una importante relación con las concentraciones bajas de cHDL y la elevación de los TG, apoyan esta opinión en los resultados de ensayos clínicos donde las estatinas no han sido capaces de eliminar el riesgo asociado al cHDL bajo15,63 Además, hay suficientes argumentos epidemiológicos para considerar que la elevación del cHDL es efectiva para reducir el riesgo cardiovascular, independientemente de la reducción del cLDL64,65.
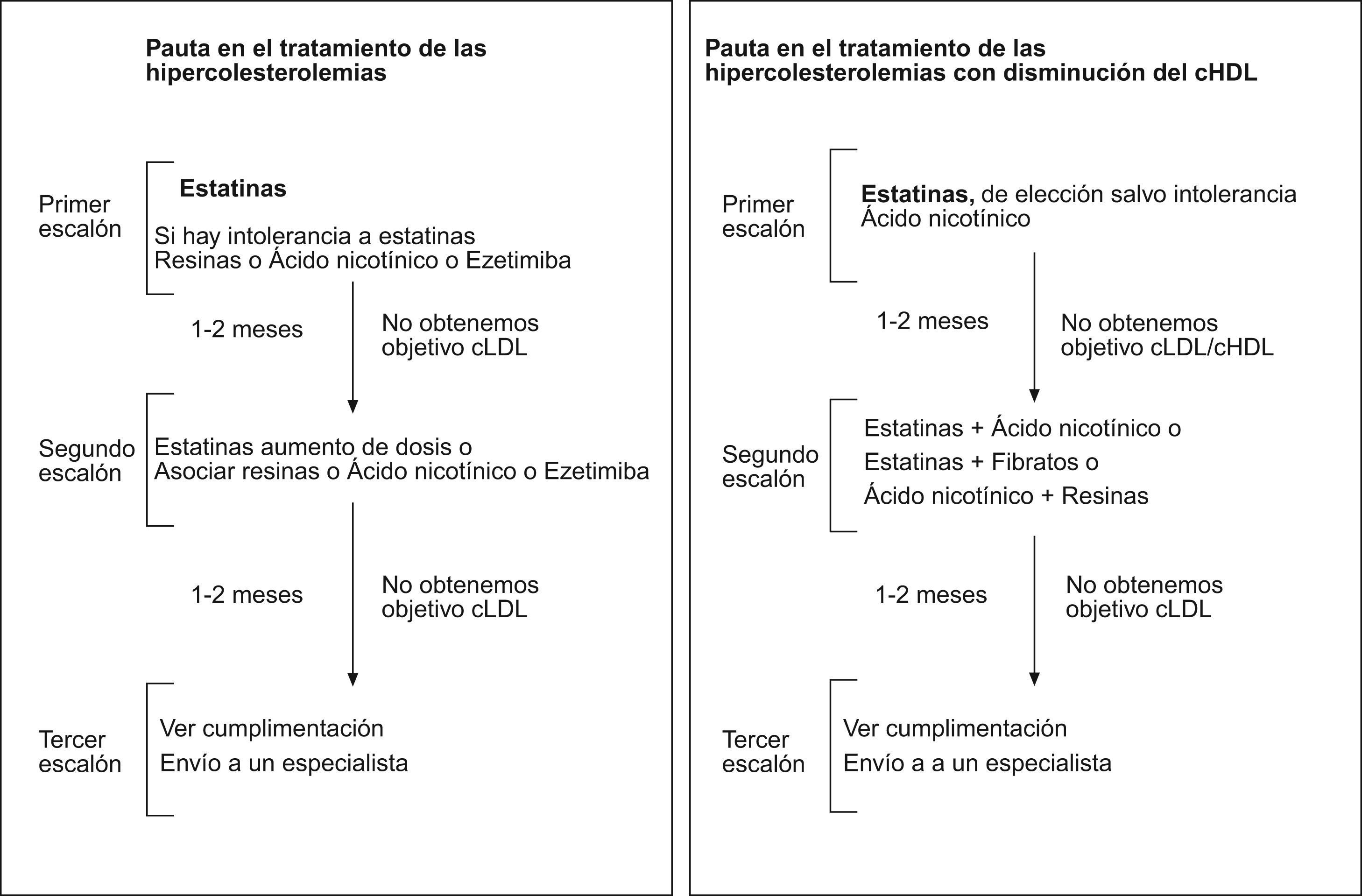
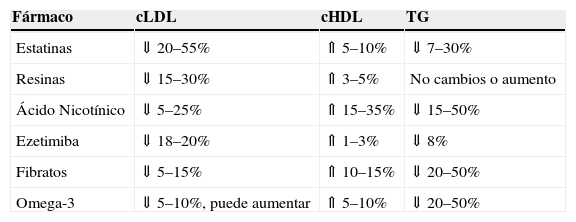
Las pautas recomendadas en el tratamiento de la hipercolesterolemia vienen en la figura 1. La asociación a las estatinas para disminuir el cLDL se realiza con resinas, con ácido nicotínico o con ezetimiba. Mientras que la asociación en sujetos con hipercolesterolemia y cHDL bajo se establece con ácido nicótinico, con fibratos. El efecto sobre los parámetros lipídicos de los diferentes fármacos utilizados en monoterapia o en combinación vienen referidos en la tabla 3.
Cambios porcentuales sobre los parámetros lípidos con diferentes fármacos hipolipemiantes
| Fármaco | cLDL | cHDL | TG |
| Estatinas | ⇓ 20–55% | ⇑ 5–10% | ⇓ 7–30% |
| Resinas | ⇓ 15–30% | ⇑ 3–5% | No cambios o aumento |
| Ácido Nicotínico | ⇓ 5–25% | ⇑ 15–35% | ⇓ 15–50% |
| Ezetimiba | ⇓ 18–20% | ⇑ 1–3% | ⇓ 8% |
| Fibratos | ⇓ 5–15% | ⇑ 10–15% | ⇓ 20–50% |
| Omega-3 | ⇓ 5–10%, puede aumentar | ⇑ 5–10% | ⇓ 20–50% |
cHDL: unido a lipoproteinas de baja densidad; cLDL: unido a lipoproteinas de baja densidad; TG: triglicéridos.
Los fibratos asociados a estatinas pueden elevar el cHDL entre 8–15%, mejorando el perfil lipídico en aquellos sujetos con hipercolesterolemia y cHDL bajo y TG elevados. Esta asociación es bien tolerada, aunque los efectos secundarios sobre el hígado y músculos puede aumentar, pero la mayoría de los estudios demuestran un escaso aumento de efectos secundarios con la asociación fundamentalmente de estatinas y fenofibrato66. La cuestiòn de si la combinaciòn de una estatina con un fibrato aporta un efecto beneficioso adicional superior al obtenido con la estatina ha sido resuelto por el estudio ACCORD CITA67, donde en sujetos con diabetes la combinaciòn de fenofibrato y simvastatina no aumentò los beneficios cardiovasculares al comparar con el grupo que solo tomò simvastatina.
Otros fármacos o métodos para reducir el cLDL y el riesgo cardiovascularUn nuevo gen, con un importante papel en la regulación del colesterol, es el PCSK9 que actúa regulando el número de receptores LDL expresados por el hígado, la sobreexpresión de este gen produce disminución de los receptores LDL y aumento del cLDL en plasma y da un cuadro de hipercolesterolemia familiar autosómica recesiva68. Mientras que las mutaciones sin sentido (nonsense) producen disminución del cLDL (descenso del 15%) con disminución de mortalidad cardiovascular, este gen podría ser una nueva diana terapéutica69.
Aféresis de LDL. Aunque, como hemos comentado, disponemos de fármacos muy efectivos en el tratamiento de la hipercolesterolemia y la prevención cardiovascular, no son efectivos en la totalidad de los sujetos, fundamentalmente con hiperlipemias primarias graves, por ello se han desarrollado métodos más complejos para tratar estos casos con resistencia a los fármacos habituales. La aféresis de LDL es un tratamiento eficaz, seguro y bien tolerado a corto y largo plazo, indicado en la hipercolesterolemia primaria grave que no responde al tratamiento convencional combinado con dieta, estatinas, resinas y ezetimiba a dosis máximas. Las principales indicaciones son la hipercolesterolemia familiar homocigota y la hipercolesterolemia grave en sujetos con ECV clínica, prevención secundaria, en el que no se consiguen los objetivos terapéuticos con la terapia convencional con 2–3 fármacos a dosis altas70. Se han utilizado diferentes sistemas71 que consiguen reducciones rápidas de las concentraciones de cLDL que oscilan entre el 60–70%. También disminuye un 50% la Lp(a), y un 27% los TG. Los descensos las concentraciones de los diferentes lípidos plasmáticos varían moderadamente según el método utilizado, aunque las diferencias no suelen alcanzar significación estadística. Este efecto hipolipemiante agudo conseguido con la aféresis no es mantenido y todos los pacientes requieren tratamiento con estatinas para reducir la síntesis hepática de colesterol, entre aféresis. Su principal inconveniente es la necesidad de someter al paciente a una sesión de aféresis cada 7–15 días y el elevado coste del sistema. La aféresis de LDL ha demostrado en el 56% de los pacientes un efecto subjetivo favorable y rápido de los síntomas de angina y disnea. La mortalidad y los eventos coronarios mayores disminuyen un 72% al compararlo con el tratamiento convencional72,73.
ConclusionesSin duda, el tratamiento farmacológico de la hipercolesterolemia se basa en la administración de estatinas, que han demostrado un importante beneficio en la prevención cardiovascular. Quedan algunos puntos de discusión, que deben resolverse, como cuándo intervenir farmacológicamente en prevención primaria, y hasta donde bajar el cLDL en prevención secundaria.
Por todo lo expuesto, y como conclusión, el tratamiento farmacológico de la hipercolesterolemia debe basarse en las estatinas utilizando el tipo y dosis adecuado para conseguir los objetivos establecidos. Deberemos combinar las estatinas con otros fármacos hipocolesterolemiantes, como resinas, ácido nicotínico o ezetimiba, cuando con estatinas potentes y con altas dosis no consigamos los objetivos. Otra importante asociación será con fármacos capaces de elevar el cHDL y reducir los TG, como el ácido nicotínico, los fibratos o ácidos grasos omega3, cuando la hipercolesterolemia se asocie con cHDL bajo o con dislipemia aterogénica, en la diabetes, síndrome metabólico, etc. Falta por establecer, definitivamente, los beneficios de estas asociaciones sobre la morbilidad y mortalidad cardiovascular, si los estudios en marcha así lo demuestran, tendremos que pensar que en la mayor parte de los casos de hipercolesterolemia con alto riesgo cardiovascular el tratamiento será combinaciones, como ya se ha establecido en la hipertensión y en la diabetes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.