La restricción energética leve y crónica resulta en una enfermedad de origen nutricional, enanismo por desnutrición (ED), con retraso del crecimiento y del desarrollo puberal. Se evaluó el perfil de secreción hipotalámica de hormona liberadora de la hormona luteinizante, basal y por estimulación con glutamato en ratas ED a fin de dilucidar la disfunción gonadotrófica. Asimismo, se evaluó la capacidad reproductiva de dichos animales durante la realimentación.
Materiales y métodos60 ratas de destete se dividieron en 2 grupos: Control (C) y experimental (ED). C fueron alimentadas a demanda libre con una dieta balanceada para roedores. ED recibió el 80% de la dieta consumida por C, durante 4 semanas (T4); A T4, ED fue alimentado a demanda libre por 8 semanas. Diez ratas de cada grupo fueron sacrificadas cada 4 semanas para los ensayos.
ResultadosA T4, peso y longitud corporal de ED frente a C disminuyeron significativamente (p<0,001). No se observaron cambios en la secreción basal, la frecuencia y la amplitud de pulsos de hormona liberadora de la hormona luteinizante de ED frente a C en ninguno de los tiempos estudiados. Por estimulación con glutamato, la secreción de hormona liberadora de la hormona luteinizante de ED frente a C fue significativamente mayor a T4 (p<0,05). Durante la realimentación, los ED alcanzaron el crecimiento compensador y la capacidad reproductiva.
ConclusionesLos resultados sugieren una menor madurez del SNC en los animales ED después de la restricción en relación a su edad cronológica. El crecimiento somático adecuado y la capacidad reproductiva normal en las ratas ED realimentadas sugieren la reversibilidad de dichos procesos comprometidos por la restricción global, leve y crónica.
Mild and chronic energy restriction results in growth retardation with puberal delay, a nutritional disease known as nutritional dwarfing (ND). The aim of the present study was to assess the profile of hypothalamic luteinizing hormone-releasing hormone (LHRH) release, at baseline and under glutamate stimulation, in ND rats to elucidate gonadotrophic dysfunction. Reproductive ability during refeeding was also studied.
Material and methodsAt weaning, 60 male rats were assigned to two groups of 30 animals each: a control and an experimental group. Control rats were fed ad libitum with a balanced rodent diet. The experimental group received 80% of the diet consumed by the control group for 4 weeks. After 4 weeks of food restriction, the ND group was fed freely for 8 weeks. Ten rats from each group were sacrificed every 4 weeks for assays.
ResultsAt week 4, body weight and length were significantly diminished in the experimental group vs. the control group (p<0.001). No changes were observed in LHRH baseline release, pulse frequency or amplitude in the experimental group compared with the control group at any time. However, under glutamate stimulation, LHRH release was significantly higher in ND rats than in control rats at week 4 (p<0.05). Refeeding the ND group allowed the rats to reach overall growth and reproductive ability.
ConclusionsThe results of the present study suggest that the response to the facilitatory effect of glutamate on LHRH release in post-restricted ND rats is probably related to a lesser central nervous system maturation in relation to their chronological age. The adequate somatic growth and normal reproductive ability attained with refeeding suggest the reversibility of the two energetically costly processes compromised by global, mild and chronic food restriction.
El crecimiento es un proceso biológico complejo condicionado por factores genéticos1, nutricionales2, endocrinos3–6 y farmacológicos7, entre otros. De todos los factores condicionantes del crecimiento y del desarrollo del individuo, el factor nutricional es, probablemente, el de mayor influencia y por ende, variaciones cuali o cuantitativas en la dieta pueden desencadenar disfunciones metabólicas y/o neuroendocrinas con consecuencias negativas evidentes en los procesos de crecimiento y desarrollo corporales.
Desde comienzos de la década del 80, Lifshitz et al8–12 describieron una entidad clínica patológica conocida como enanismo por desnutrición (ED), un tipo de desnutrición crónica observada en niños y adolescentes, manifestada por un déficit de los índices antropométricos peso/edad y talla/edad con un peso/talla e indicadores bioquímicos de malnutrición dentro de límites normales. Es por esta razón que dichos niños no se presentan emaciados como comúnmente se observa en casos de desnutrición grave asociada a la pobreza13 o en trastornos de la alimentación, como la anorexia nerviosa14.
Si bien es sabido que la falta de disponibilidad del alimento es la causa más común de desnutrición en los países en desarrollo, el patrón de crecimiento del ED no necesariamente se observa en circunstancias relacionadas al hambre y a la pobreza10,12. Puede decirse, entonces, que el deterioro del crecimiento que presenta el ED podría ser la consecuencia de hábitos alimentarios inapropiados como el de la disponibilidad de alimento limitada.
El ED, enfermedad de origen nutricional sin evidencia primaria de endocrinopatía, de falla orgánica o de retardo mental15, puede ser el resultado de creencias socioculturales relativas al peso corporal y a la dieta. La obsesión de una sociedad que basa el éxito de un individuo en la imagen corporal, así como el temor a la hipercolesterolemia o al infarto de miocardio, pueden desencadenar en un ED. Niños o adolescentes que consumen dietas saludables para adultos, dietas hipocalóricas por energía global insuficiente o restringidas en grasas, dietas cuya composición es deficiente en ácidos grasos esenciales, minerales o de mala calidad proteica, pueden resultar en un ED11.
En nuestro laboratorio hemos descrito un modelo experimental de ED en ratas macho de destete, el cual recrea esta entidad clínica observada en niños que consumen dietas inapropiadas deficientes en la energía global necesaria para lograr una ganancia de peso corporal y un crecimiento longitudinal adecuados16.
A semejanza del ED humano, el modelo de rata ED presenta una disminución en la velocidad de ganancia de peso corporal proporcional a la disminución en la velocidad de crecimiento longitudinal, lo que hace no evidente un déficit del peso para la longitud.
En relación al perfil hormonal, en estudios previos realizados en nuestro laboratorio se observó que las concentraciones séricas de GH, IGF-I, LH, FSH y testosterona disminuyeron sensiblemente en el grupo ED tras la restricción, resultados compatibles con el retraso del crecimiento somático y del desarrollo puberal descritos en el presente modelo de estrés nutricional17. Sin embargo, no se observaron modificaciones en el contenido de hormona liberadora de la hormona luteinizante (LHRH) en el hipotálamo medio basal (HMB) de los animales ED respecto de sus controles. Dichos hallazgos no determinan la ausencia de inhibición de la secreción pulsátil de LHRH por la restricción de alimento. Las concentraciones séricas disminuidas de gonadotrofinas hipofisarias en los animales restringidos sugieren una disminución de la actividad del pulso generador del sistema neural LHRH17.
Debido a que existe un consenso general de que la pubertad se inicia cuando el pulso generador de LHRH incrementa su actividad18,19, y a que el inicio de la pubertad implica un cambio del patrón de secreción de gonadotrofinas hipofisarias, desde un tipo prepuberal, caracterizado por una actividad de las neuronas LHRH baja, a un patrón adulto de secreción de gonadotrofinas con una activación fásica y sincrónica de neuronas LHRH20, el propósito del siguiente estudio fue evaluar el patrón de secreción de LHRH a través de la liberación basal, la frecuencia y amplitud de pulsos del mismo en el HMB en el presente modelo animal de ED. Asimismo, dado que la pubertad es el resultado, al menos en parte, del desarrollo o de la activación de vías facilitadoras que controlan la secreción de LHRH21–24, se estudió la sensibilidad del sistema neural de LHRH en el HMB de ratas ED, a través de la secreción estimulada de dicho decapéptido frente a la administración de un aminoácido excitador como el glutamato.
Como último objetivo se estudió el efecto de la disponibilidad de alimento sobre el crecimiento somático y la capacidad reproductiva durante la realimentación de los animales ED.
Materiales y métodosAnimales de experimentaciónSe emplearon ratas macho de la cepa Wistar desde el destete (21–22 días de edad) provenientes del bioterio de la Cátedra de Bioquímica General y Bucal de la Facultad de Odontología de la Universidad de Buenos Aires. Los animales de experimentación se dividieron en 2 grupos: Control (C) y un grupo experimental (ED). Los animales se ubicaron en jaulas galvanizadas con piso de malla con el propósito de mantener las condiciones de higiene y de evitar la coprofagia. La temperatura ambiental del bioterio fue de 21±1°C y la humedad, del 50–60%. Se respetaron los ciclos de luzos-curidad para evitar alterar el ritmo de alimentación de los animales. Todos los experimentos fueron realizados cumpliendo las normas del «NIH Handbook on the Care and Management of Laboratory Animals» y aprobado por el Comité de Ética de la Universidad de Buenos Aires.
DietaLos animales de experimentación se alimentaron con una dieta balanceada para roedores, purina, presentada bajo la forma de cilindros prensados, cuya composición centesimal fue la siguiente: humedad: 6,20%, proteínas: 23,5%, grasas: 7,60%, cenizas: 6,30%, hidratos de carbono: 56,40%; lisina disponible: 5,5g/100g proteína. El grupo C recibió la dieta en condiciones de libre demanda durante todo el periodo experimental, la que cubrió el 100% del requerimiento energético total, mientras que ED recibió, por cada 100g de peso corporal, un 80% de la misma dieta que C, administrada diariamente desde el destete, durante 4 semanas. La realimentación del grupo ED se realizó con la misma dieta, administrada en condiciones de libre demanda, hasta alcanzar la longitud corporal de los animales controles de igual edad cronológica (aproximadamente 8 semanas). Durante todo el periodo experimental, ambos grupos recibieron agua en condiciones de libre demanda.
Diseño experimentalLos animales se distribuyeron al azar en 2 grupos: C y ED. Durante el periodo experimental se realizó el seguimiento del peso (P) y de la longitud (L) corporales. El consumo de alimento se registró cada 24h. A partir de los 40 días de edad, se controlaron diariamente los animales C y ED para observar la ocurrencia de separación balanoprepucial como signo de pubertad25 y estimar en cada grupo de animales, C y ED, la edad promedio de aparición.
Al destete (T0) y cada 4 semanas (T4, T8 y T12) se sacrificaron por decapitación 9–10 animales por grupo seleccionados al azar para la determinación de la secreción basal de LHRH en HMB; a T4, T8 y T12 se realizaron los estudios de frecuencia y amplitud de pulsos de LHRH en HMB; a T0 y T4, la determinación de la secreción estimulada de LHRH en HMB en presencia de glutamato.
Una vez finalizada la cuarta semana de realimentación, la capacidad reproductiva de las ratas macho ED fue probada evaluando la incidencia de preñez de ratas hembra sexualmente maduras. Las ratas C y ED se aparearon con hembras controles y se determinó el porcentaje de preñez. Asimismo, se evaluó el número de crías por hembra y al destete se determinaron el peso y la longitud corporales de los animales. Dichos parámetros permitieron calcular el puntaje Z-P/L y se compararon con las curvas normales de crecimiento para establecer el porcentaje de déficit respecto de la población de referencia de la misma edad26.
Evaluación del crecimiento- a)
Antropometría: se midieron P y L guardando un ayuno mínimo de 2h y máximo de 4h, previo a las mediciones. La frecuencia de medición de P y L fue diaria y semanal, respectivamente. P se midió utilizando una balanza Mettler PC 4000 con una precisión de ±1mg. Los animales se anestesiaron ligeramente por exposición a éter para la medición de L. Con los datos obtenidos se estableció la categoría antropométrica utilizando la curva percentilada de P/L y el cálculo del puntaje Z. Este último resulta de aplicar la siguiente fórmula: puntuación Z=(x–x1)/DE, donde X: mediana, X1: valor del sujeto en estudio y DE: desviación estándar del valor de la mediana. La puntuación Z expresa el valor de una puntuación relativa a la mediana y a la DE de una distribución de referencia26.
- b)
Ingesta dietética: la ingesta de dieta se midió diariamente con una balanza Mettler PC 4000 con una precisión de ±1mg. La medida de consumo de alimento se determinó por la diferencia de peso del comedero de 2 días consecutivos. Esta se expresó en g/100g de rata/d.
La LHRH se determinó por radioinmunoanálisis con un antisuero altamente específico provisto por Ayala Barnea (University of Texas Southwestern Medical Center, Dallas, TX, EEUU). La sensibilidad del ensayo fue de 0,2pg/tubo y la linealidad de la curva se mantuvo hasta los 100pg de LHRH.
Preparación del tejido para la determinación de la secreción de LHRHLa disección del HMB se efectuó mediante 2 incisiones transversales: una por detrás del quiasma óptico y otra por detrás del tallo pituitario, 2 incisiones sagitales ubicadas a 1mm de la línea media y una última incisión horizontal extendida entre ambas incisiones transversales.
Determinación de la liberación basal de LHRH del hipotálamo medio basalLos HMB se preincubaron durante 15min en un medio buffer de Krebs-Ringer cuya composición fue la siguiente: (mM) NaCl 118; KCl 4,7; MgCl2 1,2; NaH2PO4 1,0; CaCl2 2,5; EDTA-Na 0,004; dextrosa 11,1; NaHCO3 25,0; ácido ascórbico 0,11; pH 7,4. Posteriormente, se reemplazó el medio de preincubación por 0,5ml de medio fresco y se incubó durante 30min más. Todas las incubaciones se llevaron a cabo en un baño termostático tipo Dubnoff a 37°C y 50 ciclos por minuto, oxigenado con carbógeno (95% de O2 y 5% de CO2). Se separó el HMB del medio de incubación y se congeló este último a −20°C hasta la determinación de LHRH por radioinmunoanálisis.
Determinación de la frecuencia y amplitud de pulsos de LHRH del hipotálamo medio basalLos HMB se preincubaron durante 15min en un medio buffer de Krebs-Ringer cuya composición fue la siguiente: (mM) NaCl 118; KCl 4,7; MgCl2 1,2; NaH2PO4 1,0; CaCl2 2,5; EDTA-Na 0,004; dextrosa 11,1; NaHCO3 25,0; ácido ascórbico 0,11; pH 7,4. Posteriormente, se reemplazó el medio de preincubación por 0,5ml de medio fresco. Durante 3h se recolectó cada 7,5min el medio de incubación, el cual fue reemplazado por medio fresco. Todas las incubaciones se llevaron a cabo en un baño termostático tipo Dubnoff a 37°C y 50 ciclos por minuto, oxigenado con carbógeno (95% de O2 y 5% de CO2). Para determinar la vitalidad del tejido, inmediatamente posterior a la toma de la última muestra, el HMB se incubó durante 15min en 0,5ml de medio fresco con el agregado de K+ 45mM. Todas las muestras recolectadas se congelaron a −20°C hasta la determinación de LHRH por radioinmunoanálisis. La determinación de la liberación de LHRH del HMB durante 180min se estimó mediante el cálculo del área bajo la curva construida luego de la determinación de la frecuencia y la amplitud de pulsos de LHRH.
Determinación de la liberación estimulada de LHRH del hipotálamo medio basalLos HMB se preincubaron durante 15min en un medio buffer de Krebs-Ringer cuya composición fue la siguiente: (mM) NaCl 118; KCl 4,7; MgCl2 1,2; NaH2PO4 1,0; CaCl2 2,5; EDTA-Na 0,004; dextrosa 11,1; NaHCO3 25,0; ácido ascórbico 0,11; pH 7,4. Posteriormente, se reemplazó el medio de preincubación por 0,5ml de medio fresco con el agregado de 10mM de glutamato (Sigma, EEUU) y se incubó durante 30min más. Todas las incubaciones se llevaron a cabo en un baño termostático tipo Dubnoff a 37°C y 50 ciclos por minuto, oxigenado con carbógeno (95% de O2 y 5% de CO2). Se separó el HMB del medio de incubación y se congeló este último a −20°C hasta la determinación de LHRH por radioinmunoanálisis.
Análisis estadísticoLos resultados se expresaron como media±error estándar (ES). Los datos se analizaron mediante análisis de varianza (ANOVA). Las diferencias entre medias se determinaron por el ensayo de comparaciones múltiples de Student-Neuman-Keuls, considerando un nivel de significancia con un p<0,0527. Los análisis estadísticos se realizaron empleando un Graphpad Prism (Versión 3.0, Graphpad Software, San Diego, CA, EEUU).
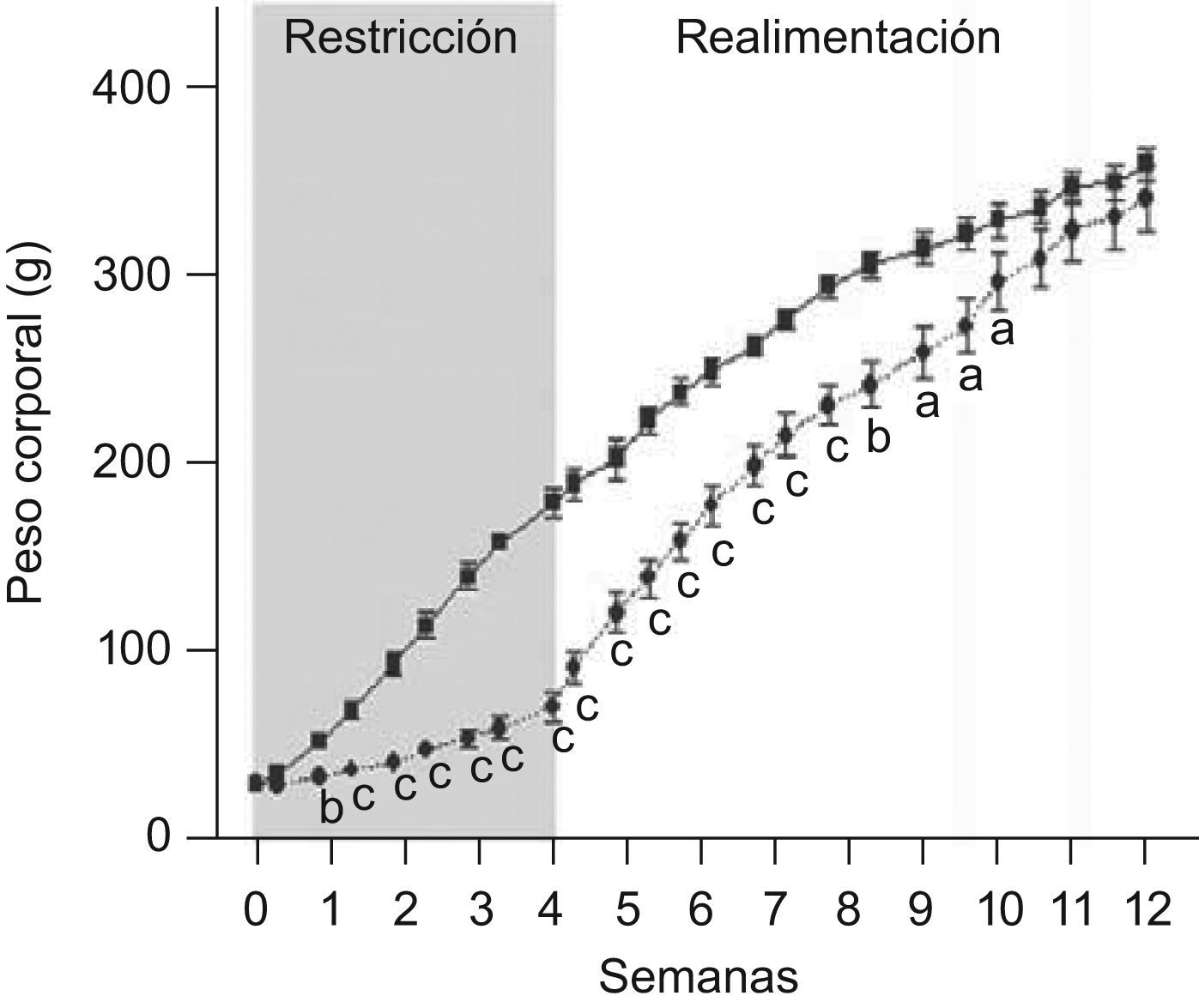
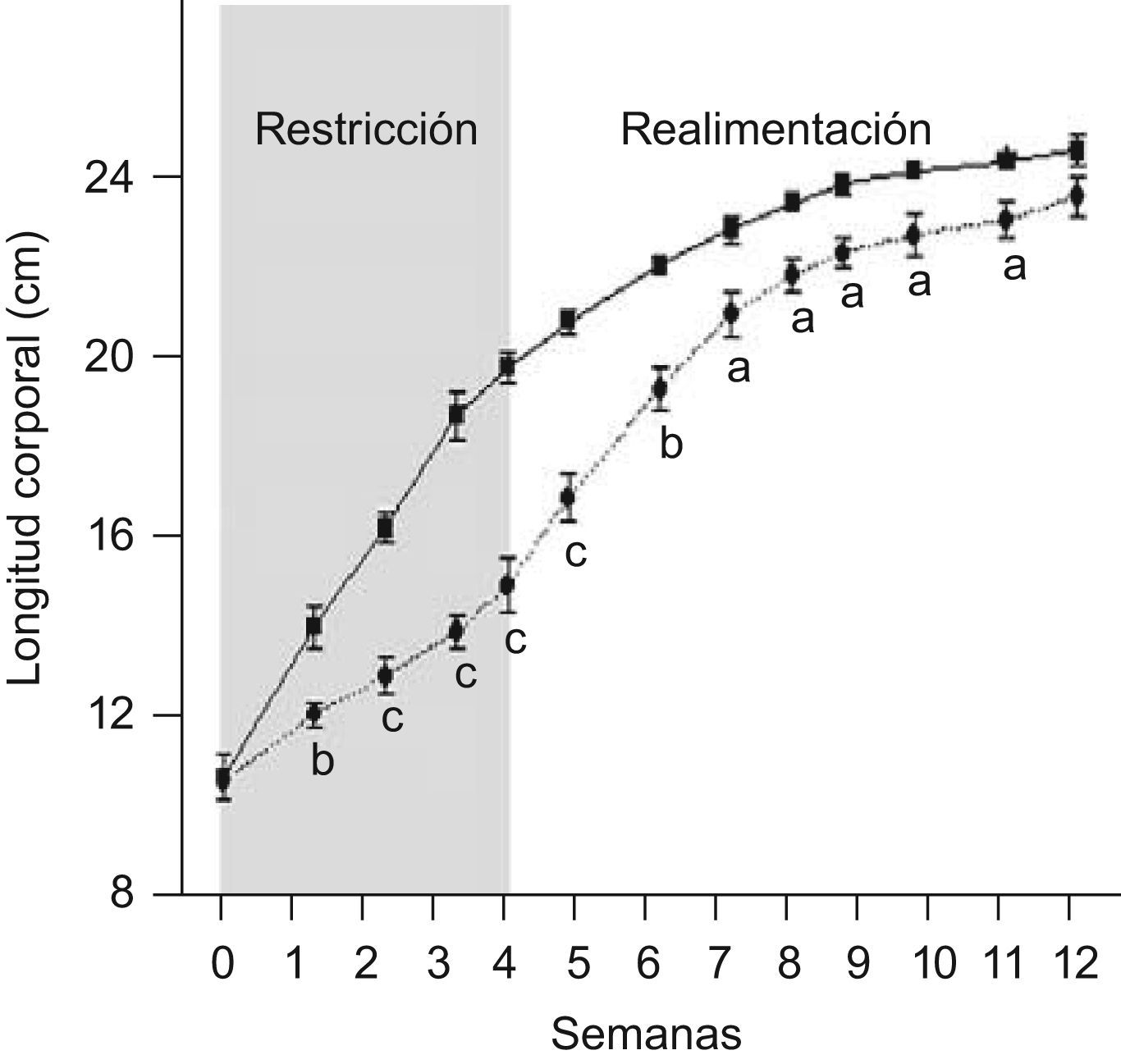
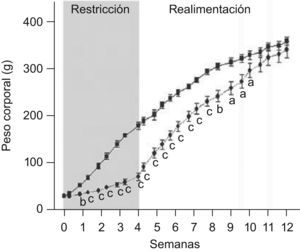
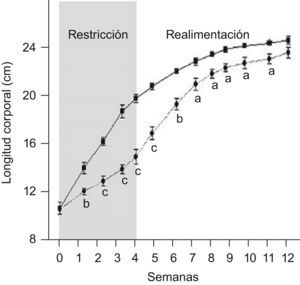
ResultadosEn las figuras 1 y 2 se muestran los perfiles de peso y de longitud corporales de ratas C y ED en función del tiempo, respectivamente. La restricción energética indujo una disminución altamente significativa (p<0,001) de la velocidad de crecimiento en el grupo ED respecto de C. A T4, el peso y la longitud corporales de los animales ED representaron un 40,6 y un 75,9%, respectivamente, al correspondiente de C. Se observó un crecimiento compensatorio en las ratas ED, con normalización de los parámetros antropométricos aproximadamente a las 7 semanas de realimentación.
Evolución del peso corporal de ratas C (–
▪–) y ED (– –¿– –) durante el periodo de restricción nutricional-realimentación. C: grupo control, ED: grupo experimental. Los valores representan la media±ES (n=10 animales/grupo). Las letras expresan diferencias significativas entre grupos: ap<0,05; bp<0,01; cp<0,001.
Evolución de la longitud corporal de ratas C (–
▪–) y ED (– –¿– –) durante el periodo de restricción nutricional-realimentación. C: grupo control, ED: grupo experimental. Los valores representan la media±ES (n=10 animales/grupo). Las letras expresan diferencias significativas entre grupos: ap<0,05; bp<0,01; cp<0,001.
En relación a la evolución del tamaño corporal, Z−P/L de los animales ED fue de −0,78±0,10, −0,60±0,15, −0,96±0,06, −0,67±0,17 en la primera, segunda, tercera y cuarta semana de depleción nutricional, respectivamente, cursando entre las categorías antropométricas de adecuado (−0,670
La edad promedio de ocurrencia de la separación balanoprepucial fue de 46,45±0,47 días para los animales control. La aparición de separación balanoprepucial en el grupo ED fue durante la etapa de realimentación, a los 51,85±0,71 días de edad, aproximadamente 5 días después de la edad de ocurrencia de la misma en los animales C de igual edad cronológica (p<0,001).
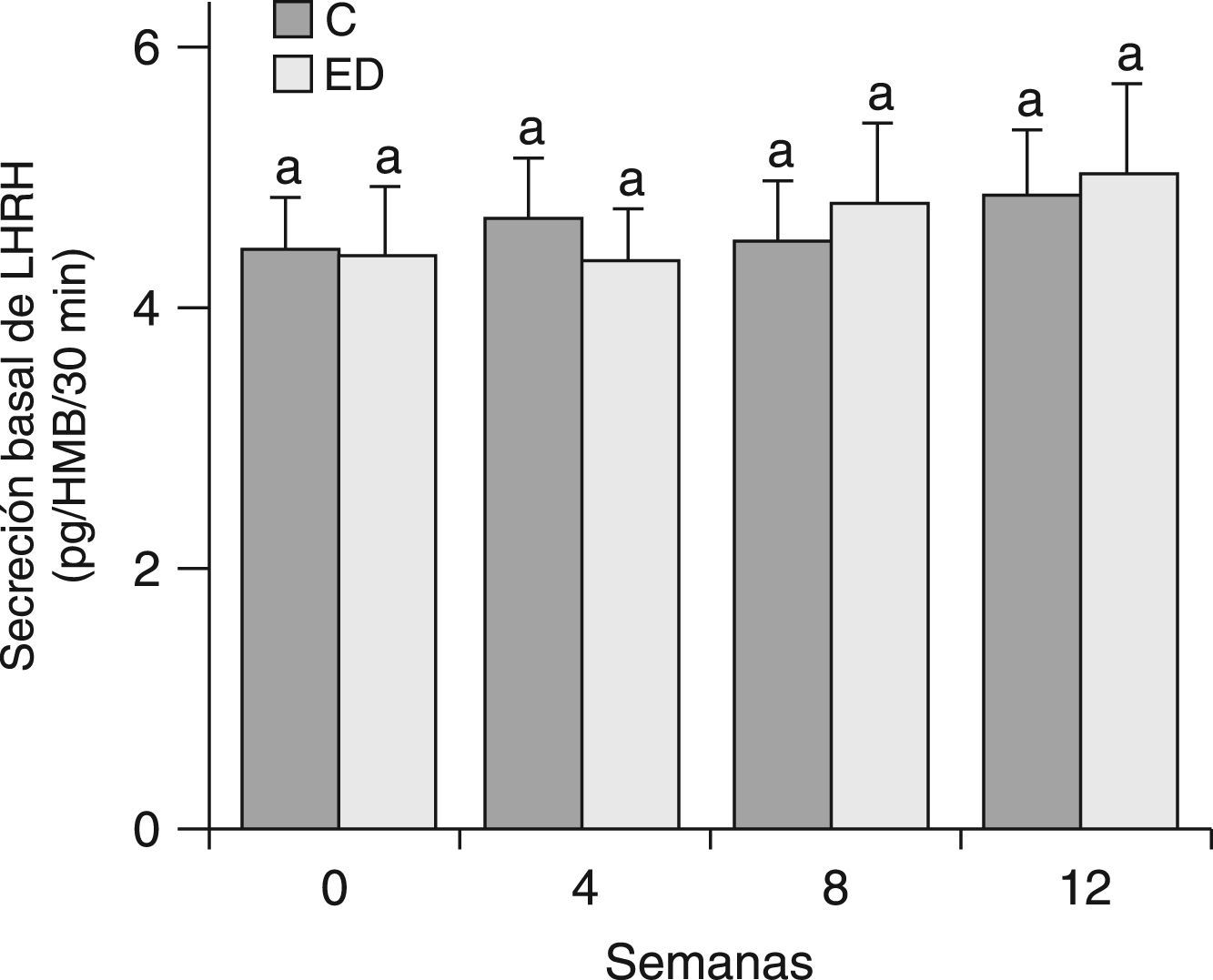
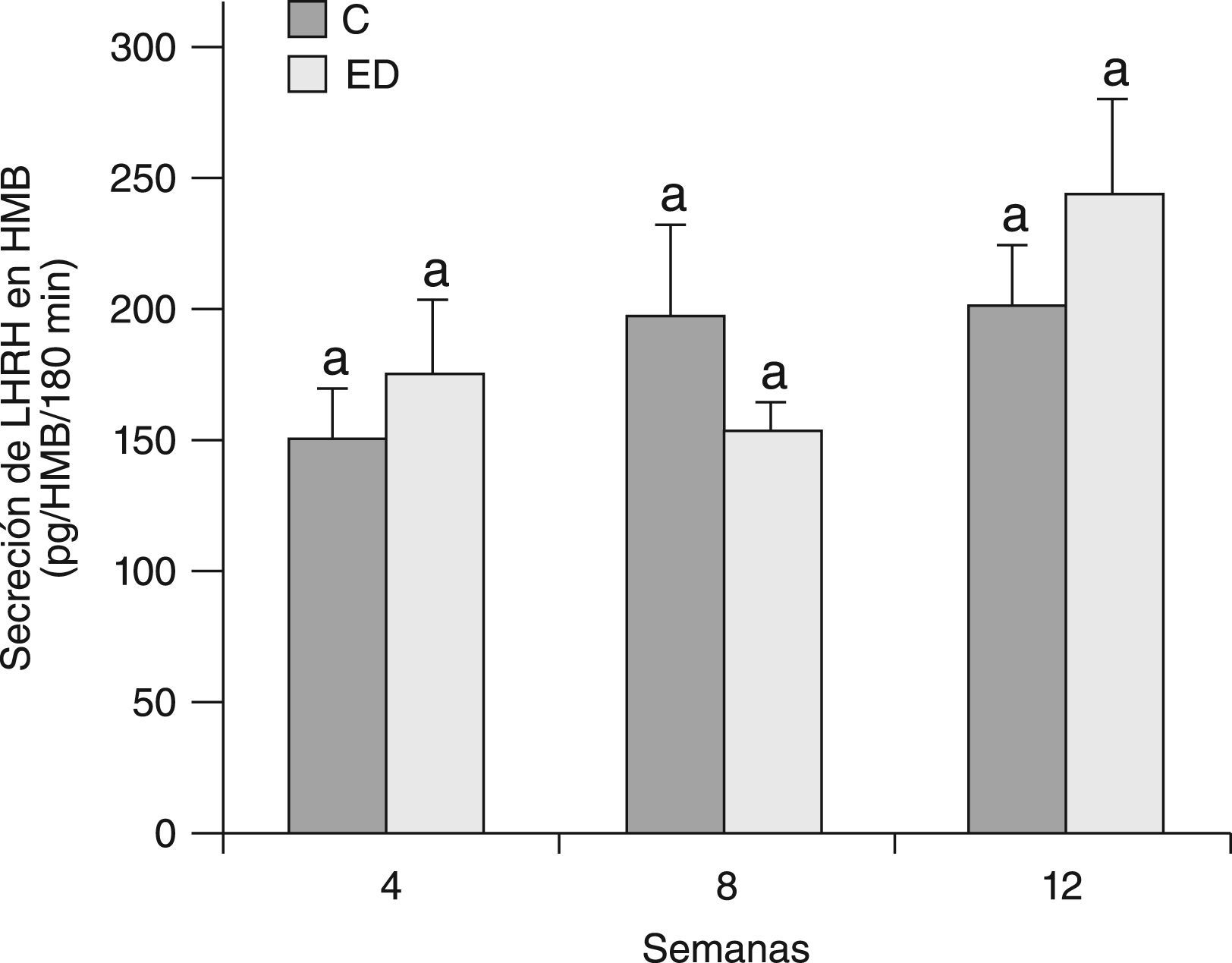
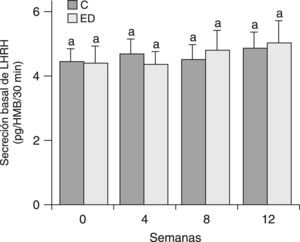
En la figura 3 se muestra la secreción basal de LHRH del HMB de ratas C y ED después de 30min de incubación en un medio buffer de Krebs-Ringer. Debido a que no se observaron diferencias significativas entre grupos en cada tiempo ni entre los tiempos estudiados, se determinó la secreción basal de LHRH del HMB por un tiempo más prolongado. En la figura 4 se muestra la secreción de LHRH del HMB durante 180min de ED frente a C desde el destete (T0) hasta el tiempo final (T12). No se observaron diferencias significativas entre grupos en cada tiempo, ni entre los tiempos estudiados.
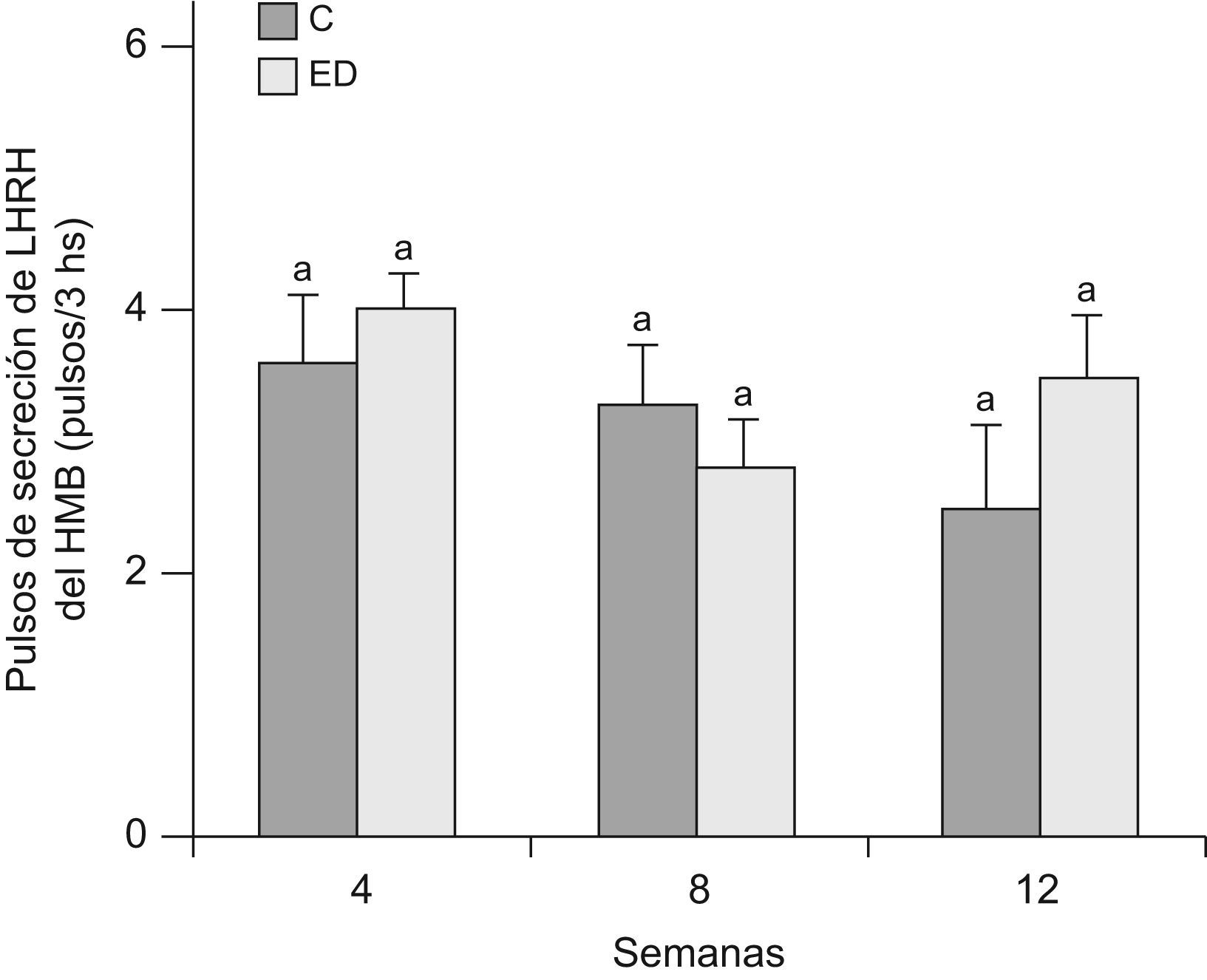
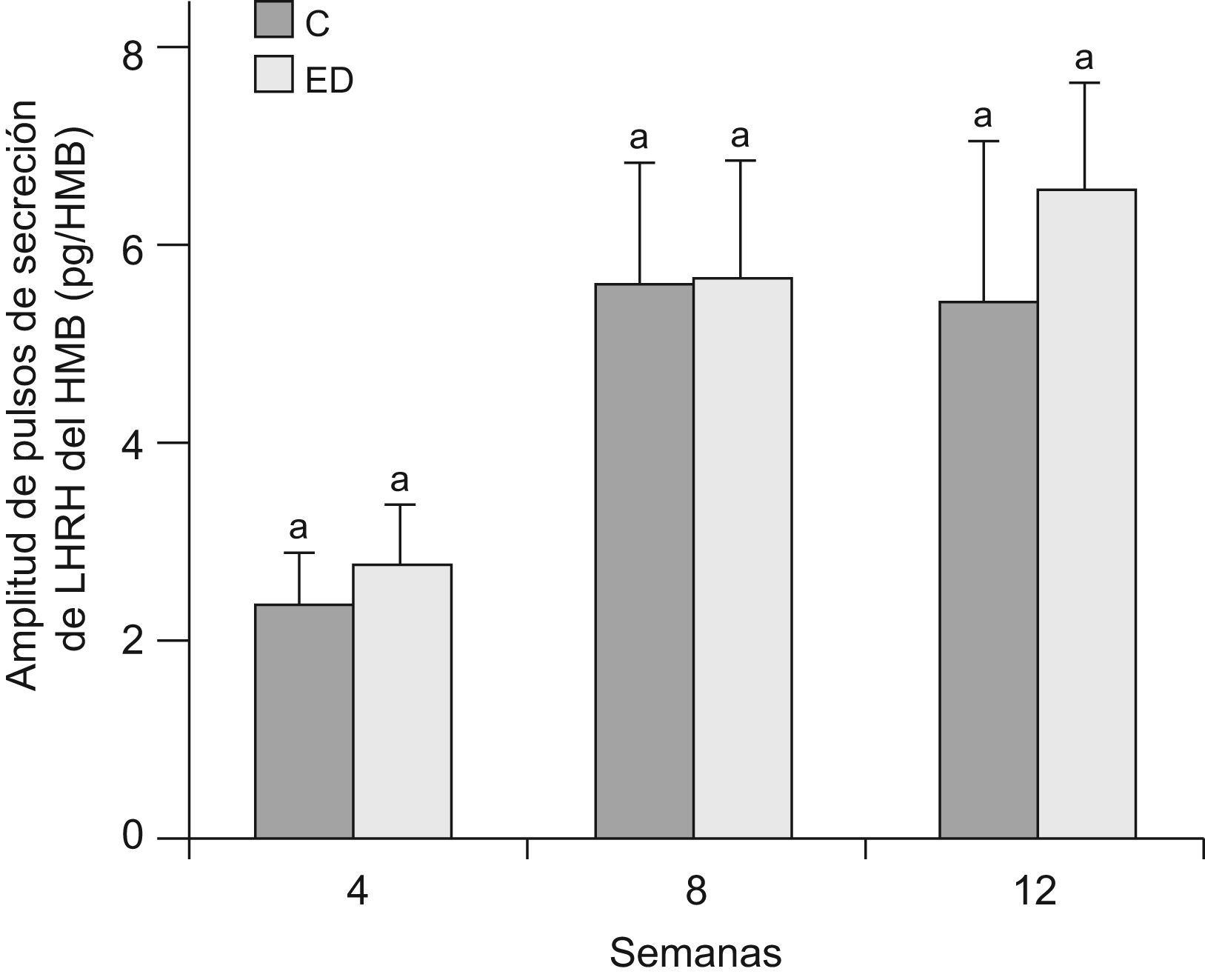
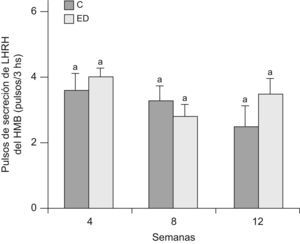
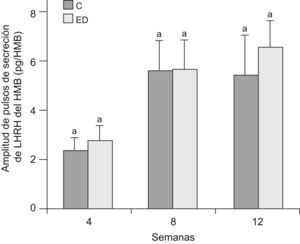
En la figuras 5 y 6 se muestran la frecuencia y amplitud de pulsos de LHRH del HMB, respectivamente, de ratas ED frente a C a T4, T8 y T12. No se observaron diferencias significativas entre grupos en cada tiempo, ni entre los tiempos estudiados en ninguno de los 2 parámetros considerados.
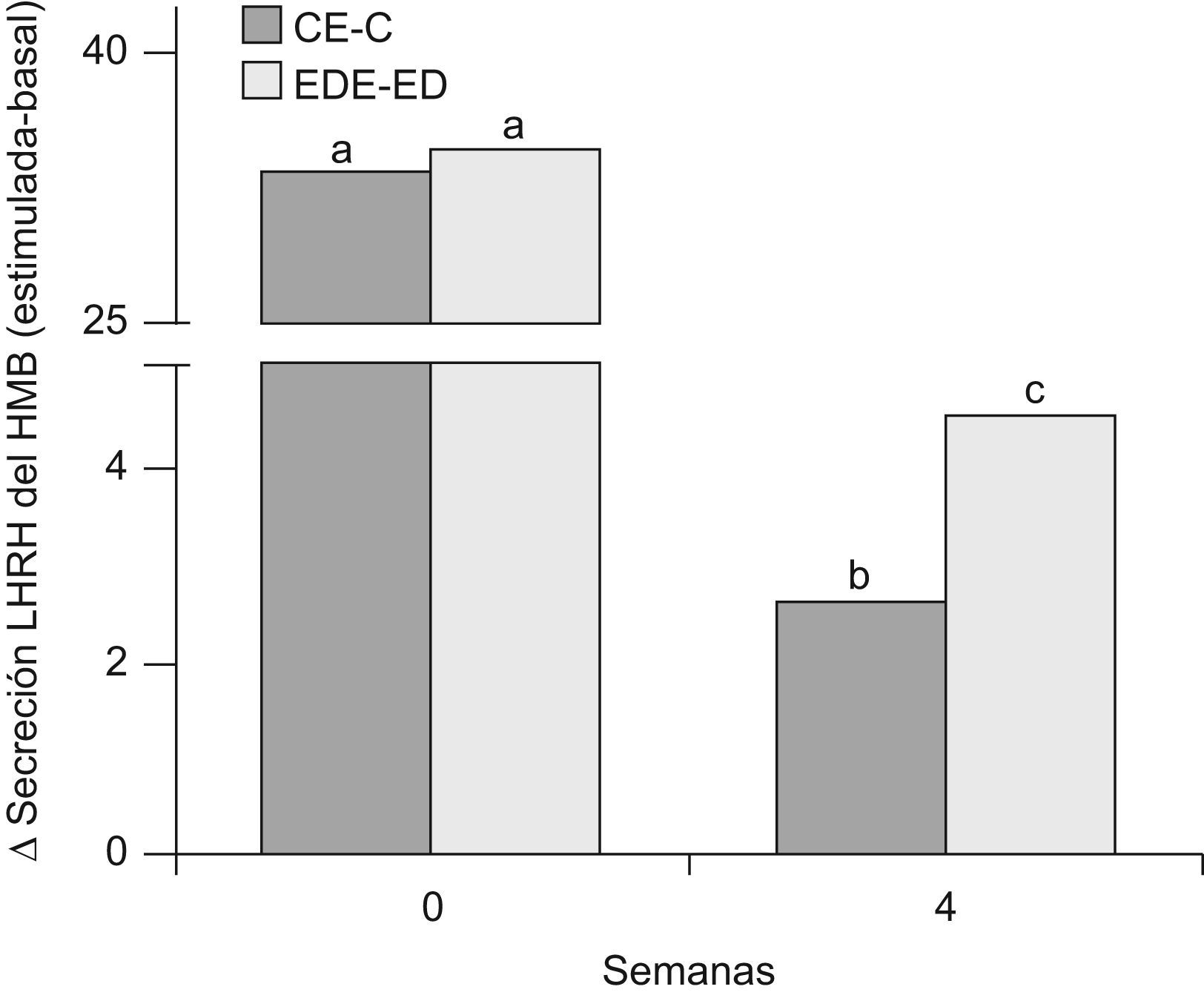
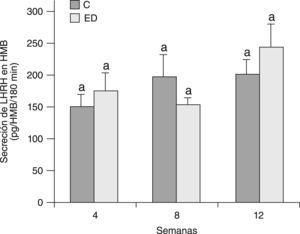
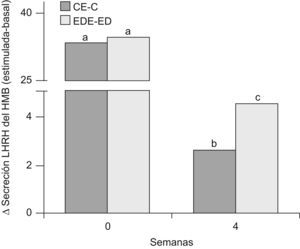
En la figura 7 se muestra la secreción de LHRH del HMB de ratas C y ED en presencia de glutamato, al inicio del periodo experimental (T0) y luego de 4 semanas (T4). A T0, no se observaron diferencias significativas en la secreción estimulada con respecto a la basal entre los grupos C y ED. A T4, la secreción estimulada-basal en los animales C y ED disminuyó significativamente respecto de T0 (p<0,05). Sin embargo, la respuesta secretoria de LHRH del HMB en presencia de glutamato fue significativamente mayor en ED frente a C luego de las 4 primeras semanas experimentales (p<0,05).
Secreción estimulada de LHRH en HMB de ratas C y ED en presencia de glutamato. C: grupo control, CE: grupo control estimulado, ED: grupo experimental y EDE: grupo experimental estimulado. n=10 animales/grupo. Letras diferentes expresan diferencias significativas entre grupos (p<0,05).
Finalizada la cuarta semana de realimentación, se evaluó la capacidad reproductiva de los animales ED respecto de C. Dicha capacidad fue observada a partir de los 77–79 días de edad, tiempo a partir del cual se consideró que los animales alcanzaron la madurez sexual, la cual fue evidenciada en estudios previos realizados en nuestro laboratorio por la recuperación de la actividad del eje hipotálamo-hipófiso-gonadal durante la realimentación de los animales ED17. El porcentaje de preñez fue del 100% para ambos grupos. La edad promedio en la que los animales C y ED preñaron a la rata hembra fue de 97,67±0,33 y 98,20±1,71 días, respectivamente. El promedio de crías por cada hembra fue de 15,67±1,85 y de 13,40±1,43 al ser apareadas con C y ED, respectivamente. No se observaron diferencias estadísticamente significativas entre animales ED y C.
DiscusiónA semejanza del ED humano, el modelo de rata ED descrito en nuestro laboratorio16 presenta una disminución en la velocidad de ganancia de peso proporcional a la disminución en la velocidad de crecimiento longitudinal. Durante la fase de depleción nutricional, los animales ED cursaron entre las categorías antropométricas de adecuado y de delgado. Dicho comportamiento es compatible con el patrón de crecimiento del ED observado en niños y adolescentes definido por los índices antropométricos del Wellcome Classification System28.
A pesar del efecto negativo de la restricción energética sobre el peso y la longitud corporales, se observó un crecimiento compensatorio completo durante la realimentación de los animales ED.
En estudios previos realizados en nuestro laboratorio observamos retraso puberal con disminución de las concentraciones séricas de LH, FSH, testosterona, sin cambios en el contenido de LHRH en HMB de animales ED17. Estos resultados son coincidentes con los obtenidos por Leonhardt et al quien observó que la restricción de alimento no modificó el contenido de ARNm para LHRH en el área preóptica hipotalámica de ratas macho, aunque sí disminuyó las concentraciones séricas de LH y de testosterona29.
En el presente estudio se observó que la secreción basal, la frecuencia y la amplitud de pulsos de LHRH del HMB no mostraron diferencias significativas entre los grupos ED y control en ninguno de los tiempos estudiados. Dichos resultados no determinan que las concentraciones séricas relativamente bajas de LH, FSH y testosterona observados en estudios previos17 en ratas ED tras restricción energética no se deba a una disminución de la pulsatilidad de LHRH como consecuencia de la restricción impuesta. Los hallazgos de Goto et al30 en relación a que la administración exógena de LHRH a ratas macho y hembra adultas, previamente restringidas en alimento, previenen los efectos de la desnutrición sobre la reproducción, sugieren que el retraso puberal descrito en el presente modelo ED17 podría ser el resultado de una disminución de la secreción pulsátil de LHRH. Otros autores muestran resultados inconsistentes respecto del efecto de la ingesta subóptima sobre la expresión del gen de LHRH y/o su liberación31,32.
Los diversos resultados observados en la literatura relativa a la expresión y a la secreción de LHRH podrían deberse a diferencias por especie, sexo, edad del modelo animal en estudio, grado y cronicidad del estrés impuesto, así como por diferencias metodológicas en las determinaciones in vivo e in vitro de LHRH.
El primer interrogante formulado en el presente estudio en relación a la pulsatilidad de LHRH fue corroborar la validez de dicho patrón de secreción en los animales controles, para luego evaluar dicho comportamiento en los animales ED.
Los trabajos realizados por Bourguignon et al33 en relación a la ontogenia de la secreción pulsátil de LHRH validan el comportamiento de las ratas controles del presente estudio. Dichos investigadores estudiaron la amplitud y la frecuencia de secreción de LHRH in vitro desde la vida fetal hasta la edad adulta en ratas macho Wistar. Los resultados mostraron una reducción progresiva de los intervalos interpulsos desde el nacimiento hasta la adquisición de un patrón adulto de frecuencia a los 21–25 días de edad, el cual se mantuvo constante en el tiempo. A su vez, observaron que la amplitud media de pulso de LHRH, si bien aumentó desde el periodo de vida neonatal temprana, no se incrementó significativamente durante el tiempo experimental evaluado.
Al igual que las observaciones de Bourguignon et al33, en el presente estudio se evidenció que la actividad del sistema LHRH en relación a la frecuencia y a la amplitud de secreción de pulsos no difirió en los animales controles en los tiempos estudiados. Semejantes resultados se observaron en los animales ED.
Podría decirse que al inicio del periodo experimental el sistema neuronal LHRH de las ratas C y ED presenta un patrón de actividad similar o compatible con el de un adulto y que sucesivos periodos de disminución e incremento de la secreción de LHRH se alternan hasta alcanzar un patrón adulto de pulsatilidad constante34.
Los estudios de Bourguignon et al21,24,33 enfatizan el hecho de que los cambios neuroendocrinos que conducen al inicio de la pubertad tienen lugar a una edad relativamente temprana en la vida de la rata, antes de las 3 semanas, sin cambios posteriores evidentes durante la pubertad. Sin embargo, los estudios realizados por Levine et al34 en ratas macho, con técnicas de microdiálisis e implantación de una cánula a nivel de la eminencia media, proveen la primera evidencia directa de un incremento peripuberal de la actividad del pulso generador de LHRH con el consecuente aumento de la secreción de gonadotrofinas asociado a la esteroideogénesis y a la adquisición de la madurez sexual. Dichos autores observaron un incremento en la frecuencia de secreción pulsátil de LHRH de aproximadamente el doble en ratas de 48–50 días de edad respecto de las de 45–47 días, las que luego alcanzaron el patrón de secreción de un adulto. Dichas observaciones sumadas a las del presente estudio sugieren que la alternancia de incrementos y disminuciones en la pulsatilidad de la LHRH durante el desarrollo puberal son consistentes con la idea de que, en la rata macho, la pubertad involucra el establecimiento progresivo de nuevos niveles de referencia en el control del eje gonadotrófico hasta alcanzar el patrón adulto de secreción de LHRH, de hormonas adenohipofisarias y de testosterona.
Ha sido extensamente estudiada la participación del glutamato y de sus agonistas N-metil-D-aspartato (NMDA) y kainato en el inicio de la pubertad. El glutamato es un aminoácido excitador que ha demostrado tener un efecto estimulatorio marcado sobre el eje reproductivo, en particular en la pubertad. Existe evidencia que demuestra que el glutamato, el NMDA y el kainato estimulan la secreción de LHRH en mamíferos inmaduros, así como la estimulación del receptor para NMDA resulta en pubertad precoz en ratas y en monos21–23,35,36. Los efectos estimulatorios de aminoácidos excitadores sobre la secreción de LHRH y/o LH no solo han sido estudiados en la rata 35,37–41, sino también en otras especies como el ratón42, la oveja43 y el mono36,44.
Los resultados del presente estudio relativos a la secreción de LHRH frente al agregado de un aminoácido excitador como el glutamato al medio de incubación sugieren que el sistema neural LHRH de las ratas ED es más inmaduro respecto de los animales C de igual edad cronológica, coincidente con las concentraciones séricas relativamente bajas de LH, FSH y de testosterona y el retraso puberal, observados en estudios previos en las ratas ED tras restricción energética17.
Los estudios de Urbanski y Ojeda35 relativos a la inducción de pubertad precoz en ratas y los de Plant et al36 en monos frente a la administración repetida de un secretagogo de LHRH, NMDA, sugieren que los cambios en la actividad del pulso generador de LHRH durante el desarrollo se deben, al menos en parte, a una reducción de la actividad de los receptores para NMDA con la edad. Es por este motivo que el incremento de la respuesta secretoria al efecto facilitatorio del glutamato sobre la secreción de LHRH en los animales ED tras restricción energética sugiere una mayor sensibilidad de las neuronas LHRH a dicho aminoácido excitador, probablemente relacionada a una menor madurez del SNC para su edad cronológica. Numerosos estudios avalan la hipótesis de que el proceso de maduración neuroendocrino hipotalámico responsable del inicio de la pubertad podría estar relacionado a un proceso más general de maduración del SNC caracterizado, al menos en parte, por una reducción progresiva de la actividad de receptores para aminoácidos excitadores. Este concepto es coincidente con los resultados obtenidos por otros autores, quienes concluyeron que la maduración de los receptores a aminoácidos excitadores en diferentes áreas del SNC se caracteriza por un pico de actividad durante las primeras semanas de vida posnatal con una subsiguiente reducción de dicha actividad hasta alcanzar un mínimo aproximadamente a la quinta semana de vida de la rata45–47.
Nuestros resultados son coincidentes con los obtenidos en estudios previos realizados en nuestro laboratorio en los que se observó una menor actividad noradrenérgica en hipotálamo anterior de animales ED48, área de mayor localización de los cuerpos neuronales LHRH de lo que resultaría el retraso puberal posiblemente asociado al efecto combinado de la disminución de los niveles séricos de esteroides sexuales y/o de leptina en el presente modelo de estrés nutricional.
El presente estudio sugiere que el estrés inducido por la restricción energética leve y crónica resulta en un patrón de actividad del sistema neuronal LHRH correspondiente a ratas inmaduras las que durante la realimentación alcanzarían un patrón adulto de pulsatilidad evidenciado por la recuperación de la capacidad reproductiva de los animales ED.
FinanciaciónEste trabajo fue subsidiado con fondos de la Universidad de Buenos Aires (Proyectos UBACyT O004).