El personal sanitario se considera un colectivo de riesgo por estar más expuesto a la enfermedad tuberculosa. La prueba de la tuberculina (PT) presenta el inconveniente del alto número de falsos positivos, sobre todo en pacientes vacunados con BCG. En los últimos años las técnicas denominadas IGRAS parecen mejorar estos inconvenientes, si bien plantean otros dilemas. Nuestro objetivo es analizar la concordancia de ambos test y realizar un estudio de coste-beneficio de las posibles estrategias diagnósticas.
Material y métodosEntre enero de 2010 y octubre de 2011 se estudió todo el personal sanitario del Hospital Universitari Mútua Terrassa de nueva incorporación y aquellos que tenían su revisión laboral. También se estudiaron trabajadores que habían sido contactos de pacientes ingresados con tuberculosis, sin aislamiento inicial. En todos los casos se realizó la PT y paralelamente un Quantiferon-TB Gold in Tube® (QF-G-IT) en sangre. Se consideró positiva una PT≥10mm y un QF-G-IT>0,35IU/ml. Se descartó enfermedad tuberculosa en todos los profesionales mediante radiología de tórax. Se hizo un estudio de coste beneficio de 3 estrategias posibles de estudio de la infección latente tuberculosa (ILT).
ResultadosSe estudiaron 226 profesionales sanitarios, con una media de edad de 30,65±16años. Cuarenta y cuatro (19,4%) presentaban vacuna con BCG, y en 8 (3,5%) se desconocía. La PT fue positiva en 33 (14,6%) casos y el QF-G-IT en 17 (7,5%). En 15 casos ambos valores de la PT y del QF-G-IT fueron positivos y coincidentes. En 18 (8%) profesionales la PT fue positiva, con un valor de QF-G-IT negativo. La concordancia entre ambas pruebas fue del 91%, con un kappa de 0,55. En vacunados, la concordancia fue del 70,5%, con un kappa de 0,33, mientras que en no vacunados fue del 98,9%, con un kappa de 0,65. La estrategia de cribado de la ILT más económica fue la basada en la PT, pero seguida muy de cerca por la estrategia basada en la PT con reconfirmación de los positivos con QF-G-IT, que fue la que mostró un mejor coste-beneficio ya que reduce profilaxis innecesarias.
ConclusionesEl QF-G-IT parece ser una técnica adecuada en la detección de la ILT y permite detectar los falsos positivos de la PT debidos a la vacuna con BCG. En este colectivo el QF-G-IT podría ser la prueba idónea para detectar a los realmente infectados y evitar así quimioprofilaxis innecesarias. La estrategia que mostró ser más coste-beneficio fue la basada en la PT con reconfirmación de los casos positivos mediante QF-G-IT.
Healthcare workers (HW) are considered a risk group for exposure to tuberculosis. Screening for latent tuberculosis infection (LTBI) is mandatory in all HW. The Tuberculin test (TT) has been used up until now for LTBI screening, but gives a high number of false positives, especially in patients vaccinated with BCG. Diagnostic methods based on detection of specific gamma interferon (IGRA) have recently appeared on the market in order to improve these drawbacks, but pose other dilemmas. The aim of this study is to determine the agreement between the two types of test and to carry out a cost-benefit study of the possible diagnostic strategies.
Material and methodsAll newly hired HW by the Hospital Universitari Mútua Terrassa between January 2010 and October 2011 we were included in the study, as well as those who had their occupational review. Workers who been in contact with patients admitted with tuberculosis before the initial isolation were also tested. In all cases a parallel TT and serum QuantiFeron-TB Gold-in-Tube® (QF-G-IT) assays were performed. TB disease was ruled out in all professional by chest X-ray. The TT was considered positive when it was equal to or more than 10mm and if the QF-G-IT was 0.35IU/mL. A cost-effectiveness analysis was designed with three possible strategies to detect LTBI in order to find the one with the best cost-benefit.
ResultsA total of 226 HW were studied, with a mean age 30.65±16, of whom 44 (19.4%) had previous BCG vaccination history, and 8 (3.5%) unknown. The TT was positive in 33 (14.6%) cases and the QF-G-IT in 17 (7.5%). The values of the TT and QF-G-IT were both positive in 15 cases. In 18 (8%) The TT was positive in 18 (8%) of cases with a negative QF-G-IT value. The agreement between the two tests was 91%, with a Kappa of 0.55. In vaccinated cases, the correlation was 70.5%, with a Kappa of 0.33, while in unvaccinated it was 98.9% with a Kappa of 0.65. The cheapest screening strategies for LTBI diagnosis were those based on TT, but followed closely by the strategy based on TT with reconfirmation of positives with QF-G-IT.
ConclusionsQF-G-IT seems to be a very sensitive technique to detect LTBI and allows false positives due to TT to be detected, particularly in BCG vaccinated HW. In this group QF-G-IT could be the ideal test to detect truly infected staff, and avoid unnecessary chemoprophylaxis. The most cost-benefit strategy was those based in TT with reconfirmation or rejection of positive cases by QF-G-IT.
España continúa siendo uno de los países con mayor prevalencia e incidencia de tuberculosis dentro de Europa1-4. Estos pacientes tienen un contacto estrecho con el personal sanitario, ya sea en la asistencia primaria o en el ámbito hospitalario5,6. En ocasiones, el diagnóstico de la enfermedad se realiza después de días de ingreso, sin medidas de aislamiento, con el aumento de riesgo de contagio para el personal sanitario7-9.
El personal sanitario, según las recomendaciones de la OMS, debe seguir controles periódicos de detección de la infección latente tuberculosa (ILT), con el objetivo de realizar un diagnóstico precoz y descartar enfermedad activa9-11. En el Hospital Universitari Mútua Terrassa (HUMT) se realiza el cribado de ILT mediante la prueba de la tuberculina (PT) a todo trabajador sanitario en el estudio de salud inicial. En los últimos 10años se realizaron un total de 10.912 revisiones y se encontraron 394 trabajadores sanitarios con PT positiva.
El cribado de la ILT en el personal sanitario se ha realizado durante décadas mediante la PT considerando positivas medidas iguales o superiores a 10mm12,13, aunque algunas guías recientes sugieren la positividad por encima de los 5mm, en contactos frecuentes o convivientes no vacunados. La PT presenta algunas desventajas generales en el diagnóstico de la ILT, y otras particulares en el colectivo de trabajadores sanitarios. El principal inconveniente en la población general es la reacción cruzada de la PT con los antígenos vacunales (bacilo de Calmette-Guerin), que origina más número de positivos de los realmente infectados14,15. Esta misma reacción cruzada se puede producir frente a antígenos de otras micobacterias no tuberculosas, con los consiguientes posibles falsos positivos de la PT16,17. Además, la PT precisa de 2 visitas por parte del paciente: una para la intradermoinoculación y otra a las 72h para la lectura.
Los inconvenientes, en el caso concreto del personal sanitario, se derivan de la repetición de los estudios de forma periódica. Sabemos que la realización de sucesivas PT en el tiempo puede acabar produciendo una sensibilización a los antígenos de la misma (en presencia de ILT antigua, vacuna con BCG o con reacción cruzada con antígenos de micobacterias no tuberculosas ambientales), que finalmente pueden dar un falso resultado positivo18,19.
Por todo ello, la PT, mal considerada como gold standard hasta hace pocos años, se ha mostrado como una técnica útil pero no siempre fiable y con importantes inconvenientes.
Una prueba que permitiese eliminar los inconvenientes de la PT pero conservando una buena sensibilidad y especificidad en el diagnóstico de la ILT eliminaría estos inconvenientes. Esto parece haberse conseguido, en parte, con el desarrollo de las denominadas técnicas IGRAS (interferon-γ release assays), que detectan la liberación de interferón-γ en respuesta a antígenos específicos de M. tuberculosis complex20-24 (ESAT-6, CFP-10 y TB7.7). Las nuevas técnicas de diagnóstico in vitro de la tuberculosis ofrecen importantes ventajas sobre la PT: evitan la subjetividad de la medida de la PT, los resultados pueden estar disponibles en 24h, la determinación puede repetirse las veces que sea necesario y evita la visita de lectura25,26. Además, no presenta reacción cruzada con la vacuna BCG, y ha demostrado en estudios previos tener una buena especificidad en el diagnóstico de la ILT.
Las posibles desventajas de las técnicas IGRAS son fundamentalmente: se ven afectadas por la inmunodepresión, la incidencia de valores indeterminados (aunque es baja la incidencia fuera de pacientes inmunodeprimidos), el ocasional viraje a positivo o negativo, la significación de los valores positivos pero cercanos al punto de corte, el posible aunque raro efecto booster que la PT puede suponer en el resultado de Quantiferon TB Gold In Tube® (QF-G-IT), y especialmente el coste económico27-31.
En nuestro hospital hemos realizado un estudio comparativo entre la PT y el QF-G-IT en personal sanitario con objeto de analizar la concordancia entre las 2 pruebas y determinar la mejor estrategia de cribado de la ILT, teniendo en cuenta el coste económico de las mismas.
Material y métodosEntre enero de 2010 y octubre de 2011 se estudió todo el personal sanitario del HUMT de nueva incorporación y aquellos que tenían su revisión laboral. En todos los casos se realizó la PT y, paralelamente, un QF-G-IT.
Así mismo se incorporó en el estudio el personal laboral relacionado con cualquier caso de tuberculosis diagnosticado en el hospital sin las adecuadas medidas de aislamiento. Se eliminaron los casos que tenían una PT previa positiva y/o que hubieran tomado tratamiento de la ILT.
Los procedimientos para la realización de dichas técnicas se explican a continuación:
• PT. El test cutáneo de tuberculina fue realizado siempre por las mismas personas, expertas en lectura de la PT. A cada trabajador se le administró 0,1ml de tuberculina PPD Evans 2UT del lote RT-23 por vía intradérmica, en la cara anterior del antebrazo. Se comprobó que la inyección causara un habón de 6 a 10mm de diámetro. La lectura de la PT (diámetro transversal) se realizó a las 72h utilizando una regla de medición estándar, valorando la induración. Se registró el tamaño de la induración en milímetros y la presencia de vesículas, necrosis o linfangitis. Se consideró positiva toda induración con un diámetro transversal igual o superior a 10mm tanto para sujetos vacunados como no vacunados32. Se decidió esta cifra de acuerdo con otros autores12,13 y por tener una proporción significativa de pacientes vacunados. La mayoría de casos fueron estudios de salud sin contacto conocido, y en el caso de trabajadores contactos de pacientes ingresados con tuberculosis, no se puede considerar este contacto como conviviente o frecuente estrictamente, por lo que se ha mantenido el valor de 10mm.
• QF-G- IT. Se utilizó la prueba Quantiferon TB Gold In Tube® de Laboratorios Cellestis (Cellestis Ltd; Carnegie, VIC, Australia). Los tubos para esta prueba se almacenaron en nevera. Se utilizaron 3 tubos por paciente (antígeno, control negativo y mitógeno) y se extrajo 1ml de sangre para cada tubo. Se trasladaron al laboratorio de Microbiología, donde fueron incubados a 37°C durante 24h y posteriormente centrifugados para separar el plasma. Las muestras de plasma se almacenaron a −70°C hasta poder realizar el análisis (28 muestras procesadas al mismo tiempo), que es la cantidad máxima analizable en una placa de ELISA. Para el cálculo e interpretación de los resultados se utilizó el software específico para QF-G-IT. El punto de corte para interpretar un resultado como positivo fue obtener 0,35UI/ml. Un resultado indeterminado se considera cuando no se produce respuesta tras el estímulo de un mitógeno y tampoco de los antígenos específicos de MT.
Se descartó enfermedad activa en todos los profesionales con algún resultado positivo mediante radiología de tórax e interrogatorio clínico.
Las variables recogidas al inicio del estudio fueron la edad, el sexo, la categoría laboral, el tiempo que llevaba trabajando en el hospital, la planta de hospitalización o bien el área de trabajo, el país de origen de los trabajadores, la presencia o ausencia de vacuna con BCG, el antecedente de PT previo, las comorbilidades y los síntomas sugestivos de tuberculosis.
Estudio económico de ambas técnicasSe hizo un cálculo unitario de las técnicas propiamente. En el caso de la PT se tuvieron en cuenta, además de los costes del material fungible utilizado, los relacionados con el coste proporcional (en base al precio/hora trabajo) de la enfermera encargada de la realización de la técnica y de la lectura de la técnica. En el caso del QF-G-IT se tuvo en cuenta el gasto de material fungible de la técnica y el coste proporcional (precio/hora trabajo) del técnico que la realiza. Finalmente, para ambas técnicas se tuvieron en cuenta el coste proporcional (precio/hora trabajo) cuando el trabajador sanitario se ausenta de su puesto de trabajo durante la inoculación y la lectura (en el caso de la PT) o bien de la extracción sanguínea (en el caso del QF-G-IT). Se hizo un cálculo medio de 15min para cada uno de estos procesos. Para ambas técnicas se tuvo también en cuenta el coste de la profilaxis. El estudio económico fue validado por el centro de costes (departamento de compras y procedimientos) del HUMT.
Este estudio recibió el consentimiento del CEIC del centro (Ref. 24.2009). Todos los participantes firmaron el consentimiento informado.
La fuente de financiación correspondió a la beca 2009 de la Fundació per la Investigació i la Docència del HUMT.
Modelos de estudio de la ILT. Análisis de costesSe plantearon 3 modelos de estudio de la ILT: el primero basado exclusivamente en la PT; el segundo, exclusivamente en la determinación de QF-G-IT, y el tercero (o estrategia mixta) consistía en la realización de la PT en todos los casos con reconfirmación de los positivos mediante QF-G-IT. Se realizó un estudio económico completo de cada uno de los modelos, considerando tanto el material fungible como los gastos laborales de la realización de los tests y del tiempo de ausencia de su puesto de trabajo del personal laboral implicado.
Se entendió coste-beneficio como la relación del coste promedio de una intervención en salud y el beneficio promedio de la misma.
Análisis estadísticoLa comparación de variables cuantitativas entre los grupos de estudio se realizó mediante la prueba de Mann Whitney para muestras independientes. Para comparar los datos categóricos, se realizó la prueba de Chi cuadrado (χ2). Un valor de probabilidad inferior a 0,05 fue considerado estadísticamente significativo.
ResultadosSe estudiaron 226 profesionales sanitarios, con una media de edad de 30,65±16años. El 78,3% fueron mujeres, el 35% enfermeras; el 22,5% médicos, el 16,4% auxiliares de enfermería y el 25,2% camilleros.
Respecto al antecedente de vacunación con BCG, 44 (19,4%) presentaban vacuna con BCG, y en 8 (3,5%) se desconocía. El antecedente de vacunación estaba directamente relacionado con el hecho de ser trabajadores nacidos fuera de España. En este sentido, 181/226 (80%) eran de nacionalidad española, 35/226 (15,5%) eran procedentes de América Latina, y el resto se dividía entre el Magreb y la Europa del Este.
Los servicios de procedencia de los profesionales fueron: el 41% procedía de plantas de hospitalización, el 19% de centros sociosanitarios, el 9,7% de diferentes gabinetes de exploraciones, el 7,5% de diferentes servicios de soporte del hospital, el 7% de atención primaria, el 5,3% de salud mental, y el resto procedían de quirófano, consultas externas y rehabilitación.
Un total de 119/226 (52,6%) tenían antecedentes de realización de alguna PT previa negativa. En cuanto a la comorbilidad, 4/226 (1,7%) eran diabéticos.
Del total de la muestra, en 190 (84%) ambos resultados, la PT y el QF-G-IT, fueron negativos. De los 193 casos con PT negativa, en 190 (98,4%) el QF-G-IT fue también negativo, y solo se registraron 2 pacientes que tuvieron un resultado de QF-G-IT positivo. Solo hubo un caso indeterminado.
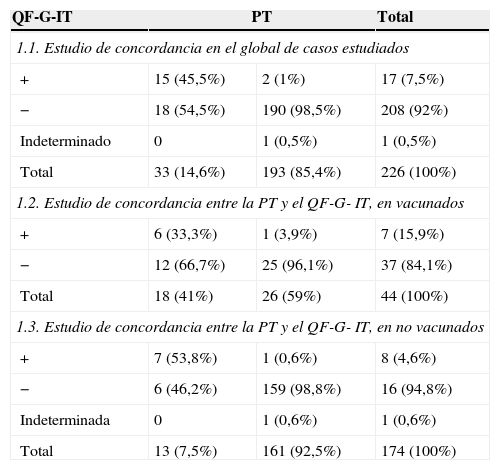
La PT fue positiva en 33 (14,6%) casos y el QF-G-IT en 17 (7,5%). En 15 casos ambos valores de la PT y del QF-G-IT fueron positivos. En 18 (8%) profesionales la PT fue positiva con un valor de QF-G-IT negativo. La concordancia entre ambas pruebas fue del 91%, con un kappa de 0,55.
En la tabla 1 se exponen los resultados de la PT y del QF-G-IT en el global de la población estudiada (tabla 1.1) y según si los casos estaban (tabla 1.2) o no vacunados (tabla 1.3). También se realizó el estudio de concordancia en dependencia de si existía vacuna con BCG o no. Los datos obtenidos se analizan a continuación.
Resultado de la PT y QF-G-IT en el total de la población estudiada y por grupos (vacunados y no vacunados)
| QF-G-IT | PT | Total | |
|---|---|---|---|
| 1.1. Estudio de concordancia en el global de casos estudiados | |||
| + | 15 (45,5%) | 2 (1%) | 17 (7,5%) |
| − | 18 (54,5%) | 190 (98,5%) | 208 (92%) |
| Indeterminado | 0 | 1 (0,5%) | 1 (0,5%) |
| Total | 33 (14,6%) | 193 (85,4%) | 226 (100%) |
| 1.2. Estudio de concordancia entre la PT y el QF-G- IT, en vacunados | |||
| + | 6 (33,3%) | 1 (3,9%) | 7 (15,9%) |
| − | 12 (66,7%) | 25 (96,1%) | 37 (84,1%) |
| Total | 18 (41%) | 26 (59%) | 44 (100%) |
| 1.3. Estudio de concordancia entre la PT y el QF-G- IT, en no vacunados | |||
| + | 7 (53,8%) | 1 (0,6%) | 8 (4,6%) |
| − | 6 (46,2%) | 159 (98,8%) | 16 (94,8%) |
| Indeterminada | 0 | 1 (0,6%) | 1 (0,6%) |
| Total | 13 (7,5%) | 161 (92,5%) | 174 (100%) |
Kappa = 0,56; p<0,0001.
Kappa = 0,33; p<0,01.
Kappa=0,65; p<0,0001
En vacunados, la concordancia fue del 70,5%, con un kappa de 0,33. De los 44 vacunados, 12 (27,3%) presentaron PT positiva y QF-G-IT negativo, y un caso mostró QF-G-IT positivo y PT negativa. En la tabla 1.2 se muestran los resultados de la PT y del QF-G-IT en población vacunada.
Pacientes no vacunadosDe los 174 no vacunados, en 159 (91,4%) ambas pruebas fueron negativas y en 6 (3,4%) la PT fue positiva con QF-G-IT negativo. En un caso el QF-G-IT fue positivo con PT negativa. En la tabla 1.3 se expresan los resultados de la PT y del QF-G-IT en los pacientes no vacunados. La concordancia entre ambas técnicas fue del 98,9%, con un kappa de 0,65.
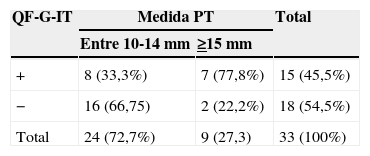
Finalmente se realizó un análisis de la concordancia de PT y QF-G-IT según el tamaño de la PT positiva: inferior a 15mm o bien igual o superior a 15mm. Se observó que de los 24 PPD de entre 10 y 15mm, en 16 casos (66,8%) el QF-G-IT fue negativo, y de los 9 PPD>15mm, en 2 casos (22,2%) el QF-G-IT fue negativo (concordancia del 22,3%, kappa 0,10). Estos datos se expresan en la tabla 2.
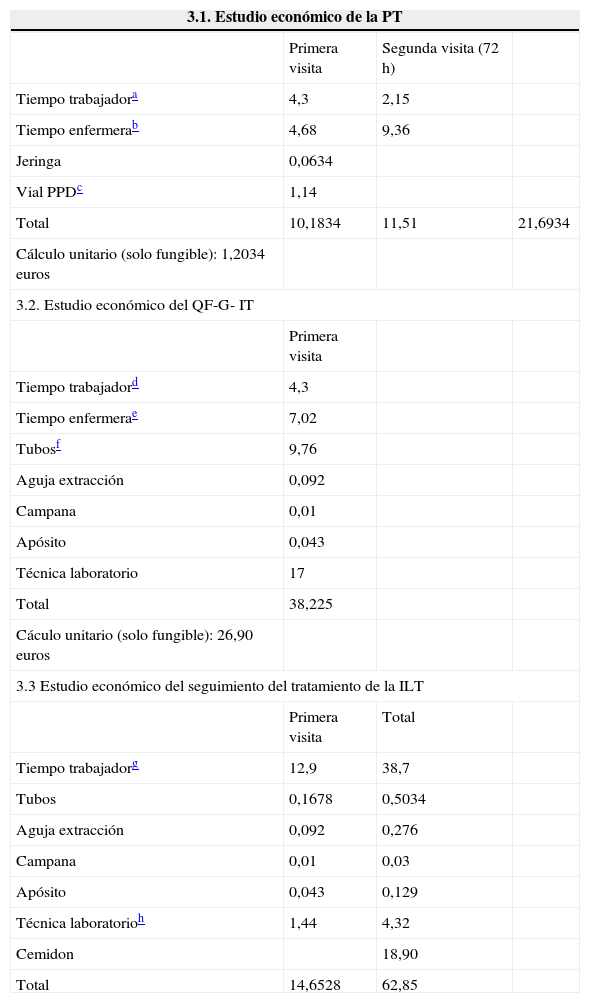
Estudio económico• PT. Según los parámetros planteados, el coste por unidad de la realización y lectura de la PT es de 21,70euros. En la tabla 3.1 se especifica, desglosado, el valor de los diferentes conceptos que intervienen en el precio final.
Estudio económico de la PT y del QF-G- IT
| 3.1. Estudio económico de la PT | |||
|---|---|---|---|
| Primera visita | Segunda visita (72h) | ||
| Tiempo trabajadora | 4,3 | 2,15 | |
| Tiempo enfermerab | 4,68 | 9,36 | |
| Jeringa | 0,0634 | ||
| Vial PPDc | 1,14 | ||
| Total | 10,1834 | 11,51 | 21,6934 |
| Cálculo unitario (solo fungible): 1,2034 euros | |||
| 3.2. Estudio económico del QF-G- IT | |||
| Primera visita | |||
| Tiempo trabajadord | 4,3 | ||
| Tiempo enfermerae | 7,02 | ||
| Tubosf | 9,76 | ||
| Aguja extracción | 0,092 | ||
| Campana | 0,01 | ||
| Apósito | 0,043 | ||
| Técnica laboratorio | 17 | ||
| Total | 38,225 | ||
| Cáculo unitario (solo fungible): 26,90 euros | |||
| 3.3 Estudio económico del seguimiento del tratamiento de la ILT | |||
| Primera visita | Total | ||
| Tiempo trabajadorg | 12,9 | 38,7 | |
| Tubos | 0,1678 | 0,5034 | |
| Aguja extracción | 0,092 | 0,276 | |
| Campana | 0,01 | 0,03 | |
| Apósito | 0,043 | 0,129 | |
| Técnica laboratorioh | 1,44 | 4,32 | |
| Cemidon | 18,90 | ||
| Total | 14,6528 | 62,85 | |
Incluye traslado (10 min) en la primera visita y tiempo de lectura. Se contabilizan 5 min en la segunda visita para la lectura.
Incluye tiempo de inyección, registro de datos en la primera visita; búsqueda del trabajador, lectura y registro de datos en la segunda.
Vial PPD de 1,5ml: 16,02 euros. Para 14 pruebas: 1,14 euros, 0,43 euros/min. Precio ponderado según convenio HUMT.
• QF-G-IT. El precio por unidad de la técnica IGRA calculada en nuestro hospital fue de 38,22euros. En la tabla 3.2 se especifican el valor de los parámetros analizados. Se especifica también en la tabla el cálculo unitario (solo fungible) de ambas técnicas.
Como puede observarse en ambas tablas, el valor fundamental en el caso de la PT corresponde a los gastos de la realización de la técnica y los derivados de la ausencia de trabajador sanitario durante la realización y la lectura de la misma. En el caso de QF-G-IT el coste fundamental se debe al material fungible.
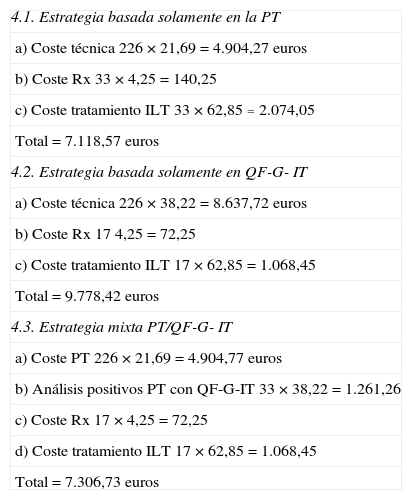
Análisis económico por estrategias del estudioLa estrategia más económica fue la basada en la PT, con un coste de 7.118,57euros, seguida de la mixta basada en PT/QF-G-IT, con un coste de 7.306,73euros, y finalmente la basada solo en QF-G-IT, con un precio de 9.778,42euros (tabla 4). Hay que hacer notar que la diferencia entre las 2 primeras estrategias es de tal solo 188euros en total.
Coste de las diferentes estrategias de cribado de la ILT
| 4.1. Estrategia basada solamente en la PT |
| a) Coste técnica 226×21,69=4.904,27 euros |
| b) Coste Rx 33×4,25=140,25 |
| c) Coste tratamiento ILT 33×62,85=2.074,05 |
| Total=7.118,57 euros |
| 4.2. Estrategia basada solamente en QF-G- IT |
| a) Coste técnica 226×38,22=8.637,72 euros |
| b) Coste Rx 174,25=72,25 |
| c) Coste tratamiento ILT 17×62,85=1.068,45 |
| Total=9.778,42 euros |
| 4.3. Estrategia mixta PT/QF-G- IT |
| a) Coste PT 226×21,69=4.904,77 euros |
| b) Análisis positivos PT con QF-G-IT 33×38,22=1.261,26 |
| c) Coste Rx 17×4,25=72,25 |
| d) Coste tratamiento ILT 17×62,85=1.068,45 |
| Total=7.306,73 euros |
La concordancia entre la PT y el QF-G-IT dependió de si la persona estaba vacunada o no. Así, la concordancia entre la PT y el QF-G-IT fue buena en personal no vacunado, siendo deficiente en vacunados.
La mínima tasa de indeterminados en el test del QF-G-IT en nuestro estudio creemos que se debió en gran parte al rápido procesamiento de las muestras, tal y como otros autores de la literatura preconizan32, y también al hecho de que la población era inmunocompetente. Todo ello nos permite considerar este test de utilidad como técnica de cribado de la ILT en este colectivo por su buena especificidad.
Si analizamos los casos positivos, la PT detectó más positivos que el QF-G-IT, pero este último permite eliminar los falsos positivos. Esto corrobora los estudios publicados hasta el momento que demuestran una mayor especificidad del QF-G-IT respecto de la PT en el diagnóstico de ILT, ya que minimiza dichos falsos positivos de la PT.
Si analizamos el total de la población, en 15 casos el QF-G-IT y la PT fueron positivos y concordantes, mientras que en 18 casos (54%) de PT positiva, el QF-G-IT fue negativo. Cuando se miran estos mismos datos en población vacunada, hasta en el 67% de sujetos con PT positiva el QF-G-IT fue negativo, lo que indica la gran influencia que la vacuna con BCG tiene en el resultado de la PT. En cambio, cuando se miraron estos mismos datos en población en que no había sido vacunada, el 46% de personal sanitario con PT positiva tenían el QF-G-IT negativo. Por lo tanto, más del 20% de casos positivos de la PT podrían deberse directamente al efecto de la vacuna. Cabe destacar también que 3/6 discordantes en el grupo de no vacunados decían haberlo estado, si bien no se consideraron, ya que no se encontró cicatriz ni aportaron documentación.
Alguien podría argüir que los negativos de QF-G-IT y positivos de PT podrían ser también falsos negativos del IGRA y verdaderas infecciones. Aunque esto es posible, conocemos el alto valor predictivo negativo del QF-G-IT.
La cifra de discordantes entre los positivos de la PT con valor negativo del QF-G-IT en no vacunados es alta. Ello nos lleva a especular con las posibles causas de este efecto. Sin duda la posibilidad de reacción cruzada de la PT debido a micobacterias ambientales no tuberculosas existe, y también en este caso el QF-G-IT nos puede ayudar (excepto para el caso de Mycobacterium kansasii, M. szulgai o M. marinum). No obstante, sabemos que este efecto no es muy importante y tal vez podría justificar a lo sumo un 10% de falsos positivos de la PT, sobre todo en medidas de PT en el límite de la positividad33. Pensamos que la explicación más probable de muchos de los falsos positivos de la PT en personal sanitario no vacunado pueden estar en relación con el fenómeno del booster de la PT, ya que hasta el 56% de profesionales tenían antecedentes previos de realización de esta técnica, y sabemos que, en algunos de estos casos, la PT puede ser falsamente positiva por hipersensibilización repetida del individuo a la misma34. En este sentido también se observa que los casos de PT en el límite de positividad son los más discordantes, mientras que valores elevados de PT muestran poca discordancia (tabla 2).
Todo ello nos lleva a valorar como una ventaja adicional la realización del QF-G-IT en personal sanitario, ya que se elimina la posibilidad de hipersensibilidad a antígenos de la PT34.
No obstante, no todos son ventajas respecto al QF-G- IT, ya que en los últimos años se ha planteado como problema la significación de los valores positivos que se encuentran cerca del límite de positividad de la técnica. En muchos casos estos positivos revierten en controles posteriores a valores negativos. En este sentido, algunos autores ponen en duda valores de QF-G-IT entre 0,35 y 0,7UI/ml o incluso hasta 1UI/ml y recomiendan que estos casos sean seguidos repitiéndose la técnica al cabo de 4-8semanas, con objeto de detectar si son positivos reales o bien revierten por debajo del límite de positividad34-39. En caso de reversión del valor positivo a negativo, posiblemente deberíamos no considerar este tratamiento. No obstante, son necesarios más estudios encaminados a estudiar la significación del QF-G- IT cuando los valores positivos son bajos (probablemente por debajo de 1UI/ml) realizando nuevos tests posteriores con objeto de ver si se trata de positivos reales. En nuestro estudio, tan solo 2 pacientes con PT negativa presentaron un QF-G-IT positivo (ambos con valores elevados), y por tanto este problema se nos ha planteado de manera menor.
Con los datos de nuestro trabajo, el QF-G- IT debería ser la prueba de elección en el diagnóstico de la ILT en personal sanitario. Existe únicamente un criterio de coste económico a la hora de plantear si la PT sería preferible frente al QF-G-IT, dado el bajo precio de la primera40,41.
A priori parece que la PT es mucho más económica que la realización del QF-G-IT. En nuestro análisis económico la PT tiene un coste de 21euros, respecto a 38euros del QF-G-IT (tabla 3). Si solamente tenemos este dato en cuenta, la PT resulta más económica y por lo tanto las estrategias de cribado deberían estar basadas en la misma. No obstante, si analizamos también los gastos del tratamiento y seguimiento de la ILT vemos que QF-G-IT permitiría ahorrar 18 tratamientos en nuestra serie, sin contar con la importancia en la calidad de vida y los posibles efectos secundarios de las personas tratadas innecesariamente. Estos datos se basan en una situación ideal en la cual las personas estudiadas cumplen perfectamente con ambos procedimientos.
De acuerdo con las 3 estrategias estudiadas, la que está basada en la PT es la más económica en todos los casos, seguida por la estrategia de cribado con PT y confirmación con QF-G-IT (con muy poca diferencia). Por último, la estrategia basada exclusivamente en QF-G-IT es la más cara, con diferencia. Conviene llamar la atención sobre la reducida diferencia entre las 2 primeras estrategias, lo cual dependerá, en general, del número de casos de vacunados.
Desde un punto de vista de coste-beneficio, a nuestro juicio, los tratamientos de la ILT que se ahorran tienen mucha importancia, por el hecho de que evitan profilaxis que no son necesarias y posible toxicidad debida a los fármacos utilizados, lo cual encarecería mucho más el precio del seguimiento.
Otros autores han publicado sus datos, especulando con el hecho de que la PT puede llegar a ser incluso más costosa que el QF-G-IT, sobre todo si el trabajador no es adherente a la visita de la lectura y precisa de repetir el test, con el consiguiente mayor coste. Cuando se revisa la literatura desde el punto de vista del análisis de costes, una mayoría de análisis acaban concluyendo que el QF-G-IT, además de las ventajas que presenta, es más coste-efectivo respecto de la PT. En este sentido, De Perio et al.42 demuestran que tanto en vacunados como en no vacunados la PT es más cara que el QF-G-IT en personal sanitario. En 2009, Fox et al.43 cuantifican el coste de la PT en 8euros y el de QF en 36euros; sin embargo, a la hora de analizar el coste de todo el modelo del estudio de contactos y del tratamiento de la ILT, concluyen que el modelo basado en QF-G-IT (7,28euros/110 sujetos) es más económico que el modelo basado en PT (8,21euros/100 sujetos), asumiendo un 50% de adherencia a la estrategia basada en PT. Todo ello se basa en la necesidad de un número más elevado de visitas en el modelo basado en PT.
Diel et al.44 van todavía más allá y analizan el coste-efectividad del otro test IGRA, el TSPOTTB, encontrado que igualmente es más efectivo que la PT en el cribado de contactos por 1.000 individuos. En Estados Unidos, Dewan et al.45 valoran en 2006 el coste del quantiferon en 33,6dólares, similar al de otras publicaciones.
Por último, en nuestro país, Alvarez-León et al.46, del Servicio Canario de Salud, llevaron a cabo en 2009 un estudio exhaustivo sobre el coste-efectividad de ambas pruebas, encontrando que el precio por caso del QF-G-IT era de 42euros€ por determinación, y los costes de la PT, de 39euros por determinación. Las 2 pruebas varían de forma importante en la estructura de costes. En el caso de la PT, la mayoría (70%) de los costes totales proceden de gastos indirectos, como el tiempo perdido de los participantes, mientras que para el QF-G-IT el componente más importante de los costes lo constituye el material fungible, que compromete el 50% de los costes totales.
Respecto a las limitaciones de nuestro trabajo destacaríamos, en primer lugar, que es un estudio transversal, con los inconvenientes propios de este tipo de diseño, ya que no existe seguimiento a largo plazo para ver si algún trabajador infectado desarrollaba tuberculosis. En segundo lugar, dependiendo del punto de corte considerado de la PT los resultados de concordancia entre las pruebas a estudio serían variables. En nuestro estudio hemos definido el punto de corte en 10mm, para considerar la PT positiva, de acuerdo con los argumentos esgrimidos en Material y métodos.
En conclusión, después del análisis de concordancia y económico del QF-G-IT, creemos que son evidentes las ventajas de las técnicas IGRA frente a la PT y que debería valorarse como la técnica de elección del estudio de la ILT en personal sanitario. A nuestro juicio la estrategia secuencial de PT inicial con reconfirmación de los positivos mediante QF-G-IT sería la que más coste-beneficio demuestra, siempre y cuando los trabajadores sean adherentes a las visitas de lectura de la PT. Si estamos seguros de que nuestra población no está vacunada con BCG, se podría plantear en estos pacientes realizar directamente la PT. Si por el contrario hay muchos casos de población vacunada, la estrategia mixta cobrará aún más interés. La estrategia de QF-G-IT exclusivo solo la vemos en poblaciones con vacunación universal y sin problemas económicos.
FinanciaciónBeca de investigación de la Fundació per a la Recerca i Docència, Hospital Universitari Mutua Terrassa 2009-2010.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.