La hepatitis E representa una proporción significativa de las enfermedades hepáticas de transmisión entérica y constituye un importante problema de salud pública, especialmente en los países en vías de desarrollo, principalmente asociada a epidemias debidas a la contaminación de los suministros de agua. El virus de la hepatitis E (VHE) es responsable de infecciones hepáticas agudas autolimitadas de transmisión oral-fecal. En países industrializados la hepatitis E aguda es esporádica, detectada en viajeros procedentes de zonas endémicas pero también en casos esporádicos sin factores de riesgo. El VHE es un virus sin envuelta con genoma de ARN de cadena sencilla en el que se han caracterizado 4 genotipos con un único serotipo. Los genotipos 1 y 2 son los predominantes en los países en desarrollo y tan solo infectan a seres humanos, mientras que los 3 y 4, que predominan en los países industrializados, también infectan a otras especies de mamíferos, especialmente el cerdo, y múltiples evidencias clasifican al VHE como un agente zoonótico. Recientemente se han comunicado casos de infección crónica por este virus en pacientes trasplantados hepáticos y renales. La tasa de mortalidad de la infección por VHE es mayor que la de la hepatitis A. Además de la vía oral-fecal se han comunicado transmisiones parenterales de este virus. Diversas vacunas se hallan actualmente en desarrollo. La severidad de esta infección en algunos grupos de pacientes, especialmente en embarazadas, y la presencia de casos de hepatitis crónica incluso con progresión a cirrosis han suscitado el interés por la aplicación de terapias antivirales con interferón y/o ribavirina.
Hepatitis E represents a significant proportion of enteric transmitted liver diseases and poses a major public health problem, mainly associated with epidemics due to contamination of water supplies, especially in developing countries. Hepatitis E virus (HEV) is responsible for self-limiting acute liver oral-faecal infections. In industrialised countries, acute hepatitis E is sporadic, detected in travellers from endemic areas but also in sporadic cases with no risk factors. HEV is a non-enveloped virus with a single-stranded RNA genome classified into 4 genotypes and a single serotype. Genotypes 1 and 2 only infect humans, and are predominant in the developing countries, while 3 and 4 are predominant in industrialised countries, and also infect other species of mammals, especially pigs, and multiple evidence classifies HEV as a zoonotic agent. Some HEV chronic infections have recently been reported in kidney and liver transplant patients. The mortality rate of HEV infection is greater than hepatitis A. In addition to faecal-oral transmission, parenteral transmission of HEV has also been reported. Several vaccines are currently in development. The severity of this infection in some groups of patients, especially pregnant women, and the occurrence of chronic hepatitis, even with progression to cirrhosis, have raised interest in the application of interferon and/or ribavirin therapy.
La hepatitis aguda E fue caracterizada en 1980 a partir de muestras de un gran brote de hepatitis aguda de transmisión por aguas fecales que se produjo en India (Nueva Delhi) entre 1955 y 19561. En ese brote, las características clínicas y demográficas y la presencia de anti-VHA descartaron al virus de la hepatitis a (VHA) como causa de la epidemia, apuntando hacia un nuevo agente etiológico. Su agente causal, el «virus de hepatitis entérica no-A», fue identificado en 19832 y denominado virus de la hepatitis E (VHE) (E por entérica y epidémica). Su genoma fue secuenciado en 19913. La hepatitis E representa una proporción significativa de las enfermedades hepáticas de transmisión entérica4 y constituye un importante problema de salud pública, especialmente en los países en vías de desarrollo, aunque también parece endémica en países industrializados de Europa y en Estados Unidos5. En los países en desarrollo el VHE se asocia principalmente a epidemias debidas a la contaminación de los suministros de agua y a las malas condiciones de saneamiento6. En los países industrializados la hepatitis E aguda es esporádica, detectada en viajeros procedentes de zonas endémicas, pero también en casos esporádicos sin factores de riesgo5. Las cepas del VHE de países industrializados suelen ser diferentes a las de países en desarrollo6, lo que apoya un origen autóctono de la infección por VHE en los países desarrollados. En este sentido, se ha especulado sobre la hepatitis E como posible causa de brotes epidémicos de características análogas al brote de India que ocurrían regularmente en Europa en la segunda mitad del sigloxix y principios delxx, cuando las condiciones sanitarias en Europa eran muy deficientes. Múltiples evidencias clasifican a la hepatitis E como enfermedad zoonótica al haber sido caracterizado el VHE en cerdos y pollos y más recientemente en ciervos, mangostas, ratas y conejos5, y es el único virus de hepatitis con reservorios animales. Desde el punto de vista clínico el VHE es responsable de infecciones hepáticas agudas autolimitadas y casos fulminantes de transmisión oral-fecal5. Sin embargo, recientemente se han comunicado casos de infección crónica por este virus en pacientes trasplantados hepáticos y renales, sumándose a los virus B, C y D como agente causal de infección hepática crónica, abriendo una línea de estudio de gran interés en el futuro7,8. La tasa de mortalidad de la infección por VHE (1-4%, o 1-15% en epidemias, o 20-30% en embarazadas) es mayor que la de la hepatitis A (0,1-2%)5. Aunque la vía de transmisión fecal-oral para el VHE está bien establecida, se han observado casos de pacientes infectados por transfusión sanguínea en Japón o ingestión alimentaria6, por lo que hay que valorar otras posibles vías de transmisión del VHE (vertical, transfusión sanguínea, contacto persona a persona, zoonótica).
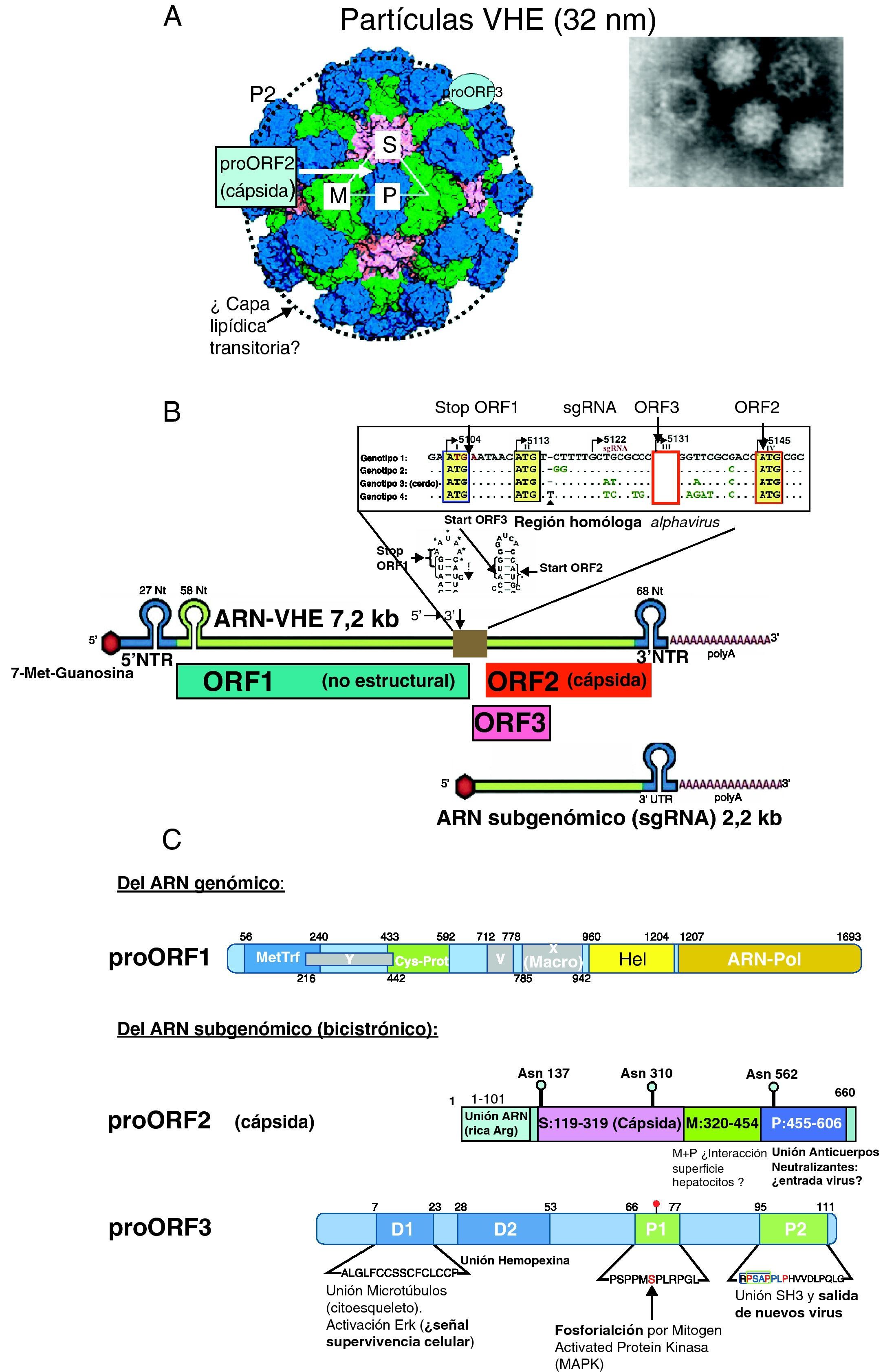
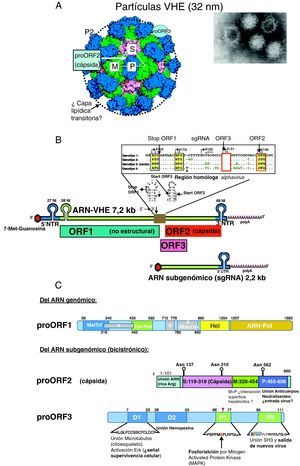
Virología del VHEPartícula viral, genoma y proteínas del VHEEl VHE está formado por una partícula icosaédrica sin envoltura de unos 32nm9 (fig. 1A) resistente a la inactivación por las condiciones ácidas y alcalinas leves del tracto intestinal, facilitando la vía de transmisión fecal-oral. El genoma viral está formado por una sola cadena de ARN (fig. 1B) de sentido positivo de ∼7,2kb con 3 regiones codificantes de proteínas o marcos de lectura abierta (ORF): ORF1, ORF2 y ORF33, flanqueadas en 5’ y 3’ por dos regiones no traducidas (NTR). La región 5′ NTR junto a una secuencia conservada de 58 nucleótidos de ORF1 y una secuencia homologa a alfavirus del centro del ARN, que se pliegan en forma de estructuras «tallo y lazo» (fig. 1B), son esenciales para la replicación y la transcripción del VHE10. ORF1 se traduce a partir de un tránscrito genómico completo (el propio ARN-VHE que actúa como mensajero) y las proteínas codificadas por ORF2 y ORF3 (solapada con ORF2) se traducen a partir de un único ARN subgenómico bicistrónico con dos codones AUG localizados en la región central del genoma homóloga a alfavirus (fig. 1B).
A) La imagen de microscopia electrónica de partículas virales del VHE y estructura cristalina de partículas seudovirales (adaptado de Xing et al.9) muestra el empaquetamiento de las proteínas proORF2 de la cápsida y la localización de los dominios P, M y S (fig. 2C) y la posible localización de proORF3. El círculo en línea discontinua indica la capa lipídica transitoria durante la salida de las partículas virales. B) Estructura del genoma del VHE: cadena de ARN de ∼7,2kb de sentido positivo: residuo 7-metil-guanosina (7-Me-Guanosina) en su extremo 5′ (cap), cola poli-A en extremo 3, regiones no traducidas 5′NTR y 3′NTR (con fragmentos plegados «tallo-lazo»), los 3 marcos de lectura abierta: ORF1, ORF2 y ORF3 y la región central homóloga a alphavirus que contiene el codón de parada (stop) de ORF1, y los de inicio (ATG) de ORF3 y ORF2 y la posición de inicio del ARN subgenómico de 2,2kb que actúa como tránscrito para ORF2 y ORF3. C) Esquemas de las proteínas codificadas por el genoma del VHE.
• proORF1 (poliproteína no estructural): MetTrf (metil transferasa), Cys-Prot (Cys proteasa parecida a papaína), Hel (helicasa), ARN polimerasa dependiente de ARN (ARN polimerasa). Además, 2 regiones análogas a proteínas no estructurales de otros virus ARN de cadena positiva: X (macrodominio) e Y. La región V (región rica en Arg) puede actuar como bisagra.
• proORF2 (proteína estructural, componente de la cápsida viral). El dominio S forma polímeros que dan lugar a la estructura de la cápsida, y los dominios M y P (este sobresale de la cápsida; fig. 1A) parecen intervenir en el reconocimiento del receptor celular y contienen los epítopos neutralizantes
• proORF3 (fosfoproteína reguladora multifuncional). Se indican los dominios hidrofóbicos D1 y D2, y los ricos en prolinas P1 y P2 (ver texto).
El ORF1, en posición 5′ del genoma viral, ocupa dos tercios del mismo y codifica una gran poliproteína, de 1.693 aminoácidos proORF1 (fig. 1C) que presenta varios motivos estructurales y funcionales responsables de la replicación viral: metiltransferasa (MetTrf), cisteín-proteasa análoga a la papaína (Cys-Prot), helicasa para ARN (Helic) y ARN-polimerasa dependiente de ARN (ARN-pol) (fig. 1B)11. La MetTrf se justifica por la presencia un residuo de 5’-metil-guanosina en 5′ del ARN (cap motive) esencial para la infectividad y replicación del VHE. El motivo esencial GDD de la región ARN-Pol parece ser el centro activo de esta enzima.
La región ORF2, en posición 3′ del genoma viral, codifica la proteína proORF2 de 660 aminoácidos glucosilada en las asparaginas 137, 310 y 562, componente de la cápsida viral11 (fig. 1C); dímeros de proORF2, al interaccionar con el extremo 5′ del genoma viral por su región N terminal, rica en argininas (aa:1-101), forman la cápsida (180 moléculas proORF2 por partícula viral)9. La proteína proORF2 contiene 3 dominios lineales9: el dominio S (aa:119-319), que forma la cápsida, y los dominios M (aa:320-454) y P (aa:320-606), que se relacionan con la interacción virus-célula huésped. El dominio P queda expuesto al exterior de la cápsida y es el posible sitio de unión de anticuerpos neutralizantes, y la diana de las vacunas que están en desarrollo11.
La región ORF3 codifica una fosfoproteína (proORF3) de 114 aminoácidos (fig. 1C), que es traducida del ARN mensajero subgenómico a partir de un tercer codón AUG con cambio de pauta de lectura (+1) respecto al codón AUG de ORF2, por lo tanto casi totalmente solapada con ORF2. Esta proteína, prescindible para la replicación in vitro, parece ser requerida para la infección en simios11. Su extremo N terminal, rico en cisteínas, se une al ARN viral formando un complejo con la cápsida viral, en cuya superficie se localiza junto a una capa lipídica que transitoriamente recubre la partícula viral durante su salida de la célula infectada12. La región C terminal de proORF3 tiene varios dominios multifuncionales que interactúan con diferentes proteínas celulares relacionados con la morfogénesis de las partículas virales y su infectividad11: de los dominios hidrofóbicos D1 y D2 (fig. 1C), D1 se une se une a una Mitogen Activated Protein-fosfatasa-cinasa con la se colocaliza en el citoesqueleto y activa la cinasa regulada extracelularmente (ERK) constituyendo una posible señal de supervivencia celular, mientras que D2 interacciona con hemopexina, una glucoproteína de fase aguda cuyos niveles plasmáticos, así como los de haptoglobina, descienden en infectados por VHE13. De esta forma, proORF3 parece inhibir la respuesta innata del huésped atenuando la respuesta inflamatoria de fase aguda. De las 2 regiones ricas en prolinas (P1 y P2), P1 contiene el residuo de serina 80 fosforilado, conservado en todas las cepas del VHE, excepto en la de México, y la región P2 contiene un motivo PxxPxxP que se une varias proteínas que contienen dominios homologia-src 3 (SH3) y que se asocia con la salida del virus11. La proORF3 parece regular el medio ambiente de la célula huésped a través de su interacción con diversas vías intracelulares. Activa la ERK uniéndose a (e inhibiendo) la fosfatasa que la inhibe. La activación prolongada de ERK generaría una señal de supervivencia y proliferación celular14. Las interacciones de proORF3 con componentes celulares pueden favorecer la replicación viral, alargando la vida de las células infectadas al atenuar la vía intrínseca de muerte y regular a la baja la respuesta inmune innata por la reducción de expresión de proteínas de fase aguda y el aumento de la secreción de α1-microglobulina con capacidad inmunosupresora, mecanismos que pueden proteger las células infectadas por VHE14.
Ciclo replicativo del VHENo se conocen ni los receptores celulares para el virus ni el motivo de la cápsida que reconoce estos receptores, que podría localizarse en el epítopo neutralizante del dominio P214. Se ha propuesto un modelo para el ciclo replicativo por su homología con otros virus ARN. En este modelo, tras la entrada del VHE en la célula huésped, el ARN genómico, ya sin cápsida, es traducido en el citosol para producir la poliproteína no estructural proORF1, que por la acción de proteasas celulares se escinde en sus componentes (MetTrf, Cys-Prot, Helic y ARN-Pol) con la colaboración de la propia proteasa Cys-Prot del VHE. La ARN-Pol copia la cadena de ARN-VHE positivo en intermediarios de ARN-VHE negativo, moldes para que la ARN-Pol sintetice nuevas copias del ARN-VHE positivo genómico, para las nuevas partículas virales y mensajero para proORF1, así como el ARN-VHE positivo subgenómico, mensajero para proORF2 (cápsida viral) y proORF3. Estas dos proteínas se transcriben a partir del motivo similar a alfavirus del ARN viral que parece actuar como promotor (fig. 1B). La cápsida viral empaqueta el genoma viral, en cuya superficie se unirá proORF3 junto a una capa lipídica (eliminada en los viriones circulantes por un mecanismo desconocido). Finalmente, los nuevos viriones saldrán de la célula a través de un camino no bien definido, con la posible intervención de proORF3. Aunque no hay datos experimentales que confirmen este posible ciclo replicativo15, se ha detectado ARN-VHE de cadena positiva y negativa en hígados de monos y cerdos infectados experimentalmente16.
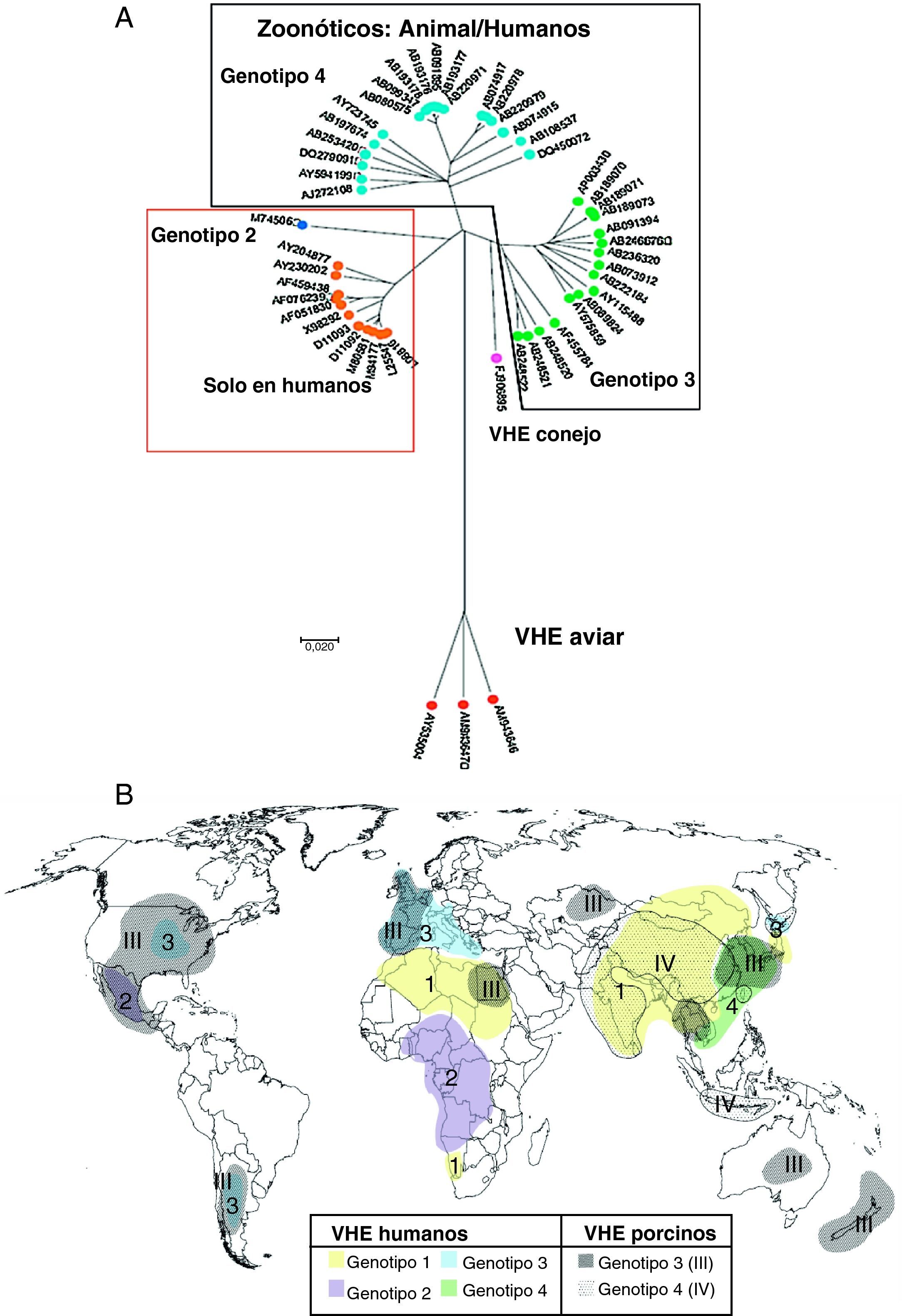
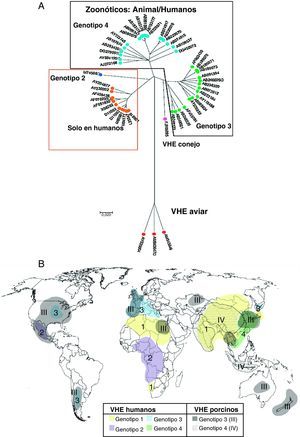
Clasificación y filogenia del VHEEl VHE se clasificó originalmente en la familia Caliciviridae, pero más recientemente ha sido clasificado como un virus ARN de sentido positivo de clase IV perteneciente al género Hepevirus, único miembro de la familia Hepeviridae17. Los estudios de diversidad inter e intrapaciente del VHE le confieren una estructura de cuasiespecie18 con una tasa de acumulación de mutaciones del ARN-VHE de 1,40-1,72×103 sustituciones de base por sitio y por año, similar a otros virus ARN, con regiones altamente polimórficas en ORF1 (que contiene una región hipervariable), mientras que los 2 extremos de ORF2, gen de la cápsida, están bien conservados. Filogenéticamente para el VHE de mamíferos se definen 4 genotipos17 (fig. 2A) y al menos 24 subtipos distintos19. La relevancia clínica de los diferentes subtipos es desconocida. La distribución geográfica de los genotipos del VHE se muestra en la figura 2B.
A) El árbol filogenético indica los diferentes genotipos del VHE. Los números corresponden a la identificación de cada secuencia en GenBank (modificado de Pavio et al.5). B) Distribución mundial de los genotipos VHE en humanos y cerdos (modificado de Purcell y Emerson17). En fondos lisos y numerados del 1 a 4, los genotipos de VHE humanos; en fondos punteados y numerados del I al IV, los porcinos.
El genotipo 1 está restringido a humanos, aislado en brotes epidémicos y casos esporádicos de Asia y Norte de África donde son endémicos, y más recientemente en América17. Presenta un 90% de homología entre los diferentes aislados. El genotipo 2 está restringido a humanos, incluye una única cepa aislada en una epidemia en México y cepas de epidemias en África Central6. Tiene una homología del 75% en nucleótidos y del 86% en aminoácidos con el genotipo 120. El genotipo 3 incluye cepas del VHE humana y porcina procedentes de países industrializados: Estados Unidos y principalmente Europa (Reino Unido, Francia, Holanda, España, Grecia, Austria e Italia), pero también en Asia, Oceanía (Australia y Nueva Zelanda) y Argentina; también se ha aislado en ciervos y jabalíes20. Solo tiene un 75% de homología con los genotipos 1 y 2 y parece cruzar la barrera de especie, pues aislados humanos han infectado cerdos y primates no humanos. El genotipo 4, que incluye cepas del VHE humano y porcino, se ha observado en casos esporádicos de hepatitis aguda de Asia y ocasionalmente en Europa6.
Los genotipos 1 y 2, restringidos a humanos, se asocian a grandes epidemias transmitidas por el agua en las regiones endémicas, mientras que los genotipos 3 y 4 de humanos y otros mamíferos son los principales responsables de casos esporádicos de hepatitis E en regiones no epidémicas. Se ha sugerido que el genotipo viral puede estar asociado a la transmisión viral y a la severidad de la enfermedad. Los genotipos 1 y 2 parecen ser más patogénicos que el 3 y 4, y de estos, el 4 más que el 321,22. En las infecciones por genotipos 1 y 2 en países en desarrollo la afectación clínica fue más alta en niños mayores y adultos jóvenes1, mientras que la hepatitis E por genotipos 3 y 4 de países desarrollados se observa en promedio a edades más avanzadas y en infectados con VIH, lo que sugiere que los genotipos 3 y 4, «menos patogénicos», es más probable que causen enfermedad en individuos inmunológicamente más débiles, como ancianos o inmunodeprimidos17.
Aunque los aislados de VHE porcino, de genotipo 3 o 4, son homólogos a los aislados humanos, en países como Suecia y Holanda las cepas porcinas son sensiblemente diferentes de las humanas (en Holanda las cepas humanas son subgenotipo 3f y las porcinas 3c)23. Esta disociación entre cepas humanas y porcinas es más patente en algunos países endémicos para la infección por VHE: en India las cepas porcinas son genotipo 4 y las humanas de genotipo 120, y en China las cepas humanas y porcinas pertenecen a diferentes subgenotipos del genotipo 424. Estos datos parecen indicar que la infección cerdo-humano no es frecuente en estos países. Los brotes de infección por VHE indican que los genotipos 1 y 2 infectan más eficientemente por vía fecal-oral entre humanos, mientras que las cepas del VHE de genotipo 3 y 4 se mantienen entre las especies animales e infectan solo ocasionalmente a humanos por transmisión zoonótica, como por ingesta de hígado de cerdo mal cocido. La distribución de los genotipos parece cambiar rápidamente con el tiempo. Así, por ejemplo, en China el genotipo 4, registrado por primera vez en el año 2000, aumenta su presencia, mientras que el 1, responsable de uno de los mayores brotes de hepatitis E registrados en China entre 1986 y 1988, parece disminuir25.
Se han aislado y caracterizado otras formas del VHE, como el aviar, aislado en pollos, que parece constituir un nuevo género del Hepevirus y no se transmite a primates26; una nueva cepa de VHE en conejos de granja en China, posible variante del genotipo 3, que podría infectar las especies susceptibles a este genotipo (humanos, cerdos, etc.), aunque no hay datos a este respecto, y un VHE detectado en ratas en Alemania (solo el 60 y el 50% de homología con los VHE humano y aviar, respectivamente) podría constituir un nuevo genotipo Hepevirus27.
Patogénesis de la hepatitis EEl VHE entra en el huésped principalmente a través de la vía oral, pero no hay suficientes datos clínicos de su posible replicación extrahepática. No obstante, se ha detectado ARN-VHE en células mononucleares28. En voluntarios el VHE se detectó en heces una semana antes de la aparición de la enfermedad y hasta 2 semanas después2,29. El ARN-VHE se detecta en el suero de casi todos los pacientes en las 2 semanas tras el inicio de la enfermedad30 y puede ser positivo de 4-16 semanas. A nivel hepático, en experimentos con primates los antígenos del VHE, indicativos de replicación viral, pueden visualizarse a los 7 días de la infección, y en el 70 al 90% de los hepatocitos en el pico de la replicación viral, simultáneamente con la aparición del VHE en bilis y heces, antes o simultáneamente con el inicio de la elevación de la alanina-aminotransferasa (ALT) y los cambios morfológicos en el hígado, sugiriendo que el VHE es liberado de los hepatocitos a la bilis, y por tanto a las heces, antes del pico de ALT y los cambios morfológicos hepáticos31. Los niveles del ARN-VHE en suero y heces son muy elevados desde el comienzo de la infección y caen bruscamente al final de esta, simultáneamente a la respuesta enérgica de anticuerpos antivirales32. La concordancia entre hallazgos patológicos, virológicos y serológicos en hepatitis E sugiere que el mecanismo patogénico de la enfermedad puede ser inmune, no relacionado con el efecto citopático del VHE. El tamaño de la dosis infecciosa puede ser decisivo para la extensión de las secuelas virológicas, inmunológicas y patológicas de infección por VHE; así, primates infectados con dosis bajas de VHE presentan infecciones subclínicas pero pueden transmitir la infección33. Se desconocen los mecanismos patogénicos de la altísima tasa de mortalidad por insuficiencia hepática fulminante en mujeres embarazadas (20-30%)34, que no se ha podido reproducir experimentalmente. Las lesiones hepáticas graves en el ser humano se asocian a una alta frecuencia de coagulación intravascular diseminada, relacionada con los cambios inmunológicos y hormonales durante el embarazo. En este sentido se ha observado un cambio hacia Th2 en el equilibrio Th1/Th2 en las mujeres embarazadas infectadas por el VHE en comparación con mujeres no gestantes20. Sin embargo, su influencia en la gravedad de la infección por VHE no está bien establecida. La evidencia es que las mujeres embarazadas con ictericia y hepatitis viral aguda por VHE mostraron mayores tasas de mortalidad y peores resultados obstétricos y fetales que las infectadas con otros tipos de hepatitis viral, con aumento de los niveles de estrógeno, progesterona y βHCG en comparación con pacientes VHE-negativos y controles14. También se han observado posibles asociaciones con factores genéticos y ambientales; así, recientemente se ha postulado que la supresión selectiva del factor NFκB con la exclusión de la p65 del complejo de transactivación en mujeres embarazadas infectadas por VHE puede causar la desrelugación de la inmunidad que provoca la muerte35.
Periodo de incubación y vías de transmisiónEn humanos voluntarios se observa un periodo de incubación de 4-5 semanas29, que es más variable, de 2-10 semanas, en los brotes de hepatitis E1. Se han comunicado 5 posibles vías de transmisión del VHE, que en orden decreciente de importancia son: a) fecal-oral, por contaminación de los suministros de agua potable; b) por alimentos contaminados, crudos o poco cocidos; y de forma menos frecuente c) por transfusión de productos sanguíneos infectados; d) por transmisión vertical (materno-fetal), y e) por contacto directo con sujetos infectados. En algunos casos, sobre todo en regiones no endémicas y casos esporádicos de regiones endémicas, no es posible establecer la ruta de adquisición de la infección.
En relación con la transmisión parenteral del VHE (vía c), hay que tener en cuenta que los suministros de sangre son vulnerables a los virus sin envuelta porque los mecanismos de inactivación parecen insuficientes para estos agentes. Se han confirmado molecularmente casos de hepatitis E relacionados con transfusiones sanguíneas en regiones no endémicas como Japón, Reino Unido y Francia; en uno de estos casos el donante había contraído la infección por VHE mediante el consumo de carne de cerdo asada (vía b) y otro paciente que compartió esta comida con el donante también adquirió una hepatitis aguda36. Todos los casos de transfusión relacionados con la hepatitis E han sido causados por cepas del VHE de los genotipos 3 y 4, sugiriendo un potencial de transmisión parenteral de estos genotipos «zoonóticos». De esta manera, la contribución de la transmisión sanguínea a las infecciones por VHE humano debe ser valorada en el futuro como posible riesgo de infección postransfusional. La transmisión persona-persona (contacto directo, vía e) es muy ineficiente (solo el 1-2% de casos del entorno familiar de pacientes con infección aguda por VHE)37.
Epidemiología de la infección por VHELa infección por VHE es probablemente la causa más frecuente de hepatitis aguda a nivel mundial, estimándose que un tercio de la población mundial ha estado infectada por este agente38. El VHE es la principal causa de hepatitis aguda en adultos en Centroamérica y en el Sudeste asiático, y la segunda, detrás del virus de la hepatitis B, en Oriente Medio y en África del Norte17. En contraste, el VHE es responsable de un número ínfimo de casos en los países industrializados, donde el VHA es la causa mayoritaria17. En contraste con la incidencia geográfica de la enfermedad por VHE, la prevalencia geográfica de anticuerpos contra el VHE es mundial, con prevalencias más altas en países en desarrollo, donde la enfermedad clínica es endémica. Esta infección presenta situaciones paradójicas, como la de Egipto, donde a pesar de los pocos casos esporádicos comunicados y la ausencia de brotes epidémicos de hepatitis E, la prevalencia de anti-VHE es sumamente elevada (hasta el 70%)39. Algo parecido ocurre en Estados Unidos, con pocos casos de hepatitis E registrados pero una elevada prevalencia de anti-VHE, que en algunos estados es incluso superior a la de anti-VHA17. Los brotes epidémicos solo se producen en países en desarrollo y se asocian con la contaminación de aguas por VHE, mientras que las infecciones esporádicas (no epidémicas) son la presentación habitual en los países desarrollados. De estos casos esporádicos, algunos se explican por transmisión zoonótica por contaminación alimentaria (productos poco cocidos: mariscos o carne) o por contacto directo con animales infectados40. El «verdadero» número de infecciones por el VHE humano resulta altamente polémico. En este sentido, el número de infecciones subclínicas en humanos es por lo menos 2 veces mayor que las infecciones clínicas. En China, solo el 2,1% de las infecciones por VHE en adultos son sintomáticas41, y en los países desarrollados esta proporción no está bien definida (7 a 21%)42. Puesto que dosis más bajas de inóculo viral parecen causar infecciones menos sintomáticas43 y la población de los países desarrollados está expuesta a dosis bajas de VHE, se puede suponer que gran parte de las infecciones por VHE en estos países sean asintomáticas y sigan sin ser reconocidas. Así mismo, las infecciones subclínicas pueden presentar una respuesta inmune limitada contra el VHE, pero con viremia y excreción fecal de VHE43,44, contribuyendo al reservorio de VHE y, por lo tanto, a su transmisión. La infección por VHE parece seguir 2 patrones claramente diferenciados: un patrón en las regiones donde se producen las epidemias (países subdesarrollados) y otro muy diferente en los países desarrollados.
Patrón epidémico: hepatitis E en regiones endémicasEn estas regiones las epidemias de hepatitis E son frecuentes y afectan a cientos o miles de personas, y se asocian al consumo de agua potable contaminada con materia fecal. Estas epidemias se han observado en India, China, Asia Sudoriental y Central, Oriente Medio y partes del norte y del oeste de África, y 2 brotes únicos (1986-1987) en México20. La duración de los brotes va de pocas semanas a más de un año, habitualmente tras periodos de lluvias torrenciales con inundaciones, que favorecen la mezcla de excrementos humanos con las fuentes de agua potable20. Las tasas de morbilidad durante los brotes de hepatitis E van del 1 al 15%, y afectan sobre todo a adultos jóvenes, más varones que mujeres. Es remarcable que los brotes de hepatitis E se asocian a una alta morbilidad y mortalidad en embarazadas (19% en embarazadas, frente al 2,1% en no embarazadas o el 2,8% en hombres)34, con un alto riesgo obstétrico de prematuridad y riesgo de mortalidad perinatal41. En estas zonas también se observa que una gran proporción de los casos de hepatitis aguda esporádica (70% en India) son causados por el VHE, con un perfil clínico similar a los casos epidémicos. La presencia de ARN-VHE en muestras de aguas residuales45 indica que el VHE circula ampliamente entre la población, incluso en ausencia de un brote de la enfermedad, causando posiblemente las infecciones esporádicas. Recordemos que, a diferencia de otras infecciones de transmisión entérica, la transmisión de persona a persona del VHE es poco común, incluso durante los brotes epidémicos (0,7-2,2% entre familiares de pacientes con hepatitis E vs. 50-75% en la hepatitis A)37. El corto intervalo de tiempo en infecciones en una misma familia indica una causa común de infecciones primarias (por ejemplo, por el agua) en lugar de la infección de persona a persona. La infección zoonótica del VHE en estas regiones parece improbable, puesto que los aislados de VHE de animales y humanos pertenecen a genotipos diferentes (por ejemplo, en India los aislados animales pertenecen al genotipo 4, mientras que los aislados de humanos son de genotipo 1)18. En estas regiones es poco probable la existencia de un reservorio animal responsable de mantener la enfermedad. La importante población de individuos con infección subclínica por VHE podría actuar como reservorio principal, manteniendo de forma continua la infección mediante contaminación fecal46.
Patrón no-endémico: hepatitis E en regiones no endémicasEn regiones sin brotes epidémicos la hepatitis E representa solo una minoría de las hepatitis virales agudas, y hasta hace unos años la mayoría de ellos estaban relacionados con viajes a zonas endémicas para la infección por VHE. Sin embargo, en los últimos años se han comunicado casos de transmisión autóctona de hepatitis E en Estados Unidos, Europa y los países desarrollados de Asia-Pacífico (Japón, Taiwán, Hong Kong, Australia). No se ha identificado la vía de infección en la mayoría de los casos esporádicos, pero la transmisión de cepas de VHE humanas a cerdos, y de estos a primates47,48, sugiere la zoonosis como causa más probable. Esta hipótesis se refuerza por: a) la gran prevalencia de anticuerpos anti-VHE en varias especies animales, y b) el aislamiento de secuencias genómicas VHE en cerdos altamente homólogas a los aislados de VHE humano. De hecho, en la mayoría de los casos esporádicos de hepatitis E en Japón se había consumido hígado de cerdo crudo o poco cocido6, lo que justifica su infectividad por la alta estabilidad térmica de las partículas del VHE. La mayor prevalencia de anticuerpos anti-VHE en humanos que trabajan con cerdos (veterinarios y granjeros) en relación con la población general4 avala la transmisión por contacto. Un hecho interesante es que en España se ha detectado ARN-VHE en el 30% de las muestras de aguas residuales de una zona urbana (Barcelona)49, y esta presencia no ha disminuido durante el mismo periodo en que el VHA ha descendido del 57,4 al 3,1%. Esta observación parece indicar que las mejoras sanitarias de la población no afectan a la prevalencia de la infección por VHE, que se podría explicar por la presencia de reservorios animales externos del VHE. La «identidad» entre las secuencias de animales y humanos de genotipo 3 en Europa o 4 en Japón evidencia fuertemente el origen autóctono de la hepatitis E y el carácter zoonótico de esta infección en dichas regiones, siendo el cerdo el reservorio principal. Esta afirmación se evidencia por los casos confirmados de transmisión alimentaria y la mayor seroprevalencia de anticuerpos anti-VHE en veterinarios y trabajadores de granjas de cerdos. En este sentido, hay que tener en cuenta la altísima prevalencia serológica de esta infección cerdos, así como la actividad viral evaluada mediante ARN-VHE en heces.
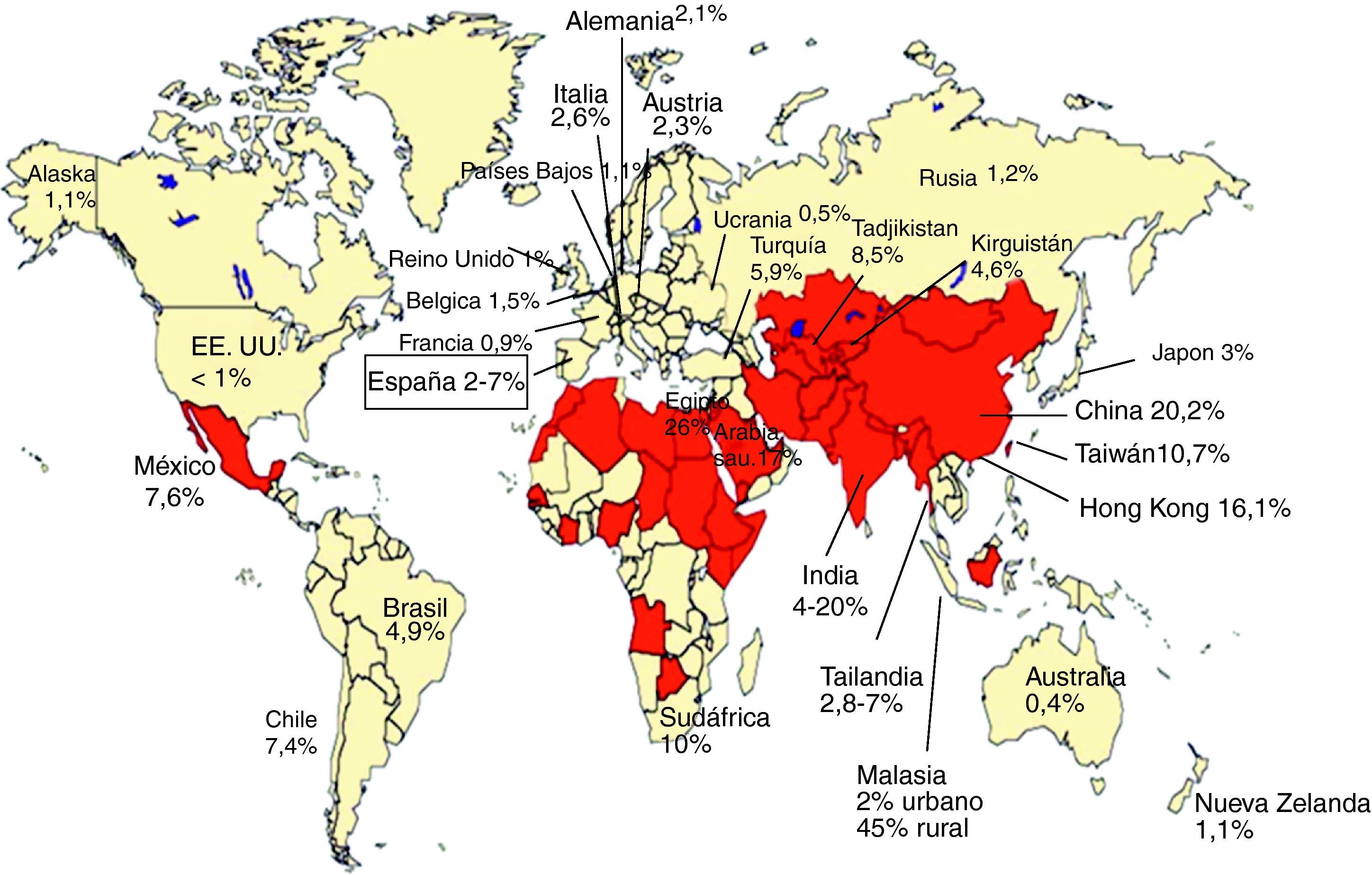
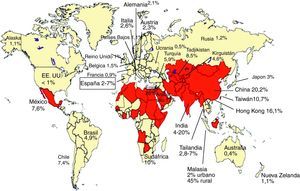
Seroprevalencia de anticuerpos IgG-VHE: evidencia de exposición al VHELa presencia de anticuerpos IgG anti-VHE, evidencia de exposición al VHE (fig. 3), se ha encontrado en sujetos sanos en todo el mundo. En general, en los países en desarrollo, donde las condiciones sanitarias del agua potable son muy deficientes y la hepatitis E es frecuente, las tasas de prevalencia son más altas que en los países desarrollados con baja frecuencia de casos clínicos de hepatitis E (fig. 4). Son áreas de alta endemicidad20,50: a) Asia del Sur y Central, con el 20-30% de prevalencia en China, el 45% en áreas rurales de Malasia y hasta el 20% en India; b) Norte de África y Oriente Medio, con el 26% en Egipto (70% en algunas series de adultos) y el 17% en Arabia Saudita. En India y en otros países endémicos, a pesar de los frecuentes brotes de hepatitis E, la seroprevalencia anti-HEV (4-20%) es inferior a la de la hepatitis A (VHA)20. Al contrario, en Egipto se detecta anti-VHE hasta en el 70% en algunas series de adultos, a pesar de la ausencia de brotes de la enfermedad20. En los países desarrollados se han comunicado tasas de seroprevalencia de anti-HEV inferiores en general, del 1-3% (por ejemplo, EE.UU. y Alemania, 2,1%; Francia, 0,9%), con casos superiores al 20% en ciertos grupos o regiones (por ejemplo, estados con gran actividad de ganadería porcina de EE.UU.)20,50. En el caso concreto de España, se han comunicado prevalencias entre el 2,2 y el 7%51,52, con una marcada diferencia en relación con la edad, siendo del 1% en individuos jóvenes y del 3,6% en los de mayor edad51. No obstante, estas seroprevalencias parecen mayores de lo esperado teniendo en cuenta la baja tasa de enfermedad clínica por VHE en estas áreas. Así, como se ha comentado en el apartado de epidemiologia, en algunos estados de Estados Unidos la prevalencia de anti-VHE es mayor que la de anti-VHA, a pesar de la baja incidencia de hepatitis E17. Estas tasas relativamente altas de anti-VHE se observan a pesar del descenso en el nivel de anticuerpos tras la infección por VHE primaria; así, por ejemplo, a los 14 años solo el 47% de afectados por un brote epidémico de VHE mantienen niveles detectables de anti-VHE y solo el 25% a los 30 años53. Se observan diferencias de prevalencia de anticuerpos anti-VHE asociadas a factores sociales, laborales, patologías asociadas, etc. Así, en veterinarios y granjeros que trabajan con cerdos en Estados Unidos, Holanda, Moldavia y China la prevalencia anti-VHE es claramente superior a la de la población general4,6. Estos datos sugieren que la infección por VHE en cerdos contribuye de forma importante a la alta prevalencia entre personas con exposición directa frecuente a estos animales e ilustran el carácter zoonótico de esta infección. En este sentido, que el VHE es endémico en cerdos con altas prevalencias de anti-VHE en todo el mundo (por ejemplo, casi el 100% en EE.UU. y México, el 90% en Nueva Zelanda, el 46% en Laos y el 98% en España) y que comparten los genotipos 3 y 4 que infectan humanos en regiones no endémicas6.
Seroprevalencia de anticuerpos anti-VHE IgG (modificado de Chandra et al.14).
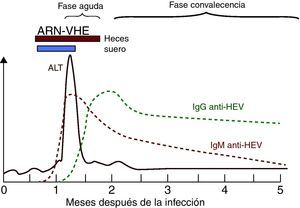
Perfil de marcadores de laboratorio en la hepatitis aguda por VHE autolimitada (modificado de Krawczynski et al.33).
Para valorar las tasas de seroprevalencia hay que tener en cuenta la contribución relativa de la infección por VHE subclínica, ya que en países endémicos es más del doble que las infecciones sintomáticas. También hay que valorar que la diferente sensibilidad y especificidad de los ensayos analíticos puede resultar en estimaciones de prevalencia erróneas, más probablemente por falsos negativos que por falsos positivos. Este hecho, unido al descenso de los títulos de anti-VHE con el tiempo, sugiere que las seroprevalencias reales y el número total de infecciones por VHE pueden ser superiores a las comunicadas. No obstante, parece poco probable que las cifras de seroprevalencia cambien drásticamente en el futuro tras la introducción de pruebas de nueva generación.
Clínica de la infección por VHEHepatitis aguda por VHELa presentación clínica de la infección por VHE es esencialmente indistinguible de la observada en otros virus hepatotropos. La etiología más común de esta infección es en forma de hepatitis aguda, que afecta habitualmente a individuos de 15 a 40 años de forma autolimitada y sin secuelas, que se manifiesta de 3 a 6 semanas después del contacto. La infección aguda cursa con formas que van de subclínica (anictérica) a hepatitis colestásica severa con ictericia, anorexia, náuseas, vómitos y ocasionalmente fiebre que duran de 1 a 6 semanas. El fallo hepático fulminante (FHF) puede ocurrir en ∼1% de los casos, con mayor morbimortalidad en pacientes con hepatopatías crónicas (54-55) y mujeres embarazadas. Estas muestran mayores tasas de mortalidad (15-20%) y peor pronóstico obstétrico y fetal que las infectadas con otras hepatitis virales. Los acontecimientos que conducen al FHF son desconocidos, y ninguno de los test diagnósticos disponibles en la actualidad permite establecer el pronóstico de la enfermedad. A nivel epidemiológico se pueden observar diferencias entre zonas endémicas y no endémicas:
Zonas con infección por VHE endémicaEn estas áreas la infección por VHE, fundamentalmente de genotipos 1 y 2 (fig. 2B), ocurre principalmente en adultos jóvenes con formas clínicas muy variadas, sobre todo hepatitis aguda ictérica autolimitada, indistinguible de la causada por otros virus hepatotropos3,49. La proporción de casos severos de insuficiencia hepática aguda es superior a la observada en otros virus como el VHA, con tasas de mortalidad del 0,5 al 4% (0,07-0,6% en los brotes epidémicos)49. La alta prevalencia de anticuerpos anti-VHE en regiones endémicas y la ausencia de síntomas de hepatitis aguda apuntan a una infección preferentemente asintomática o con evidencias de laboratorio de hepatitis E anictérica (elevación de enzimas hepáticas [ALT] y valores normales de bilirrubina en el suero). La sobreinfección por VHE de pacientes con enfermedad hepática crónica de cualquier etiología puede provocar lesiones hepáticas agudas superpuestas y un cuadro clínico de infección hepática aguda que puede empeorar su pronóstico54.
Áreas no endémicas para infección por VHEEn países no endémicos, la infección por VHE, causada por lo genotipos 3 y 4 (fig. 2B), suele detectarse mediante pruebas serológicas en casos con hepatitis inexplicables, sobre todo en pacientes de más de 60 años50. La enfermedad clínica en estos casos es similar a la observada en las regiones endémicas, aunque con una proporción mayor de hepatitis ictéricas. La mayoría de los pacientes son hombres de mediana edad o mayores, a menudo con patologías previas20, lo que parece justificar su peor pronóstico en comparación con los casos de zonas endémicas.
Hepatitis crónica por VHEHasta hace poco se creía que el VHE, como el VHA, solo causaba infecciones hepáticas agudas autolimitadas y casos de fallo hepático fulminante, sin que se asociara a procesos de cronificación. Sin embargo, recientemente se han descrito casos de infección por VHE con enfermedad hepática crónica, e incluso progresión a cirrosis, en pacientes inmunosuprimidos, como receptores de trasplante de órganos sólidos7,54,55, pacientes hematológicos o en quimioterapia56 o infectados por el virus de la inmunodeficiencia humana (VIH)57. Inicialmente se comunicaron 14 receptores de trasplante de órganos sólidos con ALT elevada y evidencias de infección por VHE, 8 de ellos con viremia (ARN-VHE) y elevación de ALT persistentes55. Posteriormente se han comunicado casos análogos, también en pacientes trasplantados (hígado, riñón o páncreas)50. Los pacientes con infección crónica por hepatitis E presentaban niveles inferiores de linfocitos CD2, CD3 y CD4E que los casos de infecciones por VHE autolimitadas resueltas, y un patrón histológico de hepatitis portal con infiltrado linfocitario denso y diferentes grados de fibrosis, incluso con progresión a la cirrosis, requiriendo retrasplante en algún caso20. Se han observado infecciones crónicas por VHE de genotipo 3 con cirrosis hepática en trasplantados renales58, lo que sugiere que la infección por VHE puede progresar a cirrosis. Todos estos casos de infección crónica por VHE se presentan en personas inmunodeprimidas y son de genotipo 3; esto último puede ser debido a que este genotipo es el mayoritario de las zonas en que se han observado los casos. Se necesitan más estudios para determinar si el genotipo 1 de VHE, predominante en las zonas endémicas para el VHE, puede causar infección persistente. En un estudio retrospectivo, Kamar et al.59 han observado que el 60% de 85 casos de receptores de órganos sólidos infectados por VHE desarrollaron una hepatitis crónica por este agente, sugiriendo la immunosupresión mediante tacrolimus como un factor fuertemente relacionado con la cronificación y la reducción de la dosis de este immunosupresor asociada con el aclaramiento del virus. En conjunto, estos datos han cambiado nuestra visión sobre la historia natural de la infección por VHE y apuntan hacia la existencia de una forma de infección persistente por VHE con daño hepático crónico y progresivo que puede evolucionar hacia la cirrosis. Esta situación, aun siendo todavía un acontecimiento poco frecuente, es clínicamente significativa en pacientes inmunosuprimidos, y en futuros estudios se debe valorar su impacto.
Diagnóstico de laboratorio de la infección por VHELa hepatitis E es clínicamente indistinguible de los otros tipos de hepatitis viral aguda, por lo que un diagnóstico preciso de la hepatitis E debe basarse en pruebas de laboratorio (pruebas serológicas y detección de ARN viral) (fig. 4). La pertenencia de los 4 genotipos de VHE a un único serotipo ha facilitado el desarrollo de inmunoensayos enzimáticos de diagnóstico universales tipo ELISA para detectar anticuerpos específicos (anti-VHE) de tipo IgG e IgM, sea cual sea el genotipo del VHE. Las técnicas comerciales para la detección de IgG o IgM anti-VHE se basan en la detección de anticuerpos frente a la proteína altamente conservada e inmunogénica de la cápsida viral codificada por ORF242. Las diferencias en sensibilidad y especificidad de las técnicas serológicas son especialmente relevantes en el diagnóstico de la infección por VHE. Así, una evaluación reciente de 6 inmunoensayos enzimáticos IgM anti-VHE (2 in house y 4 comerciales) muestra diferencias significativas de sensibilidad (del 72 al 98%) y especificidad (del 78 al 98%)60. Estas diferencias se deben principalmente a una baja sensibilidad para la detección de anti-VHE en la fase convalescente (falsos negativos más que falsos positivos)42. Las prestaciones analíticas de estos ensayos también se ven afectadas por la compleja cinética de la respuesta anti-VHE que puede tener una duración variable frente a cada epítopo. Así mismo, esta respuesta puede ser deficiente, especialmente durante la infección subclínica43, y disminuir significativamente después de la infección aguda53. A nivel virológico se efectúa la detección del genoma viral ARN-VHE y su genotipado por secuenciación, y para esta determinación se utilizan ensayos de PCR con transcripción reversa (RT-PCR) convencionales y en tiempo real no comerciales, in-house (no estandarizados) para la detección del ARN del VHE en muestras de sangre, heces y aguas residuales47,49,61.
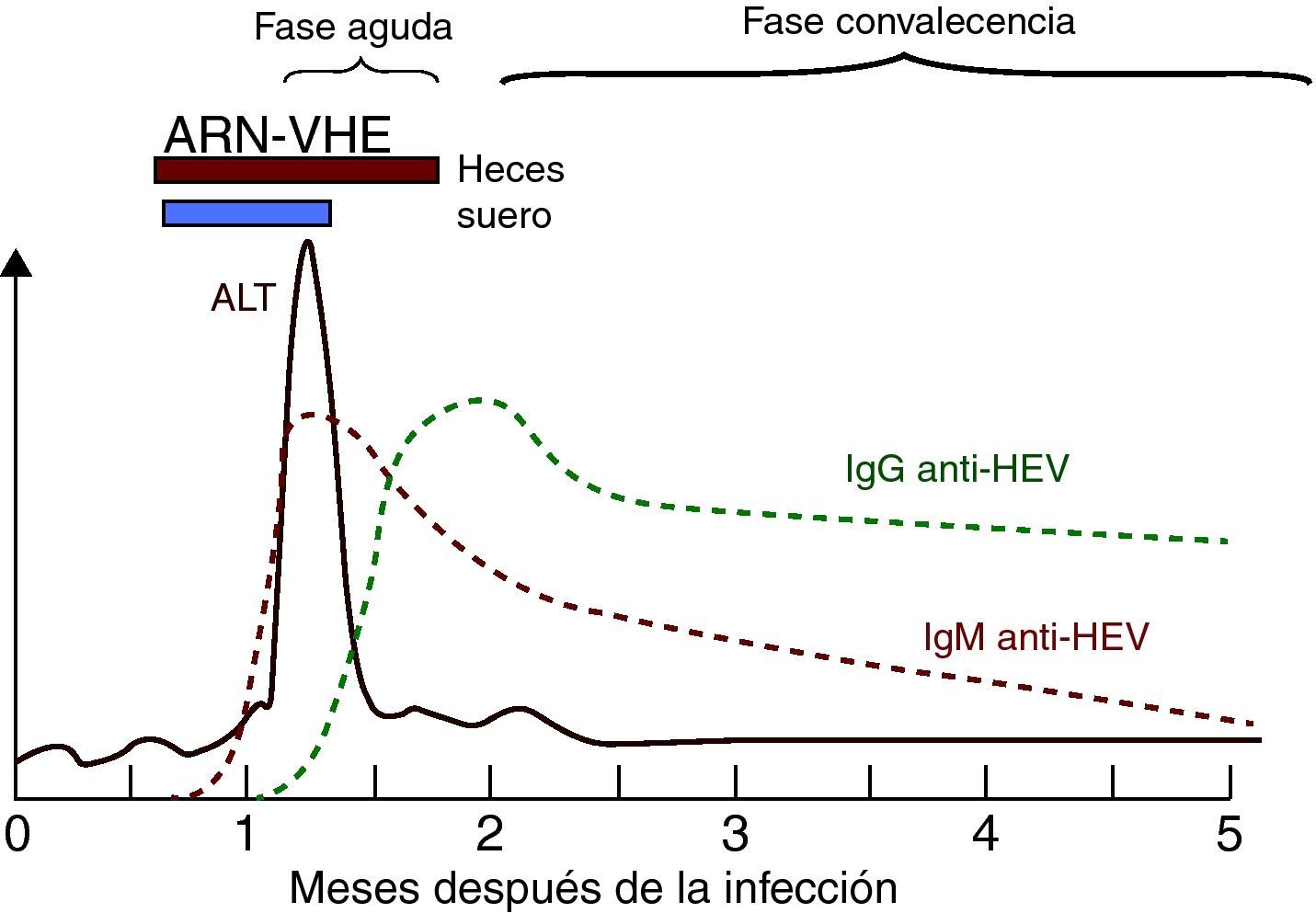
Marcadores serológicos y virológicos de la infección por el VHELa respuesta serológica anti-VHE en pacientes presenta un patrón serológico clásico de anti-VHE IgM e IgG42 (fig. 4) detectable generalmente en el momento de la aparición de la enfermedad.
La IgM anti-VHE aparece durante la fase aguda de la enfermedad tan precozmente como a los 4 días del inicio de la ictericia. Se detecta en >90% de los pacientes en las 2 primeras semanas tras la aparición de la enfermedad, con el pico en el periodo sintomático, y permanece detectable 4-5 meses42, constituyendo un marcador muy adecuado para el diagnóstico de la infección aguda. Recientemente se ha estudiado la posible utilidad de la detección de IgA anti-VHE en el diagnóstico de la infección aguda, y se ha observado que la detección de IgA anti-VHE aislada o conjuntamente con IgM anti-VHE tiene una mayor especificidad y duración que la detección del ARN-VHE en el diagnóstico de infección aguda E62. Sin embargo, son necesarios estudios adicionales para establecer la verdadera utilidad de este nuevo marcador42.
La respuesta de IgG anti-VHE es muy precoz, y comienza a desarrollarse poco después o incluso simultáneamente a la respuesta de IgM63. En macacos se ha detectado IgG anti-VHE en suero a las 3-4 semanas tras la inoculación, durante el pico de elevación de ALT, y en voluntarios humanos aumentó durante la fase sintomática de la infección14. La IgG anti-VHE aumenta a lo largo de la fase aguda y en la etapa de convalecencia, permaneciendo años después de la infección, aunque sus niveles disminuyen con el tiempo42. No obstante, es posible que la diferente duración de la persistencia de IgG anti-VHE esté relacionada con el diferente rendimiento de los métodos de evaluación utilizados. Así, algunos ensayos comerciales de IgG anti-VHE disponibles muestran concordancias que van del 40 al 70%42. Por lo tanto, la aparición de IgM anti-VHE sin IgG indica una infección muy reciente, mientras que la presencia de IgG anti-VHE sin IgM apunta a una infección pasada. No obstante, como los anticuerpos IgG anti-VHE aparecen muy temprano, ambos tipos de anticuerpos, IgG e IgM, pueden detectarse en la fase aguda.
El ARN-VHE es el único marcador virológico útil, aunque con un valor limitado, como se indica más adelante. Se puede detectar en suero y heces durante la fase aguda de la infección e incluso antes de la elevación de ALT mediante RT-PCR34. La detección de ARN-VHE permite establecer la replicación viral y su caracterización genotípica posterior. No obstante, el ARN-VHE tiene un valor limitado para el diagnóstico de infección aguda por lo breves que son los periodos de viremia (unas 2 semanas en suero y unas 4 en heces, con casos de 8 a 12 semanas), por lo que su ausencia no permite descartar el diagnóstico de infección aguda por VHE.
Por lo tanto, el diagnóstico de laboratorio de la hepatitis E aguda se basa en la presencia de IgM anti-VHE en suero y/o la detección de ARN del VHE en suero o heces. Desde el punto de vista puramente serológico, una infección aguda por el VHE es en general positiva para IgM (e IgA si lo confirman más estudios) e incluso IgG anti-VHE, mientras que solo este último es positivo para infección pasada y tiene más valor en estudios de seroprevalencia. En pacientes inmunosuprimidos, de seroconversión tardía o incluso ausente, se debe incluir la detección del ARN-VHE. En cualquier caso, y como se ha dicho anteriormente, hay que tener en cuenta que la detección de IgM-VHE presenta problemas tanto de especificidad como de sensibilidad42.
Prevención y terapia antiviral de la infección por VHEPuesto que la contaminación del agua potable con materiales fecales es la principal forma de transmisión del VHE, las medidas principales de prevención de esta infección son el saneamiento y la adecuación de las distribuciones de agua potable, así como la educación en higiene personal de la población. También es importante la correcta manipulación de los alimentos, y evitar el consumo de carne poco cocida o cruda.
La utilización de inmunoglobulinas séricas no ha demostrado capacidad para proteger frente al VHE20. En cuanto al desarrollo y la posible aplicación de vacunas frente a la infección por VHE, la existencia de un único serotipo de VHE facilita la producción de una vacuna de amplia reacción cruzada. En estudios animales varias proteínas recombinantes correspondientes a la cápsida viral (derivadas de proORF2) han demostrado ser capaces de inducir una respuesta específica de anticuerpos anti-VHE y proteger frente a la infección por VHE20. En este sentido, se han probado con éxito en voluntarios humanos 2 vacunas basadas en péptidos derivados del proORF2 (cápsida viral), que contiene epítopos neutralizantes comunes a los diferentes genotipos20,63,64,65. Así, un péptido recombinante de 56kD, una forma truncada de proORF2, induce una respuesta de anti-VHE dependiente de la dosis, y en un estudio aleatorizado desarrollado en 2.000 voluntarios del ejército del Nepal se ha observado que la hepatitis aguda E era menos frecuente en individuos receptores de esta vacuna que en los no vacunados66. La principal limitación de este estudio es que más del 99% de los individuos incluidos eran varones jóvenes (edad media, 25 años), por lo son necesarias pruebas de seguridad en mujeres embarazadas, en niños y en otros grupos de riesgo, como personas con enfermedad hepática crónica. En este mismo estudio se ha observado que los niveles de anti-VHE al final del seguimiento (media 800 días) eran inferiores a los considerados protectores en el 44% de los individuos vacunados, y se requieren estudios adicionales para establecer la duración de la protección de esta vacuna. Más recientemente se ha desarrollado otra vacuna potencial, llamada HEV-23967, que contiene como la anterior un péptido recombinante truncado de proORF2 (aminoácidos 376 a 606). Con esta vacuna, Zhu et al.68 han reportado un gran éxito en un estudio de fase III con 48.693 individuos vacunados sin infección por VHE frente a 15 casos infectados entre los 48.663 individuos que recibieron la vacuna para el VHB como placebo; no obstante, aún no se dispone de datos de seguridad e inmunogenicidad. Todavía se necesitan más estudios para determinar la duración de la protección que confieren estas vacunas. A pesar del éxito de estos ensayos preliminares, la posible comercialización de estas vacunas es una incógnita, ya que, a pesar de su evidente necesidad, el mercado potencial en los países industrializados es muy pequeño, limitado probablemente a militares y civiles que viajen a regiones endémicas. En contraste, estas vacunas serían de una gran utilidad en los países en desarrollo (especialmente en mujeres embarazadas), pero su costo tendría que ser lo suficientemente bajo como para estar al alcance de las economías de estos países.
La hepatitis E presenta peculiaridades suficientes para plantearse posibles abordajes terapéuticos, como la severidad de la infección en mujeres embarazadas, el agravamiento de la patología hepática crónica y la aparición de casos de infección crónica por VHE en individuos inmunocomprometidos. En este sentido se han comunicado algunos estudios preliminares de terapia antiviral frente a la infección crónica por VHE en pacientes trasplantados, mediante interferón pegilado69,70, observándose una respuesta viral sostenida en 4 de los 5 casos estudiados. También se ha ensayado la monoterapia con ribavirina71,72, observándose una respuesta viral sostenida en 5 de los 7 casos comunicados, rendimiento análogo al del interferón pegilado. En estudios recientes se ha mostrado la utilidad del tratamiento con ribavirina tanto en hepatitis aguda grave por VHE73 como en un paciente trasplantado cardiaco con hepatitis crónica E, en el que se consiguieron niveles indetectables de ARN-VHE74. Un posible desarrollo futuro de esta terapia antiviral frente al VHE sería centrarse en la caracterización bioquímica y estructural de las proteínas no estructurales del VHE (proteasas, helicasas y replicasas) y desarrollar inhibidores potenciales de estas proteínas. Este tipo de fármacos ya están en uso clínico para otras infecciones y se podrían utilizar como base para el desarrollo de nuevas terapias para la infección por VHE.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.