Durante los últimos años se ha registrado un aumento creciente de la población inmigrante y de viajeros procedentes de áreas endémicas de filariasis producidas por Loa loa (L. loa), Mansonella perstans (M. perstans) y Wuchereria bancrofti (W. bancrofti). Esta situación epidemiológica ha hecho necesario el desarrollo de técnicas específicas de diagnóstico molecular, alternativas al método parasitológico clásico. Por lo tanto, el objetivo planteado en este trabajo ha sido la utilización de las técnicas moleculares optimizadas en nuestro laboratorio, nested-PCR e ITS1-RFLP, en el diagnóstico de filariasis importadas, y la comparación de los resultados obtenidos con los derivados del diagnóstico parasitológico.
Material y métodosSe ha estudiado mediante la técnica de concentración de Knott, nested-PCR e ITS1-RFLP un total de 523 muestras (517 sangres, 5 helmintos adultos y un humor vítreo) que fueron remitidas al Servicio de Parasitología del Centro Nacional de Microbiología-Instituto de Salud Carlos III, entre los años 2006 y 2009, por 47 centros sanitarios de las comunidades autónomas.
ResultadosLas técnicas moleculares utilizadas demostraron ser más sensibles que el método de concentración de Knott, tanto en el diagnóstico de L. loa (n=12 frente a n=4) como en el de M. perstans (n=57 frente a n=25) en el total de muestras de sangre estudiadas.
ConclusiónLos métodos de PCR utilizados permiten un diagnóstico específico y más sensible de L. loa y M. perstans en muestras clínicas de población inmigrante y viajeros procedentes de áreas endémicas, donde estas especies de filarias son coendémicas. El método de concentración de Knott debe emplearse como técnica complementaria siempre que sea posible.
The last few years has seen an increase in the number of immigrants and travellers from endemic areas where filariasis are mainly caused by Loa loa (L. loa), Mansonella perstans (M. perstans) and Wuchereria bancrofti (W. bancrofti) species. These demographic changes has led to the need for better filariae species-specific molecular diagnostic tests to solve problems, as alternatives to the more time consuming classic parasitology methods. Thus, the objective of the present work was the implementation of optimised molecular protocols (nested-PCR and ITS1-RFLP) developed in our laboratory, for the differential diagnosis of filarial parasites. The results obtained were compared with those obtained using the conventional parasitological methods.
Material and methodsA total of 523 samples (517 peripheral blood, 5 adult worms and one vitreous body) were sent to Parasitology Department of the National Microbiology Centre, Carlos II Research Institute (ISCIII), from 47 Health Centres in the Autonomous Regions of Spain, from 2006 to 2009. The samples were studied by the Knott technique, nested-PCR and ITS1-RFLP.
ResultsThe molecular techniques applied on blood samples showed to be more sensitive that Knott's concentration technique in the diagnosis of both L. loa (n=12 versus n=4) and M. perstans (n=57 versus n=25) infections.
ConclusionsThe nested-PCR and ITS1-RFLP are potential diagnostic tools for daily routine laboratory species-specific and sensitive detection of L. loa and M. perstans filarial species in immigrant population and travellers from endemic areas where these filarial species are co-endemic. Knott's concentration technique was less sensitive than molecular methods and should be carried out as a complementary diagnostic assay.
Las filariasis humanas están restringidas a áreas endémicas tropicales y subtropicales, donde se calcula que más de 120 millones de personas están infectadas1. En los últimos años se ha registrado un aumento creciente de población inmigrante, principalmente subsahariana, procedente de zonas endémicas de filariasis, donde coexisten Loa loa (L. loa), Mansonella perstans (M. perstans) y Wuchereria bancrofti (W. bancrofti), entre otras especies de filarias2–5. Así mismo, el aumento de viajes de corta duración (<1 mes) y, sobre todo, los de larga duración (>6 meses) a zonas endémicas de filariasis, ya sea por turismo, por visitas a familiares y amigos o por cooperación o actividades misioneras, ha incrementado el riesgo de que estos individuos vuelvan a sus países de origen con los parásitos y la sintomatología correspondiente6. Ante la nueva situación, se planteaba la necesidad del desarrollo de métodos diagnósticos eficaces para detectar estas filarias y métodos que reuniesen además alta especificidad y sensibilidad, mejorando así las dificultades del diagnóstico parasitológico tradicional. Este último, basado en la observación microscópica de frotis y gota gruesa preparados directamente o tras concentración de muestras sanguíneas teñidas por el método de Giemsa, proceso que requiere personal muy cualificado y gran consumo de tiempo7. Dificultades a las que hay que sumar la frecuencia de procesos amicrofilarémicos descritos en las parasitaciones por L. loa y W. bancrofti8–10.
Además, hay que constatar la falta de sensibilidad y especificidad de los métodos serológicos disponibles en la detección de anticuerpos frente a filarias y la presencia de anticuerpos en individuos sin infección activa11,12, razón por la cual el diagnóstico serológico de las filariasis en inmigrantes procedentes de áreas endémicas no es un procedimiento apropiado para la diferenciación específica de las filariasis.
En los últimos años el Servicio de Parasitología del Centro Nacional de Microbiología-Instituto de Salud Carlos III (CNM-ISCIII) ha desarrollado y optimizado diferentes técnicas de reacción en cadena de la polimerasa (PCR) para el diagnóstico de L. loa, M. perstans y W. bancrofti13,14. Estas técnicas de PCR han sido implementadas como técnicas diagnósticas, y se realizan de forma sistemática junto con el método de concentración de Knott en la identificación de las 3 especies de filarias.
En este trabajo se presentan los resultados de un total de 523 muestras remitidas el Servicio Parasitología del CNM-ISCIII por 47 centros sanitarios de las comunidades autónomas durante el periodo comprendido entre los años 2006 y 2009.
Material y métodosSe ha llevado a cabo el estudio de un total de 523 muestras (517 muestras de sangre, 5 helmintos adultos extraídos de la conjuntiva ocular y un humor vítreo) que fueron remitidas al Servicio de Parasitología del CNM-ISCIII por un total de 47 centros sanitarios de las diferentes comunidades autónomas, durante los años 2006 (n=30), 2007 (n=173), 2008 (n=266) y 2009 (n=54) para su diagnóstico. No se pudo confirmar la precisión en la hora de recogida de las muestras de sangre y si ésta se realizó de acuerdo a la periodicidad de la filaria. Las muestras procedían en su mayoría de población inmigrante (60%), así como de viajeros y cooperantes (11%), aunque no se conocían los datos clínico-epidemiológicos de todos los pacientes (29%). La mayoría de los pacientes presentaban signos y síntomas compatibles con filariasis producida por L. loa y/o M. perstans, como eosinofilia, 20,8%; prurito y lesiones cutáneas, 7,1%; edema de Calabar, 4%; alteraciones oculares (fotofobia, dolor ocular y disminución de la agudeza visual con migración del adulto a través de la conjuntiva), 2,2%. El 2,1% de los pacientes presentaban anticuerpos frente al virus de la inmunodeficiencia humana (VIH).
El examen parasitológico de las muestras de sangre se efectuó utilizando la técnica de concentración por el método de Knott y posterior tinción de Giemsa15.
La extracción del ADN genómico (ADNg) de las muestras de sangre y del humor vítreo se llevó a cabo mediante el Kit QIAamp® DNA Blood Mini Kit (Qiagen, Hilden, Alemania), siguiendo las recomendaciones del fabricante.
El ADNg de los helmintos adultos se obtuvo por lisis celular con proteinasa K, purificación mediante extracción fenol-cloroformo y precipitación de los ácidos nucleicos con etanol16. La cuantificación y pureza del ADNg se determinó en un espectrofotómetro NanoDrop ND-1000 (Nucliber, Madrid, España). El ADNg se conservó a −20°C para su posterior análisis con los protocolos moleculares.
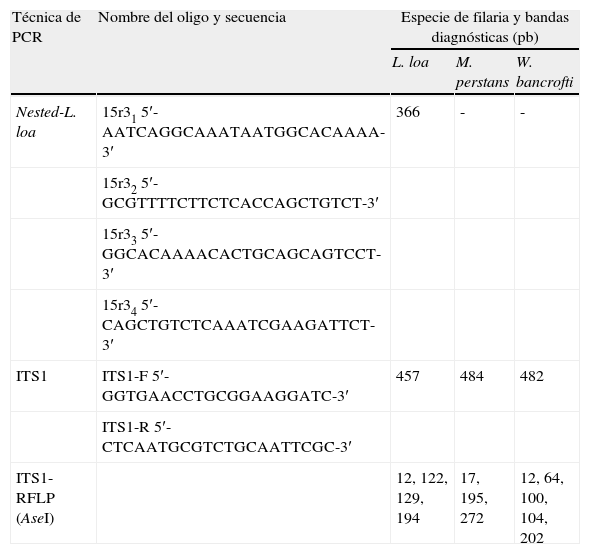
Las herramientas moleculares empleadas fueron las siguientes: a) una nested-PCR específica para L. loa, con la que se obtiene un fragmento de 366 pb correspondiente a la tercera repetición del gen que codifica la poliproteína de 15 kDa 13,17, y b) una PCR-RFLP basada en la amplificación del espacio transcrito interno 1 de los genes ribosomales (ITS-1) y posterior digestión con la enzima Ase I que resulta en un patrón de bandas diagnósticas que permiten diferenciar las especies de filarias L. loa, M. perstans y W. bancrofti14,18. En la tabla 1 se muestran los oligos utilizados en cada uno de los protocolos de PCR, así como los tamaños esperados de las bandas diagnósticas en cada caso.
Técnica de reacción en cadena de la polimerasa, secuencia de los oligos y tamaño de las bandas diagnósticas esperadas
| Técnica de PCR | Nombre del oligo y secuencia | Especie de filaria y bandas diagnósticas (pb) | ||
| L. loa | M. perstans | W. bancrofti | ||
| Nested-L. loa | 15r31 5′-AATCAGGCAAATAATGGCACAAAA-3′ | 366 | - | - |
| 15r32 5′-GCGTTTTCTTCTCACCAGCTGTCT-3′ | ||||
| 15r33 5′-GGCACAAAACACTGCAGCAGTCCT-3′ | ||||
| 15r34 5′-CAGCTGTCTCAAATCGAAGATTCT-3′ | ||||
| ITS1 | ITS1-F 5′-GGTGAACCTGCGGAAGGATC-3′ | 457 | 484 | 482 |
| ITS1-R 5′-CTCAATGCGTCTGCAATTCGC-3′ | ||||
| ITS1-RFLP (AseI) | 12, 122, 129, 194 | 17, 195, 272 | 12, 64, 100, 104, 202 | |
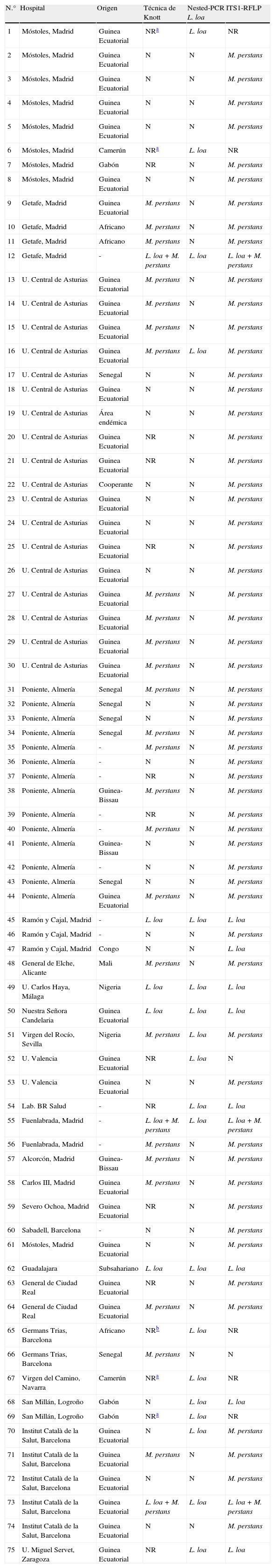
De las 517 muestras de sangre estudiadas, un total de 70 (13,5%) resultaron positivas por alguno de los 3 métodos diagnósticos utilizados, de las cuales 12 fueron positivas a L. loa (2,3%), 58 a M. perstans (11,2%) y 3 mixtas (L. loa/M. perstans) (0,58%). Estas 3 últimas muestras, al ser inicialmente mixtas por la técnica de Knott, se trataron separadamente del resto de las muestras estudiadas. Ninguna de las muestras fue positiva para W. bancrofti. En la tabla 2 se muestran los resultados correspondientes a las 70 muestras de sangre positivas, los 4 helmintos adultos y el humor vítreo, así como algunas de las características de éstas. La eosinofilia estuvo asociada a M. perstans en 12 casos, el prurito en 5 casos y la presencia de anticuerpos frente a VIH en uno solo. Las muestras positivas tanto para L. loa como las mixtas (L. loa/M. perstans) no pudieron asociarse a ningún signo clínico, o analítico, compatible con filariasis por falta de estos datos.
Datos correspondientes a algunas de las muestras clínicas estudiadas
| N.° | Hospital | Origen | Técnica de Knott | Nested-PCR L. loa | ITS1-RFLP |
| 1 | Móstoles, Madrid | Guinea Ecuatorial | NRa | L. loa | NR |
| 2 | Móstoles, Madrid | Guinea Ecuatorial | N | N | M. perstans |
| 3 | Móstoles, Madrid | Guinea Ecuatorial | N | N | M. perstans |
| 4 | Móstoles, Madrid | Guinea Ecuatorial | N | N | M. perstans |
| 5 | Móstoles, Madrid | Guinea Ecuatorial | N | N | M. perstans |
| 6 | Móstoles, Madrid | Camerún | NRa | L. loa | NR |
| 7 | Móstoles, Madrid | Gabón | NR | N | M. perstans |
| 8 | Móstoles, Madrid | Guinea Ecuatorial | N | N | M. perstans |
| 9 | Getafe, Madrid | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 10 | Getafe, Madrid | Africano | M. perstans | N | M. perstans |
| 11 | Getafe, Madrid | Africano | M. perstans | N | M. perstans |
| 12 | Getafe, Madrid | - | L. loa+M. perstans | L. loa | L. loa+M. perstans |
| 13 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 14 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 15 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 16 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | L. loa | M. perstans |
| 17 | U. Central de Asturias | Senegal | N | N | M. perstans |
| 18 | U. Central de Asturias | Guinea Ecuatorial | N | N | M. perstans |
| 19 | U. Central de Asturias | Área endémica | N | N | M. perstans |
| 20 | U. Central de Asturias | Guinea Ecuatorial | NR | N | M. perstans |
| 21 | U. Central de Asturias | Guinea Ecuatorial | NR | N | M. perstans |
| 22 | U. Central de Asturias | Cooperante | N | N | M. perstans |
| 23 | U. Central de Asturias | Guinea Ecuatorial | N | N | M. perstans |
| 24 | U. Central de Asturias | Guinea Ecuatorial | N | N | M. perstans |
| 25 | U. Central de Asturias | Guinea Ecuatorial | NR | N | M. perstans |
| 26 | U. Central de Asturias | Guinea Ecuatorial | N | N | M. perstans |
| 27 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 28 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 29 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 30 | U. Central de Asturias | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 31 | Poniente, Almería | Senegal | M. perstans | N | M. perstans |
| 32 | Poniente, Almería | Senegal | N | N | M. perstans |
| 33 | Poniente, Almería | Senegal | N | N | M. perstans |
| 34 | Poniente, Almería | Senegal | M. perstans | N | M. perstans |
| 35 | Poniente, Almería | - | M. perstans | N | M. perstans |
| 36 | Poniente, Almería | - | N | N | M. perstans |
| 37 | Poniente, Almería | - | NR | N | M. perstans |
| 38 | Poniente, Almería | Guinea-Bissau | M. perstans | N | M. perstans |
| 39 | Poniente, Almería | - | NR | N | M. perstans |
| 40 | Poniente, Almería | - | M. perstans | N | M. perstans |
| 41 | Poniente, Almería | Guinea-Bissau | N | N | M. perstans |
| 42 | Poniente, Almería | - | N | N | M. perstans |
| 43 | Poniente, Almería | Senegal | N | N | M. perstans |
| 44 | Poniente, Almería | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 45 | Ramón y Cajal, Madrid | - | L. loa | L. loa | L. loa |
| 46 | Ramón y Cajal, Madrid | - | N | N | M. perstans |
| 47 | Ramón y Cajal, Madrid | Congo | N | N | L. loa |
| 48 | General de Elche, Alicante | Mali | M. perstans | N | M. perstans |
| 49 | U. Carlos Haya, Málaga | Nigeria | L. loa | L. loa | L. loa |
| 50 | Nuestra Señora Candelaria | Guinea Ecuatorial | L. loa | L. loa | L. loa |
| 51 | Virgen del Rocío, Sevilla | Nigeria | M. perstans | L. loa | M. perstans |
| 52 | U. Valencia | Guinea Ecuatorial | NR | L. loa | N |
| 53 | U. Valencia | Guinea Ecuatorial | N | N | M. perstans |
| 54 | Lab. BR Salud | - | NR | L. loa | L. loa |
| 55 | Fuenlabrada, Madrid | - | L. loa+M. perstans | L. loa | L. loa+M. perstans |
| 56 | Fuenlabrada, Madrid | - | M. perstans | N | M. perstans |
| 57 | Alcorcón, Madrid | Guinea-Bissau | M. perstans | N | M. perstans |
| 58 | Carlos III, Madrid | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 59 | Severo Ochoa, Madrid | Guinea Ecuatorial | NR | N | M. perstans |
| 60 | Sabadell, Barcelona | - | N | N | M. perstans |
| 61 | Móstoles, Madrid | Guinea Ecuatorial | N | N | M. perstans |
| 62 | Guadalajara | Subsahariano | L. loa | L. loa | L. loa |
| 63 | General de Ciudad Real | Guinea Ecuatorial | NR | N | M. perstans |
| 64 | General de Ciudad Real | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 65 | Germans Trias, Barcelona | Africano | NRb | L. loa | NR |
| 66 | Germans Trias, Barcelona | Senegal | M. perstans | N | N |
| 67 | Virgen del Camino, Navarra | Camerún | NRa | L. loa | NR |
| 68 | San Millán, Logroño | Gabón | N | L. loa | L. loa |
| 69 | San Millán, Logroño | Gabón | NRa | L. loa | NR |
| 70 | Institut Català de la Salut, Barcelona | Guinea Ecuatorial | N | L. loa | M. perstans |
| 71 | Institut Català de la Salut, Barcelona | Guinea Ecuatorial | M. perstans | N | M. perstans |
| 72 | Institut Català de la Salut, Barcelona | Guinea Ecuatorial | N | N | M. perstans |
| 73 | Institut Català de la Salut, Barcelona | Guinea Ecuatorial | L. loa+M. perstans | L. loa | L. loa+M. perstans |
| 74 | Institut Català de la Salut, Barcelona | Guinea Ecuatorial | N | N | M. perstans |
| 75 | U. Miguel Servet, Zaragoza | Guinea Ecuatorial | NR | L. loa | L. loa |
N: negativo; NR: no realizado; -: sin datos.
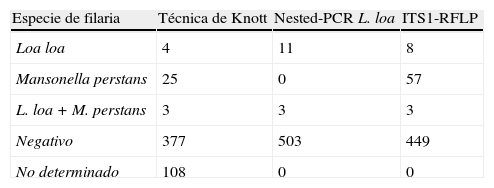
En la tabla 3 se muestra un resumen de los resultados obtenidos con las 517 muestras de sangre en función de la técnica diagnóstica utilizada. La técnica de concentración de Knott resultó ser menos sensible que los métodos moleculares tanto en el diagnóstico de L. loa (n=4 frente a n=12) como en el de M. perstans (n=25 frente a n=57) en el total de muestras positivas. Sin embargo, se dieron ciertas discrepancias como en el caso de la muestra #66 en la que solo la técnica de concentración de Knott permitió la detección de M. perstans de aquí que el número total de muestras positivas a esta filaria por todos los métodos diagnósticos utilizados sea de n=58. Así mismo, el número total de muestras positivas a L. loa fue de n=12 y no n=11, ya que la muestra #47 solo pudo ser detectada mediante la ITS1-RFLP. Hay que tener en cuenta que en 11 muestras que resultaron positivas por los métodos moleculares fue imposible realizar la técnica de concentración de Knott por falta de material. Estas pudieron ser diagnosticadas por alguna de las técnicas de PCR resultando ser 3 positivas a L. loa y 8 a M. perstans. Por otro lado, las muestras #16 y #51 únicamente fueron positivas a M. perstans por la técnica de Knott y por PCR (ITS1-RFLP) y positivas a L. loa mediante la nested-PCR. Además, las muestras #68 y #70 fueron negativas por la técnica de Knott, sin embargo, L. loa se detectó en ambas muestras por la nested-PCR. En estas muestras, #68 y #70, se determinó la presencia de L. loa y M. perstans, respectivamente, mediante ITS1-RFLP. Por lo tanto, estos individuos presentaban loasis oculta ya que las microfilarias de L. loa no pudieron ser detectadas en sangre por los métodos tradicionales. Finalmente, las 3 infecciones mixtas fueron detectadas tanto por la técnica de Knott como por la ITS-RFLP (tablas 2 y 3).
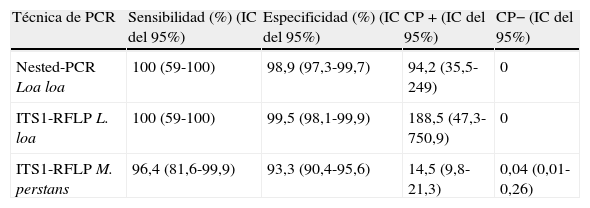
La sensibilidad y especificidad, así como los cocientes de probabilidad positivos y negativos de cada una de las técnicas de PCR, se muestran en la tabla 4.
De los 5 helmintos adultos, solo se pudo realizar la extracción de ADNg con éxito en 4 casos ya que las condiciones de conservación en formol de uno de ellos impidió la obtención de ADN de calidad para llevar a cabo su amplificación. Las 4 muestras fueron positivas mediante nested-PCR y además 2 de ellas fueron identificadas también por la ITS1-RFLP. Hay que resaltar, además, que la muestra de humor vítreo de un paciente con filariasis ocular resultó positiva mediante la nested-PCR (tabla 2), confirmando la presencia de material nucleico parasitario en dicha muestra.
DiscusiónEn este trabajo se presentan los resultados del diagnóstico de filariasis mediante PCR, así como con el método de concentración de Knott, en 523 muestras clínicas remitidas al Servicio de Parasitología del CNM-ISCIII. Actualmente, el diagnóstico de filariasis en el ámbito hospitalario se basa en la sospecha clínica y la presencia de eosinofilia. Además, el diagnóstico de certeza que se realiza a través de la observación al microscopio de las microfilarias en sangre, en frotis realizados directamente y teñidos con Giemsa o tras un método de concentración como el de Knott, tiene una sensibilidad baja; en este sentido hay que destacar que en áreas endémicas el 70% de los individuos son amicrofilarémicos (por ejemplo, loasis oculta)10,17. A pesar de que la microscopia continúa siendo la piedra angular en el diagnóstico de estas especies de filarias, esta metodología requiere además personal muy cualificado. Así mismo, la detección de anticuerpos del tipo IgG4 que se lleva a cabo con diferentes tests serológicos presenta como desventaja la falta de sensibilidad (del 56 al 98%) y especificidad (del 78 al 98%) para establecer un diagnóstico certero debido a la ausencia de infección activa y a las reacciones cruzadas con otros helmintos, respectivamente19,20. Únicamente la detección de antígenos circulantes de filarias es un método útil en el diagnóstico de W. bancrofti, relacionándose las cantidades de antígeno Og4C3 con la intensidad de la parasitación21.
Por el contrario, el análisis de las muestras mediante las técnicas moleculares, nested-PCR e ITS-RFLP, optimizadas en nuestro laboratorio, permiten la detección diferencial y específica de L. loa y M. perstans en la población inmigrante, así como en viajeros y cooperantes procedentes de áreas endémicas con gran sensibilidad y especificidad como queda reflejado en la tabla 4. Además, el cálculo de los valores de los cocientes de probabilidad positivos (CP+) y del cociente de probabilidad negativo (CP−), que dependen de los valores de sensibilidad y especificidad de las técnicas de PCR, resultó en unos valores elevados de CP+ que indican una mejor capacidad para diagnosticar la presencia de enfermedad y valores bajos de CP− indicando una mejor capacidad diagnóstica de la prueba en relación con la técnica de Knott (tabla 4).
Sensibilidad y especificidad de las técnicas de reacción en cadena de la polimerasa
| Técnica de PCR | Sensibilidad (%) (IC del 95%) | Especificidad (%) (IC del 95%) | CP+(IC del 95%) | CP− (IC del 95%) |
| Nested-PCR Loa loa | 100 (59-100) | 98,9 (97,3-99,7) | 94,2 (35,5-249) | 0 |
| ITS1-RFLP L. loa | 100 (59-100) | 99,5 (98,1-99,9) | 188,5 (47,3-750,9) | 0 |
| ITS1-RFLP M. perstans | 96,4 (81,6-99,9) | 93,3 (90,4-95,6) | 14,5 (9,8-21,3) | 0,04 (0,01-0,26) |
CP+: cociente de probabilidad positivo; CP−: cociente de probabilidad negativo; IC: intervalo de confianza.
La ITS-RFLP, además, posibilita la detección y discriminación específica de estas 2 especies de filarias de W. bancrofti. Aunque en las 517 sangres analizadas no se detectó ningún caso de parasitación por esta especie de filaria, la utilidad de esta técnica en el diagnóstico diferencial de W. bancrofti se ha podido validar en un trabajo publicado previamente14.
Hay que destacar también que el diagnóstico molecular no sólo se puede realizar a partir de sangre conservada con EDTA, sino que además se puede emplear también en muestras de sangre recogidas en papel Whatman14. Esta observación es de interés en el caso de llevar a cabo encuestas epidemiológicas en países endémicos donde existen serias dificultades para la conservación y el transporte de las muestras a laboratorios de referencia. Así mismo, los protocolos moleculares han sido aplicados con éxito a partir del ADNg obtenido tanto de helmintos adultos como de humor vítreo.
Definitivamente, el diagnóstico molecular es más sensible y preciso que el método de concentración de Knott. Además, hay que tener en cuenta, en la gran mayoría de los casos, la cantidad de sangre que se remite al analista es menor de 1ml, cantidad insuficiente para la realización del método de concentración de Knott, siendo solo posible la extracción de ADNg, para la que únicamente se necesitan 100-200μl que después se utiliza en las reacciones de PCR. En nuestro caso fueron un total de 108 muestras de sangre las que no pudieron ser analizadas por este motivo.
El número de muestras que resultaron positivas en el total de 517 muestras de sangre estudiadas alcanzó un 13,5%, de las que 12 fueron positivas a L. loa (2,3%). Este resultado es algo superior al obtenido en un estudio de detección de loasis mediante microscopia realizado a 1.638 inmigrantes procedentes de zonas endémicas en los que 30 de ellos (1,83%) resultaron positivos2. En un estudio previo de 40 muestras de sangre de individuos subsaharianos se encontró un 5% de parasitación por L. loa14. Quizás las diferencias encontradas se puedan explicar por la sensibilidad de los protocolos de amplificación empleados o por las diferencias en el origen geográfico de los pacientes analizados.
Recientemente se han descrito trabajos en los que se valora la asociación entre las infecciones por helmintos, entre ellos M. perstans y L. loa, con el VIH4,22. En nuestro caso 11 de los individuos (2,1%) presentaban anticuerpos frente al VIH, sin embargo solo en uno de los individuos seropositivos se detectó M. perstans. También se ha descrito que existe una correlación entre la presencia de eosinofilia y las alteraciones cutáneas con infecciones por helmintos23,24. En este sentido, aunque las infecciones por M. perstans son a menudo asintomáticas, pueden causar eosinofilia y prurito4. Así, en 17 individuos con datos clínicos, la eosinofilia estuvo asociada a M. perstans en 12 y el prurito en 5 de ellos. En dos de las muestras positivas a L. loa los individuos refirieron el paso ocular del adulto.
Es frecuente entre los habitantes de zonas endémicas la parasitación con varias especies de filarias como por ejemplo L. loa/M. perstans25. En nuestro caso se detectaron 3 infecciones mixtas por L. loa/M. perstans, que no pudieron asociarse a ningún signo clínico o analítico compatible con filariasis por falta de datos clínico-epidemiológicos. Una de las infecciones mixtas procedía de un individuo de Guinea Ecuatorial.
Por otro lado, todas las muestras diagnosticadas procedentes de viajeros y cooperantes de áreas endémicas fueron negativas, si bien el número de no fue muy elevado respecto al total (11%). Recientemente se ha descrito un caso de loasis oculta en un individuo japonés que tras un viaje a Camerún presentó sintomatología compatible con loasis y paso del parásito adulto por la conjuntiva ocular sin microfilaremia; en este caso no se pudo llevar a cabo el diagnóstico mediante la nested-PCR utilizada en el presente trabajo11.
La ITS1-RFLP utilizada ha sido previamente evaluada en la detección y discriminación de las 3 especies de filarias en muestras de sangre procedentes de inmigrantes subsaharianos, aunque la sensibilidad de esta PCR no parece ser lo suficientemente elevada para el diagnóstico de loasis oculta en individuos amicrofilarémicos. La positividad frente a L. loa obtenida en las muestras de 3 inmigrantes procedentes de Guinea Ecuatorial (#16 y #70) y Nigeria (#51), respectivamente, confirma la mayor sensibilidad de la nested-PCR frente a la ITS1-RFLP en el diagnóstico de loasis oculta. Esta nested-PCR ha sido utilizada previamente con éxito en el diagnóstico de loasis oculta en Gabón y Guinea Ecuatorial13,17,26. Aunque si bien en el caso de las muestras #47 y #68, correspondientes a inmigrantes de Congo y Gabón respectivamente, la ITS1-RFLP resultó tener mayor o igual sensibilidad que la nested-PCR respectivamente.
Para terminar se debe indicar que con el fin de aumentar la sensibilidad de la ITS1-RFLP, se han desarrollado 3 nested-PCR diseñadas a partir de esta PCR, específicas para cada una de las especies de filarias, y que se encuentran en fase de validación para su incorporación en el diagnóstico de rutina14.
En conclusión, los métodos moleculares desarrollados deben ser utilizados simultáneamente junto con la técnica de concentración de Knott en el diagnóstico y diferenciación de L. loa, M. perstans y W. bancrofti en muestras clínicas de individuos procedentes de áreas endémicas donde coexisten las 3 especies de filarias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo financiado por RICET-FIS (RD06/0021/0019). Este trabajo ha sido posible gracias a las muestras suministradas por los clínicos de los diferentes centros sanitarios de las comunidades autónomas.