La tos ferina es una enfermedad reemergente. Describimos la investigación de un brote de tos ferina y las medidas de control adoptadas.
MétodosSe reconstruyó el evento a través de un estudio longitudinal de incidencia. Además de los casos notificados, se realizó una búsqueda activa a partir de la lista de asistentes a las colonias a través de llamadas telefónicas. A todos los casos se les aplicó la encuesta epidemiológica, se confirmó sus antecedentes vacunales con la historia clínica informatizada y se les propuso la obtención de muestras para confirmación analítica. La descripción del brote se realizó a través de la curva epidémica, las tasas de ataque, el riesgo relativo, la prueba de tendencia lineal por edades y la cobertura vacunal.
ResultadosDe los 30 casos que se diagnosticaron 22 (73,3%) correspondían a los integrantes de las colonias. En éstas, la tasa de ataque fue del 21,8%, del 26,7% entre los niños y preadolescentes respectivamente, aumentando linealmente con la edad. El 86,4% de este último grupo estaban correctamente vacunados incluyendo la quinta dosis a los cuatro-seis años de edad. El 90% de los casos del brote fueron detectados a partir del estudio minucioso de los primeros casos y las llamadas telefónicas a los asistentes a las colonias.
ConclusionesLa búsqueda activa de casos permitió el estudio de un brote de tos ferina con elevada tasa de ataque en niños y preadolescentes y elevada cobertura vacunal y la aplicación de medidas de control que contribuyeron a la detención del brote.
Whooping cough is a re-emerging disease. We describe the investigation of an outbreak of whooping cough and the measures of control adopted.
MethodsThe event was reconstructed through a longitudinal study of incidence. In addition to the notified cases, an active search from the list of those who attended summer camps was made through telephone calls. An epidemiological survey was applied to all cases; vaccination history was confirmed with computerised clinical history and the obtaining of samples for analytical confirmation was proposed. The description of the outbreak was made through the epidemic curve, the attack rates, the relative risk and the linear trend by ages and the vaccination coverage.
ResultsOf the 30 cases that appeared, 22 (73.3%) were among the members of the summer camps. In these, the attack rate was 21.8%, 26.7% among the children and adolescents increasing linearly with the age. The large majority (86.4%) of this last group were correctly vaccinated, including the fifth dose at the age of 4-6 years. Through the meticulous study of the first cases and the telephone calls to those who attended the summer camp, 90% of the cases of the outbreak were detected.
ConclusionsThe active search of cases allowed an outbreak of whooping cough with a high attack rate to be studied in children and adolescents with a high vaccination coverage, and the application of control measures that contributed to stop the outbreak.
En los últimos 15 años, la tos ferina lejos de ser controlada ha presentado un incremento en el número de notificaciones en los países de la Unión Europea, en Estados Unidos, así como en otros países1,2. Este incremento puede ser debido tanto a mejoras en medios diagnósticos como a un aumento real en el número de casos3.
Ni la infección ni la inmunización (con células enteras o acelular) confieren inmunidad de por vida, debido a que ésta va menguando con el tiempo. Así Bordetella pertussis (B. pertussis) está presente en países con elevadas coberturas de vacunación en niños produciendo ondas epidémicas cada tres o cuatro años4 con casos en adolescentes y adultos. Estos actúan como reservorio infectando a niños menores de un año no inmunizados en cuyo caso la gravedad es mayor5–8. Se estima que la incidencia en adolescentes y adultos varía de 170 a 550 casos por 100.000 habitantes y año9,10 pudiendo ser su presentación clínica más inespecífica en forma de tos atípica y prolongada.
Algunos autores sugieren que el aumento en la incidencia es atribuible a una disminución en el efecto protector de la vacuna y ello sería debido a cambios en el patógeno11,12. Los brotes de tos ferina han dejado de ser algo anecdótico presentándose con cierta frecuencia en el ámbito familiar, escolar, e incluso comunitario13.
El objetivo de nuestro estudio es describir la investigación de un brote de tos ferina, así como las medidas de control adoptadas.
MétodosEl 28 de agosto de 2010 la Unidad de Vigilancia Epidemiológica de la Región Sanitaria de Lleida recibió la comunicación de un caso de tos ferina diagnosticado mediante la técnica de PCR en un niño de 12 años de edad. Al aplicar la encuesta epidemiológica se detectó un nuevo caso en una hermana de nueve años con un cuadro clínico compatible y con diagnóstico microbiológico en curso. Ambos casos tenían el antecedente común de haber asistido a unas colonias en la comarca de La Cerdaña, en el Pirineo Catalán, los días previos al inicio de los primeros síntomas. El período de esta actividad fue del 19 de julio al 1 de agosto. Entre el 30 de agosto y el 1 de septiembre se detectaron 12 nuevos casos clínicamente compatibles en el Área Básica de Salud de Tárrega (Lleida), todos ellos relacionados directamente con las citadas colonias o bien familiares o amigos de los asistentes a éstas.
Se reconstruyó el evento a través de un estudio longitudinal de incidencia. Se consideró caso todo paciente con tos de dos o más semanas de duración asociado con el brote. Además de los casos directamente relacionados con la asistencia a las colonias se incluyeron los secundarios a éstos. Se estableció un sistema de búsqueda activa de casos a través de contactos telefónicos diarios con el Centro de Salud y el contacto telefónico con todas las familias de los integrantes de las colonias.
A todos los casos se les aplicó la encuesta epidemiológica por parte de técnicos en salud pública, se les informó sobre la enfermedad y las medidas preventivas y se les derivó al Centro de Salud para tratamiento. La encuesta epidemiológica del Departamento de Salud de la Generalitat de Cataluña incluye a parte de los datos de filiación, información sobre el cuadro clínico, el diagnóstico, los antecedentes vacunales, las posibles fuentes de infección y las medidas de control adoptadas. Los antecedentes vacunales fueron comprobados en la historia clínica informatizada.
A los casos que acudieron al Centro de Salud se les propuso la obtención de un frotis nasofaríngeo para detección de B. pertussis en el Laboratorio de Microbiología del Hospital Universitario de Vall d’Hebrón de Barcelona. La primera muestra fue obtenida el 20 de agosto, el resto se obtuvieron entre el 1 y el 9 de septiembre. En todas ellas se realizó la técnica PCR múltiple en tiempo real para B. pertussis (región genómica IS481) y B. parapertussis (región IS1001), y detección del producto amplificado con sondas tipo molecular beacons siguiendo las instrucciones del fabricante (Cepheid) en un termociclador Sunnyvale (Cepheid).
La descripción de variables cualitativas se realizó a través de distribuciones de frecuencias y las cuantitativas a través de la media aritmética, la desviación estándar, los valores mínimos y los máximos. Como medida de frecuencia se utilizó la incidencia acumulada (IA) y como medida de asociación el riesgo relativo (RR) acompañado del intervalo de confianza del 95% (IC 95%). A nivel familiar se calculó la tasa de ataque secundaria (TAS) descontando del denominador los casos directamente originados en las colonias. La asociación entre dos variables cualitativas se realizó a través de la prueba de Chi-cuadrado y la asociación entre una variable cualitativa y una cuantitativa a través de la prueba de Kruskal-Wallis. Así mismo, se empleó la prueba de Chi-cuadrado de tendencia lineal para tal fin. El grado de significación aceptado fue de p<0,05.
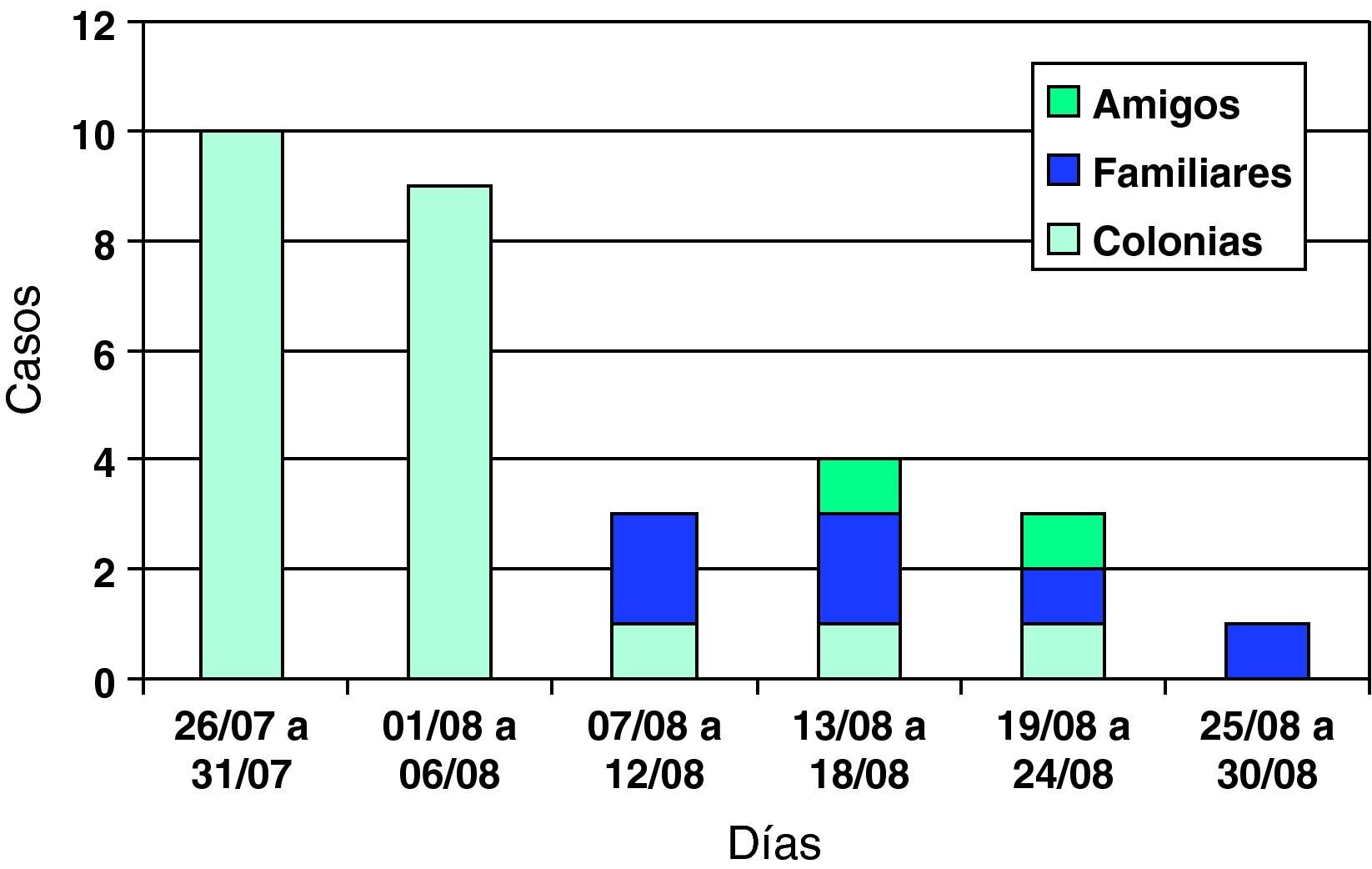
ResultadosSe diagnosticaron un total de 30 casos, 22 (73,3%) entre los convivientes de las colonias, seis (20,0%) entre familiares de los asistentes a colonias y dos (6,6%) entre amigos de los asistentes a éstas. Los casos pertenecen a nueve municipios del Área Básica de Salud de Tárrega. La curva epidémica se detalla en la figura 1. Se observó que los casos iniciaron la sintomatología en la segunda mitad del periodo de colonias y a la vuelta de éstas y posteriormente aparecieron los casos en familiares y amigos.
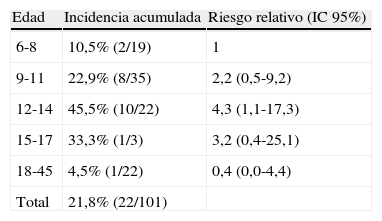
En el grupo de colonias la IA fue del 21,8% (22/101), en mujeres fue de 24,5% (13/53) y en los hombres del 18,8% (9/48) no observándose diferencias estadísticamente significativas. En los niños la IA fue del 26,7% (20/75) y en los adultos del 7,7% (2/26) no observándose diferencias estadísticamente significativas. La edad de los casos osciló de ocho a 36 años. En la tabla 1 se presenta la IA por grupos de edad, así como el RR acompañado del correspondiente IC 95%; la incidencia se fue incrementando progresivamente de los seis a los 14 años duplicándose en cada intervalo (p de tendencia lineal=0,01); posteriormente, ésta disminuyó.
Incidencia acumulada por grupos de edad y riesgo relativo en las comarcas de Lleida, 2010
| Edad | Incidencia acumulada | Riesgo relativo (IC 95%) |
| 6-8 | 10,5% (2/19) | 1 |
| 9-11 | 22,9% (8/35) | 2,2 (0,5-9,2) |
| 12-14 | 45,5% (10/22) | 4,3 (1,1-17,3) |
| 15-17 | 33,3% (1/3) | 3,2 (0,4-25,1) |
| 18-45 | 4,5% (1/22) | 0,4 (0,0-4,4) |
| Total | 21,8% (22/101) |
Se presentaron seis casos secundarios entre los convivientes familiares de los casos relacionados con las colonias, todos ellos en adultos. La TAS a nivel familiar fue del 10,5% (6/56) y si en el denominador solamente tenemos en cuenta los adultos dicha TAS pasó a ser del 14,6% (6/41). En ninguna de las familias en que se presentó algún caso había contactos de edad inferior a un año.
El 63,3% de los casos (19/30) acudieron inicialmente al sistema sanitario o fueron detectados al requerir asistencia; el 36,7% restante (11/30) fueron detectados a través de las llamadas telefónicas a las familias de los asistentes a las colonias.
El cuadro clínico estuvo compuesto por: tos de dos o más semanas de duración en el 100,0% de los casos (30/30); paroxismos tusígenos en el 89,7% (26/29); estridor inspiratoria en el 60,7% (17/28); apnea en el 29,6% (8/27); vómito postusígeno en el 26,7% (8/30), y fiebre en el 16,7% (5/30). La duración de la tos se pudo conocer en el 90,0% de los casos (27), ésta osciló de 18 a 60 días con una media de 35,7 días y una desviación estándar de 11,2. No se presentaron complicaciones ni hospitalizaciones.
Se obtuvieron muestras de frotis nasofaríngeo en 19 pacientes, en siete (36,8%) de ellos se detectó B. pertussis a través de la técnica de PCR. El tiempo transcurrido entre la fecha de inicio de los síntomas y de obtención de la muestra tuvo una media de 20,7 días y una desviación estándar de 10,7 en los casos con PCR positiva y de 24,3 y 9,7 respectivamente en aquellos en que la PCR resultó negativa no observándose diferencia estadísticamente significativa.
Los antecedentes vacunales se pudieron comprobar en 24 de los 30 casos (80,0%). Los seis casos restantes correspondían a adultos que por su edad no tuvieron oportunidad de vacunarse. Entre los 22 asistentes a las colonias, 19 (86,4%) estaban correctamente vacunados, es decir habían recibido cuatro dosis (un caso) e incluso cinco dosis (18 casos) incluyendo la de los cuatro-seis años añadida al calendario de Cataluña en 1999. Los tres niños incorrectamente vacunados correspondían: uno con cero dosis, uno con una y otro con cuatro, todos ellos deberían haber recibido cinco dosis. Los dos casos en niños amigos de los asistentes a colonias estaban correctamente vacunados con cinco dosis.
Para el control del brote se adoptaron las siguientes medidas: tratamiento de los casos con claritromicina o eritromicina y aislamiento durante los cinco primeros días de tratamiento, quimioprofilaxis con eritromicina a los contactos familiares (solo si habían convivientes menores de un año de edad), revisión del estado vacunal de 18 contactos domiciliarios. Únicamente se aplicó la quimioprofilaxis a tres contactos de una familia reticente a la vacunación, en esta misma familia se propuso la vacunación de dos contactos hecho que no fue aceptado.
DiscusiónSe estudió un brote de tos ferina con una elevada tasa de ataque en niños preadolescentes con elevada cobertura vacunal y cuyas medidas de control contribuyeron a la detención del brote.
En la reconstrucción como cohorte histórica las fuentes de información se consideran fiables (datos sociodemográficos y registros vacunales), en cambió, la determinación de la fecha de inicio de síntomas o su duración obtenidas a través de la encuesta epidemiológica podrían tener cierto sesgo de memoria.
La primera parte de la curva epidémica, los primeros 12 días del brote, presenta una tipología holomiántica propia de una exposición prácticamente simultánea a una misma fuente de infección acaecida dentro del período de colonias, generando el 86,3% (19/22) de los casos directamente relacionados con la estancia. El retraso en la detección del brote y la dificultad en la determinación de la fecha de inicio de síntomas de los primeros casos dificultaron la identificación del caso índice.
Destaca la elevada tasa de ataque en niños (más de una cuarta parte enfermaron), el incremento lineal de dicha tasa en relación con la edad de los niños y la elevada cobertura vacunal en el grupo. La gran mayoría había recibido incluso cinco dosis y la tasa de ataque en niños hasta 11 años, que se supone deberían estar protegidos frente a la tos ferina, es también elevada y progresiva con la edad. Todas estas circunstancias sugieren un nivel de transmisión superior a episodios similares14–16, explicable por el contexto de una convivencia intensa, y una elevada y precoz susceptibilidad que podría ser atribuible a una insuficiente efectividad de la vacuna.
Diferentes estudios sugieren que divergencias antigénicas entre la cepa circulante y la cepa vacunal han contribuido a una disminución del efecto protector de la vacuna incrementando la incidencia en vacunados11,12,16. En estos últimos, la expresión del cuadro clínico sería más evidente, hecho que contribuiría a una mayor detección de casos12. En cambio, aquellos que adquieren la infección de manera natural poseen una inmunidad más duradera12,17 y la presentación clínica es más inespecífica dificultando así su detección. Se está avanzando en la investigación de nuevas vacunas que mejoren su efectividad18, mientras tanto se hace necesario introducir en el calendario vacunal la dosis booster en adolescentes19–21.
En los adultos, tanto en el entorno de las colonias como en el familiar, la tasa de ataque estuvo por debajo de las descritas en otros brotes9,10. La inespecificidad del cuadro clínico en este grupo de edad y los posibles contactos repetidos con el microorganismo explicarían este patrón.
Únicamente un 10% de los casos fueron detectados por el sistema sanitario (por dos centros diferentes), casi dos terceras parte se detectó a partir de la investigación de los primeros y en el resto, un tercio, fue necesaria la encuesta telefónica para su detección. El mantenimiento de un buen nivel de sospecha y el estudio minucioso de cada caso y sus contactos u otras personas expuestas a la misma fuente hace posible la detección de brotes que, incluso presentando una elevada tasa de ataque como en éste, podrían pasar inadvertidos.
A pesar de la detección tardía del brote, un mes después del inicio de los primeros casos, su estudio inmediato y la rápida implantación de las medidas de control contribuyeron a abortar el episodio; este hecho fue crucial dada la circunstancia de que 10 días después de la primera notificación empezaba el curso escolar. Este tipo de actuaciones inmediatas han sido sugeridas y evaluadas con éxito en brotes similares a éste9,10,15,22,23.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.