Describir las características clínicas, las complicaciones, los serotipos y las resistencias antibióticas en la neumonía neumocócica en nuestro medio tras la generalización de la vacuna conjugada heptavalente (VNC-7) en pediatría.
Material y métodosEstudio prospectivo de los episodios de neumonía neumocócica, con cultivos positivos, en pacientes atendidos en urgencias desde enero de 2006 hasta febrero de 2010.
ResultadosSe estudiaron 346 episodios en 320 pacientes; 335 correspondían a 309 pacientes adultos, 221 (71,5%) varones, mediana de edad 68 años (rango: 16-94) y 11 episodios a pacientes<15 años. Fueron de adquisición comunitaria 237 episodios (68,5%). Presentaron bacteriemia 130 (37,6%) casos, evidenciando una tendencia al aumento de riesgo en los pacientes<65 años (OR=1,56; IC del 95%, 0,96-2,56; p=0,07). Desarrollaron empiema 13 (3,8%) y shock séptico 33 (9,5%). La media de edad de los pacientes con empiema fue menor (p=0,03). En el análisis multivariante se relacionaron con la presencia de bacteriemia: antecedente de patología respiratoria crónica (OR=0,45; IC del 95%, 0,25-0,81; p=0,008), antigenuria positiva (OR=2,02; IC del 95%; 1,13-3,62; p=0,01) y derrame pleural (OR=3,86; IC del 95%, 1,79-8,35; p=0,001). El shock se asoció con estadio de Fine IV-V (OR=23,6; IC del 95%, 4,96-112,82; p<0,001), edad<65 años (OR=4,47; IC del 95%, 1,75-11,39; p=0,002) y derrame pleural (OR=4,15; IC del 95%, 1,65-10,41; p=0,002).
Se observó un mayor riesgo de mortalidad ante la presencia de cualquier complicación (OR=6,6; IC del 95%, 1,5-27,2; p=0,009) y específicamente el shock séptico (OR=3,3; IC del 95%, 1,06-10,3; p=0,04). La mayoría de los serotipos obtenidos no estaban incluidos en la VNC-7.
ConclusionesLa neumonía neumocócica tras la generalización de la VCN-7 se relaciona principalmente con serotipos no vacunales. Los pacientes más jóvenes y sin patología respiratoria presentan mayor riesgo de bacteriemia, empiema y shock séptico; este último se asocia con una mayor mortalidad.
To describe clinical features, complications, serotypes and antibiotic resistance in pneumococcal pneumonia in our environment after the generalization of the heptavalent conjugate vaccine (PCV-7) in paediatrics.
Material and methodsProspective study of episodes of pneumococcal pneumonia, with positive cultures in patients treated in the emergency department from January 2006 to February 2010.
ResultsWe studied 346 episodes in 320 patients, 335 belonged to 309 adult patients, 221 (71.5%) males, median age 68 years (range 16-94), and 11 episodes to patients<15 years. Two-hundred and thirty seven (68.5%) episodes were community acquired. Bacteraemia was present in 130 (37.6%) cases, with a tendency towards an increased risk in patients < 65 years (OR=1.56, 95% CI 0.96- 2.56, P=.07). Thirteen (3.8%) patients developed empyema and 33 (9.5%) septic shock. The mean age of patients with empyema was lower (P=.03). In the multivariate analysis were related to the presence of bacteraemia: a history of chronic respiratory disease (OR=0.45, 95% CI 0.25-0.81, P=.008), positive urinary antigen (OR 2.02, 95% CI 1 13-3.62, P=.01) and pleural effusion (OR=3.86, 95% CI 1.79-8.35, P=.001). Shock was associated with Fine IV-V stage (OR=23.6, 95% CI 4.96-112.82, P<.001), age < 65 years (OR=4.47, 95% CI 1.75-11.39, P=.002) and pleural effusion (OR=4.15, 95% CI 1.65 to 10.41, P=.002).
Increased mortality risk was associated with presence of any complication (OR=6.6, 95% CI 1.5-27.2, P=.009) and specifically septic shock (OR=3.3, 95% CI 1.06-10.3, P=.04). Most serotypes obtained were not included in the VNC-7.
ConclusionsPneumococcal pneumonia after generalisation of PCV-7 is mainly related to non-vaccine serotypes. Younger patients without respiratory disease are at increased risk of bacteraemia, empyema, and septic shock, the latter being associated with a higher mortality.
Streptococcus pneumoniae (S. pneumoniae) es el principal agente causante de la neumonía bacteriana adquirida en la comunidad. A partir de la aprobación en Estados Unidos de la VNC-7 en el año 2000, la vacunación masiva de la población pediátrica ha condicionado un cambio en la epidemiología de las infecciones por neumococo, con un descenso de la incidencia de enfermedad neumocócica invasiva (ENI), sobre todo neumonías y meningitis, tanto en niños como en adultos1–6. Estos mismos cambios epidemiológicos se han descrito en otras áreas como Canadá, Francia o España, pueden modificar la forma de presentación clínica de la enfermedad y se relacionan con una reducción de las tasas de infección por serotipos contenidos en la VNC-7 y su sustitución por serotipos invasivos no incluidos7–12. Actualmente, S. pneumoniae es causante de hasta el 40% de las hospitalizaciones por neumonías en adultos y la causa más frecuente de mortalidad13,14. El papel de S. pneumoniae en la enfermedad invasiva depende tanto de la capacidad virulenta del patógeno, determinada por los más de 90 serotipos descritos, como de la interacción huésped-patógeno, que permite que cepas de baja virulencia puedan invadir a huéspedes inmunocomprometidos15–18. Existen algunos factores de riesgo reconocidos en niños y adultos para la adquisición de infección por neumococo, como asplenia, alcoholismo, diabetes mellitus, edad > 65 años, enfermedad pulmonar subyacente, enfermedad hepática grave, infección previa por virus respiratorios, déficits de inmunoglobulinas o complemento, y otros estados de inmunodepresión, incluida la infección por el virus de la inmunodeficiencia humana (VIH). Se ha visto incluso que la exposición previa a antibióticos podría actuar como factor de riesgo adicional, induciendo la aparición de cepas resistentes18,19. Tradicionalmente, la neumonía neumocócica con bacteriemia, que representa entre el 25-45% de todos los casos20–22, se ha asociado a un peor pronóstico, y la mortalidad es 3 veces superior a la forma no bacteriémica22,23.
A pesar de los cambios descritos, todavía existen pocos datos en nuestro entorno sobre la magnitud de estas variaciones, principalmente en lo que hace referencia a los cambios en la forma de presentación clínica de la neumonía neumocócica. El objetivo de este trabajo fue profundizar en el conocimiento de las características clínicas, los factores relacionados con el desarrollo de complicaciones, serotipos más frecuentes y perfiles de resistencia antibiótica en los episodios de neumonía neumocócica, atendidos en nuestra área de influencia, tras la generalización de la administración de la VNC-7 en pediatría.
Material y métodosÁmbitoEl estudio se llevó a cabo en el Hospital Son Llàtzer de Palma de Mallorca, centro que cuenta con un total de 350 camas y que atiende a un sector de población de 220.000 habitantes.
PacientesSe estudiaron prospectivamente todos los episodios de neumonía neumocócica, con cultivos microbiológicos positivos, en pacientes adultos y pediátricos atendidos en Urgencias del Hospital Son Llàtzer desde el 1 de enero de 2006 hasta el 28 de febrero del 2010.
El diagnóstico de neumonía neumocócica se basó en datos clínicos (presencia de síntomas como fiebre, disnea, tos con expectoración purulenta o dolor pleurítico) junto con la documentación de un infiltrado radiológico.
Para el diagnóstico microbiológico se valoró la presencia de S. pneumoniae en: a) muestras no estériles: muestras de esputo representativas del tracto respiratorio inferior, siguiendo los criterios de Murray, y muestras de broncoscopia con recuentos cuantitativos significativos, y b) muestras estériles: hemocultivos y líquido pleural.
Variables de estudioEn cada episodio se recogieron las siguientes variables: a) demográficas: sexo, edad, fecha de ingreso y fecha del alta o fallecimiento; b) clínico-epidemiológicas: tabaquismo, enolismo, uso de drogas por vía parenteral, antecedente vacunación frente a neumococo, origen de la neumonía, tratamiento antibiótico previo, comorbilidad y cálculo del índice de Charlson, así como tratamiento corticoideo crónico; c) exploraciones complementarias: radiografía simple de tórax, antigenuria, hemocultivos, gram y cultivo de esputo, muestras de broncoscopia y de líquido pleural; d) evolución y complicaciones: cálculo del índice de gravedad de Fine, derrame pleural, empiema, shock séptico, necesidad de ventilación mecánica invasiva o no invasiva, metástasis a distancia, endocarditis u otras, mortalidad global y relacionada, y e) datos microbiológicos de cada aislamiento: antibiograma y serotipificado (desde enero de 2009 todos los aislamientos de S. pneumoniae se remiten de forma rutinaria al Laboratorio de Referencia de Neumococos, Centro Nacional de Microbiología, Instituto de Salud Carlos III).
IdentificaciónLa identificación de S. pneumoniae se realizó mediante la observación en agar sangre de colonias alfahemolíticas, catalasa negativa y sensibles a optoquina; en los casos dudosos se recurrió a la prueba de aglutinación con partículas de látex revestidas de antisuero específico (Slidex® pneumo-kit, bioMériuex, Marcy l’Etoile, France).
AntibiogramaSe estudió la sensibilidad a penicilina, amoxicilina y cefotaxima mediante E-test (AB-Biodisk, Solna, Suecia) utilizando puntos de corte para aislamientos no meníngeos y a eritromicina, tetraciclina, cotrimoxazol y levofloxacino mediante disco-placa (Oxoid), siguiendo los criterios de CLSI-201024.
Definiciones- –
Hábitos tóxicos: se consideró consumo activo de cualquier tóxico siempre que el periodo de abstinencia fuera inferior a 1 año.
- –
Origen de la neumonía: 1) comunitaria si no existía contacto previo con el ámbito sanitario; 2) nosohusial siempre que presentara cualquiera de los siguientes criterios de riesgo: a) tratamiento intravenoso domiciliario, autoadministrado o no, cuidado de heridas o úlceras por personal especializado, en los 30 días previos; b) atención hospitalaria, hemodiálisis o quimioterapia por vía intravenosa en los 30 días previos; c) hospitalizaciones previas de dos o más días, durante los 90 días anteriores al episodio de neumonía; d) vivir en una residencia asistida u hospital de larga estancia, y 3) nosocomial: diagnóstico de la neumonía después de un mínimo de 48h desde el ingreso hospitalario. En caso de un traslado desde otro hospital, se consideró el tiempo desde el día del ingreso en el primer centro.
- –
Tratamiento antibiótico: si el paciente refería o existía constancia escrita en la historia clínica de haber recibido algún tratamiento antibiótico en los últimos 6 meses.
- –
Comorbilidad: enfermedad respiratoria crónica (enfermedades crónicas de las vías respiratorias u otras estructuras pulmonares que cursaran con disminución del flujo aéreo con o sin causa específica); sida (infección por el VIH con alguna de las enfermedades indicadoras de sida según clasificación del CDC 1987); hepatopatía crónica (enfermedad difusa hepática de etiología variada en la que se detectara o sospechara que las alteraciones superaran los 6 meses); diabetes con complicaciones (microvasculares y/o macrovasculares según documentación en la historia clínica); enfermedad renal crónica (a partir del estadio III, cuando el filtrado glomerular era < 30ml/min/1,73 m2); tratamiento corticoideo crónico (haber estado, como mínimo, el mes previo con > 20mg/día de prednisona o equivalente).
- –
Paciente no inmunodeprimido: se valoró la ausencia de antecedentes en la historia clínica de infección por el VIH, neoplasia sólida y/o hematológica con o sin metástasis, enfermedad autoinmunitaria o tratamiento con > 20mg/día de prednisona o equivalente durante el mes previo.
- –
Shock séptico: definido como presión sistólica<90 mmHg e hipoperfusión periférica con necesidad de fármacos vasopresores durante un periodo mayor a 4h, después de haber administrado sueroterapia al ingreso.
- –
Defunción relacionada: se consideró la mortalidad durante el ingreso hospitalario asociada directamente con el episodio de neumonía neumocócica, según valoración de los investigadores.
Se realizó un análisis descriptivo de toda la población del estudio. A continuación, se llevó a cabo un análisis bivariante de las variables relacionadas con el riesgo de bacteriemia, shock séptico y mortalidad relacionada. Para este último análisis se excluyó a los pacientes pediátricos (< 15 años), puesto que el número limitado de episodios de neumonía neumocócica en este subgrupo especial de población no permitió realizar un análisis detallado de los factores relacionados con el riesgo de presentar complicaciones. El grado de asociación entre dos variables cualitativas se investigó mediante la prueba de la chi al cuadrado, aplicando la prueba exacta de Fisher cuando fue necesario. En cada caso, se calcularon los valores de p y las odds ratio (OR) con sus correspondientes intervalos de confianza (IC) del 95%. Las variables cuantitativas se analizaron utilizando la prueba de la t de Student. Tanto para la bacteriemia, shock séptico y mortalidad relacionada, se realizó un análisis multivariante utilizando un modelo de regresión logística.
Este mismo análisis se repitió para el grupo de pacientes adultos no inmunodeprimidos. En este caso, también se excluyó a los pacientes pediátricos y a aquellos con alguna causa de inmunodepresión según los parámetros definidos anteriormente.
Todo análisis de los datos se realizó utilizando el programa estadístico SPSS-PC versión 12.0.
ResultadosCaracterísticas generales de los episodios de neumonía neumocócicaSe estudiaron un total de 346 episodios de neumonía en 320 pacientes. Once episodios correspondían a pacientes pediátricos (< 15 años), 8 (72,7%) varones y 3 (27,3%) mujeres, con una mediana de edad de 1 año (rango 0-5). Los 335 episodios restantes correspondían a 309 pacientes adultos, 221 (71,5%) varones y 88 (28,5%) mujeres, con una mediana de edad de 68 años (rango: 16-94). Del total de los 335 episodios de neumonía neumocócica contabilizados en adultos, 150 (44,8%) se presentaron en pacientes < 65 años y en 234 pacientes (que desarrollaron un total de 254 episodios) no existía ninguna causa de inmunodepresión aparente. En 326 (94,2%) neumonías se cursó ingreso hospitalario.
La mayoría de los episodios se consideraron de adquisición comunitaria, 237 (68,5%); el resto se relacionó con la asistencia sanitaria, 69 (19,9%) nosohusiales y 40 (11,6%) nosocomiales. La distribución de los episodios según su origen en el grupo de pacientes adultos no inmunodeprimidos fue similar: 192 (75,6%) comunitarios y 62 (24,4%) relacionados con la asistencia sanitaria (nosocomiales y nosohusiales).
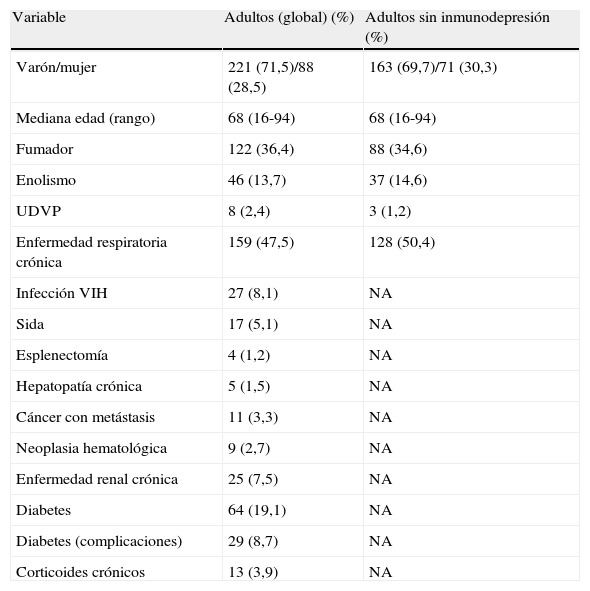
La mediana del índice de Charlson de toda la población adulta fue de 2 (rango: 0-12), siendo menor en el grupo de pacientes adultos no inmunodeprimidos, 1,66 (rango: 0-8). En la tabla 1 se muestran las principales características demográficas y clínicas en el total de neumonías en pacientes adultos y en el grupo de no inmunodeprimidos.
Principales variables demográficas y clínicas en los episodios de neumonía neumocócica en el total de pacientes adultos (> 15 años) incluidos en el estudio y en el grupo de pacientes adultos sin inmunodepresión.
| Variable | Adultos (global) (%) | Adultos sin inmunodepresión (%) |
| Varón/mujer | 221 (71,5)/88 (28,5) | 163 (69,7)/71 (30,3) |
| Mediana edad (rango) | 68 (16-94) | 68 (16-94) |
| Fumador | 122 (36,4) | 88 (34,6) |
| Enolismo | 46 (13,7) | 37 (14,6) |
| UDVP | 8 (2,4) | 3 (1,2) |
| Enfermedad respiratoria crónica | 159 (47,5) | 128 (50,4) |
| Infección VIH | 27 (8,1) | NA |
| Sida | 17 (5,1) | NA |
| Esplenectomía | 4 (1,2) | NA |
| Hepatopatía crónica | 5 (1,5) | NA |
| Cáncer con metástasis | 11 (3,3) | NA |
| Neoplasia hematológica | 9 (2,7) | NA |
| Enfermedad renal crónica | 25 (7,5) | NA |
| Diabetes | 64 (19,1) | NA |
| Diabetes (complicaciones) | 29 (8,7) | NA |
| Corticoides crónicos | 13 (3,9) | NA |
NA: no aplicable.
En 94 (27,2%) episodios se recogió el antecedente de tratamiento previo con antibióticos en los últimos 6 meses, siendo los más frecuentes levofloxacino en 54 (15,6%) casos y penicilinas en 36 (10,4%). Sólo en 7 casos constaba en la historia clínica el antecedente de vacunación previa frente a neumococo (3 pacientes pediátricos, 3 infectados por VIH y 1 con enfermedad respiratoria crónica).
El patrón radiológico más frecuente fue la condensación lobar en 191 (55,2%) casos y 67 (19,4%) neumonías cursaron con derrame pleural. Según el resultado del índice de Fine, la mayoría se clasificaron en las categorías III, IV y V con 59 (20%), 101 (34,2%) y 67 (22,7%) casos, respectivamente. Del mismo modo, en el grupo de pacientes adultos sin inmunodepresión 128 (56,1%) episodios se clasificaron como categorías IV y V de Fine.
En 107 (30,9%) neumonías el esputo fue la única muestra positiva para S. pneumoniae, mientras que en otros 90 (26%) casos el esputo se acompañó de algún otro cultivo de distinta localización o de una determinación de antígeno de neumococo con resultado positivo. En 41 (11,8%) episodios se realizó alguna técnica broncoscópica y el cultivo de líquido pleural fue diagnóstico en 9 pacientes. Cursaron con bacteriemia 130 (37,6%) episodios, aunque en el grupo de pacientes pediátricos, en 10 de los 11 casos en que se extrajeron hemocultivos resultaron positivos. La antigenuria fue positiva en 161 (53,8%) de los 299 casos en que se realizó. El antígeno en el líquido pleural se realizó en 26 casos, y fue positivo en 17 (65,3%).
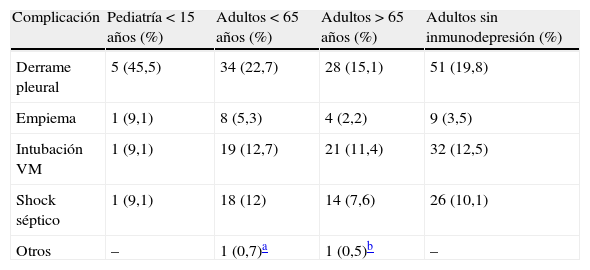
Del total de pacientes adultos, 110 (32,8%) desarrollaron alguna complicación, proporción similar a la de los adultos no inmunodeprimidos, 88 (34,2%). De los pacientes pediátricos, 6 (54,5%) presentaron complicaciones. El porcentaje de empiemas se mantuvo estable durante los 4 años del estudio (2,2% en 2006, 6% en 2007, 1,5% en 2008 y 5,8% en 2009). La media de edad de los pacientes que desarrollaron empiema fue significativamente menor que la de los que no presentaron esta complicación (50,3 vs 62,3 años, respectivamente; p=0,03), manteniéndose incluso estas diferencias al eliminar del análisis los pacientes pediátricos. En la tabla 2 se muestran las complicaciones por grupos de edad y según la presencia o no de inmunodepresión.
Complicaciones por grupos de edad y estado inmunitario del paciente.
| Complicación | Pediatría < 15 años (%) | Adultos < 65 años (%) | Adultos > 65 años (%) | Adultos sin inmunodepresión (%) |
| Derrame pleural | 5 (45,5) | 34 (22,7) | 28 (15,1) | 51 (19,8) |
| Empiema | 1 (9,1) | 8 (5,3) | 4 (2,2) | 9 (3,5) |
| Intubación VM | 1 (9,1) | 19 (12,7) | 21 (11,4) | 32 (12,5) |
| Shock séptico | 1 (9,1) | 18 (12) | 14 (7,6) | 26 (10,1) |
| Otros | – | 1 (0,7)a | 1 (0,5)b | – |
VM: ventilación mecánica.
Fallecieron durante el ingreso 31 (9,3%) pacientes y en 23 (6,9%) casos la defunción se consideró relacionada con la neumonía. De los 18 (7,1%) adultos no inmunodeprimidos que fallecieron durante el ingreso, en 12 (4,7%) se relacionó directamente con el episodio de neumonía. Ninguno de los pacientes pediátricos falleció durante el ingreso.
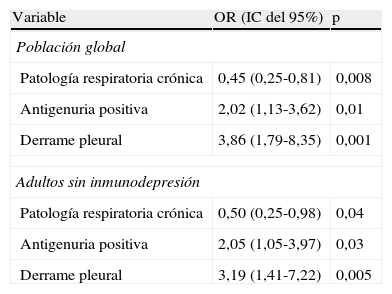
Variables asociadas con el riesgo de bacteriemia, shock séptico y fallecimientoLa mediade edad de los pacientes con bacteriemia fue menor que la de aquellos con hemocultivos negativos, 61,7±18,5 vs 64,5±16,4 años, respectivamente, con una tendencia a aumentar el riesgo de bacteriemia en los pacientes < 65 años (OR=1,56; IC del 95%, 0,96-2,56; p=0,07), aunque sin llegar alcanzar significación estadística. Además, la bacteriemia fue menos frecuente en los individuos que habían recibido tratamiento antibiótico previo en los últimos 6 meses (OR=0,53; IC del 95%, 0,3-0,94; p=0,03), así como en los pacientes con patología respiratoria crónica (OR=0,37; IC del 95%, 0,22-0,61; p<0,001). La bacteriemia se relacionó con la antigenuria positiva (OR=2,14; IC del 95%, 1,26-3,63; p=0,004) o el desarrollo de complicaciones (OR=2,06; IC del 95%, 1,23-3,44; p=0,005), sobre todo derrame pleural (OR=4,04; IC del 95%, 2,09-7,8; p<0,001), empiema (OR=5,63; IC del 95%, 1,19-26,61; p=0,02) y shock séptico (OR=2,46; IC del 95%, 1,09-5,53; p=0,02). En la tabla 3 se muestran las variables relacionadas con la presencia de bacteriemia en al análisis multivariante para toda la población de pacientes adultos incluidos en el estudio y, específicamente, para los no inmunodeprimidos.
Variables relacionadas con la presencia de bacteriemia en al análisis multivariante, para toda la población de pacientes adultos y específicamente para aquellos no inmunodeprimidos.
| Variable | OR (IC del 95%) | p |
| Población global | ||
| Patología respiratoria crónica | 0,45 (0,25-0,81) | 0,008 |
| Antigenuria positiva | 2,02 (1,13-3,62) | 0,01 |
| Derrame pleural | 3,86 (1,79-8,35) | 0,001 |
| Adultos sin inmunodepresión | ||
| Patología respiratoria crónica | 0,50 (0,25-0,98) | 0,04 |
| Antigenuria positiva | 2,05 (1,05-3,97) | 0,03 |
| Derrame pleural | 3,19 (1,41-7,22) | 0,005 |
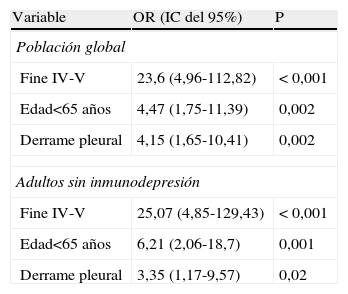
El porcentaje de pacientes<65 años que desarrollaron shock séptico fue mayor que en el grupo de más edad (12% vs 7,6%). En el análisis bivariante, se asociaron con el shock séptico: estadio de Fine IV-V (OR=13,04; IC del 95%, 3,04-55,76; p<0,001), el antecedente de esplenectomía (OR=10,03; IC del 95%, 1,36-73,8; p=0,04), la bacteriemia (OR=2,46; IC del 95%, 1,09-5,53; p=0,02) y el derrame pleural (OR=4,8; IC del 95%, 2,24-10,28; p<0,001). En la tabla 4 se muestran las variables asociadas con el shock séptico en el análisis multivariante, tanto para toda la población de pacientes adultos del estudio como para el subgrupo de pacientes no inmunodeprimidos.
Variables relacionadas con la presencia de shock séptico en al análisis multivariante, para toda la población de pacientes adultos y específicamente para los no inmunodeprimidos.
| Variable | OR (IC del 95%) | P |
| Población global | ||
| Fine IV-V | 23,6 (4,96-112,82) | < 0,001 |
| Edad<65 años | 4,47 (1,75-11,39) | 0,002 |
| Derrame pleural | 4,15 (1,65-10,41) | 0,002 |
| Adultos sin inmunodepresión | ||
| Fine IV-V | 25,07 (4,85-129,43) | < 0,001 |
| Edad<65 años | 6,21 (2,06-18,7) | 0,001 |
| Derrame pleural | 3,35 (1,17-9,57) | 0,02 |
En el análisis bivariante, se relacionaron con un mayor riesgo de mortalidad: un índice de Fine IV-V (OR=22,02; IC del 95%, 2,94-164,9; p<0,001) y la presentación de cualquier complicación (OR=13,61; IC del 95%, 5,06-36,63; p<0,001). Al analizar las complicaciones de forma individual los pacientes con shock séptico tuvieron un riesgo mayor de fallecer en relación con el episodio de neumonía (OR=13,08; IC del 95%, 5,57-30,69; p<0,001). En el subgrupo de pacientes adultos no inmunodeprimidos la media del índice de Charlson fue más elevada para los que fallecieron en relación con la neumonía (3,08±2,81)] frente a los que sobrevivieron (0,83±0,75), aunque sin llegar a alcanzar significación estadística. En el análisis multivariante las variables relacionadas con mayor riesgo de mortalidad fueron la presencia de cualquier complicación (OR=6,6; IC del 95%, 1,5-27,2; p=0,009) y específicamente el shock séptico (OR=3,3; IC del 95%, 1,06-10,3; p=0,04).
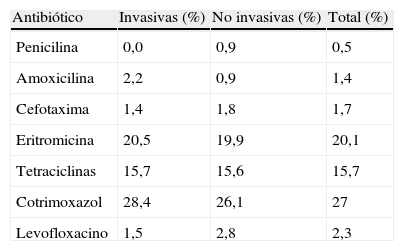
Serotipos y porcentajes de resistencias antibióticasSe serotipificaron un total de 71 cepas de neumococo en pacientes adultos. Los serotipos más frecuentes procedentes de muestras no estériles fueron principalmente los no incluidos en la VNC-7: serotipo 3 (12 aislamientos), 11A y 17F (3 aislamientos cada uno); de los serotipos vacunales el más frecuente fue el 19F (2 aislamientos). En muestras estériles, entre los serotipos no vacunales destacaban el 7F (6 aislamientos), 1 y 3 (4 y 3 aislamientos respectivamente); entre los serotipos vacunales, el más frecuente en este caso fue el 14 (2 aislamientos).
De los 11 episodios de neumonía en pacientes pediátricos sólo se obtuvo el serotipo en 3 (7F en 2 casos y 38 en otro).
De los 5 empiemas con serotipo conocido, 4 se produjeron en pacientes adultos (serotipo 1: 2 casos, y serotipos 3 y 19A: 1 caso cada uno) y 1 en pediatría (serotipo 7F).
En la tabla 5 se muestran los porcentajes de cepas resistentes a diferentes antibióticos, según los criterios mencionados, en el total de la serie, así como entre las cepas invasivas y no invasivas. Todas las cepas aisladas en pacientes pediátricos fueron sensibles a penicilina, amoxilicina, cefotaxima y quinolonas, y mostraron resistencia a eritromicina, tetraciclinas y cotrimoxazol, 4, 3 y 1 aislamientos, respectivamente.
Porcentaje de cepas (invasivas, no invasivas y total) con resistencia a diferentes antibióticos, según criterios del CLSI-2010 para aislamientos no meníngeos.
| Antibiótico | Invasivas (%) | No invasivas (%) | Total (%) |
| Penicilina | 0,0 | 0,9 | 0,5 |
| Amoxicilina | 2,2 | 0,9 | 1,4 |
| Cefotaxima | 1,4 | 1,8 | 1,7 |
| Eritromicina | 20,5 | 19,9 | 20,1 |
| Tetraciclinas | 15,7 | 15,6 | 15,7 |
| Cotrimoxazol | 28,4 | 26,1 | 27 |
| Levofloxacino | 1,5 | 2,8 | 2,3 |
El estudio presentado aporta información sobre las características epidemiológicas y sobre todo clínicas de la neumonía neumocócica en nuestro entorno y los factores relacionados con el desarrollo de complicaciones tras la generalización de la administración de la VNC-7.
A pesar del desarrollo de diferentes vacunas neumocócicas y de la mejora en las técnicas diagnósticas y tratamientos antibióticos, se siguen observando formas de presentación clínica grave de la neumonía neumocócica25. En una publicación que relacionó la etiología de la neumonía con la escala pronóstica de Fine, se observó que los microorganismos «típicos», sobre todo S. pneumoniae, fueron causantes de los episodios incluidos en las categorías más altas26. En nuestra serie, la práctica totalidad de los episodios (94%) precisaron ingreso hospitalario; la mayoría de ellos se clasificaron en las categorías III-V de la escala de Fine. Destaca además el elevado porcentaje de complicaciones, presentes principalmente en los individuos más jóvenes.
Cabe resaltar de nuestros resultados que, tanto en pacientes inmunodeprimidos como inmunocompetentes, un 20% de los episodios se consideraron de adquisición nosohusial. Desde que Friedman et al27 describieran el término de nosohusial asociado a las bacteriemias, varios autores han pretendido validar dicha terminología para las neumonías. Carratala et al28 observaron un aumento de cepas de S. pneumoniae resistentes a penicilina, eritromicina y quinolonas en neumonías de adquisición nosohusial, por lo que queda remarcada así la importancia de este nuevo término y de su identificación en la clínica.
Al igual que en otros estudios29,30, el tabaquismo y la patología respiratoria de base, mayoritariamente la enfermedad pulmonar obstructiva crónica, fueron los antecedentes tóxicos y patológicos más frecuentes en nuestra serie. Se ha descrito que el tabaquismo podría ser no sólo un factor de riesgo para la adquisición de neumonía neumocócica, sino también un factor pronóstico, al incrementar de forma significativa el riesgo de shock séptico31, asociación que no encontramos en nuestro caso.
En los últimos años, se ha detectado un incremento en el diagnóstico de neumonía neumocócica bacteriémica32. En nuestro estudio, más de la tercera parte de los casos tuvieron hemocultivos positivos y, en concordancia con datos anteriores a la introducción de la VNC-7, la neumonía bacteriémica mostró una tendencia a predominar en pacientes con edad < 65 años33. Además, observamos que el riesgo de desarrollar bacteriemia fue menor en los pacientes con patología respiratoria de base, como también se describe en algún trabajo previo34. En el mismo sentido, la antibioterapia en los 6 meses previos al episodio fue más frecuente en los pacientes con neumonía no bacteriémica. Sin duda, ambas circunstancias están relacionadas, puesto que los pacientes con patología respiratoria crónica son más susceptibles de presentar agudizaciones y por ello de haber recibido terapia antibiótica. Podría especularse que una menor exposición a los serotipos patógenos en aquellos pacientes más jóvenes, inmunocompetentes y sin patología respiratoria crónica favorecería el desarrollo de bacteriemia debido a una falta de inmunización previa frente a estos serotipos. Como previamente se ha publicado en la literatura, también observamos una asociación entre la bacteriemia y el desarrollo de derrame pleural y antigenuria positiva35.
En otros estudios, coincidiendo con nuestros datos, el porcentaje de pacientes que presentaron shock séptico osciló entre el 7,5 y 10,9%31,36. Sin embargo, al contrario de lo descrito por Garcia-Vidal et al31, el tratamiento corticoideo crónico no fue un factor de riesgo para el desarrollo de shock séptico siendo la edad<65 años, la presencia de derrame pleural y un índice de Fine IV-V los factores que se relacionaron con dicha complicación. Como era de esperar, la presencia de complicaciones se relacionó con un mayor riesgo de mortalidad, sobre todo el shock séptico, como ya se ha descrito con anterioridad31.
La reducción de la incidencia de ENI observada en Estados Unidos se ha debido no sólo a un descenso del número de infecciones producidas por serotipos vacunales, sobre todo en adultos jóvenes, sino también, aunque en menor grado, a un descenso de las infecciones por serotipos no vacunales1. En Francia se ha descrito un descenso de la incidencia de ENI tras la introducción de la VNC-7 en niños < 2 años, principalmente debido a un descenso del número de infecciones por serotipos vacunales, aunque en niños > 2 años y adultos se ha evidenciado un incremento de la incidencia de meningitis o bacteriemia, tendencia que no se puede atribuir directamente a la vacuna, puesto que entre 1998 y 2002 se había descrito una tendencia similar9. En España, la VNC-7 se comercializó en junio de 2001 y, a pesar de las indicaciones financiadas por el Sistema Nacional de Salud, muchos pediatras la recomiendan de forma sistemática37. En un estudio12 que incluyó a pacientes adultos de Barcelona, se observó un aumento de la tasa de ENI entre 2005 y 2007, coincidiendo con la expansión clonal de serotipos no vacunales, permaneciendo estables las infecciones por serotipos vacunales, con la excepción del grupo de pacientes > 65 años, en que las infecciones por serotipos vacunales se redujeron un 37%. Nuestros resultados evidencian que, tanto en los aislamientos obtenidos de muestras estériles como no estériles, existe un claro predominio de los serotipos no incluidos en la VNC-7. Los serotipos no vacunales más frecuentes fueron el 3, 1 y 7F; estos dos últimos se sitúan entre los serotipos que más se han incrementado durante los últimos años en nuestro medio (el 126 y el 462%, respectivamente)12. En estudios de nuestro entorno se ha descrito un incremento de la tasa de empiemas en población pediátrica desde la introducción de la VNC-77,10. Los serotipos que se han relacionado con el desarrollo de empiema paraneumónico en pacientes pediátricos han sido el 3, 5, 7F, 19A y especialmente el serotipo 138. Aunque en nuestra serie el número de empiemas paraneumónicos con serotipo conocido se redujo a 5 episodios, todos ellos se han relacionado con el desarrollo de esta complicación. A diferencia de Garcia-Vidal et al31, no hemos evidenciado una asociación entre el aislamiento del serotipo 3 y el riesgo de shock séptico o muerte relacionada. El motivo de esta discordancia podría ser que la mayoría de infecciones por serotipo 3 de nuestra serie, serotipo con un bajo potencial invasivo39,40, se aislaron de muestras de esputo y broncoscopia, y sólo en 3 casos de muestras estériles. Otra justificación, como los autores citados previamente apuntan en su trabajo, podría ser la diferencia de genotipos del propio serotipo 3 entre las diferentes series31.
Desde la introducción de la VNC-7, las tasas de infección neumocócica por cepas con resistencia antibiótica, tanto en poblaciones pediátricas como en adultos, han disminuido, principalmente a costa de los serotipos incluidos en esta vacuna7,10,12,41–43. Nuestros resultados concuerdan con lo descrito, evidenciando tasas de resistencia muy bajas a los antibióticos betalactámicos al utilizar los puntos de corte para aislamientos no meníngeos. Los porcentajes de resistencia a macrólidos, tetraciclinas y cotrimoxazol se mantienen más elevados, aunque en algún caso son menores que los descritos en otros trabajos6,7,10. El porcentaje de cepas resistentes a levofloxacino es bajo, manteniéndose estable a lo largo del periodo del estudio y siendo más frecuente en los pacientes que han recibido tratamiento con quinolonas en los 6 meses previos al episodio de neumonía44.
Entre las limitaciones de nuestro trabajo destacan que se trata de un estudio realizado en un solo centro hospitalario y, por tanto, no podemos extrapolar los datos a la ciudad de Palma de Mallorca, ni por supuesto a toda la Comunidad Autónoma de las Islas Baleares. El Hospital Son Llàtzer fue inaugurado en enero de 2002, por lo no que disponemos de datos del periodo anterior a la comercialización de la VNC-7 ni de información de los serotipos causantes de los episodios de neumonía anteriores a 2009. Además, se trata de un estudio realizado en el ámbito hospitalario y basado en la recogida de los aislamientos de neumococo, lo que supone un sesgo de selección, al no haber incluido los episodios de neumonía neumocócica atendidos ambulatoriamente en atención primaria, aquellas neumonías atendidas en urgencias en las que no se realizaron pruebas de diagnóstico microbiológico o las que tenían una antigenuria positiva como única prueba diagnóstica. No disponemos de datos sobre la tasa de niños vacunados en nuestro entorno, donde el sistema sanitario privado tiene una importante implantación. Sin embargo, según datos facilitados por la Direcció General de Farmàcia, Conselleria de Salut i Consum (Govern Balear) se estima que, en función del número de dosis de vacunas vendidas y el porcentaje de población pediátrica < 5 años, la tasa de vacunación en el periodo 2000-2007 fue de 112,3 vacunas/1.000 niños, con un aumento progresivo hasta 246/1.000 al final de dicho periodo. En algunas variables, el número de casos es reducido, lo que puede influir en la interpretación de los resultados. A pesar de todas estas limitaciones, nuestros resultados concuerdan con lo descrito hasta el momento en la literatura y creemos que aportan una información válida, principalmente en relación con los cambios en la forma de presentación clínica y las complicaciones de la neumonía neumocócica en adultos desde la introducción de la VNC-7, aspecto menos estudiado en los grandes estudios de base epidemiológica. Será interesante continuar recogiendo datos de forma prospectiva con el fin de valorar los cambios epidemiológicos a los que asistiremos en los próximos, años a partir de la comercialización de la vacuna conjugada 13-valente.
Como conclusiones destacamos que, tras introducción de la VNC-7 en pediatría, la neumonía neumocócica en nuestro medio se relaciona principalmente con serotipos no incluidos en la VNC-7. Los adultos jóvenes y sin patología respiratoria de base presentan un mayor riesgo de bacteriemia y complicaciones como empiema y shock séptico. La presencia de shock séptico se asocia a una mayor mortalidad.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.