El virus de la hepatitis E (VHE) es el principal agente causal de hepatitis no-A no-B de transmisión entérica. El incremento de casos autóctonos y la elevada prevalencia detectada en el ganado porcino sugieren la posibilidad de la existencia de un reservorio animal. El objetivo de este trabajo es determinar la presencia del VHE, de anticuerpos anti-VHE de clase IgG e IgM así como los factores de riesgo en individuos sanos con y sin exposición a ganado porcino.
MétodosSe incluyeron un total de 212 individuos, 113 con exposición y 99 sin exposición a ganado porcino. En todos los sueros se determinó la presencia del ARN-VHE y anticuerpos anti-VHE IgG e IgM. Las muestras positivas para anti-VHE IgM e IgG se confirmaron por inmunoblot.
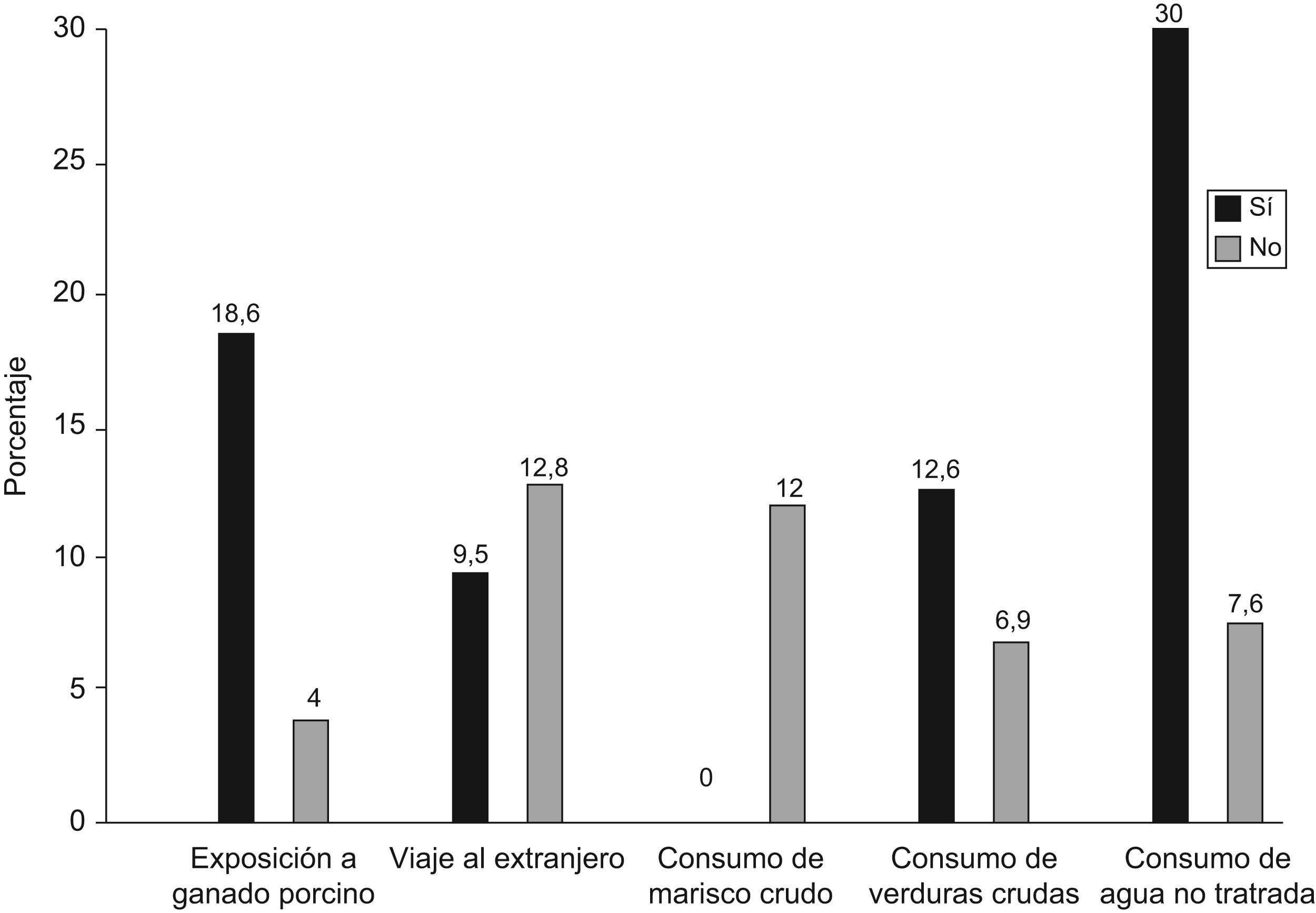
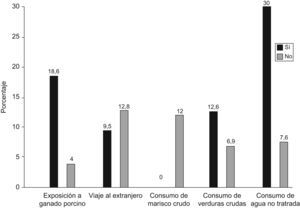
ResultadosEl ARN-VHE y los anticuerpos anti-VHE IgM no se detectaron en ninguna muestra. De las 212 personas analizadas, 25 (11,8%) presentaron anti-VHE IgG, siendo 21 (18,6%) expuestos y 4 (4%) no expuestos a ganado porcino (p=0,004); 19 personas de todos los analizados (12,8%) habían viajado al extranjero en el último año (p=0,507). En cuanto a los datos de los 25 individuos que presentaban anti-VHE IgG, ninguno de ellos había consumido marisco crudo (p=0,999); 23 (12,6%) consumieron verduras crudas (p=0,387); y 12 (30%) consumían habitualmente agua no tratada (p=0,008).
ConclusionesLos datos obtenidos en este estudio sugieren que la infección por el VHE puede tratarse como una enfermedad ocupacional en trabajadores del sector porcino y que deberían tomarse las medidas higiénico-sanitarias correspondientes en este grupo para disminuir la exposición al VHE.
Hepatitis E virus (HEV) is the main causative agent of enterically transmitted non-A non-B hepatitis with a self-limiting clinical presentation in humans. The increasing number of non-immigrant cases of hepatitis E and the high prevalence detected in pigs suggested that this species is a reservoir. Several studies have been published describing differences in the prevalence of anti-HEV antibodies between people exposed and not exposed to pigs, but the risk factors for the acquisition of the virus have not been well studied. The aim of this work was to study the prevalence of hepatitis E virus (HEV), IgG and IgM antibodies anti-HEV and the risk factors for the acquisition of this virus in a populations exposed and unexposed to pigs.
MethodsSera from 212 people were tested for the presence of RNA-HEV, IgG and IgM antibodies anti-HEV. Positive results obtained using ELISA assays were confirmed by western-blot.
ResultsRNA-HEV and IgM anti-VHE were not detected in any of the individuals. Twenty-five samples (11.8%) showed IgG anti-HEV, 21 (18.6%) persons in contact with pigs and 4 (4%) unexposed individuals (P=0.004); 19 (12.8%) had travelled out of Spain in the last year (P=0.507). None of the 25 seropositive people had consumed raw shellfish (P=0.999), whereas 23 (12.6%) had consumed raw vegetables (P=0.387) and 12 (30%) usually drank untreated water (P=0.008).
ConclusionThese data support that HEV infection should be treated as an occupational disease illness in pig workers. Therefore, systematic application of hygiene measures in this group is highly recommended to avoid exposure to this virus.
La hepatitis E es una infección vírica con un patrón epidemiológico de transmisión entérica. A nivel mundial, se estima que más del 50% de las hepatitis agudas son debidas a este agente. El virus de la hepatitis E (VHE) es un virus no envuelto, constituido por un ARN monocatenario de polaridad positiva (7,2Kb) y con 3 regiones de lectura abierta (ORF)1. Actualmente, el VHE está clasificado en la familia Hepeviridae, como único integrante del género Hepevirus2. En base a las comparaciones filogenéticas y al análisis de las secuencias aisladas se han obtenido cepas de referencia y se han identificado 4 genotipos y 24 subtipos diferentes. Los genotipos 1 y 2 han sido identificados en epidemias y brotes de hepatitis E en países tropicales y subtropicales de África, Asia y Centroamérica, por contaminación de las aguas de abastecimiento público. Los genotipos 3 y 4 se han aislado en casos esporádicos de hepatitis E así como en animales en EE.UU., Argentina, Europa, China y Japón, por lo que se cree que tienen naturaleza zoonótica. La principal vía de transmisión del VHE es la transmisión fecal-oral, a través de aguas contaminadas con materia fecal3. La ingestión de estas aguas contaminadas da origen a epidemias y brotes, principalmente en países subdesarrollados. También se han descrito otras vías de transmisión como la vertical, parenteral y alimentaria. Esta última vía de transmisión parece ser cada vez más importante debido a los casos documentados tras la ingestión de carne cruda de animales como cerdo, ciervo y jabalí.
Desde el punto de vista epidemiológico, el VHE presenta 2 formas, la epidémica y la esporádica, que pueden ocurrir simultáneamente en un área determinada. La forma de presentación epidémica suele ser el resultado de una contaminación fecal de las aguas de abastecimiento público y es frecuente en países en vías de desarrollo de África, Asia y Centro América. La forma de presentación esporádica suele observarse en países industrializados y está relacionada con individuos que han viajado a zonas endémicas, o con la inmigración desde estos países, aunque cada vez es más frecuente que se produzcan casos sin historial de viaje4 a dichas áreas (casos autóctonos). En este sentido, se han descrito casos autóctonos de hepatitis E en países industrializados, entre los que se encuentra España. La detección de estos casos autóctonos sugirió la existencia de uno o varios reservorios animales, por lo que se investigó la presencia del virus en diferentes especies animales. Así, el VHE se ha detectado en suero y heces de distintas especies como roedores, aves de corral, ovejas, vacas, perros y cerdos. De todas ellas, el ganado porcino presenta la seroprevalencia más elevada, y además se ha detectado un alto grado de homología genética entre aislados del VHE de origen porcino y humano en diversos países5,6.
El objetivo de este estudio fue determinar la prevalencia del VHE detectando el ARN-VHE mediante RT-nested-PCR en personas sanas expuestas al ganado porcino y en personas sin exposición (donantes voluntarios), así como la detección de anticuerpos anti-VHE de clase IgG e IgM mediante enzimoinmunoensayo en los grupos citados anteriormente, confirmando la presencia de anticuerpos anti-VHE mediante western-blot. Adicionalmente, se determinaron y valoraron los factores de riesgo asociados a la presencia de marcadores del VHE (contacto con ganado porcino, viaje a zonas endémicas, ingesta de marisco crudo, de verduras crudas y de agua no tratada).
MétodosSe incluyeron en este estudio un total de 212 individuos con edades comprendidas entre 20–60 (33±9) años, de los que 113 eran hombres y 99 mujeres, residentes en la Comunidad Valenciana. Se clasificaron en 2 grupos según la exposición a ganado porcino, de los cuales 113 (53,3%) pertenecieron al grupo de expuestos a ganado porcino y 99 (46,7%) al grupo sin exposición (donantes voluntarios). De los 113 individuos expuestos, 86 (76%) eran hombres y 27 (24%) mujeres. Entre los donantes voluntarios, 27 (27,3%) eran hombres y 72 (72,7%) mujeres. Los criterios de selección de los individuos fueron los siguientes: los no expuestos se seleccionaron al azar y con su consentimiento, del censo de la Universidad CEU Cardenal Herrera; y los expuestos a ganado porcino se seleccionaron al azar y con su consentimiento del censo de trabajadores del sector porcino de la Comunidad Valenciana. A todos los individuos se les realizó una encuesta epidemiológica que recogía información general (nombre, edad, sexo y lugar de residencia) y cuestiones sobre posibles factores de riesgo para contraer la infección por el VHE, como la exposición al ganado porcino y años de exposición, realización de viajes al extranjero y en su caso el país visitado, consumo de marisco crudo, de verduras crudas y de agua no tratada.
A todas las personas se les extrajo muestras de sangre por venopunción y los sueros obtenidos fueron congelados a −20°C hasta su utilización.
Para la determinación del nivel de transaminasas hepáticas (ALT y AST) en suero se utilizó un ensayo comercial (SPINREACT, Barcelona) de bioquímica húmeda.
El ARN-VHE fue extraído de las muestras séricas por un método comercial (QIAmpViral RNA kit, QIAgen, Valencia, CA, EE.UU,) según las instrucciones del fabricante. La detección del ARN-VHE se realizó mediante RT-nested-PCR con iniciadores localizados en la región ORF2 (3156N forward 5′-AATTATGCYCAGTAYCGRGTTG-3′; 3157N reverse 5′-CCCTTRTCYTGCTGMGCATTCTC-3′; 3158N forward 5′-GTWATGCTYTGCATWCATGGCT-3′); 3159N reverse 5′-AGCCGACGAAATCAATTCTGTC-3′). La obtención del ADNc se realizó a 42°C durante 60min con Superscript II reverse-transcriptase (Invitrogen, California, EE.UU.) utilizando el iniciador 3157N. Cinco μl de este ADNc se utilizó para la primera PCR usando Ampli Taq gold DNA polymerase (Applied Biosystems, Foster City, EE.UU.). La amplificación se realizó en un termociclador 2700 (Applied Biosystems, Foster City, EE.UU.) con los siguientes parámetros: desnaturalización a 95°C/9min seguido de 40 ciclos: desnaturalización 94°C/1min, hibridación 55°C/30s y extensión 72°C/1min, con una incubación final a 72°C/7min. La segunda PCR se realizó con 5μl del amplificado de la primera PCR y los parámetros de amplificación fueron los mismos. El producto amplificado tenía 348 nucleótidos que se visualizaron mediante electroforesis en gel de agarosa al 2% y teñido con bromuro de etidio.
En lo que respecta al análisis de anticuerpos anti-VHE de tipo IgG e IgM en suero, se utilizó un método inmunoenzimático comercial (Fortress Diagnostics Limited, Reino Unido). La sensibilidad y especificidad de este método se determinaron por el fabricante como 92% y 88%, respectivamente. Las muestras positivas a anticuerpos anti-VHE IgG e IgM se confirmaron mediante western-blot (RecomBlot HEV IgG/IgM, Mikrogen, Martinsried, Alemania).
Análisis estadísticoPara el análisis estadístico de los datos se utilizó el modelo de regresión logística binaria, al disponer de una variable que describe una respuesta en forma de 2 posibles eventos y que nos permite estudiar el efecto que otras variables tienen sobre ella. Las variables analizadas en este estudio fueron presencia de ARN-VHE, presencia de anticuerpos anti-VHE IgG e IgM, exposición a ganado porcino, viaje al extranjero, frecuencia de consumo marisco crudo, verduras crudas y de agua no tratada. Para determinar la correlación entre variables se calcularon los OR con sus correspondientes intervalos de confianza del 95%. Se realizaron los tests χ2 de Pearson y t de Student para la comparación estadística de las seroprevalencias obtenidas. Se consideraron valores estadísticamente significativos aquellos que tuvieron un valor p<0,05. La bondad de ajuste del modelo se determinó mediante la prueba de Hosmer-Lemeshow que permite corroborar que el modelo calculado se ajusta a los datos usados para estimarlo. Todos los análisis estadísticos se realizaron utilizando el programa SPSS® (Chicago, IL) para Windows, versión 15.0.
ResultadosEl ARN-VHE no se identificó en ninguno de los 212 individuos que componen este estudio, al igual que los anticuerpos anti-VHE de tipo IgM. Todas las personas presentaron niveles normales de transaminasas hepáticas. En referencia a la detección de anticuerpos frente al VHE de tipo IgG en los 212 individuos analizados, 25 personas (11,8%) fueron positivas, siendo 21 (18,6%) de ellas expuestas a ganado porcino y 4 (4%) no expuestas. De estos 25 seropositivos, 6 (9,5%) habían viajado al extranjero en el último año. Ninguno de los 25 individuos que presentaban anti-VHE IgG habían consumido marisco crudo; 23 (12,6%) consumían habitualmente verduras crudas y 12 (30%) consumían habitualmente agua no tratada (fig. 1). Todos los sueros anti-VHE IgG positivo mediante ELISA fueron confirmados por western-blot.
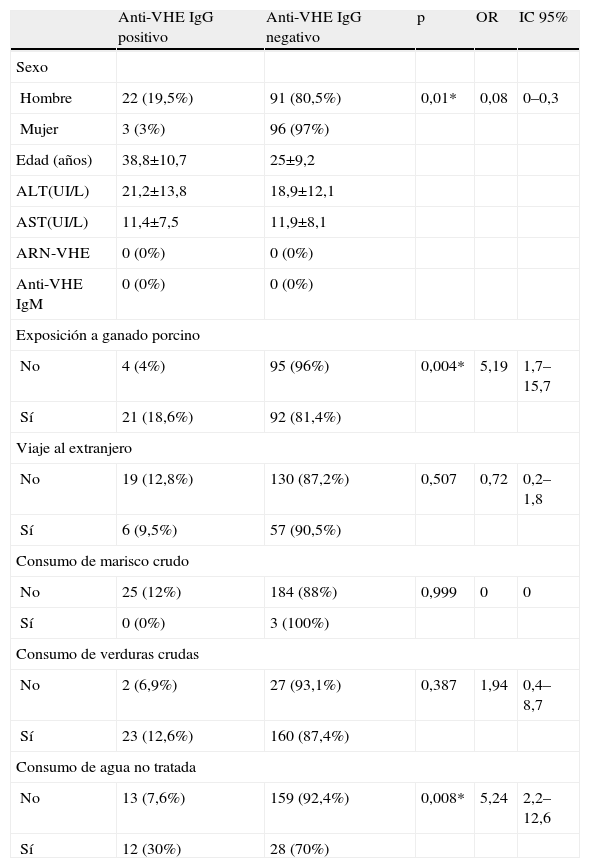
En el análisis estadístico se obtuvieron diferencias significativas entre la presencia de anti-VHE de tipo IgG y la exposición a ganado porcino y el consumo de agua no tratada (p<0,05). En lo que respecta a la exposición a ganado porcino, esta confirmó ser un factor de riesgo para contraer la infección por el VHE (p=0,004), con una OR de 5,19 (IC 1,7–15,7), es decir, un individuo en contacto con ganado porcino puede llegar a tener una probabilidad de infectarse por el VHE, hasta 5,19 veces más que un individuo sin exposición a estos animales (tabla 1). En cuanto al consumo de agua no tratada se obtuvo un valor de OR de 5,24 (IC 2,2–12,6) (p=0,008). Este consumo de agua no tratada se producía en fuentes localizadas en los lugares próximos a las granjas porcinas donde trabajaban estos individuos.
Características y factores de riesgo en la población estudiada, según la presencia o ausencia de anticuerpos anti-VHE IgG
| Anti-VHE IgG positivo | Anti-VHE IgG negativo | p | OR | IC 95% | |
| Sexo | |||||
| Hombre | 22 (19,5%) | 91 (80,5%) | 0,01* | 0,08 | 0–0,3 |
| Mujer | 3 (3%) | 96 (97%) | |||
| Edad (años) | 38,8±10,7 | 25±9,2 | |||
| ALT(UI/L) | 21,2±13,8 | 18,9±12,1 | |||
| AST(UI/L) | 11,4±7,5 | 11,9±8,1 | |||
| ARN-VHE | 0 (0%) | 0 (0%) | |||
| Anti-VHE IgM | 0 (0%) | 0 (0%) | |||
| Exposición a ganado porcino | |||||
| No | 4 (4%) | 95 (96%) | 0,004* | 5,19 | 1,7–15,7 |
| Sí | 21 (18,6%) | 92 (81,4%) | |||
| Viaje al extranjero | |||||
| No | 19 (12,8%) | 130 (87,2%) | 0,507 | 0,72 | 0,2–1,8 |
| Sí | 6 (9,5%) | 57 (90,5%) | |||
| Consumo de marisco crudo | |||||
| No | 25 (12%) | 184 (88%) | 0,999 | 0 | 0 |
| Sí | 0 (0%) | 3 (100%) | |||
| Consumo de verduras crudas | |||||
| No | 2 (6,9%) | 27 (93,1%) | 0,387 | 1,94 | 0,4–8,7 |
| Sí | 23 (12,6%) | 160 (87,4%) | |||
| Consumo de agua no tratada | |||||
| No | 13 (7,6%) | 159 (92,4%) | 0,008* | 5,24 | 2,2–12,6 |
| Sí | 12 (30%) | 28 (70%) | |||
IC: intervalo de confianza; OR: Odds Ratio; p: nivel de significación (*p<0,05: significativo); VEH: virus de la hepatitis E.
Once (44%) de los 25 individuos positivos a anticuerpos anti-VHE IgG, presentaron conjuntamente 2 factores de riesgo: exposición a ganado porcino y consumo de agua no tratada.
En el presente estudio, de los 25 individuos que resultaron positivos a anti-VHE IgG, solamente 6 (25%) habían viajado al extranjero. Los países visitados fueron Francia, Alemania, Holanda y Reino Unido, zonas consideradas como no endémicas, pero en los que se han descrito casos autóctonos de hepatitis E. No obstante, no se obtuvieron diferencias estadísticamente significativas (p=0,507).
En cuanto al resto de variables analizadas en el estudio (consumo de marisco crudo y verduras crudas), tampoco hubo diferencias estadísticamente significativas frente a la presencia de anticuerpos frente al VHE (p=0,999 y p=0,387, respectivamente).
Para evaluar la corrección del modelo estadístico planteado en todas las variables se realizó la prueba de bondad de ajuste de Hosmer y Lemeshow, con un resultado próximo a 1 (0,92), lo que ratifica la validez del estudio.
DiscusiónEn este estudio se ha detectado una elevada seroprevalencia de anticuerpos anti-VHE de tipo IgG en el grupo de individuos expuestos a ganado porcino (18,5%). Este dato, en conjunción con la ausencia de viremia, puede sugerir que el VHE sea el responsable de infecciones subclínicas, ya que ningún individuo declaró en la encuesta epidemiológica el padecimiento de una hepatitis aguda en algún momento de su vida. En los países industrializados, los factores implicados para que se produzca una hepatitis E aguda o una hepatitis E subclínica todavía no se han determinado, aunque existen publicaciones en las que se apuntan como posibles factores la edad, una patología hepática ya existente en el momento de la infección y/o el genotipo de la cepa4.
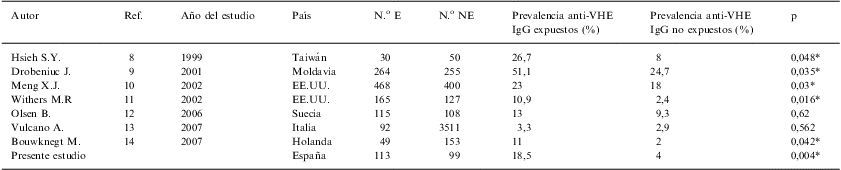
Actualmente, existen pocos estudios que analicen la relación entre la exposición al ganado porcino y la seropositividad frente al VHE, aunque casi todos describen altas prevalencias entre las personas que tienen contacto con cerdos en comparación con los grupos control. En la tabla 2 se muestran los estudios realizados en países como Taiwán, Moldavia, EE.UU., Suecia, Italia y Holanda8–14, donde se han obtenido unos valores de seroprevalencia en individuos expuestos del 26,7%, 51,1%, 23%, 10,9%, 13%, 3,3%, y 11%, respectivamente.
Estudios de seroprevalencia del VHE en grupos con exposición y sin exposición a ganado porcino
| Autor | Ref. | Año del estudio | País | N.o E | N.o NE | Prevalencia anti-VHE IgG expuestos (%) | Prevalencia anti-VHE IgG no expuestos (%) | p |
| Hsieh S.Y. | 8 | 1999 | Taiwán | 30 | 50 | 26,7 | 8 | 0,048* |
| Drobeniuc J. | 9 | 2001 | Moldavia | 264 | 255 | 51,1 | 24,7 | 0,035* |
| Meng X.J. | 10 | 2002 | EE.UU. | 468 | 400 | 23 | 18 | 0,03* |
| Withers M.R | 11 | 2002 | EE.UU. | 165 | 127 | 10,9 | 2,4 | 0,016* |
| Olsen B. | 12 | 2006 | Suecia | 115 | 108 | 13 | 9,3 | 0,62 |
| Vulcano A. | 13 | 2007 | Italia | 92 | 3511 | 3,3 | 2,9 | 0,562 |
| Bouwknegt M. | 14 | 2007 | Holanda | 49 | 153 | 11 | 2 | 0,042* |
| Presente estudio | España | 113 | 99 | 18,5 | 4 | 0,004* |
N.o E: número de expuestos, N.o NE: número de no expuestos, p: nivel de significación (*p<0,05: significativo); VHE: virus de la hepatitis E.
En cuanto al consumo de agua no tratada, esta es una práctica habitual en las distintas zonas rurales de nuestra área de estudio (Comunidad Valenciana), donde existen un gran número de fuentes o pozos de agua no potabilizada. Además, en estas mismas zonas, los agricultores suelen abonar los campos con fertilizantes compuestos por heces de diversos animales (generalmente de cerdo) y regarlos con el agua de las fosas de purines de granjas de cerdo. Así, en un estudio realizado en 21 granjas de cerdos de la Comunidad Valenciana7, se detectó el ARN-VHE en el 50% de las fosas de purines de dichas granjas. Estos datos sugieren que si estos purines no son tratados y se utilizan para regar los campos, pueden filtrarse a través de la tierra y contaminar con el VHE los acuíferos de donde procede el agua de las fuentes o pozos, pudiendo alcanzar en último lugar a la población humana, con el consiguiente problema de salud pública que ello supone. Sin embargo, esta hipótesis necesita ser confirmada mediante estudios que detecten el VHE en las aguas de estas fuentes y pozos.
En España se han descrito varios casos esporádicos de hepatitis E aguda en Madrid4,15, Cádiz16, Barcelona17, Huelva18 y Huesca18. El último estudio publicado en nuestro país de un caso autóctono de hepatitis E aguda, ha sido el de un hombre de 62 años que trabajaba en un matadero4. En este estudio se consiguió aislar una cepa que mostraba un elevado porcentaje de homología con cepas porcinas españolas (97,3%). Este dato junto con los resultados del presente estudio, refuerza la idea de que el ganado porcino está actuando como reservorio del VHE.
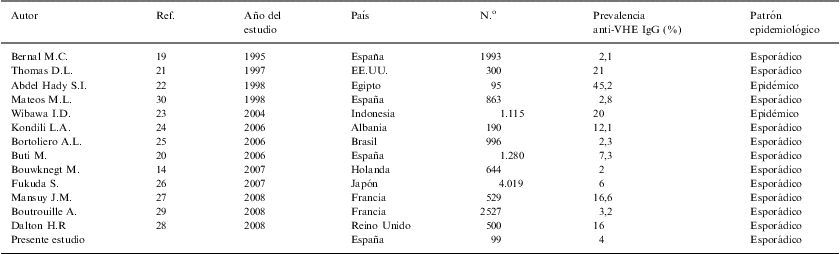
Excluyendo países endémicos como Egipto e Indonesia, donde los datos de seroprevalencia fueron del 45,2% y 20% respectivamente, las prevalencias en países no endémicos varían entre un 2% y un 21%19–29. Estas amplias variaciones son descritas incluso en un mismo país, como es el caso de Francia donde en 2 estudios realizados en 2 regiones del país detectan seroprevalencias bastante diferentes, en el centro del 2,8% y en el sudeste del 16,6%. En otros estudios realizados en países europeos se encuentran valores inferiores y superiores a los obtenidos en nuestro trabajo, como un 2% en Holanda y un 16% en el Reino Unido, respectivamente. En el presente estudio, se ha observado en individuos sin contacto con ganado porcino (grupo control) una seropositividad frente al VHE del 4%. Este dato es superior al publicado en otro estudio realizado en España, por Bernal et al19 en 1995, en el que se obtuvo una seroprevalencia del 2,1% en población general. En 1998, Mateos et al30, analizaron la prevalencia de anticuerpos anti-VHE de clase IgG en 863 donantes de sangre, obteniendo una seropositividad del 2,8%, mientras que en 2006, Buti et al20 detectaron una prevalencia de anticuerpos anti-VHE IgG del 7,3% en población general. Es importante destacar que en todos los trabajos citados menos uno19, las muestras positivas no fueron confirmadas mediante western-blot. Adicionalmente, en ninguno de los 3 estudios citados anteriormente se tuvo en cuenta el contacto con ganado porcino como factor de riesgo. En estudios realizados en otros países, también se detecta una amplia diversidad de resultados en cuanto a la seroprevalencia del VHE en población general, tal y como se observa en la tabla 3. La gran variedad observada entre las prevalencias descritas en los diferentes estudios citados, puede ser debida a la diversidad del tamaño muestral, al país donde se realiza el estudio y/o a la técnica de diagnóstico utilizada. En este contexto, se han realizado diversos estudios en países industrializados, que analizan la variabilidad de la sensibilidad, dependiendo del ensayo utilizado para el diagnóstico serológico, mostrando una amplia variación de sensibilidad (entre 17–100%). Así, Herremans et al, en 200731, observaron que la especificidad de los ensayos que se utilizan para determinar anticuerpos anti-VHE IgM era aceptable mientras que la determinación de anti-VHE IgG, la especificidad fue muy variable dependiendo del ensayo utilizado Una posible causa que explica esta variabilidad es que los antígenos utilizados en estos enzimoinmunoensayos son péptidos sintéticos o proteínas recombinantes del VHE que difieren no solo en longitud, sino además en la región del genoma que las codifica y en el genotipo.
Estudios de seroprevalencia del VHE en donantes voluntarios en diferentes países
| Autor | Ref. | Año del estudio | País | N.o | Prevalencia anti-VHE IgG (%) | Patrón epidemiológico |
| Bernal M.C. | 19 | 1995 | España | 1993 | 2,1 | Esporádico |
| Thomas D.L. | 21 | 1997 | EE.UU. | 300 | 21 | Esporádico |
| Abdel Hady S.I. | 22 | 1998 | Egipto | 95 | 45,2 | Epidémico |
| Mateos M.L. | 30 | 1998 | España | 863 | 2,8 | Esporádico |
| Wibawa I.D. | 23 | 2004 | Indonesia | 1.115 | 20 | Epidémico |
| Kondili L.A. | 24 | 2006 | Albania | 190 | 12,1 | Esporádico |
| Bortoliero A.L. | 25 | 2006 | Brasil | 996 | 2,3 | Esporádico |
| Buti M. | 20 | 2006 | España | 1.280 | 7,3 | Esporádico |
| Bouwknegt M. | 14 | 2007 | Holanda | 644 | 2 | Esporádico |
| Fukuda S. | 26 | 2007 | Japón | 4.019 | 6 | Esporádico |
| Mansuy J.M. | 27 | 2008 | Francia | 529 | 16,6 | Esporádico |
| Boutrouille A. | 29 | 2008 | Francia | 2527 | 3,2 | Esporádico |
| Dalton H.R | 28 | 2008 | Reino Unido | 500 | 16 | Esporádico |
| Presente estudio | España | 99 | 4 | Esporádico |
VEH: virus de la hepatitis E.
En conclusión, este estudio sugiere que el consumo de agua no tratada y la exposición a ganado porcino son factores de riesgo para contraer la infección por VHE. La exposición al ganado porcino parece indicar que la infección por este virus podría tratarse como una enfermedad ocupacional en trabajadores del sector porcino y que deberían tomarse las medidas higiénico- sanitarias correspondientes en este grupo para disminuir la exposición al VHE.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente estudio se ha realizado gracias a los proyectos financiados por la Generalitat Valenciana (GV05/132), la Escuela Valenciana de la Salud (Consellería de Salud, 053/2005) y la Universidad CEU-Cardenal Herrera (PRUCH 04/08 y 06/21).