Se pretende analizar los resultados a corto y medio plazo de diferentes técnicas quirúrgicas en el tratamiento de la diverticulitis aguda complicada (DAC).
MétodosEstudio retrospectivo y multicéntrico de pacientes operados de urgencia o de urgencia diferida por DAC.
ResultadosEstudiamos a 385 pacientes: 218 hombres y 167 mujeres, de edad media 64,4±15,6 años, intervenidos en 10 hospitales. La mediana (25-75° percentiles) de evolución desde el inicio de los síntomas hasta la cirugía fue de 48 h(24-72), y su indicación más frecuente, un cuadro peritonítico (66%). El abordaje fue generalmente abierto (95,1%) y los hallazgos más comunes, peritonitis purulenta (34,8%) o absceso pericólico (28,6%). La técnica más habitual fue el procedimiento de Hartmann (PHT) en 278 (72,2%), seguida de resección y anastomosis primaria (RAP) en 69 (17,9%). Se complicaron 205 pacientes (53,2%) y fallecieron 50 (13%). Edad avanzada, inmunodepresión, factores de riesgo quirúrgico y peritonitis fecal se asociaron a mayor mortalidad. El lavado peritoneal laparoscópico (LPL) tuvo elevada tasa de reintervenciones, implicando frecuentemente un estoma, y la RAP se complicó con dehiscencia de sutura en el 13,7% de pacientes, sin diferencias en la morbimortalidad al compararla con el PHT. La mediana de estancia postoperatoria fue de 12 días; su mayor duración se relacionó con la mayor edad, riesgo quirúrgico ASA, hospital y complicaciones postoperatorias.
ConclusionesLa cirugía por DAC tiene importante morbimortalidad y se asocia frecuentemente a un estoma terminal. Además, el LPL presenta alta tasa de reintervenciones. LA RAP, aun asociando un estoma de protección, parece de elección en muchos casos.
To analyze short and medium-term results of different surgical techniques in the treatment of complicated acute diverticulitis (CAD).
MethodsMulticentre retrospective study including patients operated on as surgical emergency or deferred-urgency with the diagnosis of CAD.
ResultsA series of 385 patients: 218 men and 167 women, mean age 64.4±15.6 years, operated on in 10 hospitals were included. The median (25th-75th percentile) time from symptoms to surgery was 48 (24-72) h, being peritonitis the main surgical indication in a 66% of cases. Surgical approach was usually open (95.1%), and the commonest findings, a purulent peritonitis (34.8%) or pericolonic abscess (28.6%). Hartmann procedure (HP) was the most used technique in 278 (72.2%) patients, followed by resection and primary anastomosis (RPA) in 69 (17.9%). The overall postoperative morbidity and mortality was 53.2% and 13% respectively. Age, immunosupression, presence of general risk factors and faecal peritonitis were associated with increased mortality. Laparoscopic peritoneal lavage (LPL) was associated with an increased reoperation rate frequently involving a stoma, and anastomotic leaks presented in 13.7 patients after RPA, without differences in morbimortality when compared with HP. Median postoperative length of stay was 12 days, and was correlated with age, surgical risk, ASA score, hospital and postoperative complications.
ConclusionsSurgery for CAD has important morbidity and mortality and is frequently associated with an end-stoma. Moreover LPL presented high reoperation rates. It seems better to resect and anastomose in most cases, even with an associated protective stoma.
Existen controversias en el manejo quirúrgico de la diverticulitis aguda complicada (DAC). Así, hay debate sobre si realizar o no anastomosis1–3 y también sobre si adoptar una actitud mínimamente invasiva, tal como el lavado peritoneal laparoscópico (LPL)3–6.
En un estudio previo, evidenciamos una baja tasa de reconstrucción de la continuidad intestinal tras el procedimiento de Hartmann (PHT)7, que tiene, además, una morbimortalidad y costes nada despreciables, por lo que, cuando se analiza la actitud en urgencias, habría que establecer comparaciones que incluyan ambas intervenciones frente a la resección y anastomosis primaria (RAP) o a los resultados a largo plazo de una actitud no resectiva8.
En nuestro país hay grupos con gran experiencia en el manejo de la DAC4, pero no existen revisiones sobre su tratamiento habitual. El objetivo del presente trabajo es analizar los resultados a corto y medio plazo de diferentes técnicas quirúrgicas en el tratamiento de la DAC en distintos hospitales de la Comunidad Valenciana.
MétodosRealizamos un estudio retrospectivo, multicéntrico, en la Comunidad Valenciana, que incluye a pacientes intervenidos de urgencia o de urgencia diferida por DAC, desde enero de 2004 hasta diciembre de 2009, con recogida de datos a finales de 2012, para poder evaluar la posible recurrencia de la diverticulitis o reconstrucción del estoma. Se facilitó un fichero informático a los cirujanos y servicios interesados para la recogida de datos. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario de Valencia.
Se analizaron variables demográficas, comorbilidad, indicación quirúrgica, hallazgos operatorios, grado de contaminación de la herida9, Peritonitis Severity Score (PPS)10, tipo de intervención y resultados en términos de estancias y morbimortalidad a 30 días de la cirugía, empleando la clasificación modificada de Clavien-Dindo11. Se consideraron como dehiscencias o fugas anastomóticas, aquellas diagnosticadas con repercusión clínica, excluyendo las asintomáticas, dado el carácter retrospectivo del estudio.
Los datos fueron analizados mediante el paquete estadístico SPSS (versión 20) para Windows (SPSS Inc., Chicago IL, EE. UU.). Se emplearon los test no paramétricos de la U de Mann Whithney o de Kruskal Wallis para datos independientes en las variables continuas, y la asociación de variables categóricas con la morbimortalidad se analizó mediante los test χ2 y exacto de Fisher. Utilizamos la regresión logística binaria para predecir la influencia de las variables con significación p<0,1 en el estudio univariante sobre la morbimortalidad. Se consideró significativo un valor de p<0,05.
ResultadosAnalizamos a 385 pacientes, 218 (56,6%) hombres y 167 (43,4%) mujeres, de edad media 64,4 años (DE 15,6), intervenidos quirúrgicamente en 10 hospitales. La década en que se produjeron más casos fue la de 71 a 80 (31,4%), mientras que un 22,6% tenían 50 años o menos. La mitad de los centros eran de tercer nivel (71% de pacientes) y, el resto, de distrito. La mediana (25-75° percentiles) de tiempo de evolución clínica hasta la cirugía fue de 48 h (24-72) y la indicación más común, un cuadro peritonítico en un 66%.
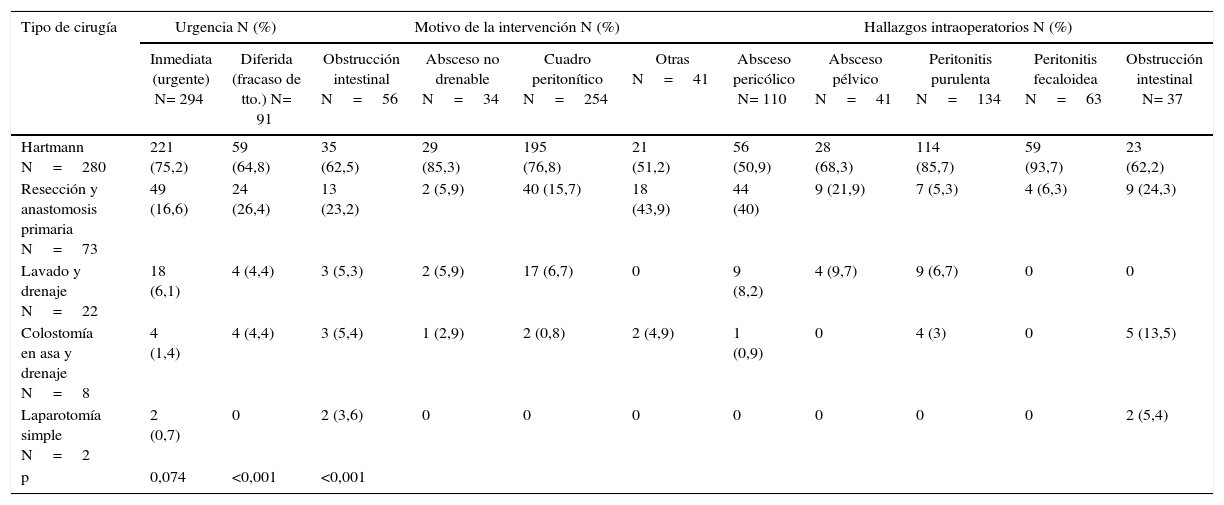
El abordaje fue mayoritariamente abierto y el hallazgo más frecuente, la peritonitis difusa purulenta seguida del absceso pericólico. La intervención más realizada fue el PHT (72,2%) (tabla 1) independientemente de la indicación o los hallazgos (tabla 2). Los hospitales terciarios realizaron más RAP que los de distrito (24 vs. 6%; p<0,0001). Esta técnica se asocia más a cirugía limpia-contaminada (43,6%) que a contaminada (28,3%) o sucia (6,9%) (p<0,0001). La RAP se efectuó en pacientes de menor edad que el PHT: 59,5 (DE 16) frente a 65,8 años (DE 15,5) (p=0,03). El PSS10 o el número de factores de riesgo (NFR) no se relacionaron con el tipo de intervención (p=0,2 y p=0,783, respectivamente).
Datos preoperatorios y relativos a la intervención quirúrgica
| Variable | N (%) |
|---|---|
| Edad en años, mediana (rango) | 68 (25-97) |
| Horas de evolución (N=290), mediana (rango) | 48 (5-504) |
| Factores de riesgoa(N=330), mediana (rango) | 1 (0-5) |
| Inmunodepresión | 46 (13,9) |
| IMC kg/m2(N=86) | 27 (19-40) |
| ASA (N=248) | |
| I | 23 (9,3) |
| II | 94 (37,9) |
| III | 105 (42,3) |
| IV | 26 (10,5) |
| Motivo de intervención | |
| Obstrucción intestinal | 56 (14,5) |
| Absceso no drenable percutáneamente | 34 (8,8) |
| Cuadro peritonítico | 254 (66) |
| Otros | 41 (10,6) |
| Cirujano | |
| Colorrectal | 82 (21,2) |
| Staff | 236 (61,3) |
| M.I.R. | 67 (17,4) |
| Urgencia | |
| Inmediata (cirugía de entrada) | 294 (76,4) |
| Diferida (fracaso de tratamiento) | 91 (23,6) |
| Abordaje laparoscópico | 19 (4,9) |
| Hallazgos intraoperatorios | |
| Absceso pericólico | 110 (28,6) |
| Absceso pélvico | 41 (10,6) |
| Peritonitis purulenta | 134 (34,8) |
| Peritonitis fecaloidea | 63 (16,4) |
| Otros/variosb | 37 (9,6) |
| Grado de contaminación | |
| Limpia-contaminada | 46 (11,9) |
| Contaminada | 138 (35,8) |
| Sucia | 201 (52,2) |
| Peritonitis Severity Score | 8 (7-9) |
| Hipotensión intraoperatoria (N=301) | 53 (17,6) |
| Tipo de intervención | |
| Resección y colostomía (Hartmann) | 280 (72,7) |
| Resección y anastomosis primaria | 73 (19) |
| Lavado y drenaje | 24 (6,2) |
| Colostomía en asa y drenaje | 8 (2,1) |
| Resección de colon (N=385) | |
| Ninguna | 28 (7,3) |
| Limitada al área afecta | 81 (21) |
| Sigmoidectomía | 272 (70,6) |
| Colectomía subtotal | 4 (1,1) |
| Anastomosis (N=73) | |
| Manual | 10 (13,7) |
| Mecánica (grapadora lineal) | 8 (11) |
| Mecánica (grapadora circular) | 55 (75,3) |
| Nivel de anastomosis (N=61) | |
| Colon sigmoide | 10 (16,4) |
| Recto (al promontorio) | 48 (78,7) |
| Recto (bajo el promontorio) | 3 (4,9) |
| Estoma asociadoc(N=73) | 11 (15,1) |
| Duración de la intervención en minutos (N=346) | 150 (30-375) |
ASA: clasificación de estado físico de la American Society of Anaesthesiology; IMC: índice de masa corporal; M.I.R.: médico interno-residente.
Intervención realizada en función del motivo por el que se indicó y de los hallazgos
| Tipo de cirugía | Urgencia N (%) | Motivo de la intervención N (%) | Hallazgos intraoperatorios N (%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Inmediata (urgente) N= 294 | Diferida (fracaso de tto.) N= 91 | Obstrucción intestinal N=56 | Absceso no drenable N=34 | Cuadro peritonítico N=254 | Otras N=41 | Absceso pericólico N= 110 | Absceso pélvico N=41 | Peritonitis purulenta N=134 | Peritonitis fecaloidea N=63 | Obstrucción intestinal N= 37 | |
| Hartmann N=280 | 221 (75,2) | 59 (64,8) | 35 (62,5) | 29 (85,3) | 195 (76,8) | 21 (51,2) | 56 (50,9) | 28 (68,3) | 114 (85,7) | 59 (93,7) | 23 (62,2) |
| Resección y anastomosis primaria N=73 | 49 (16,6) | 24 (26,4) | 13 (23,2) | 2 (5,9) | 40 (15,7) | 18 (43,9) | 44 (40) | 9 (21,9) | 7 (5,3) | 4 (6,3) | 9 (24,3) |
| Lavado y drenaje N=22 | 18 (6,1) | 4 (4,4) | 3 (5,3) | 2 (5,9) | 17 (6,7) | 0 | 9 (8,2) | 4 (9,7) | 9 (6,7) | 0 | 0 |
| Colostomía en asa y drenaje N=8 | 4 (1,4) | 4 (4,4) | 3 (5,4) | 1 (2,9) | 2 (0,8) | 2 (4,9) | 1 (0,9) | 0 | 4 (3) | 0 | 5 (13,5) |
| Laparotomía simple N=2 | 2 (0,7) | 0 | 2 (3,6) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 (5,4) |
| p | 0,074 | <0,001 | <0,001 | ||||||||
Tto: tratamiento.
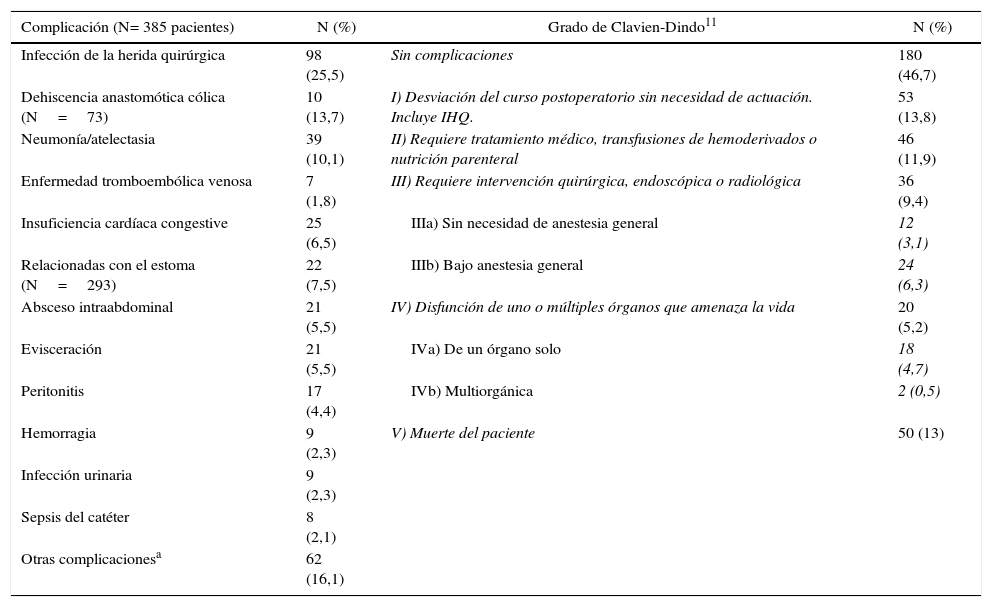
Hubo morbilidad en 205 pacientes (53,2%) con 348 complicaciones y 60 reintervenciones, y fallecieron 50 (13%) (tabla 3). Las más frecuentes fueron las infecciosas (48,5%), seguidas de las cardiorrespiratorias. El 27,5% de los pacientes presentaron complicaciones graves (grado III o superior de Clavien-Dindo11).
Complicaciones posquirúrgicas. N= 385 pacientes
| Complicación (N= 385 pacientes) | N (%) | Grado de Clavien-Dindo11 | N (%) |
|---|---|---|---|
| Infección de la herida quirúrgica | 98 (25,5) | Sin complicaciones | 180 (46,7) |
| Dehiscencia anastomótica cólica (N=73) | 10 (13,7) | I) Desviación del curso postoperatorio sin necesidad de actuación. Incluye IHQ. | 53 (13,8) |
| Neumonía/atelectasia | 39 (10,1) | II) Requiere tratamiento médico, transfusiones de hemoderivados o nutrición parenteral | 46 (11,9) |
| Enfermedad tromboembólica venosa | 7 (1,8) | III) Requiere intervención quirúrgica, endoscópica o radiológica | 36 (9,4) |
| Insuficiencia cardíaca congestive | 25 (6,5) | IIIa) Sin necesidad de anestesia general | 12 (3,1) |
| Relacionadas con el estoma (N=293) | 22 (7,5) | IIIb) Bajo anestesia general | 24 (6,3) |
| Absceso intraabdominal | 21 (5,5) | IV) Disfunción de uno o múltiples órganos que amenaza la vida | 20 (5,2) |
| Evisceración | 21 (5,5) | IVa) De un órgano solo | 18 (4,7) |
| Peritonitis | 17 (4,4) | IVb) Multiorgánica | 2 (0,5) |
| Hemorragia | 9 (2,3) | V) Muerte del paciente | 50 (13) |
| Infección urinaria | 9 (2,3) | ||
| Sepsis del catéter | 8 (2,1) | ||
| Otras complicacionesa | 62 (16,1) |
aComplicaciones no incluidas como variables del estudio, pero registradas en cada centro.
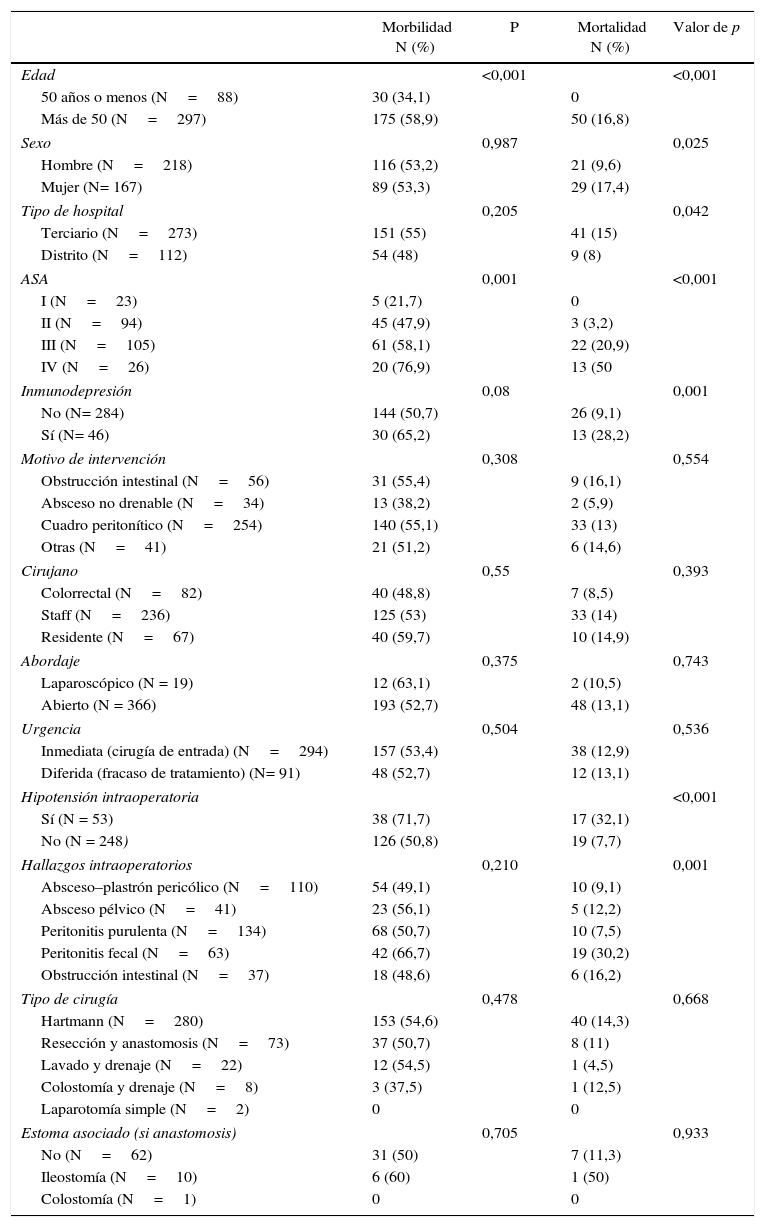
La edad, riesgo ASA, PSS y NFR se asociaron a riesgo de morbimortalidad en mayores de 50 años frente a menores, de (OR: 2,7; IC 95% 1,7-4,5; p<0,0001). Los inmunodeprimidos tuvieron mayor mortalidad (OR 3,9; IC 95%: 1,8-8,3) y mayor, pero no significativa, morbilidad. La hipotensión intraoperatoria se asoció a mortalidad: (OR: 5,7; IC 95%: 2,7-11,9) (tabla 4). La morbilidad osciló ampliamente entre hospitales del 33,3 al 65,4% (p=0,153) y la mortalidad del 5,3 al 29,7% (p=0,079).
Morbilidad y mortalidad de la intervención en función de diferentes factores
| Morbilidad N (%) | P | Mortalidad N (%) | Valor de p | |
|---|---|---|---|---|
| Edad | <0,001 | <0,001 | ||
| 50 años o menos (N=88) | 30 (34,1) | 0 | ||
| Más de 50 (N=297) | 175 (58,9) | 50 (16,8) | ||
| Sexo | 0,987 | 0,025 | ||
| Hombre (N=218) | 116 (53,2) | 21 (9,6) | ||
| Mujer (N= 167) | 89 (53,3) | 29 (17,4) | ||
| Tipo de hospital | 0,205 | 0,042 | ||
| Terciario (N=273) | 151 (55) | 41 (15) | ||
| Distrito (N=112) | 54 (48) | 9 (8) | ||
| ASA | 0,001 | <0,001 | ||
| I (N=23) | 5 (21,7) | 0 | ||
| II (N=94) | 45 (47,9) | 3 (3,2) | ||
| III (N=105) | 61 (58,1) | 22 (20,9) | ||
| IV (N=26) | 20 (76,9) | 13 (50 | ||
| Inmunodepresión | 0,08 | 0,001 | ||
| No (N= 284) | 144 (50,7) | 26 (9,1) | ||
| Sí (N= 46) | 30 (65,2) | 13 (28,2) | ||
| Motivo de intervención | 0,308 | 0,554 | ||
| Obstrucción intestinal (N=56) | 31 (55,4) | 9 (16,1) | ||
| Absceso no drenable (N=34) | 13 (38,2) | 2 (5,9) | ||
| Cuadro peritonítico (N=254) | 140 (55,1) | 33 (13) | ||
| Otras (N=41) | 21 (51,2) | 6 (14,6) | ||
| Cirujano | 0,55 | 0,393 | ||
| Colorrectal (N=82) | 40 (48,8) | 7 (8,5) | ||
| Staff (N=236) | 125 (53) | 33 (14) | ||
| Residente (N=67) | 40 (59,7) | 10 (14,9) | ||
| Abordaje | 0,375 | 0,743 | ||
| Laparoscópico (N = 19) | 12 (63,1) | 2 (10,5) | ||
| Abierto (N = 366) | 193 (52,7) | 48 (13,1) | ||
| Urgencia | 0,504 | 0,536 | ||
| Inmediata (cirugía de entrada) (N=294) | 157 (53,4) | 38 (12,9) | ||
| Diferida (fracaso de tratamiento) (N= 91) | 48 (52,7) | 12 (13,1) | ||
| Hipotensión intraoperatoria | <0,001 | |||
| Sí (N = 53) | 38 (71,7) | 17 (32,1) | ||
| No (N = 248) | 126 (50,8) | 19 (7,7) | ||
| Hallazgos intraoperatorios | 0,210 | 0,001 | ||
| Absceso–plastrón pericólico (N=110) | 54 (49,1) | 10 (9,1) | ||
| Absceso pélvico (N=41) | 23 (56,1) | 5 (12,2) | ||
| Peritonitis purulenta (N=134) | 68 (50,7) | 10 (7,5) | ||
| Peritonitis fecal (N=63) | 42 (66,7) | 19 (30,2) | ||
| Obstrucción intestinal (N=37) | 18 (48,6) | 6 (16,2) | ||
| Tipo de cirugía | 0,478 | 0,668 | ||
| Hartmann (N=280) | 153 (54,6) | 40 (14,3) | ||
| Resección y anastomosis (N=73) | 37 (50,7) | 8 (11) | ||
| Lavado y drenaje (N=22) | 12 (54,5) | 1 (4,5) | ||
| Colostomía y drenaje (N=8) | 3 (37,5) | 1 (12,5) | ||
| Laparotomía simple (N=2) | 0 | 0 | ||
| Estoma asociado (si anastomosis) | 0,705 | 0,933 | ||
| No (N=62) | 31 (50) | 7 (11,3) | ||
| Ileostomía (N=10) | 6 (60) | 1 (50) | ||
| Colostomía (N=1) | 0 | 0 | ||
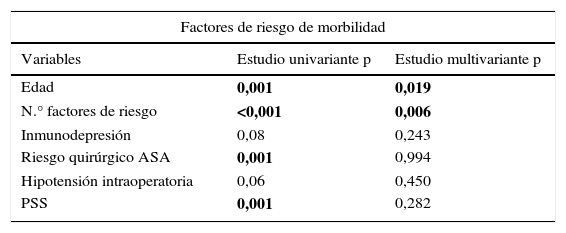
En el análisis multivariante, el NFR se asoció a más morbilidad; el riesgo ASA, la inmunodepresión y el PSS, a mortalidad postoperatoria y la edad, a ambas (tabla 5).
Estudio multivariante de los factores de riesgo de morbimortalidad postoperatoria
| Factores de riesgo de morbilidad | ||
|---|---|---|
| Variables | Estudio univariante p | Estudio multivariante p |
| Edad | 0,001 | 0,019 |
| N.° factores de riesgo | <0,001 | 0,006 |
| Inmunodepresión | 0,08 | 0,243 |
| Riesgo quirúrgico ASA | 0,001 | 0,994 |
| Hipotensión intraoperatoria | 0,06 | 0,450 |
| PSS | 0,001 | 0,282 |
| Factores de riesgo de mortalidad | ||
|---|---|---|
| Variables | Estudio univariante p | Estudio multivariante p |
| Edad | <0,001 | 0,018 |
| Sexo | 0,025 | 0,528 |
| Tipo de hospital | 0,042 | 0,998 |
| IMC | 0,064 | 0,225 |
| N.° factores de riesgo | <0,001 | 0,225 |
| Riesgo quirúrgico ASA | <0,001 | 0,033 |
| Hipotensión intraoperatoria | <0,001 | 0,097 |
| Inmunodepresión | 0,001 | 0,034 |
| Hallazgos operatorios | 0,001 | 0,124 |
| PSS | <0,001 | 0,025 |
Se incluyeron en el análisis multivariante aquellos factores con una significación de p<0,1 en el univariante.
En negrita: estadísticamente significativos.
IMC: índice de masa corporal; PSS: Peritonitis Severity Score.
Se reintervino a 62 pacientes (16,1%). El único factor que afectó la tasa de reoperaciones fue la cirugía empleada y, concretamente, el LPL se asoció a un 45%, en las que se efectuaron 7 estomas, manteniendo la significación en el análisis multivariante (p=0,006). Hubo también más NFR en quienes se evisceraron (2,1 vs. 1,1; p=0,036). Este fue el motivo más común de reintervención (30%), seguido de peritonitis difusas (21,6%), absceso intraabdominal (20%) o necrosis/retracción del estoma (16,6%).
La dehiscencia anastomótica (DA) cólica tras RAP, una intervención que solamente se efectuó en la mitad de los centros, se presentó en el 13,7%. Las anastomosis manuales tuvieron mayor riesgo que las mecánicas (p=0,024) y las resecciones parciales de sigma, una tendencia a la fuga anastomótica mayor que las sigmoidectomías completas (33,3% frente a 10,9%; p=0,067). Ningún paciente con anastomosis protegida por un estoma presentó una fuga.
De los 10 pacientes con dehiscencia anastomótica, 3 fueron tratados conservadoramente y, de los 7 reoperados, en 6 se transformó la anastomosis en colostomía terminal. Un paciente falleció por cuadro séptico.
La mediana de estancia postoperatoria global (25-75° percentiles) fue de 12 días (8-20) (rango 1-120). Únicamente la mayor edad y el NFR se asociaron a estancias prolongadas (p<0,001). Sin embargo, sí hubo diferencias significativas entre hospitales (p=0,011), que oscilaron entre 12 y 21 días. Los pacientes complicados presentaron estancias más largas (21,9 días; DE 18,5) que los no complicados (10,5 días; DE 5,3; p<0,0001), así como los reintervenidos (30,6 días; DE 21,4) que quienes no lo fueron (14,1 días; DE 12,1; p<0,0001).
A largo plazo, se observó recurrencia de la diverticulitis en 13/244 pacientes (5,3%), que fue superior en los no resecados (38,1%) y en aquellos con exéresis limitada a la zona afecta (4,8%), que en quienes se resecó el sigma (1,2%; p<0,0001). Los pacientes con LPL tuvieron el 41,2% de recurrencias y aquellos a los que se hizo colostomía y drenaje, el 33,3% frente al 1,6% tras PHT o el 2,9% tras RAP (p<0,0001).
Tras la intervención quirúrgica inicial, 312 pacientes presentaban un estoma (301 colostomías y 11 ileostomías derivativas).
DiscusiónLa diverticulitis aguda requiere cirugía urgente en alrededor del 25% de los pacientes3,12,13, está gravada con importante morbimortalidad y secuelas, como la realización de una colostomía que quizás nunca se cierre7,8. Pese a la tendencia a ambulatorizar los casos leves14,15, afloran pacientes más complejos por edad y comorbilidades.
La elección técnica es una de las controversias en el manejo de la DAC: anastomosar o no hacerlo, o mantener una actitud no resectiva son opciones en las que influye tanto la tradición como la experiencia, e incluso las circunstancias de las urgencias hospitalarias en nuestro entorno.
La distribución en edad y sexo de nuestros pacientes fue similar a diferentes series occidentales4,16. La mediana de evolución hasta la cirugía fue de 48 h, y solamente un 22% no presentó ningún factor de riesgo. Los más comunes son las enfermedades cardiovasculares isquémicas y la arterioesclerosis. Un 14% se consideraron inmunodeprimidos por presentar neoplasias avanzadas, ser trasplantados, tener insuficiencia renal o estar en tratamientos con corticoides, inmunosupresores o quimioterápicos. Esta tasa es más baja que la de otros estudios pues el dato, recogido en función de los antecedentes registrados, posiblemente se infraestimó17.
La indicación quirúrgica más frecuente fue un cuadro peritonítico y el PHT la técnica más empleada (72,7%), acorde con la literatura2–4, y fue la más común en todos los escenarios, independientemente, del riesgo quirúrgico o del cirujano. Ante peritonitis difusa se empleó en casi un 90%, en detrimento de la RAP, realizada en este contexto solamente en el 7% de los casos. Es llamativo que pese a las recomendaciones de la literatura3,18, en un 21% de los casos se limitase la resección al área afecta del sigma y en el 16% se hiciese una anastomosis al colon sigmoideo en lugar de al recto.
La sigmoidectomía de urgencia se requiere para pacientes con fracaso del tratamiento no operatorio o cuadro peritonítico franco, recomendación importante basada en evidencias de moderada calidad (1B) para la American Society of Colon and Rectal Surgeons3. Aunque series cortas han mostrado éxitos con tratamiento no operatorio en pacientes incluso con neumoperitoneo, solamente se podría reservar a aquellos muy estables, sin signos peritoneales ni de sepsis grave19. Tras la resección, el cirujano puede efectuar una anastomosis asociada o no a derivación fecal proximal, o una colostomía terminal. La evidencia de estudios no aleatorizados es que la RAP no se asocia a peores resultados1,20. El Diverticulitis disease propensity score21 estima la posibilidad de realizar una anastomosis primaria o una colostomía terminal mediante diversos factores predictivos22 y, en un estudio prospectivo, los pacientes con índice superior estuvieron más cerca de que se les realizase un PHT23. Debido a los sesgos bibliográficos, el cirujano debe sopesar los riesgos individuales en cada caso. Así, favorecen al menos una diversión proximal la inestabilidad hemodinámica, la acidosis, el fracaso multiorgánico y la inmunosupresión, aparte de las preferencias del cirujano, que puede temer realizar cirugía reconstructiva en un paciente nada favorable, quizás a una hora intempestiva3,4,18. Si bien tienen limitaciones, los metaanálisis que comparan RAP y PHT en peritonitis difusa muestran mortalidad comparable22 y Zeitoun et al.24, en un ensayo multicéntrico aleatorizado, tampoco observaron diferencias cuando se efectuó una resección, o bien colostomía y drenaje.
Los pacientes de 50 o menos años tuvieron menor riesgo quirúrgico que los mayores, que además presentaron más frecuentemente inestabilidad hemodinámica o un PSS mayor, como en otros estudios10,25. Hubo tendencia a efectuar RAP en los más jóvenes.
En función del centro, se observaron diferencias en todas las variables a excepción de la edad: la RAP fue más empleada en hospitales terciarios, posiblemente por mayor dedicación específica, y los cirujanos colorrectales hicieron más RAP y menos PHT que los no colorrectales. Hay que destacar que ningún paciente con anastomosis protegida por un estoma presentó dehiscencia. Un ensayo aleatorizado entre pacientes con peritonitis a los que se efectuó una RAP protegida por ileostomía, o bien un PHT, hubo de interrumpirse prematuramente pues la reconstrucción de Hartmann tenía más complicaciones graves (20 vs. 0%), que la de la ileostomía y los pacientes con PHT reconstruían menos frecuentemente su estoma (57 vs. 90%)26.
El abordaje laparoscópico fue poco utilizado: se realizó LPL en menos del 3% de los pacientes. Series de casos y estudios retrospectivos mostraron beneficios de esta técnica en peritonitis purulentas27 por su baja mortalidad, menos estomas e infecciones de herida, sin diferencias en cuanto a recurrencias con técnicas resectivas; pero su baja calidad metodológica, el dejar un foco séptico y la escasez de estudios prospectivos tras el inicial de Myers et al.28 han continuado limitando su uso. En resumen, todavía no hay evidencias para considerarlo una alternativa adecuada a la colectomía3, aunque recientes ensayos aleatorizados muestran un postoperatorio inmediato más rápido y menos molesto, si bien no se ha demostrado superioridad frente a técnicas resectivas. Parece controlar la sepsis en el 80% de los casos sin precisar cirugía posterior en un 50%5,6,29–32 y, en cualquier caso, su indicación sería las peritonitis purulentas en pacientes no inmunodeprimidos ni de elevado riesgo quirúrgico en las que no se evidencia una perforación franca. Para ello no solo se requiere un cirujano experimentado en acceso laparoscópico sino también mayor discriminación radiológica entre peritonitis difusa y fecal y mejor diagnóstico de los cánceres perforados para decidir su uso33.
Nuestra morbimortalidad fue acorde con la literatura20,34 y no hubo diferencias entre los pacientes operados de urgencia y aquellos con fracaso de tratamiento. Globalmente las complicaciones infecciosas supusieron el 48,5%, y la causa más frecuente de mortalidad fue el fracaso multiorgánico/shock séptico en el 72% de casos. Entre los factores relacionados con morbilidad posquirúrgica, el estudio multivariante únicamente reconoció la edad y el NFR: la edad, ASA, inmunodepresión y PSS de mayor riesgo de mortalidad fueron similares a otras series3,4,35, y el único factor que afectó a las reintervenciones fue la técnica empleada, con elevada tasa de abscesos intraabdominales y el 45% de las reintervenciones tras LPL, lo cual debe hacer que nos planteemos aquilatar las indicaciones concretas de esta técnica.
El riesgo de morbimortalidad ha hecho reflexionar sobre opciones conservadoras y así, Sallinen et al.36 abogan por tratamiento no operatorio en pacientes con pequeña cantidad de aire ectópico sin signos clínicos de peritonitis, en la línea de los cambios hacia estrategias menos agresivas16,19, dadas las tasas de complicaciones posquirúrgicas y de reintervenciones. Sin embargo, hay que reservar para casos muy seleccionados esta actitud terapéutica3.
Hubo dehiscencia anastomótica en el 13,7% de los pacientes con RAP; las de mayor riesgo fueron las anastomosis manuales, posiblemente asociadas a resecciones menores. Hay que recordar que debe extirparse todo el colon sigmoide, con el margen distal de resección a nivel del promontorio sacro y anastomosis al recto superior, tanto por garantizar menores recurrencias como para reducir las dehiscencias anastomóticas al contar con un muñón rectal vascularizado adecuadamente3,18,37,38.
La estancia postoperatoria fue prolongada en nuestra serie, con variación importante entre hospitales, lo que traduce tanto diferencias en el case-mix como en el manejo perioperatorio de los pacientes. Aunque con los sesgos inherentes al estudio, es también notorio que la recidiva de la diverticulitis fuese superior en los no resecados, y en aquellos con resección limitada o con anastomosis al sigma. Concretamente, tras LPL, el 41% presentó recurrencia frente a menos del 2% cuando se efectuó una resección.
La resección vía laparoscópica se ha mostrado segura para tratar a los pacientes intervenidos mediante colectomía electiva por diverticulitis3,38, pero la literatura apoya también este acceso a la DAC y, dadas las dificultades técnicas, la asistencia manual (hand port) puede ser de utilidad en algunos casos39. Sin embargo, solo el 4,9% de nuestros pacientes se intervinieron a través de acceso laparoscópico: 10 a los que se efectuó LPL, 5 PHT y 4 RAP. El seguimiento de series aleatorizadas de resección por DAC refleja resultados comparables en calidad de vida gastrointestinal y recurrencia de la diverticulitis40, si bien la resección laparoscópica es técnicamente difícil y requiere entrenamiento, experiencia y selección de los casos idóneos3.
En conclusión, el estudio, que presenta las debilidades de ser retrospectivo —lo cual le resta homogeneidad— y de incluir datos no muy recientes, tiene, por el contrario, la fortaleza de recoger la casuística de 10 hospitales con una muestra de 385 pacientes intervenidos. Así, en nuestro entorno, los pacientes con DAC requieren cirugía urgente generalmente por un cuadro peritonítico y son operados mediante abordaje laparotómico, con una peritonitis purulenta como el hallazgo más frecuente. La técnica más habitual es el PHT, con diferencias en la casuística y en la técnica empleada al comparar los distintos hospitales. La considerable morbimortalidad así como las estancias postoperatorias —aun sin tener en cuenta la presumible intervención de reconstrucción de la continuidad digestiva tras PHT— y la alta tasa de reintervenciones tras LPL, hacen necesario plantear estrategias como la RAP, protegida o no con un estoma, que no ha mostrado incremento de incidencias postoperatorias y puede resolver el problema de forma definitiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Marta Aguado, Javier Aguiló, Zutoia Balciscueta, Sylvia Barros, Juan Carlos Bernal, Miriam Cantos, Javier Espinosa, Matteo Frasson, Rafael García-Calvo, Eduardo García-Granero, Lucas García-Mayor, Juan Hernandis, Francisco Landete, Félix Lluís, David Martínez-Ramos, Emilio Meroño, Isabel Rivadulla, Rodolfo Rodríguez, María Dolores Ruiz, José Vicente Roig, Vicente Roselló, Antonio Salvador-Martínez, Natalia Uribe, Celia Villodre.