La cirugía bariátrica ha demostrado ser muy eficaz en el control de la obesidad y el síndrome metabólico. Sus resultados no solo se expresan en términos de pérdida de peso, sino también en la resolución de comorbilidades, mejoría de la calidad de vida y de las complicaciones derivadas. Los diferentes parámetros utilizados para medir estos resultados requieren de una uniformidad y de unos patrones de referencia. Por ello, es fundamental establecer cuáles son los indicadores y los criterios de calidad que definen las «buenas prácticas» en cirugía bariátrica. En este sentido, la Sección de Obesidad de la Asociación Española de Cirujanos (AEC), en colaboración con la Sociedad Española de Cirugía de la Obesidad (SECO), se plantea como objetivo identificar los puntos clave que definen la calidad en este tipo de cirugía. Para ello se describen los principales indicadores basados en la literatura publicada, así como los criterios de remisión de las principales comorbilidades según las evidencias encontradas y sus grados de recomendación.
Bariatric surgery has proven to be highly effective in controlling obesity and metabolic syndrome; the results of this surgery are not only expressed in terms of weight loss, but also in terms of resolution of comorbidities, improved quality of life and complications. The different parameters used to measure these outcomes require uniformity and reference patterns. Therefore, it is essential to identify those indicators and quality criteria that are helpful in defining the «best practice» principles in bariatric surgery. In this regard, the Section of Obesity of the Spanish Association of Surgeons, in collaboration with the Spanish Society for Bariatric Surgery (SECO), present as an objective to identify the key points that define «quality» in this type of surgery. We describe the main indicators based on the published literature as well as the criteria for referral of the main comorbidities according to the evidence found and grades of recommendation.
La cirugía bariátrica ha demostrado su eficacia para el control de la obesidad mórbida y del síndrome metabólico, con una superioridad clara respecto a los tratamientos médicos1,2. Es imprescindible establecer cuáles son los criterios de calidad que definen la «buena práctica» en cirugía bariátrica para poder contrastar los resultados y saber si estamos ofreciendo un tratamiento quirúrgico eficaz. Teniendo en cuenta que la pérdida del seguimiento de los pacientes es el principal factor limitante en la evaluación de resultados, debe existir un seguimiento mínimo del 60% al menos durante 5 años según el Registro Internacional de Cirugía Bariátrica y el Comité de Estándares3. La Sección de Obesidad de la Asociación Española de Cirujanos (AEC) en colaboración con la Sociedad Española de Cirugía de la Obesidad (SECO) se ha propuesto identificar los puntos clave que definen la calidad de la cirugía bariátrica.
El objetivo de este artículo es describir los indicadores de calidad actuales, a partir de la literatura publicada y como dintel mínimo requerido en la práctica clínica, así como los criterios de remisión de las principales comorbilidades.
MétodosBúsquedaSe realizó una búsqueda bibliográfica en grupos de 2miembros de la Sección de Obesidad Mórbida de la AEC y en 3bases de datos bibliográficas (Pubmed, Scopus y Web of Science) con los términos «bariatric surgery and weight loss results/excess weight loss», «bariatric surgery and comorbidities/diabetes mellitus/ cholesterol/ dyslipidaemia/ obstructive apnea/hypertension», «bariatric surgery and morbidity/complications», «bariatric surgery and mortality», «bariatric surgery and revisional surgery», «bariatric surgery and standards» y «bariatric surgery and quality of life». Se consideraron artículos en inglés y castellano publicados entre 2005 y 2015. Los artículos fueron clasificados por áreas temáticas y revisados por los miembros de la sección, los cuales decidieron inicialmente su inclusión o exclusión según la información que respondía a las preguntas clave planteadas. Posteriormente, 2miembros supervisores valoraron los artículos incluidos y confirmaron su inclusión/exclusión. Se excluyeron los artículos que no aportaban datos numéricos concretos ni casos clínicos, y se aceptaron estudios de clase 2++ como nivel de evidencia mínimo (estudios de cohortes o de casos y controles bien realizados con bajo riesgo de sesgo según la escala del Scottish Intercollegiate Guidelines Network4 [SIGN]). A continuación se definieron los estándares de calidad con base en las evidencias encontradas, así como su nivel y el grado de recomendación.
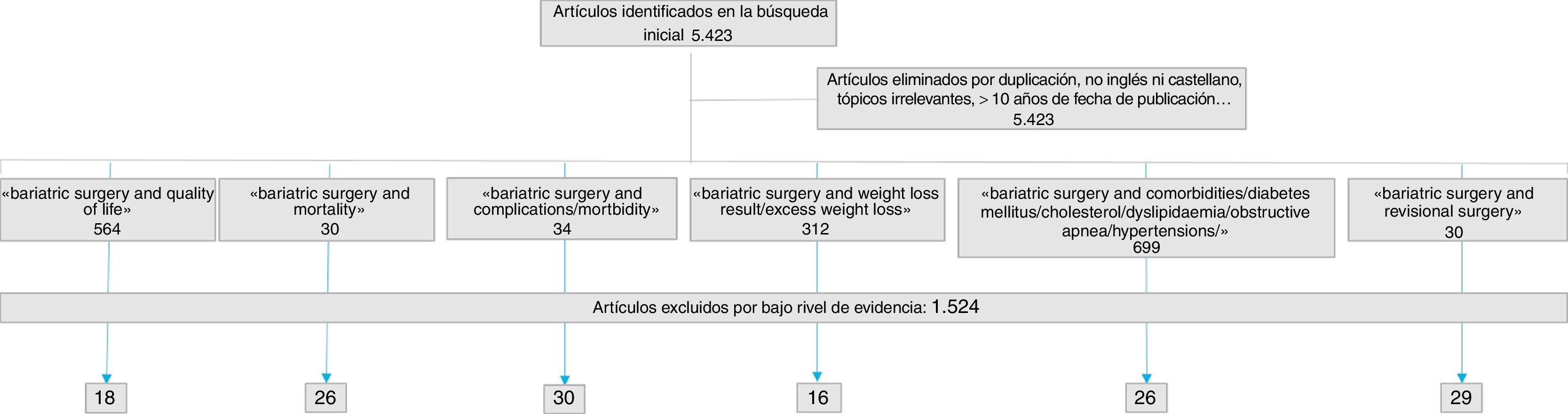
SelecciónSe identificaron inicialmente 5.423 referencias. Se seleccionaron 312 artículos relacionados con el peso, 699 artículos con las comorbilidades, 564 con la calidad de vida, 30 con la cirugía de revisión, 30 con la mortalidad y 34 con las complicaciones postoperatorias. La selección final de artículos y su distribución se muestran en la figura 1. Las cifras que se proporcionan en los estándares o indicadores son las mismas que las encontradas durante el proceso de revisión.
ResultadosEn la tabla 1 se resumen los principales indicadores de calidad, objetivos y su grado de recomendación. En el caso de las comorbilidades, los indicadores son sustituidos por los criterios de remisión. La tabla 2 recoge el resumen de las recomendaciones.
Principales indicadores con sus objetivos y recomendaciones
| Indicadores | Objetivos | Nivel de evidencia y grado de recomendación | |
|---|---|---|---|
| Peso | • PSP: Porcentaje de sobrepeso perdido: (peso inicial – peso final)/ (peso inicial – peso ideal) • Porcentaje del exceso del IMC perdido. %EIMCP = (IMC inicial – IMC actual / IMC inicial–25) × 100. • IMC esperado = 0,33IMC inicial + 14 Para la consulta diaria y para dar respuesta aproximada a los pacientes • Porcentaje del exceso del IMC perdido esperado: [IMC inicial – IMC final/IMC inicial – (0,33IMC inicial + 14)]×100 A nivel clínico individual y para comparar series • Uso del porcentaje de peso total perdido. %PTP: (peso inicial – peso actual/peso inicial)×100 Para comparación y publicación de resultados | > 50% al primer año de la cirugía > 50% al primer año de la cirugía > 100% a los 2años de la cirugía ≥40% a los 2años en BPGY Usar tablas de percentiles | 1-/A/√1 |
| DM2a | • Remisión completa: HbA1c ≤ 6% y normalización de la glucemia (100 mg/dl) en ayunas sin medicación durante un año como mínimo • Remisión parcial: HbA1c 6-6,5% y glucemia en ayunas entre 100 y 125 mg/dl) sin medicación • Remisión prolongada: al menos 5 años de remisión. Mejoría HbA1c < 7%, con tratamiento farmacológico Criterios ADA (American Diabetes Association) | >60% con remisión completa (1-5 años de la cirugía) | 1-/A/√1 |
| HTAa | • Remisión completa: TA<120/80 sin medicación • Remisión parcial: TA sistólica 120-140mmHg y TA diastólica 80-89mmHg sin medicación | Resolución de la HTA, con reducción del tratamiento coadyuvante o sin él, en todos los procedimientos quirúrgicos a los 2 años de seguimiento en un porcentaje mínimo de un 70% | 2++/B/√1 |
| Dislipidemiaa | • cLDL < 100 mg/dl, TG < 150 mg/dl, colesterol total < 200 mg/dl, cHDL > 60 mg/dl | Resolución de la hipercolesterolemia y la hipertrigliceridemia, con reducción del tratamiento coadyuvante o sin él, en todos los procedimientos quirúrgicos a los 2 años de seguimiento en un porcentaje mínimo de un 70% | 2++/B/√1 |
| Síndrome de apnea obstructiva del sueño | • Número de episodios apneicos-hipoapneicos/hora, registrados mediante polisomnografía | Polisomnografía normal (<5 eventos/h) al menos en un 25% de los pacientes con SAOS a partir del año de la cirugía | 2++/B/√1 |
| Síndrome metabólicob | • Obesidad visceral con aumento de la circunferencia de cintura ≥ 102cm en ♂ y ≥ 88cm en ♀ • Triglicéridos elevados (> 150 mg/dl) • Colesterol HDL < 40 mg/dl en ♂ y <50 mg/dl en ♀ • Presión arterial elevada sistólica > 130 o diastólica > 85mmHg. • Glucemia en ayunas > 100 mg/dl | Metas mínimas de buen grado de control metabólico (con/sin tratamiento activo coadyuvante): HbA1c < 7%, cLDL < 100 mg/dL, triglicéridos < 150 mg/dL, cHDL > 40 mg/dL ♂o > 50 mg/dL ♀ y TA < 140/80mmHg | Consenso SECO/SEEDO 2012 4/D/√1 |
| Mortalidad | • Número de fallecimiento/número de pacientes intervenidos×100 | <0,5% | 2-/B/√1 |
| Morbilidad | • Complicaciones postoperatorias: (pacientes con complicaciones postoperatorias/pacientes intervenidos)×100 | General < 10% • Límite recomendable para TEP: < 1,5% • Límite recomendable para fístulas < 4% • Límite recomendable para hernias internas < 3% Específica por técnica: ver tablas 3 y 4 | 1-/A/√1 |
| Calidad de vida | • Test de BAROS completo (Bariatric Analysis and Reporting Outcome System), Moorehead-Ardelt Quality of Life instrument (MAQOL) | Puntuación > 6 (1-5 años de la cirugía) | 2-/B/√1 |
| Cirugía de revisión | • Porcentaje de reintervenciones diferidas debidas a una falta de pérdida de sobrepeso o de calidad de vida | < 2% anual | 2-/B/√1 |
Resumen de las recomendaciones de la Sección de Obesidad Mórbida de la AEC y la SECO
| - Es recomendable que los cirujanos que se dediquen a la cirugía bariátrica realicen los programas específicos de formación apoyados y supervisados por la Asociación Española de Cirujanos (AEC) y la Sociedad Española de Cirugía de la Obesidad (SECO) u otro tipo de organismos debidamente acreditados |
| - Es necesario un enfoque multidisciplinario del paciente: cirujano, anestesiólogo, endocrinólogo, nutricionista, psicólogo... |
| - Se recomienda el uso de escalas predictivas de riesgo de mortalidad específicas antes de la cirugía |
| - Es necesario incorporar el uso sistemático del porcentaje del peso total perdido (%TWL) para expresar los resultados de la pérdida de peso, además de los indicadores clásicos. Incluir sus valores en las tablas de percentiles para los valores de referencia. Puede ser de utilidad el uso del IMC esperable en la consulta clínica diaria |
| - Se recomienda el uso de los criterios oficiales de resolución (ADA, ASBMS y Consenso SECO-SEEDO 2012) para expresar y publicar resultados respecto a las comorbilidades |
| - Se recomienda el registro y análisis sistemático de la morbilidad precoz, tardía y de la mortalidad |
| - Se recomienda el uso de test específicos que analicen la calidad de vida antes y después de la cirugía bariátrica |
| - Es necesario el seguimiento exhaustivo y sistemático de todas las comorbilidades, así como un control polisomnográfico después de la cirugía en pacientes afectos, además, de SAOS |
| - La cirugía bariátrica de revisión debe ser realizada por cirujanos bariátricos con experiencia y en centros e instituciones expertas o acreditadas (recomendable un número mínimo de 50 casos al año según criterios de la European Accreditation Council for Bariatric Surgery) |
La completa normalización del peso no es una condición indispensable para obtener una mejora significativa de la salud5. Algunos autores defienden que es más importante la mejora de las comorbilidades y la repercusión social, que la cuantificación del peso perdido6. Desde 1981 se propuso utilizar el porcentaje de sobrepeso perdido (%PSP) para cuantificar el resultado de la cirugía bariátrica, poniendo el límite del éxito en el 50% del PSP7,8. En 1997, Baltasar et al.9 propusieron considerar también el índice de masa corporal (IMC) asociado al %PSP para clasificar los resultados. En 2004 se introdujo el concepto de porcentaje de exceso de IMC perdido (PEIMCP)10. En 2013, el metaanálisis de Courcoulas et al.11 analizó los resultados de 161.756 pacientes, en términos de %PSP, hasta los 5 años de seguimiento, con un IMC inicial medio de 45,5kg/m2. Al primer año de la cirugía, el %PSP estimado para el bypass gastroyeyunal (BPGY) oscila entre un 63 y un 72% y entre el 51 y el 69% para la gastrectomía vertical (GV). A los 2años, un PSP 74-80% para el BPGY vs. UN 42-50% para la GV. Al cuarto y quinto años, la variabilidad en el BPGY se dispara (59-93 y 44-85%, respectivamente), sin datos suficientes para la GV. El registro español de GV12 obtiene al año de la cirugía un PEIMCP de un 78% para un IMC < 40kg/m2, de un 75% para IMC entre 40 y 49kg/m2, de un 55% para IMC entre 50 y 59kg/m2 y de un 67% para IMC > 60kg/m2. A los 3años de la cirugía se muestran resultados de PEIMCP cercanos al 100% en IMC < 40kg/m2 y para IMC > 40kg/m2 el rango oscila entre un 60 y un 78%. Respecto a la derivación biliopancreática (DBP) con cruce duodenal (DS), los resultados de Nelson et al.13 describen un %PSP de un 79% a los 2años de la cirugía en pacientes con IMC > 50kg/m2, comparable a los resultados publicados por Buchwald et al.14. También, la GV con bypass duodenoileal (SADIs) ofrece un %PSP de un 94,7% al año de la cirugía15. Pero existen otras maneras de expresar la pérdida de peso. En este sentido, el Bariatric Outcomes Longitudinal Database (BOLD)16 en 2012 postuló que el valor más homogéneo y con menor variabilidad es el porcentaje de peso total perdido en kg (PPTP) o el porcentaje de total weight loss (%TWL) = (peso inicial-peso actual/peso inicial)×10017. Varios trabajos ya publican así sus resultados, con valores de un −44% para la DBP-DS y de un −34% para el BPGY a los 2años de seguimiento18, o de un −33,5% a los 5 años19. El %TWL permite comparar series evitando el sesgo del IMC inicial y puede representarse gráficamente en tablas de percentiles realizadas a partir de las diferentes series de datos. Es difícil que un superobeso (IMC > 50kg/m2) alcance un IMC de 25kg/m2 tras la cirugía: parece razonable establecer un límite más realista para racionalizar sus expectativas. En este sentido, Baltasar et al.20 proponen el término de IMC esperable (IMCesp= 0,33IMCinicial+14), calculado mediante regresión lineal, anulando el punto de corte de 25 como constante. La fórmula aplicada al PEIMCP es: [IMCinicial-IMCfinal/IMCinicial – (0,33IMCinicial+14)]×100. El resultado se clasifica como excelente si ≥100% y mejorable si ≤100%. Posteriormente, Baltasar ajusta las constantes para cada técnica quirúrgica. Así, resulta una fórmula distinta para cada una de ellas y permite comparar series y técnicas quirúrgicas de forma más exacta21.
Estándares de calidad de la resolución de comorbilidades: la resolución de las comorbilidades debe estar recogida, analizada y comunicada según los criterios de resolución oficiales de las sociedades científicas implicadasLa cirugía bariátrica resuelve significativamente las comorbilidades relacionadas con la obesidad y mejora a largo plazo la morbimortalidad22,23. Ya en 2004, Buchwald et al.24 describieron la resolución de comorbilidades según las diferentes técnicas en su metaanálisis ampliamente difundido en la comunidad científica.
Diabetes mellitus de tipo 2De acuerdo con una revisión publicada por la Cochrane Library25, el porcentaje de remisión de la diabetes mellitus de tipo 2 (DM2) depende del tipo de cirugía. Para la DBP se sitúa en el 95% y en un 57% para la banda gástrica (BG), sin que haya todavía suficientes datos a largo plazo para la GV. En 2009, Buchwald14 se centró en la resolución de la DM2 con una remisión global del 78%, que se mantiene estable a los 2años en un 62%. La mayor resolución se conseguía con la DBP (95,1%), seguida del BPGY (80,3%), la gastroplastia vertical en banda (79,7%) y la BG (56,7%). Un reciente metaanálisis publica unas tasas de remisión del 60,8% para la GV26. Con la técnica SADIs se describen resoluciones completas en el 75% de los pacientes a los 3 años de la cirugía en pacientes que reciben antidiabéticos orales, y del 38,4% en pacientes en tratamiento con insulina27. Las tasas globales de remisión comunicadas más recientemente son más bajas que las descritas previamente en la literatura: se estima que un 60% de los pacientes alcanzan la remisión durante los primeros 5 años tras la cirugía, tal y como apuntan varios ensayos clínicos y metaanálisis28–33. Existen diferencias dependiendo de los criterios utilizados para considerar la diabetes resuelta o no. Debido a esta variabilidad, que ha sido evidenciada recientemente34, se aconseja utilizar de manera exclusiva los criterios de la American Diabetes Association (ADA) (tabla 1)35.
Hipertensión arterial y riesgo cardiovascularUna buena escala para medir el riesgo cardiovascular en el mundo occidental es el Framingham risk score36, aunque en España existen otras escalas adaptadas a nuestra población, como la REGICOR, que parte de un riesgo cardiovascular más bajo que el del mundo anglosajón37. El riesgo estimado de enfermedad coronaria después de un BPGY disminuye de un 11 a un 5% en hombres y de un 6 a un 3% en mujeres tanto para la población diabética como para la no diabética38,39. Después de un BPGY, la resolución o mejoría de la hipertensión arterial (HTA) se produce en un rango que varía respectivamente entre un 61 y un 78,5% de los pacientes a los 2años de seguimiento, incluso en pacientes ≥ 55 años40. En el estudio SOS41, durante los primeros años de seguimiento existe, sin embargo, un rebote de esta enfermedad, con un 13,2% de los pacientes que recaen en cifras de HTA. Posteriormente, el mismo estudio comprueba que las técnicas restrictivas ejercen un efecto pasajero sobre la HTA, mientras que el BPGY se asocia a disminuciones más sostenidas e incluso a un incremento de la diuresis diaria42. Existen estudios que señalan que el déficit de vitamina D después de la cirugía desempeña un papel importante en el desarrollo de la HTA: los pacientes con suplementación vitamínica resuelven la HTA de forma más eficaz que los no suplementados43,44. Los criterios de remisión vienen definidos según los estándares publicados recientemente por Brethauer et al.45 de la American Society for Bariatric and Metabolic Surgery (ASBMS) (tabla 1).
DislipidemiaVarios estudios analizan la mejoría de la dislipidemia después de la cirugía46. Al año de un BPGY, la medicación antidiabética, antihipertensiva e hipolipidemiante diminuye en un 76, 51 y 59%, respectivamente47. Estos resultados contrastan con los datos iniciales del estudio SOS41, en el que no se encontraron diferencias en los niveles de colesterol total entre los pacientes control y los pacientes intervenidos después de 10 años (a excepción del grupo intervenido con BPGY). Posteriormente, se ha comprobado que la dislipidemia se normaliza y se mantiene estable a los 10 años en el 69,7% de los pacientes intervenidos respecto al 22% de los no intervenidos48. En el metaanálisis de Buchwald24, el perfil lipídico mejora de forma significativa en todos los procedimientos quirúrgicos a los 2 años de seguimiento en un porcentaje mínimo de un 70%, con mejorías máximas para el DBP-DS (99,1%) y el BPGY (96,9%). Los criterios de resolución son los definidos por Brethauer et al.45 (tabla 1).
Síndrome metabólicoEl síndrome metabólico engloba un conjunto de factores de riesgo que relacionan la enfermedad cardiovascular y la diabetes. Para su definición se utilizan los criterios publicados por Alberti et al.49 (1: obesidad visceral con aumento de la circunferencia de cintura ≥ 102cm en ♂ y ≥ 88cm en ♀; 2: triglicéridos elevados [>150mg/dl]; 3: colesterol HDL < 40mg/dl en ♂ y < 50mg/dl en ♀; 4: presión arterial elevada sistólica > 130 o diastólica >85mmHg; 5: glucemia en ayunas > 100mg/dl). La meta mínima de control después de la cirugía viene definida por los criterios aprobados en el Consenso SECO/SEEDO en 201250 (tabla 1).
Síndrome de apnea obstructiva del sueñoVarios estudios demuestran que la pérdida de peso debida a la cirugía bariátrica mejora el síndrome de apnea obstructiva del sueño (SAOS), incluso a largo plazo51. Se considera su diagnóstico con ≥5 apneas o hipoapneas/hora52. Los rangos de prevalencia en individuos obesos varían del 55 al 100% en función de si se realiza valoración de todos los pacientes o exclusivamente de aquellos con síntomas24. Buchwald et al.24 demuestran una mejora significativa en las series analizadas del 85,7%. Sin embargo, Greenburg et al.53 determinan que la enfermedad residual sigue existiendo en la mayoría de los pacientes más añosos y más obesos y tan solo el 23% cumplen criterios de resolución. La falta de «somnolencia diurna» no indica la resolución del SAOS54. Por lo tanto, las pruebas de diagnóstico mediante polisomnografía deben llevarse a cabo cuando se alcanza un peso estable (a partir del año como mínimo) de forma rutinaria.
Estándares de mortalidad en cirugía bariátrica: en la actualidad la mortalidad debe ser inferior al 0,5%En 1991 la tasa de mortalidad aceptada oscilaba entre un 0,5 y un 1,5%55. Actualmente está cercana al 0% gracias al abordaje laparoscópico, los programas de formación y el manejo multidisciplinar de los pacientes56. Publicaciones recientes del Longitudinal Assessment of Bariatric Surgery consortium data o el Bariatric Outcome Longitudinal Database (BOLD), entre otros, confirman que la tasa de mortalidad está por debajo del 0,5%57–63. Es una tasa aceptable, teniendo en cuenta que la mortalidad a largo plazo en pacientes obesos mórbidos no operados es superior al 6%64. En el año 2011 se analizó específicamente la mortalidad por esta causa y se encontró una mortalidad global del 0,3% en los primeros 30 días65. La causa más frecuente de fallecimiento fue el fallo multiorgánico por sepsis (33%), seguido por el de origen cardiaco (28%) y la embolia pulmonar (17%). La sepsis abdominal, asociada sobre todo a la fuga anastomótica, sigue siendo un reto en este tipo de pacientes66,67. La mortalidad es variable, dependiendo de la experiencia del grupo quirúrgico, lo cual refuerza la importancia de la curva de aprendizaje68. La mortalidad durante la curva de aprendizaje de los programas de formación es del 0,57% para cirujanos sin entrenamiento específico y del 0% en los que sí lo tienen, con una reducción de las complicaciones del 18 al 7,7% en los cirujanos bien formados69. Se recoge una mortalidad del 5% en grupos que realizan menos de 10procedimientos/año y del 0,2% en grupos con grandes volúmenes de pacientes70,71. La mortalidad también se ve influida por el abordaje empleado y el sexo (0,30% cirugía abierta vs. 0,07% cirugía laparoscópica; 4,74% ♂ vs. 0,13% ♀)72. La técnica quirúrgica en sí misma es un factor de riesgo independiente: se describe una mortalidad para la BG inferior al 0,3%73 y para el BPGY del 0,4%74–76. De igual modo, el registro español de la GV12 la sitúa en el 0,36% en consonancia con otros grupos de gran experiencia.
Existen varias escalas predictoras del riesgo de mortalidad, las cuales estratifican a los pacientes en subgrupos, con las que se observa un incremento de la tasa de complicaciones, reintervenciones y de mortalidad cuando determinados factores están presentes77. Son el Obesity Surgery Mortality Risk Score (que considera el IMC > 50 kg/m2, edad > 45 años, sexo masculino, HTA y riesgo de tromboembolia pulmonar [TEP])78, el Longitudinal Assessment of Bariatric Surgery (LABS) Consortium Study79 (que considera la obesidad extrema, historia de tromboembolia, presencia de SAOS e incapacidad de caminar 60 m) y el Metabolic Acuity Score que añade la DM y factores psicológicos a los anteriores80.
Estándares de morbilidad en cirugía bariátrica: el registro y análisis de las complicaciones es obligatorio en los centros en los cuales se realiza este tipo de cirugíaHaciendo referencia al momento postoperatorio, hablamos de morbilidad precoz (<30 días: TEP, fugas y hemorragias) o tardía (>30 días: úlceras marginales, estenosis y hernias internas). Actualmente, la tasa global de morbilidad precoz se sitúa por debajo del 7% en los centros con mayor experiencia81,82. La tasa de complicaciones se encuentra influida por la técnica quirúrgica, con un porcentaje de complicaciones mayores superior para el BPGY (2,5-3,6%) frente a la GV (2,2-2,4%) y, en último lugar, frente a la BG (0,9-1%)82. La morbilidad también se relaciona con el volumen de procedimientos realizados, tanto a nivel global de centro hospitalario como a nivel específico de cirujano. Se ha determinado como un factor de riesgo la realización de un menor volumen de procedimientos (morbilidad en centros con <150 pacientes: 4,1%; entre 150 y 300 pacientes: 2,7%; >300 pacientes: 2,3%), sin diferencias por el hecho de que el centro se encuentre o no acreditado como centro de excelencia en cirugía bariátrica82,83.
Como complicaciones generales, la incidencia de enfermedad tromboembólica varía ampliamente: oscila de un 084 a un 3,5%85. Se han publicado incidencias del 0,9% de TEP, 1,3% de trombosis venosa profunda y un 2,2% de dicha trombosis asociada a TEP86. Respecto a la herida quirúrgica, el abordaje abierto asocia un riesgo de seromas de hasta un 40%, con un riesgo de hernia incisional del 32%87,88. El porcentaje de hernias incisionales a través de orificios de trocar se sitúa en un 0,57%89. Respecto al riesgo de desarrollo de hernia interna, existe consenso en su reducción si se confecciona el bypass gástrico antecólico, y se recomienda el cierre de todos los defectos creados con sutura irreabsorbible90–92. Su diagnóstico tardío puede condicionar la perforación del asa herniada y, secundariamente, la muerte del paciente93. La incidencia de hernia interna publicada en el BPGY laparoscópico ha alcanzado el 10%94. Actualmente, la incidencia se ha reducido a un 0,2%, probablemente influida por la no sección del meso del asa alimentaria95–97. La morbilidad específica según la técnica quirúrgica se resume en las tablas 3 y 4. El riesgo global de hemorragia tras BPGY oscila entre un 0,94 y un 4,4%, que suele ocurrir en la mayoría de los casos en el periodo postoperatorio inmediato, como consecuencia de la hemorragia en las anastomosis, líneas de grapas, sección de mesos o lesiones viscerales98,99.
Morbilidad específica de la banda gástrica y la gastrectomía vertical
| Banda gástrica147,148 | Gastrectomía vertical |
|---|---|
| • Dilataciones del reservorio 6,4% • Problemas con los orificios de los trocares 5,9% • Erosión 0,8% • Retirada de la banda 2,2% • Reintervenciones (cualquier causa) 11% si IMC inicial > 40 kg/m2 • Reintervenciones (cualquier causa) 2,6% si IMC inicial 35-39 kg/m2 | • Estenosis: 0,1-3,9% (incisura angularis)149–151 • Fugas (++ángulo de His): 0-3,9%152,153 • Hemorragia línea de grapas: 0-9%154,155 • Reflujo gastroesofágico: 4,7-39%156 |
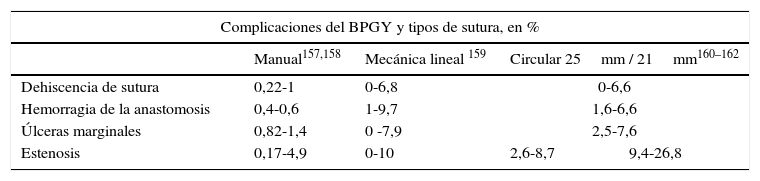
Morbilidad específica del bypass gastroyeyunal en Y de Roux según el tipo de sutura empleada
| Complicaciones del BPGY y tipos de sutura, en % | ||||
|---|---|---|---|---|
| Manual157,158 | Mecánica lineal 159 | Circular 25mm / 21mm160–162 | ||
| Dehiscencia de sutura | 0,22-1 | 0-6,8 | 0-6,6 | |
| Hemorragia de la anastomosis | 0,4-0,6 | 1-9,7 | 1,6-6,6 | |
| Úlceras marginales | 0,82-1,4 | 0 -7,9 | 2,5-7,6 | |
| Estenosis | 0,17-4,9 | 0-10 | 2,6-8,7 | 9,4-26,8 |
BPGY: bypass gastroyeyunal en Y de Roux.
La cirugía bariátrica mejora la calidad de vida, con cambios mantenidos a largo plazo100,101. Para su evaluación existen varios instrumentos102. Los más utilizados son el Bariatric Analysis and Reporting Outcome System (BAROS)103, Moorehead-Ardelt Quality Of Life instrument (MAQOL)104, el Impacto del peso sobre la calidad de vida (IWQOL)105, el 36-Short Form Health Survey (SF-36)106 y el Nottingham Health Profile (NHP)105. Varios estudios comprueban una mejoría muy significativa en la calidad de vida después de un BPGY, tanto al año como a los 5 años de la cirugía y en diferentes categorías de IMC107–109. Los pacientes con un IMC previo a la cirugía más bajo se correlacionan con unas mejores puntuaciones en el BAROS y en MAQOL-II110. Con respecto al seguimiento a largo plazo (>6 años), Himpens et al.111,112 demuestran niveles de satisfacción altos después de un BPGY y una GV (a pesar de tener esta última una incidencia de un 23% de reflujo gastroesofágico). Otros trabajos demuestran que, después de una GV, un PSP >50% se correlaciona con mejores puntuaciones en las áreas relativas a la función física y percepción general de salud dentro del test SF-36113. Existen estudios comparativos sobre la calidad de vida entre GV vs. BPGY, y entre la DBP vs. BG, con resultados similares114,115. Se han encontrado diferencias entre la técnica de GV vs. BG (a favor de la GV) en el test telefónico Bariatric Quality of Life (BQL)116. A menudo no se correlacionan los resultados entre lo médicamente deseable y las expectativas del paciente: en el caso del peso, existen publicaciones que sitúan el peso ideal deseado por los pacientes en un peso equivalente a un PSP del 90%, lo que obliga a pensar que sus expectativas son un factor importante a tener en cuenta en la puntuación global de estos tests117.
Indicadores de calidad en cirugía de revisión bariátrica: la cirugía de revisión debe practicarse en centros con una amplia experiencia en cirugía bariátricaLa cirugía de revisión se realiza cuando una primera técnica de cirugía bariátrica ha fracasado o ha causado secuelas no tolerables. A lo largo de los años, se han definido varios criterios de fracaso con base en el peso final, pero también podemos afirmar que existe un fracaso cuando no se consiguen controlar las comorbilidades relacionadas con la mortalidad precoz10. Las causas del fracaso se relacionan con la técnica quirúrgica seleccionada, el equipo multidisciplinar bariátrico, la correcta selección y seguimiento del paciente y su incapacidad para mantener una conducta alimentaria apropiada118–123. Los estándares publicados por Baltasar et al.9 contemplan un porcentaje inferior al 2% anual, sin embargo, conforme aumenta el volumen de cirugías primarias, aumenta dicho porcentaje. Se han publicado series con reintervenciones que oscilan entre un 5 y un 56%124–126. La cirugía de revisión es técnicamente compleja y está asociada, generalmente, a un mayor riesgo que los procedimientos primarios127,128. No parece haber ningún abordaje quirúrgico estandarizado para ella129. Aunque tradicionalmente se realizaba por laparotomía, hoy en día hay una tendencia creciente a usar el abordaje laparoscópico130,131. La revisión laparoscópica puede llevarse a cabo de manera segura si se realiza por cirujanos bariátricos experimentados en centros de alto volumen quirúrgico bariátrico y laparoscópico129,132–135. Los procedimientos restrictivos más frecuentes que requieren cirugía de revisión por una pérdida insuficiente de peso son la gastroplastia vertical con banda con tasas del 25-54% y la BG, con tasas entre el 40 y el 50%, que en su gran mayoría son convertidos a BPGY136,137. A pesar del éxito del BPGY primario, entre un 10 y un 20% de los pacientes presentan una falta de pérdida de peso adecuada o desarrollan una reganancia de peso138–140. Las últimas series publicadas describen unas tasas de reintervención entre el 8,1 y el 9% a los 5 y 13 años, respectivamente141,142. En la GV, los resultados publicados son con base en complicaciones como el reflujo gastroesofágico o las estenosis, y se describen tasas entre el 2 y el 10%143. El paso de GV a BPD-DS no se considera cirugía de revisión en las publicaciones encontradas144. Además, en caso de pérdida insuficiente de peso, muchos autores realizan el segundo tiempo con el BPGY y no su segundo tiempo teórico (DS), ya que presenta más complicaciones que el BPGY145. La cirugía de revisión puede presentar complicaciones de hasta el 14% y una mortalidad del 0,86%146. Se requieren seguimientos superiores a los 5 años para evaluar su eficacia.
LimitacionesEste trabajo es fruto de la colaboración conjunta entre diferentes miembros de las sociedades científicas representadas. El principal objetivo ha sido identificar cuáles son los indicadores objetivos y los criterios mínimos de calidad en el contexto global de la cirugía bariátrica. Nuestro propósito no ha sido realizar una comparación sistemática entre las diferentes técnicas quirúrgicas, por lo que no se pueden extrapolar con el suficiente análisis y rigor científico unas recomendaciones específicas para cada una de ellas. Sin duda, ello representa un futuro reto dentro del trabajo que desarrollamos desde las sociedades científicas españolas.
ConclusionesLos avances tecnológicos, la mejor formación de los equipos multidisciplinares y la simplificación de las técnicas quirúrgicas laparoscópicas han convertido a la cirugía bariátrica en una de las más seguras y eficaces; pero esta eficacia y seguridad debe estar contrastada a partir de unos requerimientos mínimos en los resultados. Las guías de práctica clínica existentes no siempre incluyen criterios estrictos, de ahí que el establecimiento de unos estándares de calidad y unas recomendaciones resulte muy útil: ello servirá de base para la mejora continua de la atención prestada por todos los profesionales dedicados al tratamiento de la obesidad mórbida. El encaje de los resultados dentro de un marco definido también beneficia sin duda al paciente: contar con herramientas objetivas en la práctica clínica diaria también nos ayudará a la racionalización de sus expectativas ante este tipo de cirugía.
Autoría/colaboracionesDiseño, recogida de datos y redacción: Fátima Sabench Pereferrer, Eduardo Domínguez-Adame Lanuza, Ainitze Ibarzabal Olano, María Socas Macias y Víctor Valentí Azcárate.
Revisión de resultados: Amador García Ruiz de Gordejuela y Francisca García-Moreno Nisa, Jesús González, Fernández, Ramón Vilallonga Puy y Nuria Vilarrasa García.
Revisión crítica del manuscrito: Raquel Sánchez Santos y Fátima Sabench Pereferrer
Soporte institucional y revisión de resultados: Asociación Española de Cirujanos y Sociedad Española de Cirugía de la Obesidad (SECO).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.