La cirugía R0 con márgenes libres es el «gold-standard» en el tratamiento de los sarcomas de partes blandas, así como el mejor predictor de su recurrencia y de la supervivencia de estos pacientes. El objetivo del presente trabajo fue evaluar la evolución de los pacientes afectos de un SRP tratados mediante cirugía de resección «en bloque» frente a los tratados con enucleación en la primera cirugía.
MétodosUna serie de 56 pacientes adultos fueron divididos en 2 grupos según la resección quirúrgica. El grupo A mediante una cirugía de enucleación y el grupo B mediante una cirugía «en bloque». Se valoran la supervivencia global (SG) y el tiempo a la recurrencia (SLE), de acuerdo al tipo histológico y a la estrategia quirúrgica inicial.
ResultadosEl tiempo libre de enfermedad fue más prolongado tras una cirugía en bloque (p<0,05); no hubo diferencias con relación a la supervivencia global. Cuando comparamos el tipo histológico con una cirugía de enucleación versus una cirugía en bloque, la SLE y la SG fueron superiores en el liposarcoma. En el análisis multivariado, solo la presencia de márgenes libres y la histología liposarcoma se asociaron significativamente con una mejor supervivencia.
ConclusiónEl tratamiento de los pacientes con un sarcoma retroperitoneal debe ser claramente agresivo, requiriendo exéresis múltiviscerales. A partir de los resultados de SG y SLE, es importante que el tratamiento de estos pacientes se base en una primera cirugía lo más radical posible.
Today, free margin surgery is the gold-standard management for soft-tissue sarcoma patients and one of the most important predictors of recurrence and survival. To obtain optimal results, a multidisciplinary approach is necessary. The aim of this study was to evaluate the evolution of patients with RPS treated by «en bloc«surgical resection versus those treated with enucleation in the first surgery.
MethodsFifty-six adult patients were divided into 2 groups. Patients in Group A underwent enucleation surgery, and patients in Group B underwent en bloc surgery. The endpoints of the study were survival time and time to recurrence, according to histological type and first surgical strategy.
ResultsDisease-free survival was longer for en bloc surgery (P<0,05), but there was no difference in overall survival. When comparing the histology of patients who underwent enucleation surgery and en bloc resection surgery, the disease-free survival and overall survival rates were longer for liposarcoma. In the multivariate analysis, only free margins and histology of liposarcoma were significantly associated with a better survival.
ConclusionsThe surgical management of patients with retroperitoneal sarcoma must be very aggressive, often requiring multivisceral resection. Considering the disease-free survival and overall survival rates obtained, it is clear that it is critical to manage patients as early as possible by a radical en bloc surgery.
Los sarcomas de partes blandas son una entidad poco prevalente. Representan menos del 1% de los tumores en adultos y tan solo el 15% de los casos tienen una localización retroperitoneal (SRP)1. Ha sido descrita su asociación con factores de riesgo como son el antecedente de una irradiación previa intensa, condiciones genéticas propicias o la presencia de un linfedema crónico2. En la mayoría de los casos, su etiología aún es desconocida. Las metástasis asientan preferentemente en pulmón y en hígado, son raras en regiones linfáticas y la mayoría de las diseminaciones son por vía hematógena3.
En la actualidad, la cirugía radical R0 con márgenes libres es el tratamiento «gold-standard» de estos pacientes. La calidad de esta cirugía, según algunos autores, es el más importante predictor de la recurrencia y de la supervivencia4. Así mismo, existe una clara asociación entre el grado histológico y las recidivas5. Para conseguir unos resultados terapéuticos óptimos es necesario un manejo multidisciplinar, en el que participen cirujanos y especialistas en radiología, anatomía patológica, oncología y radioterapia6,7.
El objetivo del presente trabajo fue evaluar la evolución de los pacientes afectos de un SRP tratados mediante cirugía de resección «en bloque» frente a los tratados con enucleación en la primera cirugía.
MétodosSe revisa una serie consecutiva de 56 pacientes afectos de un SRP, tratados quirúrgicamente entre junio de 2000 y enero de 2010. Unos pacientes fueron tratados primariamente en nuestro centro y otros, procedentes de otras instituciones, fueron remitidos a nuestro centro para seguimiento, por presentar recurrencias o para completar adecuadamente el tratamiento quirúrgico. Todos los pacientes fueron valorados inicialmente por un comité multidisciplinario.
El protocolo de estudio incluyó la realización de una tomografía computarizada de 3 fases y la realización de biopsia percutánea si existían dudas diagnósticas.
Los pacientes fueron divididos en 2 grupos en función del tipo de la primera cirugía realizada. La selección de la técnica fue en función de las características locorregionales del tumor valoradas intraoperatoriamente en los casos operados primariamente en nuestro centro y a criterio de los cirujanos implicados en los casos operados en otros centros.
Todos los pacientes tenían criterios preoperatorios de resecabilidad (tumor que afecta o contacta con estructuras no vitales o sustituibles), independientemente de si recibieron o no un tratamiento neoadyuvante radio- o quimioterápico.
Las 2 estrategias quirúrgicas estudiadas fueron la enucleación (grupo A), consistente en la extirpación del tumor con su pseudocápsula sin resección de las estructuras en contacto con la misma (esta técnica se considera por definición una resección R1 al no haber margen de tejido sano en el análisis patológico), y la resección en bloque del tumor con las estructuras en contacto, independientemente de su infiltración (grupo B).
Se registraron todos los datos clínicos y anatomopatológicos desde la primera intervención si el paciente fue tratado inicialmente tanto en nuestro centro como en otra institución.
Las variables consideradas fueron la edad, el sexo, el tipo y grado histológico del SRP, la técnica quirúrgica utilizada (con especial atención a los órganos resecados con el tumor), tipo de resección (R0, R1, R2), informe patológico de los márgenes de resección, centro hospitalario donde se realizó el primer tratamiento quirúrgico, morbilidad de acuerdo con la escala Clavien-Dindo, supervivencia libre de enfermedad (SLE), supervivencia global (SG) y tratamientos adyuvantes8.
El tratamiento neoadyuvante fue indicado en los pacientes con SRP agresivos, especialmente no-liposarcoma (histiocitoma fibroso maligno, leiomiosarcoma, schwanoma maligno, fibrosarcoma y sarcoma de Ewing). La radioterapia intraoperatoria no está incluida en nuestro protocolo. En aquellos casos en los que la exéresis en bloque no fue posible debido a la proximidad o a la invasión de estructuras vitales (raíz del mesenterio, ambos riñones, columna…) o por un cirugía excesivamente agresiva no tolerada por el paciente, se indicó una enucleación lo más completa posible. De acuerdo con las indicaciones de las guías de la National Comprehensive Cancer Network (NCCN), los pacientes con tumores de gran tamaño y agresivos, como el histiocitoma fibroso maligno, el leiomiosarcoma, el schwanoma maligno, el fibrosarcoma y el sarcoma de Ewing extraesquelético fueron considerados para tratamiento adyuvante quimio- o radioterápico9.
Los datos fueron recogidos por un único investigador y analizados con SPSS v. 19.0. Las medianas fueron usadas para el análisis comparativo y las curvas de Kaplan-Meyer, para el análisis de la supervivencia. El intervalo de confianza se situó en el 95% y la significación estadística en una p<0,05.
Para el análisis uni- y multivariado de los factores de mal pronóstico se utilizó la regresión logística de Cox.
ResultadosTodos los pacientes incluidos en el presente estudio fueron valorados tras una cirugía de un SRP con intención curativa desde el año 2000, fecha a partir de la cual se incluyó la cirugía en bloque en nuestros protocolos terapéuticos quirúrgicos. El seguimiento de todos los pacientes incluyó un mínimo de 18 meses tras la cirugía (rango 24-204 meses). El grupo A incluyó 27 a pacientes tras una enucleación, y el grupo B incluyó a 29 pacientes tras una cirugía en bloque.
Grupo AAnálisis descriptivoEn el grupo A, la edad media de los pacientes fue de 46 años (rango 31-61). Trece pacientes fueron tratados en nuestro centro, en el contexto de un equipo multidisciplinario, y los 14 restantes fueron tratados primariamente en otras instituciones.
Los tumores fueron sintomáticos en el 66% de los casos. La biopsia preoperatoria se realizó en el 40% de los pacientes. El tratamiento neoadyuvante fue indicado en el 18,5% de los pacientes con un tumor no-liposarcoma. La cirugía conseguida fue óptima (R0) en el 15%, marginal (R1) en el 63% y microscópicamente residual (R2) en el 22% de los pacientes. El diámetro medio del tumor resecado fue de 20cm, siendo<10cm en el 18% de los casos, entre 10 y 20cm en el 52% de los casos, y >20cm en el 29,6% de los casos. El tipo histopatológico fue de liposarcoma en el 70,4% de los casos, histiocitoma fibroso maligno en el 11% de los casos y otros tipos de tumores (leiomiosarcoma, schwanoma maligno, fibrosarcoma, sarcoma de Ewing extraesquelético) en el 18% de casos.
Se obtuvieron márgenes libres de tumor en el 7,4% de los pacientes. Al valorar el grado histológico, en la mayoría de los pacientes el tumor era de grado iii (59,3%), siendo el 22,2% de grado ii y el 18,5% de grado i.
Al valorar la morbilidad quirúrgica según la clasificación de Clavien-Dindo, observamos un 7,4% con grado iiib y un 3,7% (un caso) con grado iv (tabla 1)8. La estancia media hospitalaria fue de 9,3 ± 4 días.
Morbilidad de acuerdo a la clasificación de Clavien-Dindo
| Grupo A enucleación | Grupo B resección en bloque | |
| Grado I | Una infección de herida | 3 infecciones de herida |
| Grado II | Una infección del tracto urinario19 transfusión sanguínea | Una trombosis venosa profundaUna infección del tracto urinario24 transfusión sanguínea |
| Grado IIIa | Un absceso intraabdominal | 2 absceso intraabdominal |
| Grado IIIb | Una perforación duodenalUna oclusión intestinal | Una hemorragia con tratamiento conservadorUna dehiscencia anastomóticaUna oclusión intestinal |
| Grado IVa | 0 | Un íleo paralítico |
| Grado IVb | 0 | |
| Grado V | Una isquemia intestinal | Una isquemia intestinalUna hemorragia masiva |
La tasa de reintervenciones fue del 7,4% (2 casos). El tratamiento adyuvante fue administrado en el 48% de los pacientes (40,7% quimioterapia y 18,5% radioterapia).
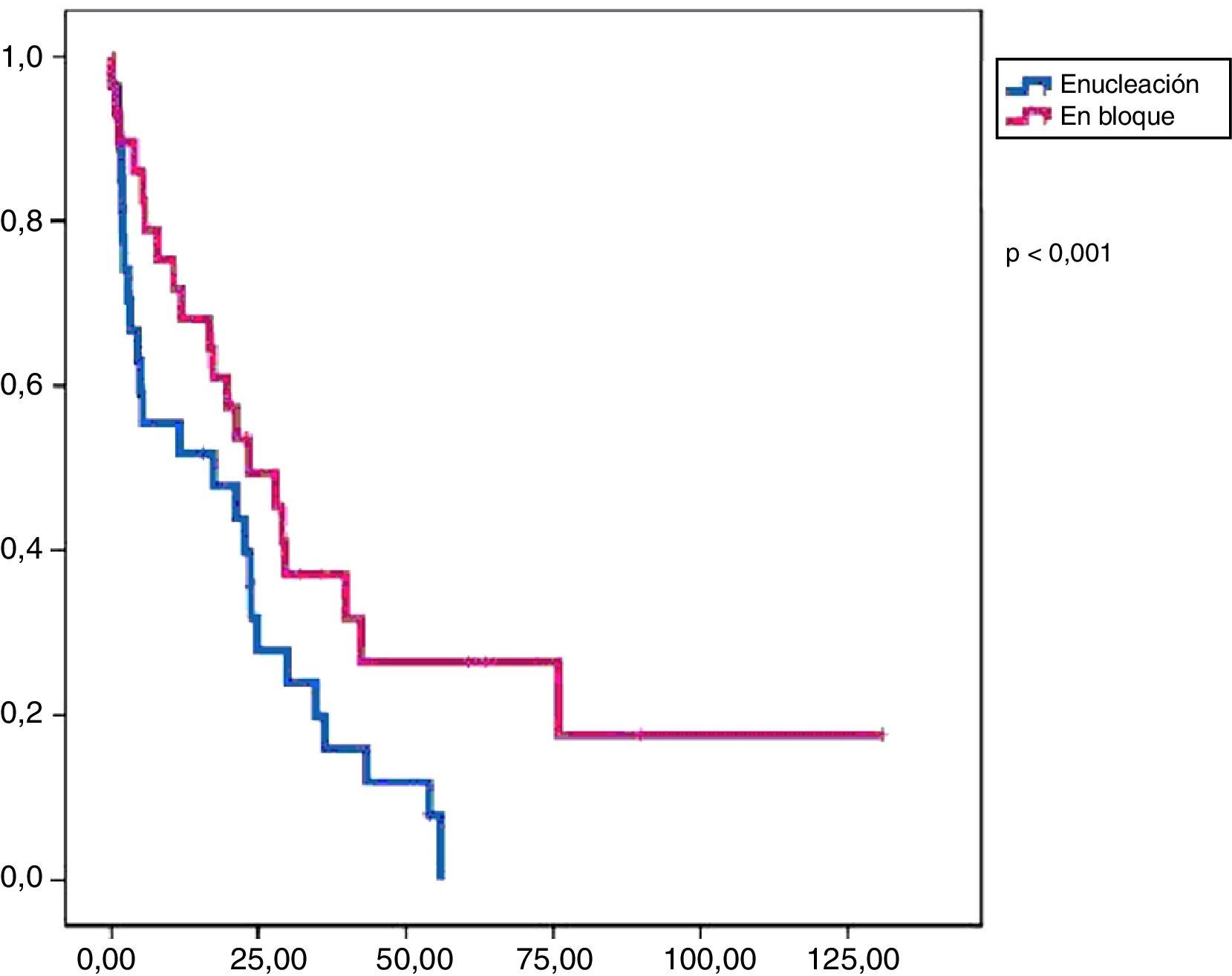
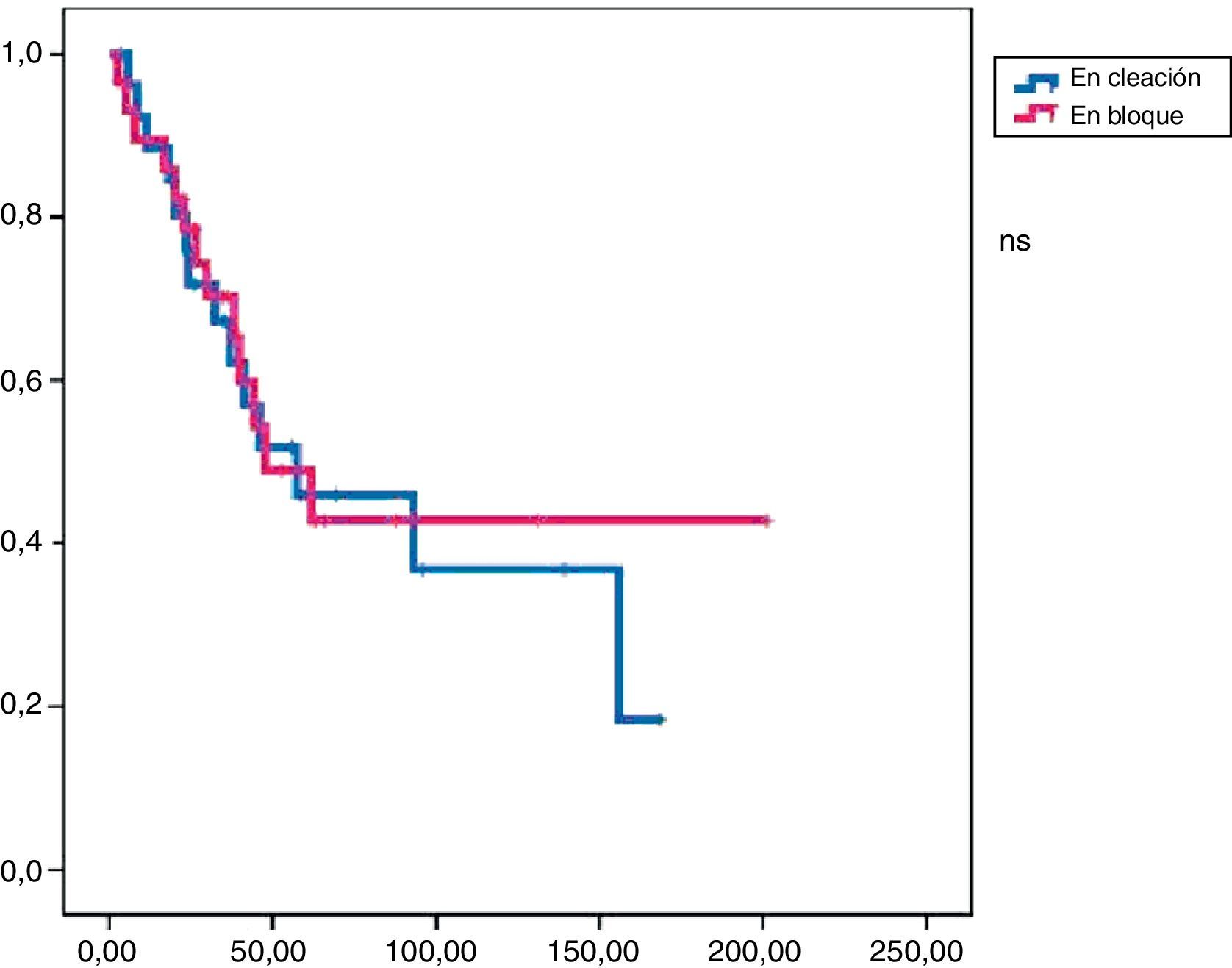
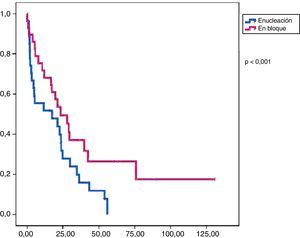
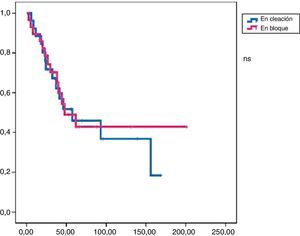
En este grupo recidivaron 24 pacientes con una media de SLE de 17,3 meses. Al final del periodo de seguimiento, 19 pacientes seguían vivos y la media de SG fue de 47,9 meses (figs. 1 y 2).
Cabe destacar que en comité multidisciplinar se reevaluaron todos los pacientes no intervenidos en nuestro centro y en el 70% de ellos se realizó una segunda cirugía con intención curativa «en bloque».
Grupo BAnálisis descriptivoEn el grupo B, la edad media de los pacientes fue de 60 años (rango 46-74 años). Un total de 25 pacientes (86,2%) fueron tratados inicialmente en nuestro hospital y tan solo 4 pacientes, en otras instituciones. Los pacientes presentaban sintomatología en el 76% de casos. La biopsia preoperatoria se realizó en el 41% de los casos. El tratamiento neoadyuvante fue administrado en 14 pacientes. La cirugía fue considerada radical en todos los pacientes operados mediante una resección tumoral asociada a exéresis de órganos o estructuras adyacentes y no limitada a la resección del tumor y su pseudocápsula. Los órganos o estructuras asociados a la resección tumoral fueron el riñón (70%), el colon derecho o izquierdo (44%) y otros en el 18% de los casos (bazo 4 pacientes, músculo psoas en 6 pacientes, vena cava inferior en un paciente que no requirió reconstrucción por trombosis previa, útero en 2 pacientes, páncreas en 3 pacientes, colon en 15 pacientes e intestino delgado en un paciente). Se resecó un solo órgano con el tumor en 10 pacientes, 2 órganos en 13 pacientes, 3 y 4 órganos en 2 casos respectivamente, y finalmente la exéresis de 5 órganos en un solo paciente. El cirujano consideró la cirugía como óptima en el 65,5% de los casos, marginal en el 27,5% al resecar zonas incluyendo únicamente la pseudocápsula tumoral por estar en contacto con estructuras no extirpables y microscópicamente con tumor residual en el 7% de los casos.
El diámetro medio tumoral fue de 28cm, siendo >20cm en el 59% de los casos, entre 10-20cm en el 34% de los casos, y tan solo el 7% menores de 10cm. El subtipo tumoral fue liposarcoma en el 55,2% de los casos, histiocitoma fibroso maligno en el 13,8% de los casos, leiomiosarcoma en el 10,3% de los casos y «otros» en el 20% de los casos. El informe anatomopatológico identificó márgenes libres de tumor en el 51,7% de los casos. El grado histológico predominante fue iii/iii en el 48,3% de los casos y de grado ii/iii en el 38% de los casos. La morbilidad perioperatoria observada, según la clasificación de Clavien-Dindo, fue de 14% de grado iiia y 17% de grado iiib, y 6% de grado V (mortalidad 2 pacientes) (tabla 1)8. La estancia media hospitalaria fue de 17,2 ± 12 días.
La tasa de reintervenciones fue del 17,2%. Se administró tratamiento adyuvante en el 55% de los casos (51,7% quimioterapia y 38% radioterapia). En este grupo recidivaron 14 pacientes con una SLE media de 23,4 meses. Al final del periodo de estudio habían fallecido 9 pacientes y la SG media fue de 57,3 meses (figs. 1 y 2).
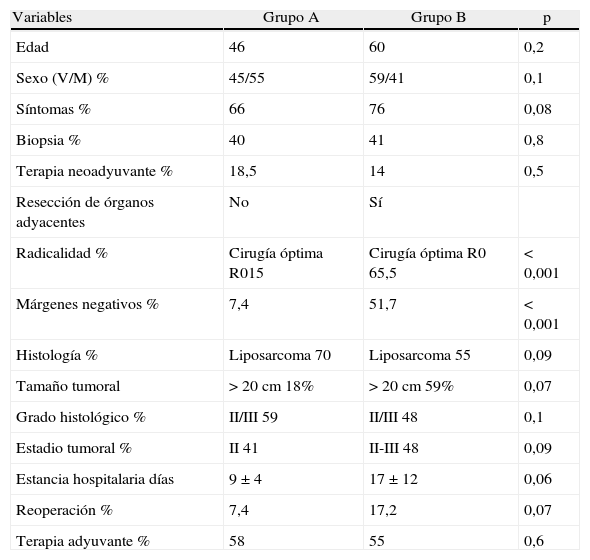
Análisis comparativoLos grupos A y B fueron equiparables con respecto a todos los parámetros estudiados excepto en la radicalidad de la cirugía (con un mayor porcentaje en el grupo B) y a la presencia de márgenes libre (mayor porcentaje grupo B) (tabla 2). En cuanto a la supervivencia libre de enfermedad, el grupo B mostró unos mejores resultados con diferencias significativas (p<0,01) respecto al grupo A. También encontramos una mejor supervivencia global en el grupo B pero en este caso sin llegar a la significación estadística (p<0,08).
Comparación entre grupos
| Variables | Grupo A | Grupo B | p |
| Edad | 46 | 60 | 0,2 |
| Sexo (V/M) % | 45/55 | 59/41 | 0,1 |
| Síntomas % | 66 | 76 | 0,08 |
| Biopsia % | 40 | 41 | 0,8 |
| Terapia neoadyuvante % | 18,5 | 14 | 0,5 |
| Resección de órganos adyacentes | No | Sí | |
| Radicalidad % | Cirugía óptima R015 | Cirugía óptima R0 65,5 | <0,001 |
| Márgenes negativos % | 7,4 | 51,7 | <0,001 |
| Histología % | Liposarcoma 70 | Liposarcoma 55 | 0,09 |
| Tamaño tumoral | >20cm 18% | >20cm 59% | 0,07 |
| Grado histológico % | II/III 59 | II/III 48 | 0,1 |
| Estadio tumoral % | II 41 | II-III 48 | 0,09 |
| Estancia hospitalaria días | 9±4 | 17±12 | 0,06 |
| Reoperación % | 7,4 | 17,2 | 0,07 |
| Terapia adyuvante % | 58 | 55 | 0,6 |
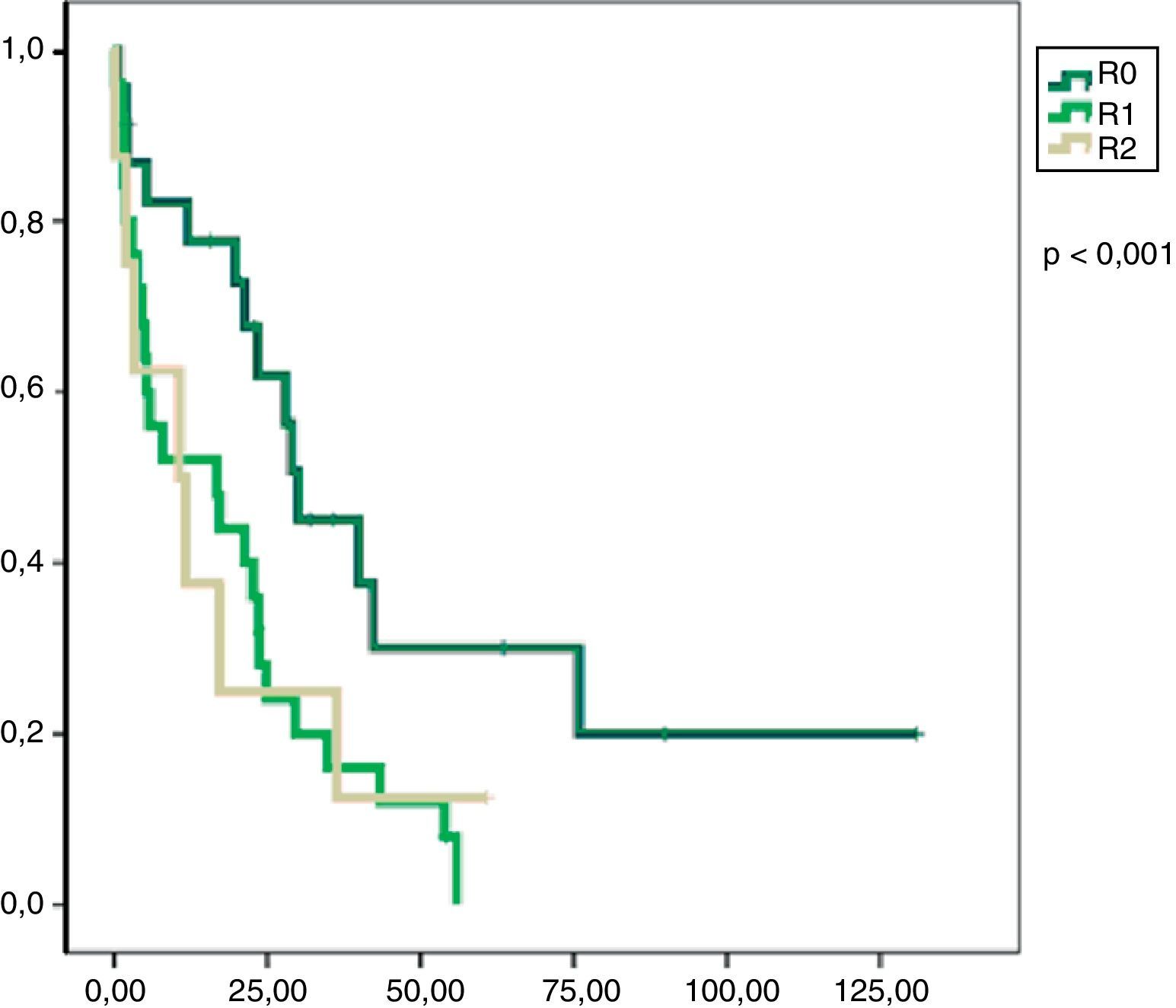
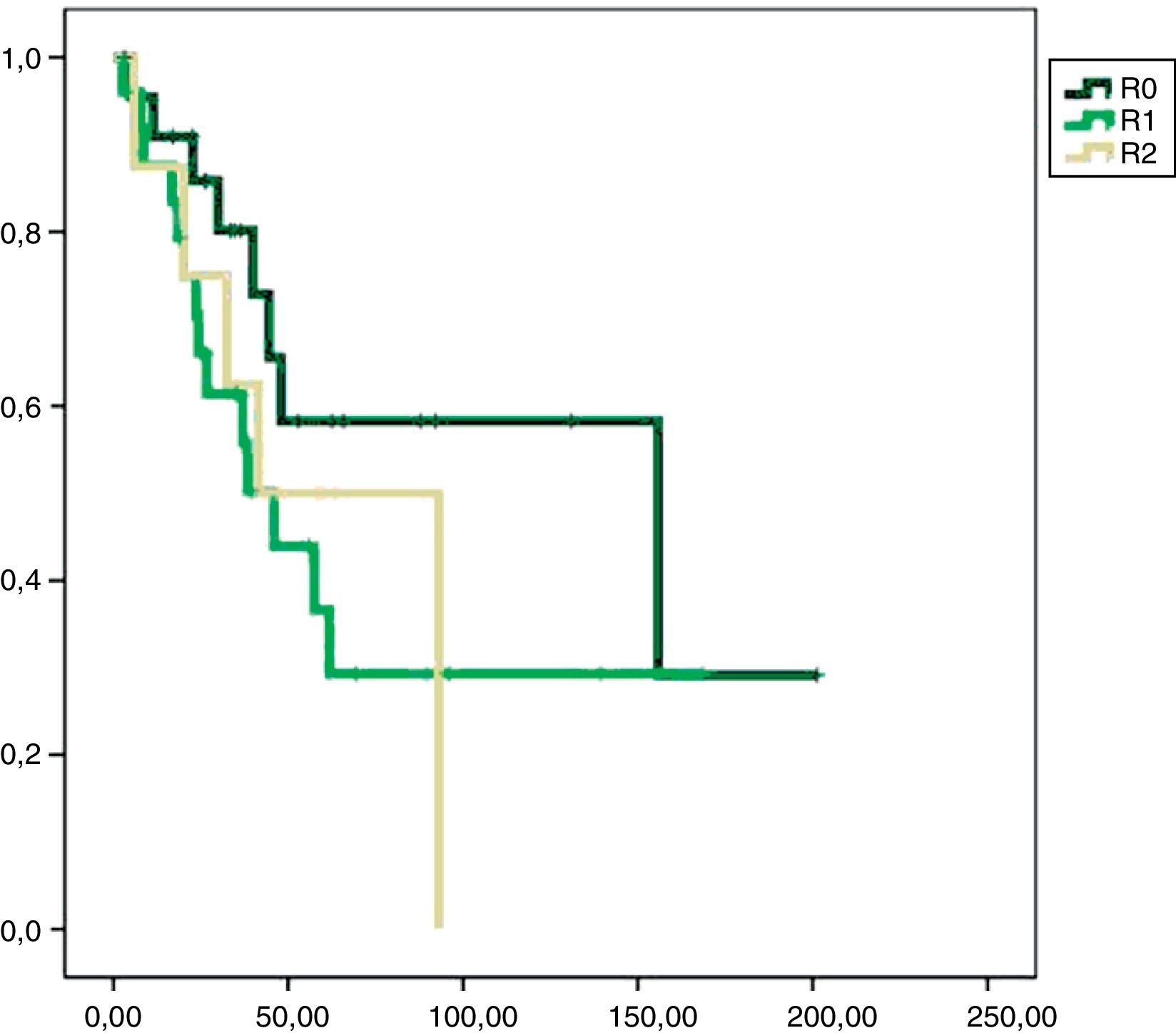
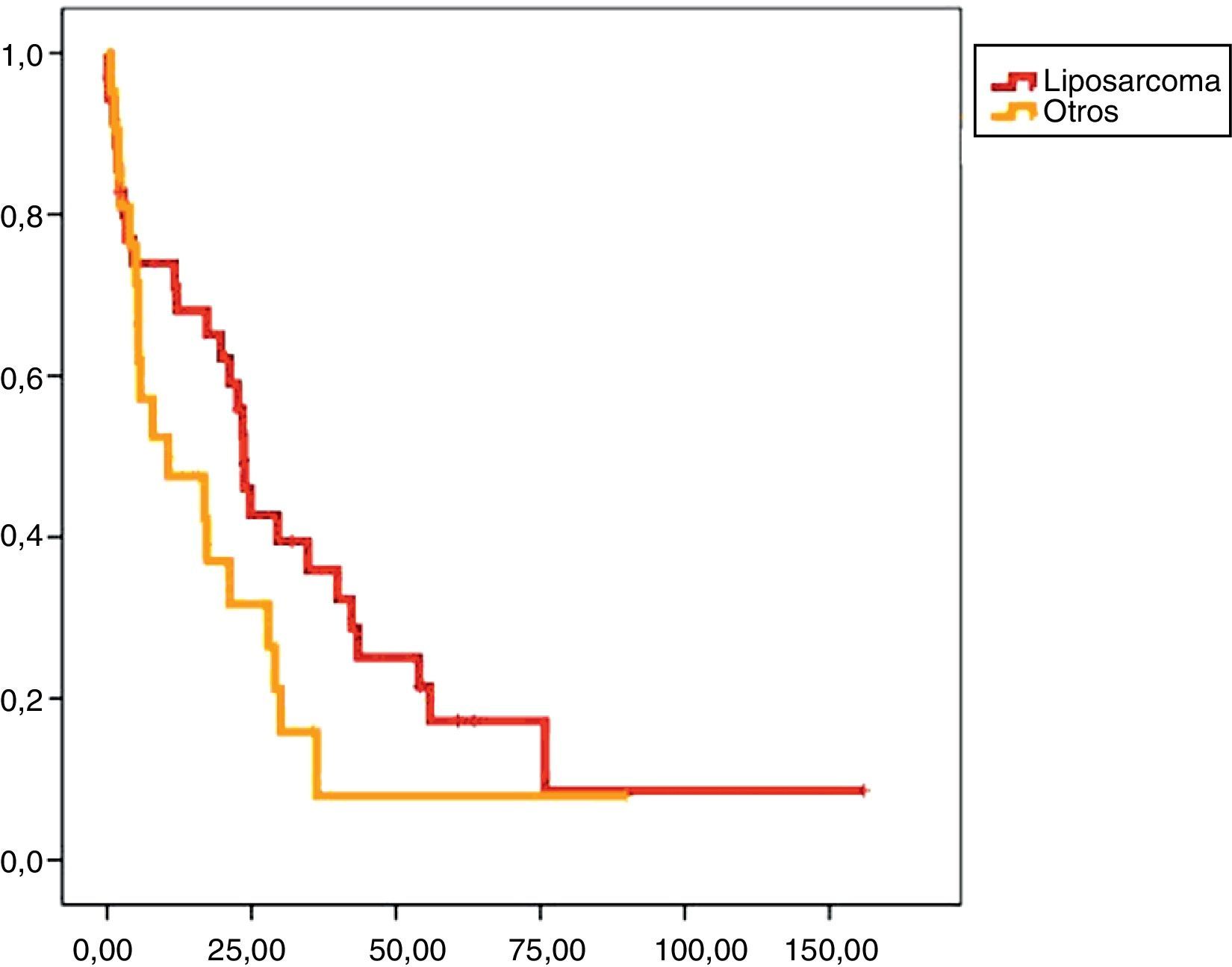
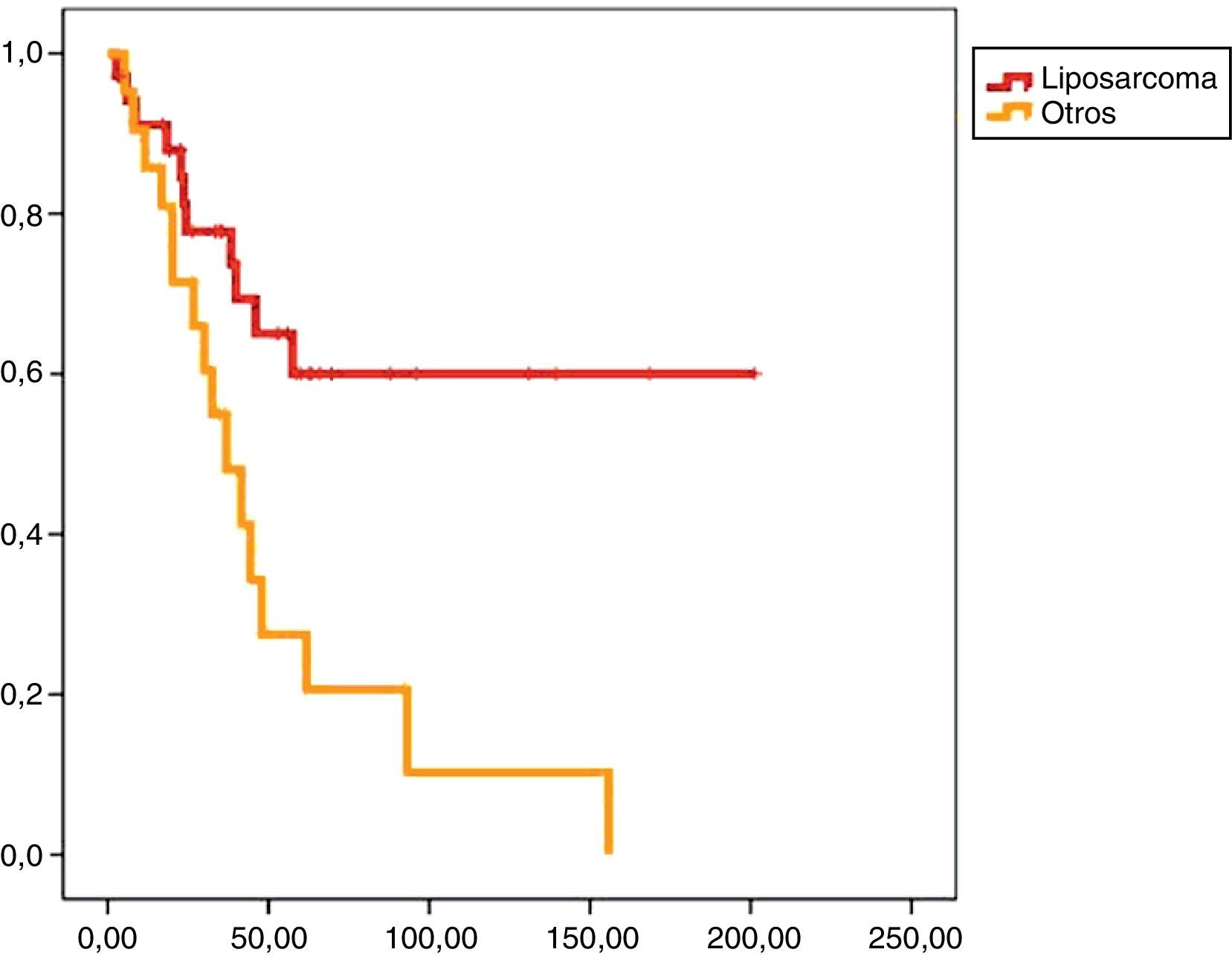
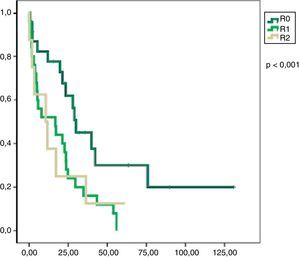
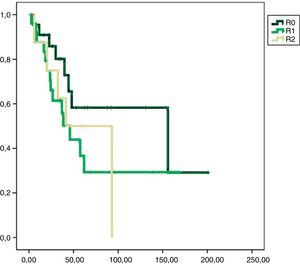
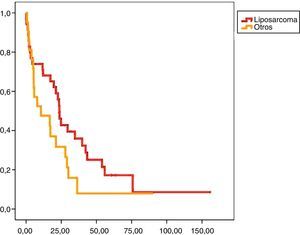
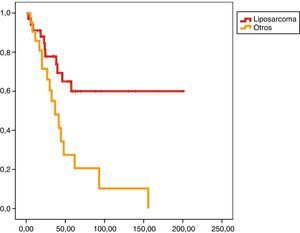
En el análisis univariado encontramos que la SLE fue más prolongada en las resecciones R0 con una clara diferencia significación estadística (p<0,05). No obstante, esta diferencia no pudo ser observada con relación a la SG (figs. 3 y 4). Cuando se compararon los diferentes tipos histológicos (liposarcoma versus otros tipos) independientemente del tratamiento a que fueron sometidos los pacientes, la SLE y la SG fueron superiores en los pacientes afectos de liposarcoma (figs. 5 y 6). El análisis multivariado puso de manifiesto que solo el tipo de radicalidad de la exéresis y el subtipo histológico tenían significación asociada. La exéresis tumoral R0 y el subtipo liposarcoma se asociaron a una mayor SLR y solo el subtipo liposarcoma se asoció a una mayor SG.
Los SRP tienen un buena supervivencia a medio plazo, siendo del 60% a 5 años tras un tratamiento quirúrgico óptimo10. La mayoría de los SRP son liposarcomas que, a pesar de presentar una baja frecuencia de metástasis, tienen una alta incidencia de recidivas locales11. La supervivencia está directamente relacionada con las recidivas, pues más pronto o más tarde las resecciones óptimas son imposibles.
La cirugía es la mejor opción terapéutica para los SRP, especialmente para los liposarcomas, al no haber evidencia de ningún agente quimioterápico que mejore la supervivencia de estos pacientes12. Incluso cuando el tratamiento quirúrgico no es óptimo, la radioterapia sola es insuficiente para la «esterilización tumoral», como indican estudios previos13. En nuestra serie, el tratamiento neoadyuvante no condicionó ninguna variación en la SLE ni en la SG, siendo estos factores independientes de dicho tratamiento.
El objetivo de la cirugía en bloque consiste en obtener una exéresis completa tanto macro- como microscópica, aun si ello exige la inclusión de órganos abdominales o retroperitoneales sanos que estén en contacto con el tumor14,15. El retroperitoneo no es un espacio bien definido, por lo que un número no despreciable de órganos abdominales o retroperitoneales suelen estar en contacto con el tumor, y no necesariamente infiltrados por el mismo. No obstante, la importancia de conseguir una cirugía radical R0 puede exigir incluir estos órganos en la resección (cirugía en bloque). La series publicadas presentan un índice de resecciones óptima del 54 al 88%15,16.
En nuestra serie, el índice de una cirugía óptima fue más alta en los pacientes intervenidos en nuestro centro que en el grupo de pacientes tratados en otras instituciones sin estrategias multidisciplinarias o sin cirujanos con experiencia en exéresis multiorgánicas (73 vs. 27%). Estos resultados son comparables con los obtenidos en los centros de referencia15,16. Por otra parte, considerando nuestros resultados, no parece que el índice de complicaciones severas fuera superior en el grupo de cirugía con resecciones más agresivas, excluyendo la mortalidad, que no es comparable al incluir pacientes remitidos de otros centros. Por ello, creemos que la resección en bloque de los SRP es factible en primera línea con resultados aceptables. Es bien conocido que las dificultades de una resección R0 aumentan tras las reintervenciones sucesivas, siendo ello particularmente cierto en las lesiones retroperitoneales11. La mayoría de los pacientes mueren tras complicaciones de estas cirugías reiterativas.
En nuestro estudio, la mejor supervivencia libre de enfermedad en el grupo de pacientes operados por primera vez con cirugía en bloque, nos indica que es crucial el tratamiento radical desde el principio. En los pacientes del grupo de enucleaciones, donde 14 de los 27 pacientes fueron operados en centros sin equipo multidisciplinar, al detectarse la recidiva o persistencia tumoral pudimos realizar una cirugía en bloque en el 70% de ellos. Este dato contribuye a la supervivencia global de manera evidente y puede explicar que no encontremos diferencias significativas entre los 2 grupos. Desgraciadamente, las segundas y sucesivas cirugías, incluso con intención radical, suelen tener peores resultados.
Nuestro estudio muestra que una cirugía inicial óptima puede alcanzar los índices de supervivencia libre de enfermedad más altos y, consecuentemente, mejores índices de supervivencia global. En el análisis multivariado, la presencia de márgenes libres en la pieza de resección tumoral y la histología liposarcoma mostraron relación con una mejor supervivencia libre de enfermedad como han demostrado otros autores17–19.
Podemos concluir que el procedimiento quirúrgico ideal en pacientes con sarcoma retroperitoneal es una cirugía agresiva en bloque, que incluya una exéresis multivisceral. En la actualidad, esta actitud terapéutica parece ser la mejor opción para los pacientes afectos de un sarcoma retroperitoneal, especialmente si esta exéresis «en bloque» se planifica como primera línea terapéutica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.