La cirugía conservadora del cáncer de mama plantea un nuevo problema: la posible afectación tumoral de los márgenes de resección. Esta eventualidad se relaciona de forma negativa con la supervivencia libre de enfermedad. Diversos factores pueden incrementar la probabilidad de que los márgenes estén afectados, en su mayoría relacionados con características del tumor, de las pacientes o de la técnica quirúrgica. En la última década, muchos han sido los estudios que han tratado de identificar factores que puedan predecir la afectación de los márgenes quirúrgicos, aunque en la actualidad, son las nuevas técnicas utilizadas en el estudio de los márgenes y en la localización tumoral las que están propiciando una disminución significativa de las reintervenciones en la cirugía conservadora del cáncer de mama.
Conservative breast cancer surgery is facing a new problem: the potential tumour involvement of resection margins. This eventuality has been closely and negatively associated with disease-free survival. Various factors may influence the likelihood of margins being affected, mostly related to the characteristics of the tumour, patient or surgical technique. In the last decade, many studies have attempted to find predictive factors for margin involvement. However, it is currently the new techniques used in the study of margins and tumour localisation that are significantly reducing reoperations in conservative breast cancer surgery.
Desde sus inicios la cirugía del cáncer de mama ha evolucionado progresivamente hacia técnicas cada día más conservadoras, desde las mastectomías radicales descritas por Halsted a principios del siglo xx hasta las mínimas tumorectomías de la actualidad. No obstante, este progreso ha dado origen a un nuevo problema: la afectación tumoral de los márgenes de resección.
Esta posibilidad, que se valora entre el 20 y el 40% de la cirugía conservadora1,2, propicia la recidiva local3–5, por lo que en la mayoría de los casos obliga a la reintervención con ampliación de los márgenes de resección. Este hecho se hace más relevante en las enfermas menores de 40 años que presentan una menor tasa de supervivencia libre de enfermedad a los diez años en comparación con las pacientes de mayor edad (34,6 vs 84,4%)6. Por el contrario, en las pacientes con márgenes no afectados no se han demostrado diferencias respecto a la recurrencia local en los diferentes grupos de edad7. Si bien la importancia de los márgenes libres es indudable, otros factores se han mostrado determinantes en la probabilidad de desarrollar recurrencia local. De estos factores, cabe destacar la terapia sistémica, que parece disminuir la tasa de recurrencia local, así como la biología del tumor, como ocurre en los tumores calificados como «triple negativos» (negativos para receptores de progesterona, estrógenos y HER2) que presentan un riesgo mayor de recurrencia local, independientemente del tratamiento aplicado8.
Por otra parte, la influencia de los márgenes de resección cercanos al tumor (definidos en muchos centros como una distancia entre 0 y 2mm) sobre la recidiva local es un tema controvertido5,9,10. No obstante, la gran mayoría de estudios que han evaluado esta cuestión concluyen que no existe correlación entre la recidiva local y la distancia del tumor al borde de resección, por lo que en la actualidad la presencia de márgenes cercanos no se considera indicación de reintervención. Al respecto, es importante aclarar que un margen negativo, sea cual sea su tamaño, podría no indicar ausencia total de tumor residual en la mama, sino una carga tumoral restante suficientemente baja como para ser controlada mediante radioterapia8. Esta aseveración quedó demostrada en un estudio de 1985, en el cual se concluyó que hasta un 43% de las pacientes presentaban algún tipo de foco tumoral satélite más allá de 2cm del tumor principal, disminuyendo esta cifra hasta un 11-18% en caso de un margen de 3-4cm11.
A pesar de la indiscutible importancia de los márgenes libres en la progresión de la enfermedad, al menos la mitad de las pacientes reintervenidas no presentarán tumor residual (TR), siendo estas, por tanto, cirugías innecesarias y potencialmente evitables12. Por ello, en la última década, han sido muchos los estudios encaminados a la búsqueda de factores predictores de MP y TR, coincidiendo en su mayoría en una serie de factores que deberían ser tenidos en cuenta en el diseño de la estrategia quirúrgica. Por otro lado, se están desarrollando diferentes técnicas y protocolos de localización tumoral y de evaluación de los márgenes con la finalidad de disminuir la tasa de MP y TR.
El objetivo de esta revisión es el análisis, basado en la evidencia científica disponible, de aquellos factores biológicos y técnicos implicados en el objetivo de conseguir márgenes de resección libres y ausencia de tumor residual para una exigente cirugía conservadora del cáncer de mama.
Factores predictores de márgenes positivos en la pieza de resecciónComo ya se ha comentado, la afectación de los márgenes de resección ha sido identificada como un importante factor de riesgo de recidiva local3, por lo que, en la mayoría de los centros, la expresión «márgenes afectos» es sinónimo de reintervención con el correspondiente impacto negativo desde el punto de vista estético y económico, además de un retraso en el tratamiento adyuvante, y la consiguiente ansiedad de las pacientes.
A este respecto, una serie de estudios, la mayoría retrospectivos, publicados durante la última década han permitido identificar algunos factores que predicen, de manera independiente, un mayor riesgo de presentar MP. Estos son: pacientes jóvenes (< 45-50 años)13–15, tumores grandes (> 20-30mm)15–21, tumores multifocales15–17,20,21, ausencia de diagnóstico preoperatorio de cáncer13,17,18,21,22, microcalcificaciones en la mamografía15,16, localización estereotáxica del tumor23–27, presencia de componente in situ (CDIS)13,15,18,20,21 e histología lobulillar infiltrante13,18–20,22.
Más recientemente, en 2012, ha sido publicado un estudio prospectivo con 305 pacientes de cáncer de mama no palpable intervenidas mediante cirugía conservadora2. Los resultados del mismo, al igual que los trabajos citados anteriormente, apoyan que la presencia de microcalcificaciones, enfermedad multifocal, localización estereotáxica del tumor (vs ecográfica) y presencia de CDIS son factores de riesgo, tanto en el análisis univariante como en el multivariante; la localización estereotáxica versus ecográfica presentó una mayor odds ratio en el análisis multivariante, probablemente relacionada con que los tumores que solo son visualizados mediante mamografía se muestran de forma más indefinida y difusa, hecho que dificulta su marcaje y su resección.
Otro reciente estudio prospectivo ha tratado de definir factores preoperatorios útiles para evaluar el riesgo de precisar de múltiples intervenciones en comparación con una única intervención tras la tumorectomía28. Los resultados de este estudio, tanto en análisis univariante como multivariante, coinciden con los anteriores en lo que se refiere a las microcalcificaciones y a la histología lobulillar, que aumentarían el riesgo de reoperación por márgenes positivos. Otro hallazgo de este estudio, no descrito previamente, ha sido que el grado 2 en la biopsia preoperatoria (tumor moderadamente diferenciado) aumenta el riesgo de reintervención hasta casi el doble cuando se compara con el grado 1 (tumor bien diferenciado), sin haberse demostrado una diferencia significativa con el grado 3 (tumor pobremente diferenciado), aunque sí lo ha sido en otro estudio29.
Shin et al.30, también en 2012, demostraron que las pacientes con mamas radiológicamente densas (> 75% de tejido fibroglandular) presentaban una tasa de márgenes afectos cuatro veces mayor que aquellas con mamas grasas, probablemente debida a la dificultad para delimitar los límites del tumor, hecho igualmente demostrado por Bani et al.31. Este factor de riesgo junto con otros cuatro (CDIS, histología lobulillar, microcalcificaciones y diferencia de medida tumoral > 5mm entre ecografía y RMN), les permitió elaborar un normograma de riesgo que condujo a la detección de hasta el 85% de las pacientes que presentaron MP, herramienta que podría resultar muy útil en la identificación preoperatoria de pacientes con riesgo significativo de presentar MP, permitiendo plantear una estrategia terapéutica más adecuada para lograr márgenes de resección negativos.
Por último, también se ha propuesto que tanto la quimioterapia preoperatoria como la fijación con formol y el tiempo transcurrido desde la extracción de la pieza hasta su análisis anatomopatológico podrían determinar una insuficiente valoración del estado de los bordes y, en consecuencia, una mayor tasa de márgenes positivos debido a la retracción del tejido. El primero de estos factores no ha sido corroborado; así, Soucy et al.32 no encontraron diferencias significativas en la afectación de márgenes en enfermas con y sin quimioterapia preoperatoria. Con relación a los dos restantes, un trabajo que analizó los pesos y volúmenes, así como la distancia entre el margen y el tumor, en 68 piezas, transcurridos diferentes periodos de tiempo, concluyó que no existe tal relación temporal, ni con la fijación en formol33. No obstante, este último hecho es controvertido, habiéndose publicado estudios que parecen demostrar una reducción del tamaño tumoral tras la fijación en formol34. Además, un trabajo experimental publicado en 2010 en el cual se comparó mediante RMN el efecto del formol en diferentes tejidos concluyó que este aldehído provoca una ligera expansión en el tejido muscular, retracción del tejido graso y aplanamiento de la muestra35. Con estos datos a la vista, se puede concluir al menos que la fijación en formol de la pieza podría, de alguna forma, alterar la medición de los márgenes tumorales, si bien solo futuros estudios permitirán esclarecer la importancia de este hecho.
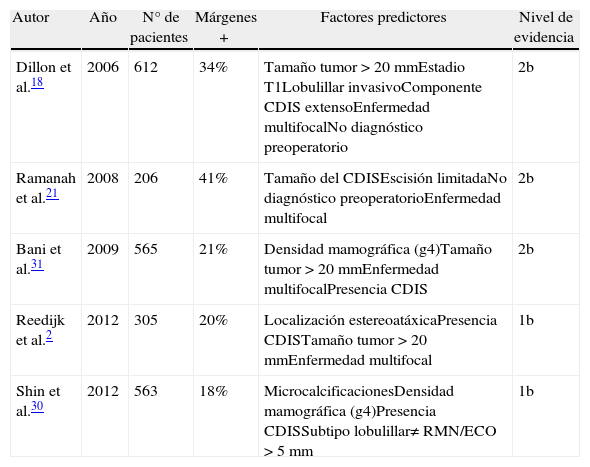
De forma esquemática, en la tabla 1 pueden consultarse las características y conclusiones fundamentales de los estudios comentados en este apartado.
Factores predictores de márgenes positivos en la pieza de resección
| Autor | Año | N° de pacientes | Márgenes + | Factores predictores | Nivel de evidencia |
| Dillon et al.18 | 2006 | 612 | 34% | Tamaño tumor > 20mmEstadio T1Lobulillar invasivoComponente CDIS extensoEnfermedad multifocalNo diagnóstico preoperatorio | 2b |
| Ramanah et al.21 | 2008 | 206 | 41% | Tamaño del CDISEscisión limitadaNo diagnóstico preoperatorioEnfermedad multifocal | 2b |
| Bani et al.31 | 2009 | 565 | 21% | Densidad mamográfica (g4)Tamaño tumor > 20mmEnfermedad multifocalPresencia CDIS | 2b |
| Reedijk et al.2 | 2012 | 305 | 20% | Localización estereoatáxicaPresencia CDISTamaño tumor > 20mmEnfermedad multifocal | 1b |
| Shin et al.30 | 2012 | 563 | 18% | MicrocalcificacionesDensidad mamográfica (g4)Presencia CDISSubtipo lobulillar≠ RMN/ECO > 5mm | 1b |
CDIS: carcinoma ductal in situ; ECO: ecografía; g4: grado 4; Márgenes +: positividad de márgenes (%); RMN: resonancia magnética; RMN/ECO: diferencia de medida tumoral entre ecografía y RMN.
Clasificación del nivel de evidencia según The Oxford 2011 levels of evidence, Levels of Evidence Working Group, Oxford Centre for Evidence-Based Medicine (OCEBM).
Según nuestra experiencia, hasta el 60% de las enfermas que se reintervienen por MP no muestran TR en el estudio histopatológico definitivo. Este hecho se describe de forma constante en la literatura con porcentajes que rondan el 50% en la mayoría de estudios36, por lo que poder predecir qué pacientes no presentarán cáncer residual en la reintervención resultaría muy beneficioso.
En 1995 se publicó el primer trabajo, en el cual, de forma retrospectiva se estudió la presencia de TR en pacientes que habían sido sometidas previamente a biopsia escisional por cáncer de mama37. Tras revisar 420 pacientes, de las cuales solo un 47% presentaron TR, concluyeron que los factores de riesgo más significativos a este respecto eran: presentación clínica (palpable vs no palpable: 3 vs 11%) y estado de la axila (metastásica vs libre: 14 vs 7%). Por otro lado, Saarela et al.38, tras analizar prospectivamente a 49 pacientes, encontraron que el tamaño tumoral no se relacionaba con la presencia de TR, aunque hallaron relación, como parece lógico, con la multifocalidad, al igual que otros autores39. No obstante, ambos estudios no son comparables, ni por el tamaño de la muestra, ni porque este último solo incluyó a pacientes con tumores no palpables. Asimismo, otro trabajo del 2004 apoya que en tumores ≥ 20mm con MP existe hasta un 14% más de TR que en tumores más pequeños40. En la misma línea, otro estudio prospectivo con 47 pacientes41 avala este hecho, poniendo el punto de corte del tamaño tumoral en 30mm, añadiendo además como factor de riesgo la presencia de HER2/Neu +, también descrito para MP42, así como una relación entre volumen del tumor y pieza de resección mayor del 70%. En este trabajo41, otros nueve parámetros fueron estudiados sin que se encontrara significación estadística. Entre ellos destacan: componente intraductal extenso, tumor palpable y metástasis linfáticas axilares.
En 2009, un sorprendente trabajo concluyó, tras analizar retrospectivamente a 303 pacientes, que la tasa de TR no difería entre enfermas con márgenes cercanos y positivos39. Datos, que además de inesperados, se encuentran en discordancia con otro trabajo metodológicamente similar cuyos resultados respaldan la lógica de que a mayor margen, menor tasa de afectación residual43.
En 2012, Halevy et al.29 desarrollaron un score de probabilidad de encontrar TR en la reintervención tras MP basado en seis parámetros que se comportaron como factores de riesgo independientes, concluyendo que, para pacientes con márgenes ≤2mm y un score < 4 la probabilidad de encontrar un foco de cáncer microinvasivo residual (< 2mm) es del 3,2%, siendo hasta del 10% la posibilidad de encontrar CDIS.
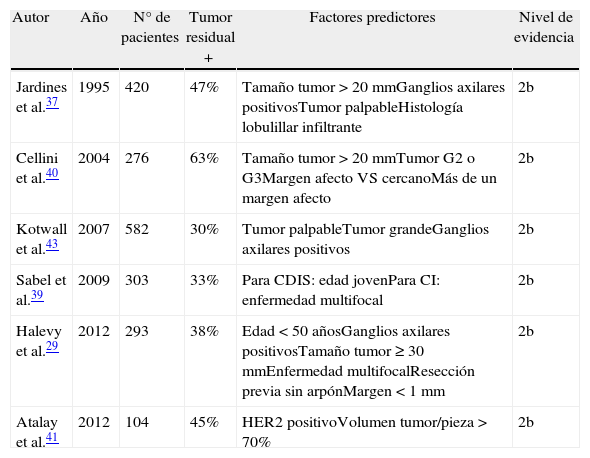
A modo de resumen, en la tabla 2 pueden consultarse los resultados de los principales trabajos citados en el presente apartado.
Factores predictores de existencia de tumor residual en la reintervención
| Autor | Año | N° de pacientes | Tumor residual + | Factores predictores | Nivel de evidencia |
| Jardines et al.37 | 1995 | 420 | 47% | Tamaño tumor > 20mmGanglios axilares positivosTumor palpableHistología lobulillar infiltrante | 2b |
| Cellini et al.40 | 2004 | 276 | 63% | Tamaño tumor > 20mmTumor G2 o G3Margen afecto VS cercanoMás de un margen afecto | 2b |
| Kotwall et al.43 | 2007 | 582 | 30% | Tumor palpableTumor grandeGanglios axilares positivos | 2b |
| Sabel et al.39 | 2009 | 303 | 33% | Para CDIS: edad jovenPara CI: enfermedad multifocal | 2b |
| Halevy et al.29 | 2012 | 293 | 38% | Edad < 50 añosGanglios axilares positivosTamaño tumor ≥ 30mmEnfermedad multifocalResección previa sin arpónMargen < 1mm | 2b |
| Atalay et al.41 | 2012 | 104 | 45% | HER2 positivoVolumen tumor/pieza > 70% | 2b |
CDIS: carcinoma ductal in situ; CI: carcinoma infiltrante; G2: tumor moderadamente difenciado; G3: tumor pobremente diferenciado.
Clasificación del nivel de evidencia según The Oxford 2011 levels of evidence, Levels of Evidence Working Group, Oxford Centre for Evidence-Based Medicine (OCEBM).
Como alternativa a la localización mediante arpón de tumores no palpables, al menos otras tres técnicas han demostrado su utilidad.
Por un lado, la resección guiada mediante ultrasonidos (intraoperative ultrasound [IOUS]), basada en la evaluación tumoral antes y durante la cirugía, así como del espécimen resecado, ha demostrado reducir considerablemente la tasa de MP al 3-11%23,24,26,27, respecto del 45-57% que describen algunas series con el uso del arpón, y el 26% conseguido mediante la localización de lesiones ocultas radioguiada (radioguide occult lesion localization [ROLL])24,44. Si bien es cierto que los datos de IOUS resultan concluyentes, en defensa del uso del arpón y en discordancia con la mayoría de estudios, un trabajo del 2012 encuentra entre la IOUS y el arpón tasas similares de MP (6,7 vs 6,5%) y reintervenciones (12,5 vs 11%)45. No obstante, dado que la ecografía no es la técnica ideal para valorar microcalcificaciones y, por tanto, CDIS, y que solo el 50% de los tumores son visualizados mediante ecografía46, su uso no es generalizable. No obstante, a la vista de estos resultados podría resultar de utilidad en centros con disponibilidad y experiencia47.
Basada también en ultrasonidos y por tanto con sus mismas desventajas se encuentra la localización asistida por criosonda (cryoprobe-assisted localization [CAL]). Esta técnica, utilizada en su origen para el tratamiento de tumores benignos48, fue aplicada por primera vez en cáncer de mama por Tafra et al.49 en 2003. Su utilidad ha sido demostrada en tumores pequeños y no palpables. Consiste en colocar, guiada mediante ecografía, una criosonda dentro del tumor y congelarlo, convirtiéndolo así en una esfera palpable que sea fácilmente resecable36. Si bien esta técnica no ha demostrado superioridad respecto al arpón en cuanto a la tasa de MP (28 vs 31%; p=0,691) y reintervenciones (19 vs 21%; p=0,764)50, sí disminuye claramente el tiempo operatorio y el volumen de tejido extirpado, mejorando los resultados estéticos50. Además, el procedimiento per se produce necrosis tumoral, pudiendo tener por tanto efecto en la ablación de márgenes. Tanto es así que, en 2011 fue publicada la primera serie con el uso de esta técnica por vía percutánea para ablación de cánceres < 10mm. De las 15 pacientes incluidas, el procedimiento demostró necrosis tumoral completa, evaluada mediante RMN y estudio histopatológico en 14 de ellas, pudiendo atribuirse el fracaso en la paciente restante a una incorrecta posición de la sonda51.
Por otra parte, y basada en medicina nuclear, en 1996 se describió la técnica ROLL como herramienta para la localización de tumores no palpables52. Si se compara con el arpón, la ROLL resulta segura, efectiva y menos cruenta53; incluso, según algunos autores, disminuye la tasa de MP (57 vs 26%)54 y de reintervenciones55,56. Además, el empleo de la ROLL no aumenta el tiempo operatorio, e incluso disminuye el tiempo de localización tumoral hasta 7 min en algunas series55–57; no obstante, sí parece aumentar los costes respecto al arpón36. Un metaanálisis publicado en 2012 en el que se incluyeron cuatro estudios y 449 pacientes apoya estos resultados58.
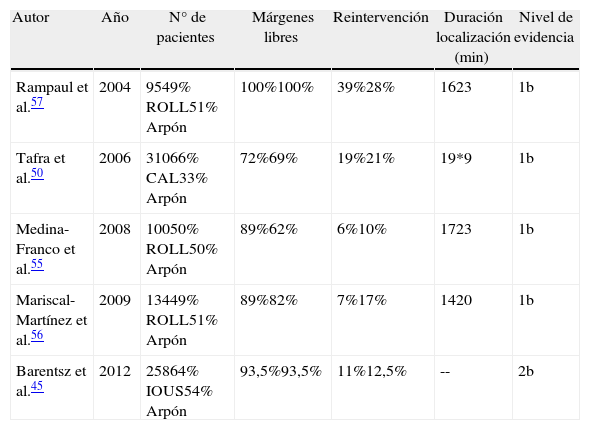
La tabla 3 muestra un resumen de los principales estudios llevados a cabo comparando ROLL, CAL e IOUS con el arpón.
Influencia de las técnicas de localización tumoral intraoperatoria
| Autor | Año | N° de pacientes | Márgenes libres | Reintervención | Duración localización (min) | Nivel de evidencia |
| Rampaul et al.57 | 2004 | 9549% ROLL51% Arpón | 100%100% | 39%28% | 1623 | 1b |
| Tafra et al.50 | 2006 | 31066% CAL33% Arpón | 72%69% | 19%21% | 19*9 | 1b |
| Medina-Franco et al.55 | 2008 | 10050% ROLL50% Arpón | 89%62% | 6%10% | 1723 | 1b |
| Mariscal-Martínez et al.56 | 2009 | 13449% ROLL51% Arpón | 89%82% | 7%17% | 1420 | 1b |
| Barentsz et al.45 | 2012 | 25864% IOUS54% Arpón | 93,5%93,5% | 11%12,5% | -- | 2b |
CAL: localización asistida por criosonda; IOUS: resección guiada mediante ultrasonidos; ROLL: localización de lesiones ocultas radioguiada.
Clasificación del nivel de evidencia según The Oxford 2011 levels of evidence, Levels of Evidence Working Group, Oxford Centre for Evidence-Based Medicine (OCEBM).
*Si bien el tiempo de localización resulta mayor, el tiempo global del procedimiento resulta menor en CAL que para el arpón (31 vs 104min).
También en el ámbito de la delimitación tumoral intraoperatoria, aunque más alejadas de una posible estandarización, existen varias técnicas emergentes.
La fabricación de sondas manuales de detección de positrones (positron emission tomography [PET]), basadas en la medición del metabolismo celular, ha hecho posible la aparición de esta técnica de demarcación tumoral en tiempo real59. Resultados preliminares apoyan su posible utilidad en el cáncer de mama, si bien la falta de especificidad y resolución espacial, la dificultad para delimitar tumores pequeños (< 10mm) y su alto coste hacen de ella por el momento una técnica aún por desarrollar36,60.
De forma similar, probablemente la técnica en desarrollo más novedosa a este respecto sea el mapeo óptico mediante fluorescencia casiinfrarroja. Fundamentada en la capacidad de emisión de este tipo de luz de determinados fluorocromos, bien uniéndose a receptores tumorales como el VEGF, EGF 2 o el HER2/neu61–64, o bien siendo activados por proteasas tumorales como la catepsina B y D, y la metaloproteinasa de la matriz 265,66, esta técnica permitirá la delimitación tumoral así como la evaluación y escisión de tejido tumoral remanente o de nódulos sospechosos67. Entre las ventajas que presenta están: ser rápida, segura, inocua, fácil de realizar, relativamente barata y con alta resolución (hasta 10μm). A pesar de todas estas ventajas, las características propias de la propagación de la luz en los tejidos hacen de la profundidad a la que a menudo se encuentran los tumores de mama un obstáculo a superar. Aun así, esta técnica se perfila como una de las más prometedoras en el futuro de la cirugía conservadora del cáncer de mama36. En la misma línea, otros dispositivos de mapeo fotoacústico aún en investigación podrían demostrar utilidad en los próximos años68.
Estudio de los márgenes de resección: cómo, cuándo y dóndeDe los métodos utilizados para la evaluación de los márgenes de resección, el más simple de todos se basa en la delimitación tumoral con tinta china y su valoración macroscópica durante la cirugía y microscópica posteriormente por el patólogo. No obstante, las nuevas técnicas de análisis de márgenes tumorales mejoran sobremanera los resultados de la tinta china, razón por la cual esta empieza a considerarse una técnica en desuso.
Parte de estas técnicas son llevadas a cabo por el radiólogo sobre la pieza de resección, bien mediante el uso de ecografía, bien de mamografía. A este respecto, un estudio del 2006 llevado a cabo con 25 muestras concluyó que el uso exclusivamente de ecografía proporcionaba mejores resultados en la valoración de los márgenes que el de mamografía, obteniéndose resultados similares al combinar ambas técnicas. La ecografía sobreestimó el margen en el 58,9% de los casos mientras que la mamografía lo hizo en el 66,7%. Además, la media de la diferencia entre margen mínimo estimado mediante histología y ecografía fue de 2,1mm, siendo de 3,8mm mediante mamografía, con diferencias estadísticamente significativas. De esta forma sus autores concluyen que si el margen tumoral medido mediante ecografía es dos veces el deseado (> 4mm), la tasa de márgenes adecuados supera el 90% de los casos69. A pesar de esto, la mamografía rutinaria por sí misma, en ausencia de cualquier otro método, ha demostrado su utilidad en pacientes con tumores no palpables70, disminuyendo la tasa de reintervención del 31 al 20%71.
Desde un punto de vista histopatológico, con el fin de valorar intraoperatoriamente los márgenes de resección, se dispone de varios métodos de probada eficacia.
El análisis mediante cortes por congelación (frozen section analysis [FSA]) es un procedimiento cada vez más popular en la cirugía de mama. Una vez extraída la pieza se congela, se procesa y se analiza microscópicamente (proceso que dura unos 30 min). Presenta una sensibilidad y especificidad entre el 65–78% y el 98–100%, respectivamente36. La relación coste-beneficio de la técnica resulta muy positiva al disminuir el número de reintervenciones72,73, si bien ha de reseñarse que aumenta el tiempo quirúrgico, puede dificultar el análisis histológico definitivo y es poco fiable tanto en tumores menores de 10mm como en CDIS74,75.
Otra prometedora técnica en este campo es la impronta citológica (intraoperative touch preparation cytology [IOTPC]; o simplemente imprint citology [IC]). El fundamento de esta técnica, de la cual se están desarrollando equipos automatizados76, se encuentra en la capacidad de adhesión al vidrio de las células cancerosas (que no presenta ni el tejido adiposo ni el glandular). Este método ha demostrado en algunos estudios sensibilidad y especificidad cercanas al 100%77,78, así como capacidad para disminuir la recurrencia local a 5 años al compararla con el FSA (8,2 vs 2,8%)79. No obstante, parece ser menos efectiva en los tumores lobulillares80, presenta artefactos con el uso del electrobisturí y no permite evaluar multifocalidad ni distancia al margen36.
Comparando ambas técnicas (FSA vs IC) recientemente ha sido publicada una revisión sistemática que concluye la eficacia de ambas en la evaluación de márgenes quirúrgicos y la consecuente disminución de las reintervenciones81. En este trabajo, no se encontraron grandes diferencias entre ambas técnicas, a excepción del tiempo de ejecución (13min para IC vs 26min para FSA). La sensibilidad para el FSA y la IC fue del 83 y 72%, y la especificidad del 95 y 97%, respectivamente. La tasa de reintervención sin el uso de ninguna de ellas se estimó en el 35%, reduciéndose al 11% mediante IC, y al 10% mediante FSA.
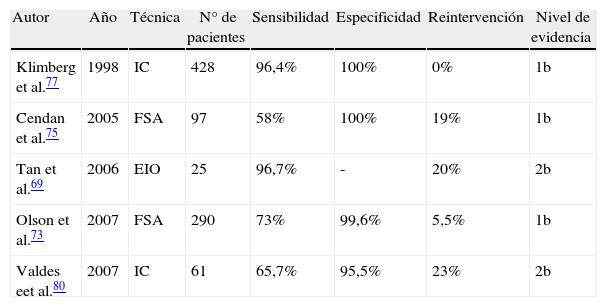
La tabla 4 recoge los aspectos más importantes de los estudios más influyentes a este respecto, si bien, nuevos estudios prospectivos controlados aleatorizados son necesarios para confirmar estos resultados y aclarar el papel que puedan llegar a tener estas técnicas.
Estudio de los márgenes de resección
| Autor | Año | Técnica | N° de pacientes | Sensibilidad | Especificidad | Reintervención | Nivel de evidencia |
| Klimberg et al.77 | 1998 | IC | 428 | 96,4% | 100% | 0% | 1b |
| Cendan et al.75 | 2005 | FSA | 97 | 58% | 100% | 19% | 1b |
| Tan et al.69 | 2006 | EIO | 25 | 96,7% | - | 20% | 2b |
| Olson et al.73 | 2007 | FSA | 290 | 73% | 99,6% | 5,5% | 1b |
| Valdes eet al.80 | 2007 | IC | 61 | 65,7% | 95,5% | 23% | 2b |
EIO: ecografía intraoperatoria; FSA: análisis mediante cortes por congelación; IC: impronta citológica.
Clasificación del nivel de evidencia según The Oxford 2011 levels of evidence, Levels of Evidence Working Group, Oxford Centre for Evidence-Based Medicine (OCEBM).
Otra cuestión debatida en la evaluación de los márgenes de resección es si estos deben evaluarse en la pieza o en la cavidad quirúrgica. La biopsia rutinaria del margen cavitario resulta tentadora desde el punto de vista oncológico82, no obstante, esta actitud no se corresponde con el objetivo de la cirugía conservadora. La relación inversa entre volumen de tejido mamario extirpado y MP ha sido suficientemente probada83,84. Tanto es así, que la infiltración de los márgenes de la cavidad parece correlacionarse mejor con la supervivencia que los de la pieza85, por lo que algunos autores concluyen que el resultado de los márgenes de la pieza de resección puede ser obviado si se ha realizado estudio de los márgenes cavitarios86. No obstante, dadas las diferentes combinaciones posibles entre MP de pieza y cavidad87 y la pobre correlación que se establece entre ambos parámetros85, se recomienda cautela a la hora de basar la actitud terapéutica exclusivamente en los márgenes cavitarios hasta la aparición de estudios de seguimiento a largo plazo87.
ConclusionesLos datos disponibles en la actualidad no aportan una fórmula mágica con la cual resolver el problema de los márgenes tumorales positivos y sus consecuencias. No obstante, la evidencia encontrada en la literatura permite concluir que:
- 1)
Tumores grandes, multifocales, con microcalcificaciones y CDIS, tipo lobulillar y una edad < 45 años se comportan como factores independientes de riesgo de presentar márgenes positivos y deberían ser tenidos en cuenta a la hora de plantear la estrategia quirúrgica.
- 2)
Los datos publicados hasta el momento en torno a factores predictores de encontrar enfermedad residual en una paciente que presentó márgenes positivos no permiten eludir la reintervención en este supuesto.
- 3)
La ROLL y la IOUS parecen ser superiores al arpón en cuanto a comodidad para la paciente, tasa de márgenes positivos y reintervenciones, por lo que se perfilan como métodos de localización de elección a corto plazo.
- 4)
La valoración intraoperatoria de márgenes mediante ecografía o mamografía, así como mediante las técnicas histológicas FSA e IC, ha demostrado suficientemente su utilidad al disminuir la tasa de márgenes positivos y reintervenciones. De esta forma, su introducción en un protocolo de cirugía conservadora mejoraría los resultados del procedimiento.
Una vez conocidos estos elementos, la individualización, el sentido común y la prudencia deben primar en la toma de decisiones y en el acto quirúrgico para evitar al máximo las reintervenciones tras cirugía conservadora en cáncer de mama, teniendo además siempre en cuenta que, una vez conseguidos unos márgenes libres, mayores márgenes de resección no significan menor probabilidad de recurrencia local. Los nuevos avances tecnológicos en este campo auguran un prometedor futuro aún por dilucidar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.