La duodenopancreatectomía cefálica (DPC) es el tratamiento de elección en el adenocarcinoma de cabeza de páncreas. Sin embargo, sigue presentando elevada morbilidad y mortalidad posquirúrgica.
El objetivo de este estudio es definir las variables que influyen en la morbilidad y mortalidad postoperatoria tras la duodenopancreatectomía cefálica por adenocarcinoma de páncreas (ADCP).
Material y métodosSe han recogido prospectivamente las variables de los pacientes intervenidos entre 1991–2007, con el fin de investigar los factores asociados a una mayor morbilidad.
ResultadosSe han intervenido 204 pacientes por ADCP, de ellos 57 eran mayores de 70 años. Se han realizado 119 DPC, 11 con linfadenectomía extendida, 66 DPC con preservación pilórica y 8 con ampliación a pancreatectomía total por afectación del margen de sección. Treinta y cinco casos asociaron resección venosa portal o mesentérica. Se han detectado complicaciones postquirúgicas en el 45% de casos, las más frecuentes: vaciado gástrico lento (20%), infección incisional (17%), fístula pancreática (10%), y complicaciones médicas graves (8%). El 13% fue reintervenido y la mortalidad postoperatoria global fue del 7%. La edad del paciente superior a 70 años, el hemoperitoneo postoperatorio, la dehiscencia gastroentérica, y la presencia de complicaciones médicas graves fueron factores de riesgo de mortalidad postquirúgica en el estudio multivaviante. La fístula pancreática no fue un factor relacionado con la mortalidad posquirúrgica.
ConclusionesLa duodenopancreatectomía cefálica es una técnica segura pero con morbilidad considerable. Los pacientes con edad superior a 70 años deben ser seleccionados cuidadosamente antes de intervenirlos. Las complicaciones médicas graves deben tratarse de forma agresiva para evitar una evolución desfavorable.
Cephalic duodenopancreatectomy (CDP) is the treatment of choice in cancer of the head of the pancreas. However, it continues to have a high post-surgical morbidity and mortality.
The aim of this article is to define variables that influence post-surgical morbidity and mortality after cephalic duodenopancreatectomy due to pancreatic adenocarcinoma (PA) cancer of the head of the pancreas (CHP).
Material and methodsThe variables were prospectively collected form patients operated on between 1991 and 2007, in order to investigate the factors of higher morbidity.
ResultsA total of 204 patients had been intervened due to PA, of whom 57 were older than 70 years. Of these patients, 119 had a CPD, 11 extended lymphadectomy, 66 with pyloric conservation, and 8 with extension to total pancreatectomy due to involvement of the section margin. Portal or mesenteric vein resection was included in 35 cases. Post-surgical complications were detected in 45% of cases, the most frequent being: slow gastric emptying (20%), surgical wound infection (17%), pancreatic fistula (10%), and serious medical complications (8%). Further surgery was required in 13%, and the over post-surgical mortality was 7%. A patient age greater than 70 years, post-surgical haemoperitoneum, gastroenteric dehiscence, and the presence of medical complications were post-surgical mortality risk factors in the multivariate analysis. Pancreatic fistula was not a factor associated with post-surgical mortality.
ConclusionsCephalic duodenopancreatectomy is a safe technique but with a considerable morbidity. Patients over 70 years of age must be carefully selected before considering surgery. Serious medical complications must be treated aggressively to avoid an unfavourable progression.
La cirugía es el único tratamiento con impacto real sobre la supervivencia del paciente con adenocarcinoma pancreático resecable, siendo la duodenopancreatectomía cefálica (DPC) la técnica aceptada para el tratamiento de dicho tumor. A pesar de los avances en la técnica y el manejo perioperatorio, las complicaciones tras la DPC aparecen, en un 40–60% de pacientes1–4. El objetivo de este estudio es revisar los resultados obtenidos en nuestro centro en el tratamiento quirúrgico del cáncer de cabeza de páncreas, y definir las variables que influyen en la morbilidad y mortalidad postoperatoria.
Material y métodosHemos recogido la experiencia en el tratamiento del adenocarcinoma de cabeza de páncreas (ADCP) en el Hospital Universitari de Bellvitge mediante duodenopancreatectomía cefálica (DPC) desde 1991 hasta 2007. Hemos registrado de forma prospectiva los datos clínicos y quirúrgicos de todos ellos.
Manejo preoperatorioTodos los pacientes que ingresan en nuestro centro con ictericia obstructiva son estudiados por el Servicio de Cirugía General, con el fin de acelerar el diagnóstico hasta la intervención. El estudio se inicia con ecografía abdominal, seguida de tomografía computerizada helicoidal (TC), realizada por la Sección de Radiología Abdominal5. Dada la extensión temporal de la serie, la técnica del TC se ha modificado. Desde 1991 a 1994 se utilizo TC no helicoidal. Desde 1994 a 2004 se utilizo TC helicoidal de una corona. A partir de 2003 se utilizó el TC multidetector de 4, 16 y posteriormente 64 coronas. El drenaje biliar preoperatorio no se lleva a cabo de forma sistemática6 y únicamente se indica a aquellos pacientes con dudas sobre el manejo final o bien con una demora prevista de la cirugía superior a 15 días. Ni la edad avanzada del paciente ni el tamaño tumoral han sido un motivo de contraindicación para la cirugía.
Los criterios de irresecabilidad han sido la presencia de metástasis, invasión arterial (arteria mesentérica superior, arteria hepática o tronco celíaco), obliteración venosa, o invasión de otros órganos por contigüidad (excepto duodeno)7. La definición de invasión arterial ha sido la presencia de contacto directo entre el tumor y el vaso arterial, aunque no sea superior al 50%. En cuanto a la afectación venosa, se considera invasión a un contacto superior al 50% entre el tumor y el vaso, y se considera irresecable la obliteración de algún segmento del eje venoso porto-mesentérico8,9. El resto de afectaciones parietales venosas se han considerado para resección.
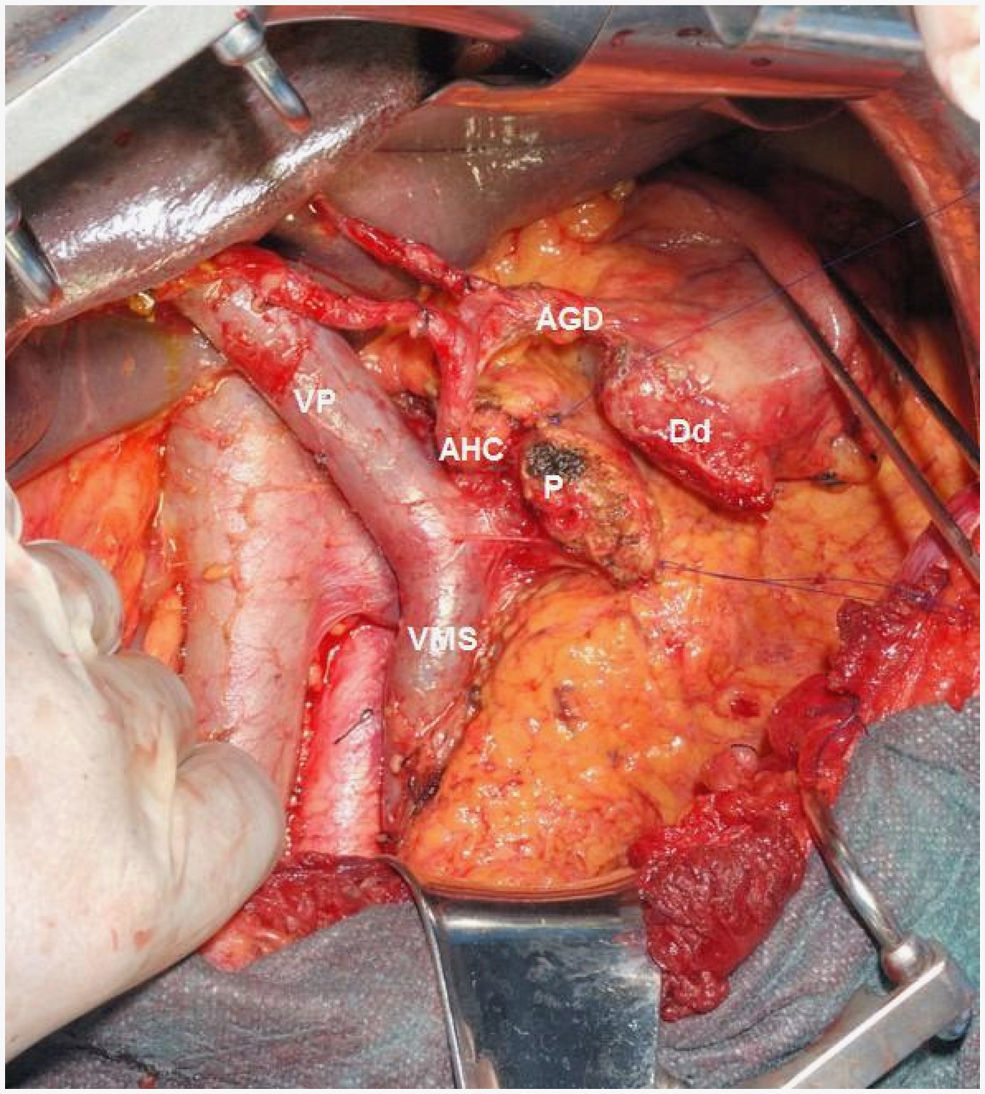
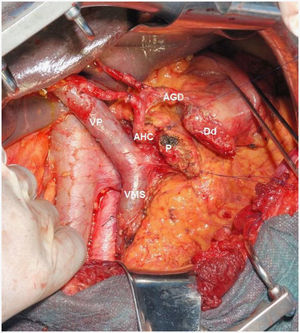
Técnica quirúrgicaLa intervención quirúrgica se inició con una exploración minuciosa y sistemática de la cavidad abdominal10. En caso de evidenciar signos de extensión de la enfermedad se realizó biopsia peroperatoria, contraindicando la resección en caso de positividad de la misma y practicando una derivación biliodigestiva11,12. Todos los pacientes fueron resecados con intención curativa, es decir extirpando la enfermedad macroscópica en el momento de la intervención. La técnica realizada fue la DPC, con una linfadenectomía estándar (tejido linfático peripancreático y periduodenal) ampliada al hilio hepático, margen derecho de arteria mesentérica superior y región preaortocava13,14. Para simplificar el estudio de los territorios de afectación ganglionar, definimos territorio local al peripancreático, y territorio regional al interaortocaval15,16. En caso de infiltración duodenal o cambios isquémicos a nivel duodenal17–20 se optó por practicar hemigastrectomía (DPCW), y en caso contrario preservación pilórica (DPCPP) (fig. 1). La reconstrucción se practicó en todos los casos con una asa intestinal única a la cual se anastomosó el páncreas, vía biliar y duodeno consecutivamente. La anastomosis pancreático-yeyunal realizada fue ducto-mucosa termino-lateral como primera elección, o bien termino-terminal introducida en caso de presentar ducto fino. Finalmente, se colocaron dos drenajes aspirativos cercanos a la anastomosis pancreático-yeyunal y uno en la anastomosis bilio-digestiva.
DefinicionesSe definió ducto pancreático fino el inferior a 3mm de diámetro, y ancho el igual o superior a 3mm21. Se definió vaciamiento gástrico lento (VGL) en aquellos pacientes con necesidad de sondaje nasogástrico superior a 10 días postoperatorios16. Se consideró fístula pancreática16,22 a la salida de líquido por drenajes con contenido rico en amilasas a partir del día 3 postoperatorio, aplicando la clasificación del grupo internacional para el estudio de fístula pancreática (ISGPF22). Se definió morbilidad postoperatoria a cualquier complicación aparecida durante el ingreso del paciente en el hospital, y mortalidad postoperatoria aquella acaecida durante dicho período23,24. Recogimos la presencia de las siguientes complicaciones: vaciamiento gástrico lento, hemoperitoneo, hemorragia digestiva alta, fístula pancreática, fístula biliar, dehiscencia gastroenteroanastomosis, infección incisional, infección respiratoria, infección urinaria, infección de catéter, absceso intraabdominal, peritonitis, pancreatitis aguda. Otras complicaciones postoperatorias no incluidas en ninguna de estas categorías fueron contabilizadas como complicaciones médicas graves para su mejor análisis estadístico. Se registraron las complicaciones como las complicaciones del sistema nervioso central, tromboembolismo pulmonar, distrés respiratorio, o infarto agudo de miocardio entre otros, de acuerdo con los conceptos definidos por el grupo ISGPF22.
Estudio estadísticoAnálisis descriptivo según medidas de tendencia central (media, mediana) y de dispersión (desviación estándar y rango intercuartílico) según criterios de normalidad (test de Kolmogorov-Smirnov). Posteriormente se realizó un estudio comparativo entre variables cualitativas según Chi-cuadrado o Fisher y variables cuantitativas según test de t de Student o U de Mann Whitney. Aquellas variables que mostraron una asociación con p-valor <0,10, y que no presentaron interacción entre ellas fueron consideradas en un modelo de regresión logística binaria siendo la variable dependiente morbilidad o mortalidad postoperatoria. Se utilizó el paquete estadístico SPSS 12.0®, y el valor estadísticamente significativo considerado fue de p-valor<0,05 en todos los casos.
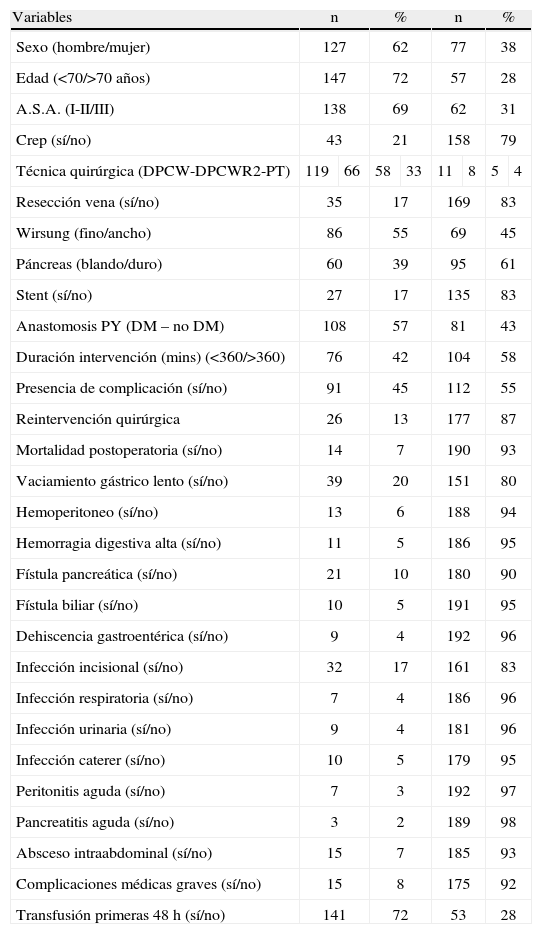
ResultadosDetalles demográficosSe realizaron 204 DPC por ADCP en nuestro centro durante el período 1991 a 2007. Todos los pacientes fueron intervenidos en nuestro centro por un grupo uniforme de cirujanos, de acuerdo con la técnica quirúrgica implantada por el líder del grupo (J. Fabregat). En cuanto a los datos demográficos, la edad de los pacientes fue superior a los 70 años en 57 casos (28%), y en su mayoría fueron hombres (62%). El estudio preoperatorio demostró que 62 (31%) presentaban algún tipo de patología de base enfermedad sistémica grave, pero no incapacitante (categoría A.S.A. III25). En cuanto al manejo preoperatorio, a 43 pacientes (21%) se les había practicado un drenaje biliar preoperatorio (tabla 1). La estancia hospitalaria postoperatoria media fue de 19 (±12) días, con un rango de 6 a 96 días.
Características de los pacientes intervenidos por adenocarcinoma de cabeza pancreática. Hospital Universitari de Bellvitge, 1991–2007
| Variables | n | % | n | % | ||||
| Sexo (hombre/mujer) | 127 | 62 | 77 | 38 | ||||
| Edad (<70/>70 años) | 147 | 72 | 57 | 28 | ||||
| A.S.A. (I-II/III) | 138 | 69 | 62 | 31 | ||||
| Crep (sí/no) | 43 | 21 | 158 | 79 | ||||
| Técnica quirúrgica (DPCW-DPCWR2-PT) | 119 | 66 | 58 | 33 | 11 | 8 | 5 | 4 |
| Resección vena (sí/no) | 35 | 17 | 169 | 83 | ||||
| Wirsung (fino/ancho) | 86 | 55 | 69 | 45 | ||||
| Páncreas (blando/duro) | 60 | 39 | 95 | 61 | ||||
| Stent (sí/no) | 27 | 17 | 135 | 83 | ||||
| Anastomosis PY (DM – no DM) | 108 | 57 | 81 | 43 | ||||
| Duración intervención (mins) (<360/>360) | 76 | 42 | 104 | 58 | ||||
| Presencia de complicación (sí/no) | 91 | 45 | 112 | 55 | ||||
| Reintervención quirúrgica | 26 | 13 | 177 | 87 | ||||
| Mortalidad postoperatoria (sí/no) | 14 | 7 | 190 | 93 | ||||
| Vaciamiento gástrico lento (sí/no) | 39 | 20 | 151 | 80 | ||||
| Hemoperitoneo (sí/no) | 13 | 6 | 188 | 94 | ||||
| Hemorragia digestiva alta (sí/no) | 11 | 5 | 186 | 95 | ||||
| Fístula pancreática (sí/no) | 21 | 10 | 180 | 90 | ||||
| Fístula biliar (sí/no) | 10 | 5 | 191 | 95 | ||||
| Dehiscencia gastroentérica (sí/no) | 9 | 4 | 192 | 96 | ||||
| Infección incisional (sí/no) | 32 | 17 | 161 | 83 | ||||
| Infección respiratoria (sí/no) | 7 | 4 | 186 | 96 | ||||
| Infección urinaria (sí/no) | 9 | 4 | 181 | 96 | ||||
| Infección caterer (sí/no) | 10 | 5 | 179 | 95 | ||||
| Peritonitis aguda (sí/no) | 7 | 3 | 192 | 97 | ||||
| Pancreatitis aguda (sí/no) | 3 | 2 | 189 | 98 | ||||
| Absceso intraabdominal (sí/no) | 15 | 7 | 185 | 93 | ||||
| Complicaciones médicas graves (sí/no) | 15 | 8 | 175 | 92 | ||||
| Transfusión primeras 48h (sí/no) | 141 | 72 | 53 | 28 | ||||
La técnica quirúrgica empleada con más frecuencia fue la resección de la cabeza del páncreas con gastrectomía en un 58% de los casos, a pesar que la preservación del píloro se llevó a cabo en 66 (33%). Se realizó resección de vena porta o VMS en 35 pacientes (17%) y la afectación del margen obligó a completar la pancreatectomía total en 8 casos (4%) (tabla 1). La resección venosa portal o de la vena mesentérica superior se llevó a cabo mediante una plastia lateral en 16, resección venosa y anastomosis término-terminal en 16 e interposición de injerto (autólogo o de cadáver) en 3. En un paciente joven se realizó resección de confluente arteria hepática-arteria gastroduodenal, así como de vena porta con interposición de sendos injertos de cadáver. En los inicios de la serie se asoció una linfadenectomía extendida (DPCWR2, resección de adenopatías en territorios tronco celíaco y lado izquierdo de Arteria Mesentérica Superior) a 11 pacientes (5%), técnica que fue abandonada posteriormente debido a la elevada morbilidad presentada.
Complicaciones postoperatoriasUn total de 91 pacientes (45%) tuvieron alguna complicación postoperatoria, siendo el VGL la más frecuente, afectando al 20% de los enfermos. Se identificó fístula pancreática en 21 casos (10%), de ellos de ellos 5 fueron tipo B y 12 del tipo C (paciente con reintervención asociada o bien exitus postoperatorio) según la clasificación de la ISGPF22. La fístula biliar se evidenció en 10 (5%) y fístula gastroentérica en 9 (4%). Las complicaciones hemorrágicas aparecieron en 13 en forma de hemoperitoneo, y en 11 casos como hemorragia digestiva alta. La complicación séptica registrada de forma más frecuente fue la infección incisional (32/17%) (tabla 1). La estancia hospitalaria postoperatoria fue superior en los pacientes con alguna complicación postoperatoria 26 vs. 13 días (p<0,001).
Se reintervinieron 26 (13%) pacientes. La indicación de la reintervención en 5 pacientes fue hemoperitoneo, en 4 abscesos intraabdominales, 2 hemorragia digestiva alta, 2 coleperitoneo, 2 por dehiscencia sutura gastroentérica, y 2 por evisceración. Por último, 9 pacientes reintervenidos presentaban fístula pancreática, en 6 se completó la pancreatectomía total, y en 3 se practicó drenaje de la fístula pancreática. Entre los pacientes reintervenidos, 8 pacientes fallecieron.
Las complicaciones médicas graves aparecieron en 15 pacientes (8%). Registramos una miscelánea de patologías, entre ellas 4 pacientes con insuficiencia cardíaca, 2 insuficiencia respiratoria aguda, 1 evisceración, 1 oclusión intestinal, 1 insuficiencia renal aguda, 1 isquemia intestinal, 1 perforación traqueal, 1 accidente vascular cerebral, 1 necrosis pared abdominal, 1 colitis isquémica, 1 arritmia cardíaca severa. 5 de estos fallecieron, por ICardíaca (2), shock séptico (2), o isquemia intestinal masiva.
En el análisis univariante de factores de riesgo de complicaciones tras la cirugía, identificamos la edad avanzada (superior a 70 años, p=0,02) y la patología de base (A.S.A III, p=0,04) como factores de riesgo. Entre los detalles intraoperatorios, la sutura pancreática sobre un ducto fino (p=0,007), una glándula pancreática blanda (p=0,002), y la realización de una sutura diferente a ducto-mucosa (p=0,05) fueron factores que implicaron una mayor complicación. En el estudio multivariante se demostró que únicamente la consistencia dura del páncreas era un factor protector de complicaciones postoperatorias (OR=0,4 (0,1–0,8)). El resto de variables de riesgo perdieron significación estadística.
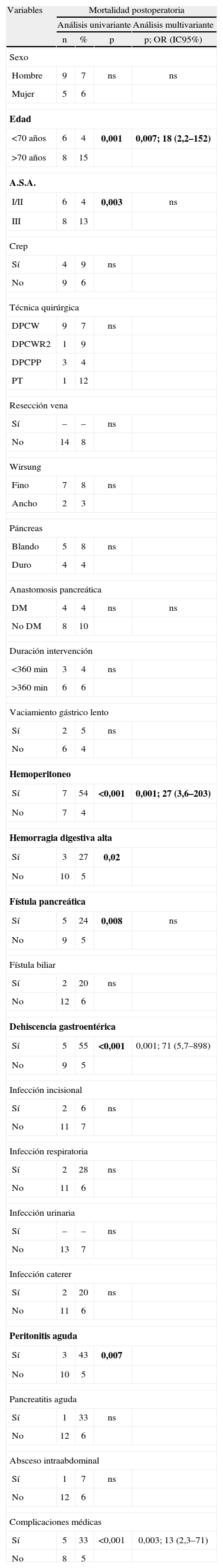
Mortalidad postoperatoriaLa mortalidad postoperatoria fue del 7% (14/204). En el estudio univariante se demostró que la edad superior a 70 años (p=0,001), la patología de base (A.S.A III, p=0,003), y la presencia de complicaciones médicas graves (p<0,001) durante el postoperatorio eran factores de riesgo de mortalidad postquirúrgica. Al realizar el estudio multivariante, se confirmó que la edad avanzada, la presencia de complicaciones médicas en el postoperatorio, así como de complicaciones quirúrgicas graves como hemoperitoneo o dehiscencia de la gastroenteroanastomosis, seguían siendo factores de riesgo de fallecer durante el postoperatorio inmediato (tabla 2).
Factores de riesgo de mortalidad postoperatoria tras duodenopancreatectomía cefálica por adenocarcinoma de cabeza de páncreas
| Variables | Mortalidad postoperatoria | |||
| Análisis univariante | Análisis multivariante | |||
| n | % | p | p; OR (IC95%) | |
| Sexo | ||||
| Hombre | 9 | 7 | ns | ns |
| Mujer | 5 | 6 | ||
| Edad | ||||
| <70 años | 6 | 4 | 0,001 | 0,007; 18 (2,2–152) |
| >70 años | 8 | 15 | ||
| A.S.A. | ||||
| I/II | 6 | 4 | 0,003 | ns |
| III | 8 | 13 | ||
| Crep | ||||
| Sí | 4 | 9 | ns | |
| No | 9 | 6 | ||
| Técnica quirúrgica | ||||
| DPCW | 9 | 7 | ns | |
| DPCWR2 | 1 | 9 | ||
| DPCPP | 3 | 4 | ||
| PT | 1 | 12 | ||
| Resección vena | ||||
| Sí | – | – | ns | |
| No | 14 | 8 | ||
| Wirsung | ||||
| Fino | 7 | 8 | ns | |
| Ancho | 2 | 3 | ||
| Páncreas | ||||
| Blando | 5 | 8 | ns | |
| Duro | 4 | 4 | ||
| Anastomosis pancreática | ||||
| DM | 4 | 4 | ns | ns |
| No DM | 8 | 10 | ||
| Duración intervención | ||||
| <360 min | 3 | 4 | ns | |
| >360 min | 6 | 6 | ||
| Vaciamiento gástrico lento | ||||
| Sí | 2 | 5 | ns | |
| No | 6 | 4 | ||
| Hemoperitoneo | ||||
| Sí | 7 | 54 | <0,001 | 0,001; 27 (3,6–203) |
| No | 7 | 4 | ||
| Hemorragia digestiva alta | ||||
| Sí | 3 | 27 | 0,02 | |
| No | 10 | 5 | ||
| Fístula pancreática | ||||
| Sí | 5 | 24 | 0,008 | ns |
| No | 9 | 5 | ||
| Fístula biliar | ||||
| Sí | 2 | 20 | ns | |
| No | 12 | 6 | ||
| Dehiscencia gastroentérica | ||||
| Sí | 5 | 55 | <0,001 | 0,001; 71 (5,7–898) |
| No | 9 | 5 | ||
| Infección incisional | ||||
| Sí | 2 | 6 | ns | |
| No | 11 | 7 | ||
| Infección respiratoria | ||||
| Sí | 2 | 28 | ns | |
| No | 11 | 6 | ||
| Infección urinaria | ||||
| Sí | – | – | ns | |
| No | 13 | 7 | ||
| Infección caterer | ||||
| Sí | 2 | 20 | ns | |
| No | 11 | 6 | ||
| Peritonitis aguda | ||||
| Sí | 3 | 43 | 0,007 | |
| No | 10 | 5 | ||
| Pancreatitis aguda | ||||
| Sí | 1 | 33 | ns | |
| No | 12 | 6 | ||
| Absceso intraabdominal | ||||
| Sí | 1 | 7 | ns | |
| No | 12 | 6 | ||
| Complicaciones médicas | ||||
| Sí | 5 | 33 | <0,001 | 0,003; 13 (2,3–71) |
| No | 8 | 5 | ||
En nuestro país, pocos centros han publicado previamente su experiencia en esta patología, siendo series con diferentes tipos de tumores del área periampular, o con menor número de pacientes26–29. La serie presentada es la experiencia nacional más extensa publicada hasta el momento en cuanto a los resultados del tratamiento quirúrgico del ADCP. El estudio actual intenta dilucidar cuáles son los factores que pueden influir en la aparición de las complicaciones postoperatorias.
Resección pancreática en mayores de 70 añosComo hemos demostrado, la edad avanzada es un factor determinante en la evolución del paciente. De hecho, un 15% de nuestros pacientes mayores de 70 años fallecen tras la cirugía, frente a un 4% de los menores de 70 años. En la literatura, existe controversia sobre la indicación de cirugía pancreática en pacientes añosos. Mientras unos grupos defienden sus resultados en pacientes de edad avanzada4,30, otros señalan los riesgos en los enfermos de más de 70 años31. Un gran número de factores pueden explicar dichas diferencias, aún por dilucidar. Tani4,30 únicamente demostró un mayor porcentaje de VGL, aunque los pacientes añosos presentaban diferencias antes de la intervención, como un nivel A.S.A. superior, menor hemoglobina y albumina. En otro estudio con grupos homogéneos en cuanto a estatus A.S.A., diagnóstico, sexo, e índice de masa corporal, Ouaissi31 pudo demostrar cómo los pacientes de más de 70 años presentaban mayor mortalidad (4 vs. 0) y morbilidad postoperatorias (56% vs. 36%), aunque sin significación estadística. Por último, Boldt32 ha demostrado recientemente en un estudio randomizado que los pacientes añosos serían más sensibles a la administración de cristaloides durante la cirugía, ya que comportaría una mayor lesión endotelial y un aumento en los marcadores de inflamación. Como vemos, el manejo intraoperatorio y la reanimación postquirúrgica en este tipo de pacientes probablemente debería ser revisado con el fin de disminuir la morbilidad postoperatoria. A pesar de nuestros hallazgos, en nuestro centro únicamente contraindicamos la cirugía en el enfermo añoso con comorbilidades asociadas.
Anastomosis gastroentéricaLa complicación más frecuente en nuestra serie ha sido el vaciamiento gástrico lento. En nuestro centro no utilizamos octeotride ni eritromicina de forma sistemática, al no haber suficiente evidencia científica que apoye su uso ni en estudios randomizados33–35 ni en metaanálisis36, e incluso se apunta que puede agravarse37. Ha habido múltiples factores demostrados como causantes de VGL. La aparición de VGL fue atribuido por algunos a la cirugía con preservación del píloro (DPCPP)38. Sin embargo, estudios posteriores bien diseñados no lo confirmaron17,39. Recientemente, un estudio randomizado ha demostrado cómo tras DPCPP, la reconstrucción de la sutura gastroentérica en posición antecólica ha sido un factor determinante para dismuir la vaciamiento gástrico lento40. En nuestro centro la utilizamos desde el año 2007, y el uso de dicha variación técnica (datos no mostrados) ha comportado una disminución del VGL.
Por último, hemos evidenciado que la dehiscencia de la sutura gastroentérica es una de las variables que se asocia a mayor mortalidad postquirúgica en el estudio multivariante. Diversos factores como los niveles de urea y creatinina previas a la intervención, y la hemorragia intraoperatoria han sido asociados a fístula gastroentérica41, lo que indica que, además de la técnica quirúrgica, el manejo perioperatorio es determinante para reducir dicha complicación.
Fístula pancreática tras duodenopancreatectomía cefálicaLa incidencia de fístula pancreática en nuestro centro es similar a otras series21,22,42, apareciendo esta en mayor porcentaje si la glándula es de consistencia blanda. Uno de los resultados sorprendentes del estudio ha sido evidenciar que la complicación más temida de la cirugía pancreática no sea un factor que agrave la mortalidad. El manejo médico y percutáneo ha evolucionado en estos años, con la aparición de nuevos materiales de drenajes quirúrgicos, la radiología intervencionista y la mejora en pautas de nutrición parenteral. De hecho, se ha demostrado una menor estancia hospitalaria y mortalidad en 129 pacientes atendidos en centros con radiología intervencionista todos ellos tras DPC43. En nuestro centro, tras la aparición de fístula pancreática realizamos lavados por los drenajes intraabdominales con el fin de evitar la persistencia de sepsis local. Con este manejo, la reintervención quirúrgica en pacientes con fístula pancreática se indicó en 9 pacientes, mientras que se evitó en 12. Finalmente, fallecieron 5 de ellos (24%). De forma similar, otros grupos han demostrado el tipo de drenaje intraabdominal también es importante en el manejo de la sutura pancreática44.
Complicaciones médicas tras la duodenopancreatectomía cefálicaEntre los 15 pacientes que presentaron algún tipo de complicación médica grave, 5 fallecieron. Las complicaciones médicas no suelen ser un motivo de estudio en las series publicadas, sin embargo en nuestro análisis hemos podido evidenciar una mortalidad del 30% en presencia de complicaciones médicas, básicamente cardiorrespiratorias y vasculares. En 2 estudios previos publicados por el Hospital Johns Hopkins y la Universidad de Zurich3,45 ya se puso de manifiesto la importancia de la cardiopatía en la cirugía pancreática. En el primer estudio publicado45, se valoró el riesgo de presentar fístula pancreática tras 1891 DPC. La coronariopatía y la consistencia blanda del páncreas fueron las dos únicas variables significativas en el estudio multivariante que comportaban un mayor riesgo de fístula pancreática. El estudio posterior3, que analizó las complicaciones postoperatorias tras 633DPC y demostró que la patología cardiovascular y la consistencia del páncreas eran los factores significativos en el estudio multivariante. En nuestra experiencia, la patología cardiovascular también es la principal complicación médica a considerar tras la cirugía. Así pues, parece claro que la patología cardiovascular es un factor a tener muy en cuenta en la valoración preoperatoria, y en especial en pacientes añosos que pudieran asociar ambos factores de riesgo.
ConclusiónLa DPC es la técnica de elección en el ADCP cefálico, con una mortalidad aceptable en centros de referencia. Sin embargo, las complicaciones posquirúrgicas aparecen casi en la mitad de pacientes. Recientemente, algunas guías clínicas han aconsejado la realización de esta cirugía únicamente en centros que practiquen más de 20DPC/año46–49, para mejorar los resultados a corto y largo plazo. A la vista de nuestros resultados, creemos que el manejo clínico preoperatorio es crucial para disminuir las complicaciones tras la cirugía. La selección de pacientes, la valoración de su situación nutricional, así como la mejoría de su función renal y cardíaca en presencia de ictericia mejorará los resultados. Los pacientes añosos deberán valorarse de forma individualizada antes de someterlos a una DPC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.