La gangrena de Fournier es una fascitis necrotizante con diseminación rápidamente progresiva que afecta la región perineal y genital. A pesar de los avances terapéuticos, puede relacionarse a un alto índice de mortalidad. El objetivo este estudio es analizar la epidemiología y la morbimortalidad de la gangrena de Fournier en nuestro centro en los últimos años.
Material y MétodosEstudio retrospectivo de 41 pacientes con diagnóstico de gangrena de Fournier tratados entre los años 1998–2007. Se analizaron datos correspondientes a edad, sexo, comorbilidad, origen, extensión, evolución, estudio microbiológico, aspectos quirúrgicos, tratamiento antibiótico y mortalidad.
ResultadosDe los 41 pacientes tratados en este periodo, el 93% fueron hombres, con edad media de 60 años. La diabetes fue el antecedente patológico más común (49%) seguido del alcoholismo (46%) y la inmunosupresión o neoplasia (34%). El origen fue perianal en el 66% de los casos, seguido del urológico (32%). El tiempo de evolución antes del diagnóstico fue 3 días (mediana). El 49% precisaron varias revisiones quirúrgicas, y la mortalidad fue del 29%. La mayoría (93%) de los cultivos fueron positivos, y en el 76% de los casos se aisló más de un microorganismo (los más frecuentemente aislados fueron enterobacterias y anaerobios). En el análisis univariado, el tratamiento antibiótico con carbapenémicos y la ausencia de complicaciones sistémicas se asociaron a menor mortalidad.
ConclusionesLa gangrena de Fournier sigue siendo una patología grave con una mortalidad elevada. El diagnóstico precoz y tratamiento quirúrgico y antibioterápico agresivos son necesarios para su adecuado tratamiento.
Fournier's gangrene is a rapidly progressing necrotizing fascitis that affects the perineal and genital area. Mortality still remains high. The aim of this study was to evaluate the epidemiological progression and morbidity-mortality of Fournier′s gangrene at our centre over the past 10 years.
MethodsRetrospective study of 41 patients treated for Fournier′s gangrene between 1998 and 2007. Variables studied included, demographic variables, aetiology, microbiology, surgical and antibiotic treatment, morbidity, and mortality.
ResultsThe mean age of the patients was 60, and 93% were male. The most common co-morbidity was diabetes (49%), followed by alcoholism (46%) and immunosuppression or neoplasia (34%). The origin was perianal in 66% of cases, followed by a urological origin (32%). The median time from the onset of symptoms to diagnosis was 3 days. Several surgical debridements were required in 49% of the patients, and the mortality rate was 29%. Most cases had positive cultures (93%), and in 76% more than one microorganism was isolated (enterobacteriaceae and anaerobic flora). In the bivariate analysis, antimicrobial treatment with carbapenems and the absence of systemic complications were associated with lower mortality.
ConclusionsFournier's gangrene continues to be a severe surgical emergency, with a high mortality rate. Early diagnosis and aggressive surgical and antibiotic therapy are necessary for adequate management.
La gangrena de Fournier (GF) es una fascitis necrotizante de etiología infecciosa que produce una gangrena genitoperineal necrosante rápidamente progresiva. El primer autor que describió la enfermedad fue Baurienne en 17641–4. A pesar de ello, no fue hasta el 1883 cuando un venereólogo francés, Jean Alfred Fournier, describe las características clínicas de la enfermedad a raíz del estudio de una serie personal de 5 casos5. Fournier atribuyó el proceso gangrenoso a una etiología idiopática, aunque en la actualidad se considera el resultado de una infección polimicrobiana con participación de aerobios y anaerobios. El proceso afecta principalmente a varones, y aunque tiene un rango de edades amplio, afecta mayoritariamente a pacientes por encima de los 50 años6.
Entre los factores de riesgo destacan la diabetes mellitus (DM), el alcoholismo crónico, las neoplasias malignas y el VIH7. Se origina en el área anorrectal o genitourinaria y se extiende con cierta frecuencia a la pared abdominal anterior. Esta progresión es consecuencia de una trombosis vascular secundaria a una endarteritis obliterante que permite a la flora microbiana normal penetrar por disección fascial a espacios previamente estériles. Las condiciones de baja presión de oxígeno, limitado aporte vascular y sobrecrecimiento bacteriano conducen a la producción de hidrógeno y nitrógeno por parte de microorganismos anaerobios que se acumula en el tejido subcutáneo, traduciéndose clínicamente en crepitación de los territorios afectos8.
Esto se traduce clínicamente en una sepsis grave en la gran mayoría de los casos, y a pesar de los avances terapéuticos en los últimos años, la mortalidad se sitúa entre 3–67% según las series publicadas9.
El objetivo del presente estudio fue analizar las características clínicas y epidemiológicas de los pacientes con GF y comparar nuestros resultados con las series publicadas previamente. El objetivo secundario fue determinar los factores relacionados con la mortalidad en estos pacientes.
Material y métodosEn el presente estudio se han incluido de forma retrospectiva todos los pacientes con GF tratados en el Hospital Universitario de Bellvitge, hospital de tercer nivel de atención a adultos, por el Servicio de Cirugía General y Digestiva o el Servicio de Urología entre los años 1998–2007.
El diagnóstico de GF se realizó a partir de la historia clínica, exploración física, pruebas de imagen y hallazgos intraoperatorios basándose en los siguientes criterios, modificados de Kuo et al10: 1) infección de tejidos y partes blandes con afectación de la zona escrotoperineal o perianal; 2) presencia de aire infiltrando el tejido subcutáneo demostrado en exploración física o como hallazgo radiológico; 3) hallazgos quirúrgicos de tejido gangrenado y necrótico; 4) fascitis necrotizante comprobada histopatológicamente.
Se recogieron datos correspondientes a edad, sexo, comorbilidad, origen, extensión, evolución, estudio microbiológico, aspectos quirúrgicos, tratamiento antibiótico, morbilidad postoperatoria y mortalidad durante el ingreso hospitalario.
El análisis descriptivo de los datos se muestra en media o mediana (variables continuas) o en porcentaje (categóricas). Dado el tamaño de la muestra, para la comparación de las variables potencialmente relacionadas con la mortalidad entre los dos grupos (vivos y muertos) se utilizaron tests no paramétricos (U Mann-Whitney para variables continuas y Fisher para categóricas). El análisis multivariado se realizó con las variables estadísticamente significativas en el bivariado y se ajustó por edad, enfermedad de base y sexo, utilizando un método de regresión por pasos. Todos los análisis se realizaron mediante el paquete estadístico SPSS versión 15.0. Para todos los análisis, la significación estadística se estableció en p<0,05.
ResultadosUn total de 41 pacientes fueron diagnosticados y tratados en el Hospital Universitario de Bellvitge por el Servicio de Cirugía General y Digestiva y el Servicio de Urología entre los años 1998–2007. De los 41 pacientes, 38 (93%) fueron hombres. La edad mediana fue de 60 años (rango: 19–78).
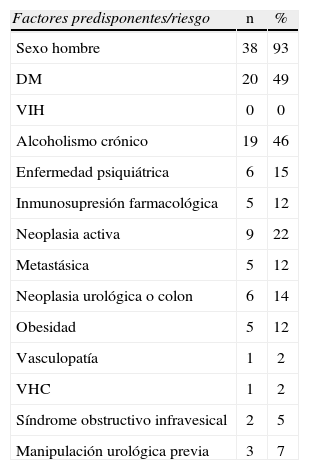
Un total de 20 pacientes eran diabéticos (49%), siendo el antecedente patológico más común en esta serie, seguido del alcoholismo activo (46%). Los datos demográficos y comorbilidades se pueden observar en la tabla 1.
Datos demográficos y comorbilidades (N=41)
| Factores predisponentes/riesgo | n | % |
| Sexo hombre | 38 | 93 |
| DM | 20 | 49 |
| VIH | 0 | 0 |
| Alcoholismo crónico | 19 | 46 |
| Enfermedad psiquiátrica | 6 | 15 |
| Inmunosupresión farmacológica | 5 | 12 |
| Neoplasia activa | 9 | 22 |
| Metastásica | 5 | 12 |
| Neoplasia urológica o colon | 6 | 14 |
| Obesidad | 5 | 12 |
| Vasculopatía | 1 | 2 |
| VHC | 1 | 2 |
| Síndrome obstructivo infravesical | 2 | 5 |
| Manipulación urológica previa | 3 | 7 |
El origen de la infección fue perianal en 27 de los casos (66%), urológico en 13 (32%) y ginecológico en 1 (2%).
En 8 pacientes (20%) se realizaron exploraciones radiológicas para delimitar la extensión del proceso. En 6 pacientes se realizó una TC y en 2, ecografía.
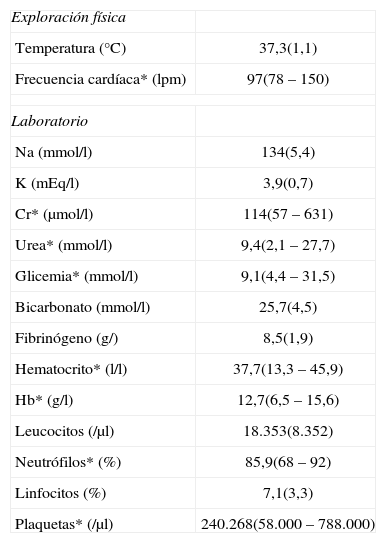
El tiempo de evolución mediano fue de 3 días (1–15 días), presentando demora diagnóstica (definida como visita previa a un servicio de urgencias) 14 de los pacientes (34%). Los datos de exploración física y de laboratorio se pueden observar en la tabla 2.
Exploración física y laboratorio (N=41)
| Exploración física | |
| Temperatura (°C) | 37,3(1,1) |
| Frecuencia cardíaca* (lpm) | 97(78–150) |
| Laboratorio | |
| Na (mmol/l) | 134(5,4) |
| K (mEq/l) | 3,9(0,7) |
| Cr* (μmol/l) | 114(57–631) |
| Urea* (mmol/l) | 9,4(2,1–27,7) |
| Glicemia* (mmol/l) | 9,1(4,4–31,5) |
| Bicarbonato (mmol/l) | 25,7(4,5) |
| Fibrinógeno (g/) | 8,5(1,9) |
| Hematocrito* (l/l) | 37,7(13,3–45,9) |
| Hb* (g/l) | 12,7(6,5–15,6) |
| Leucocitos (/μl) | 18.353(8.352) |
| Neutrófilos* (%) | 85,9(68–92) |
| Linfocitos (%) | 7,1(3,3) |
| Plaquetas* (/μl) | 240.268(58.000–788.000) |
Todos los valores se expresan en media (DE) excepto las variables marcadas con * que se expresan en mediana (rango).
La estancia mediana correspondió a 18 días (1–64 días). Un total de 26 pacientes (68%) requirió ingreso en unidad de cuidados intensivos por un tiempo superior a 24h, siendo la estancia mediana de 5,5 días en dicha unidad (2–62 días).
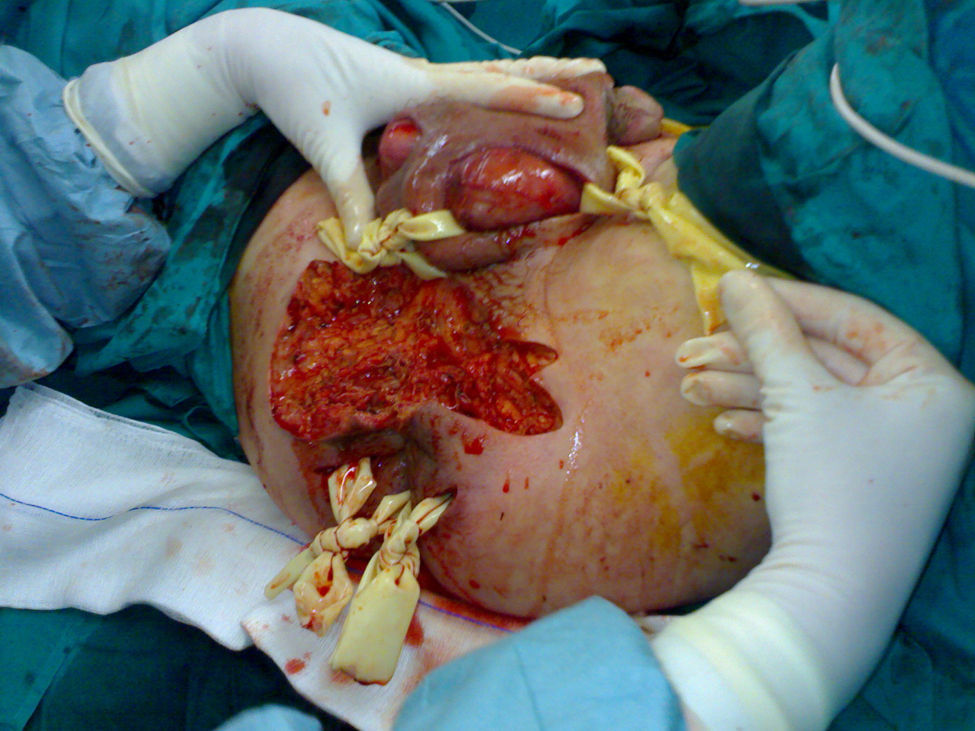
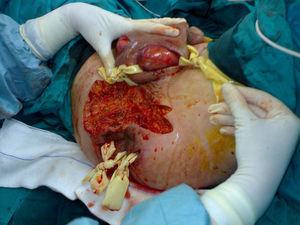
Todos los pacientes del presente estudio fueron tratados con desbridamiento quirúrgico amplio, antibioterapia de amplio espectro y cura tópica de la herida durante el ingreso (fig. 1). Veinte de los pacientes (49%) requirieron reintervención quirúrgica, principalmente en las primeras 96h (50%). Cinco pacientes (12%) precisaron de una tercera intervención quirúrgica. Se requirió la realización de estoma intestinal en un 37% de los casos. De un total de 15 colostomías, la etiología de la GF era perianal en 12 de los pacientes (80%) y urológico en los 3 restantes (20%). Tres pacientes con colostomía fallecieron en el postoperatorio.
Se realizó asimismo cistostomía suprapúbica en un 22%, orquiectomía en 5% y falectomía en un 2%.
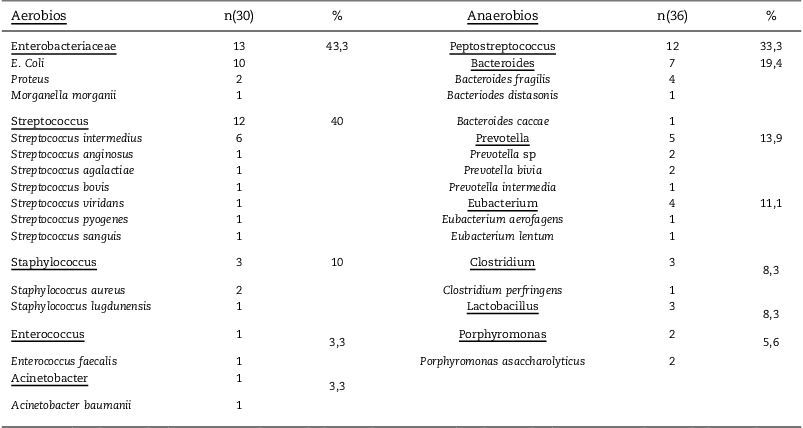
En 38 de los 41 casos los cultivos recogidos durante la cirugía fueron positivos y en la mayoría (76%) se aislaron 2 o más microorganismos. Por grupos, los microorganismos anaerobios de cualquier tipo fueron los más frecuentemente aislados (63%), seguidos de las enterobacterias (32%) y los cultivos polimicrobianos sin predominio de ningún microorganismo en especial (29%). Exceptuando los anaerobios, la especie más frecuentemente aislada es E. coli. Organismos potencialmente resistentes, como Acinetobacter spp., S. aureus resistente a meticilina y Enterococcus spp. se aislaron con poca frecuencia (tabla 3). La mayor parte de pacientes recibieron tratamiento antibiótico empírico en monoterapia con agentes de amplio espectro, siendo los carbapenémicos la elección más frecuente (61%), seguido de los betalactámicos con inhibidores de betalactamasa (22%).
Microbiología (N=41)
| Aerobios | n(30) | % | Anaerobios | n(36) | % |
| Enterobacteriaceae | 13 | 43,3 | Peptostreptococcus | 12 | 33,3 |
| E. Coli | 10 | Bacteroides | 7 | 19,4 | |
| Proteus | 2 | Bacteroides fragilis | 4 | ||
| Morganella morganii | 1 | Bacteriodes distasonis | 1 | ||
| Streptococcus | 12 | 40 | Bacteroides caccae | 1 | |
| Streptococcus intermedius | 6 | Prevotella | 5 | 13,9 | |
| Streptococcus anginosus | 1 | Prevotella sp | 2 | ||
| Streptococcus agalactiae | 1 | Prevotella bivia | 2 | ||
| Streptococcus bovis | 1 | Prevotella intermedia | 1 | ||
| Streptococcus viridans | 1 | Eubacterium | 4 | 11,1 | |
| Streptococcus pyogenes | 1 | Eubacterium aerofagens | 1 | ||
| Streptococcus sanguis | 1 | Eubacterium lentum | 1 | ||
| Staphylococcus | 3 | 10 | Clostridium | 3 | 8,3 |
| Staphylococcus aureus | 2 | Clostridium perfringens | 1 | ||
| Staphylococcus lugdunensis | 1 | Lactobacillus | 3 | 8,3 | |
| Enterococcus | 1 | 3,3 | Porphyromonas | 2 | 5,6 |
| Enterococcus faecalis | 1 | Porphyromonas asaccharolyticus | 2 | ||
| Acinetobacter | 1 | 3,3 | |||
| Acinetobacter baumanii | 1 | ||||
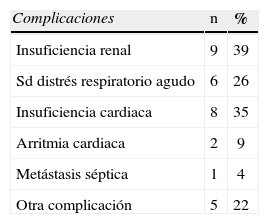
Se presentaron complicaciones postoperatorias en el 56% de los pacientes (tabla 4). A pesar de tratamiento quirúrgico y antibioterápico agresivos, el 29% de los pacientes murieron durante el ingreso. Al comparar el grupo de supervivientes (n=29) con el grupo de pacientes que murieron (n=12), las únicas variables relacionadas con mayor mortalidad de forma significativa en el análisis bivariante fueron la presencia de alguna complicación (38% frente a 75%; p=0,03), tratamiento con carbapenémicos (72% frente a 33%; p=0,03), hematocrito (mediana 38 frente a mediana 32; p=0,006) y temperatura (media=37,5°C frente a 36,8°C; p=0,041). La necesidad de estoma no se relacionó de forma significativa con la mortalidad. El análisis de regresión logística no identificó ningún factor independientemente asociado a la mortalidad en los pacientes con GF.
DiscusiónExisten una serie de trastornos sistémicos subyacentes que se han identificado con frecuencia en la GF y, en algunas series, se han relacionado con la mortalidad9,11,12. En todos ellos, existe una disminución de la inmunidad celular del huésped que condiciona al desarrollo de la infección. Entre ellos, conviene destacar la DM (20–70%). La mayoría de autores consideran la DM como un factor de riesgo, pero existe cierta discrepancia en si se asocia a mayor mortalidad. Según Nisbet, la diabetes es un factor de riesgo para la aparición de GF, pero no afecta el pronóstico11. En contraposición, Yanar no encontró mayores tasas de mortalidad entre los pacientes diabéticos12. En nuestra serie, la diabetes aparece como patología de base en el 49% de los pacientes, dato que coincide con la literatura, pero no se ha encontrado relacionado significativamente con la mortalidad.
El alcoholismo crónico se describe con una frecuencia de 4–66% como factor de riesgo de GF, y se ha asociado a un peor pronóstico, especialmente en aquellos pacientes que presentan simultáneamente DM13. También en nuestra serie hemos detectado un alto porcentaje de alcoholismo crónico (46%).
Otros factores asociados incluyen el trasplante de órganos14,15, tratamientos antineoplásicos16–18, VIH19,20 y enfermedades gastrointestinales7.
Laor et al21 establecieron un índice pronóstico, el FGSI (Fournier's Gangrene Severity Index), para determinar la severidad y pronóstico de la enfermedad en sus pacientes. Este índice fue validado posteriormente por Yeniyol y Tuncel22,23 Los parámetros utilizados en el FGSI son: temperatura, frecuencia cardiaca, frecuencia respiratoria, sodio sérico, potasio, niveles de creatinina, niveles de bicarbonato séricos, hematocrito y recuento leucocitario. En nuestra serie únicamente se ha conseguido relacionar la temperatura y el hematocrito con la mortalidad.
En los casos más dudosos puede ser de gran utilidad la realización de técnicas de diagnóstico por la imagen. La radiología simple de abdomen puede poner de manifiesto la presencia de gas en el tejido subcutáneo, pero exploraciones como la ecografía de partes blandas y la TC tienen gran sensibilidad para la detección de dicho fenómeno24. La ecografía de partes blandas es de gran utilidad en fases iniciales de la enfermedad, pudiendo detectar un engrosamiento de la pared escrotal y la existencia de gas subcutáneo. No obstante, existe una alta tasa de falsos negativos (10–21%)25–27.
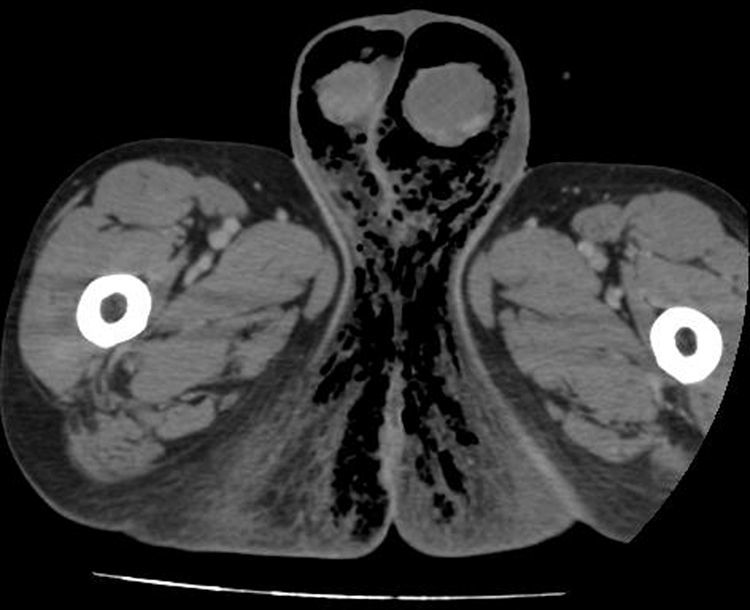
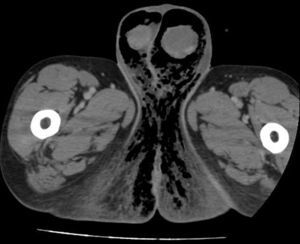
La TC/RM también resulta de utilidad en el diagnóstico precoz de GF objetivando la presencia de gas en el tejido subcutáneo, engrosamiento de la pared escrotal e indemnidad de testículos y epidídimos (fig. 2). Puede informar asimismo de la causa y resulta de gran utilidad para delimitar la extensión del proceso28,29. En la presente serie, no se consideró necesaria la utilización de estas pruebas en una mayoría de los casos, pues la historia clínica y hallazgos exploratorios compatibles fueron suficientes para realizar el diagnóstico de GF y decidir la intervención quirúrgica.
En la actualidad se considera que la GF habitualmente es una infección polimicrobiana6,7, con participación sinérgica de gérmenes aerobios y anaerobios. La mayoría de los gérmenes aislados en los cultivos suelen formar parte de la flora habitual, pero en combinación con factores locales y sistémicos pueden adquirir gran virulencia. El papel de los microorganismos anaerobios en la GF en ocasiones se pone de manifiesto por un mal olor característico, que se considera patognomónico de su participación6. No obstante, en muchas ocasiones no es posible demostrarla mediante los cultivos (el inadecuado procesamiento de las muestras y los requerimientos nutricionales más estrictos son las causas habituales de ello)30. A diferencia de la mayor parte de series publicadas, en nuestra serie se han identificado en la mayoría de los casos participación por anaerobios.
Una parte fundamental del tratamiento de GF son las medidas generales de soporte. Es necesaria una rápida estabilización hemodinámica, corrección del shock distributivo, corrección de las alteraciones hidroelecrolíticas y un aporte energético que confiera un estado nutricional adecuado durante todo el proceso31.
Dada la gravedad del cuadro clínico y la rápida progresión de la enfermedad debe realizarse la exploración quirúrgica con la máxima celeridad, realizando un desbridamiento radical de todas las áreas necróticas afectas. Se deben realizar incisiones amplias a través de la piel y los tejidos subcutáneos que deben superar las áreas comprometidas hasta hallar fascia normal8,13,32. Se realizan lavados abundantes de la zona desbridada y se deja la herida abierta. Si existe persistencia de áreas afectas por necrosis pasadas 24–48h debe indicarse un segundo procedimiento quirúrgico, similar a lo observado en nuestra serie.
En casos seleccionados se precisará asimismo de derivaciones intestinales o de la vía urinaria. Cuando se sospeche que la causa es un traumatismo uretral o existe extravasación de orina está indicada la realización de una cistostomía suprapúbica con el fin de evitar un cateterismo vesical retrógrado32. La realización de una colostomía se reserva para los casos en que se objetiva una perforación rectal o colónica o la afectación del esfínter anal durante el acto quirúrgico8,13,32,33. Aunque existen discrepancias, se puede considerar la derivación intestinal para evitar la contaminación fecal de la herida operatoria34. En nuestro centro, la indicación para realizar un estoma fue a criterio del cirujano. De todos los pacientes con colostomía, el motivo de realización de la misma fue la afectación rectal o del esfínter anal por necrosis.
La necesidad de realización de falectomías u orquiectomías es excepcional porque el pene y los testículos poseen su propia irrigación sanguínea independiente de la circulación comprometidas de la fascia y la piel del escroto34. A pesar de esto, 2 de nuestros pacientes requirieron orquiectomía y un paciente, falectomía.
Se han descrito otras terapias adyuvantes como la aplicación local de miel, terapia VAC, y la oxigenoterapia con cámara hiperbárica en caso de infecciones causadas por Clostridium, en algunas series asociado a estoma en casos seleccionados, con resultados prometedores34,36. En nuestro centro durante el periodo de estudio no se dispuso de estas modalidades de tratamiento complementario.
La terapia con antibióticos debe realizarse de forma empírica por vía parenteral, con antibióticos con cobertura amplia para cocos gram-positivos, bacilos gram-negativos y anaerobios. Una pauta clásica consiste en el uso de la triple cura con: a) cefalosporina de tercera generación o aminoglucósido para cobertura frente gram-negativos; b) penicilina benzatínica o amoxicilina para especies de estreptococo; c) metronidazol o la clindamicina para anerobios35. Estudios recientes aconsejan la administración de cefalosporinas de tercera generación y metronidazol, pudiéndose añadir gentamicina23,36. Igualmente eficaz, pero más sencillo de administrar, es la monoterapia con carbapenémicos (imipenem, meropenem, ertapenem) o betalactámicos de amplio espectro de la familia de las ureidopenicilinas (piperacilina-tazobactam)31.
En nuestro centro, el tratamiento antibiótico empírico fue adecuado, teniendo en cuenta los microorganismos posteriormente aislados, en un 86% de los casos. La falta de adecuación de la terapia antibiótica empírica fue condicionada por la presencia de gérmenes multirresistentes tales como Staphylococcus aureus resistentes a meticilina y Acinetobacter baumanii. Aunque hemos observado una menor mortalidad asociada al tratamiento con carbapenémicos, no se ha podido confirmar como factor independientemente asociado a la mortalidad.
ConclusionesEn los últimos 10 años, en nuestro centro, la GF se ha presentado como una patología grave con una mortalidad elevada. La alta sospecha diagnóstica y reconocimiento precoz, el tratamiento quirúrgico y antibioterápico agresivos siguen siendo necesarios para su adecuado tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.