La resección de tumores hepáticos del lóbulo izquierdo anatómico suele ser una técnica sencilla, tanto la seccionectomía lateral izquierda (SLI) como la segmentectomía II ó III. Nuestro objetivo es presentar los resultados del abordaje laparoscópico y plantear si podría ser el “técnica ideal” en las unidades de cirugía hepática con experiencia en cirugía hepática laparoscópica (CHL).
Pacientes y métodoPresentamos 18 pacientes con resección de tumores sólidos del lóbulo izquierdo anatómico por CHL: 10 casos con SLI y 8 casos con segmentectomía II ó III. Realizamos un estudio comparativo con un grupo control de 18 pacientes intervenidos con la misma técnica quirúrgica por cirugía abierta.
ResultadosNo hubo mortalidad en ninguno de los 2 grupos (n=36). La morbilidad fue similar (5.5% por grupo). Para la SLI, el grupo CHL (n=10) presentó menor estancia hospitalaria (p=0.005) y menor tiempo quirúrgico (141 vs 159min) (diferencias no e.s), que el grupo de CA. Para las resecciones segmentarias II ó III, el grupo CHL (n=8) presentó mayor empleo de la maniobra de Pringle (p=0.05), mayor tiempo quirúrgico (p=0.05) y una estancia hospitalaria inferior (4.8 vs 5.6 días) (diferencias no e.s), que el grupo de CA.
ConclusionesLa SLI debe realizarse por laparoscopia en centros que tengan experiencia debido a una menor estancia hospitalaria y un menor tiempo quirúrgico que la realizada por CA, con la misma morbimortalidad. Las resecciones segmentarias II ó III realizadas por laparoscopia, aunque tienen menor estancia hospitalaria, presentan un mayor tiempo quirúrgico, por lo que las ventajas no son tan evidentes como para la SLI.
The resection of tumours of the anatomical left lobe is normally straightforward using either left lateral sectionectomy (LLSEC) or segmentectomy II or III. Our objective is to present the results of the laparoscopic approach and to consider whether this could be the “ideal technique” in liver surgery units where the surgeons have experience of laparoscopic liver surgery (LLSURG).
Patients and methodsWe have studied patients with resected solid tumours of the anatomical left lobe using LLSURG (n=18): 10 cases with LLSEC and 8 cases with segmentectomy II or III. We carried out a comparative study with a control group of 18 patients operated on using the same surgical technique using open surgery (OS).
ResultsThere were no cases of mortality in either of the 2 groups (n=36). Morbidity was similar (5.5% per group). For LLSEC, the LLSURG group (n=10) had a shorter hospital stay (p=0.005) and less surgical time (141 vs. 159min) (differences not significant.), than the OS group. For segmentary resections II or III, in the LLSURG group (n=8) there was greater use of the Pringle manoeuvre (p=0.05), greater surgical time (p=0.05) and a shorter hospital stay (4.8 vs. 5.6 days) (differences not significant), than in the OS group.
ConclusionsLLSEC should be carried out by laparoscopy in centres where they have considerable experience. The patients may have a shorter hospital stay and spend less time in surgery than when OS is performed, with the same morbidity and mortality rates. Segmentectomy resections II or III carried out by laparoscopy involve a shorter hospital stay but longer surgery time and therefore the advantages are not as evident as they are for LLSEC.
El desarrollo de los medios tecnológicos y la experiencia de los equipos quirúrgicos en cirugía hepática laparoscópica (CHL) ha permitido realizar resecciones hepáticas lobares derechas e izquierdas1–3 en tumores hepáticos sólidos (THS). Incluso ha permitido a algunos grupos realizar hepatectomías para el trasplante hepático de donante vivo4–6.
Debido a la disposición anatómica de los pedículos portales de los segmentos II y III y de la vena suprahepática izquierda (VSHI), la seccionectomía lateral izquierda (SLI) fue la primera resección reglada en realizarse por laparoscopia7, ya que es una técnica sencilla por cirugía abierta (CA). La técnica se ha visto favorecida por la incorporación de las endostapler para la sección de elementos vasculares8–11.
Aunque algunos autores propugnan la realización de una SLI en todos los casos de tumores en estos segmentos12, existen situaciones en las que es necesario realizar solo una segmentectomía II ó III, bien por tratarse de tumores benignos o bien por tener que ahorrar parénquima hepático (resección de metástasis hepáticas –MH– para reservar parénquima para futuras re-resecciones, resección de MH del lóbulo izquierdo como primer tiempo de la resección en 2 tiempos, etc.).
En este momento, dada la sencillez con la que se realiza la CHL de THS del lóbulo izquierdo, planteamos que el abordaje laparoscópico podría ser el “técnica ideal” en las unidades de cirugía hepática que tengan experiencia en CHL. Para comprobar este planteamiento presentamos los pacientes con SLI y las resecciones segmentarias II y III realizadas por CHL y comparamos los resultados con un grupo control de pacientes intervenidos con la misma técnica quirúrgica por CA.
Pacientes y métodoEntre Enero 1996–Julio 2008 hemos realizado 515 resecciones hepáticas (RH). En Enero de 2003, comenzamos una evaluación prospectiva de pacientes para CHL, habiendo realizado 57 RH, de los cuales 18 tenían THS en lóbulo izquierdo (segmentos II y III de Couinaud): en 10 casos realizamos una SLI (segmentos II–III) y en 8 realizamos resección laparoscópica segmentaria (5 del segmento III y 3 del segmento II). Dos de estos 8 casos de resección laparoscópica segmentaria se realizaron como primer tiempo de la RH en 2 tiempos quirúrgicos de MH de carcinoma colorrectal (MHCCR). La edad media fue de 62 años (rango 38–78) y 12 fueron varones (66%). El 11% (2 casos) fueron tumores benignos (1 adenoma de 5cm en segmento II y un hemangioma de 6cm en segmento III), y 16 fueron malignos (89%), la mayoría (14 casos) fueron MHCCR, 1 paciente tenía un hepatocarcinoma de 8cm próximo a la VSHI, y el restante fue un leiomiosarcoma primario de 7cm localizado en segmento III, próximo a ramas portales del segmento IV (el tamaño tumoral superior a 5cm no fue una limitación para indicar resección laparoscópica). La media de lesiones fue de 2 (rango 1–4) y el tamaño tumoral fue de 4cm (rango 2–8cm).
Técnica quirúrgicaSe empleó la cirugía laparoscópica asistida con la mano (CLAM), en los 16 pacientes con tumores malignos por ser tumores grandes y localizados junto a grandes vasos y se empleó la CTL en el adenoma hepático y hemangioma. La técnica quirúrgica de la CTL y de la CLAM1,13,14 se presenta someramente.
- 1.
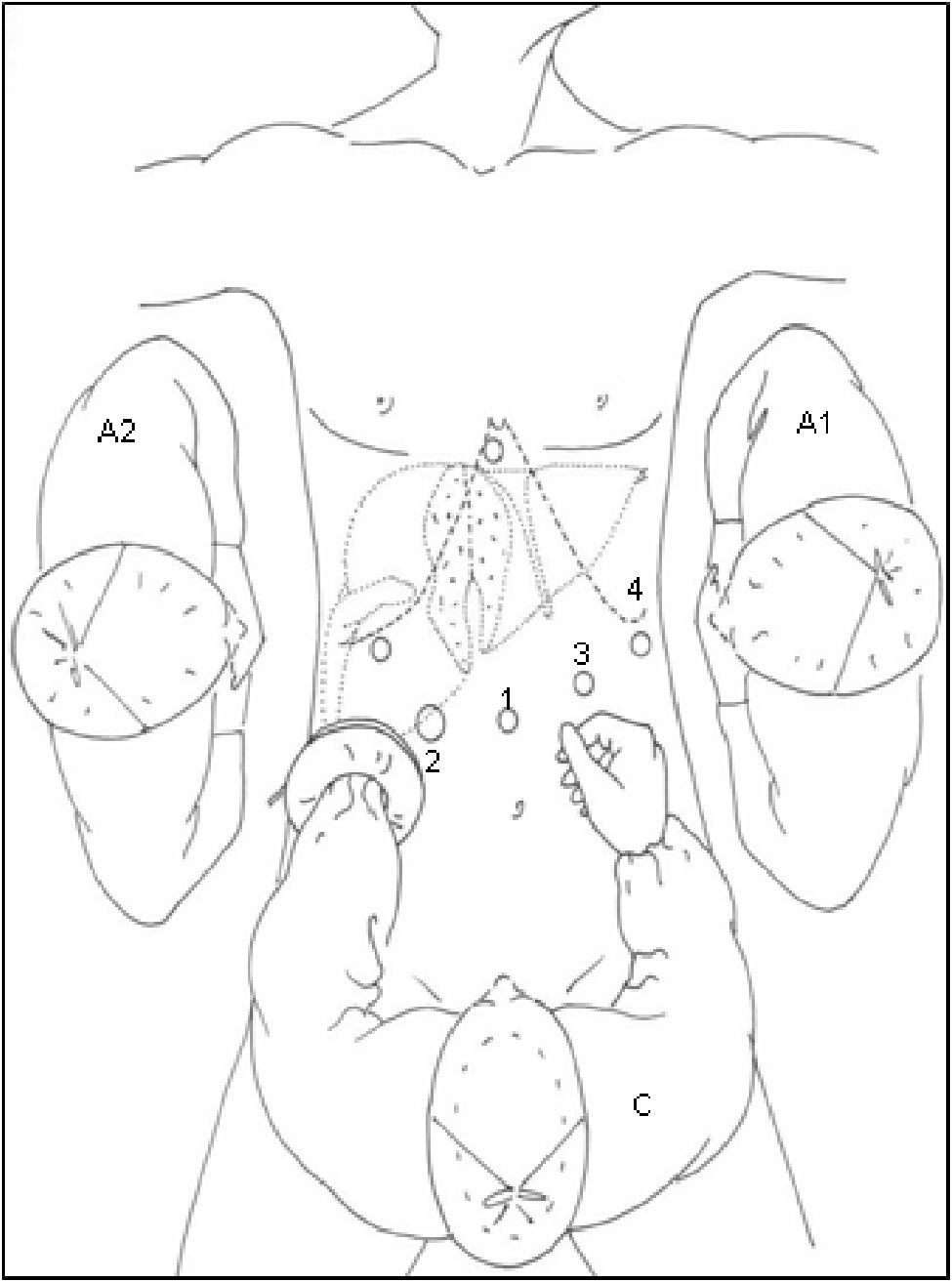
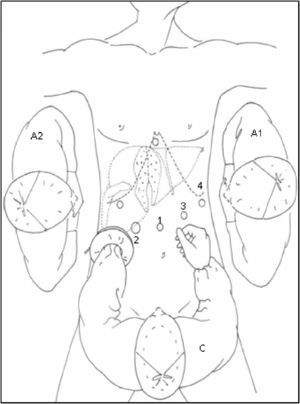
Posición del paciente y colocación de trócares: En 2 casos se empleó CTL para realizar una resección segmentaria: el paciente se coloca en decúbito supino y el cirujano se sitúa entre las piernas. El primer ayudante a la izquierda del paciente, estando el segundo ayudante a la derecha del mismo empleando para ello un segundo monitor. Se utilizaron 5 trócares, 4 de ellos siguiendo una línea cóncava a la lesión y uno en epigastrio (fig. 1). Tras la creación del neumoperitoneo (12mmHg de CO2), se coloca un trócar de 10mm a nivel umbilical para la introducción de la óptica, un segundo trócar de 10mm a la izquierda del trócar umbilical y un tercero de 12mm a la derecha. El 4° trócar se coloca en flanco izquierdo, línea axilar media, para introducir el clamp que realice la maniobra de Pringle; y el restante subxifoideo para introducir pinzas de separación hepática. A continuación se realiza ecografía intraoperatoria laparoscópica, introducida por trócar de 12mm. Tras la movilización necesaria del lóbulo izquierdo se realiza sección del epiplon menor para control del pedículo hepático y posterior oclusión del hilio hepático, si fuese necesario.
En 16 casos se empleó la CLAM descrita en nuestra Unidad14: la colocación del paciente y de los ayudantes es idéntica a la CTL. Se inicia la intervención realizando una incisión transversa en flanco derecho desde la linea axilar media a la linea axilar anterior. Se liberan adherencias de cirugía previa y se introduce el hand-port. Con la mano izquierda del cirujano dentro del abdomen, se introduce un trócar de 10mm en una zona libre de adherencias, y se crea el neumoperitoneo, procediendo a continuación con la colocación de los 4 trócares restantes, con la misma localización y función que en la CTL (figs. 2 y 3). Posteriormente, se realiza ecografía con sonda abdominal (Entos®, CT8, Phillips) ) introducida por hand-port®.
- 2.
Técnica quirúrgica de la segmentectomía II ó III: En el caso de la segmentectomía III, no se realiza sección de ningún ligamento de anclaje. En el caso de la segmentectomía II, sí es necesaria la movilización de estos ligamentos. La sección del parénquima se realiza con bisturí armónico (Ethicon®) o con Ligasure® de 10mm (Tyco©). En el caso de la segmentectomía II, la sección de la vena suprahepática izquierda se realiza con endostapler. Una vez completada la hepatectomía se retira el clamp que ocluye el pedículo hepático y, si es necesario, se completa la hemostasia con Tissuelink® (Primm©), se suturan las posibles fugas biliares existentes y se aplica Tachosil® (Nycomed©) en el lecho quirúrgico. La colocación del drenaje se realiza selectivamente. En caso de la CTL, al no existir adherencias, la pieza quirúrgica se extrae mediante incisión de Pfannestiel; y en el caso de pacientes intervenidos de MHCCR, se procede a la extracción de la pieza sin fragmentar a través de la incisión del flanco derecho para el hand-port.
- 3.
Técnica de la SLI: Se realiza sección del ligamento redondo lo más alto posible para que no interfiera con la visión y a continuación se secciona el ligamento falciforme. Posteriormente, se secciona ligamento triangular y coronario izquierdo hasta llegar a identificar la VSHI, sin rodearla. Se inicia sección del parénquima, con Ligasure® de 10mm, a la izquierda del ligamento redondo hasta identificar el pedículo del segmento II, que se secciona con endostapler. Se continúa la sección del parénquima con Ligasure hasta idenficar la rama portal del segmento III, que también se secciona con endogía. La sección del parénquima restante, hasta la VSHI se realiza con Ligasure de 10mm, hasta finalmente, seccionar la VSHI con endostapler. Se completa la hemostasia y se acaba la intervención como se ha descrito en las segmentectomías.
Para SLI laparoscópica, se seleccionaron los pacientes con tumores localizados en segmentos II, III ó centrales, que aunque tuviesen más de 5cm, no tuvieran invasión vascular quedando los pedículos vasculares libres. Para la segmentectomías II ó III laparoscópicas, se seleccionaron los pacientes con tumores periféricos en segmentos II ó III, con un tamaño inferior a 5cm. En nuestra Unidad14, indicamos CLAM en el caso de MHCCR para una mejor estadificación (14 casos), en tumores grandes y en los próximos a grandes vasos (2 casos).
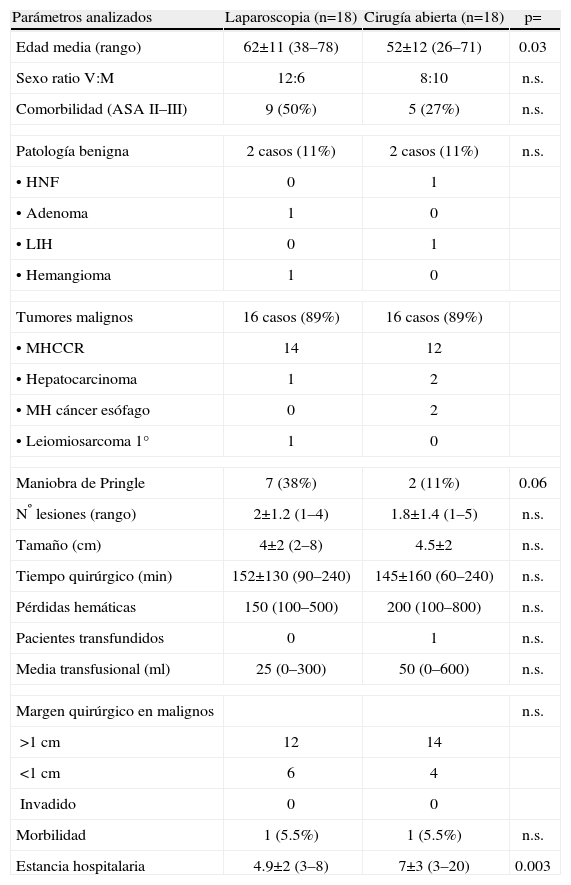
Grupo control (tabla 1)Constituido por 18 pacientes intervenidos por cirugía abierta (CA) con la misma técnica quirúrgica (10 seccionectomías II–III y 8 segmentectomías del S. II y III), elegidos al azar entre 36 pacientes intervenidos entre 2000 y 2008. Aunque los datos se recogieron de forma prospectiva según la base de datos de tumores hepáticos, el estudio no fue randomizado dado que la curva de aprendizaje de la CHL es muy dificultosa. 16 pacientes tenían patología maligna y 2 fueron tumores benignos. En CA realizamos siempre incisión subcostal bilateral y como método de sección de parénquima empleamos bisturí ultrasónico y de argón para la sección del parénquima y endostapler vasculares para la sección de los pedículos vasculares.
Resección de tumores hepáticos sólidos localizado en lóbulo hepático izquierdo por cirugía laparoscópica (n=18) y por cirugía abierta (n=18)
| Parámetros analizados | Laparoscopia (n=18) | Cirugía abierta (n=18) | p= |
| Edad media (rango) | 62±11 (38–78) | 52±12 (26–71) | 0.03 |
| Sexo ratio V:M | 12:6 | 8:10 | n.s. |
| Comorbilidad (ASA II–III) | 9 (50%) | 5 (27%) | n.s. |
| Patología benigna | 2 casos (11%) | 2 casos (11%) | n.s. |
| •HNF | 0 | 1 | |
| •Adenoma | 1 | 0 | |
| •LIH | 0 | 1 | |
| •Hemangioma | 1 | 0 | |
| Tumores malignos | 16 casos (89%) | 16 casos (89%) | |
| •MHCCR | 14 | 12 | |
| •Hepatocarcinoma | 1 | 2 | |
| •MH cáncer esófago | 0 | 2 | |
| •Leiomiosarcoma 1° | 1 | 0 | |
| Maniobra de Pringle | 7 (38%) | 2 (11%) | 0.06 |
| Nº lesiones (rango) | 2±1.2 (1–4) | 1.8±1.4 (1–5) | n.s. |
| Tamaño (cm) | 4±2 (2–8) | 4.5±2 | n.s. |
| Tiempo quirúrgico (min) | 152±130 (90–240) | 145±160 (60–240) | n.s. |
| Pérdidas hemáticas | 150 (100–500) | 200 (100–800) | n.s. |
| Pacientes transfundidos | 0 | 1 | n.s. |
| Media transfusional (ml) | 25 (0–300) | 50 (0–600) | n.s. |
| Margen quirúrgico en malignos | n.s. | ||
| >1cm | 12 | 14 | |
| <1cm | 6 | 4 | |
| Invadido | 0 | 0 | |
| Morbilidad | 1 (5.5%) | 1 (5.5%) | n.s. |
| Estancia hospitalaria | 4.9±2 (3–8) | 7±3 (3–20) | 0.003 |
V/M=varón/mujer.
HNF=hiperplasia nodular focal.
LIH=litiasis intrahepática.
MHCCR=metástasis hepáticas de cáncer colorrectal.
Los datos fueron tabulados en el programa estadístico SPSS 15.0 para Windows. El análisis estadístico de las tablas de doble entrada se realizó mediante el test de la chi-cuadrado y el test exacto de Fisher, y para el análisis de la edad, número de nódulos tumorales, tamaño de los nódulos, número de segmentos resecados, estancia hospitalaria y tiempo quirúrgico se utilizaron test no paramétricos (Kruskal–Wallis y test de Mann–Whitney). Se consideró estadísticamente significativo una p<0.05.
Resultados- 1.
Resultados de los 36 pacientes (tabla 1). No hubo mortalidad en ninguno de los dos grupos. La morbilidad fue similar: en el grupo CHL, 1 paciente de 18 (5.5%) presentó una colección intraabdominal que se resolvió con drenaje radiológico y en el grupo CA, 1 paciente de 18 presentó una fístula biliar por drenaje que precisó de cirugía para su resolución definitiva. No existieron diferencias entre ambos grupos respecto al sexo, comorbilidad, indicación quirúrgica, número de lesiones resecadas, tamaño de las lesiones, necesidades transfusionales, margen quirúrgico de resección, morbilidad y tiempo quirúrgico empleado. El grupo laparoscopia presentó una edad superior (63 años) que el grupo CA (52 años) (p=0.03), mayor empleo de la maniobra de Pringle (7 vs 2 casos) (p=0.06) y una menor estancia hospitalaria (4.9 vs 7 días) (p=0.003).
- 2.
Resultados de la SLI (tabla 2). Cuando comparamos el grupo SLI realizada por CHL, con el grupo de CA, solo existieron diferencias e.s. en cuanto a una mayor edad (65 vs 51 años) (p=0.043) y una menor estancia hospitalaria (4.9 vs 8.4 días) (0.005), en el grupo CHL. El tiempo quirúrgico fue inferior con CHL (141 vs 159min), aunque las diferencias no fueron e.s.
Tabla 2.Pacientes con seccionectomía lateral izquierda por laparoscopia (n=10) y por cirugía abierta (n=10)
Parámetros analizados Laparoscopia (n=10) Cirugía abierta (n=10) p= Edad media (rango) 65± 10 (49–78) 51± 13 (26–64) 0.043 Sexo ratio V:M 7:3 5:5 n.s. Comorbilidad 5 3 n.s. Patología benigna 0 casos 2 casos n.s. •HNF 0 1 •LIH 0 1 Tumores malignos 10 casos 8 casos •MHCCR 8 6 •Hepatocarcinoma 1 1 •Leiomiosarcoma 1° 1 0 •MH cáncer esófago 1 0 Maniobra de Pringle 1 0 n.s. Nº lesiones (rango) 1.9±1.2 (1–4) 1.5±0.9 (1–3) n.s. Tamaño (cm) 4.1±1.7 (2–8) 4.4±1.7 (2–8) n.s. Tiempo quirúrgico (min) 141 ±120 (90–240) 159 ±120 (60–240) n.s. Pérdidas hemáticas 180 (100–500) 150 (100–400) n.s. Pacientes transfundidos 0 0 n.s. Media transfusional (ml) 45 (0–300) 30 (0–300) n.s. Margen quirúrgico en malignos n.s. >1cm 10 10 <1cm 0 0 Invadido 0 0 Estancia hospitalaria 4.9±1.5 (3–7) 8.4±4.3 (3–20) 0.03 V/M=varón/mujer.
HNF=hiperplasia nodular focal.
LIH=litiasis intrahepática.
MHCCR=metástasis hepáticas de cáncer colorrectal.
- 3.
Resultados de las segmentectomías aisladas II ó III (tabla 3). Cuando comparamos el grupo de resecciones segmentarias del lóbulo izquierdo realizadas por CHL, con el grupo de CA, existieron diferencias en cuanto a un mayor empleo de la maniobra de Pringle (6 vs 2 casos) (p=0.05) y un mayor tiempo quirúrgico (166 vs 127min), en el grupo laparoscópico (p=0.05). La estancia hospitalaria fue inferior con CHL (4.8 vs 5.6 días), aunque las diferencias no fueron e.s.
Tabla 3.Resección de segmentos II ó III por laparoscopia (n=8) y por cirugía abierta (n=8)
Parámetros analizados Laparoscopia (n=8) Cirugía abierta (n=8) p= Edad media (rango) 59±11 (38–71) 55±11 (42–71) n.s. Sexo ratio V:M 5:3 3:5 n.s. Comorbilidad 4 (50%) 2 (25%) n.s. Patología benigna 2 casos (25%) 0 casos n.s. •Adenoma 1 0 •Hemangioma 1 0 Tumores malignos 6 casos (75%) 8 casos •MHCCR 6 6 •Hepatocarcinoma 0 1 •MH cáncer esófago 0 1 Maniobra de Pringle 6 (75%) 2 (25%) 0.05 Nº lesiones (rango) 2.25 ±1.2 (1–4) 3 ±2.5 (1–5) n.s. Tamaño (cm) 4±1.1 (3–6) 4.7±2.3 (2–6) n.s. Tiempo quirúrgico (min) 166 ±48 (100–240) 127 ±120 (120–180) 0.05 Pérdidas hemáticas 120 (100–200) 220 (100–800) n.s. Pacientes transfundidos 0 1 n.s. Media transfusional (ml) 0 75 (0–600) n.s. Margen quirúrgico en malignos n.s. >1cm 2 (25%) 4 (50%) <1cm 6 (75%) 4 (50%) Invadido 0 0 Estancia hospitalaria 4.8±1.3 (4–8) 5.6±1.3 (4–7) n.s. V/M= varón/mujer.
MH: metástasis hepáticas, MHCCR: metástasis hepáticas de cáncer colorectal.
La CHL no se ha generalizado entre los cirujanos hepáticos, debido a las dificultades técnicas que presenta1,12,14,15–22. Relacionado con esta poca experiencia, no existen estudios prospectivos randomizados que comparen la SLI laparoscópica y abierta. Solo existe un estudio control comparando 18 SLI realizadas por CTL frente a 20 realizadas por CA23. Los resultados de este estudio retrospectivo, no muestran unas ventajas evidentes de la CHL frente a CA (la maniobra de Pringle empleada y la estancia hospitalaria fueron similares, a expensas de unas pérdidas hemáticas inferiores en el grupo CHL pero con un mayor tiempo quirúrgico).
Desde el punto de vista técnico, la SLI es una técnica de fácil realización debido a la especial disposición de los elementos hiliares de los segmentos II y III, de la delgadez del parénquima hepático a nivel del ligamento venoso, y a la disposición transversal de la vena hepática izquierda, no siendo necesaria la disección del tronco principal para su sección. Linden et al8 comunican que la sección de los pedículos vasculares con endostapler, ha simplificado la técnica quirúrgica. Con una mínima disección a la izquierda del ligamento redondo, introduce el instrumento con una carga vascular de 6cm y secciona los elementos del segmento II y III. Es necesario asegurarse previamente que el grosor del parénquima a dicho nivel no sea superior a 3cm (medido por TAC y por ecografía intraoperatoria). Con otra carga vascular similar secciona, a continuación, la VSHI. En nuestra experiencia, hemos modificado esta técnica, ya que a la izquierda del ligamento redondo el grosor del parénquima siempre es superior a 3cm, por lo que primero se secciona con Ligasure 10mm, hasta identificar la salida de los elementos hiliares del segmento II y III, seccionándolos con 2 cargas independientes. En este punto, tras el disparo, es necesario comprobar el sangrado y la posibilidad de que exista algún conducto biliar no grapado, como ocurrió en 2 de nuestros pacientes en los que se realizó sutura laparoscópica. Se continúa la sección con Ligasure hasta llegar a la VSHI, aplicando una tercera carga de endogía vascular de 6cm a dicha vena.
La maniobra de Pringle es empleada de forma sistemática por algunos autores15, otros la emplean en el 66% de las SLI23,24 y Duluq et al20, con criterios similares la emplea en el 50% de los casos. En algunas series23,24, el tiempo de oclusión fue muy prolongado (39min de media, rango 23–62min). Nosotros y otros autores8,25,26, consideramos que el empleo de la maniobra de Pringle en la SLI debe ser selectivo. Así, Belli et al26 no la emplean en ninguno de los 8 pacientes que presentan (7 fueron hepatocarcinoma sobre cirrosis) y plantea que así se evita la isquemia hepática que puede agravar la insuficiencia hepática en estos pacientes y menor formación de ascitis ya que muchos de estos pacientes presentan hipertensión portal. Linden et al8 no la emplea en ninguno de los 5 pacientes que presenta y nosotros la empleamos en ningún paciente por CA y solo la utilizamos en un caso de CHL, debido a un sangrado excesivo (oclusión continua durante 10min).
Se ha comunicado23 que la morbimortalidad de la SLI fue similar tanto con CHL como con CA, resultados similares a los obtenidos en nuestra serie y por otros autores8,13,25. Las pérdidas hemáticas fueron similares entre CHL y CA en nuestra serie, resultados reproducidos por otros autores.
El tiempo quirúrgico de la SLI por laparoscopia es superior que con CA en la mayoría de series8,23,24. Nuestro estudio es el primero que comunica un menor tiempo quirúrgico con CHL frente a CA, quizás debido a que por CA empleamos una incisión subcostal bilateral y por laparoscopia empleamos CLAM. Belli et al26 comunican un tiempo similar al de nuestra serie (142min de media en 8 pacientes).
La ventaja principal de la cirugía laparoscópica para realizar la SLI, reside en una menor estancia hospitalaria. En nuestra serie fue de 4.9 días con CHL frente a 8.2 por CA. Otros comunican una estancia inferior 2.2 días24, y otros algo superior (5.75 días)26. En el estudio de Lesurtel et al23, la estancia fue similar en ambos grupos: 8 días con CHL y 10 días con CA.
Por otra parte, según nuestro criterio, existen tumores en el lóbulo izquierdo en los que es conveniente realizar una resección segmentaria II ó III, estando indicada en tumores benignos y cuando sea necesario ahorrar parénquima hepático para futuras resecciones (MHCCR que pueden requerir futuras re-resecciones y en primer tiempo del “two-stage liver resection”). Respecto a la SLI, estas segmentectomías presentaron un mayor tiempo quirúrgico (debido a que entrañan una mayor dificultad técnica) y se empleó con más frecuencia la maniobra de Pringle (en 9 de los 16 pacientes frente a la SLI en la que se empleó en 1 de los 20 pacientes). Respecto a la CA, en el grupo laparoscopia fue necesario un mayor empleo de la maniobra de Pringle (75% vs 25% en el grupo CA) y un tiempo quirúrgico superior. Sin embargo, a pesar de la mayor dificultad técnica, la estancia hospitalaria fue inferior con CHL, aunque las diferencias no fueron e.s.
En conclusión, la SLI, en las unidades de cirugía hepática con experiencia en CHL deben realizarse inicialmente por laparoscopia debido a una menor estancia hospitalaria que la realizada por CA, con la misma morbilidad. Las resecciones segmentarias II ó III realizadas por laparoscopia, presentan un mayor tiempo quirúrgico para su realización que por CA y, si se tiene experiencia en CHL, también deberían ser realizadas por laparoscopia ya que la estancia hospitalaria es menor, aunque las diferencias no fueron e.s.