La Sociedad Española de Arteriosclerosis tiene entre sus objetivos contribuir al mayor y mejor conocimiento de la enfermedad vascular, su prevención y su tratamiento. Las enfermedades cardiovasculares son la primera causa de muerte en nuestro país y conllevan además un elevado grado de discapacidad y de gasto sanitario. La arteriosclerosis es una enfermedad de causa multifactorial, y es por ello que su prevención exige un abordaje global que contemple los distintos factores de riesgo con los que se asocia. Así, este documento resume el nivel actual de conocimientos e integra recomendaciones y procedimientos a seguir ante el paciente que presenta enfermedad cardiovascular establecida o se encuentra con elevado riesgo vascular. En concreto, este documento revisa los principales síntomas y signos a evaluar durante la visita clínica, los procedimientos de laboratorio y de imagen a solicitar de forma rutinaria o aquellos en situaciones especiales; igualmente, incluye la estimación del riesgo vascular, los criterios diagnósticos de las distintas entidades que son factores de riesgo cardiovascular, plantea recomendaciones generales y específicas para el tratamiento de los distintos factores de riesgo cardiovascular, así como sus objetivos finales. Por último, el documento recoge aspectos habitualmente poco referidos en la literatura, como son la organización de una consulta de riesgo vascular.
One of the main goals of the Spanish Society of Arteriosclerosis is to contribute to a wider and greater knowledge of vascular disease, its prevention and treatment. Cardiovascular diseases are the leading cause of death in our country and also lead to a high degree of disability and health expenditure. Arteriosclerosis is a multifactorial disease, this is why its prevention requires a global approach that takes into account the different risk factors with which it is associated. Thus, this document summarizes the current level of knowledge and integrates recommendations and procedures to be followed for patients with established cardiovascular disease or high vascular risk. Specifically, this document reviews the main symptoms and signs to be evaluated during the clinical visit, the laboratory and imaging procedures to be routinely requested or those in special situations. It also includes the estimation of vascular risk, the diagnostic criteria of the different entities that are cardiovascular risk factors, and presents general and specific recommendations for the treatment of the different cardiovascular risk factors and their final objectives. Finally, the document includes aspects that are not often mentioned in the literature, such as the organisation of a vascular risk consultation.
La medicina es una ciencia en perpetuo cambio. En los últimos años hemos asistido a un continuo avance en el abordaje de la patología cardiovascular, gracias en parte a la aplicación de las diferentes ómicas que, junto con un mayor conocimiento de la fisiopatología de la enfermedad, la implementación de nuevas técnicas de imagen y las nuevas herramientas terapéuticas, nos han permitido aproximarnos a la enfermedad desde una perspectiva más holística.
En este contexto, la medicina actual tiende a potenciar la prevención y el diagnóstico precoz, con el propósito de identificar la enfermedad en sus fases iniciales, como es un buen ejemplo la enfermedad vascular subclínica (EVS).
En el terreno de la medicina cardiovascular, y en concreto en España, se ha producido un progresivo descenso de la mortalidad, en especial de la mortalidad por episodios isquémicos cerebrovasculares y cardiacos; sin embargo, la morbilidad se ha incrementado, y el número de ingresos hospitalarios y la necesidad de procedimientos de revascularización siguen creciendo. Por tanto, se necesita un mayor esfuerzo en el control de los factores de riesgo cardiovascular (FRCV) tanto clásicos como emergentes.
En los últimos decenios los avances en el diagnóstico y en el tratamiento farmacológico de la hipertensión arterial (HTA), la hipercolesterolemia y la diabetes mellitus tipo2 (DM2) han sido espectaculares y se traducen en un mayor grado de control, si bien aún lejos de los niveles óptimos, ensombrecidos por grupos de pacientes con una baja adherencia y colectivos médicos con una elevada inercia terapéutica. Asimismo, se va reduciendo la prevalencia del tabaquismo en ciertos subgrupos de población, que en gran parte se explica por las restricciones de consumo legisladas en los últimos años. Sin embargo, otras áreas de la prevención cardiovascular no ofrecen expectativas tan buenas: el incremento de la prevalencia del síndrome metabólico (SM), la obesidad y la DM, cada vez a edades más tempranas, indica que aún existe un largo camino por recorrer para, si no evitar la enfermedad cardiovascular (ECV), al menos para retrasarla.
La Sociedad Española de Arteriosclerosis (SEA) tiene entre sus objetivos contribuir al mejor conocimiento y control de los FRCV en nuestro país, en especial de la dislipemia, a través de su red de Unidades de Lípidos. Esto se traduce en fomentar actividades investigadoras y formativas. La ECV de naturaleza arteriosclerótica es multifactorial y por ello requiere una estrategia dirigida al conjunto de FRCV, incluyendo las dislipemias. Por ello, la SEA ha decidido elaborar unos estándares de calidad para el control global del riesgo cardiovascular, una forma de resumir la evidencia científica y las recomendaciones nacionales e internacionales sobre los principales factores de riesgo. Estamos convencidos de que este documento aportará claridad y constituirá una puesta al día de los procedimientos diagnósticos, la utilidad real o de investigación de diversas pruebas bioquímicas o de imagen, la categorización del riesgo vascular y el tratamiento, tanto en lo que se refiere a los hábitos de vida, especialmente la dieta, como al tratamiento farmacológico.
Este documento nace con la intención de ser revisado y actualizado de forma periódica y ser de utilidad a todos los clínicos que de una u otra forma atendemos pacientes de riesgo vascular, desde la atención primaria a la atención hospitalaria, en prevención primaria o secundaria y, en general, a todos aquellos miembros que pertenecen a las sociedades que integran el Comité Español Interdisciplinario para la Prevención Cardiovascular (CEIPC). Este documento va también dirigido a los profesionales en formación del grado, no solo de las profesiones sanitarias, así como a los investigadores básicos con interés en la arteriosclerosis.
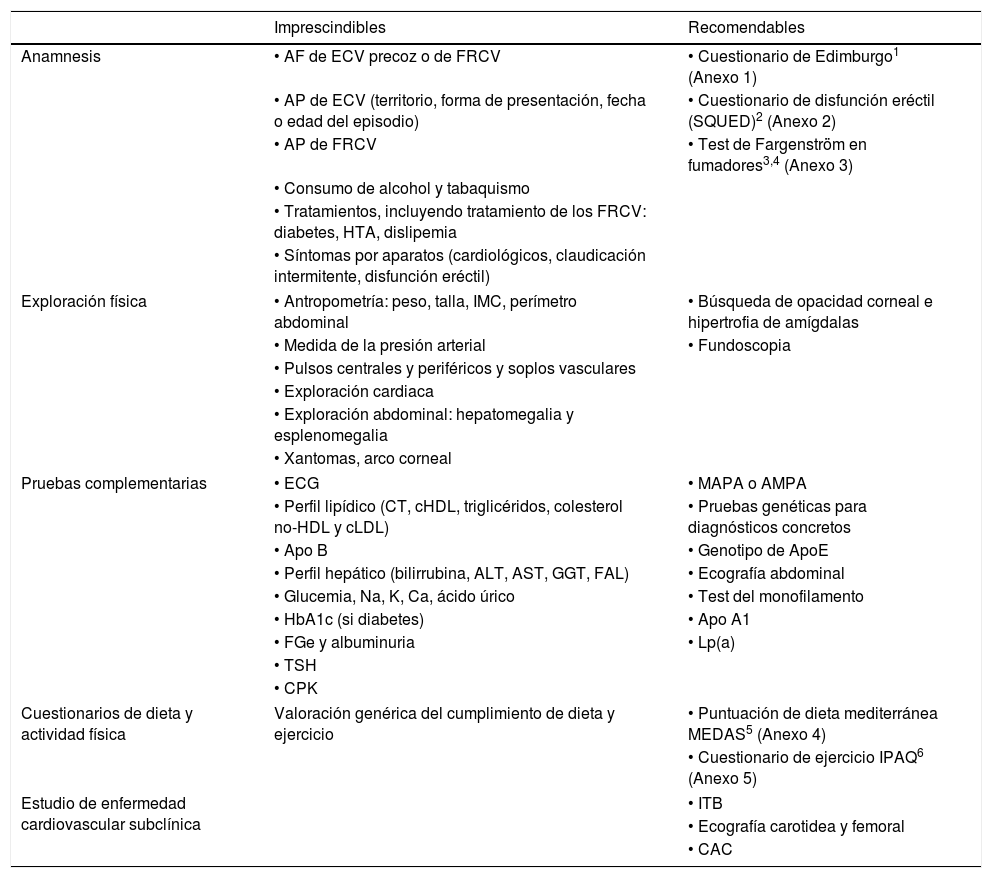
Anamnesis, exploración y pruebas complementarias en consultaLa historia clínica convencional y la recogida ordenada de síntomas y signos del paciente suponen el procedimiento común para acceder al diagnóstico de la patología. En este apartado nos centraremos en destacar las características más importantes. La tabla 1 muestra de forma resumida los elementos que deben practicarse en una consulta que aborde el riesgo cardiovascular (RCV).
Elementos para practicar en el abordaje del riesgo cardiovascular
| Imprescindibles | Recomendables | |
|---|---|---|
| Anamnesis | • AF de ECV precoz o de FRCV | • Cuestionario de Edimburgo1 (Anexo 1) |
| • AP de ECV (territorio, forma de presentación, fecha o edad del episodio) | • Cuestionario de disfunción eréctil (SQUED)2 (Anexo 2) | |
| • AP de FRCV | • Test de Fargenström en fumadores3,4 (Anexo 3) | |
| • Consumo de alcohol y tabaquismo | ||
| • Tratamientos, incluyendo tratamiento de los FRCV: diabetes, HTA, dislipemia | ||
| • Síntomas por aparatos (cardiológicos, claudicación intermitente, disfunción eréctil) | ||
| Exploración física | • Antropometría: peso, talla, IMC, perímetro abdominal | • Búsqueda de opacidad corneal e hipertrofia de amígdalas |
| • Medida de la presión arterial | • Fundoscopia | |
| • Pulsos centrales y periféricos y soplos vasculares | ||
| • Exploración cardiaca | ||
| • Exploración abdominal: hepatomegalia y esplenomegalia | ||
| • Xantomas, arco corneal | ||
| Pruebas complementarias | • ECG | • MAPA o AMPA |
| • Perfil lipídico (CT, cHDL, triglicéridos, colesterol no-HDL y cLDL) | • Pruebas genéticas para diagnósticos concretos | |
| • Apo B | • Genotipo de ApoE | |
| • Perfil hepático (bilirrubina, ALT, AST, GGT, FAL) | • Ecografía abdominal | |
| • Glucemia, Na, K, Ca, ácido úrico | • Test del monofilamento | |
| • HbA1c (si diabetes) | • Apo A1 | |
| • FGe y albuminuria | • Lp(a) | |
| • TSH | ||
| • CPK | ||
| Cuestionarios de dieta y actividad física | Valoración genérica del cumplimiento de dieta y ejercicio | • Puntuación de dieta mediterránea MEDAS5 (Anexo 4) |
| • Cuestionario de ejercicio IPAQ6 (Anexo 5) | ||
| Estudio de enfermedad cardiovascular subclínica | • ITB | |
| • Ecografía carotidea y femoral | ||
| • CAC | ||
AF: antecedentes familiares; ALT: alanina aminotransferasa; AMPA: automedida de la presión arterial; AP: antecedentes personales; Apo B: apolipoproteína B; Apo E: apolipoproteína E; AST: aspartato aminotransferasa; Ca: calcio; CAC: calcio coronario; cHDL: colesterol de lipoproteínas de alta densidad; ECV: enfermedad cardiovascular; ECG: electrocardiograma; FAL: fosfatasa alcalina; FGe: filtrado glomerular estimado; FRCV: factores de riesgo cardiovascular; GGT: gamma glutamil transpeptidasa; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal; ITB: índice tobillo-brazo; K: potasio; Lp(a): lipoproteína (a); MAPA: medición ambulatoria de la PA; Na: sodio; PA: presión arterial; TSH: hormona estimulante de tiroides.
Es necesario el conocimiento de los antecedentes familiares de primer y segundo grado, tanto en lo que se refiere a enfermedades prevalentes relacionadas con las ECV, como a los factores de riesgo, sobre todo en casos con sospecha de hipercolesterolemia familiar (HF) o de ECV prematura. Los antecedentes familiares tienen mayor valor cuando estos aparecen en familiares de primer grado y a edades tempranas de la vida, por debajo de los 55años en el varón y por debajo de los 65años en la mujer.
Antecedentes personalesAdemás de los antecedentes personales convencionales (alergias, intervenciones quirúrgicas, etc.) se debe indagar específicamente por ECV y por los diversos FRCV mayores (DM, HTA, dislipemia, tabaquismo y obesidad); si están presentes se debe anotar la edad de inicio y los tratamientos que reciben los pacientes, independientemente de su indicación. Las reacciones adversas o la intolerancia a los medicamentos y la existencia de embarazo o posibilidad de gestación deben igualmente ser conocidas. Se debe cuantificar la potencia del FRCV si está presente (número de cigarrillos al día y años de fumador, niveles máximos de colesterol-LDL (cLDL), HbA1c y PAS o peso). Deben registrarse igualmente la presencia de enfermedades sistémicas con situación inflamatoria de bajo grado, como la psoriasis, la enfermedad por VIH, la artritis reumatoide o el lupus eritematoso sistémico y las neoplasias, pues por sí mismas o por su tratamiento aumentan el riesgo vascular. También deben registrarse en las mujeres los antecedentes de HTA o diabetes gestacional, así como la fecha de la menopausia.
Anamnesis actual y por aparatosEs necesario indagar por el motivo de consulta, que habitualmente suele ser una falta de control de uno o más de los FRCV. Se debe inquirir por síntomas asociados con episodios isquémicos en los tres territorios mayores que hayan podido pasar desapercibidos o no estén diagnosticados aún (los que sugieran accidente isquémico transitorio [AIT], dolor torácico con el esfuerzo, palpitaciones, disnea o la claudicación intermitente), síntomas cardinales de la DM, cefalea o mareos asociados con elevación de las cifras de presión arterial (PA), síntomas relacionados con causas secundarias de HTA (tabla 2) y elevaciones asintomáticas de los lípidos, excepcionalmente asociados con xantomas. Si el paciente ha sido instruido, sería aconsejable anotar las automedidas de la PA ambulatoria.
Síntomas y signos sugestivos de HTA secundaria
| • Elevación paroxística de la PA o la HTA establecida con crisis añadidas, y la triada clásica de cefalea, sudoración y palpitations (feocromocitoma) |
| • Ronquidos e hipersomnia (apnea del sueño) |
| • Síntomas prostáticos (insuficiencia renal crónica obstructiva) |
| • Calambres musculares, debilidad (hipopotasemia por hiperaldosteronismo) |
| • Edemas, astenia, tenesmo y polaquiuria (enfermedad renal) |
| • Obesidad central, facies luna llena, equimosis, estrías (síndrome de Cushing) |
| • Fármacos o drogas de abuso (alcohol, AINE, cocaína, anfetamina, regaliz, etc.) |
| • Ausencia de historia familiar de HTA |
| • Aparición de la HTA en sujetos jóvenes (< 35 años) |
| • HTA refractaria o que requiere más de tres fármacos para su control |
| • Respuesta paradójica a betabloqueantes |
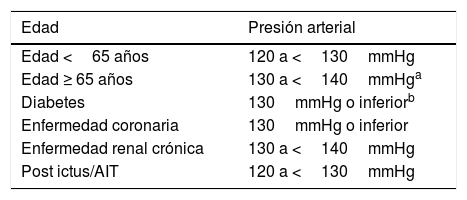
Debe registrarse el peso, la talla, el perímetro abdominal y calcularse el índice de masa corporal (IMC). La PA debe medirse de acuerdo a las recomendaciones de la tabla 3. La exploración cardiocirculatoria básica es obligada, en especial la presencia de soplos y la magnitud de los pulsos arteriales; la interpretación de los hallazgos dependerá del contexto: una ausencia de pulsos pedios puede indicar en un anciano claudicante una enfermedad arterial periférica (EAP), mientras que en un joven hipertenso puede indicar coartación de la aorta. Debe recogerse el hallazgo de hepatomegalia y/o esplenomegalia La presencia de xantomas, su morfología y su localización en muchos casos son un factor diagnóstico de primer nivel.
Recomendaciones para la medida de la PA y diagnóstico de HTA
| Medida de la PA |
|---|
| • Paciente sentado durante 3-5min antes de iniciar las medidas de la PA |
| • Realizar al menos dos medidas, en posición sentado, separadas 1-2min, y hacer medidas adicionales si las dos primeras son muy diferentes. Considere la media si le parece adecuado |
| • Realizar un mayor número de medidas si el paciente presenta arritmia (p.ej., fibrilación auricular) |
| • Utilizar un manguito estandarizado: 12-13cm de ancho y 35cm de largo, pero disponer de uno más ancho cuando la circunferencia del brazo sea >32cm |
| • Mantener el manguito a la altura del corazón, independientemente de la postura del paciente |
| • Se recomienda realizar una medida bilateral (simultánea de la PA en los dos brazos en la primera visita, especialmente en los pacientes de alto riesgo vascular). En posteriores visitas, utilizar como referencia el brazo con los valores más altos de PA: una diferencia entre las dos extremidades superiores >10-15mmHg se asocia con un incremento del RCV. Cuando la diferencia es importante (≥30mmHg), se ha de sospechar una estenosis de la arteria subclavia |
| • Medir la PA después de 5min en decúbito y después de 1-3min en bipedestación: Se debe hacer en la primera visita o cuando se sospecha clínicamente una hipotensión ortostática, especialmente en pacientes mayores, diabéticos o pacientes neurológicos |
| Diagnóstico de HTA |
|---|
| • El diagnóstico de HTA (especialmente en la HTA grado1) se establecerá después de la comprobación de los valores de PA en dos o más medidas tomadas en cada una de dos o más ocasiones separadas varias semanas. Se recomienda confirmar el diagnóstico mediante medidas ambulatorias de la PA: AMPA o MAPA durante 24h |
AMPA: automedida de la presión arterial; HTA: hipertensión arterial; MAPA: monitorización ambulatoria de presión arterial; PA: presión arterial; RCV: riesgo cardiovascular.
Adaptado de Williams et al.8.
Se debe contar con un perfil lipídico completo (colesterol total [CT], triglicéridos [TG], colesterol HDL [cHDL], cLDL [estimado por Friedewald o por método directo] y calcular el colesterol no HDL si los TG están elevados). Si están disponibles en el centro, es útil determinar la apolipoproteínaB (ApoB) porque puede contribuir al cribado de una disbetalipoproteinemia y a diferenciarla de la forma más común de la hiperlipemia familiar combinada9. La determinación del número y del tamaño de las partículas lipoproteicas, disponible en España para su aplicación clínica, es informativa especialmente en pacientes con dislipemia aterógena, en la que suele existir una discordancia entre las concentraciones lipídicas y el número de partículas. Los lectores pueden obtener información adicional sobre medición de partículas aterogénicas en una reciente revisión10. En la primera visita debe solicitarse un hemograma convencional y pruebas de bioquímica en sangre que incluyan un perfil glucémico (glucemia en ayunas, HbA1c), la función renal y hepática, así como los niveles de CPK, Na, K, Ca y ácido úrico; igualmente, TSH. En la orina, preferentemente de primera hora de la mañana, determinar el cociente albuminuria/creatinina urinaria; la medición de proteínas en orina es necesaria para descartar síndrome nefrótico. Puesto que el riesgo de hepatotoxicidad por los tratamientos es excepcional11, no se recomienda el control sistemático de transaminasas durante el tratamiento con estatinas, excepto con aumento de dosis12 (EAS/ESC 2016). Un ECG en reposo aporta información de valor en pacientes que son evaluados por HTA.
Anamnesis, exploración y pruebas complementarias en consulta: recomendablesAnamnesis: cuestionario de Edimburgo y cuestionario de disfunción eréctilLa anamnesis específica sobre hábito de fumar, incluyendo test de Fargeström (Anexo 3), puede consultarse más adelante, en «Paciente fumador». Ante la sospecha de claudicación intermitente, el cuestionario de Edimburgo (Anexo 1) permite reforzar el diagnóstico clínico y está validado en nuestro país1. El cuestionario para la sospecha de disfunción eréctil (SQUED) se encuentra en el Anexo 2.
Exploración físicaEn los pacientes con cHDL muy bajo debería buscarse de forma específica la presencia de opacidad corneal (déficit de LCAT) o la hipertrofia amigdalar (enfermedad de Tangier). La fundoscopia aporta información valiosa en el examen del paciente con diabetes y en las lesiones de órgano diana de la HTA, siendo imprescindible en la HTA de grado3 (PAS ≥180mmHg y o PAD ≥110mmHg).
Pruebas complementarias adicionalesLa escala clínica y bioquímica de HF del Dutch Lipid Clinic Network (DLCN) (Anexo 6) debe utilizarse ante sospecha de HF13 y confirmarse con el diagnóstico genético. La existencia de procedimientos de secuenciación masiva y la comercialización de paneles genéticos para hipercolesterolemia permite el diagnóstico de la misma, la diferenciación entre formas heterocigotas y homocigotas (en las cuales puede haber solapamiento) o el hallazgo de otras enfermedades con las que puede compartir fenotipo (déficit de lipasa ácida lisosomal). Los genotipos de la ApoE se deben conocer cuando hay sospecha de disbetalipoproteinemia. La cuantificación beta (ultracentrifugación) podría ser de interés para la confirmación de la disbetalipoproteinemia (cociente cVLDL/TG>0,3 en mg/dl) y para estudiar las lipoproteínas plasmáticas, pero dado su elevado coste y complejidad, su uso está limitado. Una ApoB baja en presencia de hiperlipidemia combinada es sospechosa de disbetalipoproteinemia. La ApoA1 se recomienda en el estudio de la hipercolesterolemia en la infancia, un índice ApoB/ApoA1 superior a 0,82 mostró mayor sensibilidad y especificidad en la detección de los portadores de una mutación genética para HF14. La elevación de la Lp(a) puede tener un papel relevante en el incremento del riesgo vascular que presentan algunos pacientes con HF, y en sujetos con enfermedad isquémica prematura, o recurrente a pesar de un buen control de sus factores de riesgo cardiovascular. En estas circunstancias estaría indicada su determinación.
Entre las pruebas complementarias adicionales, la monitorización ambulatoria de la PA (MAPA) durante 24h o mediante automedida estandarizada de la PA en domicilio (AMPA) durante 5-7días es recomendable, y está especialmente indicada cuando hay discordancia entre tomas de PA en consulta y domicilio, elevada variabilidad, cuando se sospecha HTA nocturna (p.ej., apneas del sueño) y en casos de HTA resistente15.
Estudio de la enfermedad vascular subclínicaLas pruebas que comentamos en este apartado se efectúan con la única intención de re-estratificar el riesgo vascular de un sujeto, ya que conciernen a un paciente sin ECV establecida ni síntomas que hagan sospechar ECV. Se refieren a un periodo de la historia natural del proceso aterosclerótico durante el cual, en ausencia síntomas y signos, existen alteraciones estructurales demostrables en los vasos. Por definición, solo puede conocerse su existencia mediante acciones diagnósticas específicas. Tanto los FRCV como la enfermedad ateromatosa tienen carácter sistémico, por lo que el hallazgo de afectación vascular en un territorio también aporta información sobre el estado de la enfermedad en los demás. Las técnicas exploratorias disponibles son no invasivas y su utilización se plantea para la obtención de información complementaria en la estimación del RCV, para redefinir los objetivos lipídicos y para orientar las decisiones terapéuticas15. También se ha propuesto la utilización de alguna de estas exploraciones para el cribado sistemático. Las exploraciones más habituales para diagnosticar la ECV subclínica son las siguientes:
Índice tobillo/brazoEl índice tobillo/brazo (ITB) es el cociente de las presiones sistólicas de tobillo/brazo para cada miembro inferior. Permite diagnosticar la EAP silente cuando este cociente es <0,9. Un valor inferior a 0,9 indica la existencia de una estenosis mayor del 50% entre la aorta y las arterias distales de la pierna con alta especificidad (90%) y una sensibilidad aceptable (79%); valores ≥1,4 suelen indicar la presencia de calcificación arterial, una situación que también se asocia con un incremento del riesgo de complicaciones cardiovasculares. Por su sencillez, el ITB puede realizarse de forma sistemática en la evaluación del estado vascular del paciente, siempre que se disponga de un doppler portátil y de 15min para su determinación.
La medición del ITB no está justificada en pacientes de bajo riesgo por su escasa rentabilidad16, mientras que su rentabilidad es máxima cuando se efectúa en sujetos con los dos principales factores de riesgo asociados con EAP, como son la DM y el hábito de fumar. En series españolas, hasta un 25% de pacientes con DM2 sin claudicación tienen ITB<0,917. En los pacientes con DM de larga evolución y alta probabilidad de microangiopatía (que pueden identificarse con el test de monofilamento) el ITB tiene escasa sensibilidad para detectar casos de EAP debido a la elevada frecuencia de calcificación arterial que enmascara su medida.
Grosor íntimo-medial y placas de ateroma en carótidas y femoralesOtra prueba extendida es la medición del grosor íntimo-medial (GIM) a nivel de las carótidas o femorales y, sobre todo, la detección de placas de ateroma. Las necesidades de equipamiento son mayores que para el ITB, son más dependientes del operador y consumen más tiempo, aunque su coste es bajo y, dado que no hay radiación, se puede utilizar para monitorizar de forma repetida el estado de las carótidas a lo largo del tiempo. El área más reproducible suele ser la pared distal de la carótida común, 1cm por debajo de la bifurcación. Como el valor de GIM varía con los FRCV y en especial con la edad, algunos autores consideran patológicos los valores que superan el percentil 75 para la misma edad y sexo del paciente, si bien la mayoría de las guías consideran patológico un valor >0,9mm. Aunque un aumento del GIM se asocia con el RCV, no aporta información sustancial más allá de la ya aportada por la de los factores de riesgo18.
Se considera placa carotidea al engrosamiento focal mayor del 50% de la pared del vaso que lo rodea, o a un GIM mayor a 1,5mm que protruye en la luz adyacente19. No solo se valora su presencia sino también el número, el tamaño, la irregularidad y la ecodensidad, características que se asocian también con el riesgo de complicaciones cardiovasculares en los territorios cerebral y coronario.
Las recientes Guías Europeas de Prevención Cardiovascular aconsejan utilizar solo la presencia de placa a la hora de re-estratificar el riesgo de un paciente y desaconsejan utilizar de forma aislada el valor del GIM15.
Presencia de calcio coronarioLa TAC torácica permite la cuantificación del calcio coronario (CAC) que se expresa en unidades Agatston. La presencia de calcio indica una fase avanzada de arteriosclerosis coronaria y es un mejor predictor de episodios isquémicos que la presencia de placa carotidea y femoral20,21. Una puntuación igual o superior a 300 o al percentil 75 para la edad, sexo y raza es el umbral que se utiliza para considerar el RCV alto, información complementaria que reclasifica el riesgo de los pacientes, en especial en el rango intermedio22. Cuando no existe calcificación alguna (Agatston=0), la probabilidad de lesión obstructiva coronaria es casi nula; el riesgo de episodios es tanto mayor cuanto mayor es el grado de calcificación22. La puntuación aumenta inexorablemente con la edad, y aunque la repetición de la medición tras unos años aporta una actualización del riesgo, que es el correspondiente a la exploración más reciente, los cambios observados raramente contribuyen a modificar la actitud preventiva o terapéutica23. Las guías europeas15 consideran la presencia de CAC como un modificador del riesgo. Su mayor limitación es el coste y clásicamente el riesgo asociado con la radiación, aunque en la actualidad las nuevas exploraciones rápidas de baja radiación han minimizado dicho riesgo24. La angiografía por tomografía computarizada muestra enfermedad coronaria estenótica subclínica capaz de aportar información adicional a los factores de riesgo clásicos, en especial en diabéticos y pacientes con HF de larga evolución25,26. La información que aporta es independiente de la suministrada por el CAC, que continúa identificando a pacientes con un riesgo superior aún en ausencia de estenosis27. Los avances en el software de interpretación de la angio-TAC coronaria, muchos de ellos en versión beta en el momento de redacción de esta guía, con estimación de la histología virtual de la placa de ateroma, del volumen de la placa y del volumen total de la placa normalizado, probablemente conllevarán un nuevo paradigma en el conocimiento de la arteriosclerosis subclínica y, sobre todo, en la predicción de episodios en pacientes de alto riesgo.
Cuestionarios de dieta y actividad física: escalas recomendadasMás allá de indagar sobre datos generales de la dieta, como si esta es rica en hidratos de carbono o grasas saturadas, o de alteraciones del patrón alimentario, la dieta puede ser evaluada con un simple cuestionario de 14 preguntas (MEDAS) sobre adherencia a la dieta mediterránea (Anexo 4), que ha sido validado en el ensayo PREDIMED y se asocia con la presencia de FRCV y con el RCV28. Debe cuantificarse el consumo de alcohol, que puede hacerse anotando el número (volumen en ml) de cervezas, vino y/o licor a la semana y cuantificando los gramos del alcohol ingeridos por semana, estimando una graduación de 6, 12 y 40grados, respectivamente, mediante la fórmula [volumen en ml×graduación×0,8]/100.
La actividad física puede evaluarse de una forma semicuantitativa tanto durante el trabajo (1: no trabaja o sedentario; 2: camina regularmente durante el trabajo; 3: camina regularmente y levanta pesos, y 4: importante actividad física) como en el tiempo de ocio (1: no realiza ejercicio; 2: camina al menos 4h a la semana; 3: camina >4h a la semana, y 4: entrenamiento vigoroso)29. Por último, es posible cuantificar de forma simple la actividad física usando el cuestionario IPAQ, igualmente validado6 y disponible online30.
Indicación de pruebas especialesAlgunos biomarcadores han sido ampliamente investigados como predictores del riesgo de ECV (homocisteína, fosfolipasaA2 asociada con lipoproteína, factores trombogénicos) y no han sido incorporados a la rutina clínica por no aportar información adicional relevante del RCV en un paciente concreto. En su conjunto, estos biomarcadores no tienen justificación clínica, ya que no aumentan la capacidad predictora de episodios respecto del SCORE europeo15. Más controvertido es el papel del más estudiado de todos ellos, la proteínaC reactiva (PCR), que en diversos estudios ha mostrado su capacidad predictiva de riesgo cardiovascular. Su determinación permite detectar pacientes que puedan presentar riesgo residual independiente de los parámetros lipídicos.
En presencia de síntomas o signos sugestivos o ante la sospecha de enfermedad se deben solicitar las pruebas complementarias pertinentes, ergometría en caso de dolor torácico, o pruebas de imagen ante sospecha de hipertensión secundaria, test hormonales, etc.
Diagnóstico del riesgo cardiovascularRecogida de diagnósticos en la historia clínica: criterios diagnósticosTodo paciente atendido en una unidad de lípidos debe tener en su historia clínica un listado de diagnósticos estandarizados, que incluyen los referidos en la tabla 4. Además, deben añadirse todos los diagnósticos derivados de las enfermedades que pudiera tener, tanto cardiovasculares como no cardiovasculares8,31-39.
Criterios diagnósticos
| Diagnóstico | Definición |
|---|---|
| Hipercolesterolemia | Colesterol total |
| • Colesterol total recomendable <200mg/dl | |
| • Colesterol total levemente elevado 200-249 mg/dl | |
| Hipercolesterolemia: | |
| • Colesterol total elevado >250mg/dl | |
| Colesterol LDL | |
| • cLDL deseable: ≤100mg/dl | |
| • cLDL por encima del deseable: 100-129 mg/dl | |
| • cLDL en el límite: 130-159 mg/dl | |
| Hipercolesterolemia: | |
| • cLDL elevado: 160-189 mg/dl | |
| • cLDL muy elevado: ≥ 190 mg/dl | |
| Alternativamente, si la concentración de TG es ≥400 mg/dl el diagnóstico se basa en el C-no-HDL: | |
| • C-no-HDL deseable: ≤ 130 mg/dl | |
| • C-no-HDL por encima del deseable: 130-159 mg/dl | |
| • C-no-HDL en el límite: 160-189 mg/dl | |
| Hipercolesterolemia: | |
| • C-no-HDL elevado: 190-219 mg/dl | |
| • C-no-HDL muy elevado: ≥ 220 mg/dl | |
| Hipertrigliceridemia | TG deseables <150 mg/dl |
| Hipertrigliceridemia: | |
| • Leve: 150-499 mg/dl | |
| • Moderada 500-1.000 mg/dl | |
| • Grave: ≥ 1.000 mg/dl | |
| Hiperlipemia mixta | Concentraciones elevadas tanto de cLDL o C-no-HDL, como de TG |
| Hipercolesterolemia familiar | Utilización de las tablas de la DLCN (Anexo 6) |
| Hiperlipemia familiar combinada | ApoB > 120 mg/dl y TG > 150 mg/dl en al menos 2 miembros de la familia e historia familiar de ECV sintomática prematura |
| Dislipemia aterogénica | Hipertrigliceridemia (triglicéridos > 150 mg/dl) y cHDL bajo (< 40 mg/dl en varones y <50 mg/dl en mujeres) |
| Hipoalfalipoproteinemia | cHDL < 40 mg/dl en varones |
| cHDL <50 mg/dl en mujeres | |
| Hiperlipoproteinemia (a) | Lp(a) ≥ 50 mg/dl |
| Hipertensión arterial (medidas en consulta) | • Presión arterial óptima <120 y <80mmHg |
| • Normal 120-129 y 80-84mmHg | |
| • Normal-alta 130-139 y 85-89mmHg | |
| • HTA grado I: PAS 140-159 y/o PAD 90-99mmHg | |
| • HTA grado II: PAS 160-179 y/o PAD 100-109mmHg | |
| • HTA grado III: PAS ≥ 180 y/o PAD ≥ 110mmHg | |
| • HTA sistólica aislada: PAS ≥ 140 y PAD <90mmHg | |
| El diagnóstico se establece tras comprobar los valores de PA en al menos 2 medidas en 2 o más visitas separadas varias semanas | |
| Cuando la PAS y la PAD se ubiquen en distintas categorías se aplicará la categoría superior | |
| La HTA sistólica aislada se clasifica en grados (1, 2 o 3) según el valor de la PA sistólica | |
| Diabetes | • Glucemia en ayunas de al menos 8 h ≥ 126 mg/dl (7,0 mmol/l)a, o |
| • Glucemia 2 h tras una SOG de 75g ≥ 200 mg/dl (11,1mmol/l)a, o | |
| • HbA1C ≥ 6,5% (48 mmol/mol), o | |
| • Paciente con síntomas clásicos de hiperglucemia con un valor de glucemia ≥200 mg/dl (11,1 mmol/l)a | |
| Prediabetes | Presencia de: |
| • Glucemia en ayunas alterada: glucemia en ayunas entre 100 mg/dl (5,6 mmol/l) y 125 mg/dl (6,9 mmol/l), o | |
| • Intolerancia a la glucosa: glucemia 2 h tras SOG de 75g, entre 140 mg/dl (7,8 mmol/l) y 199 mg/dl (11,0 mmol/l), o | |
| • HbA1c entre 5,7 y 6,4% (39-47 mmol/mol) | |
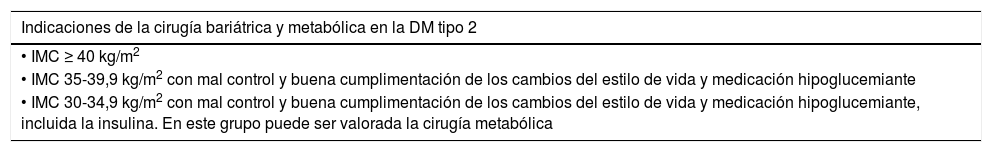
| Obesidad | IMC ≥ 30,0 kg/m2 |
| • Obesidad grado I: 30,0-34,9 kg/m2 | |
| • Obesidad grado II: 35,0-39,9 kg/m2 | |
| • Obesidad grado III: ≥ 40 kg/m2 | |
| Sobrepeso | IMC ≥ 25,0 kg/m2y <30,0 kg/m2 |
| • Grado I: 25,1-27,5 kg/m2 | |
| • Grado II: 27,6-30,0 kg/m2 | |
| Normopeso | IMC 18,50-24,9 kg/m2 |
| Bajo peso | IMC <18,5 kg/m2 |
| • Delgadez extrema <16,0 kg/m2 | |
| • Delgadez moderada 16,0-16,9 kg/m2 | |
| • Delgadez leve 17,0-18,4 kg/m2 | |
| Síndrome metabólico | Se requieren 3 de los siguientes 5 criterios: |
| 1) Perímetro abdominal elevado (≥ 94cm en varones y ≥80cm en mujeres de origen europeo) | |
| 2) TG ≥ 150 mg/dl (1,7 mmol/l) o en tratamiento con fármacos que reduzcan los TG | |
| 3) cHDL <40 mg/dl (1,0 mmol/l) en varones o <50 mg/dl (1,3 mmol/l) en mujeres o en tratamiento con fármacos dirigidos a aumentar el cHDL | |
| 4) PA ≥ 130/85mmHg o en tratamiento con fármacos dirigidos a reducir la PA | |
| 5) Glucemia en ayunas ≥ 100 mg/dl o en tratamiento con fármacos antidiabéticos | |
| Fumador actual37 | Persona que ha fumado por lo menos un cigarrillo en los últimos 6 meses. Dentro de este grupo se puede diferenciar: |
| • Fumador diario: persona que ha fumado por lo menos un cigarrillo al día durante los últimos 6 meses | |
| • Fumador ocasional: persona que ha fumado menos de un cigarrillo al día | |
| Cuantificación del consumo de tabaco (índice paquetes / año): (número cigarrillos fumados al día×número años de fumador)/20 | |
| Ex fumador | Persona que habiendo sido fumador se ha mantenido en abstinencia al menos los últimos 6 meses |
| Nunca fumador | Persona que nunca ha fumado o ha fumado menos de 100 cigarrillos en toda su vida |
| Fumador pasivo | Persona que no fuma, pero que respira habitualmente el humo de tabaco ajeno o humo de segunda mano o humo de tabaco ambiental |
| Lesión de órgano diana | • Rigidez arterial: presión de pulso (en el anciano) ≥ 60mmHg o velocidad de onda de pulso > 10 m/s |
| • Hipertrofia ventricular izquierda: | |
| – en el ECG (Índice Sokolow-Lyon> 3,5 mV; RaVL> 1,1 mV; producto voltaje por duración Cornell> 2.440 mV*ms), o | |
| – ecocardiográfica (masa de ventrículo izquierdo> 115 g/m2 en varones o > 95 g/m2 en mujeres por área de superficie corporal) | |
| • Microalbuminuria (30-300 mg/24 h) o ratio albúmina-creatinina (30-300 mg/g) o macroalbuminuria (> 300 mg/24 h) | |
| Enfermedad vascular subclínica | Presencia de: |
| • ITB <0,9 (Para algunos autores un valor > 1,4 es también patológico), o | |
| • Al menos una placa en arteria carótida o femoral, o | |
| • Cuantificación de CAC: Agatston ≥ 300 unidades | |
| Filtrado glomerular (FG) (ml/min/1,73 m2) en la enfermedad renal crónica | Grado | FG | Definición |
| G1 | ≥ 90 | Normal | |
| G2 | 60-89 | Ligero descenso del FG | |
| G3a | 45-59 | Descenso ligero-moderado del FG | |
| G3b | 30-44 | Descenso moderado del FG | |
| G4 | 15-29 | Descenso grave del FG | |
| G5 | <15 | Fallo renal (prediálisis) | |
| Categorías de albuminuria (cociente albúmina/creatinina en mg/g) en la enfermedad renal crónica | A1 | <30 | Normal |
| A2 | 30-300 | Moderadamente elevada | |
| A3 | > 300 | Muy elevada | |
Apo B: apolipoproteína B; CAC: calcio coronario; cLDL: colesterol-LDL; cHDL: colesterol-HDL; C-no-HDL: colesterol-no-HDL; DLCN: Dutch Lipid Clinic Network; ECG: electrocardiograma; ECV: enfermedad cardiovascular; FG: filtrado glomerular; GIM: grosor del espesor íntimo-medial; HbA1c: hemoglobina glucosilada; HDL: lipoproteína de alta densidad; HTA: hipertensión arterial; IMC: índice de masa corporal; ITB: índice tobillo-brazo; LDL: lipoproteínas de baja densidad; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RaVL: voltaje de la onda R en la derivación aVL; SOG: sobrecarga oral de glucosa; TG: triglicéridos.
Uno de los primeros pasos que hay que realizar al evaluar a pacientes con factores de riesgo es el cálculo del RCV, ya que hay determinadas decisiones que se tomarán en un sentido u otro según el nivel o valor del RCV, como, por ejemplo, el momento de iniciar tratamiento hipocolesterolemiante y su objetivo terapéutico.
El riesgo (absoluto) cardiovascular es la probabilidad de que ocurra un determinado episodio vascular en un determinado periodo de tiempo en base a los FRCV que tiene el paciente que pertenece a un determinado grupo poblacional. Por lo tanto, no hay un sistema universal de cálculo del RCV. Las guías europeas de prevención cardiovascular15 y las de control de la dislipemia12, a las que se adhiere la SEA a través del CEIPC, recomiendan el uso del sistema SCORE40 para valorar el RCV en su versión para países de bajo RCV en situación de prevención primaria, es decir, para individuos que aún no han tenido episodios cardiovasculares. Este sistema calcula el riesgo de muerte cardiovascular de causa aterosclerótica en un plazo de 10años considerando los siguientes factores de riesgo: sexo, edad, tabaquismo, PAS y CT.
Sistemas de cálculo de riesgo cardiovascularEn España se han utilizado mayoritariamente tres sistemas de estimación del RCV: uno cualitativo-ordinal (de la Guía Europea de Hipertensión31) y dos cuantitativos: el REGICOR41 y el SCORE40.
La guía de hipertensión utiliza un sistema que no cuantifica numéricamente el RCV sino que identifica la categoría de riesgo: bajo, moderado, alto o muy alto.
El sistema REGICOR está derivado de una muestra de población de Girona mediante un modelo matemático derivado del estudio Framingham y validado en un conjunto de muestras españolas. Es un sistema cuantitativo, como también lo es el SCORE, pero a diferencia de este, valora el riesgo coronario fatal y no fatal.
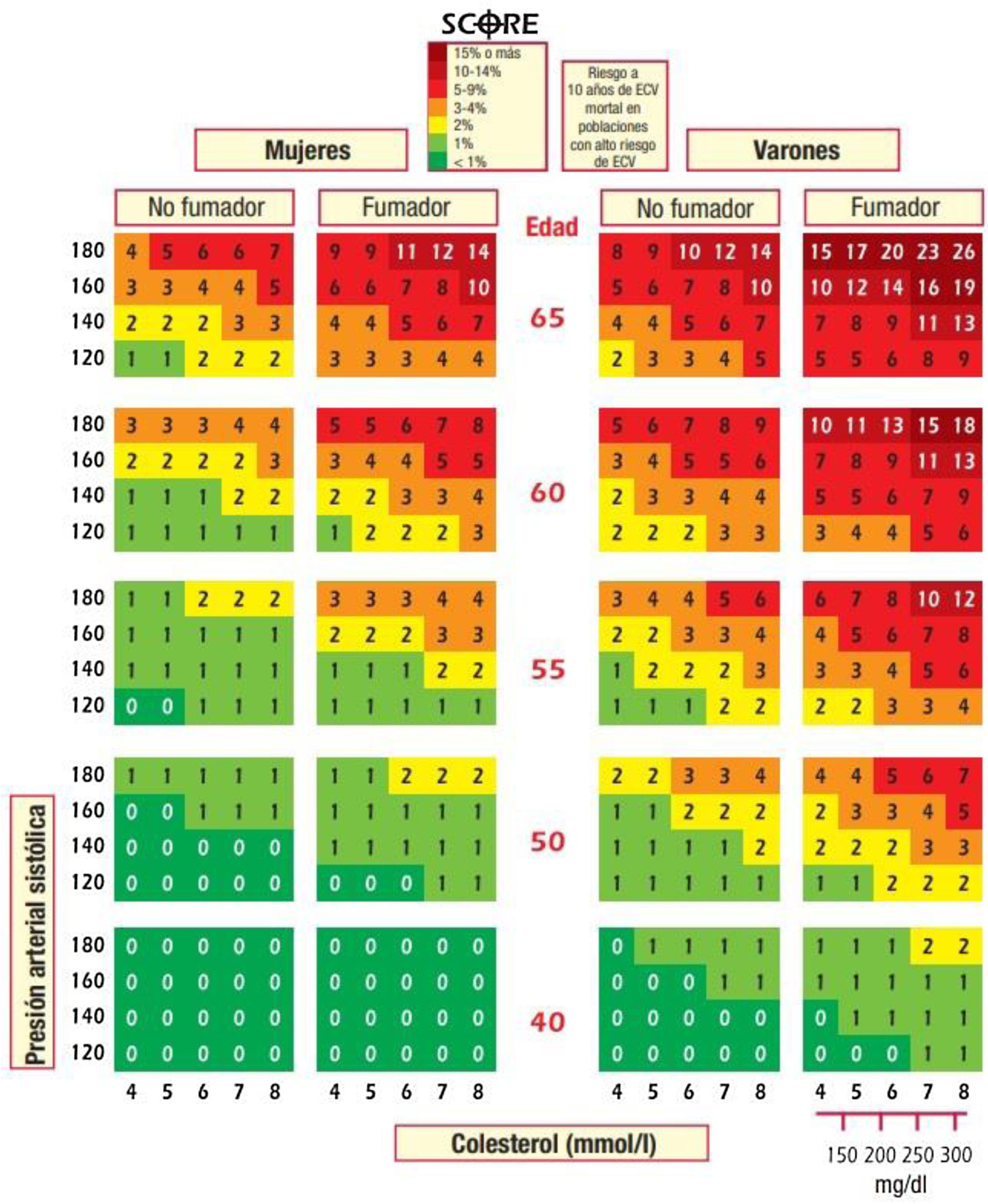
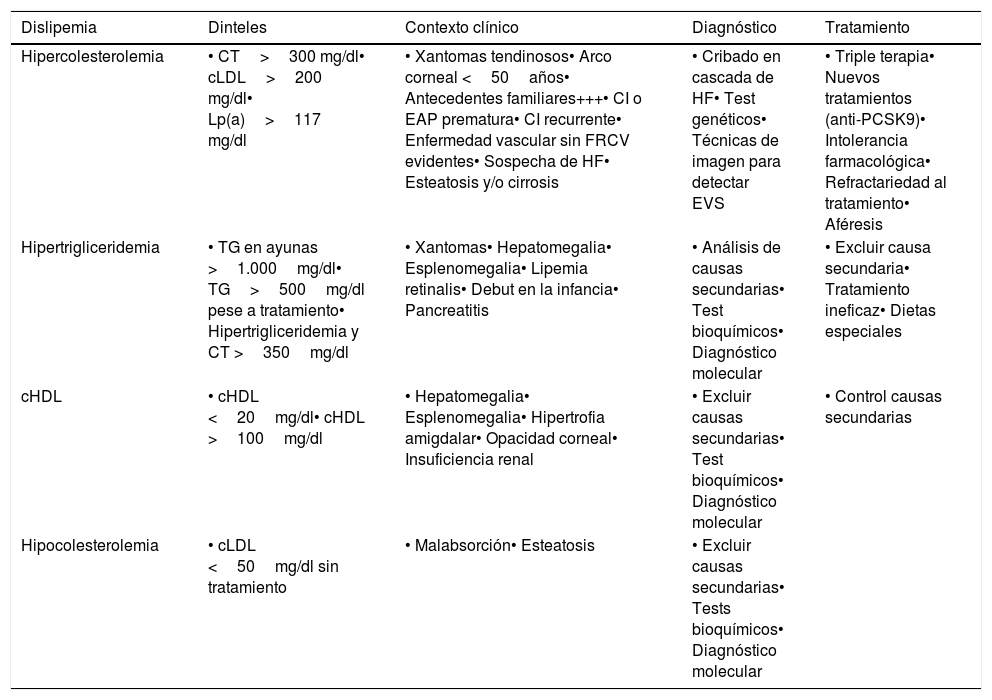
Proyecto SCOREEn el marco del proyecto Systematic COronary Risk Evaluation (SCORE) se ha calculado el riesgo mortal cardiovascular aterosclerótico a 10años con los datos de 19 cohortes de 16 zonas de Europa y se han publicado tablas para países de alto y de bajo RCV, perteneciendo España a estos últimos (fig. 1)40. Las variables incluidas son sexo, edad, tabaquismo (dicotómica), cifras de CT y de PAS, no incluyendo la DM y limitado hasta los 65años (aunque hay una tabla derivada parcialmente del proyecto SCORE para sujetos mayores de 65años denominada SCORE-OP —old people— no incluida en las guías de prevención cardiovascular). La ausencia de la DM, que podría ser una limitación, en la práctica no lo es, ya que la presencia de DM constituye de por sí una situación de alto riesgo. Algunos autores sugieren multiplicar por 3 (si es varón) o por 5 (si es mujer) el riesgo SCORE para pacientes diabéticos. También existe la versión con cociente CT/cHDL, pero los propios autores del SCORE recomiendan la utilización de la versión con solo el colesterol.
Sistema SCORE (Systematic Coronary Risk Estimation) para países de bajo riesgo cardiovascular.
De Piepoli et al.15. Reproducido con permiso de Oxford University Press en nombre de la Sociedad Europea de Cardiología.
© Sociedad Europea de Cardiología 2016. Todos los derechos reservados. Para obtener los permisos, envíe un correo electrónico a: journals.permissions@oup.com. Esta figura no está incluida en la licencia Creative Commons (CC BY-NC-ND 4.0) de esta publicación.
Con este sistema se identifica a los sujetos sin ECV, DM ni insuficiencia renal crónica (IRC) en diversas categorías de riesgo:
- •
Bajo riesgo: RCV a 10 años según SCORE <1%.
- •
Riesgo moderado: RCV a 10 años según SCORE >1% y <5%.
- •
Riesgo alto: RCV a 10 años según SCORE ≥5% y <10%.
- •
Riesgo muy alto: RCV a 10 años según SCORE ≥10%.
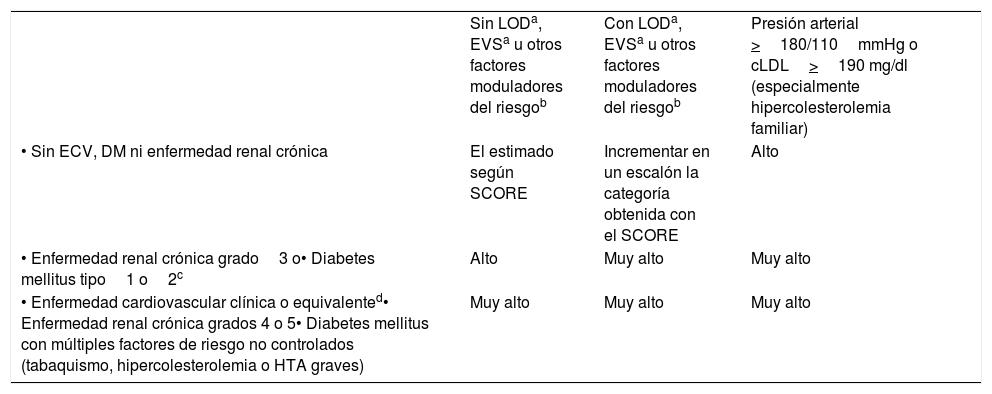
El cálculo general del riesgo debe realizarse mediante una valoración integral del paciente que incluya no exclusivamente el valor del riesgo calculado con SCORE, sino integrando factores modificadores del riesgo, datos de lesión de órganos diana y la presencia de ECV (tabla 5)8,12,15.
Cálculo de riesgo cardiovascular
| Sin LODa, EVSa u otros factores moduladores del riesgob | Con LODa, EVSa u otros factores moduladores del riesgob | Presión arterial >180/110mmHg o cLDL>190 mg/dl (especialmente hipercolesterolemia familiar) | |
| • Sin ECV, DM ni enfermedad renal crónica | El estimado según SCORE | Incrementar en un escalón la categoría obtenida con el SCORE | Alto |
| • Enfermedad renal crónica grado3 o• Diabetes mellitus tipo1 o2c | Alto | Muy alto | Muy alto |
| • Enfermedad cardiovascular clínica o equivalented• Enfermedad renal crónica grados 4 o 5• Diabetes mellitus con múltiples factores de riesgo no controlados (tabaquismo, hipercolesterolemia o HTA graves) | Muy alto | Muy alto | Muy alto |
El incremento del riesgo depende del número e intensidad de los factores moduladores. En general se precisa de varios de ellos o de una extrema gravedad de los mismos para elevar la categoría de riesgo al mismo nivel que lo hacen la presencia de EVS o LOD:
• Obesidad o sedentarismo.
• Individuos en situación de exclusión social.
• Intolerancia a la glucosa o glucemia en ayunas alterada.
• Elevación de TG, apolipoproteína B, Lp(a).
• Antecedentes familiares de ECV precoz.
• Enfermedades que supongan aumento de estrés inflamatorio-metabólico: enfermedades autoinmunes, síndrome de apnea/hipopnea del sueño, síndrome metabólico, lupus eritematoso sistémico, psoriasis, cáncer, VIH.
c Los pacientes con diabetes tipo 1 jóvenes pueden tener un riesgo cardiovascular moderado o bajo.
d Se considera ECV o equivalente a las siguientes condiciones:
• ECV clínica establecida:
−Episodio coronario (infarto de miocardio, síndrome coronario agudo, procedimiento de revascularización).
−Episodio cerebrovascular: ictus o AIT.
−Enfermedad arterial periférica sintomática.
−Aneurisma de aorta abdominal.
−Insuficiencia cardiaca (IC) independiente de la fracción de eyección.
• ECV evidente por técnicas de imagen, es decir, presencia de placa de ateroma significativa:
−Mediante angiografía coronaria (obstrucción > 50% de una arteria coronaria principal).
−Mediante ecografía carotidea o femoral (estenosis > 50%).
cLDL: colesterol de lipoproteínas de baja densidad; DM: diabetes mellitus; ECV: enfermedad cardiovascular; EVS: enfermedad vascular subclínica; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; LOD: lesión del órgano diana; Lp(a): lipoproteína (a); TG: triglicéridos.
Se aconseja seguir la estrategia de las guías europeas de prevención cardiovascular y de control de dislipemia, así como las de HTA, que clasifican a los sujetos en cuatro categorías de riesgo: bajo, moderado, alto y muy alto.
Hay situaciones que cualifican un riesgo alto o muy alto: hipertensión de grado3, hipercolesterolemia con cLDL >190mg/dl, DM, lesión de órgano diana, enfermedad renal crónica estadio3 o mayor o ECV establecida. En el resto de las situaciones nos manejaremos con el sistema SCORE. Dicho sistema considera riesgo bajo cuando es <1%, moderado si es ≥1% y <5%, alto si es ≥5% y <10% y muy alto si es ≥10%. La presencia de modificadores de riesgo supone incrementar una categoría de riesgo en caso de valores de riesgo próximos a una categoría superior.
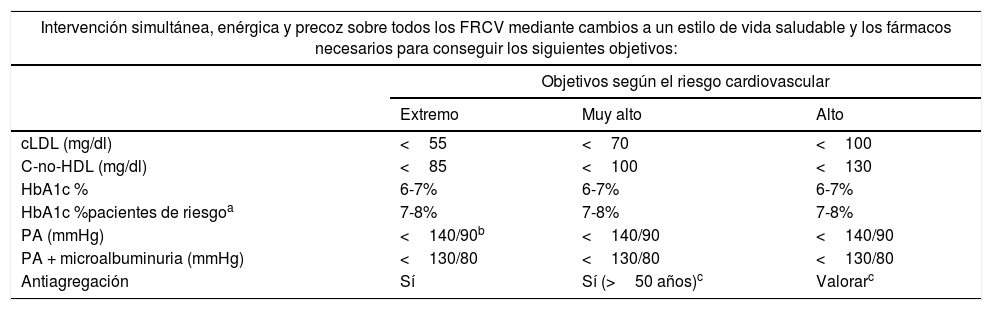
Recientemente se ha propuesto una clase más de riesgo: extremadamente alto42, correspondiente a los pacientes que presentan:
- -
Enfermedad coronaria progresiva a pesar de tener un cLDL <70mg/dl.
- -
ECV clínica estabilizada en pacientes con DM o enfermedad renal crónica (ERC) 3 o 4 o HFHe.
- -
ECV precoz (en varón <55 años, mujer <65 años).
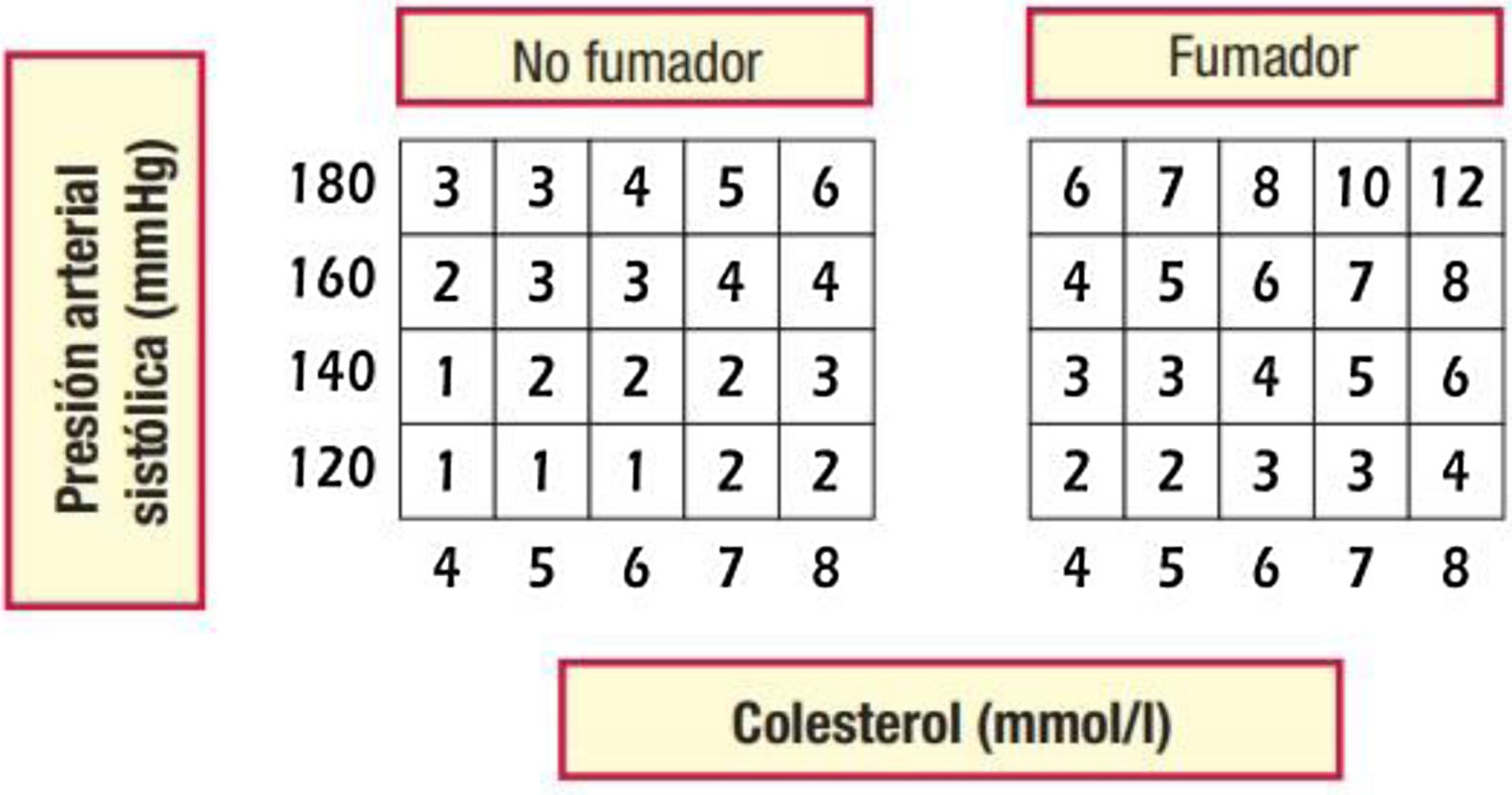
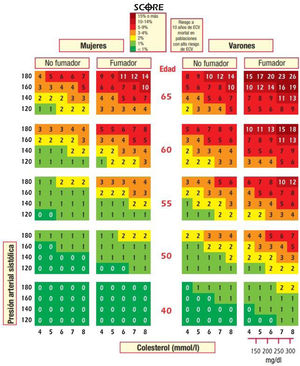
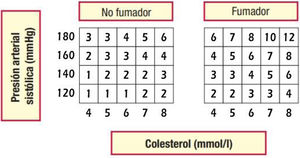
Los adultos jóvenes con elevación importante de múltiples factores de riesgo no tienen un RCV absoluto alto, por lo que se aconseja el cálculo del riesgo relativo y de la edad vascular12,15. De los sistemas utilizados en España, con el sistema SCORE se puede calcular el riesgo relativo (fig. 2) y la edad vascular43 (fig. 3). Además, comunicar al paciente su edad vascular es una forma de transmitir la información de su estado de RCV que se puede entender mejor que el valor matemático del riesgo absoluto. Los pacientes deben ser conscientes de su estado de riesgo para que adopten las medidas terapéuticas de estilos de vida y, si es el caso, farmacológicas.
Tabla de riesgo relativo. No hay categorías de riesgo relativo. Válida para hombres y mujeres de cualquier edad del SCORE (Systematic Coronary Risk Estimation).
De Piepoli et al.15. Reproducido con permiso de Oxford University Press en nombre de la Sociedad Europea de Cardiología.
© Sociedad Europea de Cardiología 2016. Todos los derechos reservados. Para obtener los permisos, envíe un correo electrónico a: journals.permissions@oup.com. Esta figura no está incluida en la licencia Creative Commons (CC BY-NC-ND 4.0) de esta publicación.
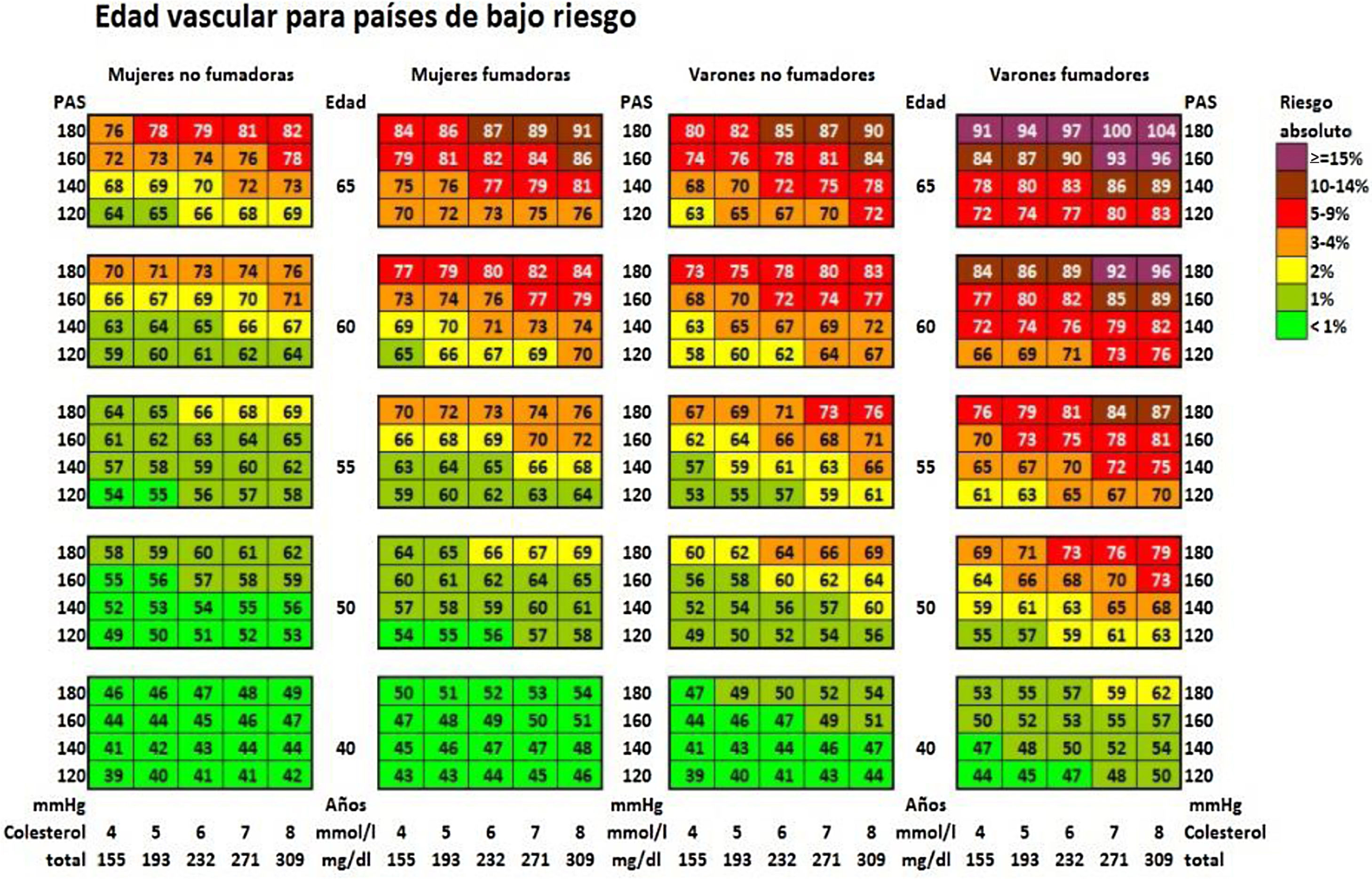
Tabla de la edad vascular según SCORE (Systematic Coronary Risk Estimation) para países de bajo riesgo cardiovascular. El color y el número de cada casilla definen el nivel de riesgo y la edad vascular, respectivamente.
De Cuende et al.43. Reproducido con permiso de Oxford University Press en nombre de la Sociedad Europea de Cardiología.
© Sociedad Europea de Cardiología 2010. Todos los derechos reservados. Para obtener los permisos, envíe un correo electrónico a: journals.permissions@oup.com. Disponible en: https://academic.oup.com/eurheartj/article/31/19/2351/441733. Esta figura no está incluida en la licencia Creative Commons (CC BY-NC-ND 4.0) de esta publicación.
Mediante la tabla de edad vascular derivada del SCORE se puede informar del riesgo absoluto y de la edad vascular. El cálculo de la edad vascular no precisa calibración, por lo que puede ser aplicado a cualquier población general, no existiendo diferencias territoriales.
Tanto la edad vascular como el riesgo relativo se pueden aplicar a cualquier edad, y tienen más utilidad clínica para sujetos sin riesgo alto.
Derivada del concepto de edad vascular está la velocidad de envejecimiento vascular44, que relaciona la edad vascular y la edad civil o cronológica.
Para pacientes con HF, que no aplican para las tablas habituales de cálculo del riesgo cardiovascular, se ha creado una primera herramienta específica basada en los datos de seguimiento de la cohorte española SAFEHEART45. Esta ecuación tiene en cuenta diversos factores como la edad, el tabaquismo, los niveles de cLDL bajo tratamiento, el IMC, la PA y los niveles de Lp(a), y permite discernir las diferencias en el riesgo en esta población específica, tan importante en nuestras consultas.
Recomendaciones generales para el control del riesgo cardiovascularRecomendaciones generales a la población para reducir su riesgo cardiovascularRecientemente el grupo de trabajo de Nutrición y Estilo de Vida de la SEA ha elaborado un detallado documento de consenso46 que aporta evidencias útiles y jerarquizadas que sirven de herramienta a los profesionales de la salud para ayudar a sus pacientes, partiendo del concepto de que las recomendaciones saludables deben ser las mismas para el control de cualquier factor de riesgo y para la prevención primaria y secundaria de las ECV. En él se resume la evidencia acumulada sobre componentes del estilo de vida como la dieta y el ejercicio físico46. Además, se hace especial hincapié no en el consumo de nutrientes, sino en el de alimentos y, sobre todo, en los patrones alimentarios más importantes para la prevención cardiovascular. Este concepto de patrón alimentario se ha afianzado en los últimos años como modelo para examinar la relación entre nutrición y salud y para servir de herramienta educativa para la población, modificando el paradigma tradicional de que la unidad nutricional básica de la dieta no son los nutrientes (p.ej., los polifenoles) sino los alimentos que los contienen (aceite de oliva virgen, cacao, frutas y verduras, etc.), ya que en sus matrices existen multitud de componentes capaces de interaccionar sinérgicamente o de modo antagónico sobre vías metabólicas determinantes para la salud cardiovascular. En esta guía recopilamos las principales recomendaciones del referido documento46.
Las diferentes dietas saludables tienen muchos componentes en común, algunos de ellos recomendables, como las frutas, las verduras, los frutos secos, las legumbres y el pescado, mientras que otros se deben restringir, como los alimentos ricos en grasa saturada, los que tienen azúcar añadido, abundante sal o han sido procesados. Hay una fuerte evidencia de que los patrones alimentarios de base vegetal, bajos en ácidos grasos saturados, colesterol y sodio, con un alto contenido en fibra, potasio y ácidos grasos insaturados, son beneficiosos y reducen la expresión de los FRCV. En este contexto destacan la dieta mediterránea, la dieta DASH, la dieta vegano-vegetariana y el índice de alimentación saludable alternativo, todos de base vegetal y con abundantes hidratos de carbono complejos. Los datos de grandes estudios de cohortes y, en el caso de la dieta mediterránea, el estudio clínico aleatorizado PREDIMED indican que la adherencia a estos patrones de alimentación confiere un claro beneficio cardiovascular47. Por el contrario, la dieta baja en grasas está actualmente en entredicho por su escaso potencial de protección cardiovascular. En relación con las grasas comestibles, el aceite de oliva virgen es la grasa culinaria más eficaz en la prevención de las ECV48. La intervención nutricional, durante unos 5años, en el estudio PREDIMED demostró que los participantes asignados a la dieta mediterránea suplementada con aceite de oliva virgen extra o con frutos secos experimentaron una reducción media del 30% de episodios cardiovasculares mayores47, aparte de otros efectos beneficiosos, entre ellos la reducción del riesgo de DM2 y de fibrilación auricular (FA)49. Es importante destacar que las margarinas actuales carecen en su mayoría de ácidos grasos trans y aportan ácidos grasos poliinsaturados n-6 y n-3.
El consumo de pescado o marisco tres veces por semana, dos de ellas en forma de pescado azul, reduce el RCV. Por ello, incentivar su consumo es un importante componente de las modificaciones de estilo de vida para la prevención de la ECV. Un beneficio nada desdeñable podría obtenerse cuando sustituye a la carne como plato principal en las comidas. Aun así, el documento antes indicado destaca que, por su riqueza en contaminantes marinos, los niños y mujeres en edad fértil no deben consumir pescado graso de gran tamaño, pescados como el atún rojo, el pez espada, el tiburón o la caballa porque contienen más contaminantes que especies más pequeñas. Las evidencias sobre las carnes indican que el consumo de carne blanca o carne magra (sin grasa visible), 3-4 raciones por semana, no incrementa el RCV, a diferencia del consumo de carnes procesadas (beicon, salchichas, embutidos) que contienen aditivos perjudiciales, como sal y nitratos, que incrementa la mortalidad total y el desarrollo de DM2 y ECV.
En relación con los lácteos, es deseable consumir al menos 2 raciones diarias (leche, leche fermentada, queso, yogur, etc.), en especial por su importante papel nutricional en el metabolismo del calcio y por su riqueza en proteínas de alta calidad biológica. Su restricción no parece ser una estrategia adecuada para la reducción del RCV, aunque sí se desaconseja el consumo habitual de lácteos con azúcares añadidos. Tampoco hay suficientes argumentos para eliminar los lácteos enteros de la dieta habitual. Para la prevención cardiovascular es recomendable reducir el consumo de grasa láctea concentrada, como la mantequilla y la nata. En la última década las recomendaciones sobre el consumo de huevos y la salud han sido discrepantes, en gran medida por falta de evidencia. Sin embargo, la evidencia científica actual sugiere que su consumo no es perjudicial en el contexto de una dieta saludable. Tanto la población general sana como las personas con FRCV, ECV previa o DM2 pueden consumir hasta un huevo al día sin temor por su salud cardiometabólica.
Las legumbres y cereales de grano completo son semillas que contienen múltiples nutrientes saludables y su consumo frecuente se asocia con reducción de factores de riesgo y de ECV. Para promover la salud cardiovascular y disminuir la concentración sanguínea de colesterol es recomendable consumir una ración de legumbres al menos 4 veces por semana. El consumo recomendado de cereales integrales es de unas 4 raciones/día, incluyendo pan en todas las comidas del día, pasta 2-3 veces/semana y arroz 2-3 veces/semana. En relación con el consumo de frutas y verduras, con las evidencias existentes se recomienda el consumo de 4-5 raciones diarias entre frutas y verduras, dado que reduce la mortalidad global y cardiovascular. Además, el efecto beneficioso de frutas y verduras es dosis-dependiente y es más evidente sobre el accidente cerebrovascular (ACV) que sobre la enfermedad coronaria. El consumo de tubérculos (sobre todo patatas) no se asocia con un aumento del RCV excepto si son fritas en aceites no recomendables y saladas.
El consumo frecuente de frutos secos se asocia con la reducción de ECV, sobre todo enfermedad coronaria, y mortalidad por cualquier causa47. Consumir con frecuencia (a diario o al menos 3 veces por semana) un puñado de frutos secos (equivalente a una ración de 30g) es muy recomendable para el control del colesterol y la salud en general. Se aconseja consumirlos crudos y sin pelar (no tostados ni salados) si es factible, ya que la mayor parte de los antioxidantes están en la piel. Para mantener el efecto saciante y evitar ganar peso deben consumirse durante el día, no como postre después de cenar. Entre los frutos secos que se recomienda consumir se incluyen avellanas, nueces, almendras, pistachos, anacardos, macadamias, piñones, etc. Si bien los cacahuetes no son realmente frutos de un árbol sino legumbres, su composición general y su alto contenido en ácidos grasos insaturados los asimila a los frutos secos, tanto desde el punto de vista nutricional como por sus efectos biológicos.
El cacao es una semilla con abundantes nutrientes, y el consumo de su principal derivado, el chocolate, mejora los factores de riesgo y se asocia con reducción de ECV, accidente vascular cerebral y DM2. Hay información que indica que tiene efectos hipocolesterolemiantes y antihipertensivos, mejorando la resistencia a la insulina, de forma que puede consumirse chocolate negro ≥70% sin azúcar añadido en el contexto de una dieta saludable. Además, se aconseja hacerlo durante el día y no por la noche después de cenar, cuando el efecto saciante no se puede compensar ingiriendo menos alimentos en la comida siguiente.
Las bebidas azucaradas forman parte de la dieta habitual de muchas personas y pueden suponer hasta un 20% del consumo calórico diario, favoreciendo un aumento de ECV, de obesidad y de DM2. La sustitución de este tipo de bebidas por agua sería muy importante para reducir el consumo energético y el riesgo de estas patologías y sus complicaciones. Si el paciente no acepta dicha sustitución, podemos recurrir a las bebidas con edulcorantes artificiales mientras no tengamos una evidencia científica de primer nivel sobre su inocuidad. El consumo de bebidas alcohólicas de cualquier tipo aumenta el cHDL, y su ingesta moderada (de bebidas fermentadas no destiladas), en comparación con la abstención o el consumo excesivo, se asocia con una reducción de ECV y mortalidad cardiovascular. Se puede permitir su consumo moderado siempre con las comidas y en el marco de una dieta saludable como la dieta mediterránea, siendo diferentes las recomendaciones para hombres y mujeres, ya que estas son más sensibles a los efectos del alcohol. No se debe promover el consumo de alcohol en las personas que habitualmente no lo hacen. El café (tanto el normal como el descafeinado) y el té son ricos en polifenoles, y hay evidencias de alto nivel de que su consumo habitual se asocia con reducción de ECV.
Existen numerosos alimentos funcionales (nutracéuticos) dirigidos a reducir el RCV, principalmente por reducción del colesterol. La eficacia hipocolesterolemiante de los esteroles vegetales y los preparados de fibra soluble, a nivel intestinal, ha sido ampliamente demostrada. La monacolina es un componente presente en la levadura roja de arroz que también reduce el colesterol, pues tiene la misma estructura química que la lovastatina. Así mismo, existen evidencias consistentes de que los ácidos grasos omega-3 a dosis farmacológicas disminuyen los TG plasmáticos.
El consumo excesivo de sal se asocia con ECV y mortalidad de causas cardiometabólicas. Debe recomendarse una dieta baja en sal (<5g/día) a nivel poblacional y con mayor justificación en pacientes hipertensos y sus familiares, recordando que para calcular la cantidad de sal total hay que multiplicar por 2,5 el contenido de sodio de los alimentos. Medidas especialmente eficaces para este fin son limitar el consumo de alimentos ricos en sal, como precocinados, enlatados, salazones, embutidos y bebidas carbónicas. Una alternativa a la sal es utilizar zumo de limón, ajo o hierbas aromáticas.
La actividad física es, según la Organización Mundial de la Salud (OMS), cualquier movimiento corporal producido por los músculos esqueléticos y que exija gasto de energía. Cuando se realiza de forma regular y mantenida protege del RCV y mejora sus factores de riesgo. Su práctica debe adaptarse a las particularidades propias de cada individuo, partiendo del principio de que poco es mejor que nada y considerando que abarca actividades como las que se realizan durante el trabajo, las formas de transporte activas, las tareas domésticas o de actividades recreativas. A su vez, el ejercicio físico es una variedad de la actividad física pero que se realiza de forma planificada, estructurada, repetitiva y realizada con un objetivo relacionado con la mejora o el mantenimiento de la aptitud física. Ambos se deben hacer de forma pausada y moderada, más que intensa y concentrada.
Es razonable pensar, y así lo muestran evidencias recientes, que no existe un modelo estándar de dieta saludable, sino que la respuesta biológica varía entre las personas, especialmente por diferencias individuales en el genoma y en el microbioma. En los próximos años la nutrición personalizada y de precisión, junto con otras ciencias como la cronobiología, en la que cada uno adopte la dieta que le sea personalmente más beneficiosa, serán un reto para la comunidad científica50. Finalmente, uno de los problemas más complejos de la relación entre las personas y su dieta es la adherencia, que depende de factores muy diferentes, como los propios del paciente, la familia, el equipo de salud que le acompaña y el propio sistema sanitario. Por ello es fundamental poner en marcha las estrategias para conseguirlo.
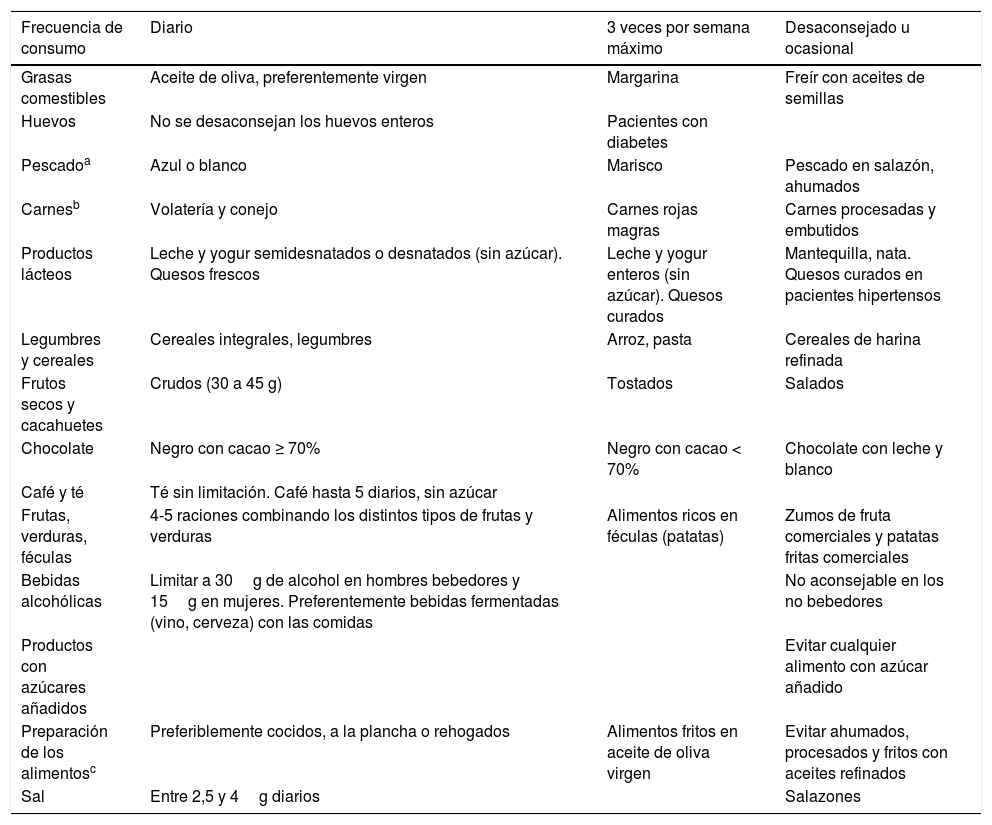
La tabla 6, recogida de dicho documento46, incluye de forma práctica la frecuencia en la forma y en la cantidad de consumo de alimentos.
Frecuencia en la forma y en la cantidad de consumo de alimentos
| Frecuencia de consumo | Diario | 3 veces por semana máximo | Desaconsejado u ocasional |
|---|---|---|---|
| Grasas comestibles | Aceite de oliva, preferentemente virgen | Margarina | Freír con aceites de semillas |
| Huevos | No se desaconsejan los huevos enteros | Pacientes con diabetes | |
| Pescadoa | Azul o blanco | Marisco | Pescado en salazón, ahumados |
| Carnesb | Volatería y conejo | Carnes rojas magras | Carnes procesadas y embutidos |
| Productos lácteos | Leche y yogur semidesnatados o desnatados (sin azúcar). Quesos frescos | Leche y yogur enteros (sin azúcar). Quesos curados | Mantequilla, nata. Quesos curados en pacientes hipertensos |
| Legumbres y cereales | Cereales integrales, legumbres | Arroz, pasta | Cereales de harina refinada |
| Frutos secos y cacahuetes | Crudos (30 a 45 g) | Tostados | Salados |
| Chocolate | Negro con cacao ≥ 70% | Negro con cacao < 70% | Chocolate con leche y blanco |
| Café y té | Té sin limitación. Café hasta 5 diarios, sin azúcar | ||
| Frutas, verduras, féculas | 4-5 raciones combinando los distintos tipos de frutas y verduras | Alimentos ricos en féculas (patatas) | Zumos de fruta comerciales y patatas fritas comerciales |
| Bebidas alcohólicas | Limitar a 30g de alcohol en hombres bebedores y 15g en mujeres. Preferentemente bebidas fermentadas (vino, cerveza) con las comidas | No aconsejable en los no bebedores | |
| Productos con azúcares añadidos | Evitar cualquier alimento con azúcar añadido | ||
| Preparación de los alimentosc | Preferiblemente cocidos, a la plancha o rehogados | Alimentos fritos en aceite de oliva virgen | Evitar ahumados, procesados y fritos con aceites refinados |
| Sal | Entre 2,5 y 4g diarios | Salazones |
Las carnes, fuente importante de proteínas animales, deben alternarse con el pescado, consumiendo una de estas opciones al día. Es preferible la carne blanca a la carne roja.
El consumo de platos aderezados con salsa de tomate, ajo, cebolla o puerro elaborada a fuego lento con aceite de oliva virgen (sofrito) puede realizarse a diario.
Adaptado de Pérez-Jiménez et al.46.
Una manera de evaluar la adherencia a la dieta mediterránea se puede obtener utilizando el cuestionario MEDAS (Anexo 4).
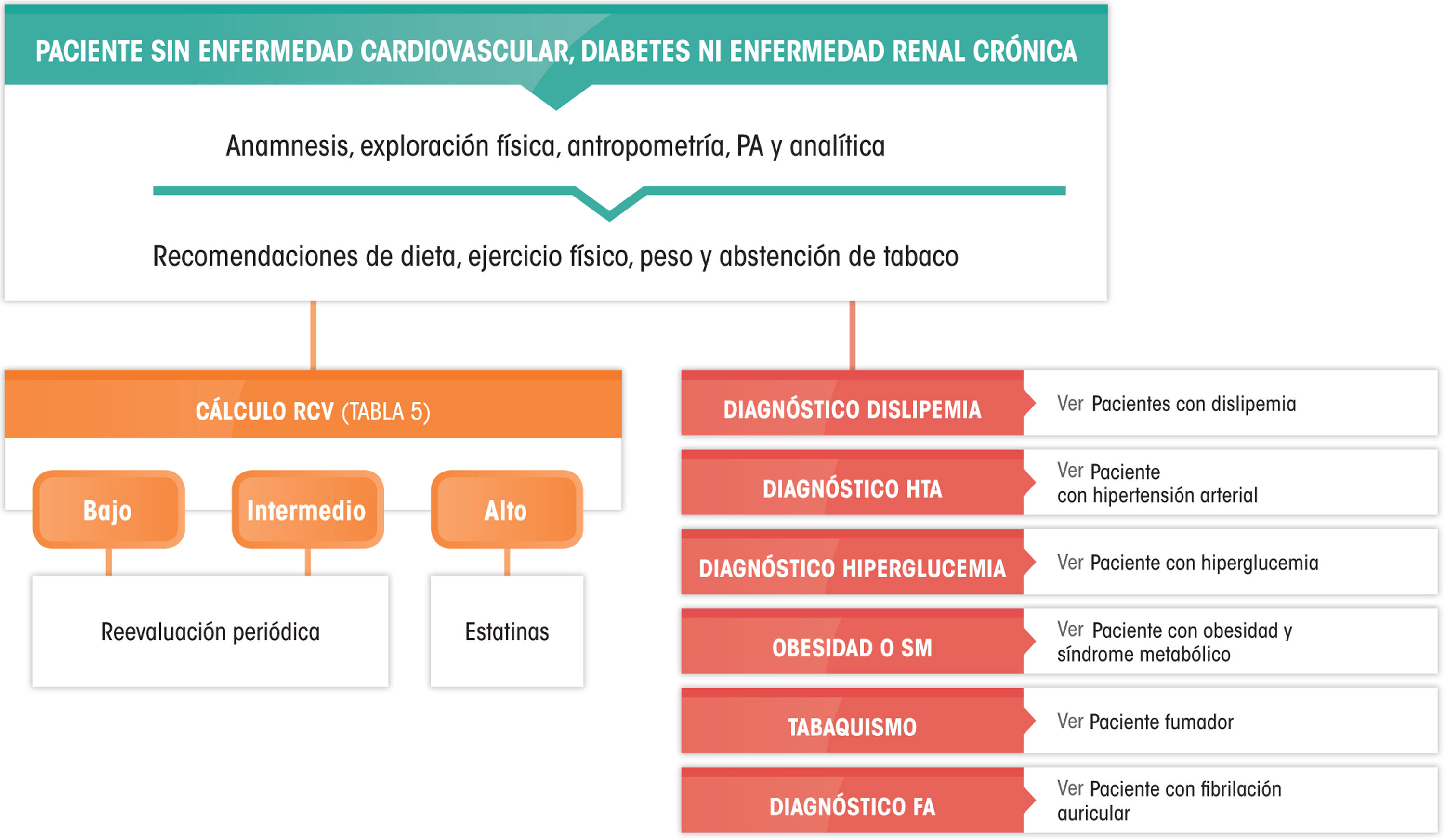
Recomendaciones farmacológicas generales en pacientes en prevención primariaLas recomendaciones de manejo clínico del RCV en pacientes sin ECV, DM ni IRC se recogen en la figura 4.
Se ha demostrado que el tratamiento con dosis bajas de aspirina reduce el riesgo de episodios vasculares, a expensas de la reducción de los infartos de miocardio no fatales y sin afectar al riesgo de ictus ni a la mortalidad, principalmente en personas de mediana edad. Sin embargo, parte del beneficio de la aspirina puede perderse con sus efectos adversos, sobre todo los relacionados con su potencial para causar hemorragia, de ahí que el balance de riesgos y beneficios de las dosis bajas de aspirina no estén claramente establecidos en prevención primaria.
Las guías norteamericanas de la USPSTF recomiendan iniciar el uso de aspirina a dosis bajas para la prevención primaria de la ECV en adultos de 50 a 59años que tengan un RCV mayor o igual al 10% a 10años, que no tengan aumentado el riesgo de hemorragia, que tengan una expectativa de vida de al menos 10años y que estén dispuestos a tomar dosis diariamente durante al menos 10años. La decisión de iniciar tratamiento en adultos de entre 60 y 69años con un RCV mayor o igual al 10% a 10años debe ser individualizada51.
Las guías europeas para la prevención cardiovascular de 201615, sin embargo, no recomiendan el tratamiento antiagregante para pacientes sin ECV, debido al aumento del riesgo de sangrado mayor. En este sentido, recientemente se han publicado varios ensayos clínicos con aspirina en prevención primaria, tanto en diabéticos como en no diabéticos, no encontrando un beneficio claro en su utilización en la prevención primaria de la ECV52-54.
EstatinasEn numerosos ensayos clínicos y metaanálisis55 las estatinas han demostrado reducir los episodios cardiovasculares en pacientes sin ECV, incluso con concentraciones no elevadas de colesterol. La reducción del riesgo relativo de ECV con las estatinas es independiente del RCV basal, pero para que el tratamiento sea eficiente es importante seleccionar a los pacientes con un alto RCV basal para que la reducción absoluta del RCV sea mayor.
Las guías europeas para la prevención cardiovascular15 recomiendan en los sujetos sin ECV, sin enfermedad renal crónica y sin diabetes estimar el riesgo de muerte de causa cardiovascular en los próximos 10años mediante las tablas del SCORE para el sur de Europa (fig. 1; véase el apartado «Sistemas de cálculo de riesgo cardiovascular»). Si el riesgo estimado es igual o mayor del 5% se considera al sujeto de alto riesgo, y si su cLDL es mayor de 100mg/dl estaría indicado iniciar tratamiento con estatinas. El tratamiento estaría también indicado en sujetos con un riesgo estimado <5% de acuerdo con el SCORE, pero que sean considerados de alto riesgo por el hecho de presentar lesión de órgano diana, EVS u otros factores modificadores que incrementaran su nivel de riesgo (tabla 5).
En las guías norteamericanas recomiendan el tratamiento con estatinas en los sujetos sin ECV, ni DM, con edades entre 40 y 75años, que tengan un riesgo estimado de episodio cardiovascular en los próximos 10años igual o superior al 7,5%, calculado en las tablas de riesgo de 2013, y un cLDL>70mg/dl. También lo recomiendan en pacientes con dislipemia, con cLDL>190mg/dl sin otros factores de riesgo.
Suplementos vitamínicosMuchos estudios observacionales prospectivos de casos y controles han observado asociaciones inversas entre la ingesta o las concentraciones séricas de vitaminas (A, grupo B, C, D y E) y el riesgo de ECV. Sin embargo, los datos de estudios prospectivos y los ensayos clínicos de intervención con suplementos vitamínicos y minerales no han demostrado ningún beneficio cardiovascular56. Por lo tanto, no está indicado el empleo de suplementos vitamínicos para la prevención de la ECV.
Recomendaciones generales en pacientes con enfermedad vascular subclínica y en prevención secundariaLos pacientes con EVS diagnosticada mediante la presencia de placas en arteria carótida o femoral o mediante CAC coronario tienen un riesgo de complicaciones cardiovasculares intermedio entre los sujetos en prevención primaria y secundaria, si bien en numerosas guías los clasifican como prevención secundaria. En estas circunstancias su manejo no diferiría del de los sujetos en prevención secundaria, si bien las evidencias de eficacia del tratamiento con antiagregantes son limitadas. Por ejemplo, en pacientes con ITB bajo pero sin claudicación intermitente el tratamiento con antiagregantes no ha demostrado ser eficaz57. En cualquier caso, su nivel de riesgo debe estimarse en función de lo recogido en la tabla 5.
En los pacientes en prevención secundaria, además de las medidas higiénico-dietéticas previamente comentadas (véase el apartado anterior «Recomendaciones generales a la población para reducir su riesgo cardiovascular»), existen una serie de tratamientos que han demostrado reducir el riesgo de nuevos episodios cardiovasculares (tabla 7).
Medidas farmacológicas que han demostrado reducir la tasa de complicaciones cardiovasculares en sujetos en prevención secundaria
| Tratamiento | Indicaciones potenciales |
|---|---|
| Antiagregantes | • Aspirina a dosis bajas o clopidogrel en pacientes con enfermedad coronaria, cerebrovascular o arterial periférica• Aspirina y dipiridamol estarían también indicados en sujetos con ictus o AIT previos• Aspirina más un inhibidor de P2Y12 en sujetos con síndrome coronario agudo o con colocación de stent, mantenido al menos 12 meses |
| Hipolipemiantes | • Estatinas si cLDL>70mg/dl para reducir en un 50% su concentración• Ezetimiba o iPCSK9 si no se consiguen las reducciones adecuadas con estatinas a las dosis toleradas y se precisan reducciones adicionales del cLDL• Fibratos si triglicéridos >200mg/dl una vez controlado el cLDL con estatinas en pacientes de alto RCV• Ácidos grasos omega-3 a dosis elevadas en hipertrigliceridemias >200mg/dl que persisten a pesar del tratamiento con estatinas en pacientes de alto RCV |
| Suplementos vitamínicos o nutricionales | Sin indicación |
| Bloqueo SRA | Si cardiopatía isquémica y:• Fracción de eyección ≤ 40%, o• Insuficiencia cardiaca, o• Diabetes mellitus, o• Hipertensión arterial |
| Betabloqueantes | Fracción de eyección ≤ 40% |
| Inhibidores de la aldosterona | Fracción de eyección ≤ 40% |
AIT: accidente isquémico transitorio; cLDL: colesterol-LDL; iPCSK9: inhibidor de la convertasa de proteínas subtilisina/kexina 9; P2Y12: quimiorreceptor para adenosín difosfato; SRA: sistema renina-angiotensina.
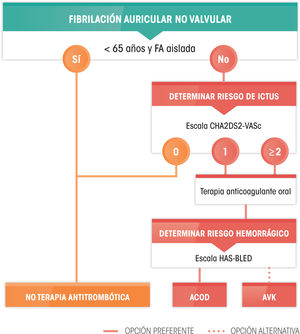
La aspirina es el antiagregante plaquetario más estudiado en la prevención cardiovascular a largo plazo en pacientes con infarto agudo de miocardio, ictus isquémico o EAP. En un metaanálisis de 16 estudios clínicos que incluían a más de 17.000 pacientes, el tratamiento con aspirina redujo significativamente los episodios cardiovasculares mayores (coronarios y cerebrovasculares) y la mortalidad total59. Asimismo, el tratamiento con aspirina se asoció con un exceso significativo de sangrados mayores; no obstante, los beneficios cardiovasculares de la aspirina superaron claramente el riesgo de sangrado.
El clopidogrel tiene un efecto similar a la aspirina en pacientes con infarto de miocardio o ictus isquémicos, pero puede ser superior a esta en sujetos con EAP. La asociación de aspirina y clopidogrel en prevención secundaria disminuye significativamente los episodios cardiovasculares mayores comparada con la aspirina sola, pero también incrementa significativamente el riesgo de sangrado.
En pacientes con ACV isquémico no cardioembólico o AIT la aspirina se puede usar sola o asociada a dipiridamol, y también se puede utilizar el clopidogrel en solitario.
El tratamiento estándar para un paciente que ha sufrido un síndrome coronario agudo, con o sin la colocación de stents, es la doble antiagregación plaquetaria (aspirina con un inhibidor de P2Y12) durante 12meses. En pacientes con alto riesgo de sangrado el tiempo con la doble antiagregación se puede reducir hasta 1-3meses.
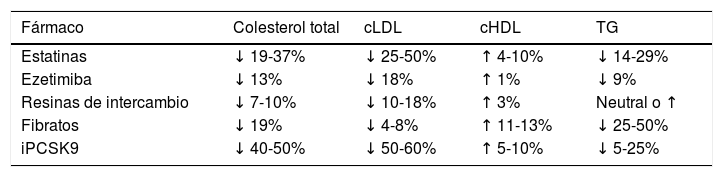
HipolipemiantesNumerosos ensayos clínicos y metaanálisis55 han demostrado que el tratamiento con fármacos hipolipemiantes (resinas, estatinas, ezetimiba, iPCSK9) en pacientes con ECV establecida disminuye los episodios cardiovasculares mayores y la mortalidad.
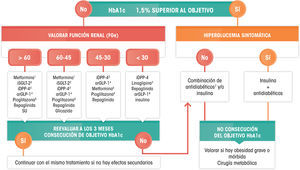
Las guías europeas15 recomiendan en los pacientes en prevención secundaria el tratamiento con estatinas con el objetivo de descender la concentración de cLDL por debajo de 70mg/dl. También recomiendan la reducción del cLDL al menos del 50% cuando la concentración basal esté entre 70 y 135mg/dl.
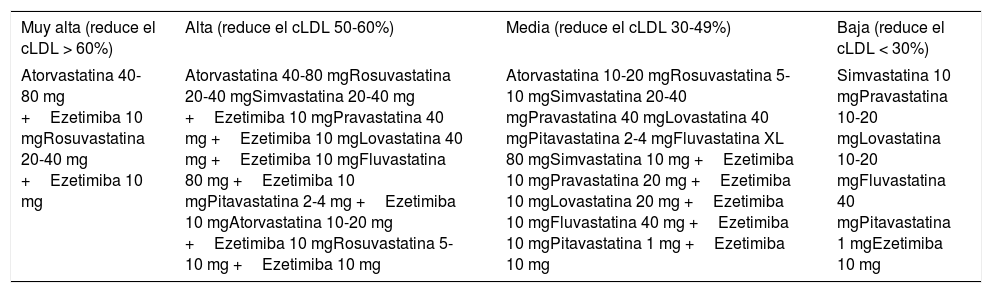
Las guías norteamericanas60 recomiendan en pacientes menores de 75años con ECV establecida la utilización de estatinas de alta o muy alta intensidad (tabla 8). Si no se consigue un descenso del cLDL ≥50%, se debe considerar la adición de ezetimiba o iPCSK9. En mayores de 75años con ECV recomiendan, una vez valorados los riesgos y beneficios, utilizar estatinas de intensidad moderada en monoterapia (tabla 8).
Clasificación de la terapia hipolipemiante según la eficacia terapéutica
| Muy alta (reduce el cLDL > 60%) | Alta (reduce el cLDL 50-60%) | Media (reduce el cLDL 30-49%) | Baja (reduce el cLDL < 30%) |
|---|---|---|---|
| Atorvastatina 40-80 mg +Ezetimiba 10 mgRosuvastatina 20-40 mg +Ezetimiba 10 mg | Atorvastatina 40-80 mgRosuvastatina 20-40 mgSimvastatina 20-40 mg +Ezetimiba 10 mgPravastatina 40 mg +Ezetimiba 10 mgLovastatina 40 mg +Ezetimiba 10 mgFluvastatina 80 mg +Ezetimiba 10 mgPitavastatina 2-4 mg +Ezetimiba 10 mgAtorvastatina 10-20 mg +Ezetimiba 10 mgRosuvastatina 5-10 mg +Ezetimiba 10 mg | Atorvastatina 10-20 mgRosuvastatina 5-10 mgSimvastatina 20-40 mgPravastatina 40 mgLovastatina 40 mgPitavastatina 2-4 mgFluvastatina XL 80 mgSimvastatina 10 mg +Ezetimiba 10 mgPravastatina 20 mg +Ezetimiba 10 mgLovastatina 20 mg +Ezetimiba 10 mgFluvastatina 40 mg +Ezetimiba 10 mgPitavastatina 1 mg +Ezetimiba 10 mg | Simvastatina 10 mgPravastatina 10-20 mgLovastatina 10-20 mgFluvastatina 40 mgPitavastatina 1 mgEzetimiba 10 mg |
Adaptado de Masana et al.63.
El fenofibrato podría estar indicado en pacientes con ECV, TG>200mg/dl y cHDL bajo, una vez que el cLDL estuviera controlado con estatinas12.
Otros fármacosLos suplementos de ácidos grasos omega-3 pueden reducir la mortalidad cardiovascular a través de la reducción de las muertes súbitas cardiacas en pacientes con enfermedad coronaria previa. Por ello, su utilización puede ser razonable en la prevención secundaria de la cardiopatía isquémica, en particular en los pacientes con un consumo insuficiente de pescado61. En pacientes en prevención secundaria o diabéticos de alto riesgo en tratamiento con estatinas (cLDL medio de 75mg/dl y TG entre 150 y 499mg/dl), el tratamiento con 4g de EPA redujo un 25% el riesgo de episodios cardiovasculares mayores58.
En pacientes con cardiopatía isquémica y disfunción del ventrículo izquierdo (FEVI≤40%), IC, DM o HTA, estaría indicado el tratamiento con un inhibidor de la enzima convertidora de angiotensina (IECA) o con un bloqueador del receptor de la angiotesinaII si hubiera intolerancia.
En pacientes con cardiopatía isquémica y disfunción del ventrículo izquierdo (FEVI≤40%) estaría también indicado el tratamiento con betabloqueantes y con antagonistas del receptor mineralocorticoide, siempre que no haya contraindicación.
No existen evidencias de que el descenso de la homocisteína con suplementos de ácido fólico o vitaminaB12 disminuya el riesgo de ECV en prevención secundaria.
La utilización en un mismo comprimido de aspirina, una estatina y un IECA facilita la adherencia al tratamiento en pacientes en prevención secundaria62.
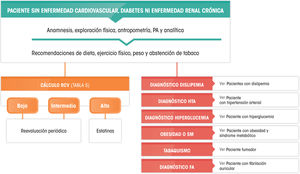
Recomendaciones terapéuticas específicasPacientes con dislipemiaPacientes con hipercolesterolemiaTodo paciente con hipercolesterolemia debe recibir una dieta baja en grasas de origen animal, de tipo mediterráneo, de acuerdo a las recomendaciones sobre alimentación de la SEA recientemente publicadas (tabla 6). La indicación de tratamiento hipolipemiante se basa en la concentración de cLDL y en el RCV global basal. Recomendamos el uso de tratamiento hipolipemiante orientado a obtener al menos los objetivos cLDL, y por ello hacemos énfasis en el uso de terapias hipocolesterolemiantes de alta intensidad, en las que las estatinas deben estar incluidas, según la tabla 8. En algunos pacientes puede haber indicación de resinas de intercambio iónico (colestipol, resincolestiramina o colesevelam) o inhibidores de PCSK9. La eficacia de los fibratos para reducir el colesterol suele ser moderada (tabla 9).
Eficacia de diversas familias de hipolipemiantes
| Fármaco | Colesterol total | cLDL | cHDL | TG |
|---|---|---|---|---|
| Estatinas | ↓ 19-37% | ↓ 25-50% | ↑ 4-10% | ↓ 14-29% |
| Ezetimiba | ↓ 13% | ↓ 18% | ↑ 1% | ↓ 9% |
| Resinas de intercambio | ↓ 7-10% | ↓ 10-18% | ↑ 3% | Neutral o ↑ |
| Fibratos | ↓ 19% | ↓ 4-8% | ↑ 11-13% | ↓ 25-50% |
| iPCSK9 | ↓ 40-50% | ↓ 50-60% | ↑ 5-10% | ↓ 5-25% |
Hace referencia a pacientes en prevención primaria, no diabéticos, con función renal preservada y un riesgo según las tablas de SCORE inferior al 5% en 10años sin que coexistan factores moduladores del riesgo ni lesión de órganos diana. La concentración de cLDL recomendada es <115mg/dl.
El tratamiento se basará en cambios terapéuticos del estilo de vida (CTEV), que incluyen alimentación de acuerdo a los estándares de la dieta mediterránea. Podría estar indicado el uso de alimentos funcionales enriquecidos en fitosteroles y fibra para disminuir el colesterol junto al incremento de la actividad física, la abstención tabáquica y la pérdida de peso si fuera necesaria. La prescripción de fármacos para disminuir el colesterol no está universalmente indicada y deberá considerarse de forma individualizada si un paciente presenta dos de los siguientes factores: edad (hombres >45años; mujeres >50años); IMC>30; antecedentes familiares de enfermedad vascular arteriosclerótica precoz; dislipemia aterógena; SM; Lp(a)>50mg/dl; placas carotideas significativas por ecografía, índice tobillo-brazo inferior a 0,9; índice de calcio coronario >400 unidades.
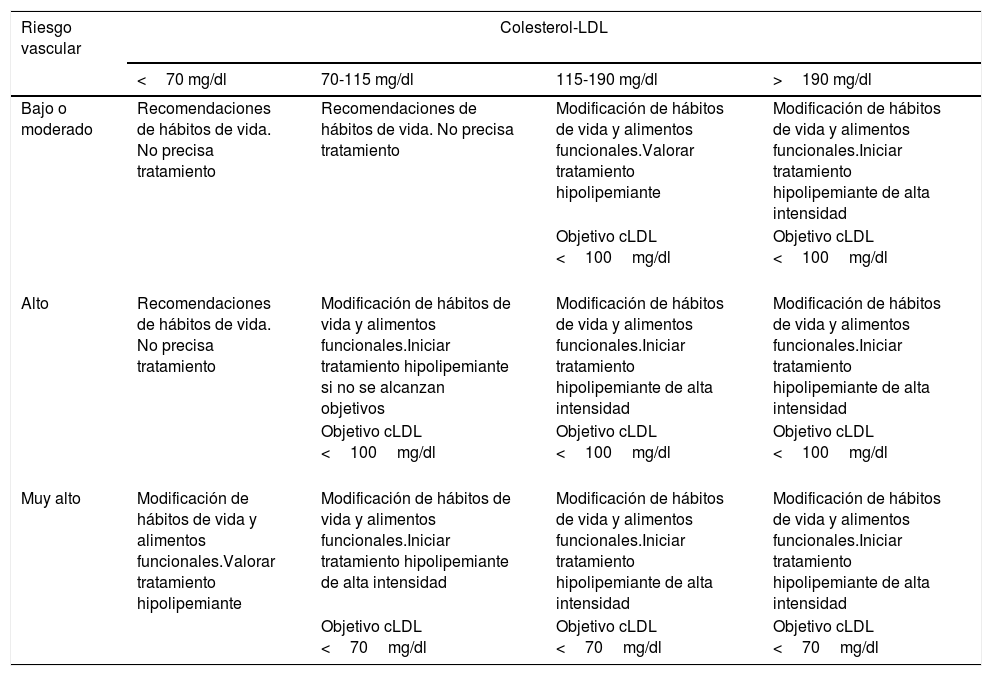
cLDL superior a 190mg/dlEl objetivo terapéutico es conseguir un cLDL <100mg/dl. El tratamiento se basará en CTEV, que incluye alimentación de acuerdo a los estándares de la dieta mediterránea. Se recomienda el uso de alimentos funcionales enriquecidos en fitosteroles y fibra, incremento de la actividad física, abstención tabáquica y pérdida de peso si fuera necesario.
Si persisten cifras de cLDL >190mg/dl, se recomienda tratamiento farmacológico hipocolesterolemiante de alta intensidad que teóricamente garantice un descenso del cLDL de al menos un 50% (tabla 8).
Se recomienda descartar HF aplicando la puntuación de la DLCN (Anexo 6) y estudio genético en caso de diagnóstico al menos probable.
Paciente de alto riesgo cardiovascularEl objetivo terapéutico es reducir el cLDL <100mg/dl.
El tratamiento inicial se basará en la aplicación de CTEV. Si persisten cifras de cLDL >100mg/dl, se recomienda tratamiento hipocolesterolemiante de alta intensidad que teóricamente garantice un descenso de cLDL de al menos un 50% (tabla 8). El tratamiento inicial debe ser con estatinas y, en caso de no alcanzar objetivos, asociado con ezetimiba.
Paciente de muy alto riesgo cardiovascularEl objetivo terapéutico es cLDL <70mg/dl y un descenso de al menos el 50% de los valores basales.
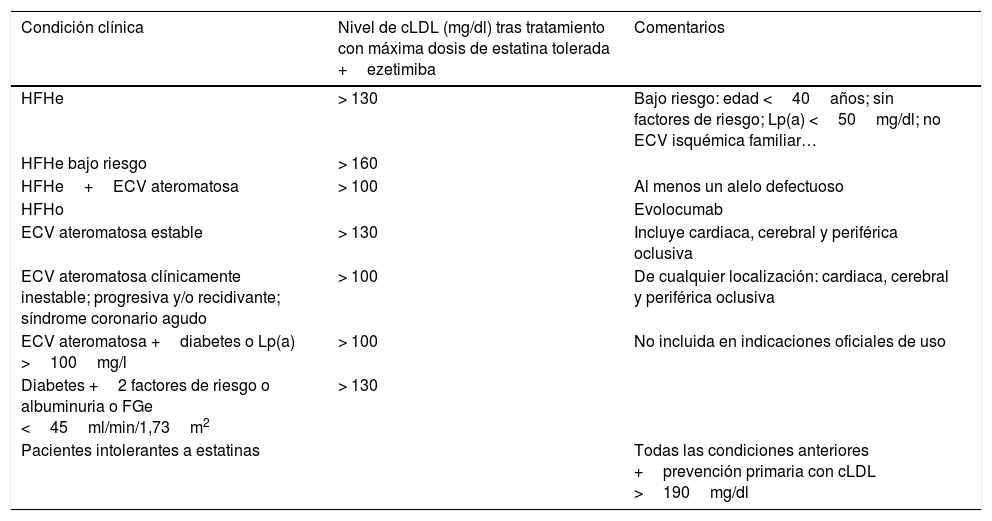
El tratamiento inicial se basará en la aplicación de CTEV y simultáneamente tratamiento hipocolesterolemiante de alta intensidad que teóricamente garantice un descenso de cLDL de al menos un 50% (tabla 8). El tratamiento inicial debe ser con estatinas y, en caso de no alcanzar objetivos, asociadas con ezetimiba. La utilización de iPCSK9 estaría recomendada en pacientes de alto o muy alto riesgo que no consigan alcanzar objetivos terapéuticos a pesar de un tratamiento hipolipemiante óptimo. La SEA hace las siguientes indicaciones que se enumeran en la tabla 10.
Criterios de la SEA para la utilización de iPCSK9
| Condición clínica | Nivel de cLDL (mg/dl) tras tratamiento con máxima dosis de estatina tolerada +ezetimiba | Comentarios |
|---|---|---|
| HFHe | > 130 | Bajo riesgo: edad <40años; sin factores de riesgo; Lp(a) <50mg/dl; no ECV isquémica familiar… |
| HFHe bajo riesgo | > 160 | |
| HFHe+ECV ateromatosa | > 100 | Al menos un alelo defectuoso |
| HFHo | Evolocumab | |
| ECV ateromatosa estable | > 130 | Incluye cardiaca, cerebral y periférica oclusiva |
| ECV ateromatosa clínicamente inestable; progresiva y/o recidivante; síndrome coronario agudo | > 100 | De cualquier localización: cardiaca, cerebral y periférica oclusiva |
| ECV ateromatosa +diabetes o Lp(a) >100mg/l | > 100 | No incluida en indicaciones oficiales de uso |
| Diabetes +2 factores de riesgo o albuminuria o FGe <45ml/min/1,73m2 | > 130 | |
| Pacientes intolerantes a estatinas | Todas las condiciones anteriores +prevención primaria con cLDL >190mg/dl |
ECV: enfermedad cardiovascular; FGe: filtrado glomerular estimado; HFHe: hipercolesterolemia familiar heterocigota; HFHo: hipercolesterolemia familiar homocigota; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína(a); PCSK9: proproteína convertasa subtilisina/kexina tipo 9.
Adaptado de Masana et al.64.
Un resumen de las indicaciones del tratamiento con fármacos hipolipemiantes de acuerdo al riesgo obtenido en la tabla 5 puede verse en la tabla 11.
Indicaciones de tratamiento hipolipemiante según riesgo cardiovascular y concentración de cLDL
| Riesgo vascular | Colesterol-LDL | |||
|---|---|---|---|---|
| <70 mg/dl | 70-115 mg/dl | 115-190 mg/dl | >190 mg/dl | |
| Bajo o moderado | Recomendaciones de hábitos de vida. No precisa tratamiento | Recomendaciones de hábitos de vida. No precisa tratamiento | Modificación de hábitos de vida y alimentos funcionales.Valorar tratamiento hipolipemiante | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante de alta intensidad |
| Objetivo cLDL <100mg/dl | Objetivo cLDL <100mg/dl | |||
| Alto | Recomendaciones de hábitos de vida. No precisa tratamiento | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante si no se alcanzan objetivos | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante de alta intensidad | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante de alta intensidad |
| Objetivo cLDL <100mg/dl | Objetivo cLDL <100mg/dl | Objetivo cLDL <100mg/dl | ||
| Muy alto | Modificación de hábitos de vida y alimentos funcionales.Valorar tratamiento hipolipemiante | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante de alta intensidad | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante de alta intensidad | Modificación de hábitos de vida y alimentos funcionales.Iniciar tratamiento hipolipemiante de alta intensidad |
| Objetivo cLDL <70mg/dl | Objetivo cLDL <70mg/dl | Objetivo cLDL <70mg/dl | ||
En pacientes con dislipemia aterogénica el objetivo principal es conseguir un cLDL o un colesterol no-HDL en objetivos terapéuticos según el nivel de riesgo con estatinas (fig. 5). Una vez conseguido, en pacientes en prevención secundaria que a pesar de un tratamiento hipolipemiante óptimo mantengan una concentración de TG>200mg/dl y cHDL bajo (<40mg/dl en varones o <50mg/dl en mujeres), se puede recomendar la utilización de fenofibrato o de ácidos grasos omega-365.
Tratamiento antidiabético en el paciente con DM tipo 2.
1 Fármaco de elección para iniciar la terapia farmacológica, en ausencia de contraindicaciones. Introducción gradual para minimizar efectos adversos digestivos.
2 Fármacos aconsejables en caso de antecedentes de ECV. No utilizar canagliflozina en caso de arteriopatía periférica (riesgo de amputación). En filtrados glomerulares de 45 a 60 se debe reducir la dosis de empagliflozina y canagliflozina y suspender dapaglifozina.
3 Fármacos a considerar en pacientes > 75 años con comorbilidades (anciano frágil). Ajustar la dosis de iDPP-4 en caso de ERC, excepto con linagliptina, que no precisa ajuste de la dosis.
4 Indicados especialmente en pacientes obesos. Liraglutida ha demostrado reducir la mortalidad cardiovascular en diabéticos con antecedentes de ECV. En caso de ERC, ajustar la dosis de exenatida.
5 Contraindicado en IC (grado iii/iv), vigilar edemas. Considerar su uso en alta resistencia insulínica o en esteatosis hepática.
6 ERC estadio 3a: reducir dosis 50%. ERC estadio 3b: no iniciar y considerar la relación riesgo-beneficio de la continuación de la terapia.
7 Utilizar los antidiabéticos adecuados según la función renal y RCV. Está contraindicada de la combinación arGLP-1 e iDPP-4.
8 Algunos arGLP1 disponen de indicación hasta con FG de 15.
arGLP1: agonistas del receptor del péptido similar al glucagón 1; DM: diabetes mellitus; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; FG: filtrado glomerular; FGe: filtrado glomerular estimado; HbA1c: hemoglobina glucosilada; IC: insuficiencia cardíaca; iDPP4: inhibidores de la dipeptidasa-4; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; RCV: riesgo cardiovascular.
Adaptado de Ruiz-García et al.99.
Actuar según lo mencionado anteriormente para su nivel de riesgo vascular y sus cifras de cLDL. Según las recomendaciones de la EAS de 2016, en los pacientes de alto riesgo, en los que después de controlar el cLDL con estatinas persiste una concentración de TG>200mg/dl, se puede considerar el uso de fenofibrato o de ácidos grasos omega-312. Así mismo, los resultados del estudio REDUCE-IT permiten recomendar dosis elevadas de omega-3 asociadas a estatinas en pacientes en prevención secundaria e hipertrigliceridemia no controlada58.
Triglicéridos entre 500 y 1.000mg/dlActuar según lo mencionado anteriormente para su nivel de riesgo vascular y sus cifras de colesterol no-HDL (aplicando los mismos criterios que los del cLDL más 30mg/dl).
Si tras la aplicación de las medidas terapéuticas recomendadas persisten cifras de TG superiores a 500mg/dl, valorar la asociación de fenofibrato y/o ácidos grasos omega-366.
Triglicéridos >1.000mg/dlEs prioritario disminuir los TG con dieta para prevenir una pancreatitis reduciendo la cantidad total de grasa a menos de 30g diarios y valorar, en los casos graves y persistentes, la introducción de aceite TCM (TG de cadena media).
Iniciar tratamiento con fenofibrato y/o ácidos grasos omega-3 (>3g/día) y, si no es suficiente, asociar ambos (>3g/día) y/o estatinas.
Pacientes con dislipemias genéticasHipercolesterolemia familiarLos pacientes con HF deben alcanzar los mismos objetivos de cLDL que la población general (<100mg/dl o <70mg/dl) de acuerdo a su nivel de riesgo. Además de la dieta y el estilo vida saludable, la mayor parte de los pacientes deben recibir una combinación de estatinas de alta potencia en combinación con ezetimiba67. De acuerdo a su riesgo basal, que también puede estratificarse, estos pacientes pueden ser tratados con iPCSK9 (tabla 10). Es necesario proceder a un tratamiento precoz para evitar el desarrollo de complicaciones cardiovasculares. Los pacientes con la forma homocigota de la enfermedad pueden recibir, además de la terapia hipolipemiante convencional (estatinas a altas dosis y ezetimiba), evolocumab y, en algunas circunstancias, lomitapida y/o aféresis de LDL68. Las guías sugieren que los niños con HF pueden iniciar tratamiento a los 8-10años, comenzando con dosis bajas y escalando hasta alcanzar los niveles recomendables12. El objetivo cLDL sugerido en los niños es <135mg/dl.
Hiperlipemia combinada familiarNo existen recomendaciones específicas para el tratamiento de esta entidad. Las guías EAS de 2016 establecen que esta dislipemia eleva el RCV y debe ser tratada inicialmente con dieta y cambios del estilo de vida; el fármaco de primera elección son las estatinas, ya que estas reducen igualmente el riesgo vascular en paciente con hipertrigliceridemia concomitante; los objetivos del cLDL y del colesterol no HDL son los recomendados según el nivel de riesgo.
DisbetalipoproteinemiaEsta es una rara hiperlipemia caracterizada por elevación de partículas lipoproteicas intermedias (remanentes) que se traduce en una hiperlipemia mixta grave, habitualmente la presencia de xantomas estriados palmares y un elevado riesgo de ECV precoz. Suele estar causada por la combinación de un genotipo E2/E2 en el gen de la ApoE y uno o varios factores ambientales (hipotiroidismo, obesidad, etc.). Debe ser sospechada en cualquier hiperlipemia mixta con niveles bajos de ApoB (<120mg/dl)69. El tratamiento va dirigido a controlar el factor ambiental coexistente, en especial la obesidad, y a utilizar estatinas combinadas o no con fibratos. Dadas las características de la dislipemia, el objetivo principal es controlar el colesterol no-HDL70.
Síndrome de quilomicronemiaConsiste en un acúmulo de quilomicrones en el torrente sanguíneo debido a una falta de actividad de la LPL y a un insuficiente catabolismo de los TG con un aumento severo de la concentración de estos71. Existe un grupo de quilomicronemias de base genética grave, el síndrome de quilomicronemia familiar (SQF)72, y otro mucho más frecuente, debido a la asociación de variantes genéticas menos patogénicas con factores agravantes, el síndrome de quilomicronemia multifactorial (SQM)73. El SQF es raro, ya que afecta a 1/1.000.000 de la población mundial. Se debe a mutaciones recesivas con pérdida de función, de carácter homocigoto o heterocigoto compuesto, de los genes de la LPL, de la ApoC2, la ApoA5, el factor1 de maduración de la lipasa (LMF1), la proteína1 de unión a las lipoproteínas de alta densidad anclada en el glicosilfosfatidilinositol (GPIHBP1) y la glicerol 3-fosfato deshidrogenasa1 (G3PDH1)74,75. La quilomicronemia aparece aun sin factores agravantes y las concentraciones de TG se mantienen muy altas de forma crónica, en general >10mmol/l (885mg/dl), siendo la respuesta a la dieta y a los fármacos escasa. El suero tiene un aspecto lechoso, y si se deja durante una noche en la nevera, aparece un sobrenadante cremoso. Suele cursar con dolor abdominal, de ligero y esporádico a severo y persistente, con limitación de la ingesta de alimentos y un deterioro muy acusado de la calidad de vida76. La complicación más grave es la pancreatitis aguda, que es tanto más frecuente y recidivante cuanto mayor es la concentración de TG, y puede aparecer en los primeros años de la vida77. La pancreatitis puede evolucionar a pancreatitis crónica con insuficiencia pancreática y diabetes. También pueden aparecer xantomas eruptivos que afectan a la superficie de extensión de las extremidades y al tronco, hepatoesplenomegalia y lipemia retinalis78.
El SQM es debido a la asociación de distintos factores genéticos de menor patogenicidad con causas de hipertrigliceridemia secundaria79. Existe un riesgo de pancreatitis, pero es menor que en el SQF por el menor grado de severidad y persistencia de la hipertrigliceridemia80. La respuesta a la dieta, a la actividad física y a los fármacos hipotrigliceridemiantes suele ser buena. El SQM suelen aparecer en la edad adulta o media de la vida.
HipoalfalipoproteinemiaLas causas más comunes de hipoalfalipoproteinemia son las ligadas a la hipertrigliceridemia y a la denominada dislipemia aterogénica. Las causas primarias son excepcionales y comprenden la enfermedad de Tangier, el déficit de LCAT y mutaciones a nivel del gen de ApoA181. No existen tratamientos específicos para estas entidades, y el tratamiento de estos sujetos debe ir encaminado al control de los restantes factores de RCV82.
Paciente con hipertensión arterialAntes de iniciar el tratamiento antihipertensivo se recomienda una medida adecuada de la PA para confirmar el diagnóstico de HTA (tabla 3), especialmente en la HTA de grado1: PAS 140-159mmHg y/o PAD 90-99mmHg (tabla 4).
Las medidas ambulatorias mediante monitorización ambulatoria de la PA durante 24h (MAPA) o mediante automedida estandarizada de la PA en domicilio (AMPA) se correlacionan más estrechamente con el pronóstico y la lesión de órganos diana que la medida clínica, por lo que su uso es altamente recomendado, no solo como diagnóstico en sujetos no tratados, o para la identificación de sujetos con HTA de bata blanca (PA clínica elevada, con valores de PA en la MAPA normales), sino también para monitorizar los efectos del tratamiento y evaluar la adherencia, así como para la detección de sujetos con HTA enmascarada (sujetos con PA normal en la consulta y valores elevados durante la MAPA). La importancia de la MAPA en el diagnóstico y seguimiento de los sujetos con HTA ha sido recientemente confirmada por Banegas et al.83. Este artículo mostró que la PA ambulatoria fue un potente predictor de mortalidad cardiovascular y mortalidad por cualquier causa, que la HTA de bata blanca no es un fenómeno benigno y que la HTA enmascarada presenta un riesgo de mortalidad incluso superior al de la HTA sostenida.
La tabla 12 muestra la definición de hipertensión según los valores de PA clínica, ambulatoria o automedida en el domicilio.
Definiciones de hipertensión según los valores de PA clínica, ambulatoria o automedida en domicilio
| Categoría | PAS (mmHg) | PAD (mmHg) |
|---|---|---|
| PA en la consulta | ≥ 140 | ≥ 90 |
| PA ambulatoria | ||
| Diurna (o en vigilia) | ≥ 135 | ≥ 85 |
| Nocturna (o durmiendo) | ≥ 120 | ≥ 70 |
| 24 horas | ≥ 130 | ≥ 80 |
| PA en el domicilio | ≥ 135 | ≥ 85 |
PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica
Adaptado de Williams et al.8.
La decisión de iniciar el tratamiento farmacológico dependerá no solo del nivel de PA, sino también del RCV en función de otros FRCV asociados, de la presencia de lesión subclínica de órganos diana (tabla 4), la cual predice la mortalidad cardiovascular de forma independiente a la puntuación del SCORE15,84, especialmente en el grupo de riesgo moderado, o bien de la presencia de una ECV o enfermedad renal establecida.
El tratamiento inicial debe incluir siempre los cambios de estilo de vida como único tratamiento inicial en los sujetos con HTA grado1 y riesgo bajo o moderado85,86. En los sujetos con HTA de grado1 pero de alto riesgo o con lesión de órgano diana se debe iniciar también el tratamiento farmacológico de forma precoz, una vez confirmado el diagnóstico de HTA en varias visitas, y preferiblemente mediante la medida ambulatoria de la PA (MAPA o AMPA).
En los sujetos con HTA de grado2 (PAS entre 160-179mmHg y o PAD de 100-109mmHg) y en los sujetos con HTA de grado3 debe añadirse el tratamiento farmacológico desde el inicio, y la mayoría de ellos requerirán tratamiento antihipertensivo combinado con al menos dos antihipertensivos. Aproximadamente el 10-12% de los hipertensos tratados requerirán más de 3 antihipertensivos87.
El principal beneficio del tratamiento antihipertensivo deriva de la reducción de la PA86, independientemente del fármaco utilizado, y el tratamiento puede iniciarse con diuréticos tiazídicos o similares (indapamida, clortalidona), IECA o ARAII, antagonistas del calcio o betabloqueantes. La posición de estos últimos como fármacos de primera línea ha sido cuestionada debido a su menor efectividad en la prevención del ictus o sus posibles efectos metabólicos desfavorables (aunque esto puede no ser aplicable a todos los betabloqueantes), excepto en las situaciones clínicas con indicación específica para estos agentes (enfermedad coronaria, IC con fracción de eyección reducida, etc.). También pueden estar indicados como tratamiento inicial en hipertensos jóvenes con un patrón hipercinético y tendencia a la taquicardia, o en mujeres en edad fértil, en las que el uso de inhibidores del sistema renina-angiotensina (SRA) debe usarse con precaución por su contraindicación desde las fases iniciales de la gestación.
Objetivo terapéutico del tratamiento antihipertensivoEl primer objetivo es reducir la PAS <140mmHg en todos los pacientes. A partir de los resultados del estudio SPRINT88,89 y de los más recientes metaanálisis90,91, las nuevas guías8 aconsejan que si el tratamiento antihipertensivo es bien tolerado, la meta terapéutica sería una PAS de 130mmHg o inferior en la mayoría de los pacientes. Respecto a la PAD, un valor <80mmHg debería ser considerado en todos los hipertensos, independientemente del nivel previo, riesgo o comorbilidades (tabla 13).
Objetivos terapéuticos de la PAS clínica en algunos subgrupos de hipertensos
| Edad | Presión arterial |
|---|---|
| Edad <65 años | 120 a <130mmHg |
| Edad ≥ 65 años | 130 a <140mmHga |
| Diabetes | 130mmHg o inferiorb |
| Enfermedad coronaria | 130mmHg o inferior |
| Enfermedad renal crónica | 130 a <140mmHg |
| Post ictus/AIT | 120 a <130mmHg |
AIT: accidente isquémico transitorio.
La prevalencia de HTA en los pacientes diabéticos es de hasta el 80%, siendo el doble que la observada en población no diabética de la misma edad y características. La coexistencia de HTA y DM incrementa el riesgo de desarrollar ECV con una mayor incidencia de enfermedad coronaria, IC, EAP, ictus y mortalidad cardiovascular.
Se recomienda iniciar el tratamiento con una combinación de un inhibidor del sistema SRA más un antagonista del calcio o un diurético tiazídico o tiazida-like, excepto cuando el filtrado glomerular estimado (FGe) es <30ml/min/1,73m2, en cuyo caso estaría indicado el diurético de asa. No se recomienda el uso de una combinación de dos inhibidores del SRA.
Se aconseja iniciar el tratamiento antihipertensivo cuando la PA clínica es ≥140/90mmHg, y el objetivo terapéutico es una PAS de 130mmHg o menor si es tolerada, pero no inferior a 120mmHg, con una PAD <80mmHg, pero no <70mmHg. En los sujetos de 65años o más se recomienda un objetivo terapéutico para la PAS de 130 a <140mmHg8,90.
HTA y enfermedad renal crónicaLa prevalencia de HTA en estos pacientes es del 67-92%, y representa su comorbilidad más frecuente. Por otra parte, la presencia de la HTA puede acelerar el daño renal, además de incrementar el RCV. Como en todos los sujetos con HTA, el tratamiento farmacológico debe acompañarse de cambios de estilo de vida, haciendo especial énfasis en la reducción en la ingesta de Na. Los diuréticos de asa deben sustituir a los diuréticos tipo tiazida o tiazida-like cuando el FGe es <30ml/min/1,73m2. Debido a que el descenso de la PA reduce la presión de perfusión, no es infrecuente una reducción del FGe entre el 10-20% al inicio del tratamiento. Se debe hacer una cuidadosa monitorización de los electrolitos.
Se recomienda iniciar el tratamiento cuando la PA es ≥140/90mmHg con un objetivo terapéutico para la PAS (tanto en el paciente diabético como en el no diabético) en el rango de 130 a <140mmHg. En algunos casos, y de forma individualizada, se puede reducir más la PA en función de la tolerancia y de su impacto sobre la función renal y electrolitos. En los pacientes con proteinuria >1g/día es beneficiosa una reducción mayor de la PA.
Se recomienda como tratamiento inicial un inhibidor del SRA más un antagonista del calcio o un diurético. No se recomienda el uso de dos inhibidores del SRA.
HTA y enfermedad coronaria estableLa HTA es un factor de riesgo mayor de enfermedad coronaria. Numerosos ensayos clínicos han demostrado los beneficios del tratamiento antihipertensivo en la reducción de la incidencia de enfermedad coronaria, tanto en prevención primaria como en prevención secundaria.
Excepto en algunos casos, como ancianos mayores de 80años o ancianos frágiles, en general se recomienda como tratamiento inicial la terapia doble con un inhibidor del SRA (IECA o ARAII) más un betabloqueante o antagonista del calcio, aunque pueden ser utilizadas otras combinaciones, como antagonista del calcio dihidropiridínico más betabloqueante. En un segundo escalón, si no se controla la HTA, el paciente debe ser tratado con triple terapia, en general añadiendo un diurético a alguna de las combinaciones anteriores.
Si presentan angina sintomática, se recomienda una combinación de betabloqueates y antagonistas del calcio dihidropiridínicos.
El objetivo terapéutico sería una PAS de 130mmHg o inferior si es tolerado, pero no <120mmHg, y una PAD <80mmHg, pero no <70mmHg. En sujetos de 65años o más un objetivo terapéutico de PAS entre 130-140mmHg puede ser adecuado.
HTA e insuficiencia cardiaca o hipertrofia ventricular izquierdaEl antecedente de HTA está presente en el 75% de los pacientes con IC crónica. Se recomienda el tratamiento antihipertensivo cuando la PA clínica es ≥140/90mmHg, tanto en pacientes con IC con fracción de eyección (FE) reducida como en los que presentan IC con FE preservada. En los pacientes con IC y FE reducida se recomienda el tratamiento con un inhibidor del SRA (IECA o ARAII), un betabloqueante y un diurético ±un antagonista de los receptores mineralcorticoides. Si no se logra el control de la HTA a pesar del tratamiento anterior, se podría añadir un antagonista del calcio dihidropiridínico.
En los pacientes con IC y FE preservada no hay fármacos específicos que hayan demostrado su eficacia en la morbimortalidad, más allá del control de la HTA, pero en caso de hipertrofia ventricular izquierda (HVI) (muy frecuente en estos pacientes), se recomienda el uso de un inhibidor del SRA en combinación con un antagonista del calcio o un diurético. En los pacientes con HVI se recomienda un objetivo terapéutico de PAS entre 120-130mmHg.
HTA e ictusEl ictus es una causa mayor de mortalidad, incapacidad y demencia. Dado que el ictus es un grupo heterogéneo, en cuanto a causas y hemodinámica subyacente, el control de la HTA en estos pacientes es complejo y supone un auténtico reto. El objetivo terapéutico es una PA <140/90mmHg, pero un objetivo de PAS entre 120-130mmHg puede ser considerado en muchos casos.
HTA resistenteRepresenta aproximadamente un 10-12% de los hipertensos tratados92. Una HTA se considera resistente cuando no se ha conseguido reducir la PA <140/90mmHg a pesar de dosis óptimas (o las dosis máximas toleradas) y un plan terapéutico que incluya un diurético (típicamente IECA o ARAII más un antagonista del calcio y un diurético).
Se debe confirmar el mal control mediante MAPA (preferible) o AMPA, y se han de excluir las causas de seudorresistencia (p.ej., mala adherencia) y la HTA secundaria.
Recientemente se ha descrito un nuevo fenotipo (HTA refractaria) cuando no se alcanza una PA <140/90mmHg a pesar del uso de 5 o más antihipertensivos93,94. Es poco frecuente (1,4%), y también precisa de la realización de una MAPA de 24h para su confirmación, así como descartar las causas de seudorresistencia, como se ha mencionado anteriormente en la HTA resistente87.
Seguimiento del paciente hipertensoTras el inicio del tratamiento farmacológico antihipertensivo es importante efectuar un seguimiento del mismo al menos una vez dentro de los dos primeros meses para evaluar el efecto sobre la PA, detectar los posibles efectos adversos y detectar una posible mala adherencia. Posteriormente se recomienda un control entre 3-6meses para verificar el control de la PA y evaluar la adherencia.
La mala adherencia es una causa frecuente de falta de control de la HTA. Para su evaluación y detección juegan un papel fundamental las enfermeras, farmacias y otros profesionales sanitarios, los cuales son de gran ayuda para la educación, apoyo y seguimiento a largo plazo de los pacientes hipertensos, por lo que han de formar parte de la estrategia global para la mejora del control de la PA. La simplificación del tratamiento y la reducción del número de comprimidos ayudarán sin duda a una mejor adherencia y a un mejor control de la PA a mediano y largo plazo.
Se recomienda una valoración de los factores de riesgo y la detección de lesión asintomática de órganos diana mediada por la HTA cada dos años91.
En los sujetos con PA normal-alta, aunque no sean tratados, se recomiendan cambios de estilo de vida y un seguimiento regular (al menos una visita anual) para medir la PA clínica y ambulatoria, así como para reevaluar su RCV.
Paciente con hiperglucemia (prediabetes y diabetes)Clasificación y pruebas diagnósticasSe ha llamado, arbitrariamente, hiperglucemia a cifras de glucosa plasmática en ayunas ≥100mg/dl, estableciéndose una gradación patológica basada en los criterios definidos en tabla 4.
La prueba de sobrecarga oral de glucosa (SOG) se realiza administrando 75g de glucosa en un adulto o 1,75g/kg de peso (máximo 75g) en niños, disueltos en agua y bebidos en menos de 5min. Los requerimientos para una correcta realización e interpretación son: ayuno nocturno de 8h después de un mínimo de 3días con una dieta >150g de hidratos de carbono por día, actividad física normal los días previos (el reposo en cama altera la prueba), ausencia de enfermedad aguda, estrés o fármacos que modifiquen la tolerancia a la glucosa (como diuréticos, anovulatorios, hidantoínas, corticoides, etc.) Debe realizarse por la mañana y en reposo. No fumar, ni tomar café, la noche anterior ni durante la prueba. Desde la introducción de la prueba de HbA1c en el diagnóstico de prediabetes y DM, tiene muy poco interés.
La medición de los valores de HbA1c debe realizarse utilizando un método estandarizado y de referencia. Esta prueba tiene ciertas ventajas comparada con la SOG: no requiere ayuno y no se altera por el estrés y por enfermedades intercurrentes. Pero tiene menor sensibilidad en el límite inferior, mayor coste y limitada disponibilidad en ciertas regiones del mundo en desarrollo. La correlación entre HbA1c y promedio de glucosa plasmática es muy alta; sin embargo, en ciertos casos puede alterarse la glicación de las proteínas, como en sujetos de edad avanzada, en algunas razas/etnias, con anemia y algunas hemoglobinopatías1.
Control de la prediabetes y diabetes: objetivo de glucosa y HbA1cControl del paciente con prediabetesLa prediabetes, descrita en la tabla 4, es una situación que aumenta el riesgo de desarrollar DM2 y ECV, en particular cuando la glucemia en ayunas es de 110-125mg/dl y la HbA1c es de 6,0-6,4%. En la práctica podemos diferenciar:
- -
Prediabetes leve: glucemia en ayunas 100-109mg/dl o HbA1c 5,7-6,0%.
- -
Prediabetes grave: glucemia en ayunas 110-125mg/dl o HbA1c 6,1-6,4%, esta segunda situación con un importante aumento del riesgo de ECV y de DM.
El control del paciente con prediabetes se basa en:
- •
Cambios del estilo de vida. Diversos programas de intervención sobre el estilo de vida (dieta y ejercicio) han demostrado un claro beneficio y son la base del tratamiento de estos pacientes. Un metaanálisis sobre los efectos de intervenciones en los estilos de vida en personas con prediabetes encontró una reducción del 54% del riesgo de desarrollar DM295. Las características generales de la dieta y del ejercicio físico en la prevención cardiovascular han sido previamente descritas y avalan la idoneidad de una dieta tipo mediterránea, con restricción calórica si existe sobrepeso u obesidad.
- •
Intervención farmacológica. En sujetos con prediabetes la ADA34 recomienda el tratamiento con metformina, especialmente en aquellos con IMC>35kg/m2, edad <60años y en mujeres con antecedentes de diabetes gestacional. Las evidencias son limitadas, pero la metformina ha demostrado una reducción de la incidencia de DM del 31-50%.
En sujetos con prediabetes, los agonistas del receptor de la GLP-1 (arGLP1) y la pioglitazona han demostrado una disminución significativa de la incidencia de DM del 55 y del 72%, respectivamente34. Pero estos fármacos no han sido aprobados para la prevención de la DM.
En resumen, durante la intervención en prediabetes están siempre indicados los cambios en el estilo de vida, mientras que el tratamiento farmacológico se debe valorar en los casos que presenten glucemia en ayunas ≥110mg/dl, HbA1c ≥6,1% y obesidad de predominio visceral.
Control del paciente con diabetesComo se ha definido previamente, el paciente con DM tiene un elevado RCV (alto, muy alto o extremo)96, siendo la ECV la primera causa de muerte en la DM y su prevalencia 2-8 veces superior a la del sujeto no diabético de similar edad y sexo.
Los objetivos del tratamiento del paciente con DM son: prevenir y retardar las complicaciones macrovasculares y microvasculares, y reducir la elevada morbimortalidad cardiovascular.
El máximo beneficio en la prevención cardiovascular del paciente con DM se obtiene interviniendo de forma simultánea en todos los factores de riesgo: dislipeia, hipertensión e hiperglucemia, obviamente junto a las medidas de cambios del estilo de vida, que incluyen el no fumar. Como demostró el estudio STENO-297, la intervención simultánea sobre estos tres factores, aun sin conseguir los objetivos óptimos, llevó a una reducción de la ECV del 53%; además, se ha evidenciado que, tras 21años de intervención intensiva sobre estos factores, el beneficio cardiovascular es aún mayor, incluyendo la disminución de la mortalidad total97, lo que refuerza la idea de que la intervención precoz, intensiva y completa sobre todos los FRCV es la más apropiada.
Para conseguir un adecuado control de la hiperglucemia se debe considerar tanto la intervención no farmacológica como el tratamiento farmacológico.
Intervención no farmacológica en el control de la hiperglucemiaLa optimización del estilo de vida del paciente con DM2 es una intervención esencial para mejorar no solo el control glucémico sino también las comorbilidades asociadas como la dislipemia, la obesidad y la HTA. Los cambios hacia un estilo de vida saludable deben incluir los siguientes aspectos:
- -
Cese del tabaquismo y moderación de la ingesta alcohólica, siempre que no haya contraindicación.
- -
Gestión intensiva de pérdida de peso (>5%) en caso de sobrepeso u obesidad. Se recomiendan intervenciones en el estilo de vida (asesoramiento nutricional, actividad física y cambio de hábitos) con supervisión continua.
- -
Actividad física que combine ejercicios aeróbicos y de fuerza-resistencia de intensidad moderada o vigorosa durante al menos 150min a la semana.
- -
Preferir la ingesta de hidratos de carbono procedentes de las verduras, frutas, cereales integrales, legumbres y productos lácteos sobre otras fuentes. Limitar especialmente los alimentos procesados que contienen grasas añadidas, azúcares o sodio.
- -
Recomendar el consumo de ácidos grasos poliinsaturados n-3 presentes en el pescado, especialmente en el azul (sardina, salmón, atún, caballa, jurel, etc.).
- -
Una dieta tipo mediterránea rica en ácidos grasos monoinsaturados (aceite de oliva virgen y frutos secos) puede beneficiar el control glucémico y de los FRCV, y por lo tanto puede ser recomendada como una alternativa eficaz.
- -
Recomendar la ingesta de fibra en la dieta (>40g/día o 20g/1.000kcal/día).
Se recomienda que en todas las consultas se insista en los mensajes a pacientes y familiares sobre el beneficio del autocuidado, junto con la promoción del ejercicio físico y los hábitos alimentarios saludables.
Tratamiento farmacológico de la hiperglucemia.Objetivos de control de HbA1cPara establecer el objetivo de HbA1c en los pacientes con DM2 hay que evaluar de forma conjunta la edad del paciente, las comorbilidades (especialmente la presencia de ECV), el riesgo de hipoglucemia, el tiempo de evolución y el grado de la capacidad de autocuidado o apoyo familiar.
Hay diferencias entre las diferentes guías: la AACE/ACE96 propone como objetivo una HbA1c ≤6,5% para la mayoría de los pacientes y HbA1c >6,5% en pacientes con importantes comorbilidades, esperanza de vida limitada o riesgo de hipoglucemia, o si el objetivo primario no puede lograrse sin resultados adversos. La ADA34 define un objetivo menos estricto, entre el 7 y el 8%, en sujetos con las características descritas, aunque propone como objetivo general una HbA1c <7% y <6,5% en pacientes con DM2 de corta duración, tratados solo con estilo de vida o metformina, y en aquellos con larga esperanza de vida y sin ECV.
En el tratamiento de la DM hay que evitar hipoglucemias, ya que se ha demostrado un aumento estadísticamente significativo de la mortalidad total y cardiovascular relacionada con ellas98. Por ello se proponen los siguientes objetivos: de forma general HbA1c6-7% (cifras menores del 6% en sujetos tratados pueden cursar con hipoglucemias nocturnas no detectadas) y entre el 7 y el 8% en los siguientes casos99:
- -
Mayor riesgo de hipoglucemia.
- -
Edad avanzada o corta expectativa de vida.
- -
Larga evolución de la DM2.
- -
Comorbilidades importantes y/o antecedentes de ECV.
- -
Poca capacidad de autocuidado y/o limitado apoyo familiar.
En el tratamiento de la DM2 no disponemos del fármaco ideal. Este debería actuar sobre todas las alteraciones fisiopatológicas de la DM2, ser bien tolerado, tener un efecto duradero, no provocar hipoglucemias, facilitar la pérdida de peso, mejorar el resto de los FRCV y demostrar una disminución de la morbimortalidad cardiovascular y total a largo plazo, todo ello con un coste razonable.
Pautas de intervención farmacológicaLos grupos farmacológicos utilizados en la DM2 y en la prevención cardiovascular aparecen en la tabla 14, donde se recogen los efectos de cada grupo farmacológico sobre la eficacia hipoglucemiante, la modificación del peso corporal, la producción de hipoglucemias graves, la ECV, la IC y la mortalidad total.
Principales características de los fármacos hipoglucemiantes utilizados en la DM2
| Eficacia hipoglucemiante | Peso | HG | ECV, IC, MT | Coste | |
|---|---|---|---|---|---|
| Metformina | Alta | = / ↓ | = | ECV ↓ moderada (UKPDS-metformina HR 0,61); IC=; MT= | + |
| SU/Glinidas | Alta | ↑ | ↑ | ECV (precondicionamiento de isquemia miocárdica) ↑; MT ↑ | + |
| Pioglitazona | Alta | ↑ | = | ECV ↓ (PROactive MACE HR 0,84); IC ↑; MT= | ++ |
| iDDP4 | Media | = | = | ECV=; IC probable ↑ saxagliptina y aglogliptina; MT= | ++ |
| arGLP-1 | Alta | ↓ | = | ECV ↓ (LEADER MACE HR 0,88); IC=; MT ↓ (LEADER MACE HR 0,85) | ++ |
| iSLGT2 | Media | ↓ | = | ECV ↓ (EMPA-REG MACE HR 0,86); IC ↓ (EMPA-REG HR 0,65); MT ↓ (EMPA-REG HR 0,68) | ++ |
| Insulina basal | Muy alta | ↑ | ↑ | ECV=; IC=; MT=. Riesgo de hipoglucemias | ++ |
arGLP-1: análogos del receptor de GLP-1; ECV: enfermedad cardiovascular
EMPA-REG OUTCOME: Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients-Removing Excess Glucose; HG: episodios de hipoglucemia; HR: hazard ratio, razón de riesgo; IC: insuficiencia cardiaca; iDDP4: inhibidores de la dipeptidasa 4; iSGLT2: inhibidores de SGLT2; LEADER: Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results study, estudio sobre los efectos cardiovasculares de liraglutida en diabéticos tipo2; MACE: major adverse cardiovascular events; MT: mortalidad total; PIOG: pioglitazona; PROactive: PROspective pioglitAzone Clinical Trial In macroVascular Events study, estudio clínico prospectivo de la pioglitazona en episodios macrovasculares; SU: sulfonilureas; UKPDS: estudio prospectivo inglés sobre diabetes; =: sin cambios/cambios no significativos; ↓ disminución; ↑ aumento.
El estudio Canvas realizado con canagliflozina ha demostrado una disminución de la enfermedad cardiovascular, insuficiencia cardiaca y mortalidad total100.
La intervención farmacológica para el control de la hiperglucemia, por consenso internacional, establece junto a los cambios en el estilo de vida (que se deben mantener en todos los escalones terapéuticos) que el primer fármaco a utilizar es la metformina, si no hay contraindicación o intolerancia. Si el objetivo de control de HbA1c está lejano hay que añadir un segundo fármaco.
Cada 3 meses se debe valorar la cumplimentación terapéutica y la consecución o no de objetivos. Según la situación se debe mantener el tratamiento o añadir otro fármaco adecuado a las comorbilidades del paciente y especialmente a su función renal, peso y presencia de ECV (tabla 15 y fig. 5)99.
Tratamiento hipoglucemiante en pacientes con DM2 en situaciones especiales
| Primer nivel | Segundo nivel | |
|---|---|---|
| ERC | • iDPP-4 ajustando dosis; linagliptina no precisa ajuste• Metformina: reducir 50% dosis en estadio 3a. No iniciar en estadio 3b y considerar la relación riesgo-beneficio de la continuación de la terapia | • Repaglinida• arGLP-1. Considerar su uso en pacientes obesos; ajustar dosis de exenatida• Insulina basal• Pioglitazoma. Utilizar con cautela, vigilar la aparición de edemas. Contraindicado en IC |
| Obesidad | • Metformina | • arGLP-1• iSGLT-2 |
| Síndrome metabólico | • Metformina | • iSGLT-2• arGLP-1. Considerar su uso en pacientes obesos• Pioglitazona. Considerar su uso si alta resistencia insulínica o en esteatosis hepática. Vigilar la aparición de edemas. Contraindicado en IC |
| Anciano frágil | • Metformina | • iDPP-4 |
| Enfermedad cardiovascular | • iSGLT-2. Beneficios demostrados en prevención cardiovascular• arGLP-1: liraglutida, semaglutida. Beneficios demostrados en prevención cardiovascular |
arGLP-1: agonistas del receptor del péptido similar al glucagón 1; DM2: diabetes mellitus 2; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; iDPP-4: inhibidores de la dipeptidil peptidasa-4; iSGLT-2: inhibidores del cotransportador sodio-glucosa tipo2.
Adaptado de Ruiz-García et al.99.
La insulinización en la DM2 con una insulina de acción prolongada o basal estará indicada si falla la doble o triple asociación o si inicialmente existe clara clínica de hiperglucemia con HbA1c elevada. Puede utilizarse con otros antidiabéticos que no tengan alta incidencia de hipoglucemias. La dosis total diaria para comenzar la insulinización es de 0,1-0,3U/kg de peso, con modificación de la dosis cada 3días hasta conseguir objetivos. Hemos de valorar en cada ocasión la necesidad real de aumentar la dosis, ya que en sujetos con obesidad e insulinorresistencia (IR) dosis elevadas pueden aumentar el peso y, con ello, la resistencia a la insulina, sin mejoría del control glucémico99.
Si en 2-3 meses tras insulinización no se consiguen los objetivos, según las características del paciente se debe elegir entre96:
- -
Metformina e insulina basal y arGLP-1.
- -
Metformina e insulina basal y iSGLT-2 o iDPP-4.
- -
Metformina e insulina basal y una o varias dosis de insulina rápida.
- -
Cirugía metabólica en caso de obesidad grave o mórbida.
En resumen, la prevención cardiovascular en la DM requiere una intervención precoz, intensiva y mantenida sobre todos los FRCV (tabla 16).
Objetivos para la prevención y el tratamiento de la enfermedad cardiovascular en pacientes con DM2
| Intervención simultánea, enérgica y precoz sobre todos los FRCV mediante cambios a un estilo de vida saludable y los fármacos necesarios para conseguir los siguientes objetivos: | |||
|---|---|---|---|
| Objetivos según el riesgo cardiovascular | |||
| Extremo | Muy alto | Alto | |
| cLDL (mg/dl) | <55 | <70 | <100 |
| C-no-HDL (mg/dl) | <85 | <100 | <130 |
| HbA1c % | 6-7% | 6-7% | 6-7% |
| HbA1c %pacientes de riesgoa | 7-8% | 7-8% | 7-8% |
| PA (mmHg) | <140/90b | <140/90 | <140/90 |
| PA + microalbuminuria (mmHg) | <130/80 | <130/80 | <130/80 |
| Antiagregación | Sí | Sí (>50 años)c | Valorarc |
cLDL: colesterol-LDL; C-no-HDL: colesterol-no-HDL; FRCV: factores de riesgo cardiovascular; PA: presión arterial.
La obesidad, definida como el exceso de grasa que conlleva un aumento del peso corporal, es una enfermedad crónica que supone un serio riesgo para la salud por su asociación con la resistencia a la insulina, DM2, HTA, ECV y otras complicaciones, lo que conlleva un aumento de la morbimortalidad.
Tiene una alta prevalencia y continúa creciendo. En estudios basados en la medida del peso y la talla, la frecuencia de obesidad supera el 25% de la población adulta.
En estudios epidemiológicos y clínicos el diagnóstico de obesidad se basa en el IMC (tabla 4).
El exceso de grasa abdominal (visceral y peri visceral) u obesidad abdominal tiene una gran importancia por su relación con las complicaciones metabólicas y cardiovasculares. Podemos clasificar los sujetos según el perímetro abdominal, medido en centímetros en la línea media entre el margen costal inferior y la cresta ilíaca o espina ilíaca anterior101; en el caso de la raza caucásica se estima como normalidad <94cm en hombres y <80cm en mujeres, y conllevaría un bajo riesgo cardiometabólico; preobesidad abdominal o perímetro alto ≥94 (94-102)cm en hombres y ≥80 (80-88)cm en mujeres, alto riesgo cardiometabólico, y obesidad abdominal o perímetro abdominal muy alto >102cm hombres y >88cm mujeres conlleva muy alto riesgo cardiometabólico.
La IR o resistencia a la insulina en los tejidos periféricos puede estar condicionada genéticamente y por factores exógenos, fundamentalmente la obesidad abdominal y la inactividad física. Esta situación puede definirse indirectamente por la concentración plasmática de insulina basal >16μU/ml, o >63μU/ml a las 2h tras SOG, o por el índice HOMA, calculado según la fórmula102 (insulina (μU/ml)×[glucosa (mmol/l) / 22,5]), considerado un índice indirecto de IR. En nuestra población los valores >3,2 indica resistencia a la insulina103. Estas pruebas tienen interés en la clínica habitual.
En investigación se evalúa la sensibilidad periférica a la insulina con pruebas más complejas in vivo. En conjunto, son métodos complejos, prolongados y costosos, y por ello solo indicados en estudios de investigación con un tamaño muestral pequeño104.
La obesidad abdominal y la IR se asocian con un conjunto de factores de riesgo para el desarrollo de ECV y DM2, que se conoce como SM. Entre las alteraciones metabólicas relacionadas con el SM destacan:
- -
Dislipemia, fundamentalmente hipertrigliceridemia, descenso del cHDL y presencia de partículas cLDL pequeñas y densas, con aumento plasmático de los ácidos grasos libres. A este conjunto de alteraciones se le conoce como dislipemia aterogénica.
- -
Hiperglucemia o DM.
- -
Hipertensión arterial.
Estas alteraciones, junto con la obesidad abdominal, son los parámetros que se han establecido para el diagnóstico de SM. Además, otras muchas alteraciones, no utilizadas para establecer el diagnóstico, tienen un gran interés, entre las que cabe citar, entre otras, la hiperuricemia o la gota, la hipercoagulabilidad y los defectos de la fibrinólisis que con frecuencia cursan con una elevación del PAI-1, la esteatosis hepática no alcohólica y el hiperandrogenismo.
La última armonización de diversas instituciones establece los criterios diagnósticos105 que se muestran en la tabla 4.
La relevancia clínica del SM se relaciona con su frecuencia —un 20-40% de la población general y un 80-85% de los sujetos con DM2— y con las posibles complicaciones relacionadas. La evolución de las complicaciones es progresiva y acumulativa y está relacionada con el grado de obesidad y el tiempo de evolución de la misma.
Entre las posibles complicaciones relacionadas con la IR y el SM se incluyen las siguientes:
- -
Cardiovasculares. Datos de metaanálisis indican que las personas con SM tienen un aumento doble del riesgo de episodios cardiovasculares y un incremento de 1,5 veces en la mortalidad por todas las causas, comparado con aquellos sin SM36.
- -
Diabetes. Estudios recientes encuentran un incremento en el riesgo relativo de desarrollar DM2 de entre 5-10 veces106.
- -
Otras complicaciones no menos importantes relacionadas con el SM son: apnea del sueño, insuficiencia respiratoria o síndrome de hipoventilación alveolar idiopática y diversas formas de cáncer (mama, útero, colon, esófago, páncreas, riñón, próstata, etc.)104.
Las guías AACE/ACE de 201742 recogen la obesidad y la obesidad abdominal como factores adicionales de RCV. Además, teniendo en cuenta que esta situación se relaciona con aumento de TG y disminución de cHDL y con SM, existe una asociación con un aumento del RCV.
Las guías NICE107 establecen el RCV basado en el IMC y el perímetro abdominal y clasifican a los sujetos el RCV bajo, moderado, alto o muy alto. Esta relación se basa en la asociación de cada categoría con FRCV clásicos y no clásicos.
Control del síndrome metabólico: objetivos de tratamientoSe centra en valorar el RCV global mediante la utilización de las tablas del SCORE e incrementando el riesgo así estimado en un escalón si presenta SM. Se deben tratar los factores de riesgo asociados según el RCV del paciente y controlar las comorbilidades asociadas con la obesidad.
Tratamiento del paciente con obesidadSe debe recomendar una dieta de protección cardiovascular, equilibrada (véase el apartado anterior «Recomendaciones generales a la población para reducir su riesgo cardiovascular») y con reducción del contenido calórico total. Se recomienda una restricción calórica moderada, indicando habitualmente dietas de 1.200-1.700kcal/día. Pueden utilizarse dietas más hipocalóricas, pero a largo plazo pueden producir déficit de minerales y vitaminas.
Como un objetivo posible, el hecho de reducir el peso corporal en un 10% produce un importante beneficio para la salud, con cambios metabólicos significativos.
Además, es importante el ejercicio físico adecuado a cada paciente y el soporte psicológico con modificación de la conducta alimentaria.
El tratamiento farmacológico en la obesidad es poco efectivo y se indica en casos seleccionados. La fluoxetina, un antidepresivo mediador de la serotonina, a dosis de 40-60mg/día puede disminuir la sensación de hambre (anorexígeno), sobre todo en los comedores compulsivos. El orlistat (Xenical®) disminuye la absorción intestinal de grasa, que será eliminada en parte con las heces; produce efectos secundarios intestinales (molestias abdominales y esteatorrea) si se utiliza con dietas ricas en grasa. Los análogos del receptor de GLP-1 (liraglutida) a dosis elevadas de 3mg por vía subcutánea al día pueden disminuir un 8% el peso corporal, pero no está financiada por el sistema nacional de salud para esta indicación107.
La cirugía bariátrica está indicada en la obesidad mórbida o en obesidad grave con múltiples complicaciones no controladas médicamente (tabla 17)108, y ha demostrado una mejoría significativa y estable de la DM, la dislipemia, la HTA y la apnea del sueño, que se mantiene 10años después de la intervención109.
Indicaciones para la realización de cirugía bariátrica
| Indicaciones de la cirugía bariátrica y metabólica en la DM tipo 2 |
|---|
| • IMC ≥ 40 kg/m2 |
| • IMC 35-39,9 kg/m2 con mal control y buena cumplimentación de los cambios del estilo de vida y medicación hipoglucemiante |
| • IMC 30-34,9 kg/m2 con mal control y buena cumplimentación de los cambios del estilo de vida y medicación hipoglucemiante, incluida la insulina. En este grupo puede ser valorada la cirugía metabólica |
| Contraindicaciones |
|---|
| • Edades <18 y >60años, aunque actualmente algunos centros operan hasta los 70años: 60-70años sería una contraindicación relativa |
| • Adicción: a alcohol o drogas |
| • Cuadros psicóticos, depresión no controlada, esquizofrenia, trastorno bipolar, etc. |
| • Bajo coeficiente intelectual |
| • Bulimia, trastorno por atracón |
| • Embarazo |
| • DM tipo 1 |
| • DM de larga evolución con secreción baja de insulina y péptido C |
DM: diabetes mellitus; IMC: índice de masa corporal.
Adaptado de Rubino et al.108.
El tabaquismo es una adicción letal y la primera causa de mortalidad evitable. Duplica el riesgo de muerte por ECV y la multiplica por 5 en los menores de 50años, por lo que se considera una variable categórica a la hora de calcular el RCV individual. Fumar tabaco favorece la formación y la rotura de las placas de ateroma, y en consecuencia la aparición de las complicaciones de la arteriosclerosis, incluyendo la trombosis y la obstrucción vascular. El humo del tabaco promueve la inflamación, la oxidación y la disfunción del endotelio arterial que predispone al espasmo arterial y se asocia con una disminución de la fibrinólisis. Fumar tabaco es perjudicial de una forma proporcional a la cantidad fumada y no existe un valor de consumo por debajo del cual desaparezca el riesgo. El fumar tabaco es perjudicial en todas sus formas, incluyendo el tabaco light bajo en nicotina y alquitrán, los puros, la pipa y el respirar humo de tabaco en el aire ambiental (tabaquismo pasivo)110,111.
Dejar de fumar es, entre todas las medidas preventivas, la más rentable en cuanto a la disminución del RCV. El beneficio se ha demostrado ya en los primeros meses de la abstinencia. Pese a ello, el consumo de tabaco se sigue manteniendo en todo el mundo y existen colectivos en los que está aumentando, entre ellos las mujeres, los adolescentes y las personas con aislamiento social112. La causa de esta situación reside en gran parte en el hecho de que no deja de promoverse su consumo, y también en la dificultad manifiesta para interrumpir el hábito de fumar. Prueba de ello es que el número de intentos fallidos antes del abandono del tabaco oscila, según distintos informes, entre 5 y 14113. En todos los fumadores, con independencia del sexo, la edad y la situación general del paciente, se debe aconsejar el abandono del tabaco. La intervención de los profesionales sanitarios sobre el tabaquismo del paciente aumenta en más de un 50% la probabilidad de que el paciente abandone el tabaco. Se considera que una persona ha dejado de fumar cuando ha transcurrido un año desde que se fumó el último cigarrillo. En la tabla 18 se muestran las recomendaciones sobre las estrategias para tratar el tabaquismo contenidas en las guías europeas de prevención cardiovascular15.
Recomendaciones sobre las estrategias para tratar el tabaquismo
| Recomendación | Clase | Nivel |
|---|---|---|
| Hay que identificar a los fumadores y darles consejo repetido para dejar el tabaco, ofreciéndoles ayuda y visitas de seguimiento, sustitutos de nicotina y fármacos cuando sea necesario | I | A |
| Se recomienda interrumpir todas las formas de fumar tabaco o productos de hierbas por ser una causa intensa e independiente de enfermedad cardiovascular | I | B |
| Debe evitarse el tabaquismo pasivo | I | B |
Adaptado de Piepoli et al.15.
Toda visita médica de control del riesgo vascular debería incluir los siguientes apartados:
- •
Anamnesis sobre el hábito de fumar, incluyendo los siguientes aspectos:
- -
¿Ha sido fumador en algún periodo de su vida (ha fumado con regularidad al menos 1 cigarrillo al mes)? (No/ Sí)
- -
¿Cuántos cigarrillos fuma al día?
- -
Si ha dejado de fumar, ¿cuántos meses han transcurrido desde que lo dejó?
- -
¿Cuántos intentos serios de dejar de fumar ha realizado a lo largo de su vida?
- •
Aconsejar con convencimiento de la necesidad de dejar de fumar. Información sobre los beneficios de dejar de fumar y sobre las estrategias facilitadoras. También sobre el incremento de peso (3-5kg de promedio) que suele ocurrir en un porcentaje alto de pacientes y su importancia relativamente menor a la del beneficio en prevención cardiovascular y salud general.
- •
Valoración del grado de adicción en el paciente fumador mediante el test de Fagerström92,114 (Anexo 3) para orientar sobre la necesidad de utilizar medidas farmacológicas y de sustitución de la nicotina.
- •
Valoración de la actitud del paciente frente al tabaquismo. Se pueden realizar tres preguntas clave:
- -
¿Cree que el tabaco le perjudica?
- -
¿Le gustaría dejar de fumar?
- -
¿Cree que podrá dejarlo?
- •
Si el paciente ha respondido afirmativamente a las tres preguntas anteriores hay que asistirlo mediante una estrategia planificada, incluyendo la fijación de la fecha, terapia conductual/motivacional y apoyo farmacológico o de consultas de tabaco específicas. Si no lo ha hecho, habrá que informarlo, motivarlo e insistir.
- •
Establecer un programa de seguimiento.
Además de las terapias mediadas por la comunicación en la visita médica, incluyendo el consejo y la entrevista motivacional, pueden utilizarse los sustitutos de nicotina y distintos fármacos115. Los sustitutos de nicotina, ya sea en forma de chicles, parches, espráis nasales o inhaladores, son eficaces y aumentan la probabilidad de abandono del tabaquismo4. El bupropión es un antidepresivo sobre el que existe una amplia base de ensayos clínicos que han demostrado su eficacia para dejar de fumar, ya que incrementa en más de un 50% las posibilidades de éxito. Su principal inconveniente es un riesgo pequeño (1/1.000) de convulsiones, sin aumentar el riesgo de ECV o enfermedad neuropsiquiátrica. La vareniclina es un agonista parcial de los receptores de la nicotina sobre el que también existe una amplia base de ensayos clínicos que han demostrado que su uso incrementa en más de 2 veces la probabilidad de abandonar el tabaco con éxito. Su principal efecto secundario es la aparición de náuseas, que pueden mitigarse con un aumento progresivo de las dosis y evitando las dosis más altas116,117.
Existe todavía una información insuficiente sobre el uso de cigarrillos electrónicos y su eficacia y seguridad para ayudar a dejar de fumar para que los profesionales sanitarios puedan pronunciarse sobre su uso.
Paciente con fibrilación auricularLa FA es la arritmia más frecuente en la población. Se estima que afecta a más de 33 millones de personas en el mundo y su prevalencia se incrementa con la edad, siendo del 10-15% en pacientes mayores de 80años. La FA tiene un impacto significativo sobre la mortalidad, la morbilidad y la calidad de vida de los pacientes, los cuales presentan un riesgo aumentado de ictus, con una frecuencia aproximada del 5% por año118.
Factores de riesgo cardiovascular que facilitan la presencia o recurrencia de la fibrilación auricularAdemás del componente genético y de la edad, existen muchos otros FRCV y procesos concomitantes que aumentan el riesgo tanto de desarrollar una FA o hacerla recurrente, como el de sus complicaciones asociadas. Identificarlos, prevenirlos y tratarlos es importante en aras de aminorar la prevalencia de la FA y su carga de morbilidad.
Hipertensión arterialUna presión sanguínea alta e incontrolada puede modificar la estructura de la pared miocárdica, favoreciendo así el desarrollo de una FA e incrementando la posibilidad de hacerla recurrente. Por otra parte, la HTA aumenta el riesgo de ACV y de episodios de sangrado intracerebrales. Por lo tanto, el control de la PA debería ser una parte integral del tratamiento de pacientes con FA119.
Diabetes mellitusAunque se conoce la influencia de la DM en el remodelado miocárdico y su predisposición al desarrollo de una FA, el control glucémico intensivo no disminuye la tasa de FA de nueva aparición. Por el contrario, una DM de larga evolución predispone a un mayor riesgo de ACV y de fenómenos tromboembólicos en pacientes con FA. No obstante, el tratamiento con metformina en pacientes diabéticos parece estar asociado con un menor riesgo a largo plazo de FA120.
ObesidadLa obesidad incrementa la probabilidad de desarrollar una FA de forma paralela al aumento del IMC121. La reducción intensiva de peso, del orden de 10-15kg, disminuye la recurrencia de la FA122. Asimismo, la mejora de la capacidad cardiorrespiratoria puede disminuir aún más la carga de FA en pacientes obesos con FA123.
Diagnóstico de la fibrilación auricular y estrategias de cribadoEl diagnóstico de FA se realiza cuando el ECG muestra intervalos RR irregulares en ausencia de ondas P, al menos durante 30s. Se distinguen 5 tipos, según su forma de presentación y duración:
- -
FA de primer diagnóstico: cuando nunca antes se diagnosticó.
- -
FA paroxística: autorrevierte a ritmo sinusal en los primeros 7 días, la mayoría antes de las 48h.
- -
FA persistente: la duración es de más de 7días.
- -
FA persistente de larga duración: se prolonga más de un año.
- -
FA permanente: está establecida y aceptada por médico y se desestima su reversión.
En muchas ocasiones la FA progresa desde episodios cortos e infrecuentes a ataques más largos y más habituales hasta hacerse permanente.
Desde un punto de vista clínico, la FA puede ser sintomática o silente (asintomática). Dada esta última condición, se recomienda hacer un cribado oportunista de la FA mediante la práctica de un ECG en personas mayores de 65años o con IC. Este cribado debería ser sistemático en las personas mayores de 75años o en sujetos con un alto riesgo de ictus, pues son estrategias costo-efectivas124. Por razones similares, a los pacientes con antecedentes de ACV o de AIT se les debe realizar un ECG o una monitorización electrocardiográfica de 72h125. La presencia de episodios de FA registrados por marcapasos o desfibriladores implantables comporta la misma necesidad de confirmación diagnóstica. A todo paciente recién diagnosticado de FA se le debe practicar, al menos, una ecografía transtorácica para valorar la función y la estructura cardiaca126.
Control integral del paciente con fibrilación auricularEl manejo integral del paciente con FA incluye la información, la educación y el autocuidado del paciente, así como el control de los FRCV y de los posibles condicionantes arritmogénicos subyacentes, la regulación del ritmo o de la frecuencia cardiaca y la prevención del ictus mediante el empleo de anticoagulantes. No obstante, hay situaciones que requieren que un paciente con FA sea derivado a un servicio de urgencias hospitalario especializado, como son la inestabilidad hemodinámica, la frecuencia cardiaca (FC) elevada e incontrolable, la bradicardia sintomática, la angina severa, la disnea intensa e irreversible o la presencia de AIT o ACV.
Control del ritmo o de la frecuencia cardiaca. Fármacos antiarrítmicos, ablación por catéter y cirugía de la fibrilación auricularNo existe ninguna evidencia que demuestre la superioridad del control del ritmo cardiaco sobre el control de la FC, siendo esta última a menudo suficiente para mejorar los síntomas relacionados con la FA127. El control agudo de la FC en pacientes con IC aguda o con una fracción de eyección del ventrículo izquierdo (FEVI) inferior al 40%, puede hacerse preferentemente con betabloqueantes o con digoxina como segunda elección. En ausencia de ambas condiciones se pueden emplear tanto los betabloqueantes como los bloqueadores de los canales de calcio: diltiazem y verapamil, quedando la digoxina como fármaco a añadir si no se logra la FC adecuada. Para un control de la FC a largo plazo, estos tres grupos farmacológicos pueden ser empleados solos o combinados, si bien, cuando el paciente presenta una FEVI menor del 40%, no se recomienda el empleo de los antagonistas del calcio. Por otra parte, la amiodarona, debido a sus posibles efectos secundarios, queda reservada para aquellos casos en que la FC no se controle pese a la terapia combinada con los tres grupos farmacológicos previamente citados. Finalmente, cuando fallen los fármacos anteriormente mencionados se puede recurrir a la ablación del nódulo auriculoventricular con implantación de un marcapasos para controlar la frecuencia ventricular127.
En el momento actual, el control del ritmo está indicado en dos condiciones:
- 1.
En la FA de reciente comienzo, si ocasiona una inestabilidad hemodinámica —en cuyo caso la cardioversión eléctrica es el tratamiento de elección—, o cuando el paciente muestra su preferencia por permanecer en ritmo sinusal, pudiendo hacerse la cardioversión eléctrica o farmacológicamente.
- 2.
En las personas con FA que permanecen sintomáticas estando bajo tratamiento para el control de la FC.
Los fármacos con potencialidad de revertir la FA a un ritmo sinusal deben ser prescritos atendiendo a la presencia o no de alteraciones estructurales cardiacas, cardiopatía isquémica, IC, valvulopatías, FEVI preservada o no, etc. La flecainida y la propafenona son efectivas para la cardioversión farmacológica oral o intravenosa, pero su uso está restringido a pacientes sin enfermedad cardiaca estructural o FEVI baja. El vernakalant intravenoso puede administrarse a pacientes con IC leve (claseI yII de la NYHA), incluidos aquellos con cardiopatía isquémica, siempre que no presenten hipotensión o estenosis aórtica severa. La amiodarona puede usarse en pacientes con IC o con cardiopatía isquémica, tanto en la fase aguda por vía intravenosa, como de mantenimiento por vía oral.
En la selección de agentes para mantener crónicamente el ritmo sinusal hay que tener en cuenta que todos ellos son potencialmente arritmogénicos y pueden tener efectos secundarios extracardiacos, debiendo predominar en el momento de su elección la seguridad del paciente128. Además de los fármacos previamente mencionados, se dispone de dronedarona, sotalol y ranolazina: La dronedarona, relacionada, químicamente con la amiodarona, está contraindicada en la IC claseIII yIV de la NYHA, en la insuficiencia renal con filtrados inferiores a 30ml/min y con el uso de otros fármacos que potencien el alargamiento del QT o que se metabolicen por la vía del CYP3A4. El sotalol, un betabloqueante con riesgo de arritmias ventriculares y torsade de pointes, está contraindicado en la hipertrofia ventricular izquierda, fallo cardiaco, alargamiento del QT, insuficiencia renal con filtrados inferiores a 50ml/min, asma, hipopotasemia, etc. La ranolazina, un nuevo inhibidor de la corriente tardía de sodio, demostró ser eficaz en pacientes con síndrome coronario agudo sin elevación del ST y en la angina inestable en el estudio MERLIN (Metabolic Efficiency With Ranolazine for Less Ischemia in Non ST-Elevation Acute Coronary Syndrome)129. En el ensayo HARMONY (A Study to Evaluate the Effect of Ranolazine and Dronedarone When Given Alone and in Combination in Patients With Paroxysmal Atrial Fibrillation) se combinaron dosis altas de ranolazina y dronedarona, reduciendo la FA en pacientes con marcapasos bicameral que presentaban episodios paroxísticos130.
En los pacientes con FA paroxística o persistente sintomáticas que sean intolerantes al tratamiento farmacológico antiarrítmico o que respondan inadecuadamente al mismo se puede emplear la ablación con catéter para restablecer y mantener el ritmo sinusal. La técnica se basa en aislar los focos arritmogénicos frecuentemente localizados en las venas pulmonares con o sin una exclusión adicional en la pared posterior de la aurícula izquierda. Cuando se lleva a cabo por equipos adecuadamente entrenados es más eficaz en la conservación del ritmo sinusal que los fármacos antiarrítmicos, con una tasa similar de complicaciones.
Del mismo modo, se puede emplear la cirugía para el control del ritmo. Esta se basa en la creación de cicatrices de aislamiento en las aurículas con el propósito de evitar los fenómenos de reentrada que inician y perpetúan la arritmia, permitiendo la reconducción del estímulo normal desde el nodo sinusal hasta el nodo auriculoventricular. Las técnicas actuales, basadas en dispositivos de transmisión de energía, permiten realizarla mediante toracoscopia con incisión mínima. En algunos estudios se muestra más efectiva que la ablación por catéter, aunque con mayor probabilidad de efectos secundarios, y en ocasiones requiere la implantación posterior de un marcapasos131. En la FA persistente sintomática podría indicarse la cirugía si la ablación por catéter ha fallado. También puede considerarse su empleo en pacientes con FA que vayan a ser sometidos a cirugía cardiaca.
Tratamiento anticoagulante para la prevención del ictusLa anticoagulación es el tratamiento de elección para la prevención del ictus isquémico, teniendo en cuenta que el riesgo es similar en la FA persistente y en la paroxística127. Clásicamente los fármacos antivitaminaK (AVK), en un rango de INR de 2-3, han sido los de elección, ya que producen una reducción en la tasa de ictus del 60-80%. La indicación de anticoagulación oral viene establecida por modelos pronósticos que han incorporado la edad y comorbilidades del paciente, siendo la escala más utilizada CHA2DS2-VASc (tabla 19), de tal forma que los pacientes con una puntuación de 0 (1 en caso de mujeres) no precisan terapia anticoagulante oral, pero sí la precisan los pacientes con una puntuación ≥2 en varones o ≥3 en mujeres. Esta recomendación se aplica a pacientes con FA no valvular, siempre que no exista un riesgo elevado de complicaciones hemorrágicas, estimado según la escala HAS-BLED (tabla 20).
Escala de riesgo trombótico CHADS2-VASc en fibrilación auricular
| Factor de riesgo | Valor ponderal |
|---|---|
| Insuficiencia cardiaca congestiva | 1 |
| Hipertensión | 1 |
| Edad ≥ 75 años | 2 |
| Diabetes | 1 |
| Ictus/AIT/embolismo periférico previo | 2 |
| Enfermedad vascular (arteriopatía periférica, cardiopatía isquémica, placa aórtica) | 1 |
| Edad entre 65 y 74 años | 1 |
| Sexo femenino | 1 |
| Puntuación máxima | 9 |
Interpretación: bajo riesgo=0; riesgo moderado=1; riesgo alto≥2.
Escala HAS-BLED de riesgo hemorrágico en fibrilación auricular
| Factor de riesgo | Valor ponderal |
|---|---|
| Hipertensión, presión arterial mal controlada | 1 |
| Función renal/hepática anormal | 1 o 2 |
| Ictus | 1 |
| Tendencia o predisposición al sangrado | 1 |
| INR inestable | 1 |
| Edad avanzada (> 65 años, condición frágil) | 1 |
| Medicamentos (aspirina o AINE), o consumo excesivo de alcohol | 1 o 2 |
Puntuación máxima: 9.
En la última década se han realizado cuatro grandes estudios aleatorizados con anticoagulantes orales de acción directa (ACOD): dabigatrán (RELY), rivaroxabán (ROCKET-AF), apixabán (ARISTOTLE) y edoxabán (ENGAGE-AF), que han demostrado una eficacia igual o superior a la de los AVK, con menor incidencia de complicaciones hemorrágicas, especialmente hemorragia intracraneal, por lo que en la actualidad constituyen la alternativa de elección en el tratamiento inicial de la FA (fig. 6)132-134. Los estudios en «vida real» confirman, asimismo, un menor riesgo hemorrágico de los ACOD en comparación con los AVK135. Finalmente, los ACOD, en combinación con monoterapia antiagregante, pueden ser una alternativa segura y eficaz a la triple terapia en pacientes con FA sometidos a intervencionismo coronario percutáneo136.
Aunque las guías europeas sitúan a los ACOD por encima de los AVK, su utilización está restringida en nuestro país. Según un informe de posicionamiento terapéutico, solo se autoriza el uso de estos fármacos, en términos generales, en los pacientes con mal control terapéutico, con antecedentes de hemorragia intracraneal o con riesgo de ella137.
Anticoagulación en pacientes que requieren cardioversiónEs importante iniciar precozmente la anticoagulación de pacientes programados para cardioversión, dado que este procedimiento está asociado con un riesgo de tromboembolismo. Los pacientes que se han mantenido en FA durante más de 48h deben comenzar la anticoagulación al menos 3semanas antes de la cardioversión, y después continuar durante 4semanas (siempre que no requieran anticoagulación indefinida). Las directrices actuales recomiendan una anticoagulación adecuada con un AVK o con dabigatrán (tanto antes como después del procedimiento). Otros anticoagulantes orales directos están siendo estudiados en ensayos clínicos prospectivos127.
Organización y funcionamiento de la consulta de riesgo cardiovascular: profesionales y dispositivos. Criterios de calidadDiferentes e importantes estudios a nivel nacional e internacional publicados en los últimos años han mostrado un nivel bajo de control global de los FRCV incluso en prevención secundaria tanto en pacientes coronarios como en ictus o EAP138-145. Ello puede ser debido a diversos factores, entre los que destacarían la insuficiente adherencia al tratamiento, la inercia terapéutica y también los modelos organizativos que, en general, se muestran poco capaces de mejorar estos resultados.
El control multidisciplinar del RCV tiene unas claras ventajas146:
- -
Homogeneizar entre los diferentes niveles asistenciales el abordaje y el tratamiento de los FRCV y así dar continuidad asistencial en la prevención del riesgo vascular.
- -
Mejorar la detección de todos los FRCV en pacientes de alto riesgo que facilite la intervención terapéutica más adecuada y precoz para cada paciente.
- -
Optimizar los recursos sanitarios, evitando duplicidades de visitas y exploraciones complementarias.
- -
Definir y consensuar criterios de derivación para generar un flujo bidireccional que facilite, en la mayoría de los casos, el retorno del paciente a nivel de atención primaria tras efectuar las evaluaciones e intervenciones que requirieron la derivación a la atención especializada. Así se garantiza que esta información llegue al médico de atención primaria y que el paciente reciba mensajes sanitarios unificados desde ambos niveles asistenciales.
- -
Promover la docencia y la investigación en RCV.
Una consulta de Riesgo Vascular, como una unidad organizativa dentro del ámbito de atención programada, precisa de:
- -
Profesionales de distintas especialidades (medicina interna, endocrinología, cardiología, nefrología, bioquímica clínica, medicina de familia, etc.), en coordinación con atención primaria, nutricionistas y enfermería, con capacidad para poder abordar de forma global los principales factores de riesgo.
- -
Protocolos unificados basados en las guías de práctica clínica para el control global de los principales FRCV.
- -
Unos requisitos estructurales básicos147. Ello incluye la posibilidad de realizar una adecuada medida de la PA con dispositivos validados (tabla 21).
Tabla 21.Recursos de una consulta hospitalaria para el control global de los principales factores de riesgo vascular
Arquitectura Recursos materiales Recursos informáticos Consulta para cada profesional sanitario y por turno de trabajo Mobiliario completo en la consulta: mesa de despacho y camilla de exploración Historia clínica, digital o no, según modelo del servicio de salud, accesible al área sanitaria de referencia Espacio para enfermería para la medida de la PA, educación sanitaria y revisión de la adherencia al tratamiento Fonendoscopio, oftalmoscopio, linterna, báscula, tallímetro y cinta métrica Acceso online a escalas de riesgo y cuestionarios Dispositivos de medida de la PA validados148 Prescripción electrónica, según modelo del servicio de salud Sistema de climatización en el centro y los consultorios Aconsejable disponer de: Posibilidad de consulta online por atención primaria 1. Dispositivo de medida de PA semiautomático para que de forma programada se puedan hacer varias medidas automáticas (en general 3) sin presencia de observador. Se aconseja que en la primera visita las 3 medidas automáticas se hagan de forma simultánea en ambos brazos 2. Acceso a la monitorización ambulatoria de la PA 3. Doppler portátil para la determinación del ITB 4. Electrocardiógrafo ITB: índice tobillo-brazo; PA: presión arterial.
Adaptado de Felip Benach147.
Como herramienta básica para medir la calidad asistencial se han de establecer unos indicadores (tabla 22) que han de permitir detectar cuáles son los aspectos de posible mejora para optimizar el control global de los factores de riesgo, y que han de ser utilizados como un sistema de autoevaluación.
Indicadores para medir la calidad asistencial en el control global del paciente con alto riesgo cardiovascular
| Indicadores | ||
|---|---|---|
| Estructura o actividad | Proceso o calidad | Resultado |
| • Número total de pacientes derivados a consulta de riesgo vascular• Número de sesiones del equipo de riesgo vascular• Número de sesiones de consultoría realizadas con atención primaria• Número de visitas no presenciales realizadas por los integrantes de la consulta de riesgo vascular: consulta virtual, tutorías, telemedicina• Producción científica: comunicaciones y publicaciones compartidas por varios miembros del grupo | • Número derivaciones a consulta de riesgo vascular que cumplen criterios derivación previamente definidos y consensuados / número total de derivaciones• Número pacientes con primera visita en la consulta de riesgo vascular con tiempo de respuesta dentro de márgenes establecidos / número total de primeras visitas• Número pacientes visitados con codificación de diagnósticos (según CIE10 / número total de pacientes visitados)• Número de pacientes en prevención primaria y no diabetes que tienen estimado su riesgo por alguna escala | • Número pacientes visitados que cumplen objetivos de control de FRCV según su categoría de riesgo / número total de pacientes visitados• Adecuación consumo de recursos (exploraciones complementarias) / número total de pacientes visitados• Número episodios de consulta de riesgo vascular cerrados por alta a atención primaria con informe asistencia consensuado / número altas consulta de riesgo vascular |
CIE-10: Clasificación Internacional de Enfermedades, 10.° revisión; FRCV: factores de riesgo cardiovascular.
Adaptado de Armario et al.146.
Las consultas donde se atiende a pacientes de riesgo vascular deben adecuarse al sistema organizativo del servicio de salud correspondiente, bien público o privado. La digitalización de las historias clínicas, la opción de la prescripción electrónica (y el conocimiento del grado de adherencia que ello permite) y las opciones de telemedicina (tanto para la interacción entre paciente-médico como médico-médico) pueden facilitar el acceso a la información clínica del paciente y al mejor control de los FRCV.
Criterios de derivación y alta del paciente con riesgo cardiovascularCriterios de derivación del paciente con riesgo cardiovascularLos pacientes con RCV elevado son remitidos a consultas por norma general para el control de alguno de los FRCV, fundamentalmente la HTA, la DM y la dislipemia; ya sea en el ámbito de la prevención primaria o en el de la secundaria. En este sentido, es frecuente que se deriven a nuestras consultas de riesgo vascular a pacientes con ECV establecida (coronaria, cerebrovascular o arterial periférica), a veces jóvenes, en los que no se identifican FRCV (para el estudio diagnóstico de trombofilia), o bien que desconocían o no controlaban adecuadamente los FRCV detectados durante la valoración hospitalaria.
No es habitual recibir pacientes para deshabituación del tabaco, aun siendo este un factor de riesgo mayor. Algunas áreas de atención primaria o de neumología cuentan con unidades específicas. En cualquier caso, cada servicio público de salud suele establecer sus propios criterios de derivación a unidades especializadas en función de sus propias agendas, de la disponibilidad de recursos y del nivel asistencial (hospitales comarcales frente a hospitales de referencia de tercer nivel).
Las principales causas de derivación para pacientes con HTA y DM quedan reflejadas en la tabla 23. La SEA ha publicado recientemente los criterios de derivación de pacientes dislipémicos a sus unidades de lípidos149 (tabla 24).
Causas de derivación de pacientes con diabetes o HTA
| Diabetes mellitus | Hipertensión arterial |
|---|---|
| • Tipo 1 | • HTA resistente |
| • Gestacional | • HTA maligna y otras emergencias hipertensivas |
| • Diabetes no filiada correctamente | • Sospecha de causa secundaria |
| • Mal control glucémico, diabetes inestable, hipoglucemias | • Embarazo; antecedente de HTA gestacional |
| • Comorbilidades (p.ej., obesidad mórbida) | • Infancia, adolescencia |
| • Enfermedad microvascular grave (polineuropatía pie diabético, insuficiencia renal crónica, retinopatía avanzada) | • Comorbilidades (insuficiencia cardiaca o renal, enfermedad cerebrovascular, coronaria o arterial periférica) |
| • Solicitud de MAPA de 24 h cuando no se dispone de recursos para realizarla e interpretarla |
HTA: hipertensión arterial; MAPA: medida ambulatoria de la presión arterial.
Criterios de derivación a unidades de lípidos de la Sociedad Española de Arteriosclerosis
| Dislipemia | Dinteles | Contexto clínico | Diagnóstico | Tratamiento |
|---|---|---|---|---|
| Hipercolesterolemia | • CT>300 mg/dl• cLDL>200 mg/dl• Lp(a)>117 mg/dl | • Xantomas tendinosos• Arco corneal <50años• Antecedentes familiares+++• CI o EAP prematura• CI recurrente• Enfermedad vascular sin FRCV evidentes• Sospecha de HF• Esteatosis y/o cirrosis | • Cribado en cascada de HF• Test genéticos• Técnicas de imagen para detectar EVS | • Triple terapia• Nuevos tratamientos (anti-PCSK9)• Intolerancia farmacológica• Refractariedad al tratamiento• Aféresis |
| Hipertrigliceridemia | • TG en ayunas >1.000mg/dl• TG>500mg/dl pese a tratamiento• Hipertrigliceridemia y CT >350mg/dl | • Xantomas• Hepatomegalia• Esplenomegalia• Lipemia retinalis• Debut en la infancia• Pancreatitis | • Análisis de causas secundarias• Test bioquímicos• Diagnóstico molecular | • Excluir causa secundaria• Tratamiento ineficaz• Dietas especiales |
| cHDL | • cHDL <20mg/dl• cHDL >100mg/dl | • Hepatomegalia• Esplenomegalia• Hipertrofia amigdalar• Opacidad corneal• Insuficiencia renal | • Excluir causas secundarias• Test bioquímicos• Diagnóstico molecular | • Control causas secundarias |
| Hipocolesterolemia | • cLDL <50mg/dl sin tratamiento | • Malabsorción• Esteatosis | • Excluir causas secundarias• Tests bioquímicos• Diagnóstico molecular |
cHDL: colesterol-HDL; CI: cardiopatía isquémica; cLDL: colesterol-LDL; CT: colesterol total; EAP: enfermedad arterial periférica; HF: hipercolesterolemia familiar; Lp(a): lipoproteína (a); TG: triglicéridos. +++: positivos
Adaptado de Sánchez-Chaparro et al.149.
En el contexto del riesgo vascular, el principal tipo de DM a considerar es la de tipo2, asociada con dislipemia, obesidad, HTA y SM; por ello, la causa más habitual va a ser la falta de un control glucémico adecuado, a pesar de que en los últimos años el arsenal terapéutico en el campo de la DM2 es enorme150.
En el caso de la HTA, en nuestro país el motivo más común de remitir pacientes a una unidad de hipertensión es descartar causa secundaria, seguido de mal control terapéutico e hipertensión resistente151, definiendo esta última como la incapacidad de controlar la PA (<140/90mmHg) pese a tres fármacos, uno de ellos un diurético7.
Para el caso de la dislipemia, las causas más comunes de remitir a los pacientes son el mal control en los niveles de colesterol o TG séricos, el tratamiento y diagnóstico de la HF, los efectos adversos de la medicación, en especial la intolerancia a las estatinas (mialgias) o la necesidad de tratamientos combinados, especialmente con iPCSK9149.
Criterios de alta del paciente con riesgo cardiovascularEs obvio que, una vez alcanzado el diagnóstico definitivo y controlado el factor de riesgo que motivó la consulta, los pacientes deben ser remitidos desde la unidad especializada para su seguimiento por atención primaria. Sin embargo, no es infrecuente que los pacientes sean revisados en las consultas por diversos motivos, entre otros, no alcanzar los objetivos terapéuticos, la necesidad de procedimientos no convencionales (cirugía bariátrica, aféresis de cLDL o perfusión en hospitales de día de terapia lisosomal sustitutiva), la necesidad de prescribir y dispensar determinados fármacos por la farmacia hospitalaria (como es el caso de los fármacos iPCSK9), la polimedicación con elevado riesgo de interacciones farmacológicas (p.ej., en sujetos con infección por VIH y trasplantados) y aquellos que sufran efectos adversos derivados de la medicación, como por ejemplo las hipoglucemias. Algunos pacientes con hipertensión secundaria se mantienen hipertensos pese al tratamiento etiológico de su enfermedad, lo que sugiere el efecto prolongado de la HTA sobre el árbol vascular (remodelado) o bien que alguno de ellos pueda tener además una HTA esencial152.
FinanciaciónEl documento «Estándares SEA 2019 para el control global del riesgo cardiovascular» ha sido financiado parcialmente por Laboratorios Ferrer, aunque estos no han intervenido ni en el diseño del mismo, ni en su redacción, ni en su contenido.
Conflicto de interesesLaboratorios Ferrer ha proporcionado apoyo para la realización de reuniones de trabajo y soporte administrativo en relación a la elaboración del documento «Estándares SEA 2019 para el control global del riesgo cardiovascular». Asimismo, Laboratorios Ferrer no ha intervenido en el diseño del mismo, ni en su redacción, ni en su contenido.
Aunque algunos autores han recibido honorarios de diferentes laboratorios farmacéuticos, incluyendo a Laboratorios Ferrer, por su participación en conferencias y asesorías, no declaran otros conflictos de intereses en relación a este trabajo.