Estudios previos sugieren que la pérdida de función de NOR-1 modula la activación de las células musculares lisas vasculares (CMLV). En este estudio utilizamos un ratón que sobreexpresa NOR-1 en CMLV para analizar su efecto en la activación celular y en la hiperplasia de la íntima inducida por estrés hemodinámico.
MétodosPara generar el modelo animal el ADNc de NOR-1 humano se situó bajo el control del promotor de SM22α. La expresión de NOR-1 se analizó mediante PCR a tiempo real, Western-blot, inmunohistoquímica e inmunocitoquímica, y su funcionalidad se determinó mediante ensayos de actividad luciferasa. Como índice de proliferación celular se determinó la incorporación de timidina tritiada. La carótida izquierda se sometió a ligadura y en secciones de la misma se realizaron análisis morfométricos e inmunohistoquímicos.
ResultadosEl transgénico desarrollado exhibía niveles significativos de NOR-1 humano en la aorta y las arterias carótidas. En las CMLV de los animales transgénicos se detectó un aumento de la actividad transcripcional de la ciclina D2, una mayor actividad proliferativa y niveles incrementados de Myh10. En estos animales la ligadura de la carótida indujo mayor formación de neoíntima y de estenosis que en los animales control, en consonancia con el marcaje de Myh10 e histona H3 fosforilada.
ConclusionesEstos resultados refuerzan el papel de NOR-1 en la proliferación de las CMLV y en el remodelado vascular, y permiten proponer este modelo como una herramienta útil para estudiar la implicación de este receptor en la función vascular y en enfermedades como la arteriosclerosis y la reestenosis.
Previous studies have shown that the loss of NOR-1 function modulates the activation of vascular smooth muscle cells (VSMC). In this study we use a mouse that over-expresses human NOR-1 in VSMC to analyze the effect of a gain of NOR-1 function on the activation of VSMC and in the hyperplasia of the intima induced by hemodynamic stress.
MethodsTo generate the transgenic animal the human NOR-1 cDNA was placed under the control of the SM22α promoter. The expression of NOR-1 was analyzed by real time PCR, Western blot, immunohistochemistry and immunocitochemistry, and NOR-1 functionality was evaluated by luciferase activity assays. The incorporation of tritiated thymidine was determined as a cell proliferation index. The left carotid artery was ligated, and cross-sections were subjected to morphometric and immunostaining analysis.
ResultsThe transgenic mouse exhibited significant levels of human NOR-1 in aorta and carotid arteries. In aortic VSMC from transgenic mice an increase in the transcriptional activity of ciclin D2 was detected, as well as higher proliferative rates and increased levels of the marker Myh10. In these animals, carotid artery ligation induced a greater neointimal formation and a higher stenotic grade than in wild-type animals, in accordance with the labelling detected for Myh10 and phosphorylated Histone H3.
ConclusionsThese results reinforce the role of NOR-1 in VSMC proliferation and in vascular remodelling, and allow us to propose this model as a useful tool to study the involvement of NOR-1 in vascular function and in vascular diseases such as atherosclerosis and restenosis.
La inflamación vascular y la proliferación de las células musculares lisas vasculares (CMLV) son elementos fundamentales en el remodelado vascular y en el engrosamiento de la íntima tanto en la aterosclerosis como en la reestenosis asociada a intervenciones que inducen daño vascular, como la angioplastia1,2. Durante el desarrollo de estas patologías se producen una serie de modificaciones en el perfil de expresión génica que conllevan la alteración de la capacidad adhesiva, migratoria, proliferativa y secretora de las células vasculares3,4. Distintos miembros de la superfamilia de receptores nucleares hormonales han sido propuestos como factores de transcripción responsables de estas alteraciones5,6. Sin embargo, a pesar de los avances en los últimos años, los mecanismos implicados en la progresión de estas enfermedades no han sido completamente caracterizados.
Los receptores nucleares huérfanos de la familia de NR4A han emergido en los últimos años como nuevas dianas implicadas en la aterosclerosis7,8. Esta familia de receptores está constituida por Nur77, Nurr1 y NOR-1 (NR4A1, NR4A2 y NR4A3, respectivamente, según la nomenclatura unificada para los receptores nucleares)7-9. Estos receptores actúan como factores de transcripción independientes de ligando y constitutivamente activos10. Presentan una baja expresión basal en células quiescentes que se induce rápidamente por estímulos extracelulares comportándose como genes de respuesta temprana7-9. La expresión de los 3 receptores NR4A se encuentra incrementada en placas ateroscleróticas de arterias coronarias humanas11-16 y está inducida en arterias de modelos porcinos y murinos sometidos a lesión vascular12,17. La expresión de NOR-1 aumenta en respuesta a estímulos mitogénicos tanto en CMLV11-13,17,18 como en células endoteliales16,19-21, y su inhibición reduce la proliferación de estas células inducida por diferentes estímulos11,17,18,20,21. Sin embargo, los resultados obtenidos en animales modificados genéticamente han sido contradictorios. En ratones transgénicos que sobreexpresan un dominante negativo que suprime la actividad de los 3 NR4A se produce un incremento en la formación de neoíntima tras la ligadura de la arteria carótida13. Sin embargo, estudios recientes realizados en ratones deficientes para NOR-1 muestran un descenso en la formación de neoíntima tras la inducción de lesión por denudación endotelial de la arteria femoral22. Ante estos resultados discordantes hemos generado un modelo de ratón transgénico que sobreexpresa NOR-1 específicamente en CML para aclarar la contribución de este receptor nuclear en la activación de las CMLV y en el remodelado vascular desencadenado por el estrés hemodinámico asociado a la ligadura de la arteria carótida, proceso que induce inflamación y sobre todo hiperplasia intimal.
MétodosGeneración de un vector de expresión de NOR-1 humanoEl vector de expresión de NOR-1 se generó a partir del ADNc de NOR-1 humano que se extrajo de la construcción pBlueScript-NOR-1 (cedida amablemente por el Dr. N. Ohkura, Growth Factor Division, National Cancer Center Research Institute, Tokio, Japón)23. El ADNc de NOR-1 se clonó en el vector pCAGGS-SM, el cual contiene el promotor mínimo de la SM22α (transgrelina) de ratón. En la construcción resultante el ADNc humano de NOR-1 está fusionado a la secuencia de poli-A del gen de la β-globina de conejo y se encuentra sometido al control específico del promotor de la SM22α que dirige la expresión a CML.
Generación del ratón transgénico TgNOR-1+CMLEl casete de expresión (3,6kb) fue recuperado por doble digestión con SalI y HindIII, purificado mediante el kit QIAquick™ Gel Extraction (Quiagen) y utilizado para la inyección pronuclear de cigotos y posterior transferencia al tracto reproductivo de hembras pseudogestantes (Crl:CD-1), como se describió previamente24. Al cabo de 3semanas tras el nacimiento de los animales, el ADN genómico de la descendencia resultante fue analizado mediante PCR para detectar la presencia del transgén, como se describe más adelante. Se estableció una línea estable de ratones transgénicos mediante el cruce de los animales fundadores portadores del transgén con ratones C57BL/6J durante más de 10generaciones para garantizar el 99,9% de pureza en este fondo genético.
Estos procedimientos se llevaron a cabo en la Unidad de Transgénesis del Instituto de Ciencias de la Salud de Aragón y en la Unidad de Experimentación Animal del Centro de Investigación Cardiovascular y fueron aprobados por los Comités Éticos de Experimentación Animal de ambas instituciones. Los animales se mantuvieron en un ambiente libre de patógenos (specific patogen free [SPF]) bajo condiciones estándar de iluminación (ciclos de 12h de luz/oscuridad) y temperatura (21±1°C) en la Unidad de Experimentación Animal (CSIC-ICCC, Barcelona, España), con acceso ad líbitum a bebida y alimento.
Análisis de ADN genómicoLa extracción de ADN genómico de los animales se realizó a partir de biopsias de las colas utilizando el kit DNeasy®Blood & Tissue (Qiagen). La presencia del transgén se determinó mediante PCR convencional con los siguientes oligonucleótidos que detectan un fragmento de 579pb correspondiente a la secuencia del ADNc de NOR-1 humano: 5′-GACAGACTGCTCCAACTTGG-3′ y 5′-GGTTCATGATCTCCGTGGTG-3′. Los productos amplificados se resolvieron por electroforesis en un gel de agarosa al 1% que contenía bromuro de etidio, y fueron visualizados bajo luz UV. Las imágenes se captaron usando el BIO-RAD Gel Doc 1000 Multi-Analyxt 1.1 (Bio-Rad).
Cultivo celularLas CMLV de aorta de ratón se obtuvieron mediante la técnica de explantes25. Las CMLV se cultivaron en DMEM (Dulbecco's modified Eagle's medium, Gibco) suplementado con un 20% de suero bovino fetal (Biological Industries) y antibióticos (100U/ml de penicilina y 0,1mg/ml de estreptomicina). Estas células se sembraron en placas multipocillo para la realización de experimentos de transfección y para la obtención de ARN y extractos proteicos, como se describe más adelante.
Análisis de los niveles de ARNmEl ARN total de cultivos celulares y de tejidos de ratón se aisló utilizando el reactivo Ultraspec™ (Biotecx Laboratories) y el kit RNeasy Micro (Qiagen), respectivamente. La integridad del ARN se determinó por electroforesis en gel de agarosa. 1μg de ARN total fue retrotranscrito a ADNc utilizando el kit High Capacity cDNA Reverse Transcription (Applied Biosystems). La cuantificación del nivel de ARNm se realizó por PCR a tiempo real utilizando el equipo ABI PRISM 7900HT sequence detection system (Applied Biosystems) y sondas específicas para NOR-1 humano (Assay-on-Demand). Se analizó el nivel de expresión de TBP (TATA-binding protein) como referencia para la normalización de los resultados26.
Inmunohistoquímica e inmunocitoquímicaLas arterias aortas y carótidas de ratón fueron perfundidas con PBS, aisladas y fijadas en paraformaldehído al 4% durante 24h. Las muestras se incluyeron en parafina y se prepararon secciones de 5μm mediante un microtomo (Jung RM2055, Leica)27,28. Las secciones se desparafinaron y rehidrataron, se trataron con peróxido de hidrógeno al 10%, para eliminar la actividad peroxidasa del tejido, y se bloquearon con suero al 10%. A continuación se incubaron con un anticuerpo contra NOR-1 (Abnova), Myh10 (Abcam) o histona 3 fosforilada (Abcam) durante toda la noche a 4°C. Tras lavados exhaustivos se aplicó el anticuerpo secundario biotinilado (Vector Laboratories). El procedimiento continuó con la adición del complejo avidina-biotina-peroxidasa (ABC; Vector Laboratories) y la aplicación del cromógeno 3,3′-diaminobenzidina (DAB). Tras el desarrollo del color, las secciones fueron contrateñidas con hematoxilina, deshidratadas y montadas. Para descartar una interacción no específica se incluyeron controles negativos, en los cuales se omitió el anticuerpo primario.
En los análisis por inmunocitoquímica, las CMLV se sembraron en Permanox®Chamber Slides (Lab-Tek®) y se cultivaron en medio sin suero durante 48h. Las células se fijaron en paraformaldehído al 4% durante 10min, se bloquearon y se siguió el protocolo Vectastain ABC (HRP-DAB; Vector Laboratories) descrito anteriormente.
Aislamiento de extractos nuclearesLas CMLV se recogieron en 1,5ml de PBS frío, se centrifugaron a 300×g durante 15s y se resuspendieron en 300μl de tampón A frío (10mM HEPES pH7,8 a 4°C, 1,5mM MgCl2, 10mM KCl, 1mM DTT, y 1X CIP, Calbiochem). Las células se incubaron a 4°C durante 15min, y tras adicionar NP-40 al 0,6% se vortearon durante 15s y se centrifugaron 30s a 12.000×g. A continuación el sedimento nuclear se resuspendió en 50μl de tampónC frío (25mM HEPES pH7,8 a 4°C, 10% glycerol, 400mM NaCl, 1,5mM MgCl2, 50mM KCl, 1mM DTT y 1X CIP, Calbiochem) y se incubó en hielo durante 30min. Los restos de cromatina nuclear fueron eliminados por centrifugación de 5min a 4°C, y el sobrenadante, que constituía el extracto nuclear, se conservó a –80°C. La concentración de proteína se determinó mediante el método de BCA (Pierce).
Análisis de Western-blotPara la obtención de extractos de proteína total, las CMLV en cultivo se lavaron con PBS y se lisaron en tampón de lisis (50mM Hepes pH7,4, 150mM NaCl, 100mM NaF, 10mM NaPPi, 10mM EDTA, 2mM Na3VO4, 1mM PMSF, 5μM leupeptina y 0,5% SDS)29. Las proteínas nucleares o el extracto total se resolvieron en condiciones reductoras en geles de SDS-poliacrilamida (10%) y se transfirieron a membranas de polivilideno (Immobilon, Millipore). Las membranas se incubaron con anticuerpos contra NOR-1 humano (Abnova), Myh10 (Abcam) o GAPDH (Sigma). Los anticuerpos unidos se detectaron tras la incubación con el anticuerpo apropiado conjugado a HRP (Dako) mediante el SuperSignal West Dura Extended Duration Substrate (Thermo Scientific). La igualdad de carga proteica fue verificada por tinción con Ponceu y mediante el análisis del nivel de expresión de GAPDH26.
Ensayos de transfección transitoria y actividad luciferasaEn los experimentos de transfección transitoria se utilizó una combinación de Lipofectamine™ LTX y Plus™ Reagent (Invitrogen) según las indicaciones del fabricante. Las CMLV de ratones normales y de TgNOR-1+SMC se transfectaron con un vector reportero de luciferasa que contenía el promotor de la ciclina D2, gen diana de los receptores NR4A12,22. La actividad luciferasa se determinó en lisados celulares utilizando el sistema Dual-Luciferase®Reporter Assay (Promega) y un luminometro (OrionI, Berthold Detection Systems). Los resultados fueron normalizados por la actividad Renilla (E2271, Promega).
Determinación de la síntesis de ADNLa síntesis de novo de ADN se determinó a través del análisis de la incorporación de timidina tritiada, como se ha descrito previamente30. Brevemente, las CMLV se incubaron con 0,5μCi/ml de [3H]-timidina (23Ci/mmol; Amersham) durante 24h. Transcurrido ese tiempo, la monocapa de células se lavó con PBS, las células se fijaron con metanol al 95%, se trataron con TCA al 10% (4°C) y se disolvieron en NaOH 0,3N. La incorporación de [3H]-timidina se determinó en un contador β modelo LS 6500 Multipurpose Scintillation Counter; Beckman Culter™).
Ligadura de la arteria carótidaLa ligadura de la arteria carótida izquierda fue realizada en ratones TgNOR-1+CML y animales normales (controles) de 4meses de edad31. Los ratones se anestesiaron por inyección intraperitoneal de ketamina (45mg/kg) y medetomidina (0,6mg/kg). La arteria carótida izquierda fue expuesta y ligada en la zona proximal de la bifurcación de la carótida con una sutura de seda de 7-0. Al cabo de 3 semanas tras el procedimiento quirúrgico, los animales fueron sacrificados y la arteria carótida izquierda fue extraída, fijada en paraformaldehído al 4% durante 24h e incluida en parafina para los análisis morfométricos e inmunohistoquímicos32.
Los procedimientos fueron aprobados por el Comité Ético del Centro de Investigación Cardiovascular de Barcelona. La manipulación de los animales se realizó conforme al RD53/2013, que cumple la normativa 2010/63/UE de la Unión Europea relativa a la protección de los animales utilizados en experimentación y otros fines científicos.
Análisis morfométricos e inmunohistoquímicosA partir de las arterias incluidas en parafina se prepararon secciones seriadas de 5μm de espesor con un micrótomo (Leica JUNG RM 2055). Las secciones correspondientes a las regiones situadas a 0,8, 1,2 y 1,6mm del punto de ligadura se tiñeron con hematoxilina y eosina. Las imágenes, captadas con microscopio (Olympus Vanox AHBT3), se analizaron con el programa informático ImageJ (NIH, Bethesda, MD). Se determinó el área de la capa media, que corresponde al área comprendida entre la lámina elástica externa (LEE) y la lámina elástica interna (LEI). El área de la capa íntima se define como el área comprendida entre la superficie de la luz y la LEI. El porcentaje de estenosis se calculó como: [área íntima/(área íntima+área luz)]×100.
Análisis estadísticosLos resultados se expresan como la media±desviación estándar (a menos que se indique lo contrario). Las diferencias significativas (para p<0,05) se establecieron mediante la prueba t de Student, o el estadístico U de Mann-Whitney para datos no apareados, utilizando el programa informático GraphPad Prism (GraphPad Software Inc, San Diego, CA).
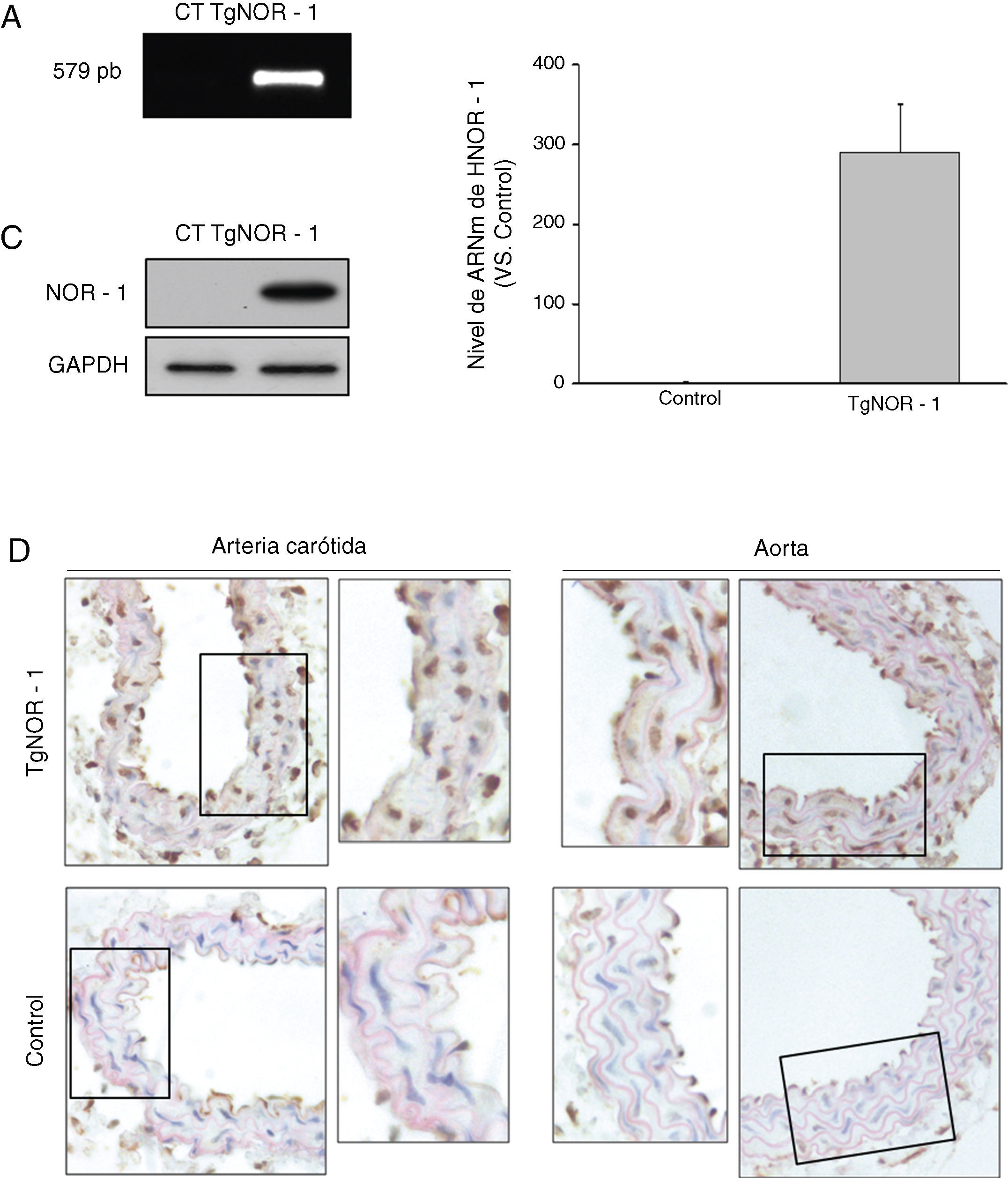
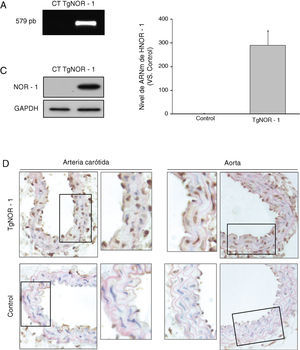
ResultadosGeneración y caracterización de un modelo de ratón transgénico que sobre-expresa NOR-1 humano en CMLPara dirigir la expresión de NOR-1 humano a CML la secuencia codificante fue clonada en el vector pCAGGS, bajo el control del promotor mínimo de la SM22α. El transgén se microinyectó en el pronúcleo masculino y los embriones fueron transferidos a hembras pseudogestantes. A las 3semanas del nacimiento se identificaron los animales portadores del transgén (TgNOR-1+CML) mediante PCR a partir de ADN genómico procedente de la cola, obteniéndose un 20% de la descendencia portadora (fig. 1A). Para evaluar la transmisión de NOR-1 humano en la línea germinal, los animales fundadores fueron cruzados con animales no transgénicos C57BL/6J. La descendencia obtenida presentó la frecuencia mendeliana esperada, indicando que la transgénesis de NOR-1 no afectaba al desarrollo ni a la viabilidad embrionaria. Los ratones transgénicos se cruzaron con ratones C57BL/6J durante más de 10generaciones para garantizar más del 99,9% de pureza en este fondo genético. Se verificó la sobreexpresión de NOR-1 en la aorta de los animales transgénicos mediante PCR a tiempo real y Western-blot (fig. 1B y C). Asimismo, los análisis inmunohistoquímicos realizados en la aorta y en la arteria carótida de los animales transgénicos demostraron una mayor expresión vascular de NOR-1, el cual presentaba la localización nuclear esperada (fig. 1D).
Caracterización de la expresión de NOR-1 en la pared vascular de los ratones transgénicos (TgNOR-1+CML). A)Tinción con bromuro de etidio del gel de agarosa en la que se muestra el fragmento de NOR-1 amplificado por PCR (579pb) a partir de ADN genómico de ratones transgénicos (TgNOR-1). El amplicón no se detecta en ADN genómico de animales normales (Control, CT). B)Nivel de ARNm de NOR-1 humano analizado por PCR a tiempo real en la aorta de los animales transgénicos. En los ratones control no se detectó la expresión de NOR-1 humano, pero se le atribuyó un valor de 1 con fines comparativos. Los datos se expresan como la media±SEM de al menos 9animales. *p<0,001 vs. control. C)Niveles de proteína de NOR-1 determinados por Western-blot en la aorta de estos animales. Los niveles de GAPDH se muestran como control de carga. D)Análisis inmunohistoquímico de NOR-1 realizado en las arterias carótida (izquierda) y aorta (derecha) procedente de ratones transgénicos (superior) y control (inferior).
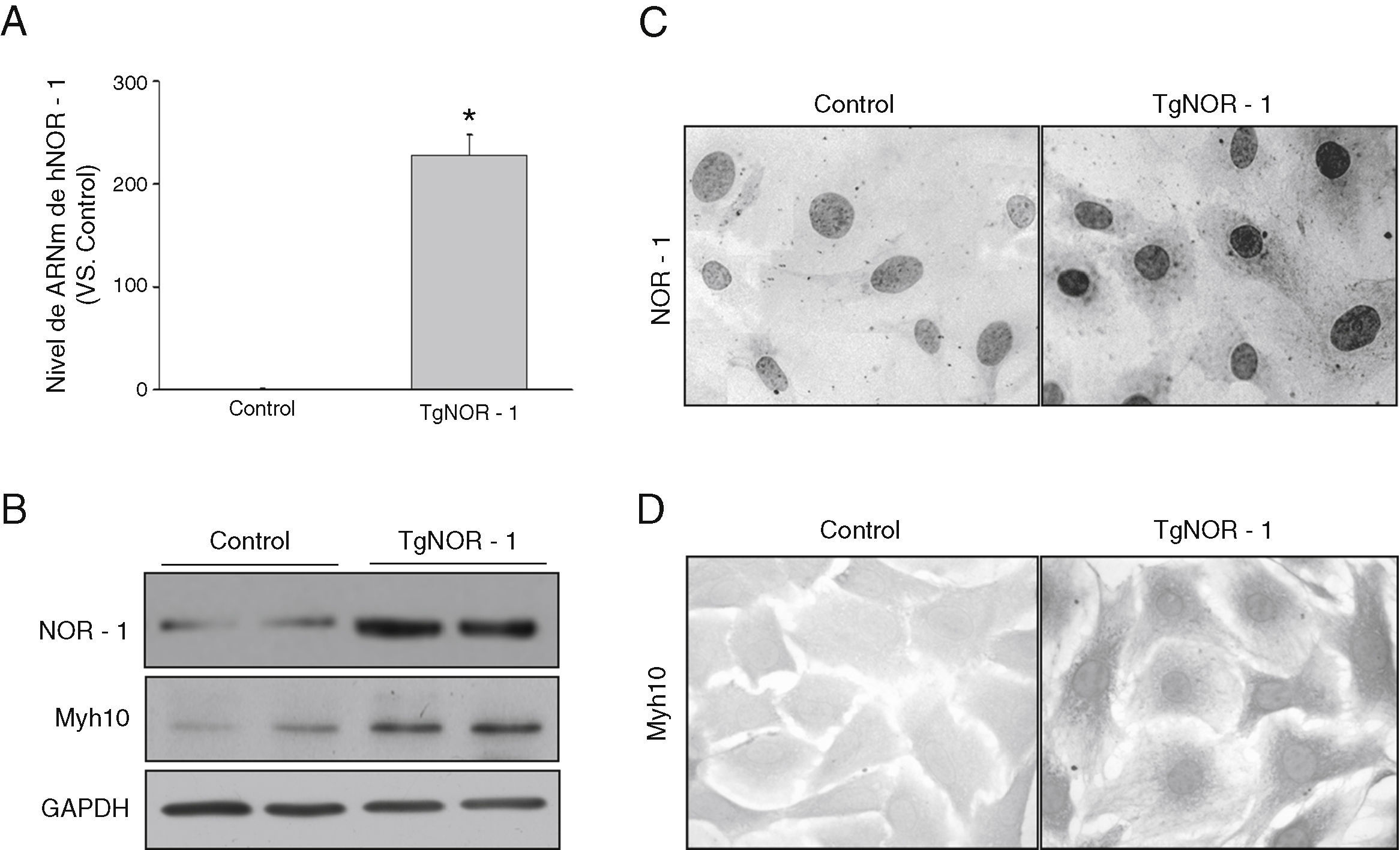
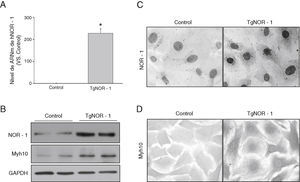
Las CMLV procedentes de la aorta de ratones transgénicos presentaron niveles elevados de ARNm de NOR-1 humano en comparación con las células obtenidas a partir de animales normales (controles) (fig. 2A). En concordancia, se observó que las células de ratones transgénicos exhibían una elevada expresión nuclear de este factor de transcripción, como demostraron los análisis por Western-blot en extractos nucleares y los estudios inmunocitoquímicos (fig. 2B y C). Además, estas células presentaban niveles incrementados de la proteína Myh10, considerada un marcador de fenotipo sintético de las CML que se encuentra incrementado en células CMLV activadas (proliferantes) (fig. 2B y D)33.
NOR-1 se sobreexpresa en CMLV de aorta de ratones TgNOR-1+CML. A)Niveles de ARNm de NOR-1 humano (hNOR-1) analizado por PCR a tiempo real en CMLV de aorta de los ratones transgénicos (TgNOR-1). La expresión de NOR-1 humano fue indetectable en las células de los ratones control, pero se asignó valor arbitrario de 1 con fines comparativos. Los datos se expresan como la media±DE (n=6). *p<0,001 vs. CT. B)Nivel de expresión de NOR-1 y del marcador Myh10 analizados por Western-blot en extractos nucleares y en lisado celular, respectivamente, de CMLV de animales control y transgénicos. Los niveles de GAPDH se muestran como control de carga. C,D)Caracterización mediante inmunocitoquímica de la expresión de NOR-1 (C) y Myh10 (D) en estas células de animales control y transgénicos.
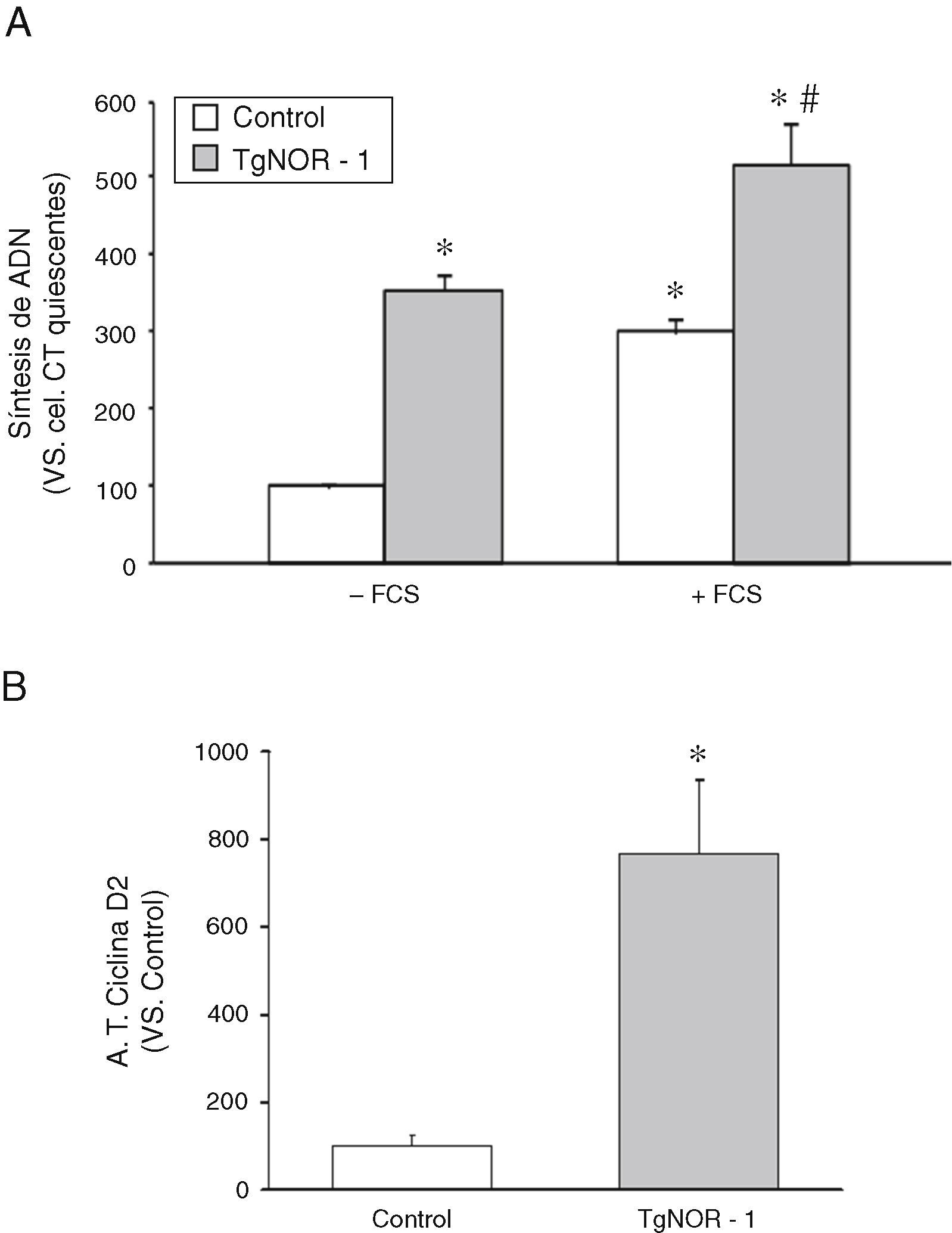
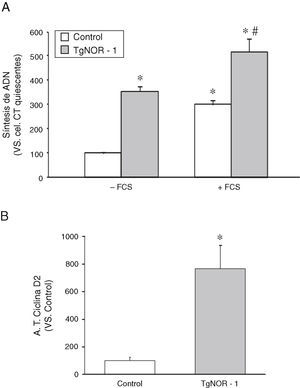
Para determinar si las CMLV de los ratones transgénicos presentaban una alteración en la tasa de proliferación, como sugerían los resultados de la figura 2B y D, evaluamos la tasa de incorporación de timidina tritiada al ADN como índice de actividad proliferativa7,18. Como se muestra en la figura 3A, las CMLV procedentes de ratones transgénicos mostraron una mayor actividad proliferativa que las células de los animales normales, efecto que fue patente tanto en células quiescentes como en células estimuladas con suero fetal bovino (+FCS). Paralelamente, estudios de transfección transitoria con una construcción reportera de luciferasa que contenía el promotor de la ciclina D2 (diana de los receptores NR4A)22 mostraron que la actividad de esta construcción era significativamente superior en CMLV de ratones transgénicos (fig. 3B).
Actividad proliferativa de las CMLV de aorta de los ratones TgNOR-1+CML. A)Incorporación de timidina tritiada al ADN en CMLV de aorta procedentes de ratones control y transgénicos (TgNOR-1). Los análisis se realizaron en células quiescentes estimuladas o no con 20% de suero fetal bovino (+FCS). Los datos se expresan como la media±DE (n=6). *p<0,001 vs. control no estimuladas (–FCS); # vs. CMLV control estimuladas (+FCS) y respecto a CMLV transgénicas no estimuladas (–FCS). B)Actividad luciferasa del promotor reportero de la ciclina D2 evaluada en CMLV de ratones control y transgénicos transfectadas con una construcción en pGL3 del promotor de la ciclina D2. Los datos se expresan como la media±DE (n=6). *p<0,001 vs. control.
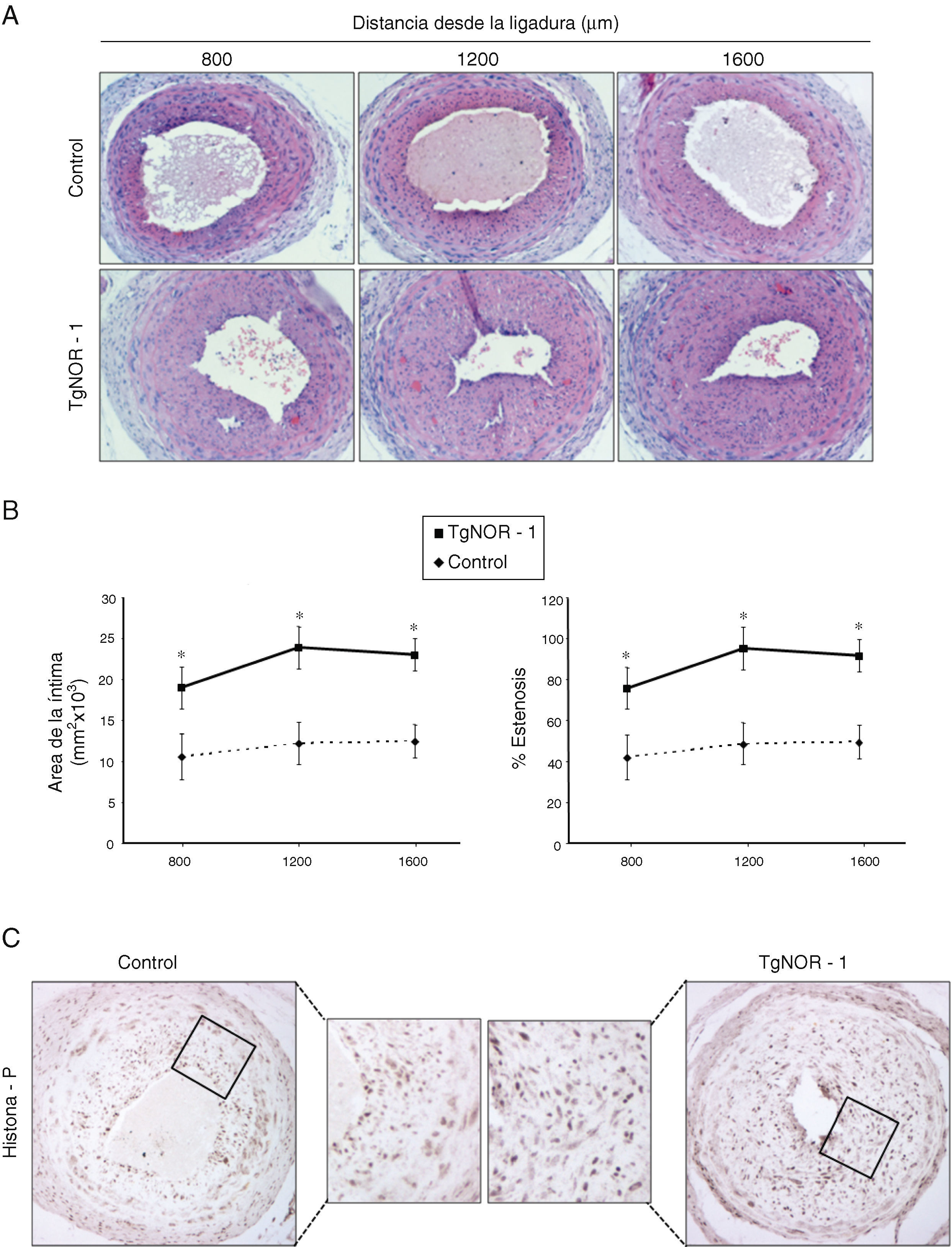
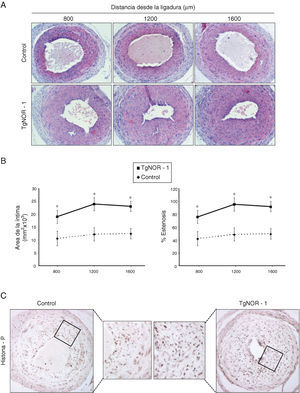
Para determinar el efecto de la sobreexpresión de NOR-1 en la formación de neoíntima inducida por lesión vascular, realizamos ensayos de ligadura de la arteria carótida en ratones normales y transgénicos. En relación con los ratones normales, los ratones transgénicos mostraron un remodelado vascular más acentuado, caracterizado por una mayor formación de neoíntima (fig. 4A). Los análisis morfométricos mostraron un incremento significativo en el área de la íntima en los vasos procedentes de ratones TgNOR-1+CML y un mayor porcentaje de estenosis que los detectados en los vasos de ratones normales (fig. 4B). De modo similar, en términos absolutos se apreció un mayor número de células positivas a Myh10 (datos no mostrados) y de histona H3 fosforilada en la neoíntima engrosada de los ratones transgénicos (fig. 4D).
En los animales transgénicos de NOR-1 se exacerba el remodelado vascular inducido mediante ligadura de la arteria carótida. Se realizó una ligadura permanente de la arteria carótida izquierda tanto en animales control como en ratones transgénicos (TgNOR-1). A)Se muestra la tinción con hematoxilina/eosina de secciones de las carótidas ligadas situadas a 800, 1.200 y 1.600μm del punto de ligadura. B)Cuantificación del área de la capa íntima y del porcentaje de estenosis en estas regiones. Los datos se expresan como media±SEM (n=6). *p<0,01 vs. control. C)Tinción inmunohistoquímica para la histona H3 fosforilada (histona-P) en secciones de arterias carótidas ligadas procedentes de ratones transgénicos y controles.
En el remodelado vascular que subyace al desarrollo de aterosclerosis y de reestenosis tras angioplastia coronaria se han implicado múltiples mediadores, aunque el conocimiento de estos procesos es todavía insuficiente. Estudios previos realizados por nuestro grupo en CMLV en cultivo11,17, así como trabajos del grupo de Bruemmer et al. en ratones deficientes en NOR-112,22, ponen de manifiesto la relevancia de este receptor nuclear en la regulación de la proliferación de CMLV. Sin embargo, los estudios con animales modificados genéticamente han dado lugar a resultados contradictorios. Efectivamente, aunque los primeros estudios mostraban que la deficiencia de NOR-1 se asociaba a muerte embrionaria34, posteriormente Nomiyama et al.22 generaron un ratón deficiente en NOR-1 que era viable y que exhibía una menor formación de neoíntima tras lesión vascular inducida por denudación de la arteria femoral. Sin embargo, en animales transgénicos que expresaban un dominante negativo que suprime la actividad de los 3 receptores se observó aumento del remodelado vascular tras ligadura de la arteria carótida13.
Con el objetivo de esclarecer la contribución de NOR-1 en la activación de las CMLV y en la hiperplasia de la íntima hemos generado un ratón transgénico que sobreexpresa NOR-1 humano en CMLV. Para ello, la secuencia codificante de NOR-1 fue clonada bajo el control del promotor mínimo de la SM22α, proteína de 22kDa expresada de forma exclusiva y abundante en CML de vertebrados adultos y considerada uno de los marcadores más tempranos de la diferenciación de las CML35. La secuencia del promotor de SM22α utilizada en esta construcción (–591/+62) contiene 2 cajas CArG (CC[A/T]6GG, a 150 y 273pb del inicio de transcripción) críticas para la transcripción específica de SM22α en CML36,37. Este promotor ha sido utilizado previamente para la sobreexpresión de proteínas de interés en la pared vascular13,38. Siguiendo esta estrategia, la construcción producida se utilizó para generar un ratón transgénico mediante procedimientos estándar. Nuestros resultados evidencian que la sobreexpresión de NOR-1 dirigida a CML no altera el desarrollo embrionario ni la viabilidad de los animales; de hecho, los animales TgNOR-1+CML no mostraron diferencias fenotípicas evidentes respecto a los animales normales. Tras la purificación del fondo genético y la obtención de una línea animal estable, los análisis inmunohistoquímicos, inmunocitoquímicos y de Western-blot confirmaron la mayor expresión de NOR-1 en las CMLV procedentes de los ratones transgénicos. También se corroboró la correcta localización nuclear de la proteína sobreexpresada. Cabe destacar que las CMLV de los ratones transgénicos exhibían una elevada tasa proliferativa y niveles elevados de un marcador del fenotipo sintético de CMLV que se induce durante la proliferación (Myh10)33. Asimismo, estudios de transfección transitoria permitieron mostrar que las CMLV de los animales transgénicos presentaban un incremento en la actividad del promotor de la ciclina D2, gen diana de los receptores NR4A. Este resultado confirmó la correcta funcionalidad de la proteína NOR-1 sobreexpresada en estas células. En conjunto, estos datos indican que NOR-1 regula positivamente la actividad mitogénica de las CMLV, lo que confirma y amplía nuestros trabajos previos que demostraban que al inhibir NOR-1 se atenuaba la actividad proliferativa de las CMLV7,12.
En el modelo de ligadura de la arteria carótida se produce una respuesta inflamatoria inicial en la que se inducen genes típicos de inflamación2, pero sobre todo se caracteriza porque en fases más avanzadas se desencadena una exacerbada respuesta proliferativa de las CMLV y un engrosamiento de la íntima. Los receptores nucleares de la familia NR4A son reguladores clave en el control de la expresión de genes implicados en la proliferación celular y recientemente se ha observado que pueden modular de forma secundaria (a través de la interferencia de la vía de NFκB) la expresión de genes implicados en la respuesta inflamatoria39. Por ello, este modelo se utilizó para evaluar cómo repercute la ganancia de función de NOR-1 sobre el remodelado vascular. La ligadura de la arteria carótida indujo un incremento del área de la íntima y un grado de estenosis superior en los ratones transgénicos que en los controles. Los resultados obtenidos en este estudio refuerzan los descritos por Nomiyama et al.22, que sugerían la contribución de NOR-1 en el engrosamiento de la neoíntima inducida por lesión mecánica. Además, estos datos ponen de manifiesto la diferente función de los miembros NR4A en el remodelado vascular. Aunque Nurr1 y Nur77 son inducidos en células vasculares por estímulos similares a NOR-1, estos receptores parecen limitar la proliferación celular y atenúan la formación de neoíntima después de lesión vascular13,14,40,41.
En conclusión, en este trabajo hemos generado un nuevo modelo de ratón que sobreexpresa NOR-1 humano en CML. La sobreexpresión de NOR-1 en CMLV da lugar a una proteína funcional que induce la actividad mitogénica de estas células y exacerba la formación de neoíntima en respuesta a lesión vascular mecánica. Aunque son necesarios nuevos estudios que esclarezcan los mecanismos moleculares implicados en la regulación del remodelado vascular por NOR-1, los datos mostrados en este trabajo sugieren que el ratón transgénico para NOR-1 dirigido a CMLV puede ser útil para establecer el papel de este receptor nuclear en el control de la activación de las CMLV, en la función vascular y su implicación en enfermedades como la arteriosclerosis y la reestenosis.
FinanciaciónEste estudio ha sido financiado por la Fundación Española de Aterosclerosis/Sociedad Española de Arteriosclerosis (Beca SEA/FEA para Investigación Básica 2010), y por los proyectos SAF2012-40127, PI12/01952 y la Red de Investigación Cardiovascular (RD12/00420/0053) del Ministerio de Economía y Competitividad (MINECO)-Instituto de Salud CarlosIII (ISCIII).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la ayuda de la Sociedad Española de Arteriosclerosis (SEA). Ricardo Rodríguez-Calvo ha sido financiado por un contrato Juan de la Cierva del MINECO, Judith Alonso ha sido financiada por una beca predoctoral FPU del Ministerio de Educación, y Beatriz Ferrán por una beca JAE-Pre del Consejo Superior de Investigaciones Científicas (CSIC). Agradecemos al Prof. Naganari Ohkura y al Prof. Eric Olson por la amable cesión del ADNc de NOR-1 humano y el promotor de SM22α, respectivamente. Los autores agradecen la asistencia técnica de Silvia Aguiló y Marta Sanz.
Una comunicación referente a esta línea de trabajo, titulada «El receptor nuclear NOR-1 media la respuesta vascular a daño mecánico y modula la inflamación: resultados de un modelo animal que sobreexpresa NOR-1 específicamente en CMLV», se presentó en el XXV Congreso Nacional de la SEA (Reus, 2012) y fue galardonada con una mención especial.