Las revisiones sistemáticas y los metaanálisis se han consolidado como una herramienta fundamental para la práctica clínica basada en la evidencia. Inicialmente, el metaanálisis fue propuesto como una técnica que podría mejorar la precisión y la potencia estadística de la investigación procedente de estudios individuales con pequeño tamaño muestral. Sin embargo, uno de sus principales inconvenientes es que suelen comparar no más de 2 intervenciones alternativas a la vez. Los «metaanálisis en red» utilizan técnicas novedosas de análisis que permiten incorporar la información procedente de comparaciones directas e indirectas a partir de una red de estudios que examina los efectos de diversos tratamientos de una manera más completa. Pese a sus potenciales limitaciones, su aplicación en epidemiología clínica podría ser potencialmente útil en situaciones en las que existen varios tratamientos que se han comparado frente a un comparador común.
Además, estas técnicas pueden ser relevantes ante una pregunta clínica o de investigación cuando existen múltiples tratamientos que deben ser considerados, o cuando se dispone tanto de información directa como indirecta en el cuerpo de la evidencia.
Systematic reviews and meta-analyses have long been fundamental tools for evidence-based clinical practice. Initially, meta-analyses were proposed as a technique that could improve the accuracy and the statistical power of previous research from individual studies with small sample size. However, one of its main limitations has been the fact of being able to compare no more than two treatments in an analysis, even when the clinical research question necessitates that we compare multiple interventions. Network meta-analysis (NMA) uses novel statistical methods that incorporate information from both direct and indirect treatment comparisons in a network of studies examining the effects of various competing treatments, estimating comparisons between many treatments in a single analysis. Despite its potential limitations, NMA applications in clinical epidemiology can be of great value in situations where there are several treatments that have been compared against a common comparator. Also, NMA can be relevant to a research or clinical question when many treatments must be considered or when there is a mix of both direct and indirect information in the body of evidence.
El metaanálisis es una técnica estadística que permite sintetizar la evidencia procedente de estudios disponibles sobre un tema de interés o pregunta de investigación concreta en el marco de una revisión sistemática previa1,2. La revisión sistemática y el metaanálisis se han consolidado durante las últimas décadas como una herramienta fundamental para la práctica asistencial y la salud pública basada en la evidencia, pero uno de sus principales inconvenientes es que generalmente no permite comparar más de 2 tratamientos alternativos a la vez. En ámbitos de la práctica clínica en los que existen múltiples alternativas de tratamiento que compiten entre sí el metaanálisis tradicional no puede proporcionar información sobre los efectos relativos de todos los tratamientos disponibles de una manera simultánea3–5. Por otra parte, en situaciones en las que no existen estudios que comparan directamente 2 o más intervenciones, el metaanálisis tradicional tampoco puede estimar sus efectos relativos. Un ejemplo de esta situación sería cuando se dispone de información de los efectos de un tratamiento en comparación con un único comparador común (por ejemplo placebo o tratamiento de referencia). Por todo ello, en los últimos años se han desarrollado y se están comenzando a emplear nuevas técnicas analíticas que permiten obtener estimaciones de los efectos relativos de los distintos tratamientos a partir de comparaciones indirectas, teniendo en cuenta la «red completa» de los estudios disponibles, y que incorporan comparaciones directas e indirectas que permitirán determinar los efectos de diversos tratamientos de una manera más completa. Tal es el caso de los «metaanálisis en red» (network meta-analysis) también conocidos como «metaanálisis con comparaciones múltiples» (multiple-treatments meta-analysis) o «metaanálisis con comparaciones mixtas» (mixed-treatments comparisons meta-analysis)5–8.
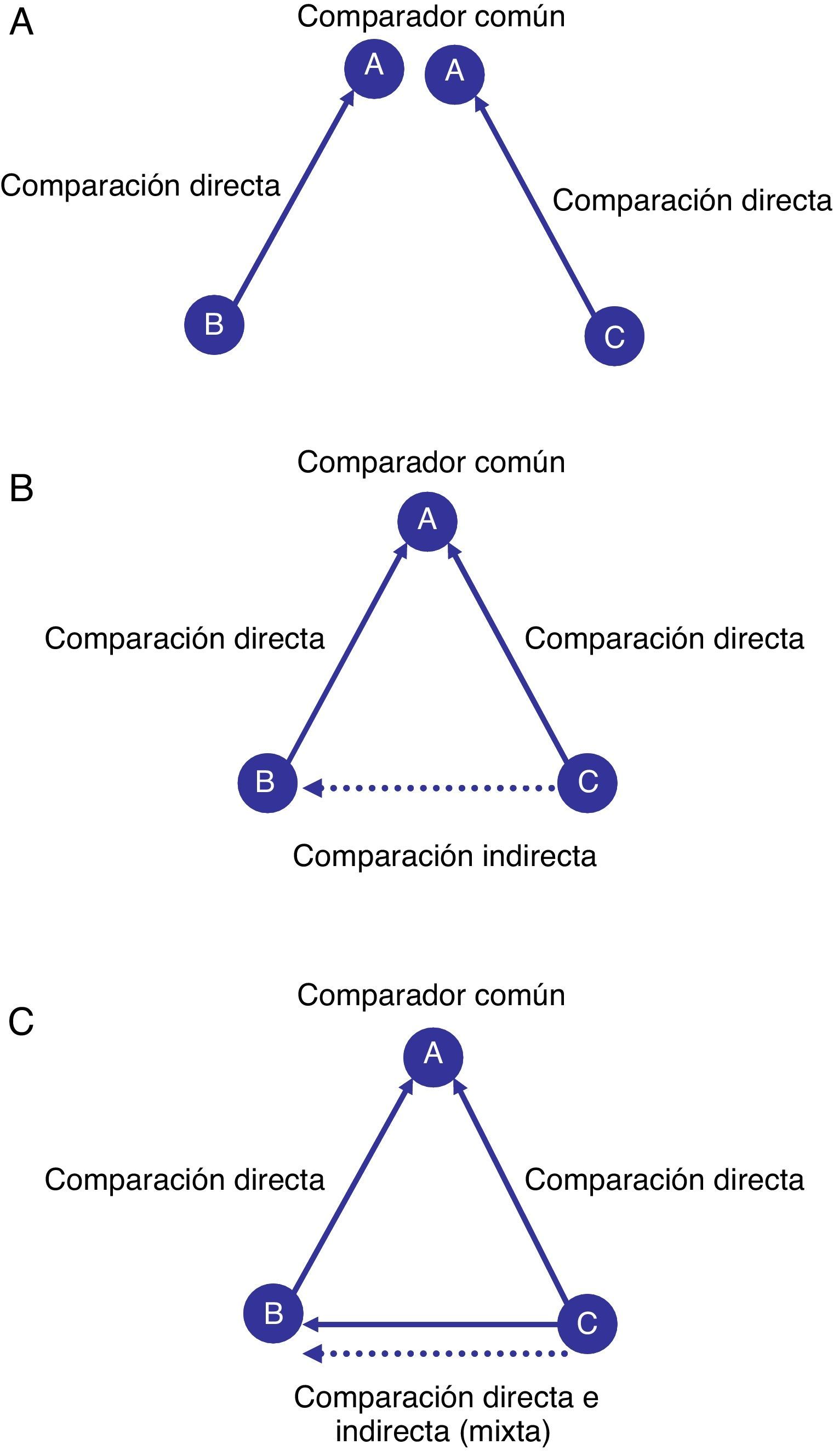
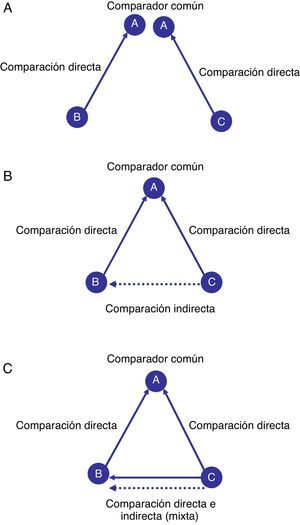
¿Qué es un metaanálisis en red?Supongamos que se desea examinar el efecto relativo de los principales tratamientos farmacológicos antihipertensivos utilizados para la prevención de la insuficiencia cardiaca. Una revisión sistemática de la evidencia científica procedente de ensayos clínicos aleatorizados y controlados solo pudo identificar estudios que comparaban el tratamiento A frente al tratamiento B y el tratamiento A frente al tratamiento C. Por lo tanto, los estudios proporcionan información que permite comparar 2 pares de tratamientos (es decir, B frente a A y C frente a A), en lo que se denominan comparaciones directas (fig. 1A). Sin embargo, se puede observar que no existe o no se ha identificado ningún estudio que compare directamente el tratamiento C frente al tratamiento B, por lo que la estimación directa entre ambos tratamientos es completamente desconocida. Siguiendo un enfoque convencional aplicando técnicas de metaanálisis, no podríamos establecer el beneficio relativo del tratamiento B respecto al C. Sin embargo, siguiendo una aproximación de metaanálisis en red se puede considerar la posibilidad de establecer comparaciones indirectas utilizando la información de los estudios que incluyen un comparador común A (fig. 1B). En el ejemplo, la comparación indirecta de C frente a B se puede obtener a partir de los resultados de las comparaciones directas de B frente a A y de C frente a A. Supongamos que el tratamiento B es mejor que A y permite prevenir 3 casos adicionales de insuficiencia cardiaca por cada 10 pacientes tratados; y que el tratamiento C es mejor que A y previene 5 casos por cada 10. Entonces, una estimación indirecta de la eficacia relativa del tratamiento C respecto al tratamiento B de forma aproximada resultaría en una eficacia relativa de 2 casos prevenidos por cada 10 pacientes tratados. Así, sería posible estimar los potenciales beneficios relativos de las distintas comparaciones en la tríada A, B y C. Además, el metaanálisis en red también permite combinar las estimaciones directas e indirectas en un único efecto del tratamiento en lo que viene denominándose una comparación mixta (fig. 1C). En el ejemplo la comparación mixta entre C y B integra los resultados de la comparación directa de los 2 tratamientos con los resultados de la comparación indirecta obtenida a partir de la información del resto de comparaciones directas (B frente a A y C frente a A). Las comparaciones mixtas pueden no solo complementar la información para aquellas comparaciones en las cuales existe poca información, sino que también pueden ayudar a mejorar la precisión de las estimaciones del efecto de los tratamientos. En resumen, un metaanálisis en red presenta información procedente de las comparaciones directas, indirectas y mixtas establecidas entre un conjunto de intervenciones alternativas.
Representación gráfica de comparaciones directas e indirectas. En la figura 1A se presentan dos comparaciones directas aisladas (una compara el tratamiento B frente a A y otra compara el tratamiento C frente a A). En la figura 2B se presentan las dos comparaciones directas anteriores que se incorporan en una revisión sistemática, permitiendo obtener una comparación indirecta (C frente a B) a partir del comparador común A. En la figura C se presentan tres comparaciones directas (las dos presentes en la figura 2B más una nueva que compara C frente a B). La combinación de una comparación indirecta y una comparación directa (por ejemplo, comparación de C frente a B) permite obtener una comparación mixta.
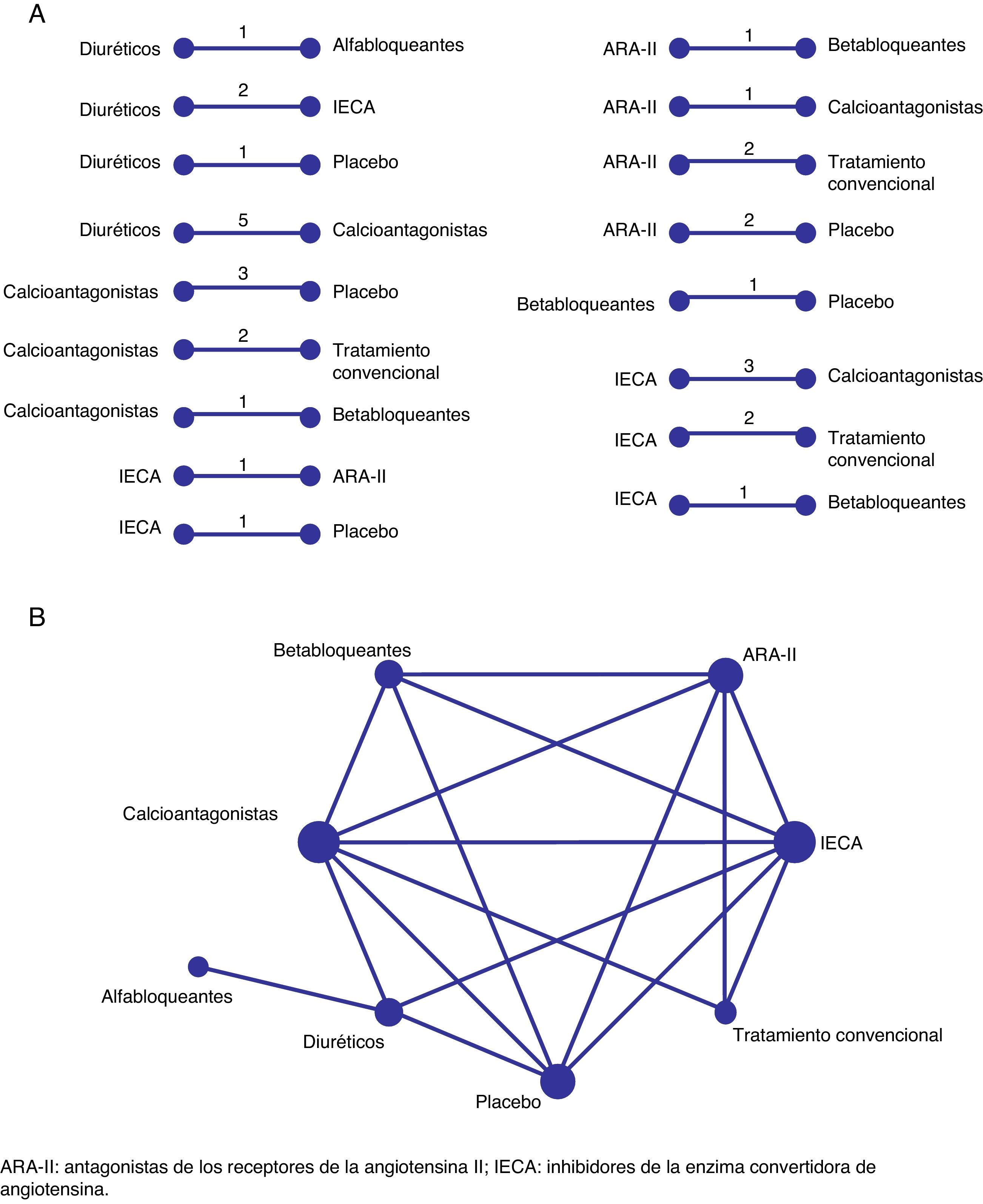
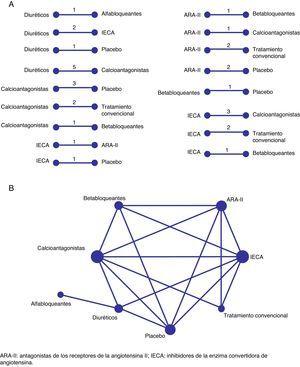
La representación gráfica de una red que muestre los diferentes tratamientos evaluados puede ser útil para comprender y determinar la fuerza de la evidencia para cada una de las distintas comparaciones, así como para mejorar la transparencia de los resultados en los metaanálisis en red5,6. Por ejemplo, en la figura 2 se presentan las múltiples comparaciones directas y la red completa de evidencia para la eficacia de diferentes tratamientos antihipertensivos utilizados para la prevención de la insuficiencia cardiaca a partir de la revisión realizada por Sciarretta et al.9. Para representar cada tratamiento se utilizan nodos, y cuando existen estudios que presentan comparaciones directas se establecen líneas o conexiones entre ellos (fig. 2A). Una red completa de tratamientos (fig. 2B) presenta en su conjunto todas las comparaciones de tratamientos identificadas a partir de los estudios identificados en una determinada enfermedad. En la tabla 1 se presenta alguna terminología utilizada habitualmente en las revisiones sistemáticas que incorporan metaanálisis en red2,4–8,10. El software estadístico más utilizado para el metaanálisis en red son los programas Stata11,12 y WinBUGS13, para los cuales hay disponibles distintos comandos de análisis y/o representación gráfica.
Tratamiento antihipertensivo para la insuficiencia cardiaca. Comparaciones directas y su representación en una red completa. En la figura 2A se presentan 17 comparaciones directas procedentes de ensayos clínicos que incluyen 8 tratamientos o alternativas distintas (6 antihipertensivos, 1 placebo y 1 tratamiento convencional sin determinar). Cada comparación directa puede tener información procedente de más de un estudio que puede combinarse a partir de metaanálisis convencionales. En la figura 2B se presenta la red completa de tratamientos a partir de las comparaciones directas anteriores. Cada nodo (o círculo) representa un tratamiento y cada comparación directa entre tratamientos viene representada por líneas conectadas entre tratamientos.
ARA-II: antagonistas de los receptores de la angiotensina II; IECA: inhibidores de la enzima convertidora de angiotensina.
Alguna terminología específica utilizada en los metaanálisis en red
| Término | Definición |
| Análisis frecuentista | Enfoque que utiliza únicamente la información obtenida en el análisis. Se fundamenta en la significación estadística para evaluar una hipótesis, a partir de los datos del estudio que se esté realizando |
| Análisis bayesiano | Emplea el conocimiento previo en el análisis de los datos, de modo que si se conoce la probabilidad de que ocurra un suceso su valor será modificado cuando se disponga esa información externa. Así pues, las fuentes de información a priori se ven trasformadas en probabilidad a posteriori y se utilizan a continuación para realizar la inferencia |
| Comparación directa | Evaluación entre 2 tratamientos que se han comparado directamente el uno con el otro (por ejemplo en un ensayo clínico) |
| Comparación indirecta | Evaluación entre 2 tratamientos que no se han comparado directamente el uno con el otro, pero que se han comparado a través de un comparador común. Respeta la aleatorización |
| Comparación mixta | Evaluación en la que se combinan los resultados o efectos de los tratamientos procedentes de comparaciones directas e indirectas |
| Consistencia | Coherencia. Acuerdo entre los efectos de las intervenciones procedentes de las comparaciones directas e indirectas |
| Factor de inconsistencia | Estadístico que identifica potenciales desacuerdos entre el efecto del tratamiento procedente de comparaciones directas e indirectas. Se puede calcular su intervalo de confianza y/o comprobar la hipótesis nula de consistencia (factor de inconsistencia igual a 0) con una prueba estadística (z-test) |
| Geometría de la red | Representación gráfica de la distribución de los tratamientos (en nodos) y sus comparaciones (conexiones) a través de una red |
| Heterogeneidad | Presencia de variabilidad entre los efectos de los tratamientos que se combinan en un metaanálisis |
| Homogeneidad | Ausencia de heterogeneidad |
| Inconsistencia | Incoherencia. Desacuerdo entre los efectos de los tratamientos procedentes de las comparaciones directas e indirectas |
| Intervalo de credibilidad | Intervalo de confianza en los análisis bayesianos |
| Metaanálisis en red | Extensión del metaanálisis de comparaciones directas en el que, en lugar de realizar un metaanálisis por separado de diversos estudios para el tratamiento B respecto al comparador A (B frente a A), para el tratamiento C respecto al comparador A (C frente a A) o para el tratamiento C respecto B (C frente a B), se lleva a cabo una valoración más completa combinando las comparaciones directas e indirectas entre diversos tratamientos que compiten entre sí en la práctica clínica (B frente a A, C frente a A y C frente a B) |
| Metarregresión | Modelo de regresión en el que la variable dependiente es el efecto del tratamiento en los estudios individuales y la(s) variable(s) independiente(s) las características de los diseños o de las poblaciones de los estudios incluidos en el metaanálisis. Permite evaluar si dichas características pueden explicar la heterogeneidad |
| Método de Bucher (o comparaciones indirectas «ajustadas») | Método para el cálculo de comparaciones indirectas a través de un comparador común en metaanálisis de ensayos con no más de 2 brazos (por ejemplo metaanálisis directo B frente A: RRBA; metaanálisis directo C frente A: RRBA; entonces se puede establecer una comparación indirecta C frente a B: Ln RRCB=Ln RRBA–Ln RRCA; siendo A: comparador común; Ln RR: logaritmo neperiano del riesgo relativo) |
| Modelo de efectos fijos | Modelo para combinar los efectos del tratamiento en un metaanálisis asumiendo que existe un único efecto común para toda la población. Por lo tanto, los efectos estimados en los estudios individuales deberían ser homogéneos |
| Modelo de efectos aleatorios | Modelo para combinar los efectos del tratamiento en un metaanálisis asumiendo que cada estudio individual es la estimación de un efecto específico distinto, permitiendo que el efecto del tratamiento varíe entre estudios. Por lo tanto, este modelo incorpora la variación entre estudios |
| Modelo consistencia | Modelo que asume consistencia entre comparaciones directas e indirectas, y permite estimar el efecto del tratamiento como una combinación de ambos tipos de comparaciones (comparación mixta) |
| Modelos inconsistencia | Modelos que permiten contrastar la asunción de consistencia estadística entre comparaciones directas e indirectas. Dependiendo del número de brazos a comparar se pueden utilizar los modelos de Lumley (ensayos con 2 brazos) o de Lu y Ades (ensayos con más de 2 brazos) |
| Red de evidencia | Conjunto de tratamientos relacionados que han sido estudiados en una determinada enfermedad o problema de salud |
| Similitud | Propiedad o principio que implicaría que los estudios analizados sean parecidos o no existan grandes diferencias en lo que respecta a potenciales factores modificadores del efecto (por ejemplo poblaciones, diseño, etc.) entre los estudios que proporcionan evidencia indirecta y directa |
| Transitividad | Suele utilizarse indistintamente cuando se refiere a la «similitud». También hace referencia al supuesto que hay que adoptar cuando se establece una comparación indirecta a través de un comparador común (es decir, si B es mejor que A y A es mejor que C, se asume que B es mejor que C) |
El metaanálisis en red basa su validez en un conjunto de supuestos. Por un lado, como sucede con otras técnicas de síntesis de la evidencia, la validez de las comparaciones indirectas dependerá de la calidad de los estudios, la variabilidad entre estudios y los sesgos de información. Por otro lado, la evidencia indirecta generalmente se considera de carácter observacional y requiere emitir sobre ella la propiedad transitiva (es decir, si un tratamiento B es mejor que A y A es mejor que C, se asume que B es mejor que C); el investigador debe valorar la transitividad de las intervenciones basándose en su conocimiento de las mismas, de la enfermedad de interés y de los diseños de los estudios. Otro aspecto importante se refiere a la consistencia o coherencia que hace referencia al nivel de acuerdo entre la evidencia procedente de comparaciones directas e indirectas. De hecho, se aconseja que exista un nivel de acuerdo alto entre la evidencia directa e indirecta para que puedan ser combinadas en un estimador resumen14. En este sentido, se recomienda que los diferentes estudios incluidos en el metaanálisis en red sean comparables por no diferir en la distribución de factores modificadores del efecto (por ejemplo diseño de los estudios, gravedad de los pacientes, tratamientos concomitantes, etc.).
La metodología del metaanálisis en red no se limita a la estimación numérica de diversas comparaciones indirectas o mixtas, sino que también permitiría explorar los sesgos o proponer una jerarquía de intervenciones. Por una parte, es posible considerar potenciales fuentes de sesgos mediante el cálculo de estimaciones ajustadas por factores considerados como variables confusoras o modificadoras del efecto. Por otra parte, el metaanálisis en red permite generar una clasificación de los diferentes tratamientos de acuerdo con la probabilidad de ser el mejor tratamiento. En ocasiones, esta clasificación podría facilitar la interpretación de los resultados procedentes del metaanálisis, y puede ser especialmente importante para los clínicos que desean conocer cuál es el mejor tratamiento para un determinado problema de salud. Sin embargo, existen riesgos de prestar excesiva atención a las probabilidades de que un tratamiento sea el mejor (o el peor), sobre todo cuando la red de evidencia es débil (existen pocos estudios para algunas comparaciones o son de pequeño tamaño y de baja calidad). De hecho, la clasificación o ranking de los tratamientos puede cambiar ampliamente cuando falta alguna alternativa de tratamiento de interés o existen indicios de sesgos de publicación15–17. Por este motivo se debería prestar más atención a la magnitud de los efectos de los tratamientos y su incertidumbre10.
Epidemiología de los metaanálisis en red publicadosEn los últimos años, los metaanálisis en red están ganando rápidamente popularidad entre clínicos, investigadores, planificadores sanitarios, editores de revistas y agencias de evaluación como una fuente de información de interés para conocer la eficacia y seguridad comparada de nuevas intervenciones. A pesar de esto algunos de los aspectos metodológicos específicos, e incluso su posible interpretación son poco conocidos. Ello incluye aspectos relacionados con la robustez de la metodología y el riesgo de sesgos de cada una de las comparaciones establecidas en las redes publicadas, la diversidad de herramientas o modelos utilizados, y las oportunidades para explorar fuentes de heterogeneidad y de inconsistencias, y la variabilidad en la presentación de los métodos y resultados en los trabajos publicados.
En una interesante revisión sistemática Bafeta et al.18 examinaron aspectos metodológicos generales de revisiones sistemáticas que incluyeran metaanálisis en red que compararan la eficacia de 3 o más intervenciones a partir de ensayos clínicos y que hubieran sido publicados hasta julio de 2012. Los autores identificaron 121 trabajos que abordaban una amplia variedad de disciplinas médicas (por ejemplo 22% en cardiología, 13% en reumatología, 10% en endocrinología y 8% en oncología). El 83% evaluaron intervenciones farmacológicas y un 46% se publicaron en revistas de alto factor de impacto. De los trabajos identificados el 73% no reportaba la estrategia de búsqueda utilizada, el 50% no incluía la evaluación del riesgo de sesgos de los estudios individuales. El 79% no presentaba las características de los estudios individuales y en un 30% el resultado primario no se identifica claramente. En cuanto a los supuestos y aspectos importantes de la metodología el 72% presentaba de manera inadecuada aspectos relevantes (tan solo consideraron el supuesto de similitud o el de consistencia el 34 y 48% de los trabajos, respectivamente).
Otra revisión reciente de la Agency for Healthcare Research and Quality (AHRQ)19,20 evaluó los métodos estadísticos utilizados en una muestra de metaanálisis en red publicados hasta 2011. Concretamente se identificaron 34 metaanálisis en red que utilizaron análisis bayesianos que abarcaban 13 áreas médicas (por ejemplo 18% en cardiología y 12% en oncología). El 86% examinaban los efectos de tratamientos farmacológicos. Los autores también observaron que en los trabajos revisados los métodos utilizados para evaluar la heterogeneidad e inconsistencia se presentaron raramente, y en aquellos trabajos que proporcionaban información al respecto existía variabilidad metodológica.
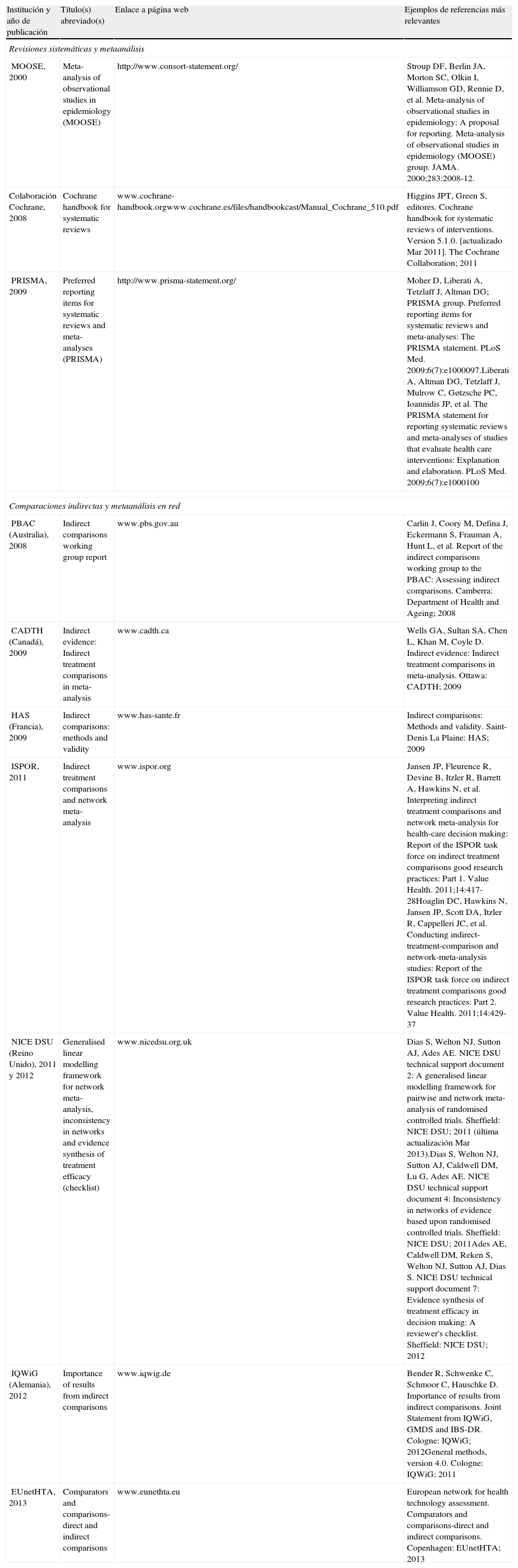
Recomendaciones para el desarrollo y presentación de resultadosLas guías y documentos que presentan recomendaciones para el desarrollo y presentación de trabajos de investigación ayudan a que investigadores, revisores y editores cumplan con ciertos estándares, proporcionando un conjunto de reglas o principios que guían hacia el mejor comportamiento en un área particular. Desde hace años algunas revistas ya utilizan y exigen a sus autores a que se adhieran a las guías y documentos pertinentes, como por ejemplo la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) o el manual Cochrane para revisiones sistemáticas y metaanálisis. En el caso particular de los metaanálisis en red existe una urgente necesidad en lograr una mejora de la presentación e interpretación en los trabajos publicados. Hasta la fecha tan solo un reducido número de instituciones y sociedades científicas han emitido y publicado documentos al respecto (tabla 2). Ante la falta de evidencias procedentes de las fuentes habituales algunas agencias de evaluación, como es el caso del National Institute for Health and Care Excellence (NICE) en Reino Unido, la Canadian Agency for Drugs and Technologies in Health (CADTH)-Common Drug Review o el Pharmaceutical Benefits Advisory Committee (PBAC) en Australia, o incluso la Colaboración Cochrane, consideran los resultados de las comparaciones indirectas como una fuente de información complementaria para guiar la toma de decisiones en distintos niveles. En situaciones en las que existe evidencia directa (procedente de ensayos clínicos comparativos) esta sigue reconociéndose como la fuente de información que proporciona el mayor grado de evidencia.
Ejemplos de algunas guías y documentos con recomendaciones para el desarrollo y la presentación de metaanálisis
| Institución y año de publicación | Título(s) abreviado(s) | Enlace a página web | Ejemplos de referencias más relevantes |
| Revisiones sistemáticas y metaanálisis | |||
| MOOSE, 2000 | Meta-analysis of observational studies in epidemiology (MOOSE) | http://www.consort-statement.org/ | Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, et al. Meta-analysis of observational studies in epidemiology: A proposal for reporting. Meta-analysis of observational studies in epidemiology (MOOSE) group. JAMA. 2000;283:2008-12. |
| Colaboración Cochrane, 2008 | Cochrane handbook for systematic reviews | www.cochrane-handbook.orgwww.cochrane.es/files/handbookcast/Manual_Cochrane_510.pdf | Higgins JPT, Green S, editores. Cochrane handbook for systematic reviews of interventions. Version 5.1.0. [actualizado Mar 2011]. The Cochrane Collaboration; 2011 |
| PRISMA, 2009 | Preferred reporting items for systematic reviews and meta-analyses (PRISMA) | http://www.prisma-statement.org/ | Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA group. Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement. PLoS Med. 2009;6(7):e1000097.Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JP, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: Explanation and elaboration. PLoS Med. 2009;6(7):e1000100 |
| Comparaciones indirectas y metaanálisis en red | |||
| PBAC (Australia), 2008 | Indirect comparisons working group report | www.pbs.gov.au | Carlin J, Coory M, Defina J, Eckermann S, Frauman A, Hunt L, et al. Report of the indirect comparisons working group to the PBAC: Assessing indirect comparisons. Camberra: Department of Health and Ageing; 2008 |
| CADTH (Canadá), 2009 | Indirect evidence: Indirect treatment comparisons in meta-analysis | www.cadth.ca | Wells GA, Sultan SA, Chen L, Khan M, Coyle D. Indirect evidence: Indirect treatment comparisons in meta-analysis. Ottawa: CADTH; 2009 |
| HAS (Francia), 2009 | Indirect comparisons: methods and validity | www.has-sante.fr | Indirect comparisons: Methods and validity. Saint-Denis La Plaine: HAS; 2009 |
| ISPOR, 2011 | Indirect treatment comparisons and network meta-analysis | www.ispor.org | Jansen JP, Fleurence R, Devine B, Itzler R, Barrett A, Hawkins N, et al. Interpreting indirect treatment comparisons and network meta-analysis for health-care decision making: Report of the ISPOR task force on indirect treatment comparisons good research practices: Part 1. Value Health. 2011;14:417-28Hoaglin DC, Hawkins N, Jansen JP, Scott DA, Itzler R, Cappelleri JC, et al. Conducting indirect-treatment-comparison and network-meta-analysis studies: Report of the ISPOR task force on indirect treatment comparisons good research practices: Part 2. Value Health. 2011;14:429-37 |
| NICE DSU (Reino Unido), 2011 y 2012 | Generalised linear modelling framework for network meta-analysis, inconsistency in networks and evidence synthesis of treatment efficacy (checklist) | www.nicedsu.org.uk | Dias S, Welton NJ, Sutton AJ, Ades AE. NICE DSU technical support document 2: A generalised linear modelling framework for pairwise and network meta-analysis of randomised controlled trials. Sheffield: NICE DSU; 2011 (última actualización Mar 2013).Dias S, Welton NJ, Sutton AJ, Caldwell DM, Lu G, Ades AE. NICE DSU technical support document 4: Inconsistency in networks of evidence based upon randomised controlled trials. Sheffield: NICE DSU; 2011Ades AE, Caldwell DM, Reken S, Welton NJ, Sutton AJ, Dias S. NICE DSU technical support document 7: Evidence synthesis of treatment efficacy in decision making: A reviewer's checklist. Sheffield: NICE DSU; 2012 |
| IQWiG (Alemania), 2012 | Importance of results from indirect comparisons | www.iqwig.de | Bender R, Schwenke C, Schmoor C, Hauschke D. Importance of results from indirect comparisons. Joint Statement from IQWiG, GMDS and IBS-DR. Cologne: IQWiG; 2012General methods, version 4.0. Cologne: IQWiG; 2011 |
| EUnetHTA, 2013 | Comparators and comparisons-direct and indirect comparisons | www.eunethta.eu | European network for health technology assessment. Comparators and comparisons-direct and indirect comparisons. Copenhagen: EUnetHTA; 2013 |
CADTH: Canadian Agency for Drugs and Technologies in Health; HAS: Haute Autorité de Santé; IQWiG: Institute for Quality and Efficiency in Health Care; ISPOR: International Society for Pharmacoeconomics and Outcomes Research; MOOSE: Meta-analysis of Observational Studies in Epidemiology; NICE DSU: The National Institute for Health and Clinical Excellence Decision Support Unit; PBAC: Pharmaceutical Benefits Advisory Committee.
El principal inconveniente del ensayo clínico es que generalmente se suele centrar en la comparación de no más de 2 o 3 alternativas a la vez (tratar frente a no tratar, tratar con una opción A frente a B y A frente a C, etc.). Ello implicaría disponer de ensayos clínicos con tantas ramas de tratamiento como alternativas disponibles y que permitieran establecer diversas comparaciones de interés para el clínico. Para una toma de decisiones más informada es necesario conocer la evidencia disponible sobre las múltiples alternativas disponibles en la práctica clínica, así como sintetizar cuantitativamente esta información. Actualmente se está trabajando desde diversos grupos (por ejemplo el grupo PRISMA y el Cochrane Comparing Multiple Interventions Group) en iniciativas que incluirían extensiones de las actuales recomendaciones para que cubran de una manera más específica aspectos y particularidades de los metaanálisis en red, y así se disponga de unos principios básicos para la buena presentación de los métodos y resultados en los futuros trabajos.
Algunas limitacionesAunque los metaanálisis en red permiten establecer comparaciones aparentemente coherentes y válidas (al menos, internamente), el clínico debe recordar que siempre deberán establecerse supuestos o asunciones que tienen que considerarse a la hora de interpretar los resultados de este tipo de análisis. Como se comentaba anteriormente, la evidencia indirecta procedente de un metaanálisis en red requiere emitir sobre ella la asunción de transitividad (es decir, si un fármaco B es mejor que A, y A es mejor que C, entonces se asume que B es mejor que C) y de consistencia (grado de acuerdo entre la evidencia directa e indirecta). La valoración de estos supuestos es importante a la hora de determinar la validez de las estimaciones presentadas en un metaanálisis en red. Existen ejemplos publicados en la literatura en los que se discute el incumplimiento de la transitividad entre estudios21, o que los resultados entre las comparaciones directas e indirectas no sean coincidentes (inconsistencia o incoherencia estadística)14,22,23. Algunas de las técnicas disponibles en la actualidad para identificar potenciales inconsistencias están en continuo desarrollo y/o presentan importantes limitaciones (por ejemplo, una escasa potencia estadística)22.
También hay que mencionar que se requiere que los diferentes estudios de los que se parte sean en mayor o menor grado comparables (similitud metodológica) por no diferir en la distribución de factores modificadores del efecto entre estudios21,24 (por ejemplo, poblaciones estudiadas, dosis utilizadas, procedimientos, medidas de resultados, tiempo de seguimiento, etc.). Todo ello, sin renunciar a los criterios de buena calidad que han de estar presentes siempre en toda revisión sistemática con (o sin) metaanálisis, como son: la calidad de los estudios individuales, siendo requerido que los sesgos o errores sistemáticos sean mínimos; y que la variabilidad (heterogeneidad) entre estudios no sea excesiva. De hecho, cualquier comparación indirecta y/o mixta siempre debería establecerse en el marco de revisiones sistemáticas y metaanálisis rigurosos, teniendo en cuenta las múltiples intervenciones que son evaluadas a partir de una red completa de estudios, evitando cualquier tipo de sesgos (por ejemplo, exclusión de intervenciones o estudios potencialmente relevantes, o una mala descripción de los resultados).
Consideraciones finalesA modo de resumen, los metaanálisis en red suponen una propuesta metodológica interesante para su aplicación en epidemiología clínica y salud pública, ya que desde un enfoque más completo que el que se venía utilizando tradicionalmente se pueden proporcionar estimaciones del efecto de los tratamientos respecto a las múltiples alternativas disponibles, facilitando el acceso a la información que puede ser relevante en situaciones en las que la evidencia procedente de comparaciones directas es escasa o inexistente. Sin embargo, cabe reconocer que la metodología se encuentra en sus etapas iniciales, y la aplicación de la evidencia proporcionada por las comparaciones indirectas para guiar la toma de decisiones clínicas es, cuando menos, controvertida10,25–29.
Los metaanálisis en red se deberían realizar en el marco de revisiones sistemáticas rigurosas que garanticen la calidad metodológica de los estudios incluidos. Para que alcancen su verdadero potencial existe una urgente necesidad de planificar, ejecutar y presentar de forma sistemática y transparente las evaluaciones que incorporen metaanálisis en red con comparaciones indirectas y mixtas. Si se trabaja en la línea correcta y estos aspectos siguen mejorando, la información procedente de los metaanálisis en red podría servir como fuente de información complementaria, no excluyente y generadora de hipótesis para futuros estudios, pudiendo así contribuir a facilitar la aplicación de los resultados de la investigación a la práctica clínica. Por otro lado, parece recomendable mayor conocimiento por parte de lectores, revisores e investigadores, mejorar urgentemente la calidad de la descripción de los métodos y resultados de los trabajos publicados en las revistas biomédicas, así como seguir desarrollando aspectos metodológicos de las técnicas para abordar posibles fuentes de sesgos30, y en la medida de lo posible, contrastar los resultados obtenidos con evaluaciones rigurosas que sirvan para responder preguntas fundamentales relacionadas con la salud pública.
NotaLas opiniones expresadas en este trabajo son responsabilidad de los autores, por lo que no reflejan necesariamente el punto de vista de los organismos en los que trabajan.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.