La disminución del riesgo cardiovascular sigue siendo uno de los objetivos principales de la Salud Pública. Contribuyen a él patologías como la Diabetes Mellitus, Obesidad e Hipertensión Arterial, todas las cuales no han logrado ser detenidas en su creciente prevalencia. Existen factores hasta ahora no considerados en forma integral al tratamiento de esta triada, como el Sindrome de Apnea Obstructiva del Sueño, que se sabe está asociado a éstas, plantea la idea de un tratamiento sinérgico como alternativa para lograr las metas terapéuticas. Sin embargo las expectativas creadas no concuerdan con los resultados comunicados, demostrándose que faltan aún estudios que realizar. Se mencionan diversos estudios epidemiológicos y se resumen los fundamentos biológicos que explican la asociación SAOS - DM.
The cardiovascular risk reduction remains one of the main goals of public health. Contributors to diseases such as diabetes mellitus, obesity and hypertension, all of which have failed to be arrested in its growing prevalence. There are so far not considered factors in a comprehensive treatment of this triad, as the Sd. Obstructive Sleep Apnea, knowing that they pose to be associated with the idea of a synergistic treatment as an alternative to achieve therapeutic goals. But the expectations are not consistent with the reported results, showing that even missing studies performed. Mentioned several epidemiological studies and summarizes the biological foundations that explain the association OSA - DM.
La mayoría de las publicaciones que se refieren a Diabetes Mellitus tipo 2 (DM2) destacan su gran prevalencia y creciente incidencia. La Organización Mundial de la Salud en septiembre del año 2012 reveló una prevalencia de DM de 347 millones de personas en el mundo, cifra que sobrepasaba la esperada para el año 2025 (1).
En Chile la prevalencia actual de Diabetes Mellitus dada a conocer por el Ministerio de Salud según la encuesta nacional de salud del año 2010, es el 9,4% de nuestra población (2), cifra concordante con la gran mayoría de los países de igual nivel de desarrollo.
La obesidad e hipertensión arterial crónica (HTA), son también problemas de salud pública, que junto a la DM dan cuenta del mayor gasto en salud a nivel local y mundial (2). Cada año los grupos de trabajo en salud pública proponen objetivos para detener estas crecientes incidencias, sin embargo periódicamente se asiste a resultados inesperados, situación que demuestra la necesidad de trabajar otros factores que aparecen vinculado a esta triada y que hasta hoy no han sido considerados. Entre estos factores se encuentran las patologías de sueño, específicamente el Sd. de Apnea Obstructiva de Sueño (SAOS) e hipoapnea (HIAS) los cuales también han sido vinculados al riesgo cardiovascular.
SAOS, definiciones, epidemiología y fisiopatologíaLa Clasificación Internacional de Trastornos del Sueño identifica las diversas alteraciones que afectan el periodo de sueño, entre las cuales existen diferentes formas de apneas, de las que se distinguen las apneas originadas a nivel del sistema nervioso central y otras causadas por obstrucción de la vía aérea. A este último grupo pertenece e Síndrome de Apnea-Hipoapnea Obstructivo del Sueño, que consiste en episodios repetidos, de 10 segundos o más de duración, de colapso parcial o total de la vía aérea superior, con disminución o cese del flujo de aire respiratorio naso-bucal, asociados a síntomas diurnos, en particular somnolencia excesiva. En pacientes gravemente afectados se producen más de 30 apneas por hora, con periodos reiterativos de hipoxia, caídas en la saturación de oxígeno en la sangre y alteración en la arquitectura del sueño caracterizada por fragmentación del periodo con despertares frecuentes a la vez que se observa esfuerzo respiratorio aumentado (3). Se han detectado síntomas de SAOS en 9% de las mujeres y 24% de los varones de la población adulta y se estima que existe un paciente más con síntomas menos evidentes y que permanecen sin diagnosticar por cada cinco de los ya diagnosticados (4). Estudios con diagnósticos más precisos en base a la presencia de síntomas y hallazgos polisomnográficos muestran prevalencia entre el 1% a 5% en varones y 1% a 3% en mujeres de la población general (5).
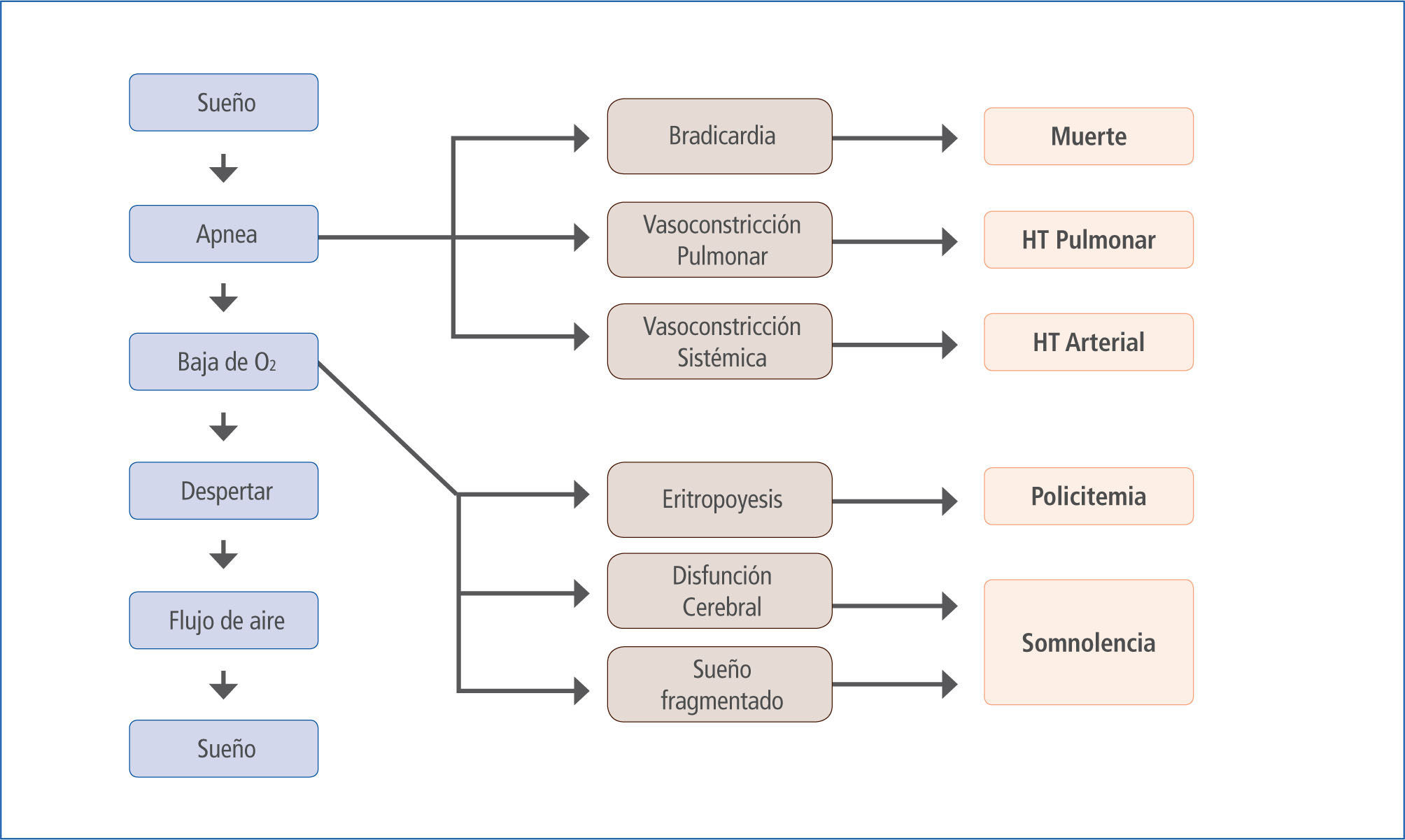
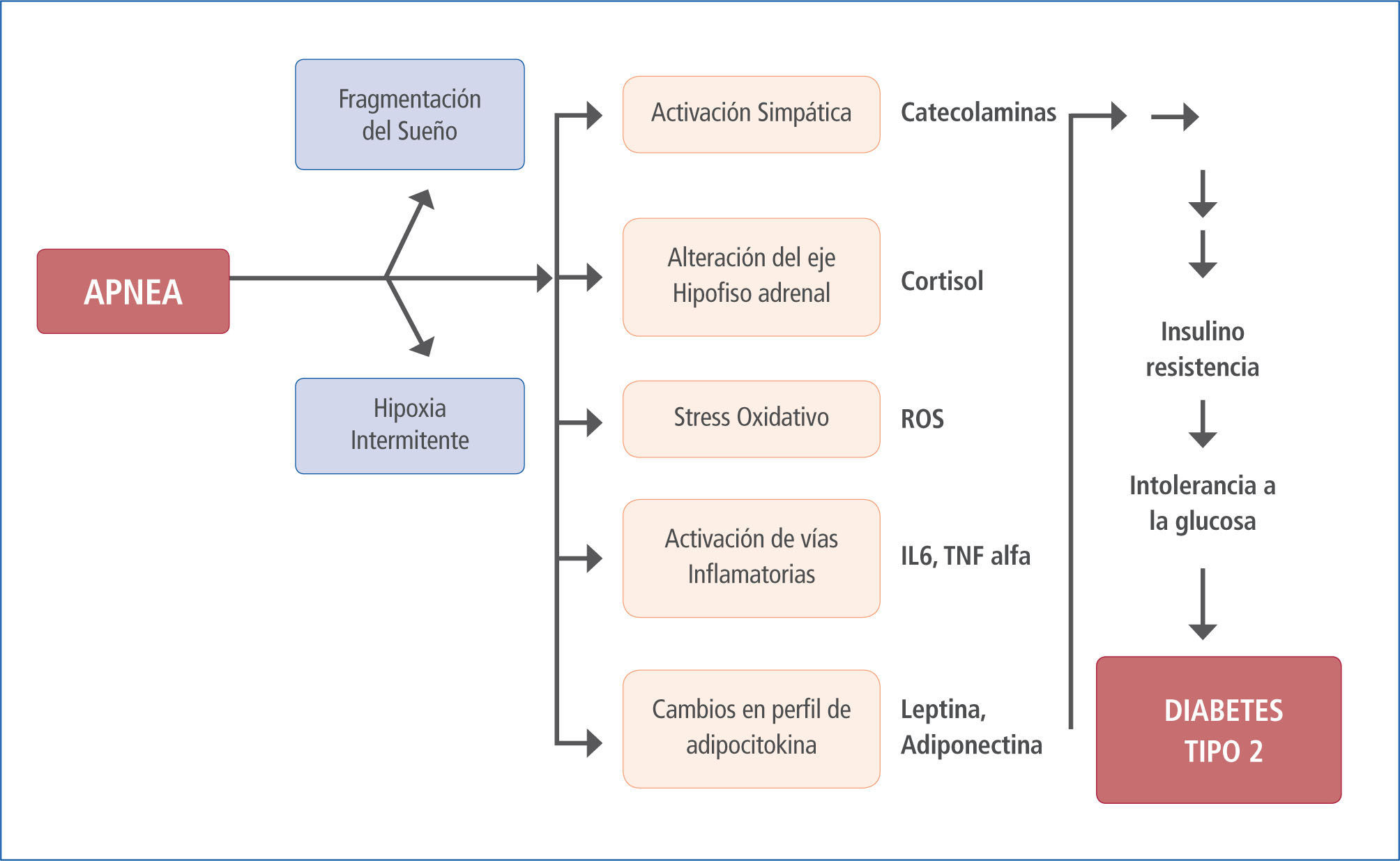
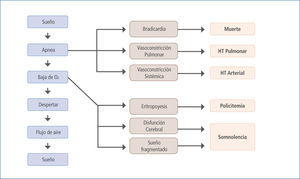
La signo-sintomatología y las consecuencias biológicas asociadas al SAOS resultan de la hipoxia e hipercapnia intermitente, cambios de presión intratorácica, activación simpática y fragmentación del sueño (6) que dan como resultado el clásico cuadro clínico con activación simpática (durante el periodo de apnea y posterior a estos (7)), desregulación metabólica, disfunción endotelial, inflamación sistémica, estrés oxidativo, hipercoagulabilidad y cambios neurohumorales, todos los cuales pueden originar y/o agravar enfermedades como HTA, hipertensión pulmonar, insuficiencia cardíaca, arritmias, enfermedad coronaria, muerte súbita y eventos agudos vasculares cerebrales entre otras (8) (Figura 1).
Fisiopatología del SAOS
Modificado de (9).
Se ha postulado que la vecindad de los núcleos hipotalámicos encargados del control y regulación del ciclo sueño vigilia, del apetito y el entorno metabólico asociado a este último junto a la red de interrelaciones existentes entre ellos son las posibles causales de la asociación existente entre el sueño y DM.
En los núcleos del hipotálamo se localizan células especializadas en mantener los niveles de glucosa circulante que aseguran la provisión para el sistema nervioso central, actividad de primer orden al carecer éste de depósitos de glucosa y no poseer capacidad de neoglucogenia (10). De las cinco etapas del sueño (movimiento ocular rápido (REM), fases 1, 2, 3, y 4 de sueño no-REM) las etapas 3 y 4, conocidas como sueño de onda lenta, son las más profundas y están asociadas a cambios metabólicos, hormonales y neurofisiológicos transitorios, que pueden afectar la homeostasis glucosa. En estas fases se reconoce una disminución en el uso de la glucosa por el cerebro.
Spiegel et al. (1999) demostró la influencia del sueño sobre la regulación de los niveles carbohidratos sometiendo a 11 hombres voluntarios sanos a restricción de sueño, durmiendo solamente 4 horas cada día por 6 días y comparar los datos obtenidos al reevaluar luego de 6 días con libertad de sueño de 12 horas. Observaron una menor tolerancia a la glucosa en el estado de deuda de sueño en relación a la condición de descanso (p <0,02), una disminución de las concentraciones de tirotropina (p <0,01), y aumento en la actividad del sistema nervioso simpático (p <0,02) junto a niveles cortisol vespertino con respuesta de estrés (p=0,0001). Es así comprensible que un estrés metabólico pudiera ser generado por eventos hipóxicos y fragmentación del sueño observada en el SAOS (11).
Diversos estudios muestran desórdenes endocrinos que se vinculan con el desarrollo de la DM o deterioro de ésta, entre estos se menciona aumento de la liberación de hormona del crecimiento por la hipófisis y disminución de corticotropina (12). El sistema nervioso simpático libera norepinefrina desde sus terminales periféricos y provoca una disminución de la secreción de insulina a la vez que incrementa la resistencia a la insulina (13). La hipoxia reiterada repercute sobre los diferentes tejidos con distintas consecuencias, en el hígado y músculo esquelético acumulan lípidos llegando a concentraciones de alta de LDL y Bajas de HDL, (14, 15), a nivel vascular se eleva el nivel de endotelina 1 y los fenómenos de reoxigenación aumentan la oxidación de las lipoproteínas de baja densidad (LDL) umentando su efecto aterogénico (16). Otras hormonas relacionadas con el metabolismo de la glucosa y lípidos como la grelina, leptina y resistina se encuentran elevadas, las cuales junto a la disminución de la orexina conducen al descontrol del apetito y origen de obesidad. Marcadores de estrés oxidativo como los niveles de interleucina 6, factor de necrosis tumoral alfa y PCR ultrasensible también se encuentran elevados en pacientes con SAOS. Todos estos marcadores también se relacionan con la patogenia y agravamiento del Sindrome Insulino Resistente (SIR), progreso y deterior de la DM2 (17).
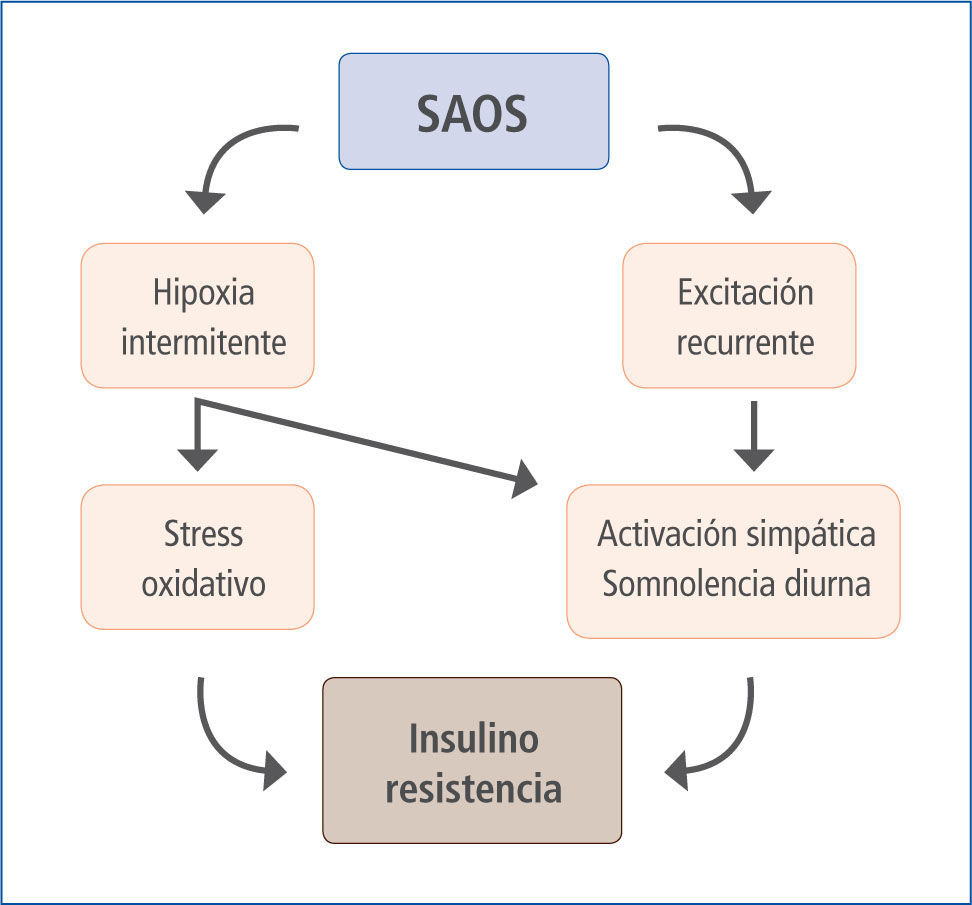
Estudios epidemiológicos han postulado una asociación entre SAOS, obesidad y DM (Figura 2), y también evidencias de relación SAOS - DM2 independiente de la presencia de obesidad. Dependiendo del tipo de estudio y herramienta diagnóstica, se menciona que entre un 20 a 40% de los individuos comparten estas dos condiciones (18); otros sugieren que aproximadamente el 49% de las personas con SAOS tiene DM2 (19, 20) y 23% de la población con DM2 padece de SAOS (21). Como dato agregado es importante considerar que pacientes con roncopatía también tienen mayor riesgo de desarrollar diabetes a 10 años, incluso sin la presencia de obesidad (22, 23).
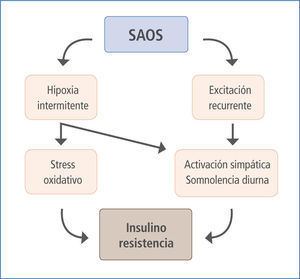
Relación SAOS - SIR
(ref 24)
Uno de los primeros trabajos que confirmó la probable interferencia de la Diabetes Mellitus en el periodo de sueño fue hecho por Robbin et al. (25) en 1959, que estudió una cohorte de pacientes diabéticos y no diabéticos en forma observacional, demostrando que las glicemias obtenidas durante el sueño en sujetos no diabéticos eran estables, en cambio los pacientes con DM mostraban marcadas variaciones. Por otro lado el efecto de la privación de sueño sobre el metabolismo de los hidratos de carbonos fue demostrado por Kuhn et al. (26) en el año 1969 al describir que la privación total de sueño conducía a un marcado aumento en los niveles de glucosa sanguíneo. Dos grandes estudios con resultados concordantes han sido los realizado por Chaput et al. que utilizando cuestionarios de auto-reporte buscó el efecto de la duración del sueño y la aparición de alteraciones en el metabolismo de la glucosa (DM o intolerancia a la glucosa). La población estudiada estuvo constituida por 323 hombres y 417 mujeres de la cohorte del Family Study Quebec, ellos fueron preguntados acerca de la duración del periodo de sueño y concluyó que aquellos que dormían durante 5 a 6 horas tenían una razón relativa de 2,09 de tener una tolerancia a la glucosa alterada en comparación con aquellos que dormían 7 u 8 horas (27). De igual manera los datos del Estudio de Salud de las Enfermeras y el Estudio de Massachusetts Male Aging demostraron por información obtenida de autovaloración de la duración de sueño en hombres y mujeres de mediana edad, que un corto periodo de sueño (menor de 5 horas cada noche) y periodos largos (sobre 9 horas cada noche en las mujeres y 8 horas cada noche en hombres) aumentaban significativamente el riesgo de desarrollar diabetes (28, 29).
Historia natural de la dm2 y su relación con el sindrome apnea obstructiva del sueñoEn la población diabética y pre diabética se reconocen alteraciones en la arquitectura, calidad y duración del sueño, siendo este más corto y de mala calidad (32, 33), trastornos que pueden afectar negativamente la homeostasis de la glucosa y la sensibilidad a la insulina, llegando a constituir un factor de riesgo independiente para el desarrollo y pronóstico de la diabetes.
El periodo que anticipa a la DM2 conocido como “insulinoresistencia” se caracteriza por una disminución, en diferente cuantía, en la respuesta de ciertos tejidos (adiposo, muscular, cerebro entre otros) a la actividad esperada de la insulina. Este fenómeno reconocido ampliamente como resistencia la insulina, es una sobreexpresión, a rangos patológicos, de la “resistencia” fisiológica a la insulina observada en diversas circunstancias que enfrenta el ser humano (embarazo, infecciones, traumas etc.). La consecuencia de este fenómeno es la tendencia a un nivel elevado de glicemia y provoca una respuesta compensatoria multihormonal entre las que destaca el incremento en la producción de insulina por las células beta de los islotes pancreáticos de Langerhans. Esta compensación conduce a un ambiente hiperinsulinémico que es suficiente, en los primeros años, para mantener la normoglicemia, pero como consecuencia de las modificaciones en diversas líneas metabólicas produce un incremento de triglicéridos y desarrollo de obesidad (34).
La interrogante surgida acerca de la influencia que pudiera tener el SAOS en el metabolismo de los Hidratos de Carbonos sigue intentando ser contestada. Recientemente Priou et al. realizó un estudio de corte transversal a una población de pacientes no diabéticos, buscando la relación de la alteración de sueño y deterioro de HbA1c, y observó una asociación directa entre el índice de Apnea - Hipoanea (IHA) y el porcentaje de pacientes con HbA1c > 6,0%. Solo el 10,8% de los pacientes con HbA1c > 6,0% tenía IAH < 5 mientras que el 34,2% tenía IAH ≥ 50. Tras realizar ajustes para múltiples variables, los resultados mostraron que el odds ratio (95% IC) para HbA1c > 6,0% de 1 como referencia obtenido con un valor IAH <5 incrementaba progresivamente según aumentaba el IAH, hasta llegar a 2.9 para IAH ≥ 50. El aumento de la hipoxemia durante el sueño también se asoció independientemente con la probabilidad de HbA1c > 6,0%. Demostraron así que el aumento en la gravedad de la SAOS es un factor independiente asociado con el deterioro del metabolismo de la glucosa (35).
Mallon et al. realizó un estudio de seguimiento en una muestra aleatoria de 2.663 individuos de 45 a 65 años que vivían en el centro de Suecia, enviando un cuestionario postal que incluía preguntas sobre la duración y alteraciones del sueño, características sociodemográficas, comportamiento de factores de riesgo, condiciones médicas y depresión. Logró una tasa de respuesta del 70,2%. Doce años más tarde, envió un nuevo cuestionario con preguntas casi idéntica a las previas a todos quienes habían respondido (n: 1.604) logrando una nueva contesta en 1.244 sujetos (77,6%). Sus resultados revelaron que los hombres que debuta-ron su diabetes durante el seguimiento, en relación a los no diabéticos, relataban sueño de corta duración (< 5 horas por noche) (16, vs 5,9%, p<0,01), dificultades para iniciar el sueño (16,0 vs 3,1%, p < 0,001), y dificultades para mantener el sueño (28,0 vs 6,3%, p<0,001). Las mujeres que reportaron nueva diabetes durante el seguimiento informaron al inicio duración del sueño largo (> 9h por noche) con más frecuencia que las mujeres no desarrollaron diabetes (7,9 vs 2,4%, P>0,05). Después del ajuste de los factores de riesgo relevantes y aplicando modelos de regresión logística, el riesgo relativo (95% IC) para el desarrollo de la diabetes fue mayor en los hombres con sueño de corta duración (2,8 [1,1-7,3]) o dificultades para mantener el sueño (4,8 [1,9 -12,5]) y concluyó que las dificultades para mantener el sueño o sueño de corta duración (< 5h) se asocian con una mayor incidencia de diabetes en los hombres (36).
Otros estudios experimentales que se refieren al efecto de la privación del sueño en los seres humanos sanos demuestran que también se la regulación del apetito y disminuye la sensibilidad a la insulina con el consiguiente aumento de la obesidad (37, 38).
Se configura así una estrecha relación en el periodo de la prediabetes y el SAOS.
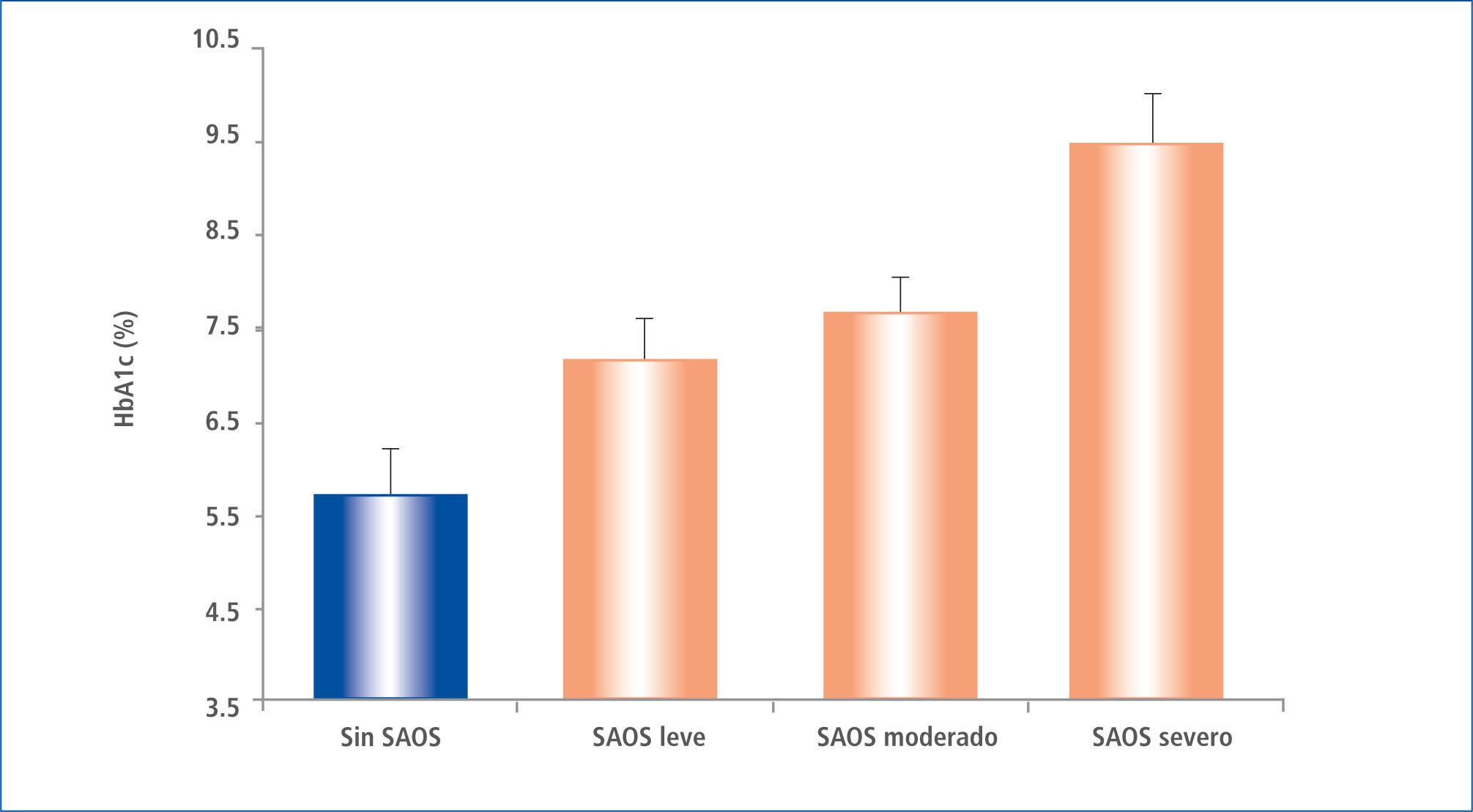
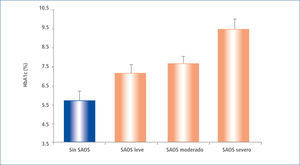
En pacientes ya portadores de DM2 se ha estudiado la influencia de la calidad del sueño sobre los resultados del control metabólico. Aronsohn et al. (Illinois), en el año 2009 realizó estudios de polisomnografía y evaluó la HbA1c en 60 pacientes consecutivos con diabetes reclutados de las clínicas ambulatorias de DM. La pregunta de estudio fue si el SAOS influye sobre el control metabólico del paciente diabético, el que era interpretado en la hemoglobina A1c (HbA1c). Se encontró que el 77% de los pacientes con DM tenían SAOS (IAH> 5), y el aumento de gravedad de la SAOS se asoció con un peor control de glucosa, después de ajustes realizados para la edad, sexo, raza, índice de masa corporal, número fármacos hipoglicemiantes, nivel de ejercicio, años de diabetes y tiempo total de sueño. En comparación con los pacientes sin SAOS, la HbA1c media ajustada se incrementó en un 1,49% (plt;0,0028) en pacientes con SAOS leve, 1,93% (p=0,0033) en los pacientes con SAOS moderado y 3,69% (P<0,0001) en pacientes con SAOS grave (p< 0,0001 para la tendencia lineal). Las medidas de gravedad de SAOS, incluyendo el total AHI (p=0,004), el movimiento rápido de los ojos AHI (p=0,005) y el índice de desaturación de oxígeno durante el sueño de movimientos oculares total y rápida (p=0,005 y p=0,008, respectivamente) se correlacionaron positivamente con el aumento de los niveles de HbA1c (39). (Figura 4).
HB. glicosilada a1c media, ajustada, en pacientes sin saos y con saos leve, moderada y severa
Datos ajustados por edad, sexo, raza, índice de masa corporal, número de medicamentos para la diabetes, nivel de ejercicio, años de diabetes, y tiempo total de sueño en la polisomnografía. Las barras representan SEM, P, 0,0001 para la tendencia lineal.
Modificado de Ref 17.
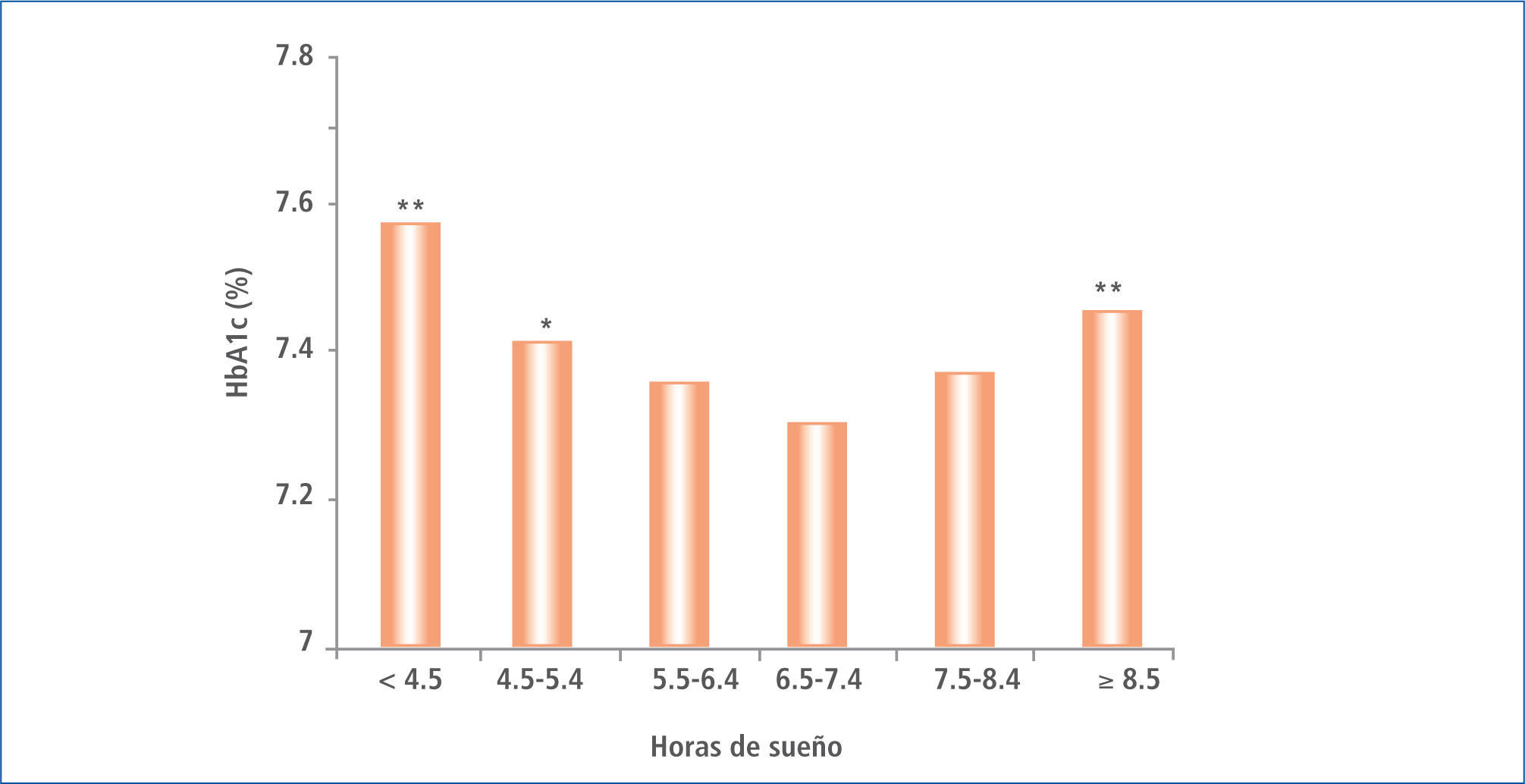
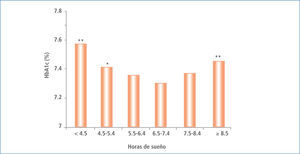
Ohkuma et al. también llega a demostrar la influencia del tiempo de sueño sobre la HbA1c, describiendo el deterioro de este parámetro en una curva tipo U, observándose una mayor HbA1c tanto en aquellos pacientes con sueño de mayor como los de menor duración (40) (Figura 5).
HBA1C media ajustados de acuerdo a edad y sexo en función de la duración del dormir en pacientes japoneses con diabetes tipo 2
* P, 0,05; ** P, 0,01 Modificado de (21).
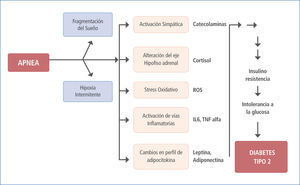
Entre los principales mecanismos de daño atribuidos a la DM2 se nombran la acumulación y acción de productos de glicación avanzada y moléculas asociadas al aumento del estrés oxidativo, ambos también aparecen como consecuencias del SAOS. Los productos de glicación avanzada y de stress oxidativo se encuentran aumentados en el SAOS en asociación directa a la severidad de la enfermedad, sin haber necesariamente presencia de DM2, pero la confluencia de ambas enfermedades muestra un incremento significativo de ellos que repercuten en el riesgo cardiovascular.
El stress oxidativo aumentado en el SAOS como consecuencia del fenómeno de hipoxia-reoxigenación y a partir de neutrófilos y monocitos se demuestra en el aumento en la producción de radicales libres las que se atenúa con la terapia con CPAP, (41, 42). Además la peroxidación de lípidos es mayor en pacientes con SAOS resultantes de la producción de especies reactivas de oxígeno (ROS) .23
Ambos fenómenos son ampliamente conocidos en el daño crónico atribuido a la DM2.
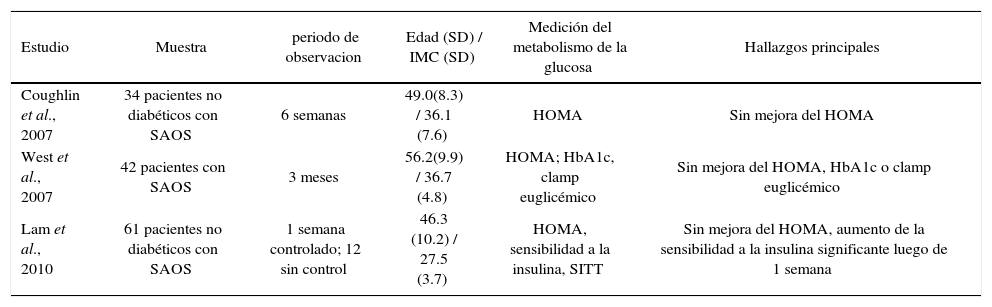
Tratamiento de saos y resultados en paciente en paciente diabeticoEl marco teórico tan claro y evidente que relaciona SAOS y DM2 no concuerda con los resultados del tratamiento del SAOS. La hipótesis planteada acerca la mejoría del SAOS con cualquier forma de tratamiento se asociaría a una mejoría de la sensibilidad a la insulina o mejorar el control de las glicemias ha encontrado resultados contradictorios; numerosas publicaciones no lo demuestran (Tablas 1 y 2). Los efectos de la presión respiratoria positiva continua (CPAP) han sido estudiados en múltiples protocolos obteniendo resultados discordantes entre ellos. (43) (Tabla 4).
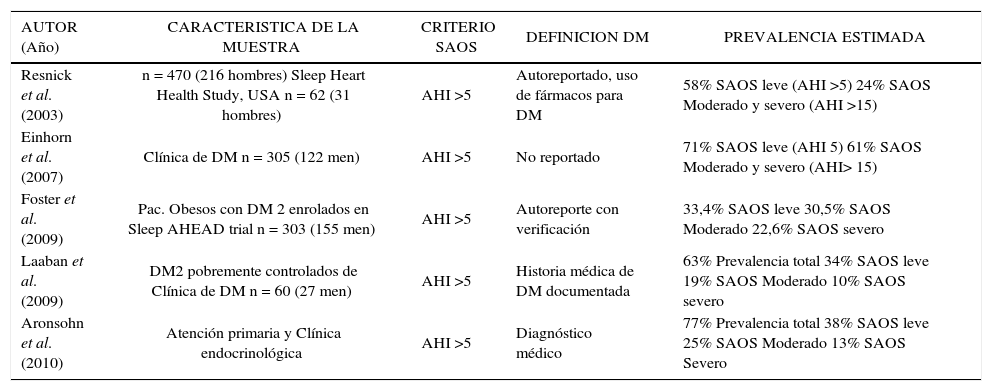
Estudios de prevalencia de SAOS en pacientes con DM2
| AUTOR (Año) | CARACTERISTICA DE LA MUESTRA | CRITERIO SAOS | DEFINICION DM | PREVALENCIA ESTIMADA |
|---|---|---|---|---|
| Resnick et al. (2003) | n = 470 (216 hombres) Sleep Heart Health Study, USA n = 62 (31 hombres) | AHI >5 | Autoreportado, uso de fármacos para DM | 58% SAOS leve (AHI >5) 24% SAOS Moderado y severo (AHI >15) |
| Einhorn et al. (2007) | Clínica de DM n = 305 (122 men) | AHI >5 | No reportado | 71% SAOS leve (AHI 5) 61% SAOS Moderado y severo (AHI> 15) |
| Foster et al. (2009) | Pac. Obesos con DM 2 enrolados en Sleep AHEAD trial n = 303 (155 men) | AHI >5 | Autoreporte con verificación | 33,4% SAOS leve 30,5% SAOS Moderado 22,6% SAOS severo |
| Laaban et al. (2009) | DM2 pobremente controlados de Clínica de DM n = 60 (27 men) | AHI >5 | Historia médica de DM documentada | 63% Prevalencia total 34% SAOS leve 19% SAOS Moderado 10% SAOS severo |
| Aronsohn et al. (2010) | Atención primaria y Clínica endocrinológica | AHI >5 | Diagnóstico médico | 77% Prevalencia total 38% SAOS leve 25% SAOS Moderado 13% SAOS Severo |
Modificado de (31).
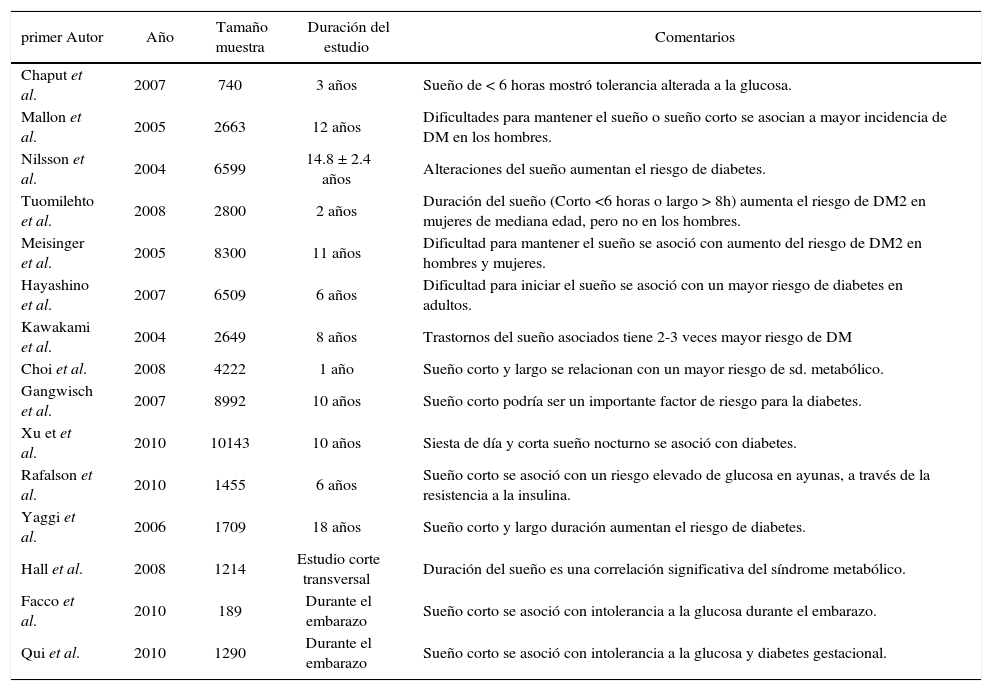
Trabajos epidemiológicos de deprivación de sueño y DM
| primer Autor | Año | Tamaño muestra | Duración del estudio | Comentarios |
|---|---|---|---|---|
| Chaput et al. | 2007 | 740 | 3 años | Sueño de < 6 horas mostró tolerancia alterada a la glucosa. |
| Mallon et al. | 2005 | 2663 | 12 años | Dificultades para mantener el sueño o sueño corto se asocian a mayor incidencia de DM en los hombres. |
| Nilsson et al. | 2004 | 6599 | 14.8 ± 2.4 años | Alteraciones del sueño aumentan el riesgo de diabetes. |
| Tuomilehto et al. | 2008 | 2800 | 2 años | Duración del sueño (Corto <6 horas o largo > 8h) aumenta el riesgo de DM2 en mujeres de mediana edad, pero no en los hombres. |
| Meisinger et al. | 2005 | 8300 | 11 años | Dificultad para mantener el sueño se asoció con aumento del riesgo de DM2 en hombres y mujeres. |
| Hayashino et al. | 2007 | 6509 | 6 años | Dificultad para iniciar el sueño se asoció con un mayor riesgo de diabetes en adultos. |
| Kawakami et al. | 2004 | 2649 | 8 años | Trastornos del sueño asociados tiene 2-3 veces mayor riesgo de DM |
| Choi et al. | 2008 | 4222 | 1 año | Sueño corto y largo se relacionan con un mayor riesgo de sd. metabólico. |
| Gangwisch et al. | 2007 | 8992 | 10 años | Sueño corto podría ser un importante factor de riesgo para la diabetes. |
| Xu et et al. | 2010 | 10143 | 10 años | Siesta de día y corta sueño nocturno se asoció con diabetes. |
| Rafalson et al. | 2010 | 1455 | 6 años | Sueño corto se asoció con un riesgo elevado de glucosa en ayunas, a través de la resistencia a la insulina. |
| Yaggi et al. | 2006 | 1709 | 18 años | Sueño corto y largo duración aumentan el riesgo de diabetes. |
| Hall et al. | 2008 | 1214 | Estudio corte transversal | Duración del sueño es una correlación significativa del síndrome metabólico. |
| Facco et al. | 2010 | 189 | Durante el embarazo | Sueño corto se asoció con intolerancia a la glucosa durante el embarazo. |
| Qui et al. | 2010 | 1290 | Durante el embarazo | Sueño corto se asoció con intolerancia a la glucosa y diabetes gestacional. |
Modificado de (30).
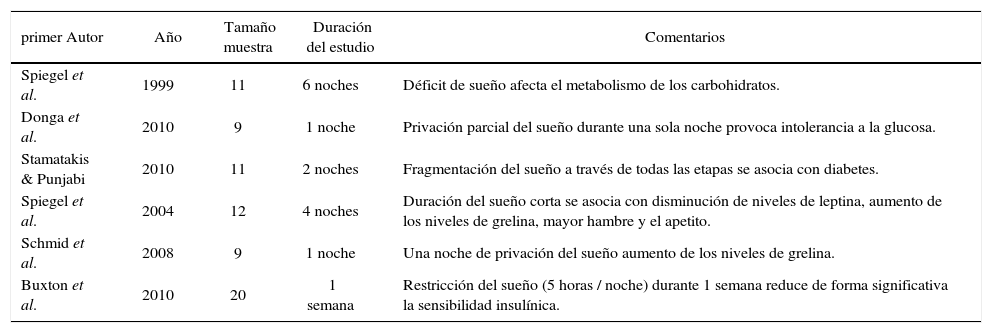
Trabajos experimentales de deprivación de sueño y DM
| primer Autor | Año | Tamaño muestra | Duración del estudio | Comentarios |
|---|---|---|---|---|
| Spiegel et al. | 1999 | 11 | 6 noches | Déficit de sueño afecta el metabolismo de los carbohidratos. |
| Donga et al. | 2010 | 9 | 1 noche | Privación parcial del sueño durante una sola noche provoca intolerancia a la glucosa. |
| Stamatakis & Punjabi | 2010 | 11 | 2 noches | Fragmentación del sueño a través de todas las etapas se asocia con diabetes. |
| Spiegel et al. | 2004 | 12 | 4 noches | Duración del sueño corta se asocia con disminución de niveles de leptina, aumento de los niveles de grelina, mayor hambre y el apetito. |
| Schmid et al. | 2008 | 9 | 1 noche | Una noche de privación del sueño aumento de los niveles de grelina. |
| Buxton et al. | 2010 | 20 | 1 semana | Restricción del sueño (5 horas / noche) durante 1 semana reduce de forma significativa la sensibilidad insulínica. |
Modificado de (10).
Efectos de cpap sobre el metabolismo de la glucosa en ensayos controlados
| Estudio | Muestra | periodo de observacion | Edad (SD) / IMC (SD) | Medición del metabolismo de la glucosa | Hallazgos principales |
|---|---|---|---|---|---|
| Coughlin et al., 2007 | 34 pacientes no diabéticos con SAOS | 6 semanas | 49.0(8.3) / 36.1 (7.6) | HOMA | Sin mejora del HOMA |
| West et al., 2007 | 42 pacientes con SAOS | 3 meses | 56.2(9.9) / 36.7 (4.8) | HOMA; HbA1c, clamp euglicémico | Sin mejora del HOMA, HbA1c o clamp euglicémico |
| Lam et al., 2010 | 61 pacientes no diabéticos con SAOS | 1 semana controlado; 12 sin control | 46.3 (10.2) / 27.5 (3.7) | HOMA, sensibilidad a la insulina, SITT | Sin mejora del HOMA, aumento de la sensibilidad a la insulina significante luego de 1 semana |
Nota: Valores son promedio (SD); IMC, indice de masa corporal (kg/m2); HOMA, modelo de homeostasis evaluatorio traido desde la glucosa en ayuna e insulina para caracterizar la insulino resistencia; HbA1c, hemoglobina glicosilada; SAOS, sindrome de apnea obstructiva del sueño; RCT, grupos randomizados controlados; SITT, test de tolerancia a la insulina corto. (Adaptado de Ref 3)
Llama a reflexión los hallazgos de trabajos de largos periodos que demuestran una significativa disminución del tono simpático a través del uso de CPAP en periodos tardíos, no habiendo respuesta significativa a tratamientos de corto plazo. Se entiende la necesidad de información con requisitos metodológicos adecuados que no ameritan críticas por ese motivo. Por ahora el CPAP sigue siendo el gold estándar de tratamiento de SOAS y debería ser usado como tal para mejorar la enfermedad y esperar evaluaciones de los resultados y utilidad para el deterioro metabólico asociado.
SíntesisAun cuando la asociación SAOS - DM parece tener clara evidencia epidemiológica y experimental, existen cuestionamiento en trabajos de terapéutica que no llegan a los resultados esperados según el marco teórico actual. Estos ponen en duda estas relaciones de mutua influencia y asociación, sin llegar a precisar otras teorías. Con las actuales facilidades y mayor alcance de la terapia con CPAP y la mayor posibilidad de medición de parámetros metabólicos, se espera que se puedan realizar estudios de mayor número de participantes con metodología adecuada para sacar conclusiones finales.
El autor declara no tener conflictos de interés, con relación a este artículo.