El pseudoaneurisma intrarrenal posterior a la nefrolitotomía percutánea (NLP) es una entidad clínica rara, que está presente en menos del 1% de los casos. Se realiza la revisión sistemática de la literatura disponible y la descripción de un caso con pseudoaneurisma intrarrenal secundario a NLP.
Materiales y métodosPresentamos un paciente de 26 años de edad, llevado a NLP izquierda. Después del procedimiento, presenta cuadro clínico de hematuria persistente, anemia e inestabilidad hemodinámica. Por angiografía con tomografía axial computarizada se documenta pseudoaneurisma intrarrenal, por lo que es tratado por radiología intervencionista con embolización selectiva de Histoacryl® al 15%.
ConclusionesEl abordaje endovascular se puede considerar hoy por hoy como el estándar de manejo de las complicaciones vasculares de la NLP, con unas altas tasas de éxito y ventajas para el paciente como baja morbilidad y mayor preservación de función renal.
© 2012 Sociedad Colombiana de Urología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
The intrarenal pseudoaneurysm after percutaneous nephrolithotomy is a rare clinical entity, and is present in less than 1% of cases. A review is made of the available literature, as well as a case report of a patient with intrarenal pseudoaneurysm after percutaneous nephrolithotomy.
Materials and MethodsThe case of 26 year-old patient is presented, on whom a left percutaneous nephrolithotomy was performed. The patient had hematuria, anemia, and hemodynamic instability. And therefore an Intrarenal Pseudoaneurysm was detected by CT angiography. The patient was treated with selective Histoacryl® 15% endovascular embolization.
ConclusionsThe endovascular approach can currently be considered as the standard management of vascular complications of percutaneous nephrolithotomy, with high success rates and advantages for the patient, such as low morbidity, and preservation of renal function.
© 2012 Sociedad Colombiana de Urología. Published by Elsevier España, S.L. All rights reserved.
La nefrolitotomía percutánea (NLP) es considerada el estándar en el manejo de la enfermedad litiásica renal de gran tamaño, presentando incidencias variables de complicaciones pulmonares, renales, y las lesiones vasculares que son las más complejas. Estas últimas con una incidencia en la literatura entre 0,2 al 2,6%1,2. Dentro de las complicaciones vasculares se encuentra la formación de un pseudoaneurisma, el cual se debe a una debilidad adquirida de la pared arterial con la formación de un saco, que de manera eventual puede erosionarse hacia el sistema colector, produciendo hematuria macroscópica. El tratamiento de esta complicación es endovascular, con unas excelentes tasas de éxito.
Presentamos el reporte de un caso y la revisión de la literatura disponible sobre la NLP y su asociación con los pseudoaneurismas.
Materiales y métodosSe realizó una búsqueda de la literatura médica usando los metabuscadores: Pubmed, MD Consult y Ovid; con los siguientes términos MESH: pseudoaneurisma renal, pseudoaneurisma intrarrenal, NLP, complicaciones.
Reporte de casoPaciente masculino de 26 de edad, con historia clínica de litiasis urinaria y episodios de cólico renal, que es llevado a NLP izquierda por cálculo de 20 mm en cáliz inferior. Bajo anestesia general, en posición decúbito prono, se realiza procedimiento con uso de nefroscopio rígido de 26 Fr sin complicaciones intraoperatorias con valores de hemoglobina preoperatoria de 11,8 g/dl y posoperatoria de 11,7 g/dl.
En el segundo día posoperatorio, el paciente presenta un episodio de hematuria macroscópica, manejado con reposo en cama y cierre del catéter de nefrostomía percutánea.
Al quinto día presenta nuevamente hematuria macroscópica asociada a retención urinaria, por lo que requiere paso de sonda vesical. Paraclínicos: hemoglobina en 9,9 g/dl, plaquetas y tiempos de coagulación dentro de los límites normales. Se deja en reposo absoluto durante 3 días, con mejoría de la hematuria y estabilidad hemodinámica, determinando al octavo día retirar la sonda vesical y el catéter de nefrostomía, con posterior alta medica. El paciente reingresa al día siguiente por dolor severo en flanco izquierdo y hematuria macroscópica, hemoglobina en 7,1 g/dl, asociada a repercusión hemodinámica dada por taquicardia y ortostatismo. Se decide transfundir 3 unidades de glóbulos rojos empaquetados, y se solicita arteriografía convencional en búsqueda de una complicación vascular y con intención de embolización según los hallazgos. Se realiza la arteriografía, la cual fue negativa para lesiones o complicaciones vasculares.
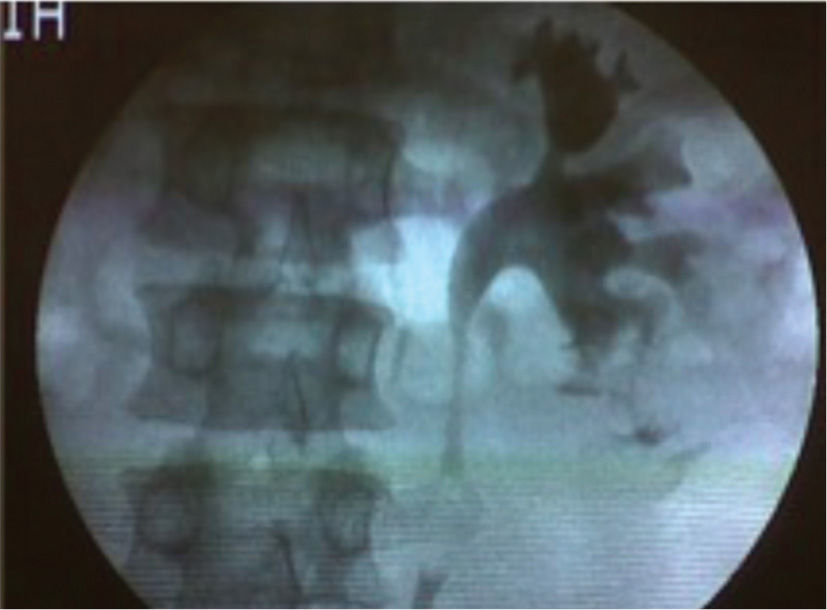
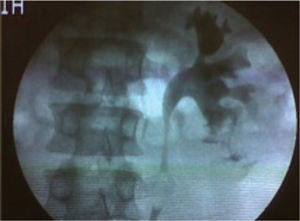
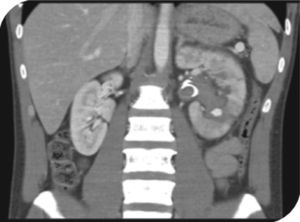
Se hospitaliza al paciente con indicaciones de reposo absoluto y monitorización. Al décimo día persiste con hematuria macroscópica, por lo que se lleva a uretrocistos-copia con hallazgo de gran coágulo intravesical, y meatos ureterales sin sangrado activo, se realiza pielografía retrógrada izquierda con evidencia de pequeña extravasación del medio de contraste por el cáliz inferior (fig. 1), y se realiza colocación de catéter en doble J (6 Fr × 24 cm). Al día siguiente, el paciente evoluciona de forma satisfactoria con mejoría de la sintomatología y diuresis espontánea con orina clara, por lo que nuevamente es dado de alta.
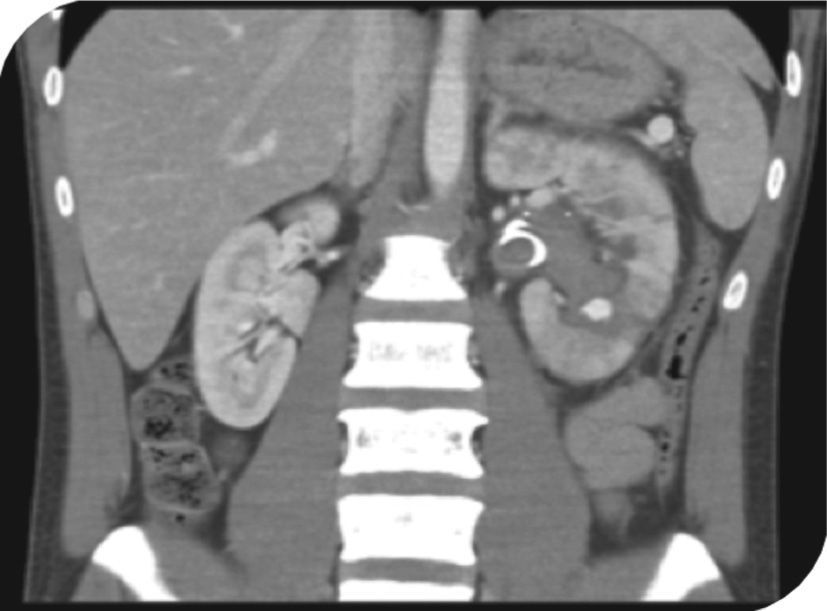
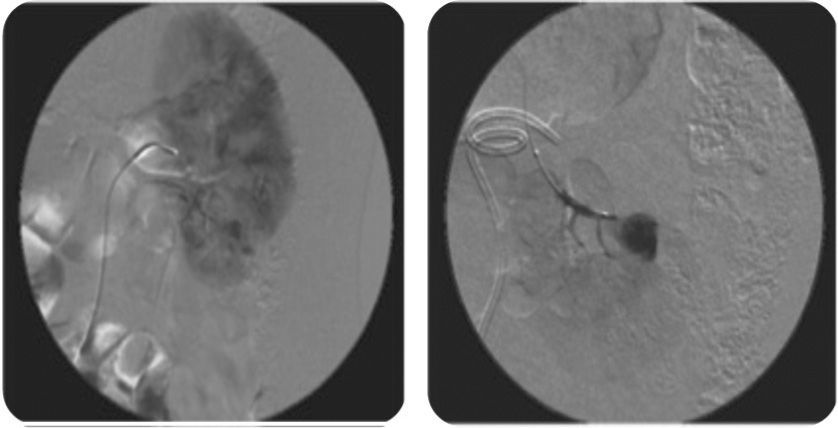
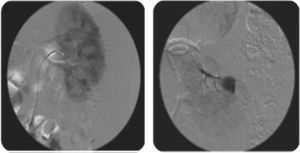
Al decimosexto día del posoperatorio, el paciente reingresa por dolor lumbar izquierdo, hematuria macroscópica, y retención urinaria. Se pasa sonda vesical, se realiza lavado vesical y se inicia cistoirrigación. Niveles de hemoglobina en 10,8 g/dl, ecografía renal y de vías urinarias que muestra catéter de en doble J en adecuada posición y coágulos intravesicales. Doce horas después, persiste hematuria e inestabilidad hemodinámica, se toman nuevos laboratorios encontrando niveles de hemoglobina en 6,9 g/dl. Se transfunden nuevamente 3 unidades de glóbulos rojos empaquetados, y se solicita angiografía por tomografía. Esta última muestra un pseudoaneurisma intrarrenal dependiente de la rama polar inferior izquierda (fig. 2). Se realiza una segunda arteriografía donde se confirma el diagnóstico y se procede a la embolización del pseudoaneurisma con Histoacryl® al 15% (fig. 3).
El paciente evoluciona de forma satisfactoria, con resolución de la hematuria y el dolor lumbar, se da de alta al segundo día de la embolización.
DiscusiónLa nefrolitotomía percutánea se describió por primera vez en la década de los cincuenta1, refinada como técnica quirúrgica veinte años después2.
Las indicaciones según las guías de practica clínica son: cálculos > 2 cm o 1,5 cm en cálices inferiores, cálculos refractarios al manejo con litotripsia extracorpórea o ureteroscopia, obesidad y malformaciones con probabilidad reducida de paso de los fragmentos tras litotripsia extracorpórea, como riñón en herradura o divertículos caliciales2,3.
La utilización de esta técnica quirúrgica ha aumentado de forma exponencial con el paso de los años, debido a un mayor entrenamiento y disponibilidad en centros de referencia4.
A través de múltiples series de casos se han logrado establecer las tasas de complicaciones de la NLP y los factores de riesgo relacionados con cada una de ellas2. Desde el inicio del uso de la NLP fue de especial importancia esclarecer si la generación de un tracto transparenquimal renal y la dilatación de este generaba daño renal; sin embargo, se ha logrado comprobar que no se altera en mayor medida la función renal5.
Las complicaciones mayores ocurren en el 1,1-7%, mientras que las complicaciones menores pueden ocurrir hasta en un 11-25%. El sangrado es la más significativa y temida, asociándose con transfusiones hasta en un 10-23%6–17, pudiendo llegar a comprometer la vida de los pacientes.
Las complicaciones renales se presentan en el 16,2%, incluyéndose en este grupo los hematomas perinéfricos, las perforaciones del sistema colector, los hematomas subcapsulares, urinomas y, en el ámbito vascular, las lesiones vasculares directas, los pseudoaneurismas, las fístulas arteriovenosas (AV) y las alteraciones vasculares mixtas (pseudoaneurisma y fístula AV)7–10.
Las complicaciones renales vasculares son raras, pero de gran importancia, ya que pueden comprometer la vida del paciente en caso de no identificarse y tratarse con celeridad. Uno de los primeros estudios retrospectivos publicados en la literatura, donde intentaron determinar la incidencia y el manejo del sangrado pos-NLP fue realizado por Kessaris et al. (1995)8, el cual reunió casos desde 1983 hasta 1992, con 2.200 procedimientos percutáneos, de los cuales 17 pacientes presentaron sangrado de difícil control. Estos fueron llevados a angiografía, encontrando una incidencia de pseudoaneurismas del 0,18%, sin lograr identificar con significancia estadística los factores de riesgo asociados, planteándose como relevantes la diabetes, la hipertensión y el déficit de factor VIII.
Un segundo estudio que pretendió identificar los factores predictivos de las complicaciones vasculares fue realizado por Aneesh S. et al.9, en la India, quienes analizaron datos de 1.854 pacientes, de los cuales 27 (1,4%) requirieron angiografía para el control del sangrado. De estos pacientes, 13 (0,7%) tenían un pseudoaneurisma como causa de la hemorragia, 6 tenían una fístula AV, 4 una lesión mixta, 1 una lesión vascular directa de arteria lumbar, y 3 pacientes no presentaban lesiones en la angiografia9. En el análisis multivariable encontraron como único factor predictivo de sangrado posoperatorio el tamaño del calculo (p = 0,041), de 4,1 ± 1,1cm.
Manish S. et al., en la India, en un análisis retrospectivo concluyó que la realización de múltiples tractos para la remoción de cálculos coraliformes es segura. Sin embargo, llama la atención que la incidencia de pseudoaneurismas es mayor en su serie comparada con otras, siendo esta del 2,68%; además, el 30% de sus pacientes requirió transfusión de algún numero de unidades de sangre11, por lo cual podríamos considerar que el numero de tractos realizados es un factor predictivo para complicaciones vasculares renales, no obstante, se requieren más estudios.
La tasa de transfusión posoperatoria se ha propuesto como una de las complicaciones más importantes de la NLP12. En el intraoperatorio es esperable algo de sangrado debido a que el parénquima renal es ricamente vascularizado. Cuando el sangrado es abundante, en ocasiones requiere la suspensión del procedimiento debido a la disminución de la visibilidad y el cierre de la nefrostomía, lo que ayudará a la coagulación de los puntos sangrantes. Si esta medida no funciona, se debe llevar al paciente a una arteriografía para descartar lesiones vasculares6. El riesgo de sangrado no varía con la técnica quirúrgica, ya sea un abordaje subcostal o intercostal18.
Otro tipo de sangrado importante es el posoperatorio, el cual aparece entre el cuarto y el octavo día, después de haberse evidenciado orina clara. Este tipo de sangrado sugiere con mayor probabilidad complicaciones vasculares como fístulas AV y pseudoaneurismas8.
Típicamente, casi tres cuartos de las fístulas AV se consideran adquiridas13. Se definen como una comunicación anormal entre un vaso venoso y uno arterial; en la mayoría de los casos, este vaso arterial presenta una dilatación aneu rismática. La causa más común de fístulas AV iatrogénicas son las biopsias renales, seguidas de otros procedimientos quirúrgicos renales, como la nefrostomía, la heminefrectomía y la nefrolitotomía14. Este tipo de lesiones generan un aumento en el retorno venoso, además de un aumento en el gasto cardíaco, por lo cual se pueden asociar a sintomatología cardíaca a largo plazo15. En varios casos, las fistulas AV secundarias a NLP se asocian a pseudoaneurismas16. En un estudio retrospectivo de 2007, realizado por Ahmed R., en Egipto, se encontró una incidencia del 0,27% de lesiones mixtas, siendo más comunes las fistulas AV puras y los pseudoaneurismas intrarrenales.
Los pseudoaneurismas constituyen una anomalía vascular común en la que hay una disrupción de la continuidad de la pared arterial19. Estas disrupciones pueden ser secundarias a varios procesos, como inflamación, trauma o posterior a procedimientos20. Clínicamente, se describe como un saco vascular perfundido, transversal a la pared arterial que tiene una comunicación permanente con la luz; este saco se encuentra contenido por la túnica media o adventicia, o en algunos casos, simplemente por tejido blando contiguo a la lesión. La mayor parte de los pseudoaneurismas son adquiridos, y tienen una forma sacular21. Este tipo de lesiones pueden ocurrir virtualmente en la totalidad de la vasculatura, sin embargo, una de las localizaciones más comunes es en el riñón, donde la mayor parte son secundarios a trauma renal (penetrante y/o no penetrante), y un moderado porcentaje secundario a lesiones posoperatorias, ya sean técnicas abiertas o percutáneas19. Estas lesiones pueden generarse tanto en las porciones intra como extraparenquimatosas de la arteria renal.
La fisiopatología de los pseudoaneurismas ha sido descrita ; sea este quirúrgico o no, y bajo la influencia de una presión arterial elevada sostenida, como es la presión del sistema arterial, la sangre se extravasa y se diseca a través de la pared vascular a los tejidos adyacentes22. Específicamente, en los pseudoaneurismas intrarrenales, el mecanismo de trauma penetrante del procedimiento percutáneo produce una lesión en el parénquima renal, al realizar el tracto, y a su vez en la pared arterial de un vaso, lo que implica inflamación y, por lo tanto, un segmento vascular debilitado. Es este segmento vascular el que por influencia de presiones arteriales elevadas puede permitir la recanalización entre el espacio intravascular y el espacio extravascular produciendo así un hematoma encapsulado y pulsátil (pseudoaneurisma)23. Eventualmente, esta lesión puede crecer y tornarse inestable, erosionando el tejido perinéfrico o el sistema pielocalicial. En este último caso, se produce una pérdida sanguínea continua hacia el sistema colector, presentándose en el paciente como hematuria.
De acuerdo con la literatura médica actual, la incidencia reportada de pseudoaneurismas intrarrenales secundarios a NLP es baja y se encuentra entre el 0,6-1%9–16. En esta revisión, nos encontramos con un pequeño número de reportes de caso23–29 y 3 estudios retrospectivos importantes11-16-18. En estos, la edad promedio de presentación es de 54 años. Entre los factores de riesgo más importantes para el desarrollo de esta complicación se encuentran el tamaño del cálculo9, la experiencia quirúrgica16, la anatomía vascular26, la ateros-clerosis y los factores de riesgo cardiovascular (por ejemplo: diabetes mellitus e hipertensión arterial)8, así como la presencia de cálculos complejos11, y el uso del nefroscopio rígido30. Actualmente, ninguno de estos factores de riesgo tiene significancia estadística, sin embargo, se considera que la experiencia quirúrgica y los trastornos de coagulación son los factores más importantes.
En cuanto a la clínica del paciente, puede ser silente, específicamente en los enfermos con trauma, o sintomática, siendo la presentación más común. Puede presentarse sintomatología sistémica o local. La sintomatología sistémica es, por lo general, secundaria al proceso anémico de rápida instauración que genera hipotensión, taquicardia y shock hipovolémico9. La sintomatología local incluye: hematuria, obstrucción del tracto urinario, disuria, y/o dolor en flancos o región lumbar. La hematuria secundaria a complicaciones vasculares como pseudoaneurismas o fístulas AV suele ser tardía. Es decir, no forma parte del posoperatorio inmediato. Estos son pacientes que generalmente desarrollan sangrados posteriores a ser dados de alta. La hematuria se instaura en las primeras 4 semanas posteriores al procedimiento31. En las series de casos revisadas, la hematuria inicia en promedio 6,4 días posteriores a la cirugía16. Existe una teoría en la cual la lesión tarda aproximadamente unos 5 días en instaurarse, y posterior a esto, si el paciente continúa en reposo, este pseudoaneurisma puede trombosarse parcialmente y controlar con esto el sangrado, pero tan pronto se reinicie la actividad física reaparecerá a su vez la hematuria27. Es por esta razón que los tiempos de aparición de este síntoma pueden variar. Por lo general, la hematuria secundaria a pseudoaneurismas intrarrenales se considera como una hematuria severa, describiéndose así por su asociación con sintomatología sistémica y en la mayoría de las ocasiones a obstrucción del tracto urinario, requiriendo altas tasas de transfusión9. Algunos pacientes pueden presentar dolor abdominal en flancos; si la etiología del pseudoaneurisma es por trauma cerrado de abdomen, este puede ser un síntoma cardinal para el diagnóstico. Es de gran importancia que el médico tratante enfoque siempre la hematuria severa posoperatoria tardía como una complicación quirúrgica vascular, ya que esta puede poner en riesgo la vida del paciente si no es sospechada.
Imágenes diagnósticasExisten varios exámenes radiológicos disponibles para corroborar esta patología, cada unos con ventajas y desventajas frente al otro. Múltiples reportes han descrito el uso de la ultrasonografía, la tomografía, la resonancia nuclear magnética y la angiografía convencional.
UltrasonografíaEn escala de grises es posible caracterizar la localización, tamaño y forma de las lesiones pseudoaneurismáticas, visualizándose como estructuras hipoecoicas quísticas contiguas a los vasos sanguíneos22. Sin embargo, la escala de grises no es diagnóstica por sí sola y debe ir siempre acompañada de US Doppler19. Con el Doppler se confirma la etiología vascular de las lesiones demostrándose flujo arterial turbulento en el saco, descrito como el “signo del yin-yang” (flujo en 2 direcciones diferentes). Este signo también puede estar presente en aneurismas saculares, por lo cual no es patognomónico19. En general, se describe una sensibilidad del 94% y una especificidad del 97% en el diagnóstico de pseudoaneurismas poscateterizacion32, sin embargo, en el diagnóstico de pseudoaneurismas de arterias profundas viscerales la sensibilidad es limitada33. No hay estudios de estos valores en pseudoaneurismas intrarrenales secundarios a NLP. Adicionalmente, debemos recordar que la ultrasonografía es operador dependiente, lo que constituye un limitador.
Tomografía con contrasteLa caracterización e identificación de pseudoaneurismas en tomografía axial computarizada simple puede ser difícil. Pero con el advenimiento de la angiografía por tomografía con reconstrucciones multiplanares en 3D, este se ha convertido en un método muy útil en el estudio y diagnóstico de las lesiones vasculares renales34. Sus ventajas sobre las otras técnicas imagenológicas son: no es operador dependiente, tiene tiempos cortos de adquisición de imágenes y además de suministrar información vascular aporta información de otras posibles lesiones asociadas y evalúa de manera más sensible la tasa de cálculos residuales35. Las reconstrucciones tridimensionales permiten la visualización de la lesión desde todos los ángulos, lo que no es posible con la angiografía. Además de esto, la tomografía aporta información acerca de la totalidad de la vasculatura (arterial y venosa), mientras que la angiografía está limitada al territorio contrastado19. La sensibilidad y la especificidad de la tomografía en el diagnóstico de pseudoaneurismas de las extremidades es de 95,1 y 98,7%, respectivamente36.
Resonancia nuclear magnéticaEs un método de estudio útil en la patología vascular renal. La angiografía tridimensional por resonancia con gadolinio delinea cuidadosamente la anatomía vascular permitiendo hacer la planeación preintervencional22. El medio de contraste no ionizado tiene mucha menor nefrotoxicidad, y no existe ninguna radiación con este método37. Existen secuencias específicas para la visualización de trombos intraluminares y el tamaño del pseudoaneurisma38. La resonancia magnética es una imagen de lenta adquisición por lo que no está indicada en pacientes que requieren un diagnóstico urgente; el monitoreo de signos vitales durante el examen es difícil, por lo que su uso es limitado en pacientes hemodinámicamente inestables39.
Angiografía convencionalSigue siendo el estándar de referencia en el diagnóstico de los pseudoaneurismas a pesar de los nuevos advenimientos tecnológicos como la angiografía por resonancia nuclear magnética y por tomografía computarizada19. La angiografía convencional tiene la capacidad de caracterizar claramente los pseudoaneurismas, incluyendo su tamaño, su artería donante, las variaciones anatómicas asociadas, y el tamaño del cuello; adicional a esto, proporciona una herramienta diagnóstica con potencial terapéutico asociado, en caso de ser necesario. Su principal limitador es su naturaleza invasiva y los riesgos que esta conlleva. El riesgo de desarrollar pseudoaneurismas en el sitio de punción en los procedimientos diagnósticos es del 1%, sin embargo, este se eleva hasta casi el 7,7% en procedimientos terapéuticos40. La incidencia acumulada de una complicación vascular mayor es entre el 0,02 y el 9%. Entre este grupo se incluyen los pseudoaneurismas, los hematomas, las fístulas AV, la embolización distal, el espasmo arterial, la isquemia, la disección de la íntima y la trombosis venosa19.
TratamientoEn la literatura se han descrito 2 tipos de tratamiento para los pseudoaneurismas intrarrenales. El primero y menos popular es el tratamiento conservador. Este se basa en la trombosis del pseudoaneurisma lograda a través del reposo, del cierre del tubo de nefrostomía, la hidratación, el uso de diuréticos y de medicamentos hemostáticos, o el taponamiento con balón de Kaye41. Un reporte de caso publicado por Basiri et al., en 2010, presenta el caso de un paciente con hemorragia severa por un pseudoaneurisma intrarrenal secundario a NLP en quien se logro una resolución espontánea24, confirmando el diagnóstico inicial con una angiografía por tomografía, y 18 días después al ser llevado a angiografía convencional para embolización no había evidencia de tal pseudoaneurisma. Plantean entonces como mecanismo de resolución la trombosis espontánea y oclusión de la lesión, y sugieren que el manejo conservador debe ser tenido en cuenta en el manejo de algunos casos de hemorragias severas en el posoperatorio de nefrolitotomías percutáneas.
El segundo tipo de manejo para estas lesiones es el control del sangrado, ya sea por vía percutánea o abierta. En las últimas décadas, la mayor parte de este, se ha hecho por vía endovascular. Sin embargo, persisten algunas indicaciones puntuales para la realización de cirugía abierta.
Entre el 80 y el 90% de los casos descritos logran un control del sangrado por vía endovascular8. La técnicas percutáneas endovasculares son una alternativa efectiva, requieren una evaluación cuidadosa de las características angiográficas de las lesiones, así como de la arteria madre de las mismas, para así optar por el método más útil en cada caso. La embolización con coils es el tratamiento de elección para los pseudoaneurismas intrarrenales generados a partir de arterias pequeñas o medianas segmentarias, ya que la embolización de este tipo de calibres resulta en una pérdida mínima de parénquima renal22. Sin embargo, la embolización incompleta puede llevar a isquemia del parénquima renal, el cual puede continuar secretando renina, elevando la presión arterial sostenidamente.
Adicional al manejo con coils existen otras técnicas descritas en la literatura que cada vez con más frecuencia están siendo utilizadas en los pseudoaneurismas intrarrenales. La aplicación de etanol se usa para infartar completamente el territorio isquémico para así detener la secreción de renina. Agentes líquidos embólicos como las partículas de gelfoam29, etilen alcohol vinil copolimero (onyx), trombina, y el n-butil Cianoacrylato (Histoacryl®)25 han sido también descritos. Recientemente, se describió el uso de stents cubiertos en el manejo de pseudoaneurisma intrarrenal con éxito23,42. Sin embargo, el uso de este tipo de stents está reservado por lo general para arterias mayores, con diámetros intraluminales de mínimo 6 milímetros, ya que existe un riesgo elevado de trombosis. También existe riesgo de estenosis del stent. Para esto, se propone como alternativa el uso de stents medicados o de material autógeno23.
El tratamiento quirúrgico abierto está reservado para aquellos pacientes en centros donde no haya experiencia en el manejo endovascular, o que tengan una anatomía vascular desfavorable, con lesiones de arterias mayores en quienes el tratamiento endovascular podría comprometer la función renal, o en pacientes en quienes el manejo endovascular no logre el control del sangrado. Este manejo puede ser nefrectomias, heminefrectomías, o ligadura vascular14.
ConclusionesEl pseudoaneurisma intrarrenal posterior a NLP constituye una causa frecuente de hemorragia tardía. La hematuria es su principal síntoma y esta puede ser severa requiriendo diagnóstico oportuno y tratamiento activo.
Las complicaciones vasculares, aunque son poco frecuentes al ser omitidas, pueden desencadenar secuelas importantes en nuestros pacientes; por tanto es importante conocerlas para establecer un manejo adecuado.
El manejo endovascular del pseudoaneurisma se puede considerar hoy por hoy como el estándar de manejo, con unas altas tasas de éxito y ventajas claras para el paciente como baja morbilidad y mayor preservación de función renal.
Nivel de evidenciaIII.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.