Alrededor del 24% de los pacientes con carcinoma ductal in situ (CDIS) de la mama diagnosticados con aguja gruesa (BAG) tendrán un componente invasivo cuando la lesión es extirpada en su totalidad. Esta subestimación de infiltración es menor cuando la biopsia es realizada con sistema de corte-vacío (SCV). Hemos evaluado nuestra experiencia en el diagnóstico del CDIS con SCV y el resultado final en la biopsia del ganglio centinela (BGC) en estas pacientes.
MétodosEste estudio incluyó a pacientes de la base de datos de CECLINES en Caracas, Venezuela, desde 1998 hasta 2013. De las 841 BGC realizadas durante este período, 64 correspondieron a CDIS con SCV, bajo guía estereotáxica o ultrasonido. Se excluyó a aquellos pacientes con microinvasión (pT1mic), lesiones mixtas y aquellas lesiones diagnosticadas mediante BAG. La metodología de la toma de muestra durante el procedimiento percutáneo consistió en múltiples muestras de diferentes partes de la lesión. Las indicaciones para la BGC en CDIS fueron: tamaño de la lesión > 30mm (DCIS extenso) o en pacientes planificadas para mastectomía.
ResultadosLa tasa de identificación fue del 95,3% (61/64). La mediana del tamaño de la lesión fue 40mm (DE 19,6); el 67,1% (43/64) tuvo diagnóstico de CDIS extenso. En el 87,5% (56/64) el hallazgo fue mamográfico; el 92,1% (59/64) fueron lesiones no palpables. Se obtuvo una mediana de 16 (DE 10,4) muestras por cada lesión. Al 82,8% (53/64) de las pacientes se les realizó una mastectomía. La distribución del grado histológico fue: G1 15,6% (10/64), G2 60,9% (39/64) y G3 23,5% (15/64). Ningún paciente presentó BGC positiva. En aquellos pacientes a los cuales se les realizó una disección axilar, no se encontró ningún ganglio positivo. La subestimación del componente infiltrante en biopsia con SCV fue del 6,2% (4/64).
ConclusionesLa subestimación del componente infiltrante en el CDIS es muy baja cuando la biopsia se realiza con una SCV, obteniendo varias muestras en lesiones no palpables, cuyo hallazgo mamográfico son microcalcificaciones, independientemente de su tamaño o el grado histológico. Consideramos que la BGC puede omitirse en pacientes seleccionados con CDIS.
About 24% of patients with ductal carcinoma in situ (DCIS) diagnosed with a core biopsy will also be found to have an invasive component when the lesion is completely excised. This underestimation is reduced when the biopsy is undertaken with a vacuum-assisted device (VAD). We evaluated our experience in the diagnosis of DCIS with a VAD and the final result of the sentinel lymph node biopsy (SLNB) in these patients.
MethodsThis study included patients from the CECLINES database in Caracas (Venezuela) from 1998 to 2013. Out of 841 SLNB performed during that period, 64 corresponded to DCIS, diagnosed by a VAD under stereotactic or ultrasound guidance. Patients with microinvasion (pT1mic) or mixed lesions at the time of the pathological evaluation of the biopsy specimen, as well as those diagnosed by a core device, were excluded from this investigation. The methodology for the biopsy consisted of multiple samples from different parts of the lesion. The indications for SLNB in DCIS were: size >30mm (extensive DCIS) or a scheduled mastectomy.
ResultsThe detection rate was 95.3% (61/64). Median lesion size was 40mm (SD 19.6). A total of 67.1% (43/64) had a diagnosis of extensive DCIS. In 87.5% (56/64), the mammographic findings were microcalcifications. Most of the lesions (92.1% [59/64]) were non-palpable. A median of 16 (SD 10.4) samples per lesion were obtained. Mastectomy was performed in 82.8% (53/64) of the patients. The distribution of histological grade was: G1 in 15.6% (10/64), G2 in 60.9% (39/64) and G3 in 23.5% (15/64). None of the patients had a positive SLNB. No positive lymph nodes were found in any of the patients who underwent axillary dissection. The underestimation rate for biopsy with a VAD was 6.2% (4/64).
ConclusionsThe underestimation rate of DCIS was very low when the biopsy was performed with a VAD and when multiple samples were obtained in non-palpable lesions, regardless of the lesion size or the histological grade. We believe that SLNB can be omitted in selected patients with DCIS.
Debido al aumento en el número de mamografías de cribado y el desarrollo de mejor tecnología, la proporción en el diagnóstico de carcinoma ductal in situ (CDIS) de la mama ha aumentado en los últimos años de manera importante. Actualmente, el CDIS representa aproximadamente el 24% de los cánceres detectados por programas de cribado en los Estados Unidos y aproximadamente el 15% en España1. Alrededor del 24% de los pacientes con CDIS de la mama diagnosticados con aguja gruesa (BAG) tendrán un componente invasivo cuando la lesión es extirpada en su totalidad2,3. Esta subestimación de infiltración es menor cuando la biopsia es realizada con sistema de corte-vacío (SCV)4. Esta posibilidad de subestimación tiene repercusión en el adecuado abordaje quirúrgico de la paciente, ya que hay reportes de afectación ganglionar en CDIS que según algunas series podría estar alrededor del 4%5. Entre muchas variables a considerar en el CDIS, la supervivencia global a 10 años cercana al 100% de las pacientes afectadas y el factor teórico de la indemnidad de la membrana basal nos llevan obligatoriamente a cuestionar el manejo actual de esta entidad. Con respecto a la realización de la biopsia del ganglio centinela (BGC) en CDIS aún existe controversia6-8.
El objetivo de este trabajo es evaluar nuestra experiencia en el diagnóstico del CDIS con SCV y el resultado final en la BGC en estas pacientes.
Métodos y pacientesEste estudio incluyó a pacientes de la base de datos de CECLINES en Caracas, Venezuela, desde 1998 hasta 2013. De las 841 BGC realizadas durante este período, 64 correspondieron a CDIS diagnosticado por SCV, bajo guía estereotáxica o ultrasonido.
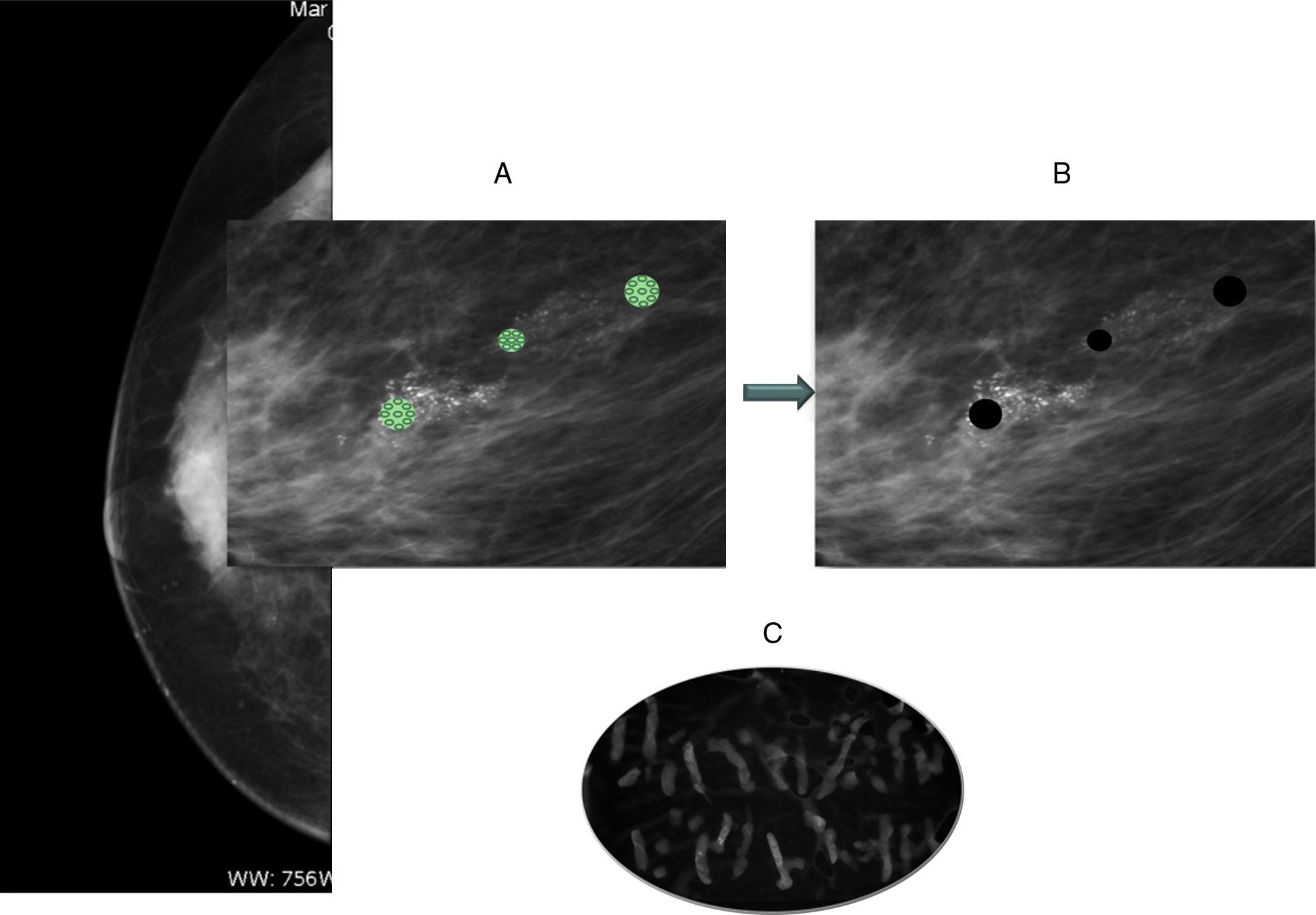
A todas las pacientes de nuestro centro con diagnóstico de patología maligna de la mama se les realiza una exhaustiva exploración tanto de la mama, como de la axila, por ecografía previo a la cirugía. La metodología de la toma de muestra durante el procedimiento percutáneo consistió en múltiples muestras de diferentes partes de la lesión y en lo posible tratando de eliminar la imagen que motivó la biopsia (fig. 1). El procedimiento fue realizado por un radiólogo dedicado a la patología mamaria, con aguja de calibre 8, 9 y 11 Gauge. Todas las cirugías fueron realizadas por el mismo equipo quirúrgico y la evaluación anatomopatológica de la biopsia y la pieza quirúrgica por al menos 2 patólogos de nuestro departamento de Patología Mamaria. Información clínica y patológica fue recogida de manera prospectiva. El grado histológico fue determinado como alto, intermedio y bajo de acuerdo con el Esquema Modificado de Patólogos Europeos9. El mapeo linfático fue realizado mediante la inyección de radiocoloide (partículas coloidales marcadas con Tc-[99m]) y azul patente. El radiocoloide fue inyectado 12-18 h previo a la BGC y el azul patente 20min antes. Nunca se realizó linfocintigrafía.
Se excluyó a aquellos pacientes con microinvasión (pT1mic), lesiones mixtas y aquellas lesiones diagnosticadas mediante BAG (fig. 2). Las indicaciones para la BGC en CDIS fueron: tamaño de la lesión >30mm (DCIS extenso) o en pacientes planificadas para mastectomía.
Fueron calculadas las medias y desviaciones estándar de las variables continuas; en el caso de las variables nominales, se calcularon sus frecuencias y porcentajes. Se comprobó la normalidad de las variables continuas mediante la prueba Shapiro-Wilks. Los contrastes de las variables continuas respecto al subdiagnóstico se basaron en la prueba t de Student para muestras independientes; en el caso de las variables nominales, también respecto al subdiagnóstico, se aplicó la prueba de la chi al cuadrado de Pearson. Se consideró un valor significativo de contraste si p<0,05. Los datos fueron analizados con JMP-SAS 11 (http://www.jmp.com/).
ResultadosLa media de edad de las pacientes fue 52 (± 9,31) años. Sesenta y cuatro casos con diagnóstico de CDIS, a las cuales les fue realizada una BGC, contaron con los criterios de inclusión para participar en nuestro trabajo. A todas estas pacientes se les realizó una ecografía mamaria que incluyó la exploración de la axila y que resultó normal. La tasa de identificación del ganglio centinela fue del 95,3% (61/64). Una de las pacientes en que el ganglio centinela no fue localizado tenía como antecedente 2 mamoplastias reductoras.
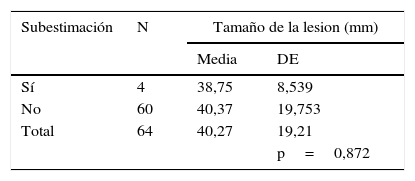
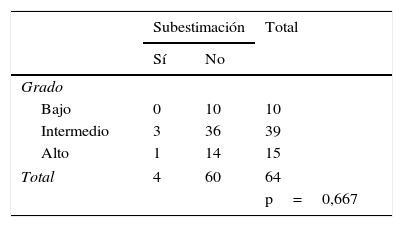
La media del tamaño de la lesión fue 40 (± 19,6) mm; el 67,1% (43/64) tuvo diagnóstico de CDIS extenso. En el 87,5% (56/64) el hallazgo fue microcalcificaciones, en el 3,1% (2/64) distorsión, en el 4,6% (3/64) masa y en el 4,6% (2/64) mixta. El 92,1% (59/64) fueron lesiones no palpables. Se obtuvo una media de 16 (DE 10,4) muestras por cada lesión. La subestimación del componente infiltrante en biopsia con SCV fue del 6,2% (4/64). Tres de estas pacientes fueron pT1mic y uno carcinoma ductal infiltrante (de 7mm). La distribución del grado histológico fue: bajo (G1, 15,6% [10/64]), intermedio (G2, 60,9% [39/64]) y alto (G3, 23,5% [15/64]). No hubo diferencias significativas entre el grado histológico o el tamaño de la lesión con la subestimación del componente infiltrante (p=0,667 y p=0,872, respectivamente) (tablas 1 y 2).
Relación entre el grado histológico9 y la subestimación del componente infiltrante
| Subestimación | Total | ||
|---|---|---|---|
| Sí | No | ||
| Grado | |||
| Bajo | 0 | 10 | 10 |
| Intermedio | 3 | 36 | 39 |
| Alto | 1 | 14 | 15 |
| Total | 4 | 60 | 64 |
| p=0,667 | |||
Ninguna paciente presentó BGC positiva. En aquellas pacientes a las cuales se realizó disección axilar (3/64) no se encontró ningún ganglio positivo en la evaluación anatomopatológica definitiva de los ganglios extirpados.
DiscusiónEl CDIS es por definición una lesión no invasiva, con un variable probabilidad de convertirse en una lesión infiltrante10. Existe amplia literatura sobre ello y su sobretratamiento10,11. Entre muchas variables a considerar en CDIS, la sobrevida global a 10 años cercano al 100% de las pacientes afectadas y el factor teórico de la indemnidad de la membrana basal nos llevan obligatoriamente a cuestionar el manejo actual de esta entidad. Con respecto a la BGC en CDIS, aún existe el debate si debe realizarse siempre, nunca o en algunos casos en particular6-8,12.
La tasa de identificación del ganglio centinela del 95,3% es aceptable y en concordancia con experiencias previas13. Hay varios trabajos que desarrollan de manera extensa las controversias actuales sobre el manejo de la axila en pacientes con diagnóstico de CDIS2,3,14-16. Estas controversias van desde el momento del diagnóstico mediante procedimientos percutáneos (relacionado a la probabilidad de subestimación de infiltración), pasando por la estadificación de la axila (la indicación de la BGC) hasta llegar al tratamiento quirúrgico final de la mama, donde tenemos la cirugía conservadora versus la mastectomía para una entidad que no debería ser tan agresiva como un carcinoma ductal infiltrante. Hay publicaciones que indican una tasa de subestimación global que va desde el 16% hasta el 20%, con variaciones del 11-13% en CDIS de bajo grado y del 36-45% en CDIS de alto grado2,4,6,17. Esta variabilidad de subestimación del componente infiltrante es debida no solo al grado de la lesión, sino que también desempeña un papel importante el hallazgo mamográfico, el tamaño de la lesión y el dispositivo utilizado para la obtención de las muestras18. Un factor poco discutido, y a nuestro parecer fundamental, es también para estos efectos la correlación entre la sospecha por técnicas de imagen y el resultado anatomopatológico.
Suh et al. encontraron una diferencia significativa de subestimación dependiendo de la utilización de BAG y SCV (47,8% para BAG y 16,1% para SCV [p<0,001])17. En nuestro estudio obtuvimos una excelente tasa de subestimación global del 6,2% utilizando una SCV, por tanto consideramos que la metodología de la toma de la biopsia es crucial para un óptimo resultado. Jackman et al. publicaron una tasa subestimación del 11% con SCV al obtener una mediana de 13 muestras por lesión en un estudio que involucró 16 instituciones hospitalarias19. Nosotros obtuvimos una media de 16 (DE 10,4) muestras por lesión. Al obtener más muestras por lesión, es obvio entender que los patólogos pueden tener un panorama más preciso de la lesión, inclusive al utilizar una aguja percutánea con un menor Gauge, la muestra ofrece más información arquitectural.
En un estudio en el MD Anderson Cancer Center identificaron varios factores de riesgo independientes para encontrar un carcinoma infiltrante en lesiones de pacientes con diagnóstico de CDIS diagnosticado con una biopsia por BAG, a los cuales se les realizó una BGC3. Estos factores incluyeron: edad<55 años, diagnóstico por BAG, tamaño mamográfico de la lesión de al menos 4cm y DCIS de alto grado. Debido a resultados, como estos hay una amplia variedad de indicaciones entre varios grupos para la realización de una BGC en CDIS. Más recientemente, la Sociedad Americana de Oncología Clínica publicó una actualización de sus Guías para la realización de la BGC en pacientes con diagnóstico de cáncer de mama temprano, en el caso de CDIS: cuando deba realizarse una mastectomía, cuando la lesión es una masa clínica o pruebas de imagen indicativa de carcinoma infiltrante o un área de CDIS>5cm8. En nuestro estudio todos los pacientes fueron diagnosticados con SCV (8,9 por 11 G), en el 87,5% la representación mamográfica fueron microcalcificaciones, la mediana del tamaño de la lesión fue 40mm (DE 19,6), el 92,1% fueron lesiones no palpables y el 60,9% fueron grado intermedio.
La tasa de positividad del ganglio centinela en pacientes con CDIS puro es modesta (2-13%)2,20. Por esta razón, algunos autores han acotado que ante la presencia de un componente infiltrante en la evaluación anatomopatológica definitiva de la pieza quirúrgica de una segmentectomía se puede entonces ofrecer una BGC como un procedimiento para la estadificación posterior3,18. Este abordaje también puede ser realizado posterior a una mastectomía, como lo demostró un estudio del Instituto Europeo de Oncología con una tasa de identificación del 100% en 4 pacientes con una mastectomía previa, en los cuales se realizó una inyección subdérmica de partículas coloidales marcadas con Tc-(99m)21. En una revisión de la literatura por Farante et al. en pacientes con diagnóstico de CDIS en los que se realizó disección axilar por BGC positiva; en el 98,5% de los casos el único ganglio afectado era el centinela6. Resulta interesante analizar que en nuestra casuística ninguno de los CDIS que diagnosticamos tuvo ganglio centinela positivo, incluidos los casos con subdiagnóstico, hecho que nos permite cuestionar la verdadera indicación de BGC en este tipo de paciente.
Las principales limitaciones de nuestro trabajo son aquellas inherentes a un estudio de una sola institución. A pesar de ello, los resultados que aquí demostramos pueden ayudar a orientar el proceso de toma de decisión para otros centros senológicos en el abordaje de pacientes inicialmente diagnosticadas con CDIS que puedan ser candidatas para una BGC, dependiendo de sus propios protocolos.
A pesar del perfil anteriormente descrito, con el fin de disminuir la tasa de subestimación del componente infiltrante, es importante destacar que según nuestros resultados la subestimación fue independiente del grado histológico (tabla 1) y el tamaño de la lesión (tabla 2), por lo que podemos inferir que el dispositivo que se utiliza para realizar la biopsia y las habilidades del operador son cruciales para obtener resultados como estos. Más aun, resulta interesante analizar que en nuestro estudio ningún paciente presentó ganglio centinela positivo, incluyendo a aquellos pacientes con subestimación, lo que nos hace cuestionar la verdadera indicación de la BGC en estos pacientes.
En conclusión, la subestimación del componente infiltrante en CDIS es muy baja cuando la biopsia se realiza con una SCV, obteniendo varias muestras en lesiones no palpables, cuyo hallazgo mamográfico son microcalcificaciones, independientemente del tamaño de la lesión o su grado histológico. La BGC no es una técnica a ser utilizada de manera rutinaria en pacientes con diagnóstico de CDIS, indistintamente del grado histológico, especialmente si la biopsia es realizada con una SCV. Dado nuestros resultados, consideramos que la BGC debe ser utilizada como un procedimiento de estadificación posterior al hallazgo de un componente infiltrante en la pieza quirúrgica de aquellas pacientes con CDIS diagnosticado según los parámetros que hemos sugerido.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.