La quimioterapia neoadyuvante (QNA) es el tratamiento de elección en las pacientes con cáncer de mama localmente avanzado. El objetivo de este estudio es evaluar la utilidad de QNA en tumores pequeños pero con factores pronósticos desfavorables.
Material y métodosSe compara la respuesta a la QNA en pacientes con tamaño tumoral T3-T4 frente a T1c-T2. Desde enero de 2000 a enero de 2011, 110 pacientes han recibido QNA. Se han revisado los datos demográficos, el tamaño tumoral, los factores pronósticos, la respuesta radiológica y anatomopatológica a la QNA, según la clasificación de Miller y Payne (MP), y la supervivencia en ambos grupos.
ResultadosSe revisaron 76 casos en el grupo T1c-T2 y 34 en el T3-T4. En el grupo T3-T4 se observó en mayor porcentaje tumores con factores pronósticos desfavorables (afectación ganglionar, receptores hormonales negativos y Her2Neu positivo). En el grupo T1c-T2, 23 casos (30,3%) recibieron antraciclinas y 53 (69,7%) antraciclinas y taxanos, mientras que en el grupo T3-T4, 10 (29,4%) y 24 (70,6%) casos recibieron dichas pautas, respectivamente. En el grupo T1c-T2 se observó en mayor porcentaje el subtipo tumoral receptores hormonales positivos frente a tumores Her2Neu positivos en los T3-T4. En relación con la respuesta a la QNA no se observaron diferencias estadísticamente significativas en la valoración radiológica o anatomopatológica, 38 pacientes (50%) T1c-T2 presentaron MP 4/5 frente a 16 (47,1%) en T3-T4.
ConclusionesEn las pacientes con cáncer de mama precoz existe la misma respuesta anatomopatológica a la QNA que en el grupo T3-T4. En nuestro estudio, el único factor independiente asociado a la respuesta patológica tumoral es el subtipo tumoral, presentando los tumores Her2Neu positivos mejor respuesta.
In locally advanced breast tumors, neoadjuvant chemotherapy (NC) is the standard treatment. The aim of this study was to analyze the utility of NC in small tumors with unfavorable prognostic factors.
Material and methodsWe compared the response to NC in patients with T3-T4 tumors versus those with T1c-T2 tumors. From January 2000 to January 2011, 110 patients received NC. Demographic data, tumor size, prognostic factors, radiological and histopathological response according to the Miller-Payne classification and survival were reviewed.
ResultsWe reviewed 76 patients in the T1c-T2 group and 34 in the T3-T4 groups. Tumors with poorer prognostic factors (negative hormone receptors, positive Her2Neu and metastatic nodal involvement) were observed in the T3-T4 group. In the T1c-T2 group, 23 patients (30.3%) received anthracyclines and 53 (69.7%) received anthracyclines plus taxanes. In the T3-T4 group, 10 (29.4%) and 24 (70.6%) patients received these chemotherapy regimens respectively. A higher percentage of the hormone receptor-positive tumor subtype was observed in the T1c-T2 group compared with Her2Neu-positive tumors in the T3-T4 group. No statistically significant differences in radiologic or histopathologic assessment were found: Miller-Payne grades 4/5 were found in 38 patients (50%) in the T1c-T2 group versus 16 (47.1%) in the T3-T4 group.
ConclusionsPathologic response to NC is the same in early-stage tumors as in locally-advanced breast cancer. In this study, the only independent factor associated with pathological tumor response was the tumor subtype, with the greatest response being found in Her2Neu-positive tumors.
La quimioterapia ha demostrado en el cáncer de mama quirúrgico un claro beneficio en términos de supervivencia global (SG), tanto si es administrada antes como después de la cirugía del tumor primario1.
El estudio NSABP B-18 demostró para el tratamiento de quimioterapia neoadyuvante (QNA) una mejoría en la tasa de cirugías conservadoras de mama frente a la adyuvancia, gracias a la reducción tumoral o down-staging, manteniendo el beneficio en términos de supervivencia2.
En el caso de los tumores de mama localmente avanzados el tratamiento neoadyuvante es el procedimiento estándar, no obstante, la neoadyuvancia representa también una opción terapéutica para aquellas pacientes con cáncer de mama inicial cuando existe ya una indicación de quimioterapia, puesto que mejora las posibilidades de control local y la tasa de supervivencia3 mediante el tratamiento precoz de las metástasis subclínicas. Asimismo, permite una evaluación in vivo de la biología tumoral, valorando su quimiosensibilidad4,5.
La respuesta anatomopatológica completa (pRC) o la presencia de mínima enfermedad residual tras QNA se correlaciona con una mayor supervivencia libre de enfermedad (SLE) y SG6,7. La pRC se define como la total ausencia de tumor infiltrante, grado de regresión tumoral Miller y Payne (MP) 5 y sin afectación ganglionar. La tasa de respuesta completa tras tratamientos neoadyuvantes basados en combinaciones de antraciclinas y taxanos es tan solo del 14-26%8. El tratamiento complementario con trastuzumab en pacientes con sobreexpresión de Her2Neu aumenta la pRC a un 40-60%9,10.
En términos de quimiosensibilidad, la diferencia entre tumores se basa en las desigualdades de sus perfiles moleculares. Así, los tumores basal-like y Her2Neu positivos son más sensibles a quimioterapia que los subtipos luminales. Esto sugiere que los genes implicados en sensibilidad a quimioterapia son expresados de modo diferente en cada subtipo tumoral11,12.
El objetivo de este estudio es analizar la utilidad de la QNA en aquellos tumores pequeños con expresión de factores pronósticos desfavorables y que ya tienen una indicación de quimioterapia.
Material y métodosSe trata de un estudio retrospectivo en el que se compara la respuesta a la QNA en estadios iniciales (T1c-T2) frente a tumores localmente avanzados (T3-T4). Entre enero del año 2000 y enero del año 2011 se han tratado con QNA 110 pacientes. Se revisaron los diversos datos demográficos y clínicos, incluyendo los factores pronósticos conocidos, como tamaño tumoral, afectación ganglionar, tipo y grado histológico, receptores hormonales y Her2Neu. Se analizó, asimismo, la respuesta radiológica y anatomopatológica según el tamaño tumoral.
En neoadyuvancia se utilizó el esquema quimioterápico basado en taxanos y/o antraciclinas. En el grupo de antraciclinas se administraron 4 o 6 ciclos de QNA (dosis de 75-90mg/m2), y en el grupo de antraciclinas+taxanos se administraron 4 ciclos de antraciclinas seguidos de 4 ciclos de docetaxel (100mg/m2) o 12 semanas de paclitaxel (80mg/m2). A partir del año 2010 se añadió trastuzumab en neoadyuvancia en aquellas pacientes con Her2Neu positivo (4mg/kg la primera dosis, seguido de 2mg/kg semanal).
La valoración de la respuesta a la quimioterapia se realizó mediante ecografía mamaria hasta el 2005, y posteriormente con RMN de mama, considerando respuesta completa (ausencia de tumor), respuesta parcial (<50% tumor) o no respuesta (>50%). La respuesta anatomopatológica se valoró en la pieza quirúrgica posquimioterapia según los criterios MP13. En el estudio se diferenció buena respuesta (MP 4/5) o mala respuesta anatomopatológica (MP 1-3).
La determinación de receptores hormonales de estrógenos (clon 6F11, Novocastra, Reino Unido), de progesterona (clon 16, Novocastra, Reino Unido) y de Her2Neu (clon CB11, Oracle, Leica Biosystems, Reino Unido) se realizó mediante técnicas de inmunohistoquímica, utilizando en todos los casos los anticuerpos prediluidos por el fabricante. Se consideró el Her2Neu positivo la sobreexpresión 3+ o 2+ si la técnica FISH (HER-2 DNA PathVysion, Abbott, Illinois, EE. UU.) era positiva.
Las indicaciones de QNA fueron:
- -
Tumores localmente avanzados: T3 y T4.
- -
Tumores pequeños: tamaño tumoral de≥1,5cm con Her2Neu positivo, triples negativos o afectación ganglionar y tamaño tumoral≥2cm.
A partir de 2008 se inició el estudio axilar mediante la biopsia selectiva del ganglio centinela pre-QNA. Las indicaciones de tratamiento axilar conservador fueron:
- -
Tumores únicos hasta 5cm o tumores multifocales hasta 3cm.
- -
Estudio axilar negativo (clínico, ecográfico y citológico).
Para analizar las variables cuantitativas se utilizó la t de Student, y para las variables categóricas, la Chi-cuadrado de Pearson o el test exacto de Fisher.
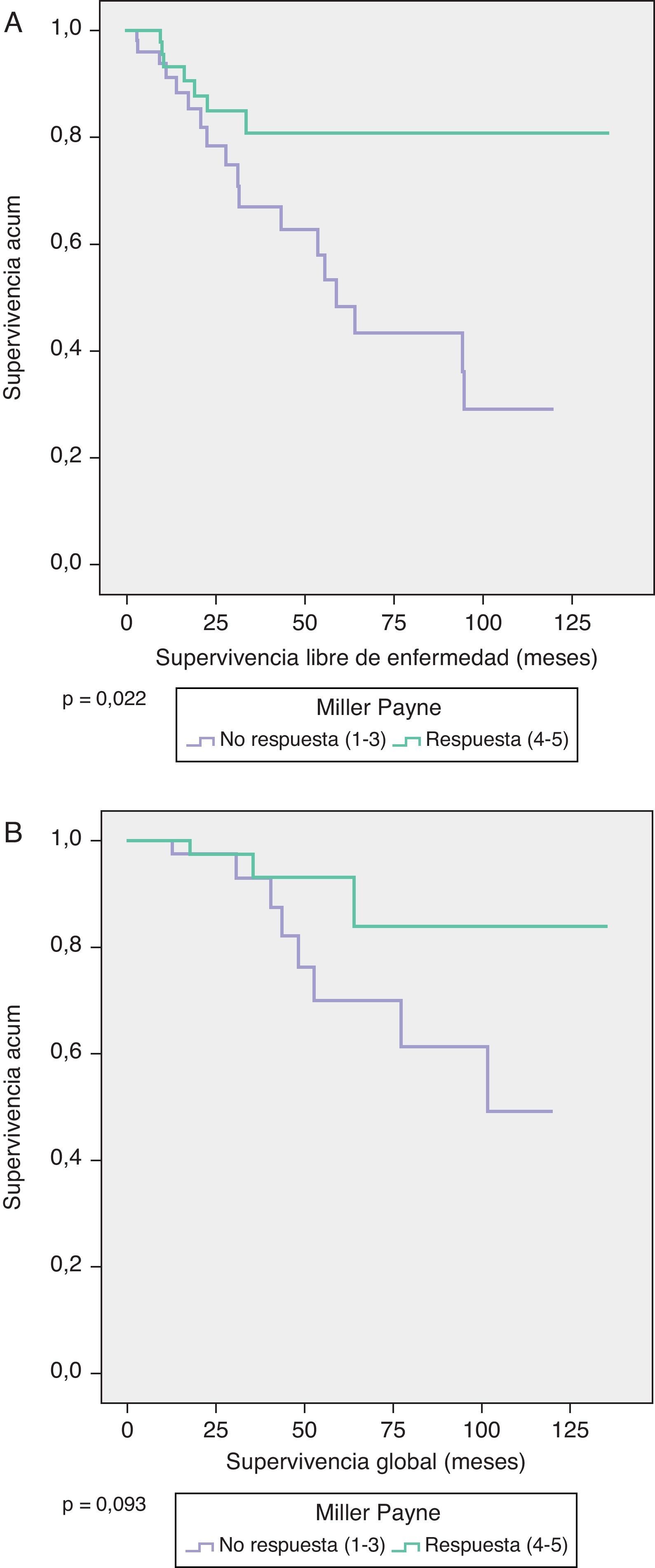
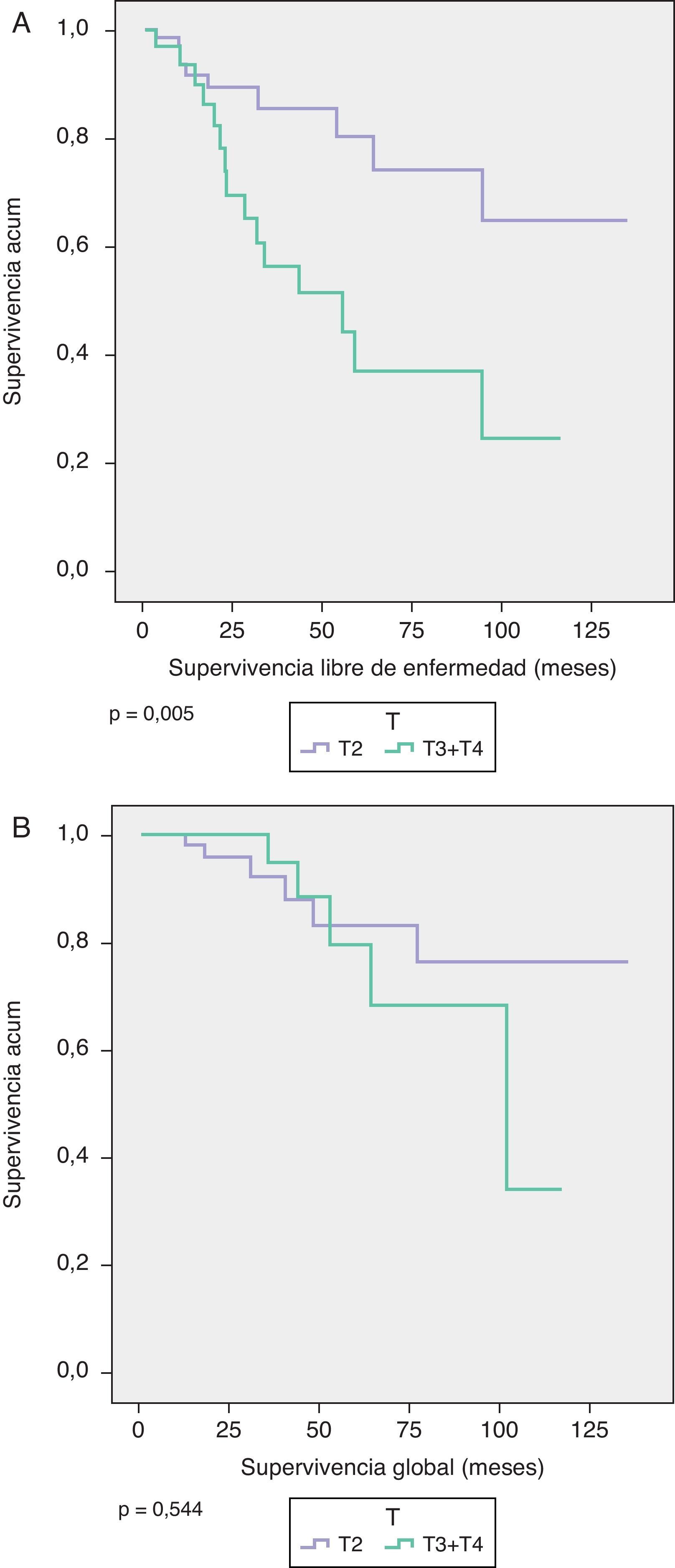
La SLE se ha estimado utilizando los modelos de supervivencia de Kaplan-Meier, que se comparan con el Log-Rank test.
Todos los análisis se realizaron utilizando el programa IBM SPSS® Statistics 20.0. Todas las comparaciones fueron bilaterales, con un nivel de significación α<0,05.
ResultadosEntre enero de 2000 y enero de 2011 se diagnosticaron 1.897 pacientes con cáncer de mama en nuestro centro. En 110 (5,8%) se inició tratamiento con QNA. El seguimiento medio fue de 87 meses y la mediana de 91,4 meses. La edad media de las pacientes que recibieron QNA fue de 47,13 años. Tras analizar los factores pronósticos, 49 pacientes (44,5%) presentaron afectación ganglionar, 37 (33,6%) fueron Her2Neu positivo y 91 (82,7%) tuvieron receptores hormonales positivos (tabla 1).
Datos descriptivos de la serie
| Casos (%) | |
| N (pacientes) | 110 |
| Edad media (años) | 47,13 |
| Tamaño tumoral (cm) | |
| Exploración clínica | 5,25 |
| Ecografía | 4,6 |
| NR | 2 casos |
| RMN | 4,53 |
| NR | 10 casos |
| Tamaño tumoral | |
| T1c-T2 | 76 (69) |
| T3-T4 | 34 (31) |
| Afectación ganglionar | 49 (44,5) |
| Histología | |
| Ductal infiltrante | 92 (83,6) |
| Lobulillar infiltrante | 9 (8,2) |
| Otros | 9 (8,2) |
| Grado histológico | |
| I | 39 (36,4) |
| II | 48 (44,9) |
| III | 20 (18,7) |
| NR | 3 casos |
| Receptores hormonales | |
| Positivo | 91 (82,7) |
| Negativo | 19 (17,3) |
| Her2Neu | |
| Positivo | 37 (33,6) |
| Quimioterapia | |
| Antraciclinas | 33 (30) |
| Antraciclinas+taxanos | 77 (70) |
| Respuesta radiológica | |
| Completa | 25 (23,4) |
| Parcial | 56 (52,3) |
| No respuesta | 26 (24,3) |
| NR | 3 casos |
| Miller y Payne | |
| 1-3 | 56 (50,9) |
| 4/5 | 54 (49,1) |
| Tratamiento quirúrgico | |
| Tumorectomía | 61 (55,5) |
| Mastectomía | 49 (44,5) |
| Subtipo | |
| RH positivos/Her2Neu negativo | 62 (56,4) |
| Her2Neu positivo | 37 (33,6) |
| Triple negativo | 11 (10) |
NR: no registrado; RH: receptores hormonales; RMN: resonancia magnética nuclear.
A 33 pacientes (30%) se les administró un esquema con solo antraciclinas y 77 (70%) recibieron una combinación de antraciclinas y taxanos.
El tratamiento quirúrgico posneoadyuvancia realizado fue conservador (tumorectomía) en 61 casos (55,5%) y mastectomía en 49 pacientes (44,5%).
De las 110 pacientes tratadas con neoadyuvancia, a 90 pacientes (81,8%) se les realizó una linfadenectomía axilar. El número de ganglios axilares extraídos y el número de ganglios afectos oscilaba de 6 a 35 y de 1 a 12, respectivamente. En 2008 se inició de forma protocolizada el estudio de la axila mediante la técnica del ganglio centinela en neoadyuvancia. A partir de ese año se han tratado 60 pacientes, de las cuales se ha realizado ganglio centinela a 28 (46,7%), con resultado negativo en 20 casos (71,4%). El 53,3% de las pacientes (32 casos) requirió una linfadenectomía axilar en primera instancia.
En relación con los subtipos tumorales, 62 pacientes (56,4%) presentaron tumores receptores hormonales positivos, 37 (33,6%) Her2Neu positivo y 11 (10%) triple negativo.
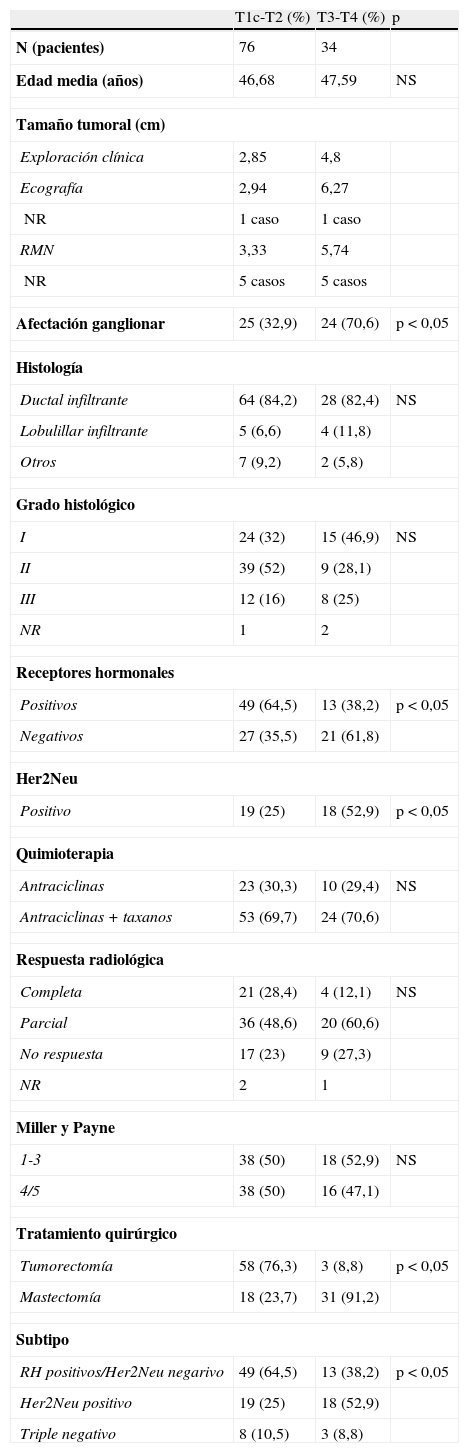
En la tabla 2 se presentan los diversos datos descriptivos ajustados al tamaño tumoral. En 76 pacientes se diagnosticó un T1c-T2 y 34 casos presentaron un T3-T4. La edad media al diagnóstico en las pacientes T1c-T2 y T3-T4 fue de 46,68 (±8,62) y 47,59 años (±8,40), respectivamente. No se encontraron diferencias estadísticamente significativas.
Datos descriptivos según el tamaño tumoral
| T1c-T2 (%) | T3-T4 (%) | p | |
| N (pacientes) | 76 | 34 | |
| Edad media (años) | 46,68 | 47,59 | NS |
| Tamaño tumoral (cm) | |||
| Exploración clínica | 2,85 | 4,8 | |
| Ecografía | 2,94 | 6,27 | |
| NR | 1 caso | 1 caso | |
| RMN | 3,33 | 5,74 | |
| NR | 5 casos | 5 casos | |
| Afectación ganglionar | 25 (32,9) | 24 (70,6) | p<0,05 |
| Histología | |||
| Ductal infiltrante | 64 (84,2) | 28 (82,4) | NS |
| Lobulillar infiltrante | 5 (6,6) | 4 (11,8) | |
| Otros | 7 (9,2) | 2 (5,8) | |
| Grado histológico | |||
| I | 24 (32) | 15 (46,9) | NS |
| II | 39 (52) | 9 (28,1) | |
| III | 12 (16) | 8 (25) | |
| NR | 1 | 2 | |
| Receptores hormonales | |||
| Positivos | 49 (64,5) | 13 (38,2) | p<0,05 |
| Negativos | 27 (35,5) | 21 (61,8) | |
| Her2Neu | |||
| Positivo | 19 (25) | 18 (52,9) | p<0,05 |
| Quimioterapia | |||
| Antraciclinas | 23 (30,3) | 10 (29,4) | NS |
| Antraciclinas+taxanos | 53 (69,7) | 24 (70,6) | |
| Respuesta radiológica | |||
| Completa | 21 (28,4) | 4 (12,1) | NS |
| Parcial | 36 (48,6) | 20 (60,6) | |
| No respuesta | 17 (23) | 9 (27,3) | |
| NR | 2 | 1 | |
| Miller y Payne | |||
| 1-3 | 38 (50) | 18 (52,9) | NS |
| 4/5 | 38 (50) | 16 (47,1) | |
| Tratamiento quirúrgico | |||
| Tumorectomía | 58 (76,3) | 3 (8,8) | p<0,05 |
| Mastectomía | 18 (23,7) | 31 (91,2) | |
| Subtipo | |||
| RH positivos/Her2Neu negarivo | 49 (64,5) | 13 (38,2) | p<0,05 |
| Her2Neu positivo | 19 (25) | 18 (52,9) | |
| Triple negativo | 8 (10,5) | 3 (8,8) | |
NR: no registrado; NS: no significativo; RH: receptores hormonales; RMN: resonancia magnética nuclear.
En el grupo T1c-T2, el tamaño tumoral medio por ecografía fue de 2,94cm (±0,72), y en las pacientes con T3-T4, de 4,83cm (±1,91). Los tumores localmente avanzados presentaban factores pronósticos desfavorables (mayor afectación ganglionar, receptores hormonales negativos y Her2Neu positivo). De las pacientes con T1c-T2, 25 casos (32,9%) presentaban afectación ganglionar al diagnóstico frente a 24 (70,6%) pacientes con T3-T4 (p<0,05). El Her2Neu era positivo en 19 (25%) casos T1c-T2 y en 18 (52,9%) tumores T3-T4 (p<0,05).
En el grupo T1c-T2, 23 pacientes (30,3%) recibieron antraciclinas y 53 (69,7%) antraciclinas y taxanos, comparado con 10 (29,4%) y 24 casos (70,6%), respectivamente, en el grupo T3-T4.
En cuanto al grado de regresión tumoral radiológica y patológica, entre T1c-T2 y T3-T4 no se encontraron diferencias estadísticamente significativas. Al estudiar la respuesta patológica, diferenciando buena respuesta (MP 4/5) versus mala respuesta (MP 1-3), se observa que existe la misma quimiosensibilidad en tumores iniciales que en tumores localmente avanzados, 38 pacientes (50%) en el grupo T1c-T2 presentaron MP 4/5 frente a 16 (47,1%) del grupo T3-T4. No se observaron diferencias estadísticamente significativas en cuanto al número de ganglios afectos posquimioterapia y el grado de regresión tumoral, pero sí hay una tendencia a una mayor respuesta patológica tumoral cuando existe menor afectación ganglionar prequimioterapia: 36 pacientes (59%) sin afectación ganglionar obtuvieron un grado de regresión tumoral MP 4/5, mientras que 18 casos (36,7%) con afectación ganglionar presentaron MP 4/5.
En el grupo T1c-T2 se realizó tumorectomía en 58 pacientes (76,3%) frente a 3 casos (8,8%) en T3-T4 (p<0,05).
Los estadios iniciales presentaban en mayor porcentaje el subtipo receptores hormonales positivos (64,5 versus 38,2%), mientras que en los T3-T4 se observaban tumores Her2Neu positivos (25 versus 52,9%) (p<0,05).
Se realizó un análisis multivariante para valorar el grado de regresión tumoral anatomopatológica ajustado al tipo de quimioterapia, al tamaño tumoral y al subtipo tumoral. Se observó que el único factor independiente asociado a la respuesta patológica tumoral era el subtipo tumoral, presentando los tumores Her2Neu positivos una mejor respuesta (p<0,05).
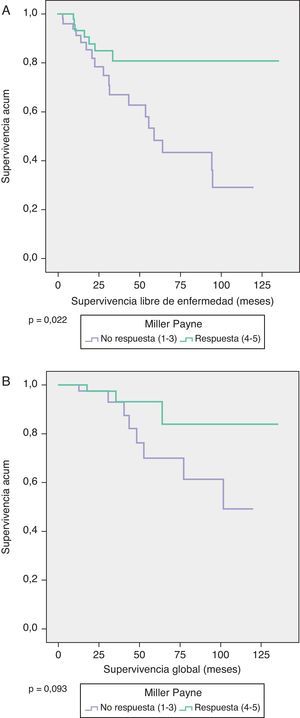
La SG a 5 años en las pacientes con MP 4/5 fue del 95% y en MP 1-3 del 70% (p=0,093), y la SLE en ambos grupos fue de 82 y 50%, respectivamente (p=0,022) (fig. 1).
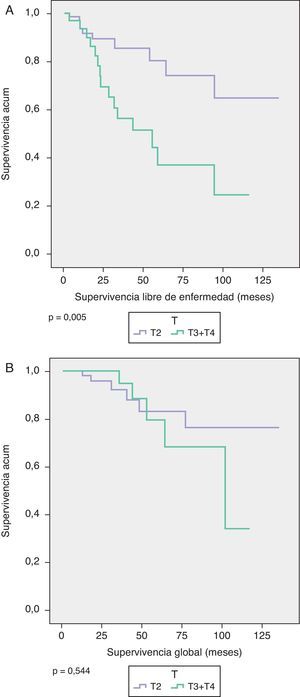
La SG y SLE a los 5 años según el tamaño tumoral (T1c-T2 versus T3-T4) fue de 83,2 y 80,2% en los T1c-T2 y de 79,6 y 37% en los T3-T4, respectivamente (SG p=0,544, SLE p=0,005) (fig. 2).
DiscusiónLa QNA representa el tratamiento inicial para el manejo multidisciplinario de las pacientes con cáncer de mama operables con gran tamaño tumoral o localmente avanzado. Múltiples estudios14,15 ya han demostrado su eficacia frente a la adyuvancia, mostrando resultados equivalentes en cuanto a supervivencia, pero permitiendo una mayor tasa de cirugía conservadora. Sin embargo, no todos los tumores presentan una misma quimiosensibilidad, las diferencias en la respuesta anatomopatológica no se basan en el tamaño tumoral, sino en las desigualdades de los perfiles moleculares16,17.
En nuestra serie, al estudiar la respuesta anatomopatológica diferenciando buena respuesta (MP 4/5) versus mala respuesta (MP 1-3), se observa que existe la misma quimiosensibilidad en estadios iniciales que en tumores localmente avanzados, y al realizar el análisis multivariante se concluye que el único factor independiente asociado a la respuesta patológica tumoral es el subtipo tumoral, presentando los tumores Her2Neu positivos una mejor respuesta.
En relación con el valor pronóstico de la respuesta anatomopatológica, las pacientes con MP 4/5 presentaban una supervivencia global del 95%, frente al 70% de aquellas con MP 1-3. Dichos resultados coinciden con la literatura, en la que pacientes con pRC tanto a nivel de tumor como en axila presentan mayor tasa de SLE y SG en relación con las pacientes con enfermedad residual posquimioterapia6,11,18. No obstante, el estudio NSABP B-2719,20, que compara diferentes esquemas de neoadyuvancia, no consiguió demostrar una relación entre pRC y aumento en la supervivencia, ya que a pesar de un incremento en la tasa de respuesta completa con pautas de doxorrubicina/ciclofosfamida (AC)-docetaxel versus AC, no había diferencias significativas en cuanto a SG ni SLE. Dichas discrepancias entre estudios seguramente son debidas a que el impacto pronóstico de la pRC se basa en las diferencias de los perfiles moleculares21. Von Minckwitz et al. demostraron claramente que la respuesta completa no está asociada al pronóstico en los subgrupos luminales A, mientras que en los subgrupos Her2Neu positivo o triples negativos la respuesta completa puede discriminar pacientes con mejor o peor pronóstico22.
Buzdar et al.23 mostraron un mayor efecto terapéutico en las pacientes con Her2Neu positivo al añadir trastuzumab a la QNA, obteniendo una mejoría en las tasas de respuesta completa del 26,3 al 65,2%.
El objetivo primordial en la neoadyuvancia es identificar y seleccionar a las pacientes que se beneficiarán de los diferentes tipos de esquemas para evitar tratamientos ineficaces. En nuestro estudio, aunque los tumores localmente avanzados (T3-T4) presentaban factores pronósticos más desfavorables (mayor porcentaje de receptores hormonales negativos y Her2Neu positivos), la respuesta a la QNA valorada por MP no difería de la de los estadios iniciales (T1c-T2).
La QNA consigue respuestas tumorales en más de dos tercios de las pacientes con cáncer de mama operable, observándose una tasa de progresión de la enfermedad durante el tratamiento de menos del 5%. En nuestro estudio concluimos que el único factor independiente asociado a la respuesta patológica tumoral es el subtipo tumoral, presentando los tumores Her2Neu positivos una mejor respuesta. Por lo tanto, la neoadyuvancia puede darse en tumores pequeños, ya que el tamaño tumoral no implica una diferencia en la quimiosensibilidad, y en las pacientes con cáncer de mama precoz existe la misma respuesta radiológica y anatomopatológica a la QNA que en el grupo T3-T4.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.