La incidencia del cáncer de mama (CM) ha aumentado progresivamente y aproximadamente el 15% de las mujeres son diagnosticados antes de los 45 años. Este subgrupo de pacientes suelen tener tumores más agresivos y serán tratadas con terapia sistémica (quimioterapia, terapia hormonal o ambos). Por otra parte, la tendencia a retrasar la edad de maternidad implica que una gran proporción de pacientes con CM jóvenes no han completado su deseo reproductivo. El impacto del tratamiento oncológico en la reserva ovárica depende de la edad de los pacientes, el tipo de esquema y la dosis recibida. El senólogo debería ser sensible al deseo gestacional y realizar una derivación inmediata a la Unidad de Preservación de la Fertilidad. Esta maniobra no implica un retraso en el inicio terapéutico de la enfermedad como demuestran nuestros resultados. En nuestro centro, 40 pacientes fueron sometidas a crioconservación de ovocitos entre 2010 y 2015. La media de días entre el diagnóstico de CM y el inicio del tratamiento oncológico fue de 37,6 días. El tiempo de estimulación (inicio del tratamiento de estimulación hasta la recuperación de los ovocitos) presentó una media de 12 días (7-21). Por lo tanto, consideramos que las pacientes jóvenes deben ser remitidas a una unidad de asesoramiento reproductivo, tal y como aconseja EUSOMA. La preservación de fertilidad requiere de la participación coordinada tanto del equipo de Oncología y el equipo de Reproducción Humana.
The incidence of breast cancer (BC) has progressively increased, and approximately 15% of women will receive a diagnosis before the age of 45 years. This patient subgroup usually has more aggressive tumours and will be treated with systemic therapy (chemotherapy, hormone therapy, or both). In addition, the tendency to delay maternity implies that a many young patients with BC will not have fulfilled their reproductive wishes. The impact of cancer treatment on ovarian reserve depends on patient age, the type of regimen and the doses received. Senologists should be sensitive to their patients’ reproductive wishes and immediately refer them to Fertility Preservation Units. As shown by our results, referral does not imply a delay in treatment initiation. In our centre, 40 patients underwent ovarian tissue cryopreservation between 2010 and 2015. The mean number of days between BC diagnosis and the start of cancer treatment was 37.6 days. The mean time from stimulation (the start of stimulation until oocyte recovery) was 12 days (7-12). Therefore, we believe that young patients should be referred to a reproductive counselling unit, as recommended by EUSOMA. Fertility preservation requires liaison between the oncology and human reproduction teams.
La incidencia del cáncer de mama (CM) está sufriendo un incremento global y se presenta a edades cada vez más tempranas1,2. El diagnóstico precoz y los actuales tratamientos han permitido unas tasas de curación muy favorables. Los protocolos de quimioterapia (QT), basados en antraciclinas y taxanos, han aumentado significativamente el pronóstico de estas pacientes, de forma que más del 90% se diagnostican en etapa inicial, con una supervivencia a los 5 años del 97%. Asimismo, aproximadamente el 25% de las pacientes son premenopáusicas y el 15% menores de 45 años3. Por otra parte, la maternidad se ha retrasado en la población occidental y todo esto provoca que muchas mujeres presenten CM sin haber cumplido su deseo gestacional. Según el Instituto Nacional de Estadística, la edad media de paridad era de 28 años en 1975, siendo en 2013 de 32 años. Actualmente, en nuestro centro la mediana de edad es de 34 años.
La incidencia de embarazos a término tras el diagnóstico de CM es muy pequeña y corresponde solo al 20% de las pacientes que presentan deseo genésico. Por una parte, el consejo de muchos sanitarios a estas pacientes es el de evitar la gestación, pero también la esterilidad es un problema en pacientes jóvenes en las que se diagnostica un CM y el efecto de la QT sobre la función de la reproducción debe ser correctamente estimado teniendo en cuenta la reserva ovárica. Existe evidencia de que los tratamientos quimioterápicos tienen un impacto negativo en la fertilidad a consecuencia de un efecto directo sobre el ovario, con una disminución de la reserva folicular4-6.
Varios estudios se han centrado en la repercusión sobre el efecto de la QT en la función ovárica y en las diferentes técnicas de preservación de la fertilidad (PF), pero todavía existe controversia en establecer cuáles serían las pacientes en las que estaría indicada una preservación y si esta puede conllevar una demora en la instauración del tratamiento oncológico. Es por ello que en nuestro centro se ha estudiado nuestra experiencia en pacientes con CM y PF para establecer una guía con carácter oncológico, y analizar así las indicaciones y el tiempo requerido para realizarlo.
Material y métodosSe trata de un estudio retrospectivo, descriptivo y observacional, en el que se revisa a las pacientes diagnosticadas de un CM y que realizaron PF mediante estimulación ovárica en nuestro centro entre los años 2010 y 2015.
El diagnóstico se realizó con punción-aspiración con aguja fina y confirmación anatomopatológica mediante biopsia con aguja gruesa o biopsia asistida por vacío. Una vez establecido el diagnóstico de malignidad, las pacientes fueron remitidas a la Unidad de Preservación de la Fertilidad, con el objetivo de ser asesoradas sobre el método más eficaz para preservar su fertilidad y valorar la posibilidad de realizarlo. En nuestro centro actualmente recomendamos la criopreservación de ovocitos frente a la criopreservación de embriones o a la criopreservación de tejido ovárico. El motivo radica en la mayor eficacia y en no necesitar pareja masculina.
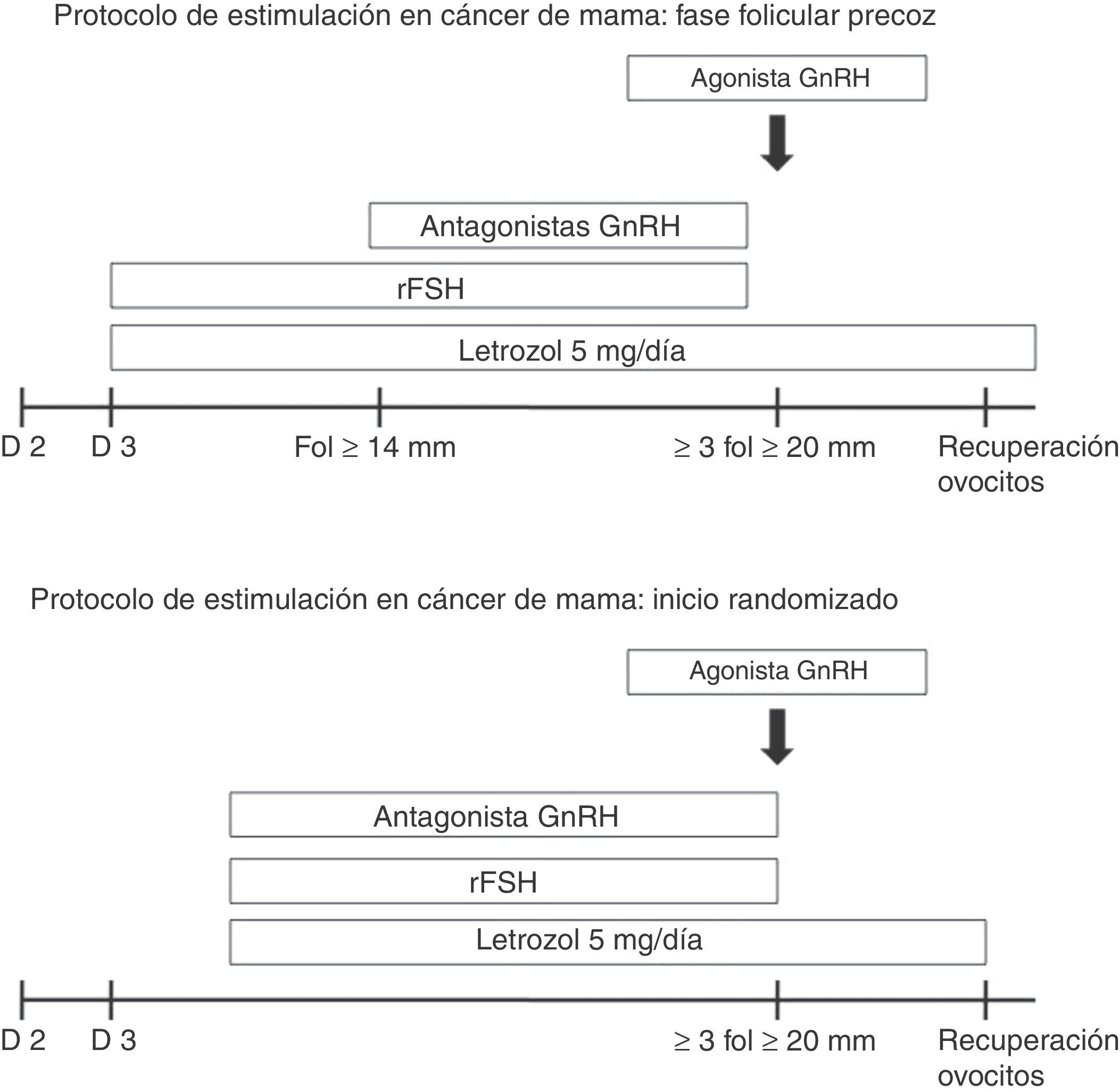
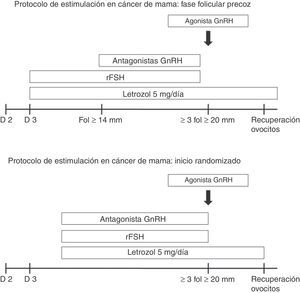
El proceso completo de criopreservación de ovocitos (estimulación ovárica y posterior recuperación de ovocitos) requiere unas 2-3 semanas, dependiendo del momento del ciclo menstrual en el que se encuentre la paciente. El protocolo de estimulación se muestra en la figura 1. El uso de antagonistas de la GnRH permite un inicio aleatorizado de la estimulación, provocando una luteólisis en 2-4 días con el posterior desarrollo folicular. Esta estrategia es muy útil cuando existe mayor limitación de tiempo y en aquellas pacientes que no se encuentran en fase folicular precoz. En cualquier caso, se utilizan los inhibidores de la aromatasa (letrozol) para evitar niveles altos de estrógenos circulantes.
Se han revisado los diferentes datos demográficos, el tamaño tumoral y los estadios al diagnóstico para establecer una guía de indicaciones. También se han analizado los diferentes factores pronósticos (receptores hormonales, HER2, Ki67, afectación ganglionar y grado tumoral), los diferentes subtipos tumorales y el tratamiento recibido.
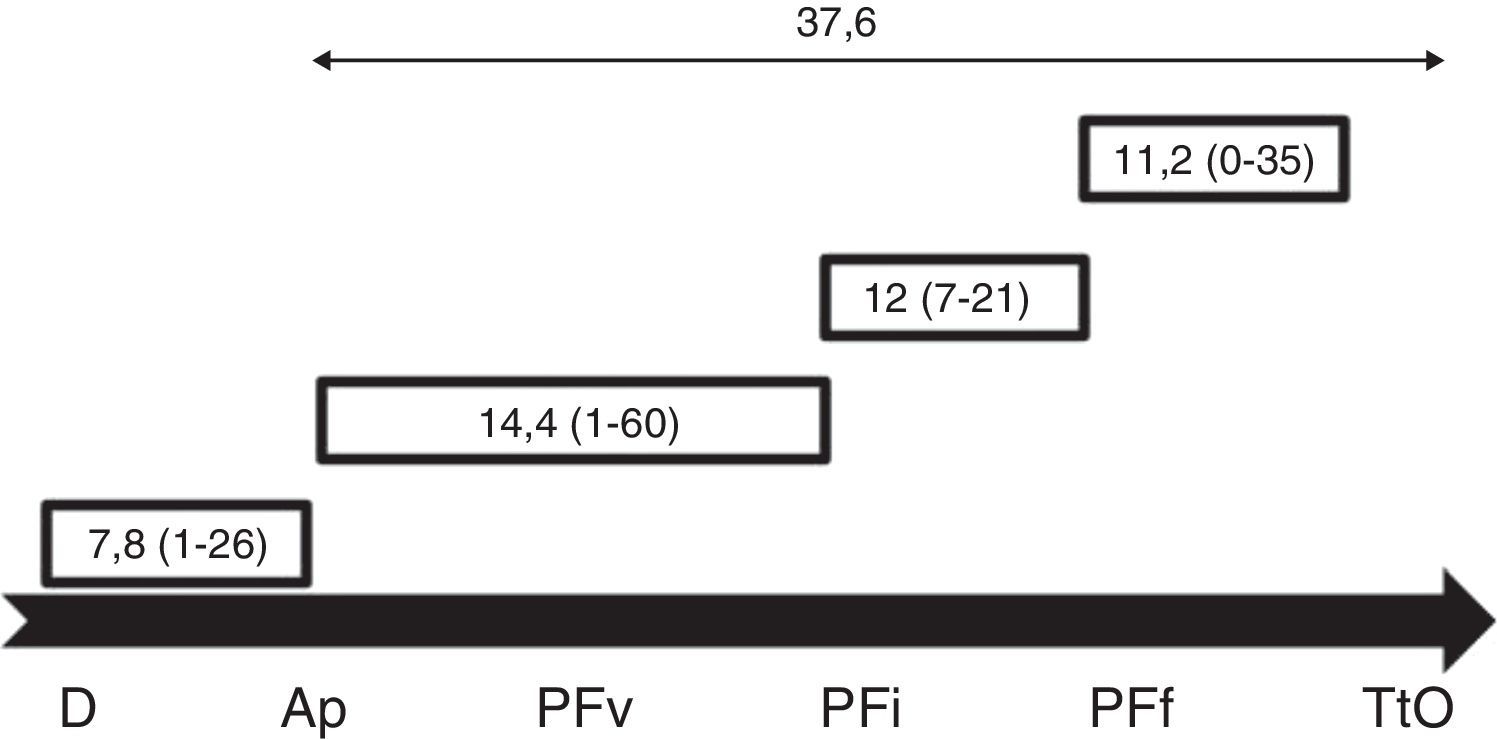
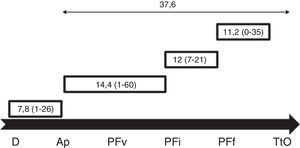
Asimismo, se ha realizado un subanálisis estudiando el tiempo de demora o no en el inicio del tratamiento oncológico. Marcamos como referencia en cada caso las fechas de los procesos siguientes: 1) diagnóstico (imagen); 2) seguridad (resultado AP); 3) visita PF; 4) inicio PF; 5) final PF, y 6) inicio del tratamiento oncológico. Los periodos analizados (en días) fueron: 1) periodo de diagnóstico (sospecha por imagen-resultado AP); 2) periodo de visita PF (resultado AP-visita PF); 3) periodo de PF (inicio PF-final PF); 4) periodo de inicio tratamiento oncológico (final PF-inicio tratamiento oncológico), y 5) periodo total (sospecha por imagen-inicio tratamiento oncológico).
Para la descripción de las variables cuantitativas se empleó el formato convencional mediana, media ± desviación estándar, máximos y mínimos. Para la descripción de variables cualitativas se utilizaron las proporciones de población.
ResultadosEntre los años 2010 y 2015, 40 pacientes se han sometido a una crioconservación de ovocitos/embriones en nuestro centro. La edad media al diagnóstico fue de 33,93 años (26-41). Las características oncológicas de las pacientes se muestran en la tabla 1. En nuestra serie se observaron en mayor porcentaje carcinoma ductal infiltrante (29 casos, 80,5%) y grado tumoral ii (16 pacientes, 47%). El estadio tumoral más frecuente fue T1c (13 pacientes, 35,1%) y T2 (13 casos, 35,1%), y el tamaño tumoral medio por ecografía fue de 2± 1,3 cm. Tras analizar los factores pronósticos, 11 pacientes (31,4%) presentaron afectación ganglionar, 29 tuvieron receptores hormonales positivos (82,9%) y 9 (26,5%) fueron HER2 positivo.
Características oncológicas de las pacientes
| Características tumorales, casos (%) | |
|---|---|
| N | 40 |
| Estadio tumoral | |
| In situ | 2 (5,4) |
| Microinfiltrante | 3 (8,1) |
| T1b | 5 (13,6) |
| T1c | 13 (35,1) |
| T2 | 13 (35,1) |
| T3 | 1 (2,7) |
| NR | 3 |
| Afectación ganglionar | |
| Positiva | 11 (31,4) |
| Negativa | 24 (68,6) |
| NR | 5 |
| Histología tumoral | |
| DCIS | 2 (5,6) |
| CDI | 29 (80,5) |
| CLI | 2 (5,6) |
| Otros | 3 (8,3) |
| NR | 4 |
| Grado tumoral | |
| I | 11 (32,3) |
| II | 16 (47) |
| III | 7 (20,7) |
| NR | 6 |
| Receptores hormonales | |
| Positivos | 29 (82,9) |
| Negativos | 6 (17,1) |
| NR | 5 |
| HER2 | |
| Positivo | 9 (26,5) |
| Negativo | 25 (73,5) |
| NR | 6 |
| Subtipo tumoral | |
| Luminal A | 6 (17,6) |
| Luminal B/HER2– | 15 (44,1) |
| Luminal B/HER2+ | 7 (20,6) |
| HER2+ | 2 (5,9) |
| Triple negativo | 4 (11,8) |
| NR | 6 |
NR: no registrado.
En relación con los subtipos tumorales, 6 pacientes (17,6%) presentaron luminal A, 15 casos (44,1%) luminal B/HER2–, 7 (20,6%) luminal B/HER2+, 2 (5,9%) HER2+ y 4 casos (11,8%) triple negativo.
En 35 casos (89,7%) se realizó tratamiento con QT (12 neoadyuvante y 23 adyuvante) y 29 pacientes (78,4%) recibieron tratamiento hormonal.
En cuanto a la valoración de la estimulación ovárica, la media del recuento de folículos antrales 12,33 ± 6,1 y la media de la hormona antimulleriana 2,1 ng/ml ± 1,4. La tabla 2 muestra los parámetros de la estimulación ovárica.
Parámetros de estimulación ovárica
| Inicio | |
| Basal | 23 (57,5%) |
| Aleatorizado | 17 (42,5%) |
| Media de dosis total de gonadotropinas (IU) | 2.164,8±935 |
| Media de pico de nivel de E2(pg/ml) | 831,6±879,3 |
| Tiempo medio de estimulación (días) | 12±3,7 |
| Media de ovocitos recuperados (número) | 14,58±9,9 |
Los datos se presentan como media ± desviación estándar.
Se analizaron los diferentes periodos utilizados para la PF. La media de días entre el diagnóstico de CM y el inicio del tratamiento oncológico fue de 37,6 días. El tiempo de estimulación (inicio del tratamiento de estimulación hasta la recuperación de los ovocitos) presentó una media de 12 días7-21 (fig. 2).
En relación con los resultados obstétricos de las pacientes a las que se ha autorizado la gestación, 7 pacientes se quedaron gestantes, 6 fueron evolutivos y 1 aborto. La gestación fue espontánea en 2 casos y 5 mediante técnica de reproducción. De las 6 pacientes con gestación evolutiva, 2 finalizaron mediante una cesárea y 4 tuvieron parto vaginal. Todas a término y no presentaron ninguna complicación obstétrica.
La mediana de seguimiento fue de 45 meses (12-108 meses). Una paciente presentó una recidiva local a los 9 meses del diagnóstico (3,8% de las pacientes) y se observó un caso de neoplasia de mama contralateral a los 42 meses de la primera. No se observaron casos de enfermedad a distancia.
DiscusiónExiste todavía controversia sobre si el embarazo en pacientes que han presentado un CM conlleva un peor pronóstico. Varios estudios recientes muestran que el embarazo después del CM no está contraindicado, e incluso está relacionado con un incremento en la supervivencia7-9. De esta manera, la PF es un campo emergente que proporciona la oportunidad de mantener la función reproductiva para todas aquellas pacientes que tienen que someterse a un tratamiento gonadotóxico y permite que puedan completar su maternidad un tiempo después de haber superado su enfermedad.
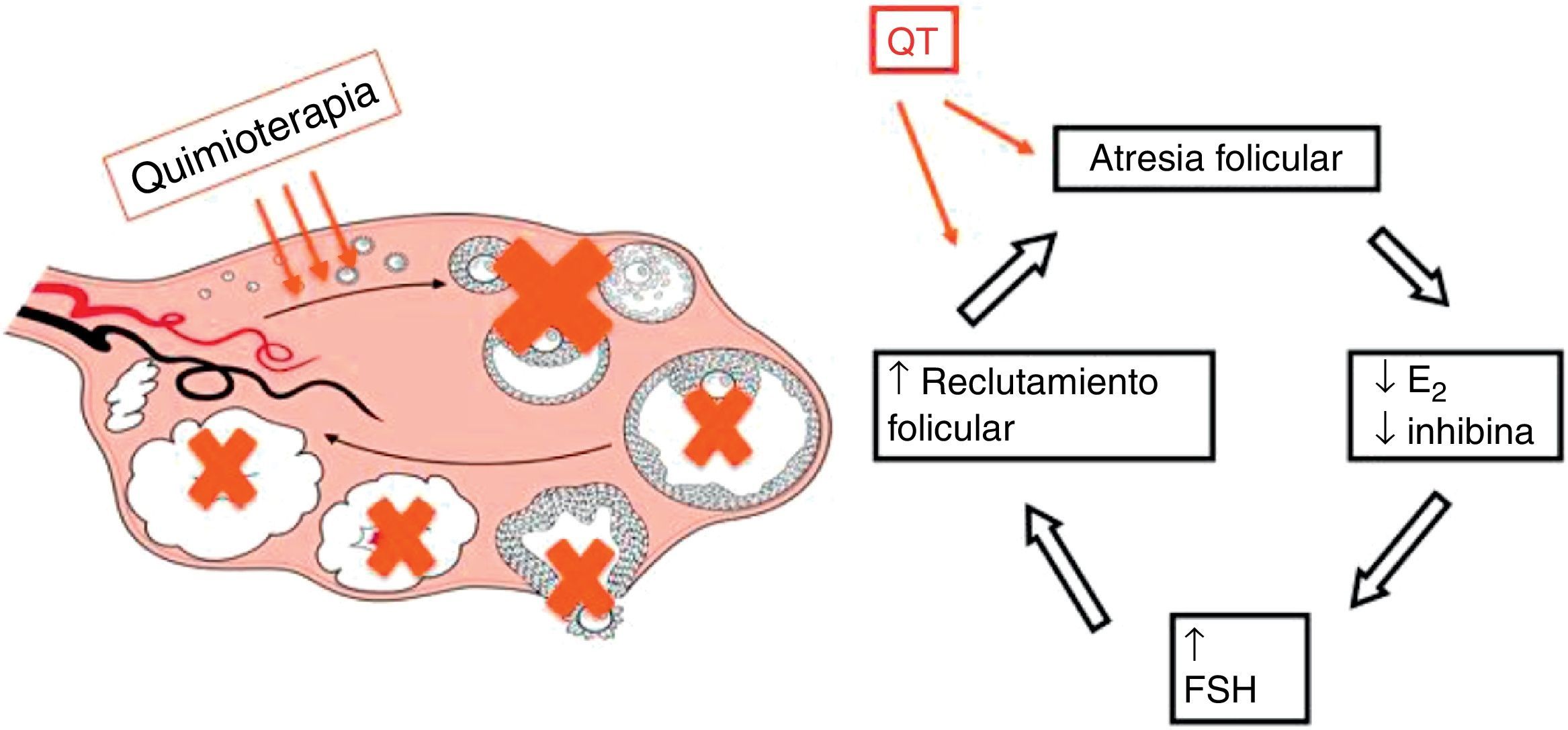
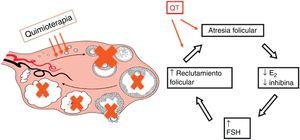
La QT recibida en pacientes con CM tiene un impacto negativo en la fertilidad, debido a un efecto directo en el ovario provocando una disminución de la reserva folicular mediante la muerte celular apoptótica (fig. 3).
La amenorrea inducida por la QT puede ser reversible o permanente. Sin embargo, los efectos no deseados de las terapias oncológicas dependen de varios factores, tales como: las características intrínsecas de las pacientes (edad, disposición genética, la quimiosensibilidad de los tejidos, los mecanismos de reparación celular), el tipo y las dosis de QT y la biología tumoral10-12. Los agentes citotóxicos como busulfán o ciclofosfamida presentan un alto riesgo de gonadotoxicidad, mientras que los esquemas basados en vincristina, 5-fluorouracilo o metotrexato tienen un bajo riesgo. En el CM, los regímenes de QT basados en ciclofosfamida, metotrexato y fluorouracilo (CMF), y ciclofosfamida, epirubicina y fluorouracilo (CEF) durante 6 ciclos tienen un riesgo elevado (aproximadamente 80%) y el régimen de antraciclinas-taxanos, el más utilizado, un riesgo moderado/intermedio. Hoy en día, el efecto de las nuevas «terapias diana» (Herceptin®, anticuerpos monoclonales, inhibidores de la tirosina-cinasa, inhibidores de la PARP) es aún desconocido13. Sin embargo, incluso si la paciente recupera su ciclo menstrual, sigue existiendo un riesgo de insuficiencia ovárica prematura.
El tratamiento con tamoxifeno está recomendado en pacientes con receptores hormonales positivos y durante un periodo de al menos 5 años. Solo tiene un riesgo bajo de fallo ovárico y es edad dependiente: en mujeres menores de 45 años el riesgo es el mismo que en las no tratadas, pero es de esperar que durante este tiempo habrá una disminución natural de la fertilidad. En las pacientes mayores de 45 años el riesgo de insuficiencia ovárica es un 10% mayor que en las no tratadas. Algunos estudios han informado del uso de análogos de la GnRH para proteger el ovario del efecto quimiotóxico. Se ha indicado que los análogos de la GnRH pueden ralentizar los folículos que entran en diferenciación y reducir la vascularización en el ovario, disminuyendo, por lo tanto, el nivel de concentración del fármaco. Moore et al. reportaron una importante reducción del riesgo de menopausia precoz en aquellas pacientes que recibieron análogos durante la QT14. No obstante, los análogos de la GnRH no están ampliamente aceptados, ya que no hay suficiente evidencia de su eficacia en la protección del ovario y no se debe subestimar los efectos de un hipoestrogenismo prolongado15-17.
Debido a todos los efectos secundarios del tratamiento oncológico, es importante que el senólogo informe a la paciente sobre las posibilidades de preservar su fertilidad. En el último EUSOMA, se acordó recomendar informar a toda paciente joven con CM sobre la PF antes de iniciar cualquier tratamiento sistémico3.
Actualmente, la mayoría de sociedades oncológicas recomiendan en sus guías de actuación que la PF debe ser discutida lo más temprano posible en la línea de tratamiento6,18,19. Pero dicha información normalmente es insuficiente y solo el 25% de los oncólogos derivan a las pacientes a una Unidad de Preservación. Posiblemente esto se deba a varios factores: existe el miedo a que niveles altos de estrógenos puedan influir en una recidiva, a la baja respuesta que puedan presentar las pacientes oncológicas o el hecho que la PF pueda retrasar significativamente el inicio del tratamiento oncológico, conllevando un peor pronóstico para la paciente.
Se ha discutido que la exposición a niveles altos de estradiol podría ser contraproducente en pacientes con tumores hormonodependientes. Algunos autores consideran que dicha exposición es demasiado breve como para causar un riesgo grave20. Además, la estimulación ovárica con inhibidores de la aromatasa se ha descrito para evitar los niveles elevados de estradiol sin ningún aumento de las tasas de recurrencia de CM21.
En cuanto al riesgo de retrasar el inicio del tratamiento oncológico, probablemente sea debido a que no existe información suficiente sobre el efecto de la PF en la planificación del tratamiento oncológico22. Se ha propuesto que las pacientes con CM lo pueden demorar hasta un mes para realizar la PF23,24. En nuestra serie, la PF solo requirió de 12 días para la obtención de ovocitos y el tiempo total entre el diagnóstico del CM y el inicio del tratamiento oncológico fue de 37,6 días. La PF no presentó un impacto negativo para las pacientes y permitió el inicio del tratamiento dentro de los márgenes de seguridad establecidos. Además, el uso de antagonistas de la GnRH permite un inicio aleatorio de la estimulación, provocando una luteólisis en 2-4 días, con el desarrollo folicular posterior. Esta estrategia puede ser útil cuando las pacientes no están en la fase folicular temprana25. Por lo que la urgencia de empezar el tratamiento no debería ser una excusa para no realizar la PF.
La PF no debería ya ser considerada una estrategia experimental y se puede realizar mediante estimulación ovárica o mediante preservación de tejido ovárico. Nuestro estudio ha analizado solamente la PF mediante la estimulación ovárica, ya que es la técnica que requiere de un mayor tiempo de realización y la que plantea todavía más discusión.
La estimulación ovárica es el método de elección en aquellas pacientes que pueden retrasar el inicio del tratamiento oncológico y cuando la estimulación ovárica controlada no está contraindicada. No es útil en prepúberes. Requiere un total de 10-14 días para la estimulación ovárica. El éxito de esta técnica se relaciona directamente con la edad y el grado de respuesta ovárica al tratamiento. Se ha descrito que la respuesta a la estimulación ovárica en estas pacientes (sobre todo las pacientes BRCA positivas) puede ser inferior debido a la propia enfermedad neoplásica. Se puede preservar embriones u ovocitos. La criopreservación de embriones es la técnica más establecida para los ciclos de fecundación in vitro y la de mayor difusión. Presenta una tasa de embarazo del 20-30% por transferencia y una tasa acumulada del 50-60%. Necesidad de una pareja o donante de esperma. Sin embargo, las crecientes implicaciones éticas de los embriones preservados plantean la vitrificación de oovocitos como la técnica preferida en la PF. La criopreservación de ovocitos se está convirtiendo en la técnica más utilizada en la mayoría de los centros especializados. La introducción de la microinyección espermática intracitoplasmática para la fecundación ovocitaria aumentó las tasas de fecundación y el desarrollo de la técnica de vitrificación ha mejorado considerablemente las tasas de implantación y de gestación. La tasa de embarazo mediante congelación lenta es del 1-10% y con vitrificación entre el 4 y el 45%. No requiere de un donante de esperma y evita dilemas posteriores por el almacenamiento de embriones12.
La principal ventaja de la criopreservación de tejido ovárico es que se puede realizar rápidamente sin retrasar el inicio del tratamiento oncológico. El trasplante de fragmentos de córtex ovárico puede realizarse de manera ortotópica o heterotópica. La neoangiogénesis después del trasplante de tejido ovárico es aún el factor limitante, ya que se obtiene tras 5 días y conlleva la pérdida del 60% de los folículos primordiales6.
No requiere de muestra espermática, es útil en prepúberes y puede realizarse en cualquier momento del ciclo. Esta técnica tiene la ventaja potencial de preservar no solo la fertilidad, sino también la función endocrina del ovario. No obstante, requiere de 2 intervenciones quirúrgicas, parte del tejido ovárico es analizado para descartar la presencia de micrometástasis. Una de las preocupaciones en relación con el trasplante de tejido ovárico es el riesgo de reinserción de células tumorales, pero no existe evidencia que aumente el riesgo en las primeras etapas de CM26.
Podemos concluir que todas las mujeres jóvenes con diagnóstico de CM deberían ser remitidas a una Unidad de Preservación de la Fertilidad. La estimulación ovárica se puede realizar en 2-3 semanas, sin causar un retraso significativo en el inicio del tratamiento oncológico. La PF es un campo multidisciplinario que requiere la colaboración y la coordinación del equipo de Oncología y el equipo de Reproducción Humana.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.