El cáncer de mama constituye un grupo heterogéneo de tumores. La positividad para receptores de estrógenos se ha considerado como un factor de buen pronóstico. Este concepto ha ido cambiando con el estudio de series mayores y seguimientos más largos. El objetivo de esta revisión ha sido evaluar el patrón de recidiva de estos tumores con tiempos de seguimiento más largos.
Materiales y métodosSe llevó a cabo un estudio de revisión de casos en el que se compararon las recidivas entre tumores hormonodependientes y hormonoindependientes. Se evaluaron los casos de recidiva, local y sistémica, diagnosticados entre 1996 y 2010, con un total de 88 casos. La distribución de los casos fue: a) 65 de tumores hormonodependientes; b) 20 de tumores hormonoindependientes, y c) 3 desconocidos. El 99% de los pacientes con tumores con receptores de estrógenos positivos realizó tratamiento endocrino adyuvante.
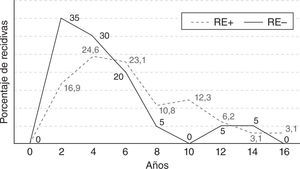
ResultadosEl patrón de recidiva de los tumores hormonoindependientes empezó con un pico a los 2 años, y después disminuyó de forma abrupta. Este patrón difirió de los hormonodependientes, con un pico de recidiva entre el tercer y el sexto año, y posteriormente disminuyó de forma gradual durante seguimientos más largos (15–20 años). La regresión logística con la variable dependiente “sin recidiva a los 5 años” mostró una asociación con el tamaño del tumor (p=0,029) y la positividad para receptores de estrógeno (p=0,05). No hubo relación para las restantes variables incluidas en el modelo (edad, menopausia, afectación ganglionar, clasificación TNM).
ConclusiónEstos datos confirman un patrón de recidiva diferente en los 2 grupos estudiados. Los carcinomas hormonodependientes tuvieron un riesgo de recidiva más elevado, alrededor de los 4–6 años, y posteriormente una disminución gradual. Por el contrario, en sólo el 16,8% de los tumores hormonoindependientes hubo recidiva después de los primeros 5 años de seguimiento.
Breast cancer is a heterogeneous group of tumours. The oestrogen receptor positivity was seen as a good prognostic factor for recurrence and survival. This concept has changed with studies with longer follow-up and larger series. It is believed that this effect of better prognosis in hormone-dependent tumours is lost after the first five years of monitoring.
Materials and methodsA case review study comparing recurrence between hormonedependent tumours and tumours with negative oestrogen receptors was undertaken. We evaluated the cases of recurrence, local and systemic, diagnosed between 1996 and 2010, totalling 88 cases. Sixty-five cases were oestrogen receptor positive, 20 cases oestrogen receptor negative, and 3 cases unknown. Almost all (99%) patients with oestrogen receptor positive tumours received adjuvant hormone therapy.
ResultsThe pattern of recurrence in negative estrogen receptors tumors began with an initial peak at 2 years, then steadily decreasing. This pattern differed from the hormonedependent tumours, with a peak incidence of recurrence between the third and sixth years, and then gradually decreasing over longer follow-ups (15 to 20 years). Logistic regression with the dependent variable “without recurrence at 5 years follow-up” showed an association between tumour size (p=.029) and hormone-dependency (p=.05). No relationship was found in the remaining variables of the model (age, menopausal status, lymph node involvement, TNM classification).
ConclusionThese data confirm a different pattern of recurrence in both groups. Hormone-dependent carcinomas had a higher risk of recurrence at about 4 to 6 years and then gradually decreased. By contrast, only 16.8% of negative oestrogen receptors tumours had a recurrence after the first 5 years of follow-up.
El cáncer de mama es la neoplasia más frecuente entre las mujeres del mundo occidental. Constituye una entidad muy heterogénea que se clasifica según los tipos histológicos, las características biológicas o a partir de su perfil genético. Cada subgrupo aporta comportamientos, respuestas terapéuticas y pronósticos diferentes.
Los criterios clínicos pronósticos más influyentes son: la afectación ganglionar, el tamaño del tumor y los índices de proliferación celular1. La determinación de la expresión de los receptores hormonales y la sobreexpresión del receptor del factor de crecimiento epidérmico humano 2 (HER-2/ neu) se realizan de forma sistemática en la práctica clínica y continúan siendo la piedra angular para la decisión del tratamiento sistémico adyuvante2. Los avances recientes empiezan a mostrar resultados prometedores en cuanto a la aplicación de los microarrays para definir perfiles genéticos de subgrupos de tumores con pronósticos distintos3.
La expresión del receptor de estrógeno (RE+) o su ausencia (RE—) divide el cáncer de mama en 2 grandes grupos. Esta división se confirma por estudios que dividen los tumores en: a) luminal A, con fuerte expresión de los receptores hormonales, y b) basales, sin expresión4, estando el estado del RE relacionado con vías de expresión genética diferentes5.
En cuanto al comportamiento clínico, la positividad de los receptores de estrógeno se ha considerado factor de buen pronóstico respecto a las recidivas y a la supervivencia6,7. Este concepto ha cambiado con observaciones posteriores, con seguimientos más largos y casuísticas mayores8. Se cree que este efecto de mejor pronóstico inicial de los tumores hormonodependientes se pierde después de los primeros 3–5 años de seguimiento9,10.
Tampoco se ha encontrado asociación con el estado de los receptores hormonales y la supervivencia en mujeres con tumores de 1 o menos centímetros y con axila negativa11. Se evaluó el riesgo de recidiva en seguimientos de 8 años, en la que se compararon 235 casos con RE— y 1.024 con RE+. Probablemente, y de una forma global, estos resultados se explican en parte por el buen pronóstico de estos tumores en estadio I.
En un estudio prospectivo, en el que se compararon los tumores RE+ y RE— en 647 pacientes respecto a la tasa de recidiva y patrón corporal de implantación órgano-específico, se comprobó que los tumores RE— tienen una recidiva mayor en los primeros 2 años, pero esta tendencia se perdía posteriormente. En cuanto a la localización, recidivaban preferencialmente en las vísceras, en contraposición con los tumores RE+ que desarrollaban metástasis en el hueso12.
Nos hemos propuesto un estudio de revisión de casos, mediante la comparación de las recidivas entre tumores RE+ y RE—. El objetivo de esta revisión ha sido evaluar el patrón de recidiva y su relación temporal cuando se comparan estos dos grupos de tumores. Como segundo objetivo, hemos evaluado el tipo de recidiva y su diagnóstico.
Materiales y métodosSe evaluaron 88 casos de recidiva, local y sistémica, diagnosticados en nuestra consulta entre 1996 y 2010. El seguimiento medio de la serie fue de 11,2 años (2–21 años). Se consideró recidiva local la ocurrida en el mismo cuadrante de la mama operada, en la cicatriz de mastectomía o ganglionar.
Los tumores con más del 10% de positividad para RE se clasificaron como RE+. La distribución de los casos fue: 65 casos RE+ (73,9%), 20 casos RE– (22,7%) y 3 casos desconocido (3,4%).
Se estudiaron las variables siguientes: edad, estado hormonal, tamaño tumoral, grado histológico, estado axilar, clasificación TNM, tiempo de recidiva, tipo de recidiva y su diagnóstico.
El protocolo de seguimiento en nuestra institución consistió en un examen clínico y marcadores tumorales (CEA y CA15-3) cada 4 meses durante los primeros 2 años, y después semestralmente hasta los 5 años. Se realizó anualmente una mamografía, una ecografía de mama y hepática, así como una radiografía de tórax durante los primeros 5 años. Transcurridos los 5 años, se realizó consulta anual con examen físico, mamografía, ultrasonido mamario y marcadores tumorales. Otras pruebas se efectuaron a partir de los síntomas presentados.
Se recomendaron los tratamientos adyuvantes de forma individualizada tras discusión en el comité de senología. El tratamiento endocrino se administró en el 99% de los casos RE+ (64/65), mediante tamoxifeno en 53 mujeres, tamoxifeno y análogos de la hormona liberadora de la hormona luteinizante en 4 casos, inhibidores selectivos de la aromatasa (IA) en 5 casos y 2 casos mediante tratamiento secuencial con tamoxifeno/IA. Una mujer se negó a recibir tratamiento hormonal.
Para el análisis estadístico se utilizó el programa SPSS versión 19. Se utilizaron modelos de regresión; para las variables continuas, se optó por los tests paramétricos (t de Student) y no paramétricos (Wilcoxon-Mann-Whitney, Kruskal-Wallis), y para las variables discretas se utilizó el test de la χ2, siempre que se cumpliesen los criterios de Cochran.
ResultadosEn nuestra unidad se diagnosticó a 88 pacientes con recidiva entre 1996 y 2010, 65 casos de RE+ (73,9%), 20 casos de RE— (22,7%) y 3 casos (3,4%) con receptores desconocidos.
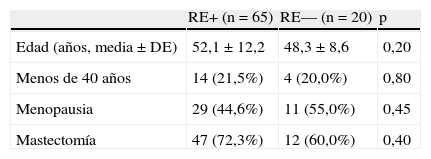
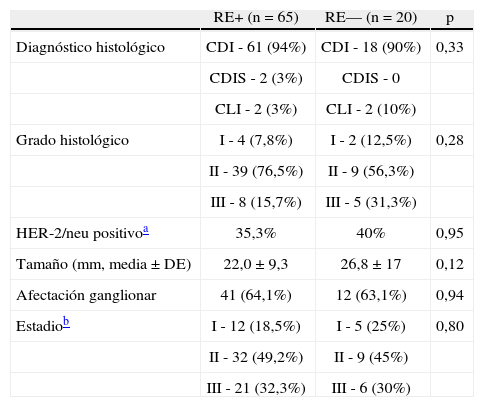
En la tabla 1 se detallan las características de estas pacientes. No se encontraron diferencias estadísticas entre las 2 poblaciones en las variables estudiadas. Las características de los tumores se exponen en la tabla 2, sin que se hayan encontrado diferencias significativas en las variables estudiadas entre los 2 grupos.
Características clínicas de las pacientes en función del estado de los receptores hormonales
| RE+ (n=65) | RE— (n=20) | p | |
| Edad (años, media ± DE) | 52,1±12,2 | 48,3±8,6 | 0,20 |
| Menos de 40 años | 14 (21,5%) | 4 (20,0%) | 0,80 |
| Menopausia | 29 (44,6%) | 11 (55,0%) | 0,45 |
| Mastectomía | 47 (72,3%) | 12 (60,0%) | 0,40 |
DE: desviación estándar; RE: receptor de estrógeno.
Características histopatológicas de los tumores y estadificación en función del estado de los receptores hormonales
| RE+ (n=65) | RE— (n=20) | p | |
| Diagnóstico histológico | CDI - 61 (94%) | CDI - 18 (90%) | 0,33 |
| CDIS - 2 (3%) | CDIS - 0 | ||
| CLI - 2 (3%) | CLI - 2 (10%) | ||
| Grado histológico | I - 4 (7,8%) | I - 2 (12,5%) | 0,28 |
| II - 39 (76,5%) | II - 9 (56,3%) | ||
| III - 8 (15,7%) | III - 5 (31,3%) | ||
| HER-2/neu positivoa | 35,3% | 40% | 0,95 |
| Tamaño (mm, media ± DE) | 22,0±9,3 | 26,8±17 | 0,12 |
| Afectación ganglionar | 41 (64,1%) | 12 (63,1%) | 0,94 |
| Estadiob | I - 12 (18,5%) | I - 5 (25%) | 0,80 |
| II - 32 (49,2%) | II - 9 (45%) | ||
| III - 21 (32,3%) | III - 6 (30%) |
CDI: carcinoma ductal invasivo; CDIS: carcinoma ductal in situ; CLI: carcinoma lobulillar invasivo; DE: desviación estándar; HER-2/neu: receptor del factor de crecimiento epidérmico humano 2; RE: receptor de estrógeno; TNM: tumor, nudo linfático, metástasis.
Como tratamiento adyuvante, 63 mujeres (71,6%) recibieron quimioterapia en neoadyuvancia o adyuvancia; a 46 (52,3%) se les administró radioterapia, y a 66 (75%), hormonoterapia. En un caso más reciente con sobreexpresión HER-2/neu, se administró trastuzumab.
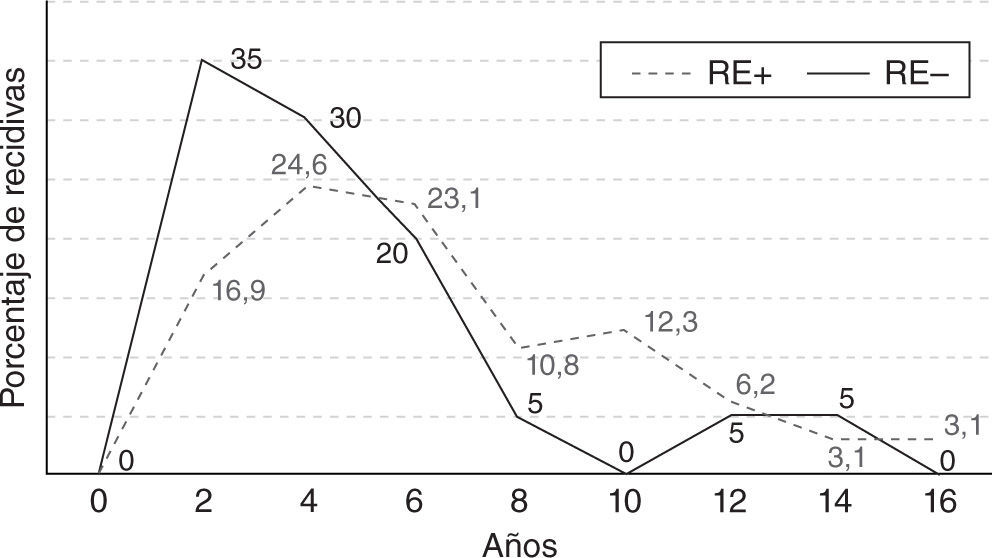
En la figura 1 se muestra el patrón de recidiva para los tumores RE— y RE+. En los primeros existe un pico inicial a los 2 años, que después disminuye de forma constante. En contraposición, este patrón difiere en los tumores RE+, con un pico de la incidencia de recidiva entre el tercer y sexto años, y posteriormente disminuye de forma lenta a lo largo del tiempo (15–20 años).
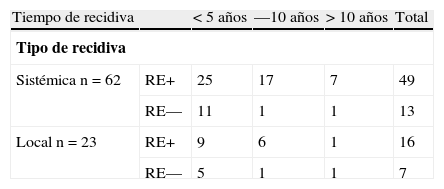
Los casos con recidiva después de los 5 años fueron de 32 pacientes (49%) en el grupo RE+ y de 3 (15%) en el grupo RE— (p=0,016). La mediana del tiempo de recidiva ha sido de 5 años (3–8 años, primer y tercer cuartil) y de 4 años (1,6 y 5 años), respectivamente, para los 2 grupos (p=0,03). Estos distintos patrones de recidiva —encontrados en función del estado de los receptores hormonales— se mantienen al analizar por separado las recidivas locales y sistémicas (tabla 3).
La regresión logística con la variable dependiente “sin recidiva a los 5 años de seguimiento” mostró una asociación entre el tamaño del tumor (p=0,04) y RE+ (p=0,04), lo cual indicaba que el riesgo de recidiva a los 5 años es 4 veces superior en el grupo RE— comparado con el grupo RE+. No hubo relación para las restantes variables incluidas en el modelo (edad y afectación ganglionar).
La primera localización de recidiva en los carcinomas mamarios RE+ fue local en 16 casos (24,6%), visceral en 26 (40%), ósea en 16 (24,6%) y ósea y visceral en 7 casos (10,8%). Además, estos porcentajes han sido similares en los carcinomas RE— (del 35, el 35, el 20 y el 10%, respectivamente). El tiempo medio de supervivencia después del diagnóstico de recidiva fue de 12 meses para las recidivas viscerales y de 31 meses para las recidivas óseas (p=0,03).
En lo que respecta a la forma de diagnóstico, la recidiva se diagnosticó en el 48,8% de los casos después de síntomas referidos en la consulta. En los casos restantes, este diagnóstico se alcanzó después de realizar exámenes de seguimiento en mujeres asintomáticas y no se encontró diferencias en la forma de diagnóstico entre los dos grupos.
En 25 casos hubo un incremento en los marcadores tumorales que llevó al diagnóstico. Los marcadores tumorales estaban aumentados en el 62,7% de los 83 casos con marcadores conocidos. Este incremento se relacionó con el tipo de recidiva, que fue más frecuente en los casos con recidiva sistémica (46/60) por contraposición a los casos con recidiva local (6/23) (el 26,1 frente al 76,7%; p<0,0001). No se encontraron diferencias en los valores de CEA y CA 15-3 entre las recidivas viscerales y óseas.
DiscusiónNuestros datos muestran un patrón de recidiva diferente en los dos grupos estudiados. Los carcinomas RE+ tienen un riesgo de recidiva más elevado alrededor de los 4–6 años, y posteriormente muestran una disminución gradual. En contraposición, la gran mayoría de las recidivas en los tumores RE— se desarrollaron en los primeros 3 años, y en sólo el 16,8%, después de los primeros 5 años de seguimiento. En nuestra casuística, el tiempo de recidiva se distribuyó en forma de un pico temprano para los tumores RE— y un pico menos importante y más tardío para los tumores RE+. El 99% de las mujeres RE+ realizaron tratamiento endocrino durante 5 años, lo que también puede contribuir a explicar la relativa protección de la aparición de recidiva en los primeros años de seguimiento en este grupo.
No encontramos una curva bimodal como la descrita en el estudio prospectivo con 2.825 pacientes RE+ y RE— sometidas a cirugía conservadora13. En este trabajo, el riesgo de recidiva sistémica y local a lo largo del tiempo mostró un patrón bimodal para ambos grupos (RE+ y RE—), con un primer pico alrededor del segundo año de seguimiento, más importante en los tumores RE—, y un segundo pico menos importante después de los 5 años. En cambio, la cronología de la mortalidad mostró un pico abrupto para RE— a los 3 años y un pico menos acentuado para los RE+ entre los 5 y los 6 años con un decrecimiento gradual. A pesar de estas diferencias, este estudio tampoco encontró diferencias en el porcentaje de recidiva local ipsolateral, metástasis a distancia y supervivencia cuando se prolongaba el tiempo de seguimiento hasta los 10 años. En otro estudio epidemiológico, en el que se incluyó a un elevadísimo número de pacientes con cáncer seguidas durante 11 años, se ha corroborado esta versión, admitiendo que el riesgo de mortalidad para los tumores RE+ y RE— es distinto y no es proporcional a lo largo del tiempo. Para los tumores RE— el riesgo alcanza su pico máximo de 7,5% al año a los 17 meses, con un declive progresivo posteriormente. Por su parte, los carcinomas RE+ carecen de un pico tan importante obedeciendo a un riesgo relativamente constante de entre el 1,5 y el 2% al año. La disminución del riesgo en los tumores RE— y la tasa de mortalidad constante en los RE+ se cruzan a los 7 años, resultando en un mejor pronóstico para los tumores RE— más tarde14.
Este patrón de recidiva más temprana de los tumores RE— es notorio al separar las recidivas sistémicas. La diferencia entre tumores RE— y RE+ se mantiene al hablar de las recidivas locales, pero no de forma tan acentuada.
En un trabajo prospectivo se han analizado las recidivas en 771 pacientes mastectomizadas comparando tumores RE+ y RE—15. Los resultados confirmaron una recidiva local y sistémica semejante entre ambos grupos, pero las curvas de mortalidad mostraron patrones distintos para los tumores RE+ y RE—. Así, se observó que los RE— tendrían un pico de mortalidad a los 3 años y los RE+ una curva con un pico máximo a los 5 años seguida de un decrecimiento progresivo y lento después. En lo que respecta al número de casos con recidiva local, metástasis a distancia y mortalidad en los 2 grupos15,16, a los 15 años esta serie no mostró una diferencia estadísticamente significativa. Los autores interpretan estos datos explicando que los tumores RE— recidivan con metástasis viscerales, rápidamente letales. Por el contrario, los tumores RE+ recidivan con un patrón similar, pero con metástasis óseas, que tendrían un mayor tiempo de supervivencia y con la posibilidad de tratamiento hormonal17,18. En nuestra casuística, las recidivas viscerales han tenido un tiempo medio de supervivencia inferior al de las metástasis óseas. Aunque es pequeña, en nuestra serie no se hallaron diferencias en un patrón corporal de implantación específico del órgano entre los 2 grupos.
En un estudio retrospectivo de 439 mujeres con recidiva de carcinoma de mama, se observó que las variables independientes relacionadas con un menor tiempo de sobrevida después de la primera recidiva fueron: la localización de la recidiva, el estado de las axilas, el tiempo libre de enfermedad y el estado de los receptores hormonales19.
Estos resultados corroboran la evidencia de que el cáncer de mama es una enfermedad heterogénea y que los tumores RE+ son una entidad distinta de los RE—. Se podría pensar en los carcinomas RE+ más bien como una enfermedad crónica que podría beneficiarse de tratamientos con hormonoterapia en esquemas prolongados y secuenciales. Esto se ha demostrado en pacientes con ganglios positivos, en los cuales se produce un aumento en la supervivencia con tratamiento hormonal extendido de tamoxifeno seguido de letrozol20.
Independientemente del tipo de curva de tiempo de recidiva —bimodal o un solo pico—, lo que es similar en todas las series estudiadas, incluida nuestra revisión, es la recidiva más temprana de los tumores RE—, en oposición al patrón de los RE+ con un pico menos importante entre los 4 y 6 años, pero con recidivas durante más de 15 años de seguimiento.
El diagnóstico temprano de la recidiva no se asocia a una mejoría en la supervivencia, aunque la introducción de nuevos tratamientos en el cáncer de mama puede cambiar este paradigma. En nuestra revisión, más del 50% de los casos de recidiva se diagnosticaron en mujeres asintomáticas. Conocer mejor el patrón de recidiva de los diferentes subgrupos de carcinoma mamario puede ayudar a establecer protocolos de seguimiento individualizados, con una mejor relación costebeneficio. Estos datos podrían apoyar pautas personalizadas de seguimiento de la mujer tratada por cáncer de mama, utilizando la misma filosofía que para las pautas de tratamiento. Así, por ejemplo, manteniendo un control más intensivo en los primeros 3 años en tumores RE— y entre los 4 y los 6 años en los RE+. En el futuro, y con mayor casuística, sería importante incluir en esta evaluación el subtipo de los cánceres de mama que sobreexpresan HER-2/neu.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.