La clasificación molecular del cáncer de mama ha permitido predecir su comportamiento biológico, proporcionando información de importancia diagnóstica y terapéutica.
El desarrollo de esquemas específicos en terapia primaria sistémica ha aumentado el porcentaje de cirugías conservadoras, manteniendo unas tasas de supervivencia libre de enfermedad y supervivencia global equivalentes a las de la terapia adyuvante.
En este ámbito, la resonancia magnética mamaria se ha consolidado como la técnica de imagen de elección para la valoración de la respuesta del cáncer de mama tratado con terapia primaria sistémica, presentando una buena correlación radiopatológica y con capacidad para discriminar diferentes niveles de respuesta en función del perfil molecular.
Molecular classification of breast cancer has allowed us to predict its biological behaviour, providing important diagnostic and therapeutic information.
The development of specific treatments in primary systemic therapy has increased the percentage of conservative surgery, with disease-free survival and overall survival rates equivalent to adjuvant therapy.
In this setting, breast magnetic resonance imaging has become the imaging modality of choice to evaluate the response of breast cancer treated with primary systemic therapy. This technique has a good radiologic-pathologic correlation and allows discrimination of different types of response according to the molecular profile.
El cáncer de mama (CM) se clasifica en la actualidad según sus características genéticas o moleculares en 3 grandes grupos con implicaciones pronósticas y terapéuticas diferentes1.
El papel de la resonancia magnética (RM) en el diagnóstico y estadificación del CM, en la planificación del tratamiento quirúrgico y en el cribado de las pacientes de alto riesgo está bien establecido.
Además de estas indicaciones, hay que resaltar dentro de las recomendaciones para el uso de RM mamaria de la Sociedad Europea de Especialistas en Cáncer de Mama la valoración de la respuesta a la terapia primaria sistémica (TPS) como una de las más aceptadas, con un nivel de evidencia tipo 1 y un grado de recomendación A2.
El avance tecnológico de la RM ha permitido que la imagen diagnóstica se aproxime a la imagen molecular, que constituye el punto de partida para la elección de la TPS.
Los radiólogos que formamos parte de las unidades de mama trabajamos con las técnicas de imagen teniendo en cuenta los subtipos tumorales. De este modo, avanzamos en el conocimiento predictivo y pronóstico de la RM en la valoración de la respuesta a la TPS.
Los objetivos docentes son:
- 1
Analizar el papel de la RM en valorar la respuesta a TPS.
- 2
Conocer la respuesta del CM según el perfil inmunohistoquímico (IHQ).
Los subtipos moleculares se definen con base en las características genéticas mediante el estudio de «microarrays». El análisis de los perfiles de expresión génica se considera en la actualidad la mejor forma de clasificar el CM; sin embargo, en la mayoría de los centros su uso se encuentra limitado, al ser una técnica cara y de difícil aplicación. Diversos estudios evidencian que con un número limitado de marcadores IHQ, disponibles en la mayoría de los servicios de Anatomía Patológica, se puede catalogar el CM en subtipos equivalentes a los basados en perfiles de expresión génica. Por este motivo, la clasificación del CM mediante características IHQ ha sido aceptada como una alternativa útil al análisis genético3.
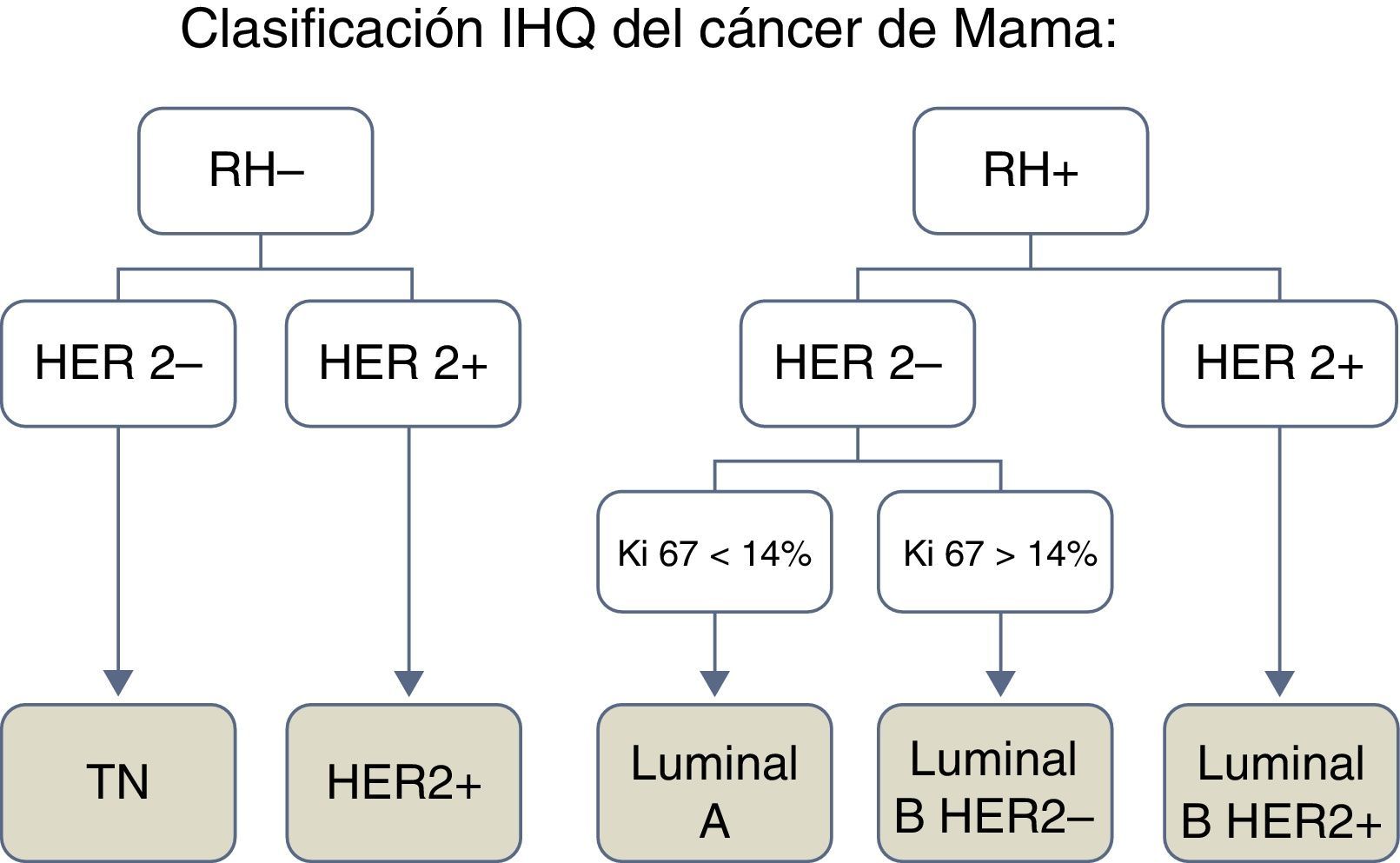
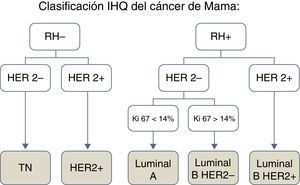
En función de las características IHQ se distinguen los siguientes subtipos de CM: luminal, HER2+ y triple negativo (TN) (fig. 1).
El subtipo luminal se caracteriza por la expresión de receptores hormonales, estrogénicos o de progesterona; el subtipo HER2+, por expresar el receptor 2 del factor de crecimiento epidérmico humano y presentar receptores hormonales negativos, y el subtipo TN, no expresa receptores hormonales ni HER2. Por otro lado, el tipo luminal se subdivide en función del índice de proliferación celular Ki-67 y de la expresión HER2 en luminal A (HER2− y Ki-67<14%), luminal B HER2− (HER2− y Ki-67>14%) y luminal B HER2+ (HER2+, independiente del Ki-67)3.
Estos subtipos IHQ presentan unas determinadas características por RM. El subtipo tumoral y el patrón de respuesta a la TPS influyen en la precisión de la RM para valorar el tumor residual4.
El subtipo HER2 ha revolucionado su pronóstico desde la incorporación de los anticuerpos monoclonales y presenta con frecuencia una respuesta completa radiológica y patológica5.
El subtipo TN suele presentar realce tipo masa y un patrón morfológico de respuesta tipo reducción concéntrica. Son tumores que responden bien a la TPS, sin embargo, hay que conocer la denominada paradoja de los tumores TN, de manera que a pesar de ser un subtipo con alta quimiosensibilidad, constituyen un grupo de mal pronóstico, a expensas de los casos no respondedores6.
El subtipo luminal se presenta frecuentemente como un realce tipo no masa. Es el subtipo que muestra un patrón de respuesta tipo fragmentación con mayor frecuencia. Son tumores poco respondedores a TPS y en este grupo la respuesta completa patológica no es un buen indicador pronóstico7.
Terapia primaria sistémicaEl desarrollo de la TPS ha conseguido grandes avances en el CM localmente avanzado:
- 1.
Aumentar la tasa de cirugía conservadora mamaria.
- 2.
Aumentar la supervivencia libre de enfermedad.
- 3.
Desarrollar esquemas terapéuticos más eficaces e individualizados basándose en la expresión de determinados marcadores biológicos y genéticos.
- 4.
Evaluar in vivo la quimiosensibilidad tumoral, siendo la respuesta radiológica completa un indicador de supervivencia libre de enfermedad.
Además, determinados subtipos se benefician de terapias específicas. La sobreexpresión del oncogén HER2+ permite el tratamiento con anticuerpos monoclonales dirigidos frente al mismo. Los tumores que presentan receptores estrogénicos y/o de progesterona se benefician de tratamiento hormonal. Estas terapias específicas consiguen una mejor respuesta al tratamiento neoadyuvante y han mejorado la supervivencia libre de enfermedad.
En casos de mala respuesta a la TPS es recomendable reevaluar el perfil IHQ, ya que se han descrito variaciones secundarias al tratamiento neoadyuvante. En los casos en los que se confirme la variación del perfil IHQ, la reorientación de la terapia sistémica puede mejorar la respuesta tumoral8,9.
Evaluación de la respuesta a terapia primaria sistémicaLa RM se ha incorporado progresivamente en la práctica clínica de la radiología mamaria y su papel en la monitorización de la respuesta radiológica a la TPS está bien establecido y documentado. Dentro de las recomendaciones para el uso de RM mamaria de la Sociedad Europea de Especialistas en Cáncer de Mama, la valoración de la respuesta a la TPS constituye una de las indicaciones más aceptadas, con un nivel de evidencia tipo 1 y un grado de recomendación A2. En el caso de pacientes candidatas a mastectomía según criterios clínicos o establecidos en la RM de estadificación, el estudio de RM pos-TPS es opcional, puesto que no modifica la indicación quirúrgica.
El examen clínico y las técnicas de imagen convencionales (mamografía y ecografía) son métodos reconocidos para cuantificar la respuesta tumoral; sin embargo, la mayoría de los autores describen una mayor correlación radiopatológica en la valoración del tamaño tumoral mediante RM.
En la práctica habitual se realiza un estudio mamográfico al finalizar la TPS para valorar la respuesta tumoral y la localización del marcador, siendo importante la identificación de microcalcificaciones residuales que pueden traducir cambios pos-TPS o carcinoma in situ y que no siempre se valoran correctamente mediante RM. La ecografía también tiene un papel importante en el contexto de la TPS, siendo la técnica empleada para la monitorización del tamaño tumoral durante los ciclos intermedios. Algunos estudios refieren una precisión similar en la valoración del tamaño tumoral tras TPS en ecografía y RM10.
La RM nos permite una valoración más exacta de la respuesta al tratamiento neoadyuvante y de la extensión tumoral pos-TPS, siendo este dato esencial para planificar el tratamiento más adecuado, aumentado el porcentaje de pacientes que pueden beneficiarse de una cirugía conservadora10–12.
El protocolo básico de RM debe incluir unas secuencias que permitan una correcta resolución temporoespacial para estudiar las características morfológicas y funcionales y calcular la diferencia del tamaño tumoral de los estudios pos-TPS respecto al realizado pre-TPS.
Protocolo de RM mamariaLas pacientes son estudiadas en posición de decúbito prono para minimizar los artefactos respiratorios, utilizando una antena de superficie específica.
Las secuencias básicas son:
- 1.
Secuencia FSE potenciada en T2 con o sin supresión grasa precontraste. Nos aporta información morfológica.
- 2.
Estudio dinámico 3D eco de gradiente con supresión grasa:
- a
Secuencia potenciada en T1 basal.
- b
Seis secuencias tras administrar contraste, con una cadencia aproximada de minuto por secuencia: dosis de 0,1-0,2mmol/Kg de Gd-DTPA a través de una vía intravenosa, a una velocidad de 2,5-3ml/seg, seguida de un bolo de suero salino de 20ml.
- a
- 3.
Secuencia difusión (SE-EPI) que se puede obtener con diferentes factores de corrección, b=500, 600 y 1.000.
Posteriormente se realiza el posprocesado en la estación de trabajo, que incluye:
- 1
Imágenes en sustracción: se obtienen al restar las secuencias poscontraste de la secuencia sin contraste. Permite valorar únicamente las áreas de realce.
- 2
Proyecciones de máxima intensidad.
- 3
Reconstrucción multiplanar: son importantes para obtener imágenes tridimensionales siguiendo la arquitectura del lóbulo mamario.
- 4
Curvas funcionales o de relación de intensidad de señal en el tiempo: determinan información cuantitativa y cualitativa de la variación en el tiempo de la intensidad de realce de las lesiones.
- 5
Cálculo del coeficiente de difusión aparente (CDA) y del porcentaje de restricción a la difusión. Aporta una valoración cuantitativa del grado de restricción a la difusión de la lesión tumoral.
Se valoran criterios morfológicos y funcionales de acuerdo con la clasificación BI-RADS.
Respuesta radiológicaPara valorar la respuesta radiológica a la TPS se calcula la diferencia del tamaño tumoral del estudio pre-TPS de estadificación locorregional con el estudio pos-TPS realizado tras 10-15 días de haber finalizado la terapia sistémica. Las imágenes multiplanares nos ayudan a establecer el tamaño tumoral mayor en los 3 ejes del espacio. Es importante marcar el tumor antes de iniciar el tratamiento neoadyuvante con uno o 2 marcadores habitualmente con guía ecográfica (si son lesiones nodulares se suele usar uno central, y si son lesiones más extensas, se utilizan 2), para que en los casos con respuesta completa radiológica se pueda colocar un arpón localizador ante un tratamiento conservador de la mama12,13.
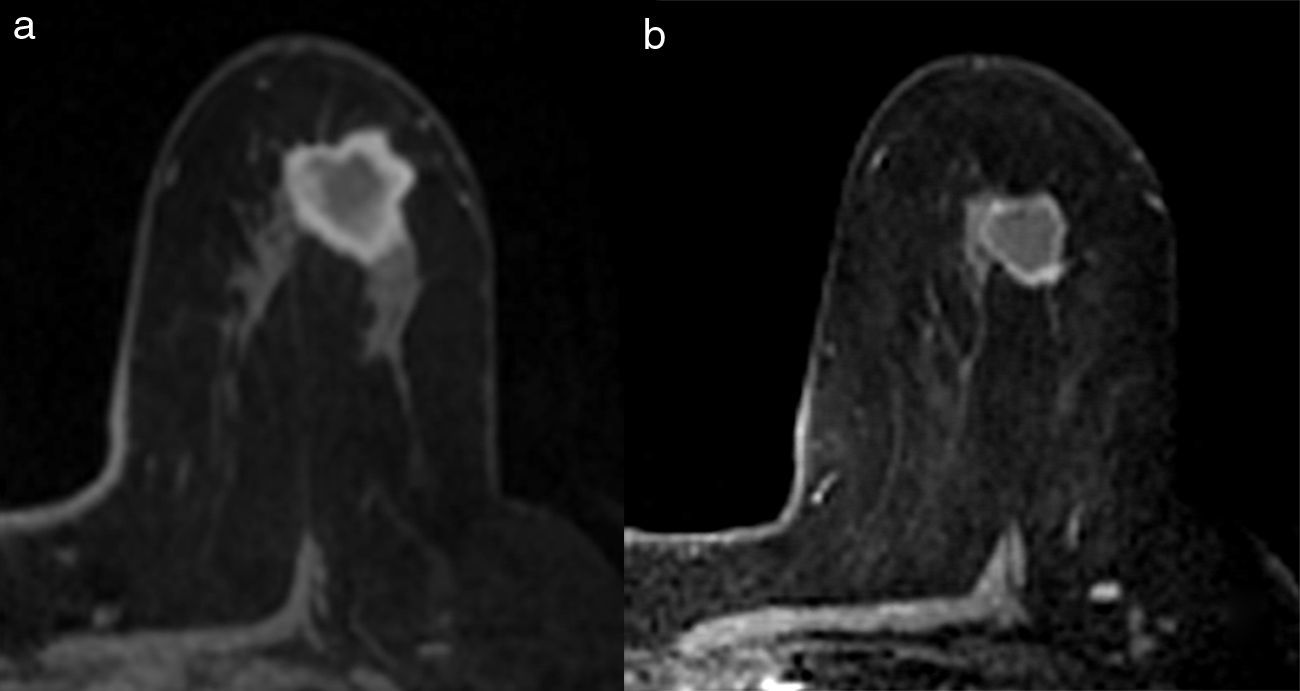
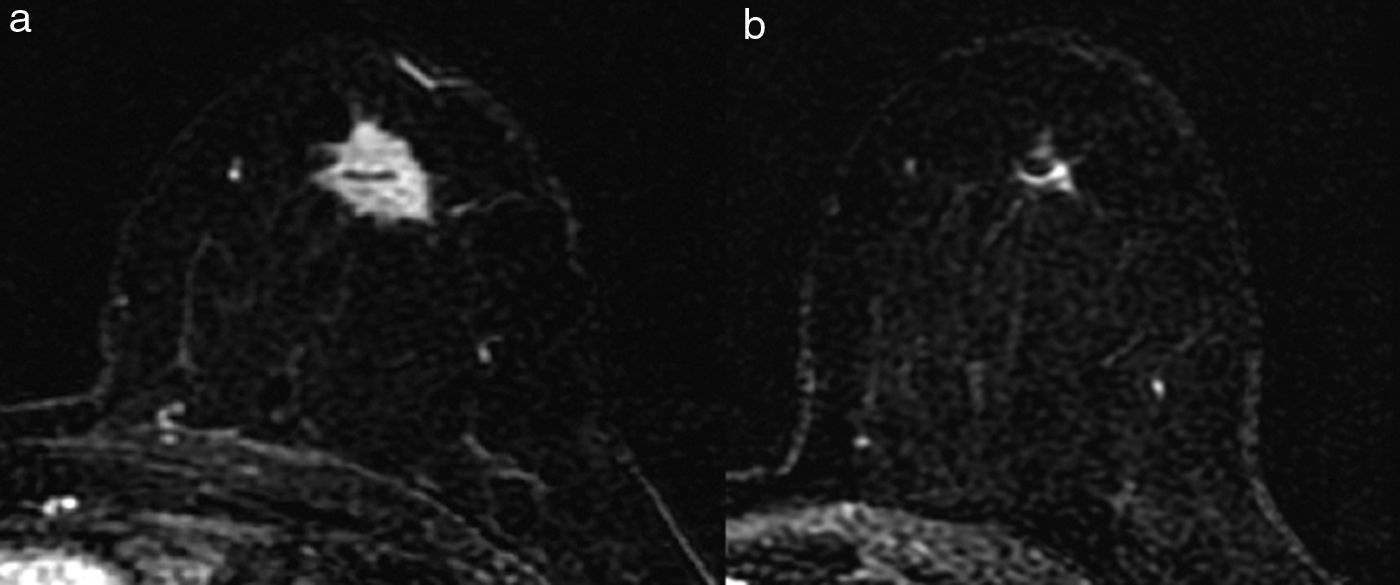
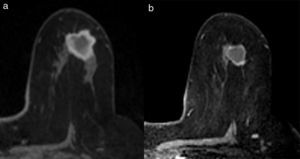
Existen diferentes escalas para establecer la respuesta radiológica (RECIST, OMS, etc.). En nuestro centro utilizamos los de la Unión Internacional de Control del Cáncer12, que distingue 4 tipos de respuesta radiológica local (figs. 2 y 3):
- 1.
No respuesta: sin cambios en el tamaño tumoral.
- 2.
Respuesta parcial menor: el tamaño tumoral disminuye menos del 50% del diámetro mayor.
- 3.
Respuesta parcial mayor: el tamaño tumoral disminuye más del 50% del diámetro mayor.
- 4.
Respuesta completa: desaparición de las lesiones y ausencia de áreas de realce patológicas.
Para valorar la respuesta radiológica se considera la disminución del diámetro tumoral mayor. Algunos autores defienden el uso de la reducción del volumen tumoral como parámetro de respuesta en la RM14–16. Sin embargo, la reducción del diámetro mayor es el parámetro que determina la planificación quirúrgica y la estadificación tumoral en la clasificación TNM.
Existe variabilidad en la literatura en cuanto a la definición de respuesta radiológica completa, considerando algunos trabajos la ausencia de realce, mientras que otros la definen como un realce igual o menor que el tejido glandular normal10.
Desde un punto de vista morfológico la respuesta se clasifica en 3 grupos:
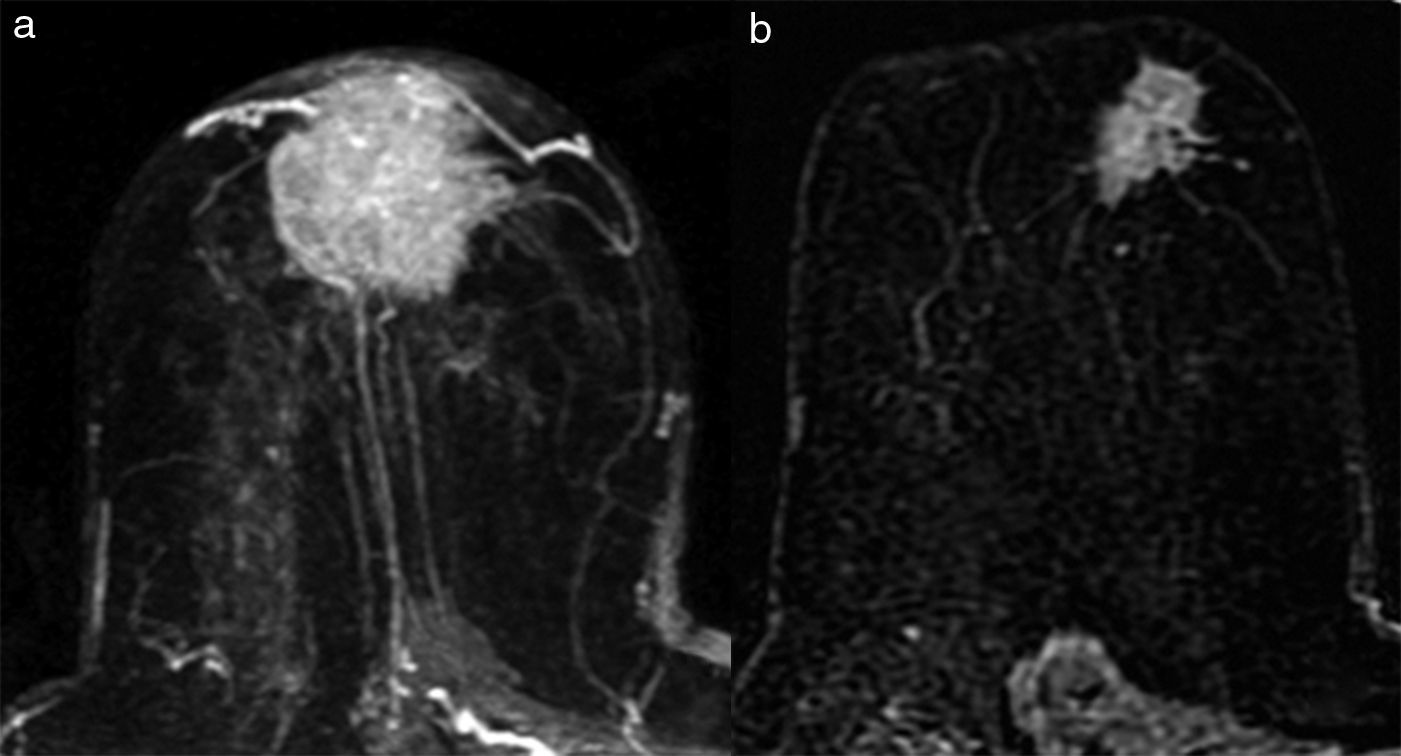
- 1.
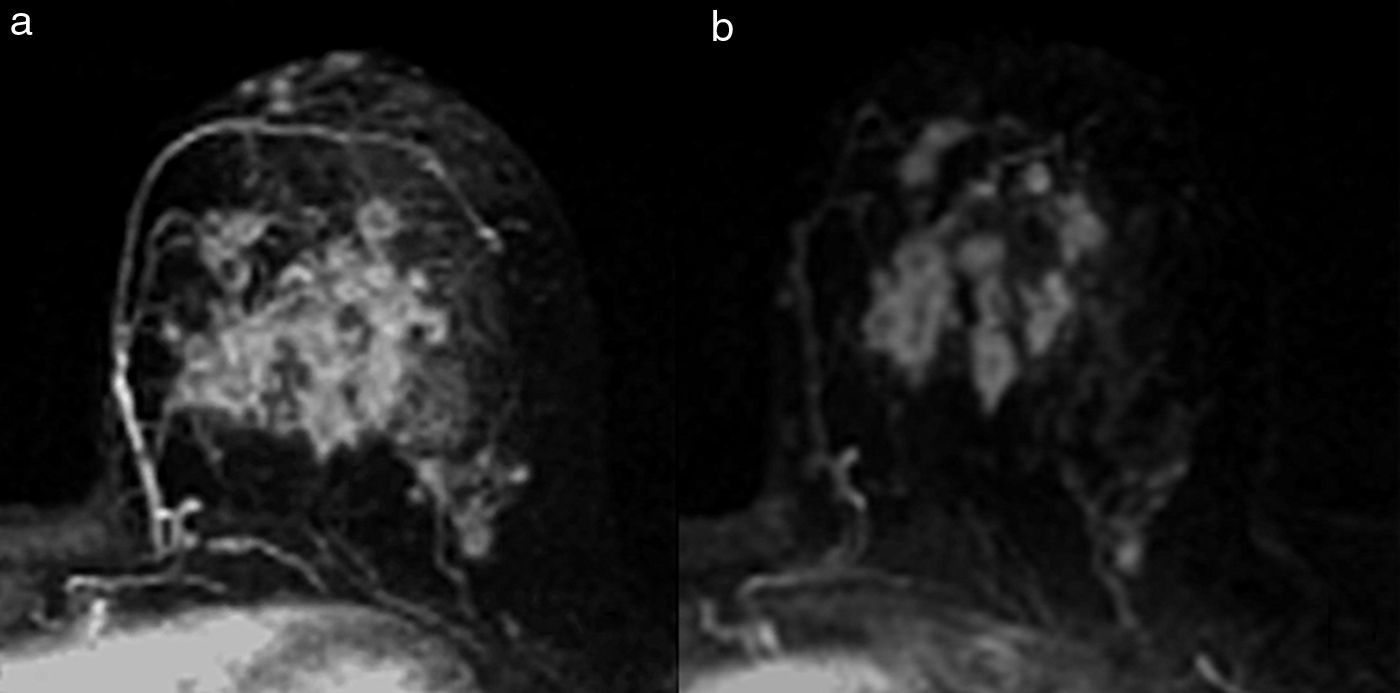
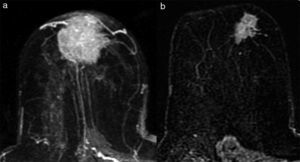
Tipo reducción concéntrica: la disminución del tamaño tumoral es circunferencial (el tumor disminuye de la periferia hacia el centro) (fig. 4).
- 2.
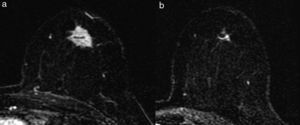
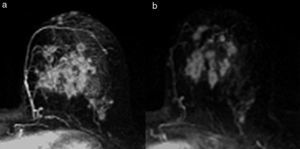
Tipo fragmentación: la tumoración presenta rotura o segmentación interna, sin variación del tamaño tumoral (fig. 5).
- 3.
Tipo mixto: se observan ambos patrones de respuesta.
El tipo reducción concéntrica lo observamos con mayor frecuencia en los carcinomas de estirpe ductal, y el tipo fragmentación, en los de estirpe lobulillar. El patrón de reducción concéntrica puede modificar la indicación de mastectomía a cirugía conservadora, mientras que el patrón de fragmentación con frecuencia obliga a realizar mastectomía si el tamaño de la lesión lo requería en la estadificación inicial.
Atendiendo al perfil IHQ, el CM muestra un tipo de realce y de respuesta característico17,18.
Respuesta patológicaPara medir la respuesta patológica debe utilizarse un protocolo estandarizado que indique el tamaño tumoral residual y el porcentaje de celularidad tumoral en la pieza quirúrgica. Los tumores de morfología muy irregular o fragmentados pueden dificultar la medición exacta del tamaño tumoral por parte del patólogo. Existen múltiples clasificaciones, entre las que destacan el sistema de Miller y Payne (fig. 6) y el de la carga tumoral residual (Residual Cancer Burden).
En la práctica clínica se utiliza con mayor frecuencia la escala de Miller Payne, que valora por separado la respuesta patológica local de la regional o ganglionar. A nivel local distingue 5 grados de respuesta patológica en función de la reducción de la celularidad tumoral invasiva y el estado ganglionar lo clasifica en 4 grupos19.
La clasificación del sistema de carga tumoral residual se desarrolló en 2007 por el MD Anderson Cancer Center. Se trata de un método que valora de manera cuantitativa la respuesta gracias a una fórmula disponible en la red con la que se obtiene un valor numérico que mide de manera conjunta la carga tumoral residual local y ganglionar. Se obtiene un resultado numérico que se extrapola a una escala cualitativa de 4 categorías20.
La respuesta patológica completa a la TPS ha demostrado asociar buenas tasas de supervivencia a largo plazo, y fue aceptada en 2012 por la FDA como un referente válido para la aprobación acelerada de fármacos en neoadyuvancia21. Sin embargo, entre el 60-85% de las pacientes no presenta respuestas patológicas completas, dependiendo la supervivencia en estos casos de la extensión tumoral residual y del pronóstico inicial22.
Precisión de la RMLa RM presenta una buena precisión diagnóstica en la valoración de la respuesta tumoral a la TPS, con una excelente correlación radiopatológica15. La realización de RM antes y después de la TPS, así como la toma de biopsias antes de la TPS y el análisis anatomopatológico de la pieza quirúrgica, han permitido evaluar la precisión de la RM.
Sin embargo, la RM también presenta sus limitaciones, y entre las causas más frecuentes de discordancia radiopatológica encontramos la existencia de falsos negativos: focos de carcinoma infiltrante menores de 5mm y tumores lobulillares o de estirpe no usual como los mucinosos; y de falsos positivos: focos o áreas de realce por carcinoma in situ (que plantean el diagnóstico diferencial con el carcinoma infiltrante) o cambios fibrosos pos-TPS; la presencia de tumores con subtipo luminal puede provocar tanto falsos negativos como falsos positivos23.
Avances en imagenEl futuro de la RM en la enfermedad mamaria señala a la técnica de difusión (DWI) como una secuencia que abre un horizonte en el estudio biológico y funcional del CM. Permite caracterizar y obtener información acerca de sus características histológicas (densidad celular, necrosis y mitosis).
La secuencia de difusión es un método no invasivo de gran utilidad para monitorizar la respuesta a la TPS y para evaluar la masa tumoral residual de forma precoz sin administrar contraste intravenoso.
El CDA permite cuantificar el grado de restricción a la libre difusión de las moléculas de agua en el tejido tumoral. Variaciones en el CDA ayudan a cuantificar la respuesta a la TPS por su efecto citolítico sobre las células tumorales, observando un aumento del CDA en los casos con buena respuesta. Sin embargo, ante una mala respuesta, la estabilidad del CDA constituye un parámetro adicional a favor de un cambio en la línea de tratamiento24,25.
La espectroscopia por RM y las constantes farmacocinéticas son técnicas que también aportan información sobre la respuesta tumoral precoz, sin embargo, en la práctica habitual su uso no está generalizado.
La espectroscopia por RM se utiliza para estudiar el metabolismo mamario, aportando información bioquímica tumoral a través del registro de las señales (picos) de los metabolitos en el área a estudiar. Permite detectar una respuesta precoz basándose en los cambios en la concentración de colina, como marcador de proliferación celular.
La valoración de las constantes farmacocinéticas puede predecir la respuesta tumoral al tratamiento neoadyuvante. En esta línea, distintos trabajos han demostrado que su modificación precoz se asocia con la respuesta tumoral al valorar cambios en los microvasos tumorales26.
Desde los comités de enfermedad mamaria los radiólogos trabajamos en el desarrollo de técnicas de imagen que nos permitan establecer unos biomarcadores consistentes y válidos que lleven a un manejo integrado del CM.
ConclusionesLa RM es la técnica de imagen más adecuada para monitorizar la respuesta tumoral a TPS.
La RM nos permite un mayor conocimiento morfológico y funcional de las características y patrones de respuesta de los subtipos IHQ del CM.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.