La carga tumoral total (CTT) obtenida del estudio OSNA de cada uno de los ganglios centinela ha sido identificada como el predictor más potente de metástasis en ganglios linfáticos axilares no centinela. Por otra parte, los distintos subtipos moleculares (SM) de cáncer de mama difieren entre ellos de forma significativa no solo en términos de incidencia, pronóstico y tratamiento, sino también respecto al patrón de afectación metastásica axilar. Nuestra hipótesis consiste en que la predicción de enfermedad metastásica en la linfadenectomía axilar puede mejorar aplicando un modelo predictivo basado en la CTT y el subtipo intrínseco del tumor.
ObjetivoEvaluar el impacto del SM subrogado inmunohistoquímicamente en la predicción metastásica de los ganglios axilares no centinela con base en la CTT.
Material y métodosEstudio retrospectivo, multicéntrico europeo, que incluye 683 pacientes procedentes de 9 hospitales.
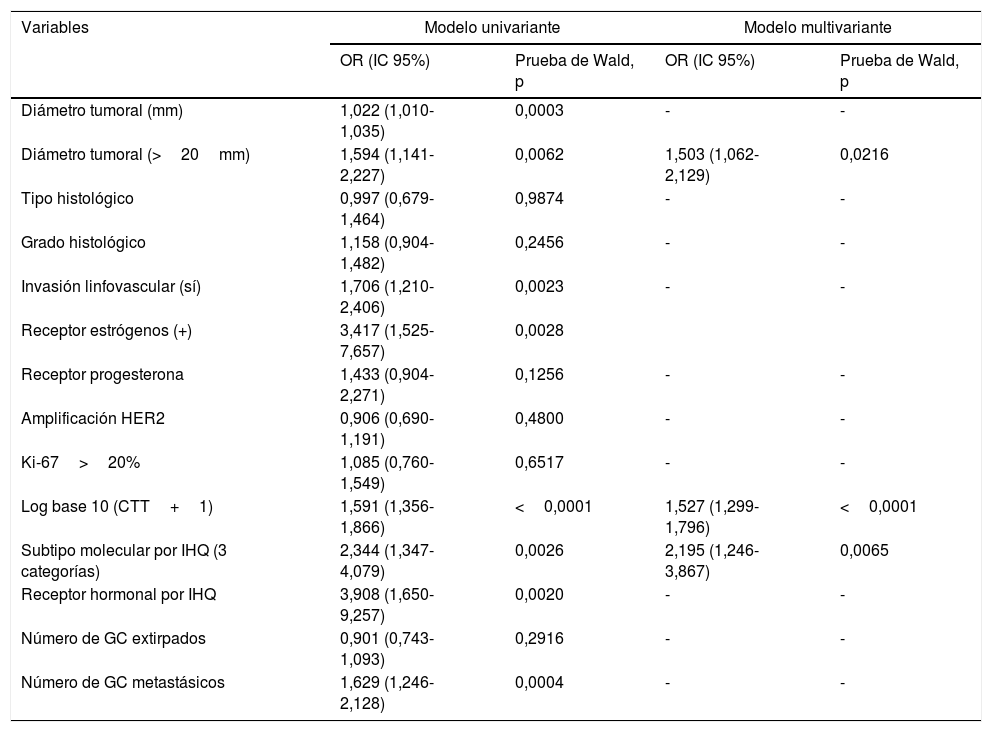
ResultadosEl análisis univariante identificó 6 variables independientes que correlacionan significativamente con la afectación metastásica axilar no centinela. De ellas, las variables valor logarítmico de la CTT, diámetro tumoral y SM diagnosticado por inmunohistoquímica fueron seleccionadas para el modelo multivariante. Las odds ratio estimadas por el modelo fueron valor logarítmico de la CTT 1.527 (IC 95% 1.299-1.796), diámetro tumoral 1.503 (IC 95% 1.062-2.129) y SM 2.195 (IC 95% 1.246-3.867).
ConclusionesEl SM, la CTT y el diámetro tumoral son los predictores más potentes de afectación axilar y deben ser incluidos en los algoritmos diagnósticos como variables esenciales para la toma de decisiones terapéuticas sobre la axila.
The total tumour load (TTL) obtained from OSNA study in each of the sentinel lymph nodes has been identified as the most powerful predictor of axillary non-sentinel lymph node metastasis. In addition, the distinct molecular subtypes (MS) of breast cancer differ significantly not only in terms of incidence, prognosis and treatment but also in terms of the pattern of axillary metastatic involvement. We hypothesised that the prediction of metastatic disease in axillary lymphadenectomy could be enhanced by applying a predictive model based on the TTL and the intrinsic tumour subtype.
ObjectiveTo evaluate the impact of the MS identified by immunohistochemistry on prediction of metastatic disease in axillary non-sentinel lymph nodes based on TTL.
Material and methodsRetrospective, European multicenter study including 683 patients from 9 hospitals.
ResultsUnivariate analysis identified 6 variables that were significantly correlated with axillary non-sentinel metastasis. Of these, the variables logarithmic value of the TTL, tumour diameter and MS diagnosed by immunohistochemistry were selected for multivariate analysis. The odds ratio estimated by the model were: logarithmic value of the TTL 1.527 (95% CI: 1.299-1.796), tumour diameter 1.503 (95% CI: 1.062-2.129) and MS 2.195 (95% CI: 1.246-3.867).
ConclusionsThe strongest predictors of axillary involvement were MS, TTL and tumour diameter. These variables should be included in diagnostic algorithms as essential parameters for therapeutic decision-making on the axilla.
La linfadenectomía axilar (LA) permanece como el tratamiento axilar estándar del cáncer de mama localmente avanzado con ganglio centinela (GC) metastásico. Sin embargo, entre el 35 y el 50% de estas pacientes no tienen ganglios axilares metastásicos adicionales, por lo que la LA puede constituir un sobretratamiento para cierto grupo de pacientes1. Los criterios para seleccionar las pacientes con GC metastásico que no se van a beneficiar de la LA son controvertidos2,3. Aunque la probabilidad de recidiva a distancia correlaciona positivamente con una serie de factores pronósticos «clásicos», como el diámetro tumoral, el grado histológico, la invasión linfovascular y el número de GC afectos4,5, ninguno de estos factores es lo suficientemente potente per se para la selección de pacientes con GC metastásico que pueden obviar la LA.
Entre los factores pronósticos «emergentes» destaca la carga tumoral total (CTT), que parece ser el predictor más potente de afectación axilar no centinela, por delante del número de GC metastásicos6. La CTT permite definir 2 grupos de pacientes con GC metastásico: alto y bajo riesgo en términos de supervivencia global e intervalo libre de enfermedad7.
Además, múltiples estudios evidencian que el subtipo molecular (SM) de cáncer de mama predice distintos patrones de metástasis, por lo que lo consideran un determinante de metástasis en ganglios linfáticos axilares no centinela en pacientes con GC metastásico8. Algunos autores proponen que mientras los carcinomas infiltrantes luminales o positivos para HER2 guardan una correlación positiva y casi lineal entre el diámetro tumoral y la metástasis axilar, en los tumores triple negativo, el diámetro tumoral no impacta en el estado de los ganglios linfáticos axilares, en los que la incidencia de metástasis oscila alrededor del 20%9–12.
Nuestra hipótesis es que la predicción de afectación axilar no centinela en pacientes con GC metastásico puede mejorar si el modelo predictivo incluye, además de los factores pronósticos clásicos, la CTT y el SM del tumor.
El objetivo del estudio MOTTO es evaluar el impacto de la CTT en la afectación axilar por SM subrogados inmunohistoquímicamente (IHQ).
Material y métodosEstudio observacional multicéntrico internacional retrospectivo en el que se han incluido de manera competitiva entre los distintos centros 683 pacientes entre los años 2009-2018. Fueron criterios de inclusión: diagnóstico de carcinoma infiltrante de mama, clínicamente N0 con, al menos, un GC con diagnóstico OSNA intraoperatorio (independientemente de que fuera metastásico o no) y haber sido sometida a LA. Fueron criterios de exclusión: diagnóstico de carcinoma intraductal y haber recibido cualquier tipo de tratamiento previo.
Los datos fueron obtenidos de los registros de la historia clínica y de los archivos del servicio de patología de los distintos hospitales. Se revisaron todas las laminillas de hematoxilina-eosina correspondientes a cada uno de los casos, así como sus correspondientes técnicas IHQ para receptores de estrógenos (RE), receptores de progesterona (RP), índice de proliferación (Ki-67) y HER2. La valoración de la expresión de cada una de estas proteínas se realizó siguiendo las recomendaciones de las guías clínicas.
En una base de datos electrónica, se incluyeron las siguientes variables: edad al diagnóstico, sexo, diámetro tumoral en milímetros, tipo histológico de tumor (clasificación WHO, 2012), RE, RP, Ki-67, HER2, SM subrogado IHQ, número de GC extirpados y CTT, número de ganglios axilares disecados y número de ganglios axilares no centinela (ganglios axilares adicionales) metastásicos.
Para la definición del SM subrogado se aplicaron los criterios de St Gallen 201113. Los tumores con expresión de RE, RP y HER2, independientemente de la expresión de Ki-67, fueron clasificados como luminal B-HER2 positivo.
Se realizó un estudio uni y multivariante de las variables incluidas para investigar el valor de cada una de ellas en el modelo predictivo para la afectación de ganglios axilares no centinela.
ResultadosLa serie incluyó 676 mujeres y 7 hombres. No hubo diferencias estadísticamente significativas entre el sexo y la afectación axilar.
La edad al diagnóstico osciló entre 23 y 95 años. La mediana de edad fue de 57 años tanto para los casos que no tuvieron afectación axilar como para los que sí la tuvieron. Las diferencias no fueron estadísticamente significativas.
El diámetro tumoral osciló entre 1 y 80mm, siendo la media de toda la serie de 21,3mm. La media para los casos sin afectación axilar fue de 20mm, y de 24mm para los que sí la tuvieron. Las diferencias fueron estadísticamente significativas (p=0,0006). Agrupando todos los casos de manera dicotómica,>20mm o<20mm, también hubo diferencias estadísticamente significativas (p=0,0074).
Hubo 105 casos de carcinoma lobulillar infiltrante (15,4%) y 549 de carcinoma ductal infiltrante (80,5%). Los 29 casos restantes, pertenecientes a tipos histológicos menos frecuentes, fueron clasificados como «otros». No se observaron diferencias estadísticamente significativas en la afectación axilar, atribuibles al tipo histológico.
Tampoco se encontraron diferencias en el grado tumoral, siendo la mayoría de los tumores, tanto con linfadenectomía (ganglios axilares adicionales, no centinela) negativa como metastásica, de grado 2.
La invasión linfovascular correlaciona con LA positiva, siendo las diferencias estadísticamente significativas (p=0,003).
La distribución por SM subrogados IHQ fue: 92% luminal, 3% HER2 y 4% triple negativo. De los biomarcadores estudiados, solo RE mostró diferencias estadísticamente significativas (p=0,001) entre LA metastásica y no metastásica.
El número de GC extirpados en el conjunto de la serie osciló entre uno y 5, siendo la mediana de 2.
La mediana de GC metastásicos fue de 1. No hubo diferencias estadísticamente significativas entre el número de GC extirpados (uno, 2, 3, 4 o 5) y la afectación axilar. Todos los casos con 5 GC se asociaron a ganglios axilares metastásicos adicionales. Se observaron diferencias estadísticamente significativas entre el número de GC metastásicos y la afectación axilar. Como era de esperar, se observó un gradiente ascendente de 0 a 4. La mediana en la CTT fue de 25.000 copias de ARNm-CK19/uL para el grupo de pacientes con linfadenectomía negativa (ganglios axilares adicionales, no centinela, negativos), mientras que la mediana de la CTT para los que tuvieron metástasis axilares no centinela fue de 100.000 copias/uL. Las diferencias fueron estadísticamente significativas.
La relación entre CTT y SM subrogado IHQ mostró un gradiente ascendente desde triple negativo a luminal (tabla 1).
Valor logarítmico de la carga tumoral total por subtipo molecular subrogado inmunohistoquímicamente
| Triple negativo | HER2 enriquecido | Luminal | p | |
|---|---|---|---|---|
| Log base 10 (CTT+1) | ||||
| N | 35 | 22 | 622 | 0,0004 |
| Media (DE) | 3,9 (1,3) | 4,3 (1,3) | 4,6 (1,1) | |
| IC 95% | (3,4-4,3) | (3,7-4,9) | (4,5-4,7) | |
| Media (mín/máx) | 4,1 (0,0/6,2) | 4,4 (1,1/6,6) | 4,6 (0,0/7,7) | |
| p entre grupos | ||||
| Triple negativo | - | 0,1722 | 0,0006 | |
| HER2 enriquecido | 0,1722 | - | 0,2944 | |
| Luminal | 0,0006 | 0,2944 | - | |
En el estudio multivariante (tabla 2), las variables con significación estadística fueron CTT, diámetro tumoral y SM-IHQ, de manera que incrementos de un punto en el valor logarítmico de la CTT aumentan en un 1,5% el riesgo de ganglios adicionales metastásicos en la LA, y un tamaño tumoral>20mm multiplica por 1,4 el riesgo de linfadenectomía metastásica.
Modelos de regresión logística uni y multivariante
| Variables | Modelo univariante | Modelo multivariante | ||
|---|---|---|---|---|
| OR (IC 95%) | Prueba de Wald, p | OR (IC 95%) | Prueba de Wald, p | |
| Diámetro tumoral (mm) | 1,022 (1,010-1,035) | 0,0003 | - | - |
| Diámetro tumoral (>20mm) | 1,594 (1,141-2,227) | 0,0062 | 1,503 (1,062-2,129) | 0,0216 |
| Tipo histológico | 0,997 (0,679-1,464) | 0,9874 | - | - |
| Grado histológico | 1,158 (0,904-1,482) | 0,2456 | - | - |
| Invasión linfovascular (sí) | 1,706 (1,210-2,406) | 0,0023 | - | - |
| Receptor estrógenos (+) | 3,417 (1,525-7,657) | 0,0028 | ||
| Receptor progesterona | 1,433 (0,904-2,271) | 0,1256 | - | - |
| Amplificación HER2 | 0,906 (0,690-1,191) | 0,4800 | - | - |
| Ki-67>20% | 1,085 (0,760-1,549) | 0,6517 | - | - |
| Log base 10 (CTT+1) | 1,591 (1,356-1,866) | <0,0001 | 1,527 (1,299-1,796) | <0,0001 |
| Subtipo molecular por IHQ (3 categorías) | 2,344 (1,347-4,079) | 0,0026 | 2,195 (1,246-3,867) | 0,0065 |
| Receptor hormonal por IHQ | 3,908 (1,650-9,257) | 0,0020 | - | - |
| Número de GC extirpados | 0,901 (0,743-1,093) | 0,2916 | - | - |
| Número de GC metastásicos | 1,629 (1,246-2,128) | 0,0004 | - | - |
Además, se observa una escala desde triple negativo a HER2 y a luminal en la que, por este orden, el paso de un subtipo molecular al siguiente multiplica por 1,4 el riesgo de metástasis axilar, de tal manera que, para el mismo diámetro tumoral y la misma CTT, el subtipo luminal tiene 4,2 veces mayor riesgo de tener metástasis axilares que los triple negativo.
DiscusiónEl estado de los ganglios axilares es uno de los factores pronósticos más potentes en el cáncer de mama, tanto para la supervivencia global como para el intervalo libre de enfermedad14,15.
Actualmente, el tratamiento axilar del cáncer de mama se basa tanto en los factores pronósticos clásicos del tumor (diámetro, grado, invasión linfovascular) como en el diagnóstico del GC y el número de GC metastásicos. A pesar de que el valor de dichos factores en conjunto es incuestionable, existe alguna controversia en la literatura acerca del valor individual de cada uno de ellos, considerados insuficientes en la actualidad para una buena predicción del estado de los ganglios axilares. En consecuencia, existe la necesidad de progresar de manera segura en los criterios de selección de pacientes tanto para evitar linfadenectomías innecesarias como el infradiagnóstico y la infraestadificación por obviar enfermedad residual clínicamente significativa en pacientes no seleccionados para LA. Definir, pues, el riesgo de metástasis axilar de manera precisa e individualizada constituye un reto fundamental en la enfermedad actual16–18.
Nuestra hipótesis fue que la inclusión del SM tumoral en el modelo predictivo, junto con la CTT, mejora la capacidad pronóstica del mismo.
Nuestros resultados estadísticos descriptivos, de acuerdo con los publicados en la literatura, muestran que el diámetro tumoral, especialmente cuando es considerado como una variable dicotómica (</>20mm), así como la invasión linfovascular, son factores independientes de mal pronóstico.
Giuliano et al. demuestran en el análisis multivariante que solo el grado tumoral (Bloom-Richardson modificado) y la edad se asociaron significativamente a la recidiva locorregional19. Nuestro estudio no ha conseguido demostrar que tenga valor pronóstico independiente. Ello puede ser atribuido, en parte, al carácter multicéntrico y retrospectivo del estudio, en el que diferentes observadores evalúan dicha variable de forma individual. Tampoco las variables «tamaño total» e «invasión linfovascular» son suficientes, en nuestro estudio, para individualizar el tratamiento sobre la axila.
Respecto al diámetro de la metástasis, se acepta en la actualidad que las micrometástasis no son indicación de LA, pero existe cierta confusión en el contexto de las macrometástasis, ya que existe un subgrupo de pacientes que, incluso con macrometástasis en más de 2 GC, no se beneficia de la LA.
Algunos estudios han relacionado la CTT del GC con el estado de los ganglios axilares adicionales. Nuestros resultados, en concordancia con los de Peg et al.6, confirman que la CTT es un predictor de mayor potencia que la variable «número de GC metastásicos», con un punto de corte de 25.000 copias de ARNm-CK19 para distinguir 2 grupos de pacientes, de alto y de bajo riesgo, en términos de supervivencia global e intervalo libre de enfermedad.
Los perfiles de expresión génica han definido, básicamente, 4 subtipos distintos de tumor a nivel molecular: luminal A, luminal B, HER2 y triple negativo, con distinto pronóstico y evolución de la enfermedad. La expresión IHQ diferencial de RE, RP, Ki-67 y HER2 se ha correlacionado, junto con el diámetro tumoral, el grado, la invasión linfovascular y el número de GC, con distintos patrones de metastásis20,21. Sin embargo, los datos existentes son controvertidos. Algunos autores concluyen que el SM, a pesar de su impacto en el intervalo libre de enfermedad y en la recidiva regional, tiene menor impacto que el diámetro tumoral o la invasión linfovascular, aunque debe ser tenido en cuenta en las decisiones terapéuticas sobre la axila9. Crabb et al., por el contrario, en un estudio de 4.444 pacientes, observan que el subtipo triple negativo predice una baja incidencia de metástasis axilares y que la inclusión del SM en el modelo predictivo facilita la toma de decisiones tanto quirúrgicas como de radioterapia sobre la axila22.
Nuestro estudio muestra que los tumores positivos para RE mostraron un mayor porcentaje de afectación axilar que los negativos, y que RE es el único biomarcador pronóstico independiente para la afectación axilar, no observándose diferencias estadísticamente significativas para RP ni para HER2. Del mismo modo, al agrupar de manera dicotómica los tumores con expresión de receptores hormonales y los que no mostraban expresión hormonal, el primer grupo mostró una mayor tasa de afectación axilar, siendo las diferencias estadísticamente significativas, de acuerdo con otros autores11,23–26.
A pesar de que nuestro estudio tiene el sesgo de que la muestra se halla enriquecida por el subgrupo de tumores luminales, demuestra que el SM es una variable determinante en el patrón de diseminación metastásica del tumor primario hacia la axila.
En consecuencia, creemos que la inclusión del SM en el algoritmo diagnóstico para la decisión terapéutica sobre la axila permite una mayor individualización del riesgo de metástasis axilar. De acuerdo con ello, nuestros resultados implican que, para una misma CTT y un mismo diámetro tumoral, el subtipo luminal tiene un riesgo 4,2 veces mayor de metástasis axilares no centinela que el subtipo triple negativo.
Hasta donde conocemos, este es el primer estudio que cuantifica el riesgo de metástasis no centinela basándose en el SM y demuestra la importancia de considerar la biología tumoral en la toma de decisiones terapéuticas sobre la axila.
En conclusión, el SM de tumor, la CTT y el diámetro tumoral son los predictores más potentes de metástasis axilar en los ganglios no centinela y deben ser incluidos en los algoritmos diagnósticos como variables esenciales para la toma de decisiones. Los resultados de este estudio deben ser validados con una clasificación genómica de los tumores, cuyos resultados constituyen la parte ii del estudio MOTTO, y que puede definitivamente reconocer el SM como una de las variables de mayor impacto para el tratamiento axilar.
FinanciaciónLos autores declaran que el presente estudio fue desarrollado con el apoyo de Sysmex España.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de sus centros de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos muy especialmente el trabajo realizado por la Sra. Emilia Morell Verduch, administrativa del Servicio de Patología del Hospital de La Ribera, sin cuya colaboración este estudio hubiera sido mucho más difícil.