Las determinaciones inmunohistoquímicas y moleculares en las muestras tisulares son métodos utilizados para establecer factores pronósticos y predictivos en el cáncer de mama. Para que estas técnicas sean lo más eficaces posible se requiere de un correcto manejo de los especímenes, lo que incluye controles preanalíticos como el del tiempo de isquemia, una correcta fijación, tallado e inclusión en parafina, así como la adecuada selección de la representación del tumor que se someterá a estudio. La precisión en todos estos pasos repercutirá en un resultado óptimo de la técnica inmunohistoquímica o molecular aplicada.
Molecular and immunohistochemical analysis of tissue samples are useful tools to establish prognostic and predictive factors in breast cancer. The efficiency of these techniques is based on a correct management of surgical specimens which includes pre-analytic controls such time of ischemia, appropriate fixation, gross manipulation and paraffin embedding. It is also important the right selection of tumor representation for study submission. The accuracy of all these steps will affect in the optimal result of the immunohistochemical and molecular test applied.
El Servicio de Anatomía Patológica es el encargado de recibir las muestras tisulares para su procesado y estudio microscópico a fin de emitir un diagnóstico. Además, actualmente es posible determinar en una muestra tisular una serie de biomarcadores que representan factores pronósticos y predictivos que contribuirán al manejo terapéutico de las pacientes con cáncer de mama. Así, el tejido ha de someterse a pruebas inmunohistoquímicas, determinaciones moleculares y test genéticos. También pueden almacenarse muestras tumorales en biobancos o el material estudiado remitirse a otros laboratorios para contrastar opiniones. Es por ello que las muestras tisulares deben procesarse siguiendo unos estándares óptimos para que todos estos procesos sean posibles y se desarrollen en las mejores condiciones con el objetivo de preservar los hallazgos morfológicos y las características biológicas. Para la preservación tisular es necesaria la utilización de un fijador adecuado, para la preservación de la antigenicidad se requiere que el tiempo de fijación sea el óptimo, y para preservar el material genético es imprescindible el control del tiempo de isquemia.
Los biomarcadores a estudiar son1:
- -
Proteínas: es el biomarcador más utilizado, pues puede determinarse mediante inmunohistoquímica. No obstante, su examen se ve alterado por al menos 67 variables preanalíticas2. Su determinación puede llevarse a cabo en material parafinado.
- -
ADN: es relativamente resistente al manejo rutinario de las muestras; no obstante, su determinación se ve influida por la acción del formol.
- -
ARNm: es la molécula más lábil y es la que utilizan muchas firmas genéticas. Su determinación se ve influida por el tiempo de isquemia caliente e isquemia fría.
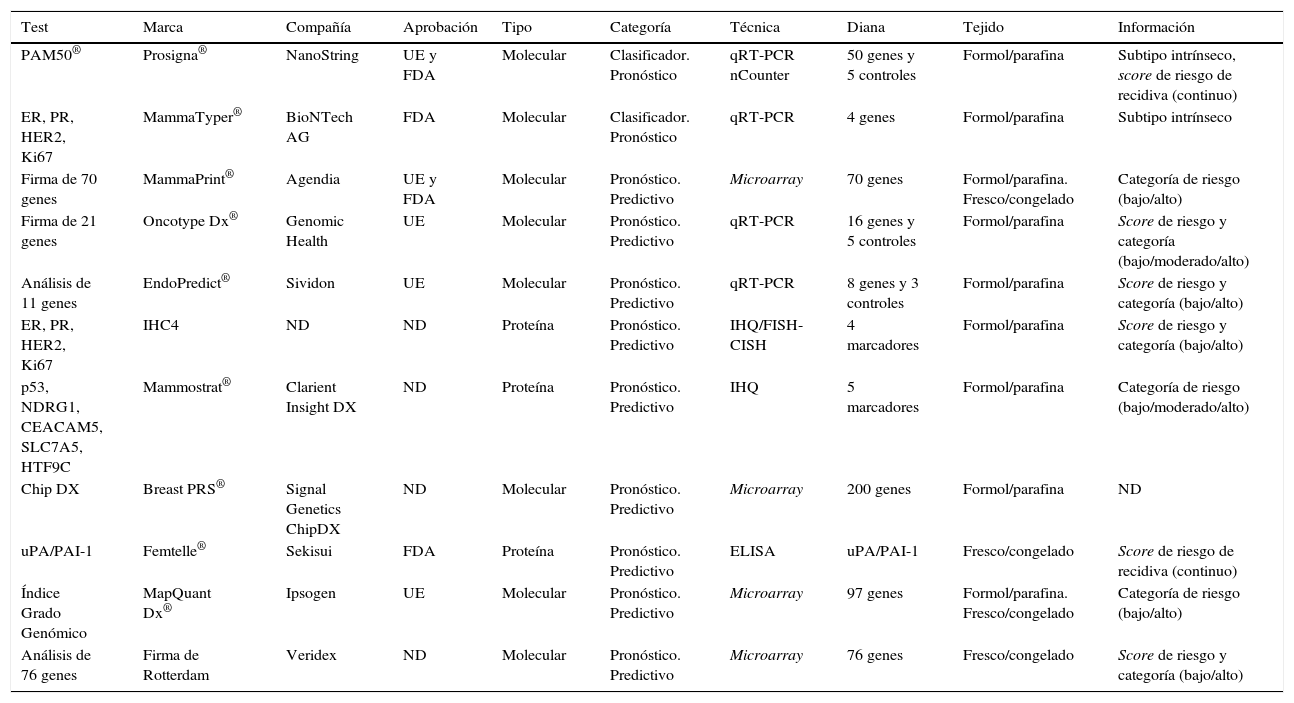
Existen varias marcas comerciales que ofrecen test genéticos, ya sean con carácter clasificador (clasifican el tumor mamario en un subtipo molecular) o pronóstico/predictivo (ofrecen información acorde del comportamiento del tumor: riesgo de recidiva, de metástasis, etc., y la respuesta a tratamientos específicos), que utilizan técnicas distintas y determinan un número variable de genes. Estas técnicas están validadas para tejido en fresco y/o tejido parafinado (tabla 1)3–6.
Características de las distintas firmas genéticas comercializadas
| Test | Marca | Compañía | Aprobación | Tipo | Categoría | Técnica | Diana | Tejido | Información |
|---|---|---|---|---|---|---|---|---|---|
| PAM50® | Prosigna® | NanoString | UE y FDA | Molecular | Clasificador. Pronóstico | qRT-PCR nCounter | 50 genes y 5 controles | Formol/parafina | Subtipo intrínseco, score de riesgo de recidiva (continuo) |
| ER, PR, HER2, Ki67 | MammaTyper® | BioNTech AG | FDA | Molecular | Clasificador. Pronóstico | qRT-PCR | 4 genes | Formol/parafina | Subtipo intrínseco |
| Firma de 70 genes | MammaPrint® | Agendia | UE y FDA | Molecular | Pronóstico. Predictivo | Microarray | 70 genes | Formol/parafina. Fresco/congelado | Categoría de riesgo (bajo/alto) |
| Firma de 21 genes | Oncotype Dx® | Genomic Health | UE | Molecular | Pronóstico. Predictivo | qRT-PCR | 16 genes y 5 controles | Formol/parafina | Score de riesgo y categoría (bajo/moderado/alto) |
| Análisis de 11 genes | EndoPredict® | Sividon | UE | Molecular | Pronóstico. Predictivo | qRT-PCR | 8 genes y 3 controles | Formol/parafina | Score de riesgo y categoría (bajo/alto) |
| ER, PR, HER2, Ki67 | IHC4 | ND | ND | Proteína | Pronóstico. Predictivo | IHQ/FISH-CISH | 4 marcadores | Formol/parafina | Score de riesgo y categoría (bajo/alto) |
| p53, NDRG1, CEACAM5, SLC7A5, HTF9C | Mammostrat® | Clarient Insight DX | ND | Proteína | Pronóstico. Predictivo | IHQ | 5 marcadores | Formol/parafina | Categoría de riesgo (bajo/moderado/alto) |
| Chip DX | Breast PRS® | Signal Genetics ChipDX | ND | Molecular | Pronóstico. Predictivo | Microarray | 200 genes | Formol/parafina | ND |
| uPA/PAI-1 | Femtelle® | Sekisui | FDA | Proteína | Pronóstico. Predictivo | ELISA | uPA/PAI-1 | Fresco/congelado | Score de riesgo de recidiva (continuo) |
| Índice Grado Genómico | MapQuant Dx® | Ipsogen | UE | Molecular | Pronóstico. Predictivo | Microarray | 97 genes | Formol/parafina. Fresco/congelado | Categoría de riesgo (bajo/alto) |
| Análisis de 76 genes | Firma de Rotterdam | Veridex | ND | Molecular | Pronóstico. Predictivo | Microarray | 76 genes | Fresco/congelado | Score de riesgo y categoría (bajo/alto) |
CISH: hibridación in situ fluorescente; ELISA: ensayo por inmunoadsorción ligado a enzimas; FDA: Food and Drug Administration; FISH: hibridación in situ fluorescente; IHQ: inmunohistoquímica; ND: no determinado; qRT-PCR: reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa; UE: Unión Europea; uPA/PAI-1: activador de plasminógeno-uroquinasa/inhibidor del activador del plasminógeno-1.
Fuente: Prat et al.3, Sinn et al.4, Chang et al.5 y Harbeck et al.6.
Para una correcta preservación del ARNm, o en caso de que se requiera una toma de muestra para banco de tumores, estudios genéticos, etc., es necesario que las piezas quirúrgicas se remitan al Servicio de Anatomía Patológica íntegras (sin seccionar) y lo más rápidamente posible después de la exéresis.
El tiempo de isquemia hace referencia al período que transcurre entre la interrupción del flujo sanguíneo y el inicio de la fijación. El tiempo que transcurre entre la interrupción del flujo sanguíneo y la exéresis es el tiempo de isquemia caliente7. Y el que transcurre entre la exéresis y el inicio de la fijación del tejido es el tiempo de isquemia fría7. Un tiempo de isquemia prolongado conlleva una acidosis tisular, una degradación enzimática y la pérdida de inmunorreacción. Es difícil influir en el tiempo de isquemia caliente, pero sí es posible controlar el tiempo de isquemia fría, que se recomienda que sea lo más corto posible (inferior a una hora), por lo que es crítico facilitar que la muestra, una vez extraída, llegue al Servicio de Anatomía Patológica para que se realice este proceso de forma adecuada1,7,8.
Excepcionalmente se ha visto que la determinación de HER2 mediante inmunohistoquímica no se ve influida hasta un tiempo de isquemia fría de 3h, pero los resultados se ven afectados si este período se supera9.
Procesado del espécimen en frescoEl procesado del espécimen debe llevarse a cabo en el laboratorio por parte de personal especializado. Es imprescindible que la pieza llegue de quirófano convenientemente señalizada (con hilos de sutura, grapas, tinta, etc.) para conocer su orientación. Así mismo, si se recibe más de una pieza es necesario conocer la relación espacial entre ellas. Todo ello se hará siguiendo unas condiciones de aislamiento del tejido y limpieza de forma que se eviten contaminaciones con otros especímenes procesados previamente. Esto es de primordial importancia en aquellas muestras que deban someterse a análisis de ARN, base de muchos de los test genéticos. En caso de la recogida de material para biobanco y estudios moleculares en fresco se utilizará material desechable y estéril. Hay que tener en cuenta, no obstante, que la toma de muestras para investigación nunca debe comprometer el diagnóstico ni el estudio de factores pronósticos y predictivos.
Si es necesario se llevará a cabo un examen radiológico, ya sea para la determinación de microcalcificaciones, o para establecer la presencia de la lesión principal y su localización en la pieza, otras lesiones secundarias y la situación de los bordes.
FijaciónEl proceso de fijación incluye una serie de reacciones químicas que dan lugar a unos entrecruzamientos entre proteínas y ácidos nucleicos de forma que se detiene el proceso de degradación tisular una vez se ha interrumpido el suministro sanguíneo a las células. El medio de fijación estándar es el formol a una concentración del 10% y tamponado con fosfato a pH neutro2,10–16, que contiene un 4% de formaldehído. Su acción forma en el tejido unos puentes hidroximetilos en las cadenas laterales de las proteínas que enmascaran los enlaces con antígenos, alterando su estructura tridimensional. Puede penetrar en las proteínas nucleares y los ácidos nucleicos, estabilizando la cubierta ácido-proteica y modificando los nucleótidos a través de reacciones con los grupos aminos libres12.
El volumen de fijador utilizado debe ser al menos 10 veces el volumen del tejido a fijar. En especímenes grandes puede utilizarse un papel o una esponja para cubrirlo y facilitar su penetración2,7. Se recomienda que esté a temperatura ambiente. Es importante señalar que el frío enlentece el efecto del formol y retrasa la fijación, por lo que si el espécimen está en formol, no es recomendable guardarlo en la nevera. La profundidad de penetración viene dada por la ley de Medawar, que establece que la difusión de los fijadores en el tejido es proporcional a la raíz cuadrada del tiempo: d (mm)=K√ t (min) (K es el coeficiente de difusión, que para el formaldehído a temperatura ambiente es de 0,78)15.
El tiempo óptimo de fijación está establecido entre las 6 y las 48h2,3,12–15. Un tiempo de fijación corto puede dar lugar a una fijación alcohólica por coagulación durante el proceso de deshidratación que se lleva a cabo en la inclusión en parafina y que afecta a la determinación de antígenos como el HER2. Un tiempo de fijación largo incrementa el enmascaramiento antigénico y requerirá de la utilización de técnicas de recuperación antigénica en las técnicas de inmunohistoquímica2,11.
Se recomienda que para una pieza quirúrgica se empleen entre 24 y 48h de fijación, para una biopsia por punción más de 6h, y, en general, se recomienda que el tiempo de fijación no supere las 72h13,14.
Con un tiempo de fijación en formol de entre 24h y 3 días no hay diferencias en la determinación inmunohistoquímica de receptores hormonales; no obstante, cuando este tiempo supera los 8 días la expresión de estos receptores disminuye, y esta disminución es significativa a partir de los 16 días de fijación12.
La fijación en formol es el método idóneo para preservar los detalles morfológicos, ofrece un buen resultado para la determinación de pruebas inmunohistoquímicas y de hibridación in situ y conserva los ácidos nucleicos. Es también el reactivo para el que están optimizados prácticamente todos los kits comerciales utilizados en inmunohistoquímica, técnicas moleculares y muchos test genéticos11.
No es recomendable la utilización de agentes decalcificantes (EDTA, ácido nítrico, etc.), fijadores alcohólicos (Z5, Pen-Fix®, etc.), fijadores mercuriales (Zenker, B3, B5, etc.), solución de Bouin, o métodos de fijación rápida (microondas, etc.) por sus efectos en la antigenicidad del tejido7,14,16,17.
TalladoEn primer lugar, se efectuará una descripción macroscópica de la pieza indicando las características de la lesión (tamaño, presencia de necrosis, etc.), y se procederá a señalar los márgenes quirúrgicos mediante tinta china, especificándose la distancia macroscópica entre estos y la lesión.
A continuación se efectuará el tallado del espécimen obteniéndose muestras representativas del tumor. Si el espécimen mide 3cm o menos se aconseja incluirlo en su totalidad. Si es mayor, se incluirá toda la lesión macroscópica en cortes consecutivos o 3 bloques tisulares para un tumor de 2cm y un bloque por cada centímetro adicional7,10, lo que hará que se disponga de material suficiente para futuros test.
Inclusión en parafinaPara incluir en el bloque de parafina se utilizará un bloque tisular de entre 1 y 1,5cm de lado y 0,2cm de espesor14. La parafina debe ser pura y estar a una temperatura aproximada de entre 55 y 58°C2. Una vez efectuado el bloque este debe conservarse a temperatura ambiente (entre 20 y 25°C)1,14.
Selección del bloque para análisisPara llevar a cabo estudios inmunohistoquímicos, moleculares, y sobre todo los test genéticos, el bloque tisular a seleccionar debe reunir las siguientes condiciones8,11,18,19:
- -
Estar representado el componente infiltrante del tumor (más de un 30% de las células a estudiar han de ser tumorales).
- -
Estar representado el foco tumoral «más agresivo».
- -
Evitar el componente in situ en el cáncer de mama.
- -
Estar representada la periferia de la lesión con presencia de tejido no neoplásico.
- -
No utilizar el material en el que se hayan efectuado los cortes por congelación para el estudio intraoperatorio.
- -
Presentar la menor cantidad posible de inflamación, necrosis, tejido adiposo, estroma, hemorragia, etc., que contaminan el análisis.
Si es necesario, para evitar la presencia de elementos contaminantes, como son el componente in situ, hemorragia, necrosis, etc., pueden utilizarse técnicas de microdisección sobre la sección histológica sin teñir para recuperar el material tisular idóneo para estudiar.
Condiciones particulares las constituyen las lesiones bilaterales, multifocales o multicéntricas, o los tumores con distintos patrones morfológicos en función del área estudiada.
Para las lesiones bilaterales, multicéntricas o multifocales se recomienda efectuar los análisis en cada uno de los tumores. La heterogeneidad dentro de un mismo tumor existe, pero parece ser que es a nivel de la expresión de genes individuales y con una baja influencia en las determinaciones basadas en microarrays en la predicción del comportamiento o evolución clínica; en cualquier caso, siempre es aconsejable seleccionar la parte más agresiva20.
En definitiva, no hay que olvidar que el mejor escenario para la paciente es ser candidata a un tratamiento específico, por lo que es recomendable encontrar la expresión del marcador antes de negarle la terapia11.
Debido a estas condiciones requeridas, es totalmente imprescindible que sea el patólogo el que lleve a cabo la selección del material adecuado para la realización de estudios específicos.
RecomendacionesMaterial fijado:
- -
Fijar el tejido antes de una hora después de la extracción.
- -
Utilizar formol al 10% tamponado.
- -
Respetar un tiempo de fijación entre 6 y 48h a temperatura ambiente.
- -
Representación en el bloque tisular de más de un 30% de componente infiltrante y evitar que haya necrosis, grasa, estroma, hemorragia, inflamación, etc.
- -
Si hay más de una lesión han de estudiarse todas, aunque puede efectuarse un análisis progresivo lesión a lesión hasta encontrar la positividad del marcador o un resultado pronóstico con trascendencia clínica.
Material en fresco:
- -
Procesar el tejido antes de una hora después de la extracción.
- -
Utilizar entre 3 y 5mm cúbicos de pieza tumoral en un tubo con sustancia conservante de ARNm.
- -
Si es necesario puede conservarse el tubo a 4°C durante 12h, o a −20°C hasta 30 días hasta su procesado, o a −80°C de forma definitiva en un biobanco.
El informe anatomopatológico debe integrar:
- -
Parámetros morfológicos clásicos7,10: tamaño, tipo histológico, grado histológico, invasión linfovascular, afectación de los márgenes, etc.
- -
Factores pronósticos y predictivos inmunohistoquímicos7,8,13,14,17,21:
- ∘
Receptores hormonales (estrógenos y progesterona): porcentaje de células con positividad nuclear e intensidad media de la tinción.
- ∘
Ki67: en porcentaje de núcleos que lo expresan.
- ∘
HER2: negativo (0 o 1+), equívoco (2+), positivo (3+).
- -
Hibridación in situ (FISH/SISH/CISH)13,21. En test con una sola sonda: media del número de señales de HER2/número de células. En test con sonda dual: media del número de señales de HER2/media del número de señales CEP17.
- -
Perfil genético21: indicando el nombre del test y las variables que este ofrece (riesgo alto, moderado o bajo, índice de recidiva, etc.) y la evaluación de la concordancia con los otros métodos.
- ∘
Cabe señalar que tanto los parámetros morfológicos como los factores inmunohistoquímicos (receptores hormonales, Ki67 y HER2) son imprescindibles, siendo los demás optativos en función de las características de cada caso.
También deben consignarse7,13,14,21: solución fijadora, tiempo de fijación y clon utilizado en el test inmunohistoquímico.
En resumen, el procesado de muestra tisulares para test inmunohistoquímicos, moleculares o genéticos requiere de un control de variables preanalíticas, como son el tiempo de isquemia, el fijador y el tiempo de fijación, etc., y la selección del bloque adecuado para el análisis. Una vez efectuado el análisis, los resultados deben correlacionarse con los hallazgos histológicos, clínicos y radiológicos antes de elaborar un informe. Si estos resultados no son acordes con los datos clínicos se debe reevaluar la histología y la información clínica, los resultados y la técnica utilizada para el test, los efectos de las variables preanalíticas y considerar un retest en material adicional. En cualquier caso, es imprescindible seguir unos protocolos basados en guías estandarizadas, utilizar métodos analíticos validados y reproducibles, y un trabajo en equipo que permita discutir los resultados en un comité multidisciplinar antes de aplicar una conducta terapéutica a la paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaTodos los autores han participado en la redacción, búsqueda de bibliografía y revisión del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.