La biopsia selectiva del ganglio centinela (BSGC) es actualmente una propuesta estándar para la estadificación de la axila en pacientes con cáncer de mama con una clara tendencia a minimizar la cirugía axilar incluso en presencia de ganglio centinela (GC) positivo. En caso de GC negativo la BSGC ha reemplazado a la linfadenectomía axilar (LA) demostrando equivalente supervivencia, mientras que los más sólidos consensos (American Society of Clinical Oncology) y, hasta fechas recientes, las guías de la National Comprehensive Cancer Network recomendaban completar la LA cuando se identifican metástasis en el GC. Esto da como resultado un excelente control locorregional y proporciona información que permite tomar decisiones sobre tratamientos adyuvantes tanto al oncólogo médico como al oncólogo radioterápico. No obstante, en los últimos tiempos múltiples estudios han debatido el valor terapéutico de la linfadenectomía quirúrgica, cobrando especial relevancia a raíz de la publicación del ensayo del American College of Surgeons Oncology Group (ACOSOG) Z0011, en el que se cuestiona el valor de esta actitud terapéutica y se propone únicamente una BSGC, omitiéndose la LA, en pacientes seleccionadas con uno o 2 GC positivos.
La evidencia científica nos dice que la radioterapia puede jugar un papel fundamental en el control de la enfermedad axilar y, a fecha de hoy, no sabemos si la baja tasa de recidiva a este nivel, en los estudios mencionados, puede estar influida por la irradiación de la mama y axila inferior. Serían necesarios estudios con un diseño apropiado para contestar esta pregunta. En ausencia de más datos, nuestra propuesta es la irradiación axilar valorando individualmente los factores de riesgo de recidiva locorregional.
Sentinel lymph node biopsy (SLNB) is currently a standard approach for staging of the axilla in patients with breast cancer, with a clear tendency to minimize surgery even in the presence of a positive axillary sentinel lymph node (SLN). The strongest consensus (American Society of Clinical Oncology) and, until recently, the National Comprehensive Cancer Network guidelines used to recommend complete axillary lymphadenectomy when metastases were identified in the SLN. However, SLNB has replaced axillary lymphadenectomy in SLN-negative patients and has demonstrated equivalent survival. This approach results in excellent locoregional control and provides information that allows both the medical oncologist and the radiation oncologist to take decisions about adjuvant treatments. Many recent studies, however, have debated the therapeutic value of surgical lymphadenectomy. This debate has become particularly important after the publication of the trial of the American College of Surgeons Oncology Group (ACOSOG) Z0011, which questions the value of this therapeutic approach and proposes SLNB alone, without lymphadenectomy, in selected patients with one or 2 positive SLN.
The scientific evidence indicates that radiotherapy may play a major role in the control of axillary disease and, to date, it is not known whether the low recurrence rate in the axilla reported in the above-mentioned studies may have been influenced by radiation of the breast and lower axilla. To answer this question, new and appropriately designed trials are needed. In the absence of more data, we propose the use of axillary radiation, but with assessment of the risk factors for locoregional recurrence in each patient.
El tratamiento de las cadenas ganglionares, y específicamente la irradiación, es actualmente un tema controvertido. Si la enfermedad disemina ordenadamente de la mama a los ganglios y de ahí a la diseminación sistémica (hipótesis halstediana) o si la enfermedad es sistémica de inicio (hipótesis fisheriana) está aún por resolver. Bajo la hipótesis de Halsted el tratamiento local de las cadenas ganglionares puede prevenir la diseminación sistémica y, por lo tanto, reducir la mortalidad por cáncer de mama. Por el contrario, la afectación ganglionar, según Fisher, sería simplemente el reflejo de una enfermedad sistémica ya presente y, por consiguiente, su tratamiento no influiría en la supervivencia global.
La biopsia selectiva del ganglio centinela (BSGC) es actualmente una propuesta estándar para la estadificación de la axila en pacientes con cáncer de mama con una clara tendencia a minimizar la cirugía axilar incluso en presencia de ganglio centinela (GC) positivo. En caso de GC negativo la BSGC ha reemplazado a la linfadenectomía axilar (LA) demostrando equivalente supervivencia, mientras que los más sólidos consensos (American Society of Clinical Oncology)1 y, hasta fechas recientes, las guías de la National Comprehensive Cancer Network2 recomendaban completar la LA cuando se identifican metástasis en el GC. Esto da como resultado un excelente control locorregional y proporciona información que permite tomar decisiones sobre tratamientos adyuvantes tanto al oncólogo médico como al oncólogo radioterápico. Estas recomendaciones están avaladas por un metaanálisis, con 69 ensayos aleatorizados, donde se incluyeron 8.059 pacientes y en el que se pone de manifiesto que el 53% de las pacientes con GC positivo presentan metástasis en otros ganglios además del centinela3.
No obstante, en los últimos tiempos múltiples estudios han debatido el valor terapéutico de la linfadenectomía quirúrgica4–9, cobrando especial relevancia a raíz de la publicación del ensayo del American College of Surgeons Oncology Group (ACOSOG) Z001110 en el que se cuestiona el valor de esta actitud terapéutica y se propone únicamente una BSGC omitiéndose la LA en pacientes seleccionadas con uno o 2 GC positivos.
En el ensayo ACOSOG Z0011, 813 pacientes con cT1-2, cN0, con uno o 2 GC positivos, por técnica de hematoxilina-eosina, fueron aleatorizadas a LA vs. no tratamiento de la axila. El ensayo fue cerrado precozmente tras un pobre reclutamiento que solo alcanzó el 47% de las 1.900 pacientes previstas. Con una mediana de seguimiento de 6,3 años los resultados fueron equivalentes entre ambos brazos de tratamiento: recidiva axilar (0,5 vs. 0,9%), recidiva en la mama (3,6 vs. 1,9%), recidiva locorregional (4,1 vs. 2,8%, p=0,53), supervivencia libre de enfermedad (82,2 vs. 83,8%) y supervivencia global (91,9 vs. 92,5%). La mayoría de las mujeres fueron mayores de 50 años (64%), tenían tumores clínicamente T1 (68%), receptores estrogénicos positivos (77%) y solo un GC positivo (60%). La mayoría recibieron irradiación de toda la mama (89%), y terapia sistémica (96%). Un 40% tuvieron micrometástasis o células tumorales aisladas, y un 60%, macrometástasis. El número de ganglios positivos adicionales en el brazo de linfadenectomía axilar fue de 27,3%, y fueron excluidas las pacientes sometidas a mastectomía o a quimioterapia neoadyuvante. No obstante, el análisis detallado de este ensayo pone de manifiesto una serie de dudas que se reflejan a continuación:
Diseño- 1.
Se define como un estudio de no-inferioridad, aceptando que la supervivencia a 5 años no sea menor del 75% del grupo control o que el riesgo de mortalidad sea menor de 1,3. Por tanto, se acepta la igualdad entre ambos brazos a pesar de tener una diferencia del riesgo de muerte de un 30%.
- 2.
La supervivencia estimada a 5 años es del 80%, en base a estudios de los años 1989 y 1992. Los resultados actuales son mejores, como demuestra el propio estudio con una cifra de supervivencia de ambos grupos superior al 90%.
- 3.
El brazo control no es el tratamiento estándar, ya que no se acepta la irradiación de las áreas ganglionares y está ampliamente aceptado que las pacientes con 4 o más ganglios afectados se benefician de la irradiación del área supraclavicular-axilar superior. Por tanto, estas pacientes estarían infratratadas, lo que podría justificar unas diferencias menores.
- 4.
La estratificación no incluye factores pronósticos como HER2, p53, Ki67, que pueden alterar los resultados.
- 5.
Únicamente se alcanza el 46,9% del reclutamiento previsto de 1.900 casos. Los autores sostienen que la suspensión del reclutamiento fue debida al bajo número de eventos registrados. La solución metodológica para compensar la disminución del número de eventos, sobre el cálculo previsto, es aumentar el número de casos.
- 6.
Se reclutan pacientes de 115 hospitales, durante 4,5 años, lo que hace una media de 7,75 enfermas por centro y 1,72 enfermas al año/centro.
- 7.
Del total de casos, 287 pacientes (32,2%) fueron aleatorizadas antes de la linfadenectomía del centinela, lo que se podría considerar como violación de protocolo, ya que era un criterio de exclusión explícito del trabajo.
- 8.
Las pérdidas de seguimiento son de 92 (20,7%)+74 (16,6%) enfermas, lo que representa un total del 19,4% de la muestra. Sin embargo, han sido incluidas en el estudio.
- 9.
El tipo de radioterapia (RT) administrada no está especificado con claridad, lo que supone un factor importante de confusión.
- 10.
El 29,3% de las enfermas del total del estudio no son irradiadas, por tanto, no recibieron el tratamiento adecuado.
- 11.
La terapia sistémica adyuvante se utiliza de forma similar en ambos grupos. Sin embargo, no está correctamente reflejada.
- 12.
Los 103 (11,6%) casos no seleccionables según los autores, se incluyeron en el estudio.
- 13.
Un 1,2% del grupo de linfadenectomía y un 7% del centinela, al final son N0, y 77 casos del grupo de linfadenectomía y 21 del centinela son pN desconocidos.
- 14.
El número de micrometástasis en el grupo control fue del 44,8%, y del 37,5% en el grupo GC. Ambas cifras son muy altas y evidencian un sesgo en la inclusión de pacientes.
- 15.
El seguimiento no estándar hace que las recidivas puedan ser infraestimadas y la mediana del mismo es de 6,3 años.
Es de destacar que en la mayoría de los ensayos mencionados que cuestionan el valor de la LA, como el estudio Z0011, la tasa de recidiva axilar fue muy inferior a la esperada (por debajo del 1%, a pesar de un estimado 27%). Posibles explicaciones a este hallazgo podrían ser:
- -
La terapia sistémica recibida por la mayoría de las pacientes. Estudios en pacientes con ganglios positivos han demostrado que aproximadamente un 25% de las mujeres que son tratadas con quimioterapia tienen una erradicación completa de la enfermedad nodal11,12.
- -
La terapia hormonal usada a largo plazo.
- -
La alta probabilidad de que la afectación ganglionar residual, en este grupo de buen pronóstico, sea principalmente en forma de micrometástasis, que puedan permanecer silentes por largos periodos de tiempo o nunca manifestarse, al igual que ocurre con las micrometástasis en la médula ósea erradicadas por el sistema inmune.
- -
Pero existe otra posibilidad altamente relevante y es que al irradiar la mama con campos tangenciales la axila inferior es incluida a dosis capaces de erradicar enfermedad residual. Se desconoce si la baja tasa de recidiva axilar en el Z0011 fue consecuencia de la irradiación de la mama, y si los oncólogos radioterápicos conocían qué pacientes no llevaban LA, pudiendo haber modificado la longitud de los campos tangenciales estándar para tratar una mayor proporción de axila.
Se ha estimado que usando campos tangenciales, sin intención de incluir la axila, más del 50% del nivel i y entre el 20 y el 30% del nivel ii reciben el 95% de la dosis prescrita13–15 (dosis terapéutica), dependiendo de la anatomía de la paciente y de dónde se coloque el límite superior del campo. Hay que tener en cuenta que este dato no ha sido documentado en ninguno de los ensayos mencionados y, por lo tanto, es difícil determinar qué papel puede jugar la RT en la baja tasa de recidiva axilar.
En cualquier caso el estudio ACOSOG Z0011 ha tenido tanto peso en la comunidad científica que incluso ha cambiado las recomendaciones de las más prestigiosas guías de práctica clínica16, estableciéndose la consideración de no hacer LA en pacientes seleccionadas T1-2 con uno o 2 GC positivos. Sin embargo, no sería recomendable extrapolar estos resultados a pacientes diferentes a las incluidas en el ensayo, ni tampoco a pacientes con mastectomía, irradiación parcial de la mama, RT en prono, intraoperatoria u otras técnicas donde la axila no este incluida en los campos de irradiación. Igualmente no sería aplicable a pacientes tratadas con quimioterapia neoadyuvante.
Implicaciones de la radioterapia en la recidiva ganglionarUno de los primeros estudios que demostró el valor de la RT en la recidiva axilar fue precisamente el NSABP-044, donde 1.079 mujeres con axila clínicamente negativa fueron aleatorizadas para mastectomía radical modificada (MRM), con LA, vs. mastectomía simple (MS) y RT axilar vs. MS con LA, solo si los ganglios llegaban a ser positivos, y por otro lado 586 pacientes con ganglios clínicamente positivos para MRM vs. MS+RT. No se observaron diferencias entre los 3 grupos con ganglios negativos ni entre los 2 grupos con ganglios positivos en supervivencia libre de enfermedad o supervivencia global. La conclusión de este estudio fue que es posible suprimir la LA en pacientes con ganglios clínicamente negativos ya que no influye en la supervivencia global ni supervivencia libre de enfermedad. No obstante, hay que destacar que las pacientes que recibieron MS+RT tuvieron una tasa significativamente más baja de recidiva locorregional. Y por otro lado, en pacientes con ganglios clínicamente positivos los resultados en supervivencia y en recidiva locorregional fueron los mismos para MRM con LA y para MS+RT, con lo que se puede concluir que la RT es igual de efectiva que la cirugía para controlar la enfermedad axilar.
Más recientemente otro estudio ha sido publicado en forma de resumen en el 35 congreso de la European Society for Medical Oncology, en 201017. Cuatrocientas setenta y cuatro pacientes con tumores menores o iguales a 3cm de diámetro, axila clínicamente negativa y GC positivo, fueron aleatorizadas a completar LA (244) o RT de la axila (230). Con una mediana de seguimiento de 43,3 meses no hubo diferencias significativas entre los 2 brazos ni en recidiva axilar (0,82 y 1,3%, respectivamente) ni en supervivencia global.
Incluso parece ser que en aquellas pacientes sin afectación ganglionar, la irradiación de las áreas podría tener un papel en la recidiva axilar. Una revisión sistemática publicada en 201118, que incluyó más de 20.000 pacientes de 45 estudios realizada para valorar la utilidad de la irradiación mamaria en la recidiva axilar, llega a la conclusión de que la irradiación mamaria disminuye la recidiva locorregional, incluso en pacientes sin afectación ganglionar. La explicación de estos resultados podría estar, como ya se ha comentado antes, en el hecho de que al irradiar toda la mama se incluye como mínimo el nivel I axilar. Esta revisión fue llevada a cabo por la desproporcionada tasa de recidiva axilar en pacientes con BSGC negativa que no recibían RT en la mama como parte de su tratamiento inicial19.
Pero no hay que olvidar que la enfermedad ganglionar puede afectar también al nivel iii de la axila, a la fosa supraclavicular y a la cadena mamaria interna. Tradicionalmente el oncólogo radioterápico ha utilizado los hallazgos de la LA para diseñar las áreas ganglionares a irradiar. El número de ganglios positivos determina el riesgo de afectación del nivel iii de la axila y de la fosa supraclavicular. Cuando este riesgo es relevante está indicada la irradiación de estos niveles ganglionares. La indicación estándar es para pacientes con afectación de 4 o más ganglios axilares y para pacientes seleccionadas con afectación de uno a 3 ganglios (tumor mayor de 4cm, extensión extranodal mayor de 2mm, inadecuada disección axilar, etc.)16,20.
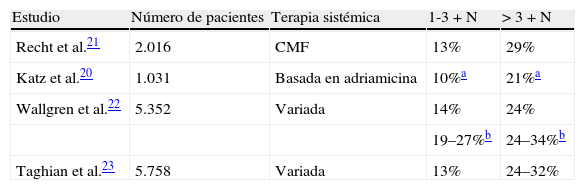
En la tabla 1 se muestra el riesgo de recidiva locorregional en función del número de ganglios afectados según diversos autores. Es de destacar que las pacientes con inadecuada disección axilar experimentaron una mayor tasa de recidiva locorregional (24% si<de 10 ganglios examinados vs. 11% si>10 ganglios examinados; p=0,02)21–23.
Tasa de recidiva locorregional en ensayos clínicos incluyendo tratamiento con mastectomía y terapia sistémica sin irradiación
| Estudio | Número de pacientes | Terapia sistémica | 1-3+N | >3+N |
| Recht et al.21 | 2.016 | CMF | 13% | 29% |
| Katz et al.20 | 1.031 | Basada en adriamicina | 10%a | 21%a |
| Wallgren et al.22 | 5.352 | Variada | 14% | 24% |
| 19–27%b | 24–34%b | |||
| Taghian et al.23 | 5.758 | Variada | 13% | 24–32% |
CMF: ciclofosfamida+metotrexato+5-fluorouracilo; N: ganglios.
Múltiples ensayos aleatorizados y metaanálisis han demostrado que la RT reduce el riesgo de recidiva locorregional y la mortalidad por cáncer de mama24–27. No obstante, estos estudios no analizan específicamente cuánto de la reducción de riesgo de recaída es debida a la irradiación ganglionar.
Recientemente se han publicado en forma de resumen, en el congreso de la American Society of Clinical Oncology 2011, los resultados del ensayo aleatorizado MA2028, donde pacientes de alto riesgo con ganglios negativos y pacientes con ganglios positivos fueron aleatorizadas, tras cirugía conservadora, para recibir RT mamaria (RTM) con o sin irradiación ganglionar regional (IGR: axila iii, FSC y CMI). El objetivo primario del estudio fue la supervivencia global. Se incluyeron 1.832 pacientes, 916 en cada brazo. La mediana de seguimiento fue de 62 meses, edad media 53,3 años, ganglios negativos 10%, 1-3 ganglios positivos 85%, >4 ganglios positivos 5%, quimioterapia adyuvante 91% y hormonoterapia 71%. RTM+IGR en comparación con RTM sola se asoció con una mejora en supervivencia libre de enfermedad locorregional aislada (HR=0,59, p=0,02, riesgo a 5 años: 96,8 y 94,5%, respectivamente), supervivencia libre de metástasis a distancia (HR=0,64, p=0,002, riesgo a 5 años: 92,4 y 87,0%, respectivamente), supervivencia libre de enfermedad (HR=0,68, p=0,003, riesgo a 5 años: 89,7 y 84,0%, respectivamente) y supervivencia global (HR=0,76, p=0,07, riesgo a 5 años: 92,3 y 90,7%, respectivamente). No obstante, RTM+IGR en comparación con RTM presenta un incremento de la toxicidad grado 2 o mayor en neumonitis (1,3 y 0,2%, respectivamente; p=0,01), y linfedema (7,3 y 4,1%, respectivamente; p=0,004).
En conclusión, los resultados demostraron una mejora significativa de la supervivencia libre de enfermedad, del control locorregional, una disminución de metástasis a distancia y una tendencia a la mejora en la supervivencia global en el grupo que recibió la irradiación ganglionar, reafirmándose el beneficio obtenido con esta en las pacientes con cáncer de mama, y han sido considerados por la propia American Society of Clinical Oncology como algunos de los avances clínicos de mayor relevancia del año 201129.
Después de estas consideraciones nos planteamos 2 cuestiones fundamentales:
- -
¿Debemos irradiar los niveles axilares i y ii en todos los casos de GC positivo?
- -
Si no conocemos el estado de la axila, ¿cómo podremos indicar la irradiación nodal regional?
Actualmente no hay datos sólidos de estudios prospectivos sobre cuál sería la óptima propuesta de RT en pacientes con GC positivo, que no hayan sido sometidas a LA.
Está en marcha el ensayo de la EORTC AMAROS30, donde se aleatorizan pacientes con GC positivo a disección axilar vs. RT axilar, independientemente del tipo de cirugía (mastectomía o CC) y del número y tamaño de GC positivos. Va a contestar la pregunta de si la LA puede ser sustituida por RT axilar evitando así la morbilidad de la primera, pero no contestará la pregunta de si en pacientes seleccionadas es necesaria la RT axilar o simplemente seguimiento.
Recientemente se ha puesto en marcha un estudio que va más allá, ya que cuestiona el propio concepto de BSGC. De hecho, esta técnica fue desarrollada para obtener información sobre el estado de la axila que permitiría a los cirujanos no hacer LA, en caso de GC negativo, e identificar a las mujeres candidatas a LA en caso de GC positivo. Pero si el pronóstico no cambia con LA, aun en presencia de GC positivo el único valor de este es aportar información para el tratamiento adyuvante. No obstante, cada vez más este tratamiento viene determinado por factores biológicos. Basándose en estos puntos, el Instituto Europeo de Tumores de Milán ha diseñado el ensayo prospectivo aleatorizado Sentinel node vs. Observation after Ultra-SouND (SOUND). Pretende reclutar 1.560 pacientes y aleatorizarlas tras exploración ultrasonográfica de la axila (negativa) a BSGC vs. No LA. En el grupo de BSGC solo se completará la LA en caso de macrometástasis. El objetivo principal es la supervivencia libre de metástasis a distancia. Este estudio tampoco contestará las preguntas sobre la RT, ya que todas las pacientes serán sometidas a tratamiento conservador incluyendo RT.
El desafío actual es identificar qué pacientes necesitan tratamiento locorregional más allá de los clásicos parámetros clínico-patológicos. Para avanzar en este sentido necesitamos identificar marcadores moleculares, tanto en el tumor primario como en los ganglios, capaces de predecir la agresividad biológica del tumor. Esto ha sido evaluado en algún grado por Mamounas et al.31, quienes identificaron una asociación entre Oncotype DX y riesgo de recidiva locorregional, en pacientes con ganglios negativos y RE positivos, reclutados en los ensayos NSABP B-14 y NSABP B-20. Como ejemplo ellos identifican un subgrupo de alto riesgo (<50 años con un score alto) en el cual puede haber un beneficio para la irradiación nodal. Esta es una línea de investigación que debe ser testada en ensayos clínicos bien conducidos
En el futuro es posible que tengamos respuesta a estas preguntas, no obstante, en la actualidad debemos recurrir a las herramientas disponibles para ayudarnos en la toma de decisiones.
Por un lado existen nomogramas validados que estiman la probabilidad de ganglios adicionales afectados en función del tamaño del tumor, grado, histología, RRHH invasión linfovascular, número de GC positivos y otros, que pueden ayudar a diseñar los campos de tratamiento para la irradiación axilar32,33. Así mismo, existen varios modelos predictivos para determinar qué pacientes con GC positivo tendrían riesgo de tener 4 o más ganglios afectados34,35.
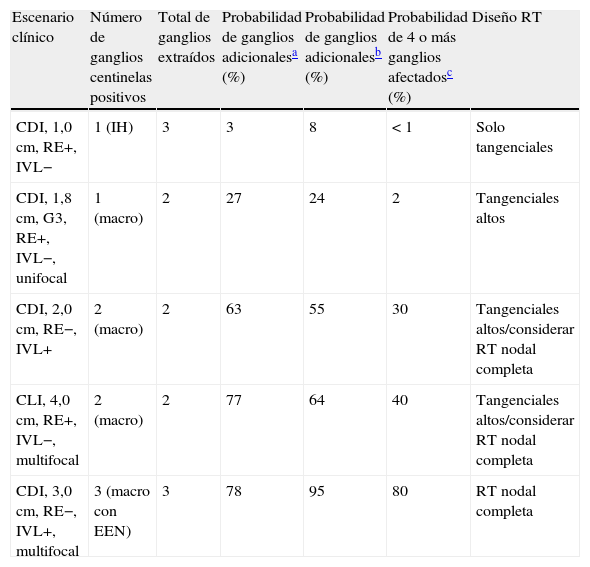
En la tabla 2 se muestran varios ejemplos de diseño de campos de irradiación siguiendo las recomendaciones de los 3 nomogramas más utilizados.
Ejemplos de decisión terapéutica radioterápica en pacientes con ganglio centinela positivo, sin linfadenectomía axilar
| Escenario clínico | Número de ganglios centinelas positivos | Total de ganglios extraídos | Probabilidad de ganglios adicionalesa (%) | Probabilidad de ganglios adicionalesb (%) | Probabilidad de 4 o más ganglios afectadosc (%) | Diseño RT |
| CDI, 1,0cm, RE+, IVL− | 1 (IH) | 3 | 3 | 8 | <1 | Solo tangenciales |
| CDI, 1,8cm, G3, RE+, IVL−, unifocal | 1 (macro) | 2 | 27 | 24 | 2 | Tangenciales altos |
| CDI, 2,0cm, RE−, IVL+ | 2 (macro) | 2 | 63 | 55 | 30 | Tangenciales altos/considerar RT nodal completa |
| CLI, 4,0cm, RE+, IVL−, multifocal | 2 (macro) | 2 | 77 | 64 | 40 | Tangenciales altos/considerar RT nodal completa |
| CDI, 3,0cm, RE−, IVL+, multifocal | 3 (macro con EEN) | 3 | 78 | 95 | 80 | RT nodal completa |
CDI: carcinoma ductal infiltrante; CLI: carcinoma lobular infiltrante; EEN: extensión extranodal; G: grado; IH: inmunohistoquímica; IVL: invasión vasculolinfática; macro: macroscópico; RE: receptores estrogénicos; RT: radioterapia.
Para pacientes con bajo riesgo de enfermedad no está claro si la axila debe ser específicamente un blanco para la irradiación. Incluso si solo se utilizan campos tangenciales el nivel i y parte del ii van a estar incluidos a dosis terapéuticas. Irradiar intencionadamente la axila solo supone pequeños ajustes para incluir los niveles i y ii y dada la escasa morbilidad que esto añade a la RT de la mama, es prudente su inclusión incluso en las pacientes con las características de las incluidas en el ACOSOG Z0011. Siempre que sea posible la irradiación de los niveles i y ii debería realizarse mediante planificación tridimensional individualizada, con las puertas de entrada necesarias para la adecuada cobertura de dichos volúmenes.
Por otro lado, pueden ser de gran utilidad práctica los consensos de expertos. Recientemente el Grupo Español de Oncología Radioterápica en cáncer de Mama (GEORM), no solo por las cuestiones que planteaba el estudio Z0011, sino en general por la variabilidad de criterios que existe entre los profesionales de la Oncología Radioterápica a la hora de irradiar las cadenas ganglionares, se planteó establecer unas recomendaciones consensuadas, teniendo en cuenta la evidencia científica para cada uno de los supuestos clínicos y desde la perspectiva de profesionales con amplia experiencia en el tratamiento radioterápico del cáncer de mama. Dichas recomendaciones para todos los supuestos están publicadas en: www.seor.es (http://www.seor.biz//Images/Archivos/NOT_I_42_C_1.PDF). La tabla 3 muestra las recomendaciones para el supuesto que nos ocupa.
Afectación de uno a 3 ganglios axilares con biopsia de ganglio centinela exclusiva o sin linfadenectomía suficiente
| Se recomienda siempre la irradiación de los niveles axilares i y ii |
| Indicada irradiación de áreas ganglionares supraclavicular y nivel iii axilar cuando coexistan factores de mal pronóstico: afectación macroscópica axilar, edad<50 años, tamaño tumoral≥5cm, grado iii, infiltración linfovascular o perineural, fenotipos agresivos (triple negativo) o receptores negativos |
| Se deja a la consideración del profesional, la irradiación de las áreas ganglionares supraclavicular y nivel iii axilar en caso de afectación ganglionar sin factores de mal pronóstico |
| Si existe afectación por micrometástasis de un único ganglio podría evitarse la irradiación axilar |
La evidencia científica nos dice que pacientes seleccionadas con uno o 2 GC positivos pueden evitar la LA. Pero no sabemos si la baja tasa de recidiva axilar en los estudios mencionados es debida a la irradiación de la mama y axila inferior. Serían necesarios estudios con un diseño apropiado para contestar esta pregunta. En ausencia de más datos, nuestra propuesta es la irradiación axilar valorando los factores de riesgo de recidiva locorregional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.