REV. SENOLOGÍA Y PATOL. MAM., 11, 2 (71-76), 1998
ORIGINALES
Demora diagnóstica y criterios de calidad en una Unidad
de Patología Mamaria
Diagnostic delay and quality criteria in a Breast Pathology Unit
P. Soriano Gil-Albarellos,
F. Vicente García,
J. V. Ferrer Valls,
L. Blázquez Lautre,
J. J. Íñigo Noain,
J. Herrera Cabezón,
J. M. Lera Tricas
Servicio de Cirugía General y Aparato Digestivo.
Hospital de Navarra. Pamplona.
Correspondencia:
Pablo Soriano Gil-Albarellos.
Servicio de Cirugía General y Aparato Digestivo.
Hospital de Navarra.
Irunlarrea, 3.
31008 Pamplona (Navarra).
SUMMARY
Introduction. The aim of this study is to know the diagnostic delay in a Breast Pathology Unit associated with a screening campaign and define quality criteria.
Patients and method. 449 screened patients were biopsed. We studied the diagnostic delay and its relations with histological findings, physical exploration, symptoms, age, mammographical appearance, cytology and stage in malign lesions.
Results. Mean diagnostic delay was 31.2 days. Proportion of patients biopsied at 15, 30 and 60 days was 38, 64 and 87%. Valid cytological study was done in 35%. Palpable lesions were biopsed statistically before nonpalpable lesions and malignant tumors before benign tumors. Retraction, cytology and malignant tumors are the independent factors in Cox''s study related with diagnostic delay.
Conclusions. Proportion of patients biopsid at 15, 30 and 60 days, valid cytological study, proportion of delayed treatment patients and equal criteria of surgeon''s unit are the quality criteria.
Palabras clave
Cáncer de mama, Detección precoz, Unidad de Patología Mamaria, Criterios de calidad, Demora diagnóstica, Citología.
Key words
Breast cancer, Screening campaign, Breast Pathology Unit, Quality criteria, Diagnostic delay, Cytology.
INTRODUCCIÓN
La meta de una unidad quirúrgica de patología mamaria implicada en un programa de detección precoz de cáncer de mama debe ser el rápido diagnóstico y tratamiento de las pacientes con carcinoma mamario. El tiempo es un factor de gran importancia en el cáncer de mama, no sólo por las favorables implicaciones pronósticas del diagnóstico precoz,.1, 2 sino por las consecuencias sociales y personales que se producen en la demora del diagnóstico quirúrgico cuando se advierte que puede haber un carcinoma de mama..3
Son varios los trabajos que han estudiado la influencia que tiene el retraso en la consulta por parte de la mujer sintomática, pero con el advenimiento de los programas de detección precoz el mayor peso de la demora en el diagnóstico no recae en las pacientes, sino en el buen funcionamiento del sistema..4, 5 Asimismo se han estudiado los criterios que indican calidad de una campaña de detección precoz de cáncer de mama;.6 sin embargo, son pocos los trabajos que intentan estudiar los parámetros que indican calidad en una unidad quirúrgica asociada a un programa de detección precoz.
El objetivo del presente trabajo es valorar la demora de diagnóstico de nuestra unidad, localizar los factores que influyen en la toma de decisiones e intentar unificar los parámetros que indican calidad en una unidad de estas características.
PACIENTES Y MÉTODO
El estudio incluye 449 pacientes remitidas entre octubre de 1991 y mayo de 1996 por la Unidad de Detección Precoz de Cáncer de Mama del Gobierno de Navarra por presentar una imagen mamográfica sospechosa de malignidad.
El proceso habitual se inicia con una sesión semanal en la que participan los radiólogos de la campaña, epidemiólogos, radiólogos del hospital, patólogos, oncólogos y los cirujanos de la unidad. En ella se presentan los casos nuevos detectados por la campaña en esa semana y que serán vistos 2 días más tarde en la consulta de cirugía. En la consulta se explora a la paciente, se solicitan las pruebas complementarias, la citología por punción de las lesiones palpables y los estudios preoperatorios. Posteriormente la paciente entra en una lista de espera, común con otros pacientes quirúrgicos, para la realización de la biopsia que determine la naturaleza del proceso. No disponemos en la actualidad de un quirófano específico de patología mamaria.
Hemos estudiado la demora diagnóstica, es decir, el tiempo transcurrido desde que la paciente es vista en nuestra consulta hasta que se realiza la biopsia, así como la demora de tratamiento, entendiendo ésta como el tiempo transcurrido entre el diagnóstico histológico y el tratamiento quirúrgico definitivo cuando fue demorado. También hemos estudiado la relación de la demora diagnóstica con la malignidad o benignidad del proceso, los hallazgos de la exploración clínica (lesiones palpables o no palpables), la sintomatología clínica cuando la hubo, la edad de las pacientes, el patrón mamográfico de la lesión, el estadio tumoral cuando fueron lesiones malignas y la realización y resultados de la citología por punción.
Los datos de cada paciente han sido recogidos de forma prospectiva en un soporte informático para su posterior estudio.
Hemos utilizado los test de «t» de Student y Chi cuadrado para comparar medias de demora y las relaciones entre variables cualitativas. Asimismo hemos confeccionado curvas de tiempo de demora diagnóstica según el método de Kaplan-Meier,.7 considerando como evento la realización de la biopsia y, dado que todas las pacientes fueron biopsiadas, sin pacientes censuradas. Para la comparación de las curvas de tiempo se utilizó el test de Breslow. Además hemos realizado un estudio regresivo multivariado de Cox.8 para la demora diagnóstica, incluyendo las variables siguientes: malignidad o benignidad del proceso, resultado de la citología, edad, lesión palpable o no palpable, clínica cuando la hubo y patrón mamográfico.
RESULTADOS
La edad media de las 449 pacientes fue de 54,6 ± 7 años. De ellas, 325 (72,4%) estaban completamente asintomáticas en el momento de la consulta, 103 (22,9%) referían haberse notado una tumoración en la mama y el resto (4,7%) referían sintomatología
variada como dolor, retracción o endurecimiento. En las pacientes que referían alguna sintomatología observamos un tiempo de evolución de 34,6 semanas (rango: 0-412). Las lesiones fueron palpables en 213 casos (47%) y no palpables en 236 casos (53%).
El patrón radiológico más frecuente fue el nódulo con espiculaciones con 120 casos (27,2%). Las microcalcificaciones solas o acompañadas por otro patrón mamográfico se encontraron en 160 casos (36,2%) (tabla 1). Presentaron tumores malignos 269 casos (59,9%) y benignos 180 casos (40,1%). El 48,5% de los tumores fueron estadios 0 o I, el 37,9% fueron estadio II y el 13,6% estadio III o IV.
| TABLA 1 | ||
| PRINCIPALES PATRONES MAMOGRÁFICOS | ||
| Patrones | Casos | Porcentaje |
| Nódulo estrellado | 120 | 27,2 |
| Nódulo circunscrito | 63 | 14,3 |
| Distorsión | 90 | 20,4 |
| Microcalcificaciones | 98 | 22,2 |
| Microcalcificaciones + distorsión | 34 | 7,7 |
| Microcalcificaciones + nódulo | 28 | 6,3 |
| Nódulo + distorsión | 8 | 1,8 |
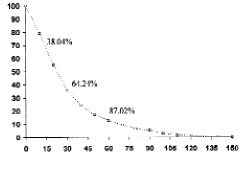
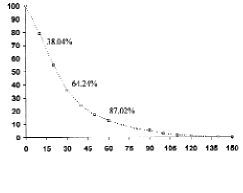
La demora diagnóstica media entre la consulta en la unidad quirúrgica de mama y la biopsia fue de 31,2 días (rango: 1-226). En 15 días el 38,04% de las pacientes ya habían sido diagnosticadas, a los 30 días el porcentaje era del 64,24% y a los 60 días el porcentaje de pacientes biopsiadas alcanzó el (87,02%) (Fig. 1). Cincuenta y cinco pacientes (12,53%) permanecían sin diagnóstico 2 meses después de la consulta, de las cuales 30 (55,5%) eran tumores benignos. A los 3 meses quedaban 24 pacientes (5,47%), de ellas 13 presentaron tumores benignos. Es de destacar que en la mayoría de las pacientes con retrasos superiores a los 2 meses hubo factores personales que demoraron la biopsia. En 94 pacientes (35,6% de los tumores malignos) se demoró el tratamiento definitivo tras la biopsia por ser no palpables o recomendarlo los hallazgos patológicos, con un retraso medio de 24,7 días (3-259).
Fig. 1. Demora diagnóstica de la serie total en porcentajes a los 15, 30 y 60 días de la consulta.
Hemos encontrado una asociación significativa entre las lesiones palpables y la malignidad (p < 0,001). El 70% de las lesiones palpables correspondieron a tumores malignos y sólo el 51% de las lesiones no palpables. Los tumores malignos presentaron una edad media de 56,09 años frente a los benignos de 52,28 años, con diferencias significativas (p < 0,001). No hemos encontrado otras asociaciones entre la clínica previa, la edad, el patrón radiológico, el tamaño clínico del tumor y el resultado patológico de la biopsia.
En 158 pacientes se realizó una citología válida, lo que supone el 35,1% del total de pacientes. En 71 de ellas el resultado fue de benignidad o ausencia de células malignas, mientras que en 87 fue maligna o sospechosa de malignidad. En nuestra serie completa la sensibilidad es del 79,5% y la especificidad del 82,3%, con un valor predictivo positivo del 91% y un valor predictivo negativo del 64,1%.
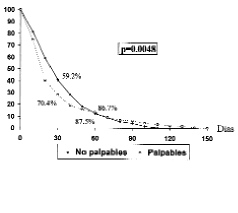
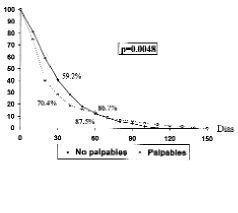
Los tumores palpables tuvieron una demora diagnóstica de 29,78 ± 34,4 días y los no palpables de 32,39 ± 25,6 días sin diferencias significativas; al confeccionar las curvas de Kaplan-Meier el test de Breslow mostró diferencias significativas (p = 0,0048). A los 15 días de la consulta ya se había biopsiado el 46,31% de las lesiones palpables y el 31,33% de los no palpables. A los 30 días las proporciones eran del 70,44% de las palpables y el 59,23% de las no palpables, siendo a los 60 días del 86,70 y el 87,55%, respectivamente (Fig. 2).
Fig. 2. Comparación de la demora diagnóstica entre lesiones palpables y no palpables con significación en el test de Breslow.
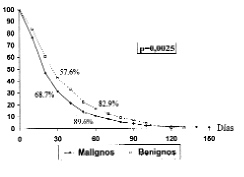
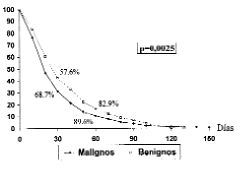
Con relación a los tumores malignos hubo una demora diagnóstica de 28,74 ± 30,4 días, significativamente menor que la de los tumores benignos, que fue de 35,14 ± 29,1 días (p = 0,03). Esta diferencia se confirmó con las curvas de Kaplan-Meier (Fig. 3), con significación en el test de Breslow (p = 0,0025). Las curvas nos demostraron que en los 15 primeros días tras la consulta se había biopsiado el 43,87% de los tumores malignos frente al 29,92% de los benignos. A los 30 días la diferencia era del 68,77% para los malignos y el 57,65% de los benignos, y a los 60 días el 89,59 y el 82,94%, respectivamente.
Fig. 3. Comparación de la demora diagnóstica entre tumores malignos y benignos con significación en el test de Breslow.
Asociando el resultado patológico de la lesión con el tamaño clínico los tumores malignos palpables son los que se biopsian antes (28,12 días) y los benignos no palpables los mas tardíos (35,4 días). No hay diferencias significativas entre los grupos comparables (tabla 2) y en las curvas de Kaplan-Meier no hubo diferencias significativas en el test de Breslow, aunque entre las lesiones palpables malignas y benignas casi se encontró significación (p = 0,0506) (Fig. 4).
TABLA 2 | |||
| COMPARACIÓN DE MEDIA DE DEMORA DIAGNÓSTICA ENTRE LESIONES SEGÚN SU CLÍNICA Y RESULTADO PATOLÓGICO | |||
| Maligno | Benigno | ||
| Palpable | 28,1 | 34,1 | p = 0,267 |
| No palpable | 29,6 p = 0,691 | 35,4 p = 0,793 | p = 0,086 |
Fig. 4. Comparación de la demora diagnóstica entre lesiones palpables o no palpables y malignas o benignas con casi significación estadística entre las lesiones palpables malignas y palpables benignas.
Las curvas de Kaplan-Meier no mostraron diferencias en el test de Breslow para la demora diagnóstica entre los distintos síntomas ni para los distintos patrones radiológicos.
En el estudio multivariado de Cox mostraron diferencias significativas independientemente de las demás variables las siguientes: el síntoma de retracción (p = 0,0091), la citología positiva (p = 0,036) y la malignidad de la lesión (p = 0,047). No alcanzaron significación el tamaño clínico de la lesión, los distintos patrones radiológicos ni otros síntomas clínicos.
DISCUSIÓN
Desde que se inició el programa de detección precoz de cáncer de mama del Gobierno de Navarra.9 la mayoría de las pacientes que acuden a la unidad de patologia mamaria son remitidas por presentar una lesión radiológica sospechosa de malignidad.
Con este sistema de actuación la mujer es relativamente pasiva y, por tanto, la demora en el diagnóstico es, en mayor proporción, responsabilidad del propio sistema..4 El tiempo de demora en el diagnóstico y tratamiento del cáncer de mama se ha demostrado como un factor de importancia en el control de la enfermedad..1 Por otra parte, la sensibilización de la población sobre el diagnóstico precoz genera en las pacientes que presentan una lesión mamográfica una situación de angustia que precisa de una respuesta rápida y eficaz..3
Al igual que otros autores,.2 pensamos que toda lesión mamográfica que presenta la mínima sospecha debe tener un diagnóstico histológico y en nuestro medio el método más fiable es la realización de una biopsia quirúrgica.
Solamente el 35% de la serie ha presentado un resultado de citología válido. Los valores de sensibilidad y especificidad en nuestras manos es menor que el de otras series publicadas,.10-12 probablemente influido porque, a efectos prácticos, en nuestros cálculos se han tratado como «malignas» las lesiones que no eran claramente benignas y que en otros estudios pueden clasificarse como sospechosos o atípicos..12
Nuestro estudio sobre 449 pacientes consecutivas presenta una demora media de 31 días, menor que la mayoría de las publicadas..4, 5 No obstante, en el estudio del tiempo la media no es un valor orientativo ni comparable, puesto que un valor demasiado alto o bajo, influenciado por factores ajenos, la altera demasiado, no dando un valor real de la eficiencia del sistema que se pretende estudiar. Las curvas de supervivencia.7 son estadísticas aplicables a todos los estudios que miden el tiempo en el que ocurre un evento y no sólo la recaída de una enfermedad. Así, hemos encontrado que casi el 40% de las pacientes ya habían sido biopsiadas en 15 días, casi el 65% en el primer mes y el 87% al segundo mes. Estos datos son comparables con los que pudieran tener otras unidades. Cincuenta y cinco pacientes fueron biopsiadas más de 2 meses después tras la consulta. La mayoría de los casos fueron las propias mujeres quienes retrasaron la biopsia. Hay que tener en cuenta que el sujeto de nuestro trabajo son personas con su propia vida, nivel cultural y escala de valores. Eso puede ocasionar que por motivos personales, familiares, laborales o sociales una persona concreta prefiera retrasar su biopsia o su tratamiento definitivo.
La edad media de las pacientes vino limitada por los criterios de selección del programa,.9 que sólo incluye mujeres entre 45 y 65 años. No obstante, los tumores malignos se dieron en mujeres de mayor edad. La proporción de tumores malignos (casi el 60%) y la proporción de tumores en estadios iniciales (48,5%) no son factores que dependan de la unidad quirúrgica, sino que indican criterios de calidad del programa..6
Las lesiones palpables se biopsian antes que las no palpables. Aunque la comparación de sus medias (29,7 frente a 32,4 días) no presentan diferencias significativas, la proporción de pacientes biopsiadas a 15 y 30 días es mayor entre las lesiones palpables, con diferencias significativas en la comparación de curvas. Esto se explica en parte porque la biopsia no precisa la colocación de un arpón guía, por lo que se obvia la colaboración con el radiólogo. Además la citología por punción con aguja fina es una orientación sólo en las lesiones palpables dada la inexperiencia en nuestro centro en citología de lesiones no palpables. Por otra parte, en las lesiones palpables se realizan cortes por congelación inmediatos a la biopsia y tratamiento en el mismo acto quirúrgico si se confirma malignidad, lo que limita el número de biopsias que se pueden programar en una sesión quirúrgica. Las lesiones no palpables consumen tiempo quirúrgico en la comprobación radiológica de la inclusión de la lesión en la pieza quirúrgica, pero permiten la programación de más biopsias en una sola sesión quirúrgica, ya que el estudio histológico es diferido.
Las lesiones malignas se biopsian una media de 7 días antes que las benignas. También las curvas muestran mayor proporción de lesiones malignas biopsiadas a 15, 30 y 60 días, con una importante significación estadística. La información aportada por la citología y la asociación de los tumores malignos con lesiones palpables son factores que explicarían, en parte, esa menor espera de las lesiones malignas para el diagnóstico histológico. La sospecha clinicorradiológica apoyada en la experiencia y prudencia del cirujano es un tercer factor de importancia que ayuda a explicar estos resultados. Como consecuencia de lo anteriormente expuesto las lesiones malignas y palpables son las primeras que se biopsian, aunque sin significación con respecto a las malignas no palpables, y esto apoya la idea de que el factor clinicorradiológico tiene una gran importancia.
El estudio multivariado de Cox nos indica variables que tienen valor independiente. La mayor significación la presenta la retracción, que es poco frecuente, pero que el cirujano-clínico reconoce rápidamente como una lesion de alta probabilidad de malignidad. La segunda variable con significación es la citología, que nos aporta una importante información a la hora de tomar decisiones. Por último, y de forma independiente, el hecho de que una lesión mamográfica presente en la biopsia un tumor maligno es una variable con significación. Este último hecho apoya nuestra idea de que dentro de las lesiones mamográficas que deben ser biopsiadas algunas tienen ciertos estigmas de mayor probabilidad de malignidad que obligan a programar su biopsia con preferencia con respecto a otras. Por ello, y siguiendo las ideas de Silverstein,.2 pensamos que las unidades quirúrgicas de patología mamaria deben estar formadas por cirujanos con especial interés en el tema, experiencia y de un número reducido, pero suficiente para cubrir sus obligaciones y con la mayor estabilidad posible, de manera que existan criterios unificados. Es obligatorio la realización de una correcta historia clínica, ahondando en la historia previa personal y familiar y una exploración concienzuda que posibilite palpar el máximo número de lesiones. La mamografía de la campaña debe ser de máxima calidad.2 e interpretada por los radiólogos de manera que si es necesario pueda completar la información por medio de una ecografía mamaria..11Por último, nos parece obligado realizar citología por punción en el máximo número de lesiones, tanto palpables.10como no palpables,.11, 12esforzándose por conseguir una sensibilidad y especificidad que se aproximen al 90%.
Por todo ello pensamos que los criterios que pueden indicar calidad en una unidad quirúrgica de patología mamaria pueden ser los siguientes (tabla 3):
| TABLA 3 |
| CRITERIOS DE CALIDAD |
| -- Demora diagnóstica, medida en proporción de pacientes biopsiadas en 15, 30 y 60 días. |
| -- Tasa de citologías válidas. |
| -- Proporción de pacientes con tratamiento definitivo diferido y tiempo de demora. |
| -- Experiencia y unidad de criterios de la unidad. |
1. La demora diagnóstica, medida en la proporción de pacientes biopsiados a 15, 30 y 60 días según el método de Kaplan-Meier. En nuestro caso nos parecen aceptables las cifras que presentamos, 40, 65 y 87%, respectivamente.
2. La tasa de citologías válidas, dado que su información puede ser en ocasiones tan válida como la biopsia para algunos autores.10 y es importante para la racionalización de los recursos disponibles. En nuestro caso el 35% nos parece insuficiente y debemos intentar la realización de citología en lesiones no palpables.
3. La proporción de pacientes en los que se demora el tratamiento definitivo, así como el tiempo de demora. En nuestra serie el 35% de los tumores malignos tuvieron un tratamiento en un segundo tiempo debido a la dificultad de un diagnóstico definitivo por congelación. La demora no fue excesiva.
4. La experiencia, estabilidad y unidad de criterios de los cirujanos que conforman la unidad, únicamente medible por el número de años de trabajo en común y por el resultado de los criterios precedentes.
RESUMEN
Introducción. El objetivo del trabajo es estudiar la demora diagnóstica en una unidad de patología mamaria asociada a un programa de detección precoz de cáncer de mama y definir los criterios que indican calidad.
Pacientes y método. Son 449 pacientes biopsiadas por nuestra unidad derivadas por un programa de detección precoz. Hemos estudiado la demora diagnóstica y su relación con el resultado histológico de la biopsia, la exploración física, la clínica, la edad, el patrón mamográfico, los resultados de la citología y el estadio tumoral en las lesiones malignas.
Resultados. La demora diagnóstica media fue 31,2 días. La proporción de pacientes biopsiadas a los 15, 30 y 60 días fue 38, 64 y 87%, respectivamente. Se realizó una citología válida en el 35% de los casos. Las lesiones palpables se biopsiaron estadísticamente antes que las lesiones no palpables y los tumores malignos antes que los benignos. La retracción, la citología y la malignidad son factores independientes con significación relacionados con la demora en el estudio de Cox.
Conclusiones. La proporción de pacientes biopsiadas en 15, 30 y 60 días, la tasa de citologías válidas, la proporción de pacientes con tratamiento definitivo demorado, el tiempo de demora de tratamiento y la unidad de criterios de los componentes de unidad son los criterios de calidad.
REFERENCIAS
1. Tabár L, Fagerberg CJG, Gad A, Baldetorp L, Holmberg LH, Grontoft O, et al. Reduction in mortality from breast cancer after mass screening with mammography. Lancet 1985;i:829-32.
2. Silverstein MJ, Gamagami P, Colburn WJ, Gierson ED, Rosser RJ, Handel N, et al. Nonpalpable breast lesions: diagnosis with slightly overpenetrated screen-film mammography and hook wire-directed biopsy in 1,014 cases. Radiology 1989;171:633-8.
3. Wardle J, Pope R. The psychological costs of screening for cancer. J Psychosom Res 1992;36(7):609-24.
4. Caplan LS, Helzlsouer KJ. Delay in breast cancer: a review of the literature. Public Health Rev 1992;20(3-4): 187-214.
5. Valenzuela Ruiz P. Control de calidad asistencial en el diagnóstico y tratamiento del cáncer de mama. Rev Senología Patol Mam 1996;9(2):57-60.
6. Paci E, Ciatto S, Buiatti E, Cecchini S, Palli D, Rosselli del Turco M. Early indicators of efficacy of breast cancer screening programmes. Results of the Florence district programme. Int J Cancer 1990;46(2):198-202.
7. Kaplan EL, Meier P. Nonparametric stimations from incomplete observations. J Am Stat Assoc 1958;53: 457-81.
8. Cox DR. Regresion models and life tables (with discussion). J Stat Soc 1972;34:187-220.
9. Ascunce N, Del Moral A, Murillo A, Alfaro C, Apesteguia L, Ros J, et al. Early detection programme for breast cancer in Navarra. Spain. Eur J Cancer Prev 1994;3(suppl 1):41-8.
10. Masood S, Frykberg ER, McLellan GL, Scalapino MC, Mitchum DG, Bullard BR. Prospective evaluation of radiologically directed fine-needle aspiration biopsy of nonpalpable breast lesions. Cancer 1990;66:1480-7.
11. Sneige N, Fornage BD, Saleh G. Ultrasound-guided fine-needle aspiration of nonpalpable breast lesions (cytologic and histologic findings). Am J Clin Pathol 1994;102:98-101.
12. Willis Sl, Ramzy I. Analysis of false results in a series of 835 fine needle aspirates of breast lesions. Acta Cytol. 1995;39(5):858-64.