Los últimos años han representado un avance extraordinario en el conocimiento de los mecanismos moleculares implicados en el origen y desarrollo de tumores humanos1, aunque su etiología siga sin conocerse en la mayoría de los casos2. El estudio detallado de algunos tipos de tumores como, por ejemplo, el de cáncer de colon3 ha establecido claramente que la acumulación progresiva de alteraciones genéticas que afectan fundamentalmente a oncogenes y a genes supresores de tumores constituyen la base molecular del desarrollo neoplásico. La mayoría de los casos diagnosticados como carcinoma de mama (por encima del 90 %) pertenecen a la categoría de tumores esporádicos4. A pesar de la abundante información proporcionada por estudios epidemiológicos sobre modelos de incidencia y de la evaluación de factores de riesgo, la etiología del carcinoma esporádico de mama sigue sin conocerse. Por el contrario, estudios citogenéticos y moleculares de células derivadas de tumores humanos y el análisis de modelos animales de carcinogénesis experimental han supuesto un avance significativo en el conocimiento actual de las alteraciones genéticas que tienen lugar durante la iniciación y progresión del carcinoma de mama. Estos estudios han demostrado que el carcinoma de mama es un tipo de tumor muy heterogéneo, cuyo desarrollo implica la acumulación de diversas alteraciones del genoma en células somáticas incluyendo procesos de amplificación, deleción y mutaciones puntuales5,6. La identificación de algunos de los genes afectados por estas alteraciones (HER-2/erbB-2/neu, p53, CCDN1) ha proporcionado marcadores de utilidad para el diagnóstico, clasificación y pronóstico de los tumores. Sin embargo, todavía se desconoce la secuencia temporal exacta en que dichas alteraciones van teniendo lugar en el curso de la progresión maligna de los carcinomas de mama, y los genes implicados en la mayoría de las alteraciones cromosómicas detectadas en los mismos aún no han sido identificados.
En nuestro laboratorio hemos utilizado un sistema modelo de carcinogénesis experimental para la detección de genes implicados en los estadios iniciales del desarrollo tumoral. El sistema utiliza cultivos primarios de células mayoritariamente fibroblastos aisladas de embriones de hámster "sirio" o "dorado"en el día 13 del desarrollo7. Las células se siembran en cultivos diluidos de tal forma que, cuando proliferan, dan lugar a colonias separadas unas de otras. Los cultivos se tratan una sola vez con una dosis única del carcinógeno(s) elegido(s) y, al cabo de 7 a 10 días, es posible observar en el microscopio la aparición de colonias que han sufrido alteraciones morfológicas como consecuencia de la acción del carcinógeno al que fueron expuestas. Estas colonias se pueden aislar fácilmente como clones individuales y estudiar en ellas las alteraciones genéticas subyacentes. Utilizando este procedimiento, clonamos un oncogén nuevo8, que denominamos PCPH, activado por la acción del carcinógeno ambiental 3-metilcolantreno. La demostración de que PCPH era un oncogén se basó en la habilidad de la molécula recombinante de inducir la formación de focos de células transformadas en ensayos de transfección en fibroblastos de ratón NIH3T39. Además, utilizando este mismo ensayo, pusimos de manifiesto que PCPH actúa de forma sinérgica con el oncogén H-ras en el proceso de transformación celular8.
Análisis de las secuencias de nucleótidos de los cDNAs de PCPH aislados de células de hámster normales y tumorales permitieron establecer el mecanismo molecular de su activación oncogénica: una deleción puntual localizada aproximadamente en la mitad del marco de lectura abierto del gen normal. Como consecuencia de dicha deleción se producía un cambio de marco de lectura, ocasionando una truncación del marco normal y la inclusión de 33 codones adicionales antes de la introducción del primer codón de terminación presente en el nuevo marco de lectura. Cuando se compara con la proteína normal, el producto del oncogén PCPH es una proteína truncada que contiene los mismos primeros 213 aminoácidos presentes en la proteína normal seguidos de un extremo carboxilo formado por 33 aminoácidos esencialmente hidrofóbicos, ausentes en la proteína normal10. Mientras que la proteína normal tiene, de acuerdo con la secuencia de nucleótidos del cDNA, una masa molecular de 47 kDa, la masa molecular de la oncoproteína es de ~30 kDa. Estudios más recientes, aún no publicados, sugieren que la adición del péptido hidrofóbico en el extremo carboxilo hace que la oncoproteína PCPH se localice en el retículo endoplásmico en células transformadas, mientras que la proteína PCPH normal es una proteína soluble, de localización citoplásmica. Estos datos están basados en la detección en el microscopio de la fluorescencia emitida en diferentes compartimientos celulares por proteínas recombinantes diseñadas como fusiones entre las proteínas PCPH normal u oncogénica en el extremo amino-terminal de la fusión y la denominada "proteína fluorescente verde" (green fluorescent protein, GFP) en el extremo carboxilo de la molécula híbrida.
Análisis de hibridación de DNA y RNA extraídos de diversas especies, de varios tipos de tejidos y de embriones de ratón en diversos estadios de desarrollo con sondas específicas de PCPH demostraron que PCPH es un gen con alto grado de conservación evolutiva en organismos eucarióticos, ya que se encuentra representado desde organismos unicelulares como las levaduras hasta en las células humanas11. Recientemente hemos aislado los homólogos de ratón12 y humano13. El alto nivel de conservación evolutiva de PCPH sugirió que su función normal podría estar relacionada con algún proceso central en el metabolismo celular que, al ser alterado, causaría la conversión neoplásica. Con objeto de entender esa posible función se construyeron vectores para la expresión del PCPH normal y oncogénico en diversos tipos celulares (fibroblastos primarios de hámster y rata, fibroblastos inmortales de ratón NIH3T3, fibroblastos COS-7 de mono transformados por el virus SV40, y células epiteliales 293 derivadas de riñón embrionario humano transformadas por adenovirus). Una de las características observadas consistentemente en células transfectadas con la versión oncogénica de PCPH fue la inducción en las mismas de un "loop" autocrino14 provocado por la co-expresión incrementada tanto del receptor erbB-2 (HER2/neu) como de heregulina (neuregulina, NDF) a2b15, conocido ligando de varios receptores de la familia erbB, cuyo prototipo es el receptor del factor de crecimiento epidérmico (EGFR, erbB-1). Teniendo en consideración que a erbB-2 se le ha atribuido un papel importante en el desarrollo de los tumores esporádicos de mama16, estos resultados proporcionaron la base para sugerir la posibilidad de que PCPH estuviera implicado de alguna manera en el desarrollo del cáncer de mama.
Como primera aproximación experimental para estudiar la posible participación de PCPH en el desarrollo de carcinomas de mama, llevamos a cabo un análisis de la expresión de la proteína producto del mismo en dos sistemas: a) líneas celulares tumorales y tumores sólidos humanos, mediante técnicas de inmunocitoquímica y western análisis utilizando un anticuerpo policlonal anti-PCPH (367-10W) obtenido de conejos inmunizados con la proteína PCPH normal expresada en Escherichia coli, y b) tumores de mama inducidos experimentalmente en ratas por tratamiento con dimetilbenz(a)antraceno (DMBA)17,18. En cuanto a los estudios con líneas celulares derivadas de tumores de mama humanos, conviene hacer referencia a la especificidad del antisuero anti-PCPH para entender el posible significado de los resultados obtenidos. Aunque como se indicó anteriormente el anticuerpo 367-10W se obtuvo frente a la proteína normal PCPH completa, análisis de células transfectadas con el oncogén PCPH demostraron que el anticuerpo también reconocía la oncoproteína truncada, por lo que se convirtió en un instrumento de gran utilidad diagnóstica que teóricamente nos permitiría detectar ambas proteínas, normal y oncogénica, en análisis por técnicas de western o inmunoprecipitación en cada muestra, incluso simultáneamente siempre que las líneas celulares o tumores sólidos en estudio tuvieran mutado al menos uno de los dos alelos del oncogén PCPH.
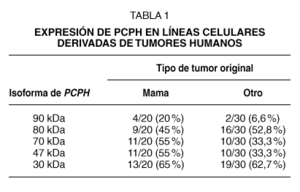
El estudio inicial incluyó un total de 50 líneas celulares tumorales, de las cuales 20 derivaban de carcinomas esporádicos de mama19. Los resultados de este análisis indicaron que, además de los polipéptidos esperados (47 kDa para la proteína normal y ~30 kDa para la oncoproteína) se detectaban en un buen número de líneas celulares otros polipéptidos de alto peso molecular (70, 80 y 90 kDa). La frecuencia con que la variedad de formas de PCPH fue detectada en líneas tumorales de mama fue mayor que las observadas en líneas celulares derivadas de otros tipos de tumores humanos entre los que se incluían líneas representativas del sistema nervioso, colon, pulmón y páncreas (tabla 1). Pero el dato que resultaba potencialmente más importante era que, en el caso de las líneas celulares de cáncer de mama, un número significativo de las mismas (13 de 20) mostraban la presencia de un polipéptido de ~30 kDa, lo que sugería inicialmente la existencia de una frecuencia elevada en este tipo de cáncer de una mutación de PCPH similar a la que se describió originalmente en las células de hámster10. En conjunto, la existencia de formas de alto peso molecular y de formas posiblemente truncadas parecería indicar que la regulación de la expresión y/o el procesamiento postraduccional de PCPH podrían estar alterados en una proporción elevada de tumores de mama humanos, y que PCPH jugaría un papel importante en la progresión maligna de los mismos.
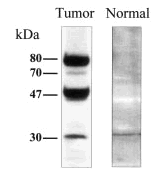
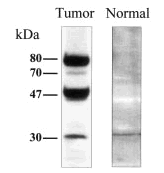
Para comprobar este punto se llevó a cabo un experimento control en que se utilizaron extractos totales de células epiteliales humanas aisladas de diferentes órganos, incluyendo la glándula mamaria, con objeto de determinar cuáles de los diversos polipéptidos detectados en líneas celulares tumorales con el anticuerpo anti-PCPH se expresaban también en células normales. Sorprendentemente, cuando cabía esperar que las células normales sólo expresasen la forma de 47 kDa, los resultados obtenidos demostraron que la única forma de PCPH detectable en células epiteliales normales era la de ~30 kDa (fig. 1).
Fig. 1. Modelo de movilidad electroforética característica de las isoformas de PCPH detectables en análisis de tipo western por el anticuerpo 367-10W en extractos totales de células derivadas de tumores de mama o del epitelio de mama normal.
Con pequeñas variaciones, que se podrían justificar como específicas de la especie, la situación era similar en el caso de los resultados obtenidos del análisis de tumores experimentales de rata. Aunque éstos serán objeto de una publicación independiente, se puede adelantar que en la glándula mamaria normal de la rata virgen el antisuero anti-PCPH detecta un polipéptido principal de ~30 kDa y otro de 47 kDa que es mucho menos abundante. En la glándula mamaria de la rata lactante se detecta el mismo modelo cualitativo de formas de PCPH, pero se observa un incremento muy significativo en los niveles de expresión, llegando a ser de alrededor de 14 veces superiores a los de la rata virgen, lo que sugeriría la posibilidad de que los niveles de PCPH estén modulados por el estado de diferenciación celular de la glándula mamaria. En tumores, sin embargo, la forma predominante es la de 47 kDa, aunque en algunos se detectan también la forma de ~30 kDa y alguna de las formas de alto peso molecular. Es interesante indicar que este patrón típico de formas de PCPH es similar independientemente de que se trate de tumores benignos o malignos, y que la abundancia de la forma de 47 kDa en tumores es siempre inferior a la de la forma de ~30 kDa en la glándula mamaria normal de la rata virgen.
En conjunto, estos resultados son importantes porque aportan información desconocida hasta el momento en cuanto al aparente procesamiento de la proteína PCPH en células normales que convierte la forma de 47 kDa en una forma de menor masa molecular (~30 kDa), y porque podrían indicar que las alteraciones en el procesamiento postraduccional de PCPH, que resultan en la aparición de isoformas de mayor y menor masa molecular, observadas en la mayoría de las líneas celulares estarían relacionadas con el desarrollo del fenotipo neoplásico. Los datos citados sobre la detección de formas de PCPH en tumores benignos de rata sugerirían que la alteración del procesamiento post-traduccional de PCPH podría ser un evento que tuviera lugar en las etapas de iniciación del proceso de conversión neoplásica. En la actualidad estamos en las fases iniciales del estudio de la expresión de PCPH en tumores humanos por técnicas de inmunohistoquímica con el anticuerpo 367-10W. Análisis de tejidos normales como control han confirmado, en líneas generales, los datos obtenidos con anterioridad con técnicas de northern y western acerca de la expresión del RNA y la proteína PCPH en extractos totales de tejidos humanos13. En cuanto a los datos obtenidos con tumores, es preciso dejar claro que son todavía muy preliminares, ya que el número de muestras examinadas hasta ahora es insuficiente para llegar a ninguna conclusión estadísticamente significativa. Sin embargo, parece haber una cierta especificidad basada en el tipo de tumor en lo referente a la tendencia a que la expresión de PCPH esté aumentada o disminuida respecto a los controles normales. Por ejemplo, la mayoría de las muestras de tumores de pulmón o de hígado analizadas hasta la actualidad muestran un claro incremento en la expresión de PCPH. En otros casos, entre los que se incluirían los tumores de mama, la tendencia no es tan clara y unos tumores muestran niveles elevados de PCPH mientras que en otros no es ni siquiera detectable.
Evidentemente, estos estudios deben continuarse aumentando el número de muestras para alcanzar niveles de significatividad estadísticamente adecuados. Sin embargo, por el momento se observa una tendencia muy interesante: la localización de PCPH es preferentemente intersticial en tumores en los que se detectan niveles incrementados en su expresión. Considerando que, primero, este tipo de localización no se ha detectado en tejidos normales y, segundo, que como se indicó más arriba en líneas celulares tumorales se detectan lo que parecen ser formas alteradas del procesamiento postraduccional de PCPH, hemos llegado a plantear como hipótesis de trabajo que alguna de las formas de PCPH procesadas diferencialmente en células tumorales pueda ser secretada. Esta(s) forma(s) secretadas se detectarían con una localización intersticial por técnicas de inmunohistoquímica.
La posibilidad de que PCPH se secrete de células tumorales provoca la discusión sobre si la acumulación de PCPH en el espacio intercelular contribuye a la progresión neoplásica de las células que lo producen, de las que las rodean o de ambas. Recientemente hemos descrito que PCPH, tanto la proteína normal como la oncoproteína, tienen actividad ribonucleótido-fosfatasa20. Es decir, ambas proteínas son capaces de hidrolizar los enlaces entre los radicales fosfato presentes en ribonucleótidos difosfato y trifosfato (GDP, UDP, ATP, etc.). Sin embargo, no tienen actividad ni frente a ribonucleótidos monofosfato, ni sobre ninguno de los desoxirribonucleótidos. Las diferentes formas de PCPH parecen tener distintos grados de afinidad por difosfatos como GDP, UDP o ADP, o por los trifosfatos correspondientes10,20. Se puede especular que la actividad de PCPH, tanto en el exterior como en el interior celular, podría causar un desequilibrio en la concentración intracelular total, y en las proporciones relativas, de nucleótidos tan importantes para el metabolismo celular como ATP/ADP, GDP/GTP, etc. Estos desequilibrios tendrían serias repercusiones en procesos celulares como la transmisión de señales, la iniciación de una respuesta apoptótica a agentes genotóxicos, los puntos de restricción del ciclo celular, etc., ya que que dichos procesos usan GDP/GTP, ADP/ATP o la concentración total de ribonucleótidos como indicadores y/o mediadores primarios en la regulación de la actividad o inactividad de enzimas implicados en sus diferentes fases. En nuestro laboratorio hemos obtenido evidencia de que nuestra hipótesis de trabajo podría ser correcta: la expresión de PCPH normal o mutante resulta en alteraciones marcadas en los sistemas de transmisión de señales a través de la cascada de Ras/Raf/MAPKs20 y, por otra parte, la expresión del oncogén PCPH convierte a las células en resistentes a diversas formas de estrés como la ausencia de suero en el medio, hipertermia, radiaciones ionizantes y agentes quimioterápicos como el cis-platino10. Resultados aún no publicados han demostrado que esta resistencia a estrés inducida por el oncogén PCPH está directamente relacionada con la inhibición de la iniciación del proceso de apoptosis provocada por la disminución significativa de los niveles intracelulares de ATP que resulta como consecuencia de la actividad ribonucleótido phosphatasa de la oncoproteína PCPH. La disminución en los niveles de ATP causada por la expresión de la proteína normal es menos pronunciada, y esto explicaría que células transfectadas con el proto-oncogén no se hagan tan resistentes a estrés como las que expresan el oncogén10.
Esta última característica de las células que expresan el oncogén PCPH puede tener repercusiones importantes en el tratamiento de tumores que expresen formas mutantes de PCPH con protocolos de radioterapia o quimioterapia, incluyendo los tumores de mama. Uno de los objetivos principales de la investigación que se lleva a cabo en la actualidad en nuestro laboratorio es llegar a entender los mecanismos por lo que el oncogén PCPH influye en los mecanismos de respuesta al estrés en células normales hasta convertirlas en neoplásicas y resistentes. A más largo plazo, un objetivo importante es encontrar medios aplicables clínicamente para revertir el proceso inducido por PCPH y sensibilizar las células tumorales antes, o durante, el tratamiento de los pacientes con quimioterapia o radioterapia. Las líneas celulares derivadas de cáncer de mama y los tumores esporádicos de mama junto a los sistemas animales de carcinogénesis constituyen nuestros modelos experimentales principales para alcanzar dichos objetivos.