La mamografía con contraste (CEM) es una nueva y prometedora técnica de imagen basada en la neovascularización de los tumores de manera similar a la resonancia magnética de la mama. Los resultados de los estudios clínicos muestran que su rendimiento diagnóstico es significativamente mejor que el de la mamografía digital convencional, y que sus valores de sensibilidad y especificidad la hacen comparable con la resonancia magnética. Sus usos actuales y los propuestos incluyen la evaluación adicional de pacientes sintomáticos o pacientes con exámenes previos anormales, la evaluación de la extensión local de los cánceres de mama recién diagnosticados, el seguimiento de la quimioterapia neoadyuvante y la detección del cáncer de mama en pacientes de alto riesgo. Aunque la técnica se aprobó para uso clínico en 2010, todavía es poco conocida. En esta revisión, presentamos la técnica CEM y sus resultados de rendimiento de diagnóstico comparados con la mamografía convencional y la resonancia magnética de la mama. También presentamos los diferentes escenarios en los que se puede utilizar con éxito, tanto en el diagnóstico de la enfermedad de mama, como en la estadificación local del cáncer de mama, así como su papel potencial en los programas de detección del cáncer de mama.
Contrast-enhanced mammography (CEM) is a promising new imaging technique based on neovascularisation of the tumour, similar to magnetic resonance imaging of the breast. The results of clinical studies show that its diagnostic performance is significantly better than that of conventional digital mammography, and that its sensitivity and specificity are comparable to those of magnetic resonance imaging. Its current and proposed uses include further evaluation of symptomatic patients or patients with abnormal results on previous examinations, assessment of the local extension of newly diagnosed breast tumours, follow-up of neoadjuvant chemotherapy and detection of breast cancer in high-risk patients. Although the technique was approved for clinical use in 2010, it is still little known. In this review, we present the technique of CEM and its results in terms of diagnostic performance compared with conventional mammography and breast MRI. We also discuss the various scenarios in which it can be used successfully, both in the diagnosis of breast disease and in the local staging of breast cancer, as well as its potential role in breast cancer screening programmes.
La mamografía sigue siendo la modalidad de diagnóstico por imagen de elección para el estudio de las lesiones mamarias en pacientes sintomáticas de más de 40 años, así como la única técnica admitida hoy en día para el cribado poblacional1,2. Sin embargo, numerosos estudios indican que la mamografía produce tanto un alto porcentaje de falsos positivos —lo que lleva a rellamadas innecesarias para la realización de estudios complementarios que generan gran ansiedad en las mujeres— como de falsos negativos, con una serie de cánceres que no se detectan a tiempo1,3-8.
Desde los años 90, la mamografía analógica ha evolucionado a la mamografía digital de campo completo (FFDM). En términos generales, la precisión diagnóstica de la FFDM y de la mamografía analógica como medio de detección del cáncer de mama es similar, si bien la FFDM presenta ciertas ventajas diagnósticas, siendo más precisa en mujeres menores de 50 años, mujeres con mamas radiográficamente densas y mujeres premenopáusicas o perimenopáusicas9. Además, la FFDM presenta muchas ventajas, como la alta calidad de las imágenes y su manejo mucho más eficiente, el almacenamiento digital seguro de las imágenes y su vinculación electrónica con los historiales médicos. Además, la digitalización de la imagen permite la posibilidad de su posprocesamiento, dando lugar a la aparición de nuevas técnicas diagnósticas, como la tomosíntesis o la mamografía con realce de contraste10-12. Centrándonos en la mamografía con contraste (CEM, por el acrónimo de la denominación en inglés contrast-enhanced mammography), la técnica se lanzó en 2010 (Senobright®, General Electric Healthcare®, Buckinghamshire, Reino Unido) y hoy en día está disponible bajo varias marcas comerciales de diferentes proveedores.
En esta revisión, presentamos la técnica CEM y sus resultados de rendimiento diagnóstico comparados con los de la mamografía convencional y la resonancia magnética de la mama. También presentamos los diferentes escenarios en los que se puede utilizar con éxito, tanto en el diagnóstico de la enfermedad de mama, como en la estadificación local del cáncer de mama, y su papel potencial en los programas de detección del cáncer de mama.
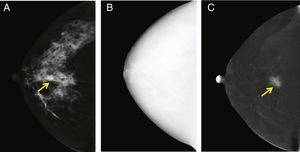
La técnica CEMLa CEM se basa en 2principios: 1) la neovascularización de los tumores que permite la difusión del medio de contraste hacia el tejido tumoral, y 2) la atenuación que sufren las radiaciones X cuando pasan a través de materiales de diferente composición, en este caso el yodo y los tejidos blandos. En la CEM, tras la administración del contraste yodado, se obtienen 2imágenes consecutivas para cada proyección, una por debajo y otra por encima del borde de absorción de energía de yodo K (33,2 kVp). La imagen de baja energía es totalmente equivalente a una FFDM13-15 (fig. 1). La imagen de alta energía permite adquirir la información de la captación de contraste10,16. Esta imagen es inadecuada para ser utilizada con fines de diagnóstico (fig. 2)10 pero permite aplicar un algoritmo de sustracción para obtener una imagen recombinada en la que se visualizan las áreas de captación de contraste, mientras que las áreas de tejido mamario normal permanecen visibles solo como fondo anatómico11.
Examen típico de la CEM (solo se muestra la vista cráneo-caudal derecha), que consiste en una imagen de baja energía (A), alta energía (B) y recombinada (C). En la imagen de baja energía se observa una imagen sospechosa, que se realza claramente en la imagen recombinada. El tumor capta el medio de contraste debido a su neovascularización. La histopatología mostró que era un carcinoma ductal invasivo. La imagen de alta energía (B) no es útil para fines de diagnóstico, pero se utiliza para la construcción de la imagen recombinada.
El estudio CEM dura unos 7 min. Dos minutos después de la administración por vía intravenosa del medio de contraste yodado, en nuestro centro se comienza estudiando la mama no sospechosa, obteniendo las 2proyecciones, cráneo-caudal y oblicua medio-lateral en este orden y luego se estudia el seno contralateral «patológico» en el orden inverso. Hay otras secuencias de realización descritas en la literatura. Si bien el orden no parece influir en el resultado final del estudio, es recomendable que una vez establecido el protocolo que se va a seguir este no se cambie. Un trabajo reciente ha indicado que, si bien se recomienda un tiempo mínimo de 1,5-2 min desde la administración por vía intravenosa del medio de contraste yodado hasta que se comienzan a adquirir las imágenes, esta ventana de tiempo puede extenderse hasta los 8 min. Esto resultaría útil si, por ejemplo, se quisiera realizar una CEM después de realizar una tomografía computarizada con contraste, ya que no sería necesario administrar una segunda dosis de medio de contraste yodado17. Una posible limitación de este estudio es que solo se evaluaron cánceres conocidos en cuanto a su presencia/ausencia y grado de captación del medio de contraste, lo cual podría haber tenido impacto en la precisión del diagnóstico de la CEM.
DesventajasUna de las principales desventajas de la CEM es que la dosis media de radiación glandular que recibe el paciente puede ser de hasta un 80% más alta que la de la FFDM, dependiendo de la densidad mamaria o del equipo de diagnóstico utilizado18-20. Sin embargo, la dosis de radiación varía significativamente según el proveedor del equipo y está en parte relacionada con el hecho de que el equipo del proveedor tenga o no en cuenta la densidad mamaria13. En todo caso, la radiación glandular media recibida en el estudio completo por ambos sistemas cumple con las normas de seguridad de referencia21. Recientemente, se ha estudiado si la lectura de una sola proyección (oblicuo medio-lateral) podría utilizarse sin pérdida significativa de sensibilidad o especificidad. Esto permitiría compensar el aumento de la dosis de radiación que plantea la CEM22. Sin embargo, los autores llegaron a la conclusión de que no se recomienda el uso de la visión única CEM, ya que no cumplía con su margen de inferioridad (o reducción del rendimiento diagnóstico que se toleraría) que había sido previamente definido por los autores.
Otro posible aspecto negativo de la CEM es que es necesario que el personal esté familiarizado con la identificación y el tratamiento de posibles reacciones adversas al medio de contraste yodado (tabla 1). Además, existe el riesgo de causar una nefropatía inducida23, aunque estudios recientes han indicado que, al menos en pacientes ambulatorios en buen estado físico sin factores de riesgo de insuficiencia renal inducida por contraste, el riesgo es insignificante y que no es necesario realizar una evaluación previa de la función renal24. Los artefactos de movimiento no suelen ser un problema importante, ya que la duración del examen es corta y bien tolerada por los pacientes. El artefacto «borde» es más frecuente, apareciendo como una zona de mayor densidad en la periferia de la mama en la imagen recombinada, debido a la dispersión de la radiación. Sin embargo, al estar situada en la periferia de la imagen, la interferencia en la interpretación del diagnóstico es mínima. Además, se dispone de módulos de software que permiten corregir o reducir considerablemente estos artefactos25. Otro artefacto que se observa con frecuencia es la distribución del medio de contraste que imita las microcalcificaciones26.
Resumen de las principales ventajas y desventajas de la CEM
| Ventajas | Desventajas |
|---|---|
| Rápida (7 min) | Una dosis de radiación glandular más alta (alrededor del 80% más) que la mamografía convencional |
| Fácil de reproducir y de interpretar | Debe realizarse en ayunas (debe programarse) |
| Económica (en comparación con la resonancia magnética), aunque los costes son aproximadamente un 20% más altos que la FFDM | No puede realizarse en pacientes con posibilidad de reacción adversa al yodo sin premedicación |
| Bien tolerada por las pacientes | No debe realizarse en pacientes con insuficiencia renal |
| Proporciona el estudio mamográfico de rutina y la imagen recombinada en un solo procedimiento | Puede haber algún caso de reacción adversa |
| Estudia ambas mamas en el mismo procedimiento | El rendimiento diagnóstico en pacientes con prótesis de mama es menor |
| Se puede realizar en pacientes que llevan marcapasos o material metálico, así como a pacientes claustrofóbicas y muy obesas |
Desde el lanzamiento de la CEM, se hizo evidente la importancia de un léxico estandarizado para describir las características de las imágenes de la CEM, similar al de la FFDM, el ultrasonido de mama y la resonancia magnética (RM) de mama (ACR BI-RADS®, American College of Radiology, Reston, EE. UU.)27,28. Dada la similitud entre la CEM y la RM29,30, varios autores han propuesto el uso del léxico MRI-BI-RADS® para la descripción y la clasificación de las lesiones estudiadas por la CEM31-33. Estos estudios han concluido que las discrepancias parciales en la interpretación de los descriptores no influyen en la puntuación final de la escala BI-RADS®, lo que permite la clasificación correcta de alrededor del 90% de las lesiones, tanto benignas como malignas, que es un porcentaje similar al de las imágenes de RM que utilizan la misma escala. Por lo tanto, para la interpretación de la CEM se utiliza un doble léxico: la interpretación de la imagen de baja energía se haría con los criterios del léxico FFDM-BI-RADS®, y sería totalmente equivalente a la mamografía convencional13-15, y la de la imagen recombinada se haría con los criterios del léxico MRI-BI-RADS® de la RM34. Lo ideal es que en el informe se incluyan ambas interpretaciones.
Rendimiento diagnóstico de la CEMLos diferentes estudios disponibles indican que el rendimiento diagnóstico general de la CEM es alto. Así la sensibilidad media calculada oscila entre el 92,7 y el 100%, siendo la especificidad algo menor, aunque los estudios muestran una gran variabilidad en función del tipo de lesiones estudiadas (entre el 41 y el 87,7%). También son altos los valores calculados para el valor predictivo positivo y el valor predictivo negativo, con un promedio del 93 y el 85%, respectivamente13,35-42.
Sin embargo, a pesar de su mejor rendimiento, todavía hay un porcentaje de falsos positivos y falsos negativos. Parece que ciertos tipos de tumores son más propensos a producir falsos negativos, aunque la heterogeneidad de las series estudiadas hasta ahora no permite sacar conclusiones muy sólidas. Si bien algunos estudios indican que los carcinomas lobulares invasivos tienen una alta tasa de falsos negativos por CEM29,43, otros estudios encuentran asociación de los falsos negativos relacionados con otros tipos de tumores, como el carcinoma ductal infiltrante, el carcinoma ductal in situ o el angiosarcoma39,44-46. Un alto porcentaje de los falsos negativos se registran en mamas densas, donde la naturaleza del parénquima mamario dificulta la distinción de las lesiones que solo se realzan sutilmente por el medio de contraste43,47. Como promedio, los mencionados estudios indican que el porcentaje de falsos negativos se sitúa en torno al 4-5%.
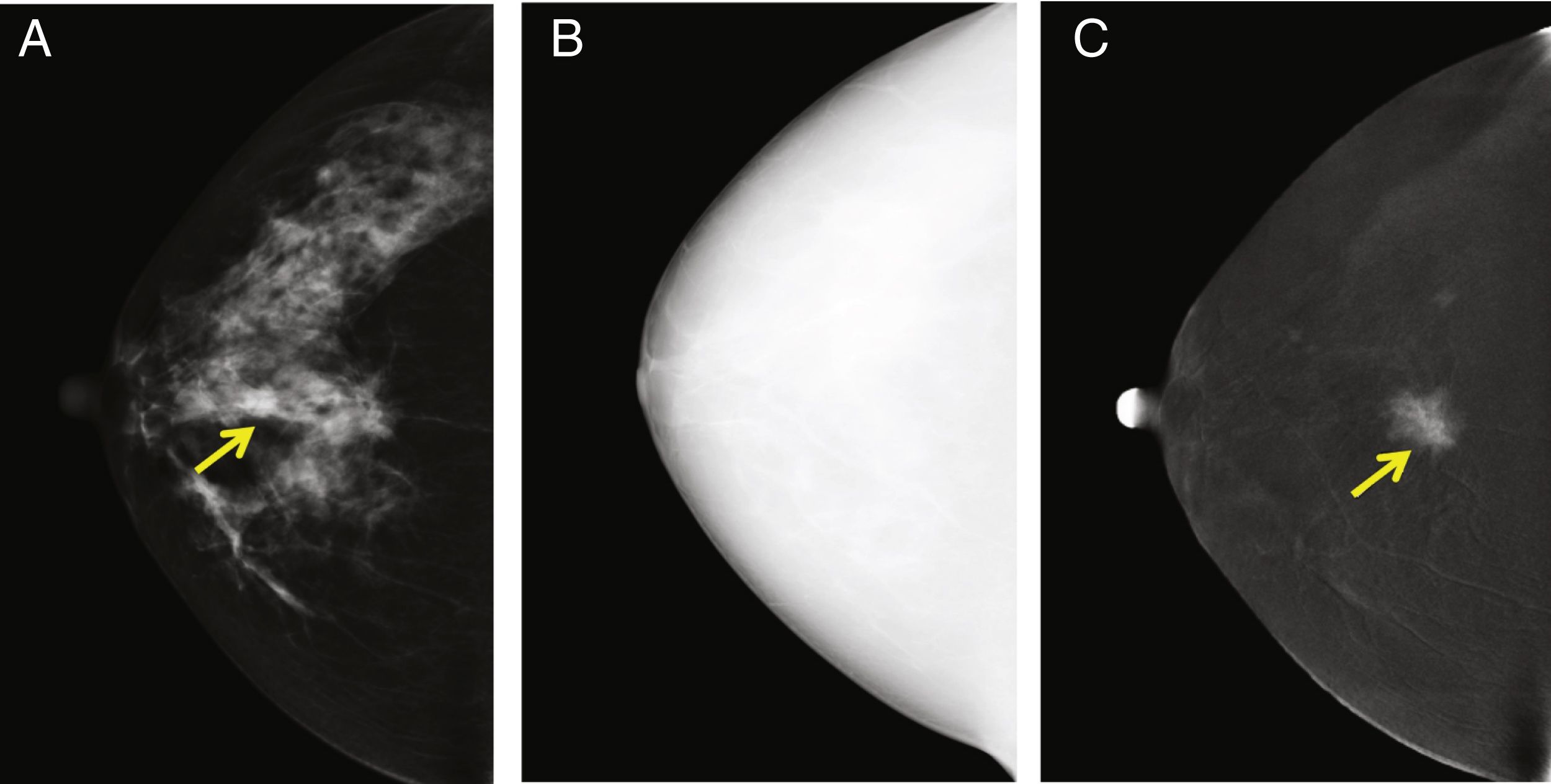
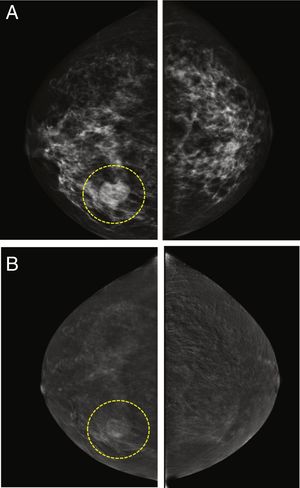
Por otro lado, algunas lesiones benignas pueden ser realzadas por el medio de contraste, incluso de manera intensa. Esto ocurre frecuentemente en el caso de los fibroadenomas, pero también de otras lesiones benignas, como el hamartoma, los ganglios intramamarios, la mastopatía diabética, la necrosis de grasa, los quistes infectados o las cicatrices radiales (fig. 3). Considerando la combinación de la captación de contraste y los descriptores de benignidad/malignidad31-33, los diferentes estudios reportan entre un 3 y un 6% de falsos positivos, lo que contribuye a que los valores de especificidad de la CEM sean menores que los de sensibilidad39,43,48-50.
Fibroadenoma en el cuadrante inferior interno de la mama derecha. La lesión era palpable en el examen clínico. A) Imágenes de baja energía del estudio CESM donde se puede ver el nódulo. B) Imagen recombinante que muestra un patrón de realce del área sospechosa. Sin embargo, la definición de los bordes, la forma redondeada, el bajo grado de captación del medio de contraste y la homogeneidad de la distribución del medio de contraste yodado sugieren la existencia de una lesión benigna.
Hasta ahora, todos los estudios han mostrado una mejora significativa en la sensibilidad y la especificidad de la CEM en comparación con la FFDM (+ 3,9 al 21,2%, y + 6 al 45,7%, respectivamente)13,35,36,38-41,43. La gran discrepancia en los valores calculados en los diferentes estudios se debe probablemente al hecho de que las series de lesiones estudiadas son muy diferentes entre sí. En algunos estudios se utilizó la CEM como técnica de primera elección41 y en otros las pacientes procedían de rellamadas posteriores a estudios de mamografía35,39,40,43. También existen estudios que incluyen pacientes que tenían un diagnóstico confirmado de cáncer de mama36) y otros que incluyen solo a pacientes con mamas densas38. La mayoría de los autores están de acuerdo en indicar que la CEM presenta un mejor rendimiento a la hora de identificar también los cánceres multifocales, pudiendo detectar hasta un 43,8% más de lesiones en los pacientes con cánceres multifocales que cuando se utilizó la mamografía convencional35.
Comparación con la resonancia magnética de mama con contrasteHasta ahora, la RM se ha considerado la técnica de referencia para el estadificación local del cáncer de mama. Su sensibilidad es muy superior a la de la FFDM, incluso con ecografía complementaria, lo que permite detectar hasta un 16% más de lesiones en la mama patológica y hasta un 4% de nuevas lesiones en la mama contralateral51,52. Sin embargo, aunque su sensibilidad es alta, su especificidad no lo es tanto, lo que lleva a la realización de un gran número de biopsias23. Entre las limitaciones de la RM se encuentran además los costos más elevados, la mayor duración del examen y de la interpretación, y la escasa disponibilidad, así como el hecho de que no es adecuada para los pacientes muy obesos, o los que tienen marcapasos, con prótesis metálicas, o que sufren de claustrofobia. Estos factores han condicionado su uso solo como una técnica de segunda línea o para la detección del grupo de muy alto riesgo. Para superar algunas de esas limitaciones y aumentar el acceso al examen de RM, recientemente se ha introducido un protocolo abreviado que permite realizar exámenes mucho más breves, pero que todavía se está evaluando, además de que su costo sigue siendo elevado y su uso no se ha generalizado53.
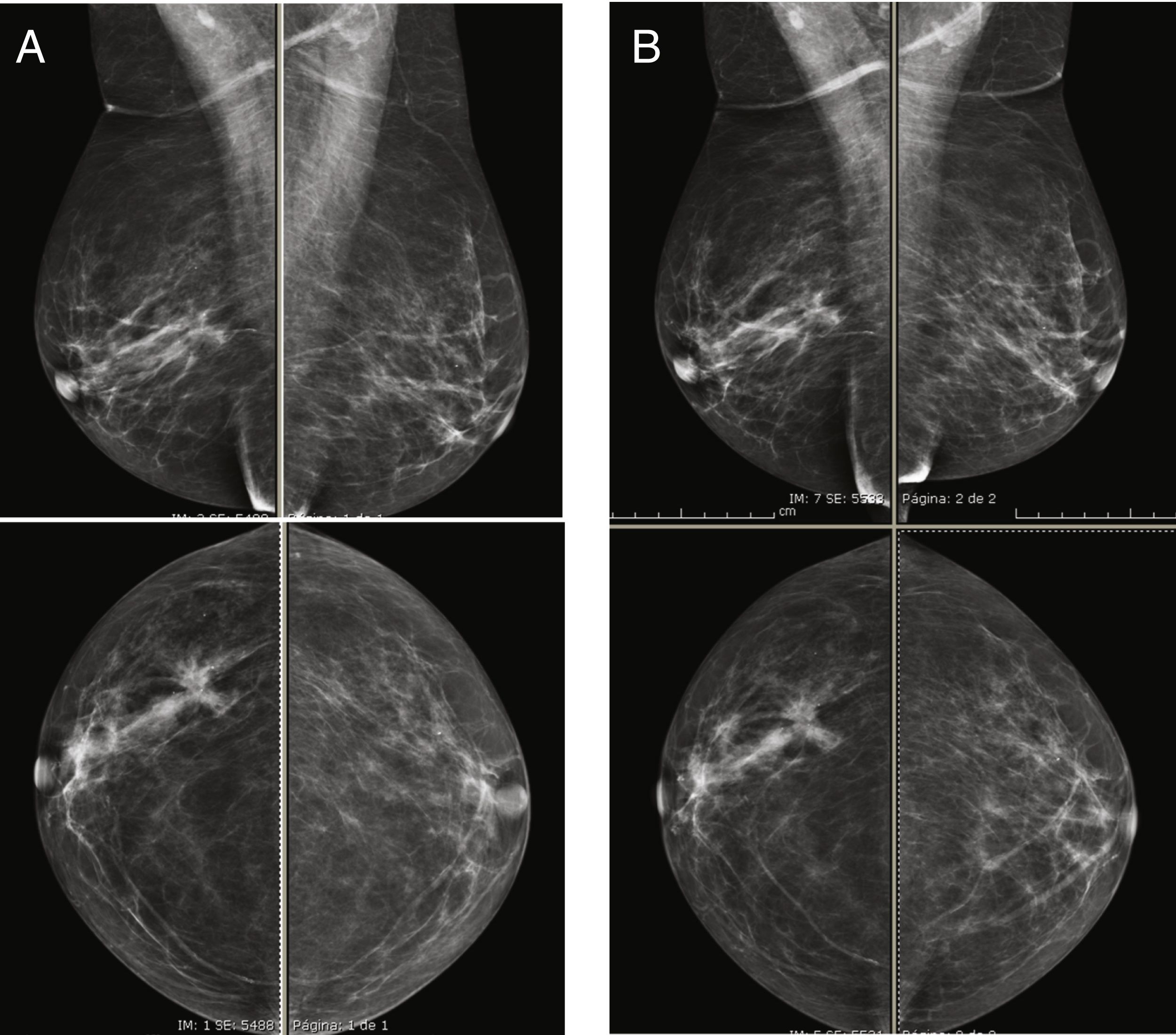
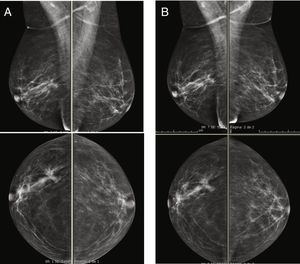
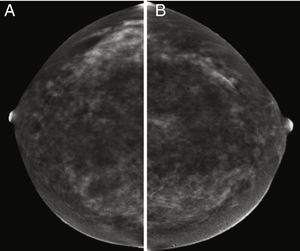
Se han realizado varios estudios comparando el rendimiento de la RM con el de la CEM y todos ellos indicaron que la CEM iguala a la RM en cuanto a sensibilidad45,46. Además, según esos estudios, la CEM tiene un número menor de falsos positivos y un valor predictivo positivo más alto que la RM, lo que indica que su especificidad es mayor. El realce del parénquima glandular normal también es similar a ambas técnicas, que en ambos casos se ha relacionado principalmente con los cambios hormonales (fase del ciclo menstrual o estado menopáusico), el grado de densidad mamaria (fig. 4) o con la existencia de radioterapia previa54,55. Como también ocurre con la RM, se ha señalado que el aumento del contraste del parénquima normal en la CEM se correlaciona con un mayor riesgo de cáncer de mama55.
Imágenes recombinantes de un estudio de CESM que muestran una captación múltiple del medio de contraste difusa y bilateral, la cual es difícil de interpretar en una paciente con alta densidad mamaria (ACR grado C). A) Proyección cráneo-caudal de la mama derecha. B) Proyección cráneo-caudal de la mama izquierda. El seguimiento de las imágenes a los 2años no mostró cambios.
Esto significa que, en términos de rendimiento diagnóstico, la CEM es bastante similar a la RM. Sin embargo, es mejor aceptada por los pacientes debido a su menor duración, mayor comodidad del procedimiento, menor nivel de ruido y menor costo56. Sin embargo, hay que tener en cuenta que la RM sigue siendo superior, ya que permite un funcionamiento dinámico, visualiza imágenes ponderadas por difusión, se considera una técnica tomográfica y que permite reconstrucciones en 3D, no implica la irradiación del paciente y el medio de contraste de gadolinio se asocia con menos frecuencia a efectos adversos. Así pues, el buen funcionamiento de la CEM permite considerarlo, al menos, como la técnica de elección para quienes no pueden someterse a una RM o cuando esta no esté disponible.
Estimación prequirúrgica del tamaño del tumorPara la correcta planificación prequirúrgica del cáncer de mama, la estimación precisa del tamaño de la lesión es muy importante. En varios estudios se ha evaluado la exactitud de esa estimación mediante el uso de la CEM, en comparación con las técnicas convencionales de obtención de imágenes y se ha llegado a la conclusión de que es una técnica muy prometedora para este fin.
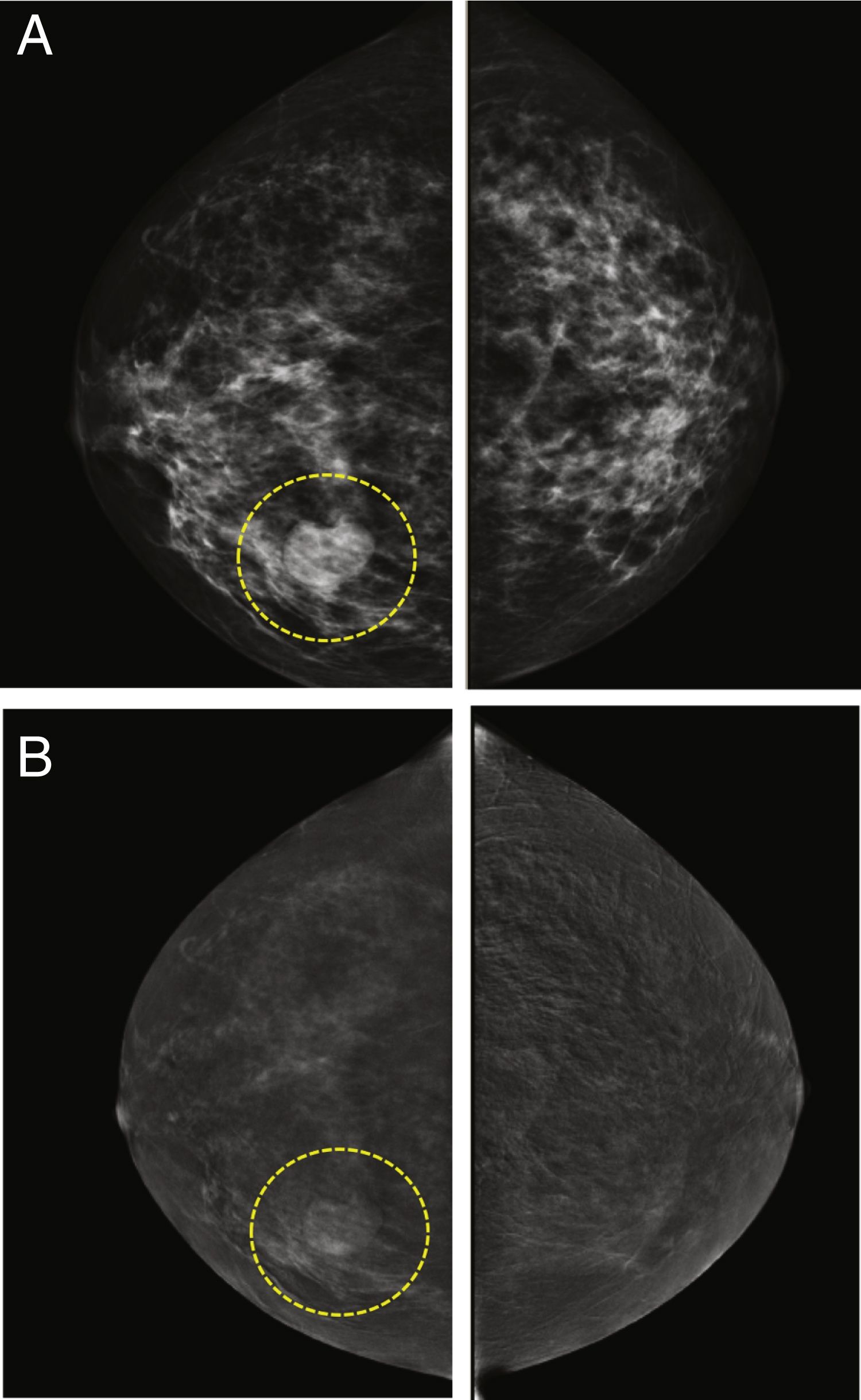
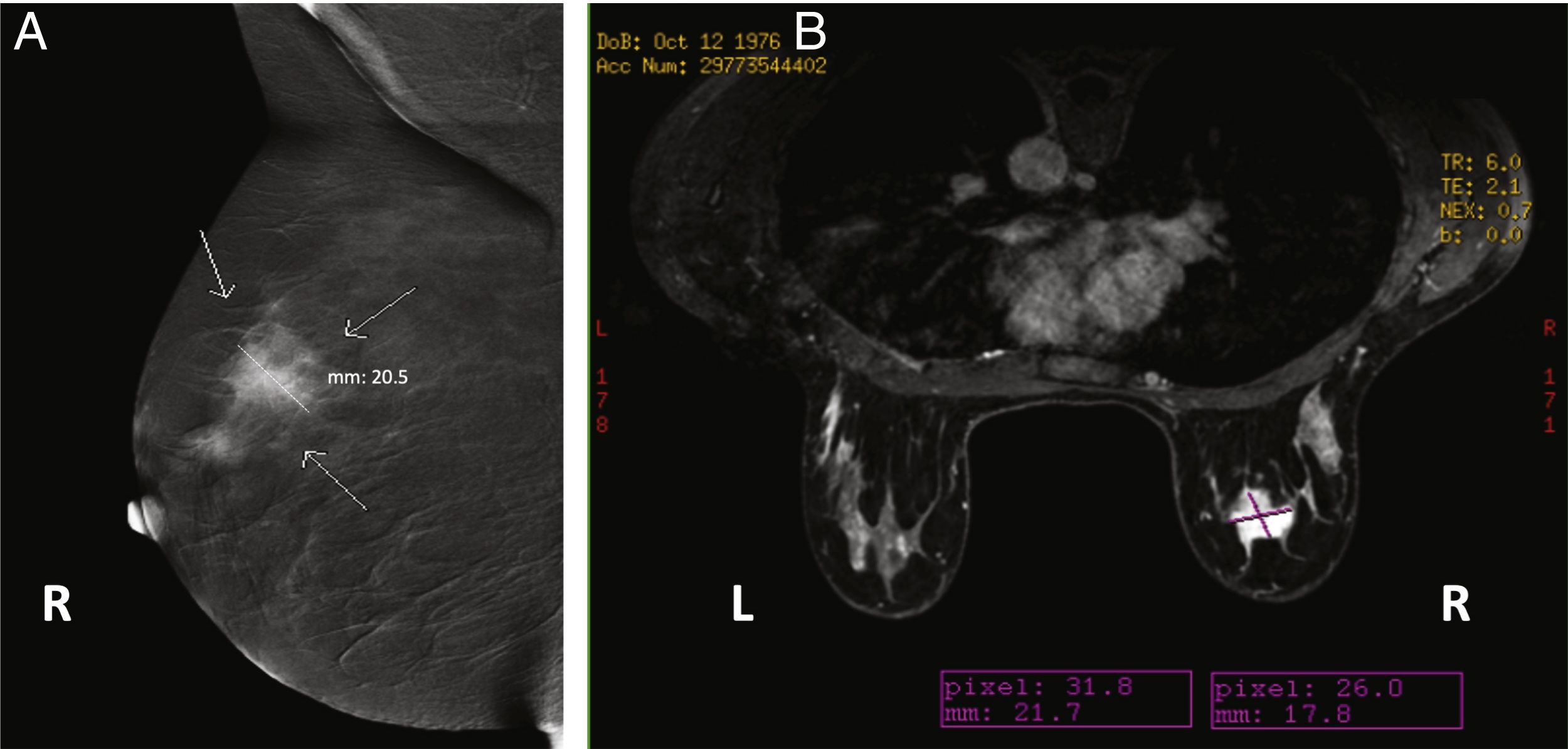
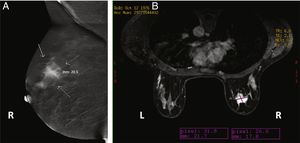
Cuando se comparan con la FFDM o ecografía mamaria, todos los estudios coinciden en que la CEM permite una estimación de tamaño más precisa. Los estudios iniciales indicaban que todas las técnicas radiológicas tendían a subestimar el tamaño de la lesión en comparación con el tamaño de la pieza quirúrgica, pero que esta subestimación era menor en el caso de la CEM13,35, o incluso que esta sobrestimaba ligeramente el tamaño57. Sin embargo, un estudio reciente con un elevado número de lesiones demostró un índice de concordancia de alrededor del 70% y confirmó que la CEM tiende a sobrestimar el tamaño de la lesión (+ 2,9mm, en promedio)58. En comparación con la RM, ambas técnicas parecen ser prácticamente equivalentes37,59,60 (fig. 5), aunque hay estudios que indican un índice de concordancia casi perfecto para la CEM, incluso superior al de la RM30.
Imágenes de una paciente de 38 años con un carcinoma ductal infiltrante demostrado por biopsia en la mama derecha. A) Imagen oblicua medio-lateral recombinada de la CEM que muestra una masa realzada por el medio de contraste que mide 20,5mm. B) Resonancia magnética de mama con contraste que muestra una masa realzada que mide 21,7mm. La medida histopatológica de la pieza quirúrgica era de 20,3mm.
La estimación del tamaño por parte de la CEM parece ser más precisa en los tumores más grandes, y cuando existe afectación ganglionar, lo que apunta a la hipótesis de que la precisión aumenta con el grado de malignidad del tumor58, probablemente debido a que son mucho más activos metabólicamente. También se ha indicado que la precisión de la CEM disminuye con una alta densidad mamaria, así como con el mayor volumen mamario58. Además, también se ha indicado que la precisión de la estimación del tamaño por la CEM es mucho mayor en las vistas craneocaudales que en las oblicuas medio-laterales60.
La CEM para monitorizar la respuesta del tumor a la quimioterapia neoadyuvanteLa quimioterapia preoperatoria neoadyuvante (NAC, por el acrónimo inglés neo-adjuvant chemotherapy) se considera el tratamiento estándar para el cáncer de mama localmente avanzado. Hasta la fecha, la técnica de referencia para evaluar la respuesta a la NAC es la RM, que ha demostrado ser superior a la ecografía en la evaluación de la extensión del tumor y la presencia de focos adicionales, y es muy sensible para identificar la enfermedad residual después del tratamiento. Debido a su similitud con la RM, varios grupos de investigación la han comparado con la CEM en la evaluación de la respuesta del tumor a la NAC, aunque con una serie muy discreta de pacientes hasta ahora.
En uno de los primeros estudios, se incluyó prospectivamente a 46 pacientes tratados mediante NAC61 y los parámetros de rendimiento calculados para la CEM fueron alrededor de un 15-20% superiores a los de la RM. Sin embargo, en otro estudio casi paralelo, que incluyó solo a 21 pacientes, la especificidad calculada para la CEM fue inferior a la de la RM62. En ambos estudios, los falsos negativos disminuyeron la precisión general de la técnica. En 2018 y 2019 se realizaron otros 2estudios, con 33 y 29 pacientes, respectivamente63,64, que mostraron rendimientos similares para ambas técnicas. En general, la conclusión de todos estos estudios es que, aunque los resultados de la CEM y la RM se correlacionan muy bien en la predicción de la enfermedad residual, ambas técnicas son algo imprecisas para predecir la respuesta patológica completa. Ninguno de las 2es lo suficientemente fiable como para permitir que la resección quirúrgica sea obviada después de una respuesta aparente completa por medio de imágenes. En conjunto, estos resultados indican que la RM sigue apareciendo como una técnica superior a la CEM, ya que, en esta última, la respuesta a la NAC solo puede evaluarse si se demuestra una reducción del tamaño de la lesión o si no hay captación del medio de contraste. Sin embargo, la RM permite utilizar mediciones más sofisticadas, utilizando cambios en los parámetros cinéticos de la captación del medio de contraste (modo dinámico), o para visualizar imágenes ponderadas por difusión. Esto permite identificar alteraciones en el entorno microvascular del tumor, lo que a su vez permite una predicción más temprana de la respuesta, después de solo unos pocos ciclos de quimioterapia, mucho antes de que los cambios en el tamaño de la lesión sean evidentes. Esto tiene la ventaja obvia de que se evitaría la continuación de tratamientos ineficaces. Estos cambios tan sutiles no son apreciables con la CEM. Por lo tanto, la CEM seguiría siendo una alternativa útil en los pacientes para los que la RM está contraindicada.
La CEM como técnica diagnóstica en pacientes de segunda llamada (técnica de segunda línea)Una de las aplicaciones más claramente establecidas de la CEM hasta ahora es su uso como técnica de segunda línea en la rellamada de pacientes después de una mamografía anormal. Por lo tanto, hasta la fecha, la mayoría de los estudios han evaluado el papel de esta técnica en grupos de pacientes previamente seleccionadas después de la selección por la FFDM.
En uno de los primeros estudios, los autores encontraron un aumento de casi el 100% de la sensibilidad y del valor predictivo negativo en comparación con la FFDM en una serie de pacientes remitidos por anomalías detectadas mediante mamografía de cribado. Esto indica que la CEM descartaría la malignidad en esta segunda llamada si el área sospechosa no está realzada por el contraste40. Además, encontraron un gran aumento de la especificidad y del valor predictivo positivo (+ 36-37% en ambos casos), lo que indica que la CEM puede ser muy útil para reducir el número de pacientes con falsos positivos en la evaluación posterior a la exploración. En otro estudio con una serie similar, pero evaluado por 10 lectores, los autores también encontraron mejoras notables en todos los parámetros diagnósticos, independientemente del grado de experiencia del radiólogo39. Además, los mismos autores mostraron que un grupo de estudiantes de secundaria con un mínimo de formación lograron un mejor rendimiento diagnóstico con imágenes CEM que los radiólogos experimentados leyendo las imágenes FFDM de los mismos pacientes65. Este grupo de investigación ha estado ampliando el seguimiento de los pacientes y, en un estudio publicado en 2017, publicó los resultados de una serie de 839 mujeres del programa de cribado, en el que se detectaron 38 lesiones adicionales por CEM que no se detectaron en la ecografía66. Se trata de un hallazgo muy relevante, ya que indica que el empleo de la CEM como técnica de segunda línea habría acortado la duración del diagnóstico y los costos para estos pacientes.
Después de algunos años, evaluando el rendimiento general de la técnica, la investigación actual se centra en la evaluación del comportamiento diferencial de las lesiones mamarias por tipos (lesiones malignas y premalignas [B3], zonas de microcalcificaciones, asimetrías, etc.). Además, la novedad de la técnica hace que se publiquen esporádicamente informes de casos clínicos26,50,67-71.
Por un lado, los carcinomas ductales in situ72 y los carcinomas lobulares invasivos73 han sido estudiados por la CEM. En ambos casos, los autores demostraron que la CEM supera a la FFDM en cuanto a la capacidad de evaluar con precisión la extensión de la enfermedad, lo que se traduce en mejores resultados quirúrgicos en estos pacientes72,73. Por otro lado, la CEM también ha demostrado ser poderosa en la clarificación de las lesiones de tipo B3. Estas lesiones premalignas representan entre el 5 y el 9% de las biopsias de mama que se indican después de la FFDM y es muy interesante disponer de potentes técnicas de diagnóstico que ayuden a distinguir entre los pacientes que necesitan procedimientos quirúrgicos y aquellos a los que se les podría recomendar un seguimiento por imágenes. La CEM podría ser una de estas técnicas, ya que, según un estudio reciente, hasta el 92,8% de las cirugías de lesiones B3 (39/42) podrían haberse evitado mediante esta técnica de imagen74.
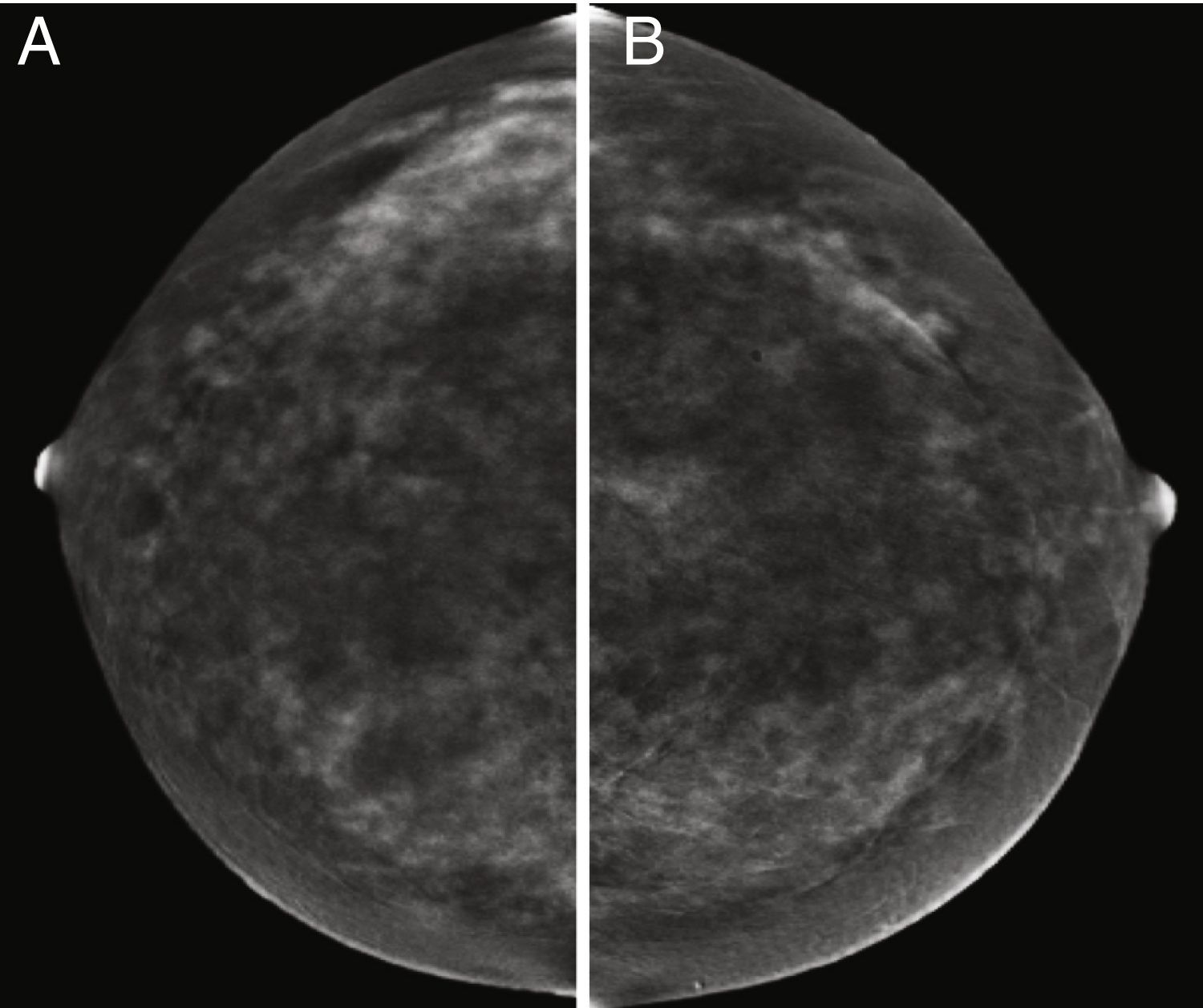
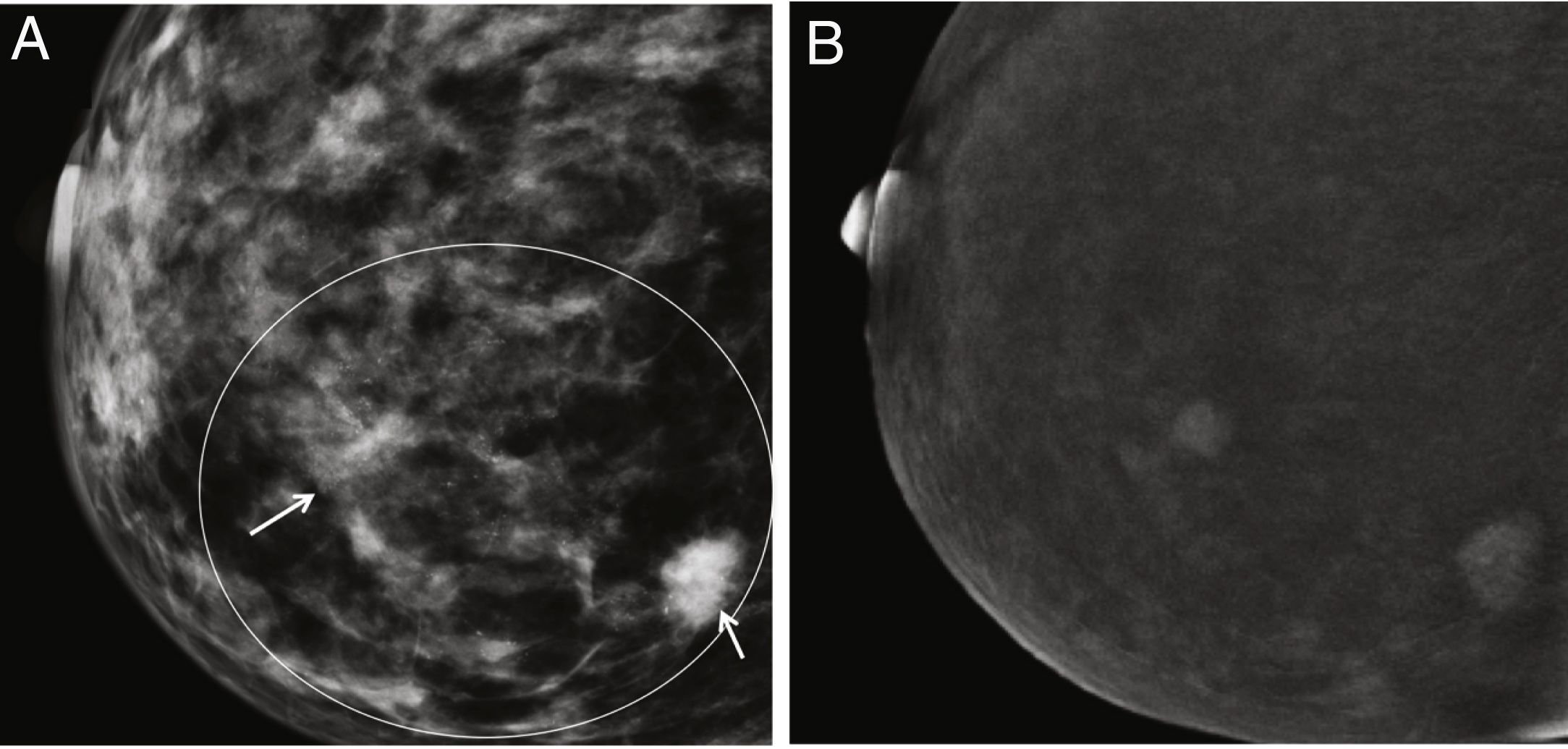
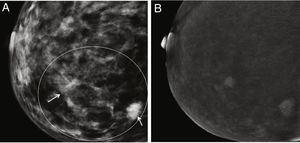
Otro campo de gran interés ha sido la posible aplicación de la CEM para discriminar las microcalcificaciones patológicas. Hasta la fecha, se han estudiado 2series. En un primer estudio, los autores incluyeron 59 microcalcificaciones visibles en la prueba de detección de FFDM, 26 de las cuales estaban realzadas por contraste en CEM y el 77% de ellas eran malignas después de la biopsia. Por el contrario, solo el 6% de los que no captaron contraste eran malignos75. Esto significa que las calcificaciones asociadas al aumento del contraste tienen una mayor probabilidad de ser malignas que las que no lo son (fig. 6). Sin embargo, la ausencia de captación no excluye definitivamente la malignidad. En un estudio realizado este año, se estudió una serie más amplia (n = 147) y los autores son más categóricos al concluir que el rendimiento de la CEM no añade valor al diagnóstico por mamografía convencional para la decisión quirúrgica, ya que los parámetros de rendimiento diagnóstico apenas mejoran, e incluso la especificidad disminuye76. En otras palabras, aunque es valiosa en el protocolo de diagnóstico, la CEM no impide la biopsia percutánea de microcalcificaciones sospechosas.
Paciente con microcalcificaciones sospechosas en el cuadrante inferior interno de la mama derecha, que también tiene varios nódulos en la gran área de microcalcificaciones. A) Imagen de baja energía. B) Imagen recombinante en la que solo la zona que coincide con la masa subyacente está realzada por el contraste y la zona intermedia no muestra captación. Resultado final: carcinoma ductal infiltrante.
Las asimetrías mamarias han sido otros objetivos de investigación, ya que es un hecho bien conocido que podría ser un signo de una malignidad subyacente, y esto podría ser un campo de aplicación interesante para la CEM. Recientemente, en una serie de 125 asimetrías, los autores encontraron 91 lesiones malignas y la CEM presentó una sensibilidad del 100% para su detección. Sin embargo, la especificidad fue menor que la de una mamografía convencional acompañada de ecografía (55,9% vs. 81,8%). Esto evidenció que varias de las lesiones benignas también estaban realzadas por el contraste. En cualquier caso, los autores concluyen que en estos casos la CEM desempeña un papel importante en la delimitación del tamaño de la lesión y la extensión de la enfermedad77, y que también es útil para descartar la existencia de una malignidad subyacente.
La CEM como técnica de imagen inicialComo hemos visto, muchos estudios de CEM se han centrado en su uso como prueba de imagen de segunda línea, equivalente a la RM, para el estadificación local del cáncer de mama primario previamente diagnosticado o sospechado. Sin embargo, como la RM es una técnica de segunda línea bien establecida, existe el peligro de que la CEM se considere siempre como un sustituto de la RM, cuando esta no pueda utilizarse o no esté disponible. Sin embargo, la buena sensibilidad, la especificidad y los valores predictivos positivos y negativos de la CEM indican que podría considerarse como el examen mamográfico primario, al menos en grupos de pacientes seleccionados. En nuestra experiencia, aunque hemos utilizado la CEM como técnica complementaria, llegamos a la conclusión de que, si se hubiera realizado como técnica de primera elección, nos habría permitido descartar directamente la malignidad hasta en un 13,8% de los casos43. Es decir, en estos pacientes se habían evitado retrasos en el diagnóstico, con la consiguiente reducción del estrés asociado y los costos adicionales.
La CEM en la paciente sintomáticaHay evidencia de que, en la paciente sintomática, la CEM podría utilizarse directamente como la técnica de primera elección y obviar la FFDM, incluso considerando el exceso de radiación que supone. La indicación de la realización de biopsias adicionales para confirmar la extensión del tumor o la multifocalidad podría indicarse en esta primera visita, evitando retrasos en el diagnóstico. En el único estudio en el que se ha empleado la CEM como técnica inicial en pacientes sintomáticos, la imagen recombinada mejoró significativamente el rendimiento en relación con la FFDM (imagen de baja energía de la CEM) en términos de sensibilidad (95% vs. 84%, respectivamente) y de especificidad (81% vs. 63%, respectivamente). La estimación del tamaño del tumor también fue más precisa, a pesar de tener una tendencia a la sobrestimación. Los radiólogos que leyeron el estudio (n = 11) calificaron a la CEM como «de ayuda decisiva en el diagnóstico» en el 75% de los casos sintomáticos48.
El costo del tiempo extra de la CEM con respecto a la FFDM (explicaciones adicionales, identificación de contraindicaciones, vía intravenosa) va en detrimento de su uso rutinario. Por lo tanto, muchos autores indican que la CEM como técnica de primera elección debería limitarse a los pacientes con masas palpables sospechosas, o a los pacientes jóvenes (< 40 años) con hallazgos sospechosos por ecografía, y en ningún caso debería hacerse a los pacientes con riesgo de experimentar nefropatía inducida por contraste23,48.
La CEM como herramienta de detección en pacientes de alto o muy alto riesgoEl grupo de pacientes de «muy alto riesgo» está constituido, por un lado, por mujeres con mutaciones genéticas (principalmente de los genes BRCA1 y BRCA2)78,79 y, por otro lado, por mujeres jóvenes (20-30 años) que sobreviven a un linfoma tratado con radioterapia, ya que unos 10 años después del tratamiento de radioterapia, hasta el 20% de ellos desarrollan cáncer de mama79. Ambos grupos tienen un riesgo de presentar cáncer de mama a lo largo de su vida alrededor de 8veces más alto que la población general78,79. Se ha demostrado que la sensibilidad de la mamografía en este grupo de pacientes es baja. Además, tampoco es recomendable para ellas debido a la dosis de radiación involucrada. Por esta misma razón, y aún más, se desaconsejaría la CEM como medio de detección precoz en estas pacientes, siendo la RM la técnica de elección53,79,80.
Sin embargo, hay otro grupo de mujeres de alto riesgo, que en la mayoría de los países no están incluidas en los programas de detección de RM, pero en las que la mamografía a menudo también es deficiente. Existe una controversia sobre el enfoque de la detección temprana en estas mujeres, que incluye a las que tienen antecedentes familiares de cáncer de mama (pero que no pertenecen al grupo de muy alto riesgo), las mujeres con antecedentes personales de cáncer de mama u otros cánceres y también las mujeres con mamas heterogéneamente densas o extremadamente densas23,81. La CEM es una de las técnicas que se están considerando a este respecto.
En un estudio piloto realizado en 2017, los autores compararon las pruebas de detección de cáncer realizadas por CEM y RM en un grupo de mujeres con un riesgo alto y muy alto, y encontraron que ambas técnicas tenían una especificidad similar (alrededor del 94%), ambas superiores a la de la FFDM45. En otro estudio similar, realizado casi simultáneamente, los autores hicieron el seguimiento de más de 1.000 pacientes con las mismas características y concluyeron que la CEM podría ser una técnica valiosa para el seguimiento de estos pacientes, dado el alto valor predictivo positivo que calcularon39. En un tercer estudio, los autores incluyeron a 611 mujeres, 98% de las cuales habían sido clasificadas como de grado C o D en términos de densidad mamaria, y el 48% de ellas también tenían un historial familiar de cáncer de mama. Los resultados se compararon con los de la FFDM, que pudo detectar 11/21 cánceres malignos, mientras que la CEM detectó 19/21. Los autores de este estudio concluyeron que la CEM era significativamente más sensible que la FFDM para detectar el cáncer de mama en esta población de riesgo, sin que la ecografía mamaria proporcionara ningún beneficio adicional82.
La CEM como herramienta de cribado en la población generalDebido a que la CEM es muy similar a la mamografía convencional (aunque con un costo y un tiempo de ejecución ligeramente superiores), pero con una sensibilidad y especificidad similares a las de la RM, algunos autores han sugerido que su uso podría evaluarse también para la detección del cáncer en la población general. Así, este año se ha publicado un estudio piloto en el que se ha aplicado la CEM en un pequeño grupo de mujeres del programa de detección de cáncer de mama en los Estados Unidos, que aceptaron voluntariamente una CEM adicional. Aunque en este estudio también se incluyó a pacientes de riesgo moderado-alto, los autores concluyen que la técnica promete ser utilizada en el cribado de la población general. En este momento se está desarrollando un estudio a gran escala, basado en estos resultados preliminares, aplicando la técnica también a las mujeres de bajo riesgo83.
Futuro de la CEMDesde 2010, hay más de 500 publicaciones disponibles sobre los diferentes aspectos, pros y contras de la CEM. Los resultados son realmente prometedores y la investigación continúa a un ritmo exponencial, con varias docenas de publicaciones cada año sobre este tema, tanto en los aspectos diagnósticos como en las mejoras de la técnica, como es el caso de los sistemas automatizados de detección de cáncer de mama, que actualmente están siendo desarrollados por varios grupos de investigación84,85.
A pesar de todo esto, la realidad es que el número de máquinas con posibilidad de hacer CEM es realmente bajo en todo el mundo. Hasta la fecha, General Electrics ha vendido alrededor de 650 unidades de su aplicación SenoBright® en todo el mundo y el número de aplicaciones del resto de los fabricantes es mucho menor que eso, lo cual sigue siendo insuficiente. El desconocimiento de la técnica sigue siendo muy elevado entre los radiólogos, cirujanos, oncólogos y entre los gestores de la salud pública y privada. Una de las razones de este desconocimiento podría radicar en la exclusividad de comercialización que existió durante los primeros 8 años por una sola empresa. Además, las compañías de seguros siguen siendo reacias a pagar por estos estudios en muchos países, a pesar de que hay estudios económicos que indican que, si las indicaciones de la RM fueran sustituidas por la realización de la CEM, esto permitiría ahorrar muchísimo dinero (estimado en alrededor de 1.000 millones de euros al año solo en el sistema de salud de los Estados Unidos)86. Es probable que se necesiten aún más estudios de investigación para superar la renuencia a sustituir una gran parte de las aplicaciones de la RM por la CEM que, según todos los estudios disponibles, es equivalente a ella en gran parte de los escenarios clínicos.
Las principales desventajas de la CEM siguen pesando mucho, sobre todo las relacionadas con la seguridad del paciente: la exposición a medios de contraste yodados, con el riesgo de reacciones adversas, y los riesgos teóricos de una mayor exposición a la radiación. A pesar de ello, y aunque la disponibilidad de CEM es actualmente baja, la adopción generalizada podría ser rápida, ya que muchos sistemas de mamografía de la generación actual ya se entregan de serie con los filtros y el software para llevar a cabo la CEM87. Por lo tanto, a medida que se vaya renovando la infraestructura, es más que probable que la disponibilidad de la técnica en los centros de diagnóstico se multiplique rápidamente. En la asistencia sanitaria privada, la aplicación del uso de la CEM también se verá afectada por los modelos de pago y la aceptación, por parte de las compañías, de las evidencias científicas que indican que la CEM es una técnica interesante que complementa la gama de modalidades de diagnóstico por imágenes del cáncer de mama.
Por último, hay que indicar que también existen interesantes perspectivas de cara a su uso combinado con otras técnicas existentes, como es el caso de la tomosíntesis, aunque estos estudios están aún en una fase muy preliminar88.
ConclusionesLa CEM ha demostrado ser una técnica valiosa para el diagnóstico y estadificación del cáncer de mama primario. A pesar de ello, sigue siendo una técnica poco conocida, aunque es probable que experimente un auge en los próximos años. Los descriptores morfológicos del léxico BI-RADS® de la RM pueden aplicarse al análisis de las lesiones de mama estudiadas por la CEM. El rendimiento diagnóstico de la CEM es superior a la de la FFDM, incluso cuando se acompaña de ecografía. Los altos valores de sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y precisión son similares a los de la RM, lo que, combinado con la sencillez de la técnica, indica que la CEM es útil, al menos como modalidad de imagen complementaria en la evaluación de las lesiones de mama. La calidad de la predicción del tamaño del tumor con la CEM es buena, y esta modalidad de diagnóstico por imagen aparece como una alternativa prometedora a la RM en la planificación quirúrgica del cáncer de mama. Sin embargo, las características biológicas del tumor y las características antropológicas de los pacientes afectan a la exactitud del diagnóstico y deben tenerse en cuenta. La CEM tiene una buena correlación y concordancia con la histopatología para evaluar la enfermedad residual después de la quimioterapia neoadyuvante, similar pero no superior a la RM. El excelente rendimiento diagnóstico de la técnica hace que constituya una prometedora modalidad de diagnóstico por imagen inicial en pacientes sintomáticas, que proporcionaría una mejor información diagnóstica y de estadificación desde la primera visita clínica. También podría ser un instrumento útil de detección en pacientes con un mayor riesgo de cáncer de mama y que actualmente no están bien cubiertos por la mamografía convencional.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasLas características del estudio lo eximen de ser evaluado por un comité de bioética.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.