Revisión bibliográfica del diagnóstico, tratamiento y supervivencia del carcinoma de mama metastásico que cursa con carcinomatosis peritoneal.
Pacientes y métodosPresentamos el caso de una paciente en tratamiento en nuestro hospital comentándose los aspectos clínicos, diagnósticos y terapéuticos de interés.
ConclusiónLas metástasis del tracto gastrointestinal extra-hepáticas secundarias a tumor de mama son poco comunes (8-10%). La carcinomatosis peritoneal presenta una baja incidencia, habiéndose descrito pocos casos en la literatura, siendo la mayoría de tipo lobulillar infiltrante. Nuestro caso tratado de carcinomatosis peritoneal de origen mamario ductal infiltrante lo hace aún más infrecuente.
We provide a literature review of the diagnosis, treatment and survival of metastatic breast cancer with peritoneal carcinomatosis.
Patients and methodsWe present a case treated in our institution and discuss relevant clinical, diagnostic, and therapeutic features.
ConclusionExtra-hepatic gastrointestinal metastasis from breast cancer is infrequent (8%-10%). The incidence of peritoneal carcinomatosis is low, with few cases reported in the literature, mostly from invasive lobular carcinoma. Our case of invasive ductal carcinoma is even less frequent.
La incidencia de cáncer de mama ha aumentado en las últimas décadas, mientras que la tasa de mortalidad ha disminuido debido a los avances del tratamiento, así como el diagnóstico en estadios precoces gracias al cribado poblacional. Como resultado, ha aumentado el número de pacientes que sobreviven a esta enfermedad, lo que conlleva un aumento de la tasa de detección de recurrencias, cuyo diagnóstico y manejo presenta un reto para el clínico. Uno de estos ejemplos es la carcinomatosis peritoneal de origen mamario, la cual es poco frecuente, habiéndose descrito sólo algunos casos en la literatura. Este hallazgo se relaciona en mayor frecuencia con el tipo histológico lobulillar infiltrante, y suele presentarse de forma tardía respecto al diagnóstico de la lesión mamaria.
Presentamos el caso de una paciente con carcinomatosis peritoneal de origen mamario que se muestra de forma sincrónica al tumor primario, cuyo origen es un carcinoma ductal infiltrante. Debido a la infrecuencia del caso que presentamos, tanto por su origen de un subtipo ductal y además el diagnóstico sincrónico, hemos considerado interesante publicarlo en esta revista.
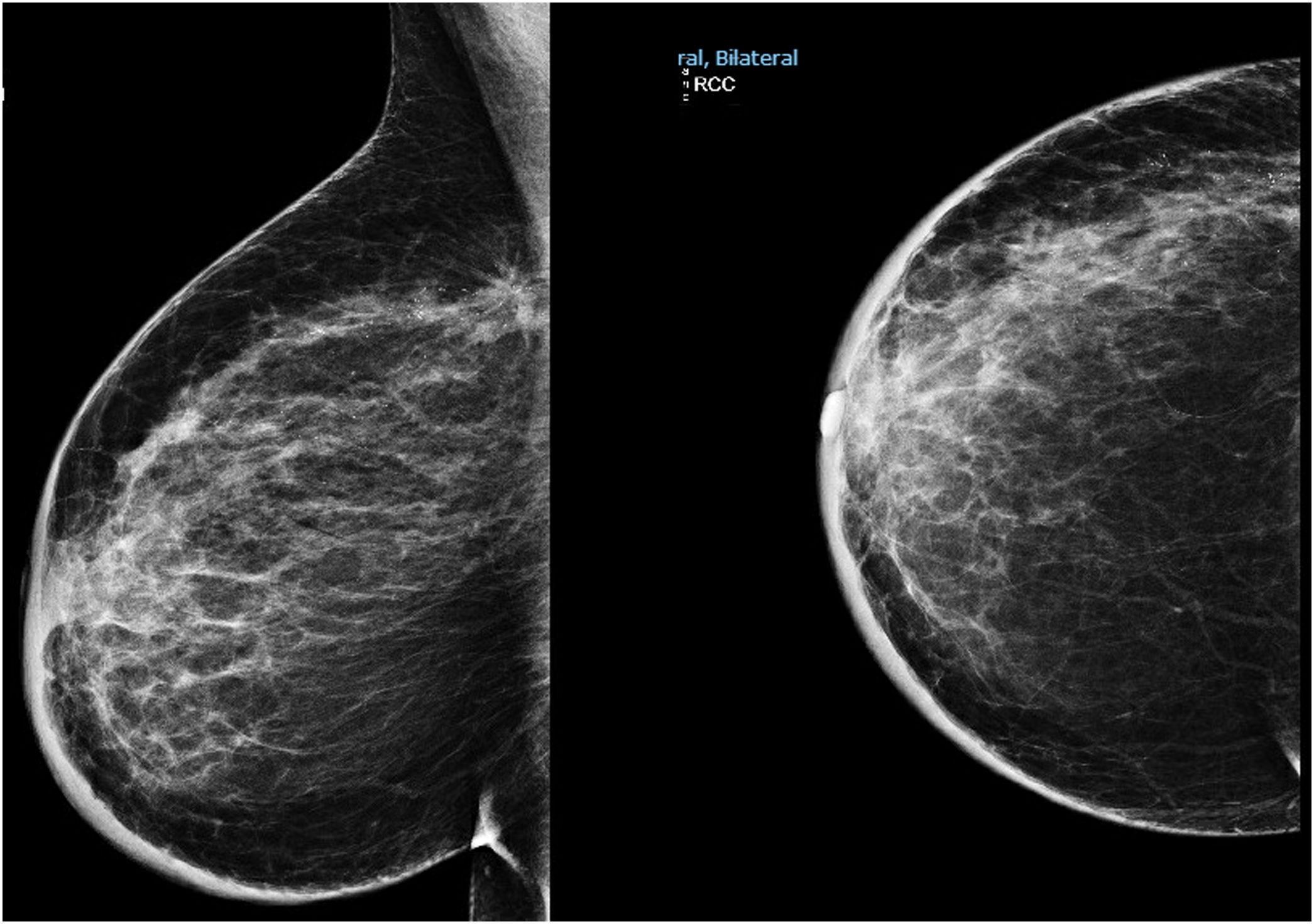
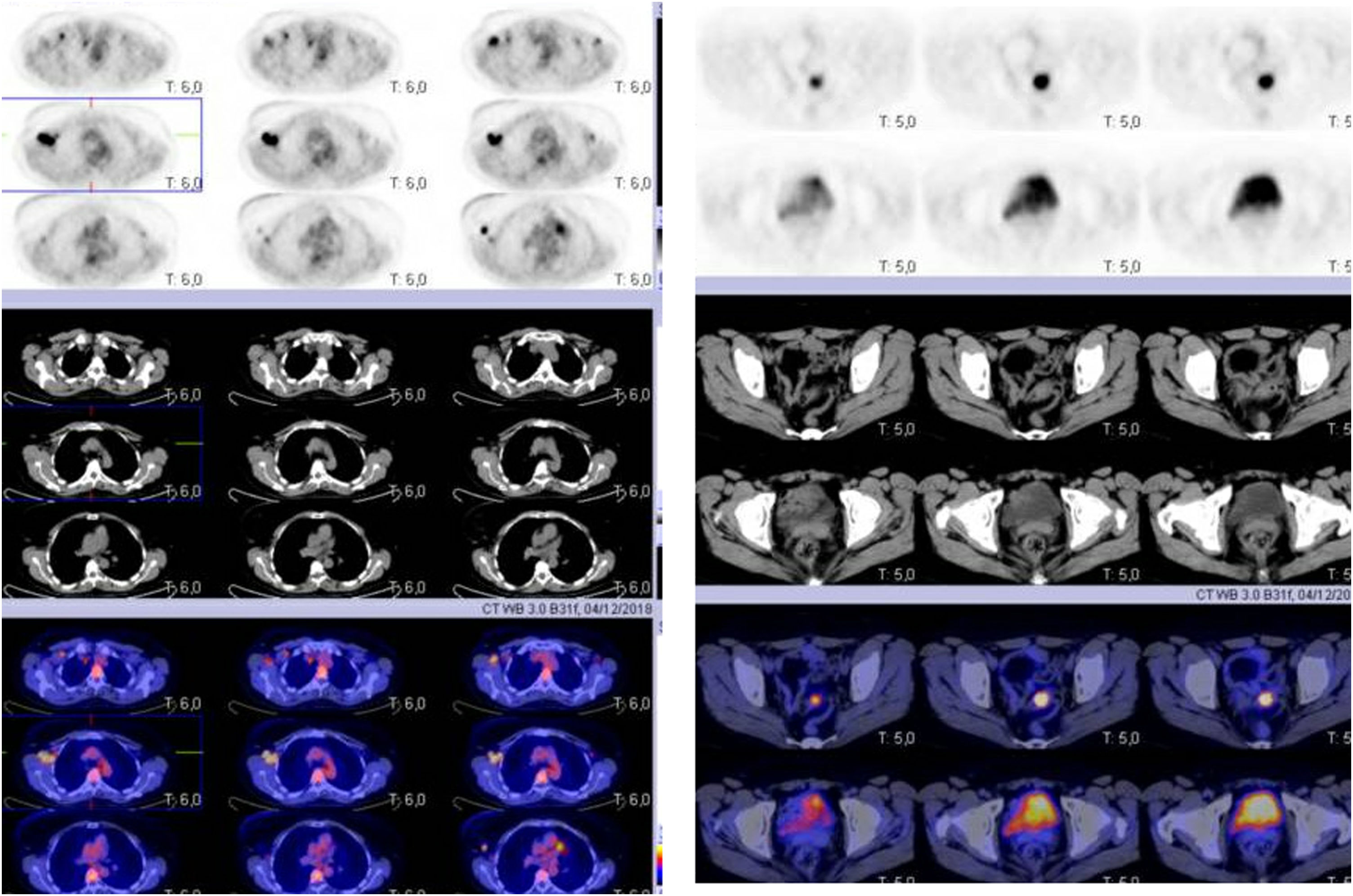
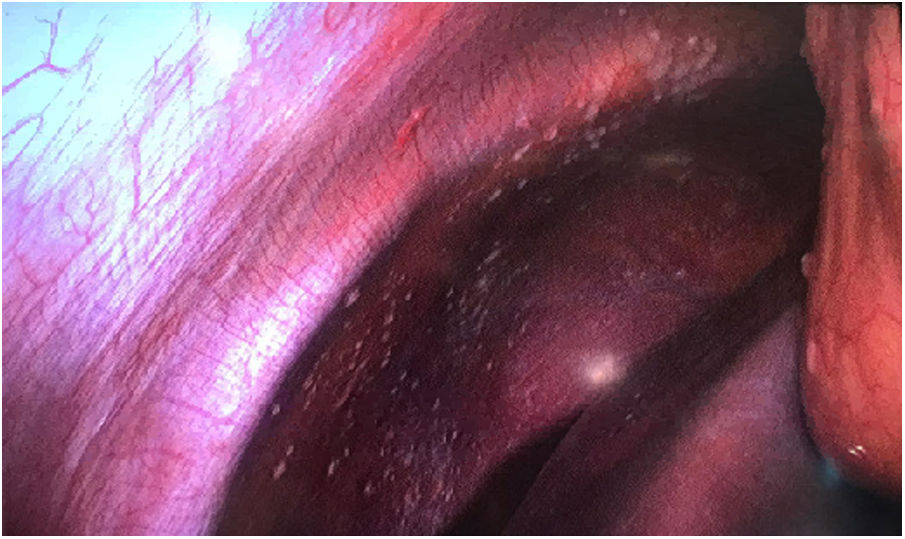
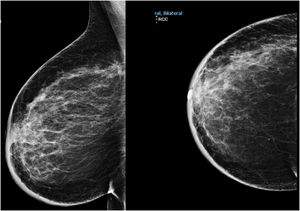
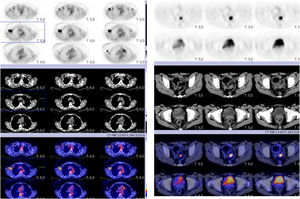
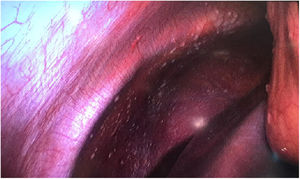
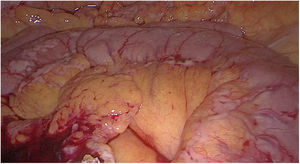
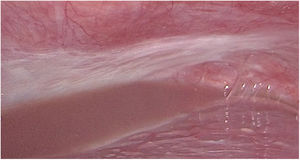
Material y métodosMujer de 53 años que consulta a su médico de familia por inflamación, dolor y enrojecimiento en mama derecha. Se cataloga como una celulitis e inicia tratamiento antibiótico oral y tópico durante un mes sin respuesta, por lo que es derivada a Dermatología. Ante la no respuesta al tratamiento se realiza biopsia cutánea que, confirma el diagnóstico de carcinoma ductal infiltrante luminal B (RE 93%, RP 15%, Her2 negativo, Ki67 70%). Tras el diagnóstico se solicita mamografía que evidencia engrosamiento cutáneo y trastorno arquitectural en el cuadrante superoexterno de la mama derecha (fig. 1). Estos hallazgos se confirman en la ecografía, que además objetiva adenopatías axilares homolaterales y adenopatía única contralateral. El estudio de extensión se realiza con PET-TC que además de la lesión mamaria y adenopatías axilares bilaterales (fig. 2), informa de neoformación en sigma, por lo que se realiza colonoscopia visualizando estenosis parcial en sigma que se biopsia con resultado de adenocarcinoma enteroide moderadamente diferenciado. Se propone tratamiento neoadyuvante (adriamicina más ciclofosfamida (AC), seguida de taxanos) para después realizar tratamiento local al ser una enfermedad oligometastásica. Sin embargo, la enfermedad presenta un perfil de agresividad alto, progresando a nivel cutáneo a AC. Esto motivó un cambio precoz a paclitaxel, con lo que se consiguió respuesta parcial. Se interviene realizando mastectomía radical modificada tipo Madden derecha, y linfadenectomía axilar izquierda. En el mismo acto quirúrgico, se realiza laparoscopia observando implantes múltiples menores de 2 cm en peritoneo parietal y epiplón con un índice de carcinomatosis peritoneal (PCI) igual a 18 (fig. 3), realizando toma de biopsias y omentectomía, no resecando lesión en sigma al considerarlo como metastásico.
El informe de Anatomía Patológica (AP) cataloga la lesión como carcinoma ductal infiltrante (ypT1c/T4d), en axila derecha con infiltración metastásica en 7 de 7 adenopatías (N2) y 2/7 en axila izquierda. Los implantes peritoneales y en epiplón se establecen como metástasis de carcinoma ductal de origen mamario. Tras los resultados inicia tratamiento con abemaciclib, letrozol y goserelina en primera línea. El PET TC se realiza finalizado el cuarto ciclo, que presenta captación a nivel únicamente del sigma.
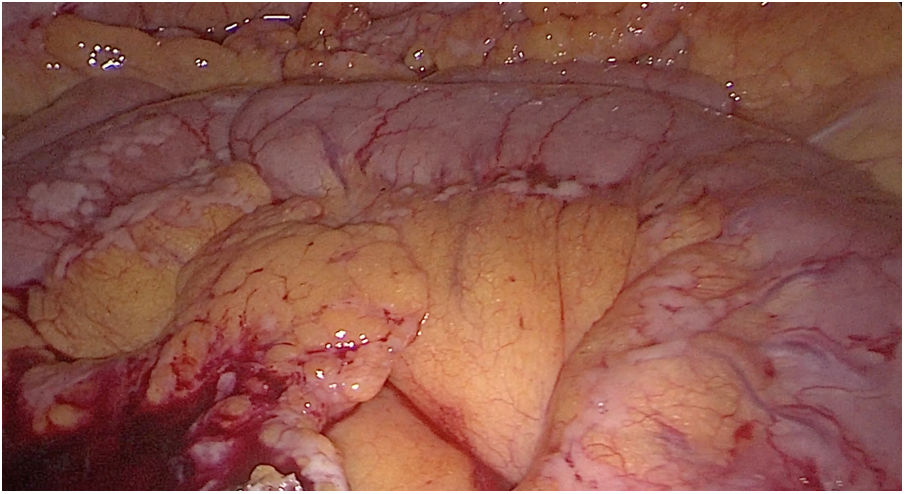
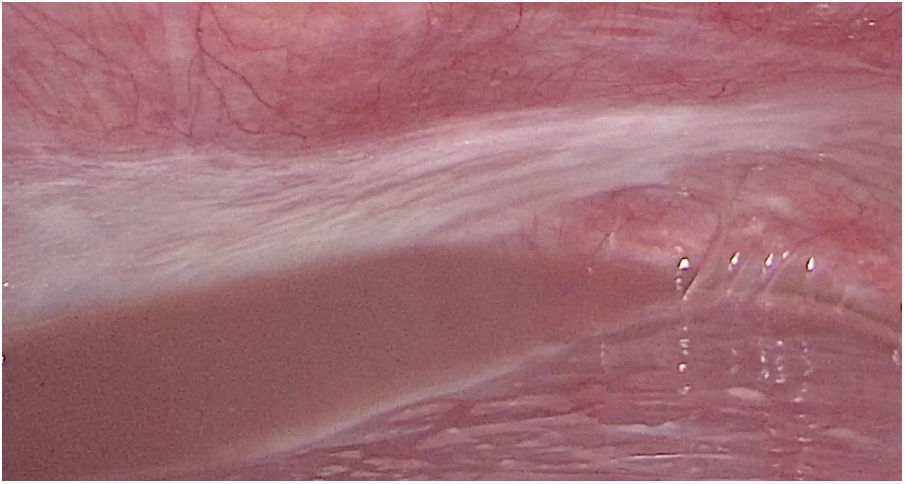
Se presenta el caso nuevamente en comité multidisciplinar y se decide sigmoidectomía laparoscópica sin anastomosis. En esta intervención se evidencian implantes en mayor número y tamaño con respecto a la primera intervención (fig. 4), localizados tanto en peritoneo como en la pared del colon sin causar obstrucción intestinal, además de ascitis en cantidad moderada no conocida previamente, calculando esta vez un PCI de 21 (fig. 5). La AP informa de adenocarcinoma enteroide de sigma pT1N0 e implantes peritoneales de carcinoma de mama que afecta a serosa de colon sigmoide, incluidos los límites quirúrgicos.
Tras evidenciarse la progresión por laparoscopia se opta por continuar con tratamiento hormonal en segunda línea, fulvestrano, en este caso, puesto que la paciente estaba asintomática. Se solicitó la determinación de PI3K para valorar la adición de alpelisib, pero esta fue negativa. En menos de dos meses del inicio de la segunda línea comienza con clínica suboclusiva, realizándose TAC que informa de ascitis severa y progresión a nivel peritoneal. Dada la refractariedad a hormonoterapia y los síntomas secundarios a la progresión, se opta por doblete de quimioterapia, carboplatino más gemcitabina. Se consigue respuesta inicial, pero la paciente tiene que ingresar por toxicidad hematológica severa, que es la situación actual de la paciente. Hasta el momento, presenta una supervivencia de 28 meses.
DiscusiónEl cáncer de mama es el tumor maligno más frecuente a nivel mundial en la mujer. La incidencia ha aumentado en las últimas décadas, disminuyendo así la mortalidad debido al diagnóstico precoz y el avance en el tratamiento. La localización del cáncer de mama metástasico está bien documentada en la literatura encontrándose con más frecuencia a nivel óseo, hígado, pulmón y cerebro. Sin embargo, existen otras localizaciones menos frecuentes como el peritoneo (8-10%) si bien, en series de necropsias se han encontrado tasas de hasta un 35%, lo que indica la gran dificultad que supone el diagnóstico de esta patología1. Sin embargo, diversos estudios señalan que el patrón de metastatización del cáncer de mama presenta diferencias significativas según su tipo histológico, ya sea ductal o lobulillar. Así, mientras los carcinomas ductales infiltrantes metastatizan con más frecuencia a ganglios linfáticos, pulmón y pleura, los carcinomas lobulillares lo hacen en el tracto gastrointestinal, genitourinario, hígado, médula ósea y en el peritoneo y el retroperitoneo2,3. Las metástasis peritoneales se han asociado con un peor pronóstico, gran morbimortalidad y una baja tasa de supervivencia con respecto a las otras localizaciones, comprobando que si se diagnostican en los primeros cinco años del diagnóstico del cáncer de mama, tienen un peor pronóstico que si se diagnostican después4,5.
Existen pocos casos descritos de carcinomatosis peritoneal de origen mamario, lo que provoca un desafío clínico, pues existen escasas referencias en la literatura sobre el pronóstico y el manejo clínico y terapéutico de estas pacientes, y los pocos que tenemos están basados en estudios observacionales en su mayoría retrospectivos, con un tamaño muestral escaso. El autor Beniey6 redactó en 2019 una revisión de los artículos que hasta el momento estaban publicados, para determinar el patrón de diseminación, los métodos de diagnóstico y el pronóstico de las metástasis gastrointestinales y peritoneales del cáncer de mama. Además, esta revisión tuvo como objetivo evaluar el papel de la cirugía citorreductora con o sin quimioterapia intraperitoneal hipertérmica (HIPEC) en pacientes afectados. En esta revisión se incluyen 21 artículos en inglés, en su mayoría observacionales. La mayoría de los artículos demuestran que la carcinomatosis peritoneal en cáncer de mama está principalmente asociada a carcinoma lobulillar infiltrante en comparación con el carcinoma ductal infiltrante, con diferencias estadísticamente significativas. Inoue et al. informaron que el 68.8% de los carcinomas lobulares se habían extendido al peritoneo en comparación con el 1% de los carcinomas ductales7,8. En cuanto a los subtipos moleculares más frecuentes con relación a la diseminación peritoneal encontramos, en este orden, los Her2+, luminal B y triple negativo, estos datos fueron estadísticamente significativos, y además congruentes con la importancia pronóstica de los subtipos intrínsecos más agresivos9.
Se ha descrito también que los tumores que presentan una pérdida somática de p53 y E-cadherina se asocian con el desarrollo de metástasis a distancia y en concreto, con diseminación peritoneal en el cáncer de mama10.
Su diagnóstico es difícil dada la inespecificidad de la sintomatología y el largo periodo que, con frecuencia, ocurre desde el diagnóstico inicial del tumor mamario hasta la afectación peritoneal. La sospecha clínica y el estudio histológico-inmunohistoquímico ayudan a diferenciar entre un tumor primario de cavidad peritoneal y metástasis de carcinoma de mama. Actualmente el TAC es el método diagnóstico de elección en la carcinomatosis peritoneal dada su rentabilidad diagnóstica, con una sensibilidad que varía según las series entre el 60% y el 93%, dependiendo del tamaño de los nódulos, las regiones abdominopélvicas exploradas y la experiencia del radiólogo.
Por tanto, ante una paciente con antecedente de carcinoma de mama (especialmente lobulillar) con síntomas gastrointestinales en la que en pruebas de imagen se diagnostique de carcinomatosis peritoneal, deberemos pensar en la posibilidad de afectación metastásica de origen mamario. En este sentido, el empleo de la laparoscopia diagnóstica para la obtención de biopsias, así como la valoración de la extensión de la enfermedad y resecabilidad, son recomendables.
Hay una falta de conocimiento de síntesis y recomendaciones específicas para el tratamiento de las metástasis peritoneales del cáncer de mama. Los estudios que evalúan el papel de la cirugía son principalmente retrospectivos y con un pequeño tamaño muestral, por lo que no sirven para asentar conclusiones al respecto11,12. En términos de tratamiento quirúrgico, hay una escasez de datos sobre los resultados de la quimioterapia intraperitoneal hipertérmica (HIPEC). Los estudios incluidos sugirieron un papel para la cirugía citorreductora y la HIPEC demostraron resultados alentadores en pequeñas cohortes cuando no se presenta enfermedad residual después del procedimiento13. Se necesitan estudios más grandes y sólidos para determinar su impacto en la supervivencia específica del cáncer de mama. La cirugía debe explorarse más en estudios prospectivos en pacientes con una carga metastásica baja, sin metástasis extraabdominales y una alta probabilidad de citorreducción completa. El manejo terapéutico de estas pacientes debe individualizarse según los casos, en espera de resultados de nuevos estudios y ensayos clínicos. Además, la determinación del PCI (Peritoneal Cancer Index) es fundamental para establecer el pronóstico de la enfermedad, valorar la respuesta al tratamiento sistémico y determinar la opción de cirugía de citorreducción.
Es importante en estos pacientes complejos con afectación peritoneal, remitirlos a un Centro de Referencia en el tratamiento multimodal donde pueda ser evaluado y, en caso de cumplir criterios de inclusión, realizar tratamiento multidisciplinar y cirugía citorreductora + HIPEC.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
FinanciaciónLos autores declaran no haber recibido fuentes de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.