La introducción de los primeros antidepresivos en la década de los cincuenta del sigloxx modificó de forma radical el tratamiento de la depresión, a la vez que aportó información sobre aspectos fisiopatológicos de esta enfermedad. Los nuevos fármacos antidepresivos (agomelatina, tianeptina, vortioxetina) están aportando datos que dan lugar a hipótesis fisiopatológicas de la depresión que difieren de la clásica teoría monoaminérgica. En este sentido, la tianeptina, un fármaco atípico por su mecanismo de acción diferencial, contribuye a clarificar que en la fisiopatología de la depresión hay algo más que monoaminas. Así, la tianeptina no modifica la tasa de serotonina extracelular, por lo que no aumenta ni disminuye la recaptación de serotonina. La administración crónica de tianeptina no altera la densidad ni la afinidad de más de un centenar de receptores clásicos relacionados con la depresión. Recientemente se ha descrito una acción débil de la tianeptina sobre receptores opioidesMu que podría explicar la liberación de dopamina en el sistema límbico y su participación en la modulación de mecanismos glutamatérgicos. Estos mecanismos sustentan la hipótesis del posible mecanismo de acción de este antidepresivo.
La tianeptina es un antidepresivo con propiedades ansiolíticas que puede mejorar síntomas somáticos. La tianeptina como modulador glutamatérgico, entre otros mecanismos, permite abordar la depresión desde un punto de vista diferente al del resto de antidepresivos.
The introduction of the first antidepressants in the 50s of the 20th century radically changed the treatment of depression, while providing information on pathophysiological aspects of this disease. New antidepressants drugs (agomelatine, tianeptine, vortioxetine) are providing data that give rise to pathophysiological hypotheses of depression that differ from the classic monoaminergic theory. In this sense, tianeptina, an atypical drug by its mechanism of differential action, contributes to clarify that in depression there is more than monoamines. Thus, tianeptine does not modify the rate of extracellular serotonin, so it does not increase or decrease the reuptake of serotonin. Chronic administration of tianeptine does not alter the density or affinity of more than a hundred classical receptors related to depression. Recently, a weak action of tianeptine on Mu opioid receptors has been described that could explain the release of dopamine in the limbic system and its participation in the modulation of glutamatergic mechanisms. These mechanisms support the hypothesis of the possible mechanism of action of this antidepressant.
Tianeptine is an antidepressant, with anxiolytic properties, that can improve somatic symptoms. Tianeptine as a glutamatergic modulator, among other mechanisms, allows us to approach depression from a different point of view than other antidepressants.
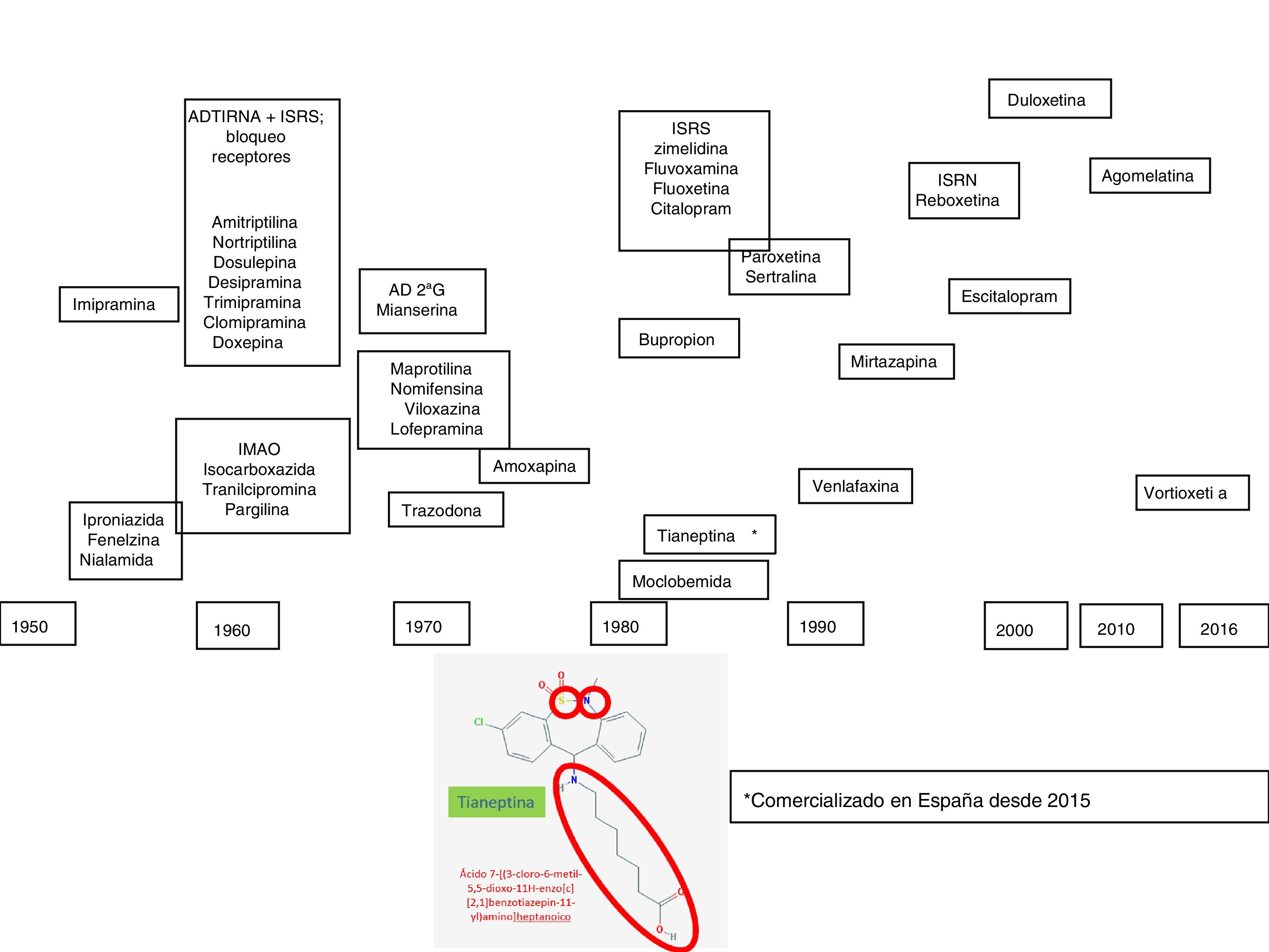
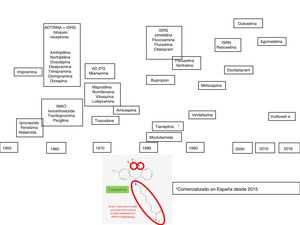
La depresión es un trastorno complejo y heterogéneo, con una fisiopatología difícil de desenmascarar. Para explicar los mecanismos que subyacen a su patogénesis se recurre a investigaciones basadas en modelos animales, técnicas genéticas y farmacológicas1, que pueden tener una translación a la clínica no siempre fácil de interpretar. Sin embargo, la respuesta farmacológica a agentes que tienen mecanismos de acción similares, fundamentalmente monoaminérgicos, ha sido de ayuda para dilucidar algunos aspectos de la fisiopatología de la depresión. En este sentido, la introducción clínica de los fármacos antidepresivos en el arsenal terapéutico se produjo durante los años cincuenta del sigloxx, período en que tuvo lugar la denominada «revolución de la psicofarmacología». Durante esa década se descubrieron las propiedades antidepresivas de la iproniazida y la imipramina, primeros exponentes de las familias de los inhibidores de la monoaminooxidasa (IMAO) y de los antidepresivos tricíclicos (ADT), respectivamente. En los años setenta fueron apareciendo nuevos antidepresivos heterocíclicos, denominados «antidepresivos atípicos» o «de segunda generación» (maprotilina, mianserina, trazodona, viloxazina, nomifensina), que constituyeron la transición para la introducción, a finales de los años ochenta, de los inhibidores selectivos de la recaptación de serotonina (ISRS), los inhibidores de la recaptación de noradrenalina y serotonina (IRNS), como la venlafaxina, y más recientemente la duloxetina y la desvenlafaxina, los inhibidores de receptores aminérgicos presinápticos, cuyo prototipo es la mirtazapina, y los inhibidores selectivos de la recaptación de noradrenalina (IRNA), con la reboxetina como único representante2,3 (fig. 1).
Desde una perspectiva farmacológica, todos estos antidepresivos han explorado mecanismos monoaminérgicos. En definitiva, con todos ellos lo que se consigue inicialmente es producir un aumento de monoaminas en la hendidura sináptica, lo que dio pie a la hipótesis monoaminérgica de la depresión4. Sin embargo, con los agentes que actúan de acuerdo con esta teoría clásica de la depresión puede existir una falta total de respuesta o presentar una respuesta parcial, permaneciendo síntomas residuales y además pueden presentar una mala tolerabilidad, relacionada con el funcionalismo serotoninérgico, con efectos adversos a nivel cardiovascular o aumento del riesgo de suicidio5.
En este sentido, se puede señalar que el avance real aportado por los nuevos agentes antidepresivos se ha basado, más que en una mayor eficacia terapéutica —algunos ni siquiera superan a los clásicos—, en un perfil diferencial de efectos adversos6, quedando problemas por resolver. Actualmente necesitamos nuevos antidepresivos que aborden el problema de la depresión con un mecanismo de acción diferente del de los antidepresivos «monoaminérgicos»6.
En la actualidad sabemos que el citado aumento monoaminérgico en la hendidura sináptica actuaría como un «interruptor» que pondría en marcha una serie de eventos presinápticos y postsinápticos retardados, mecanismos de transducción, que se asemejarían al «disco duro» de un ordenador, y que en definitiva sería el responsable del efecto antidepresivo6,7.
En la primera década del sigloxxi se comercializa la agomelatina, un antidepresivo cuyo inicio del efecto no es exclusivamente monoaminérgico. Recientemente, el arsenal antidepresivo se ha visto incrementado con la vortioxetina, con un mecanismo «multimodal», ya que afecta al funcionalismo de varias monoaminas (serotonina, noradrenalina, histamina, etc.), y por último se ha comercializado en España la tianeptina, un antidepresivo con un mecanismo de acción diferencial que es el motivo de este trabajo (fig. 1). En esta revisión describiremos como la tianeptina no utiliza interruptores monoaminérgicos, por lo que pone en marcha mecanismos de transducción diferenciales que, en definitiva, podrían ser los responsables del efecto antidepresivo6-8.
Los intentos por encontrar otros antidepresivos que inicien sus efectos a través de mecanismos independientes de los monoaminérgicos son intensos, aunque de momento se han obtenido pocos resultados satisfactorios. En efecto, la exploración de análogos de las neurotrofinas, antagonistas de la CRH, moduladores de los receptores NMDA, antagonistas de la sustanciaP, todos ellos con base experimental y científica, fundamentalmente preclínica, que avalaban un potencial efecto antidepresivo, no han dado los resultados esperados desde el punto de vista clínico y, por tanto, no han podido ser comercializados9,10.
La tianeptina es un antidepresivo atípico que constituye una excepción al abordaje monoaminérgico de la depresión11, cuyas características farmacológicas experimentales5 se desarrollarán en esta revisión.
Tianeptina en el arsenal antidepresivoLa tianeptina fue sintetizada por Deslandes y Spedding y comercializada en Europa en los años ochenta12, aunque en España su introducción ha sido muy reciente. La tianeptina tiene una estructura heterocíclica que le ha llevado a menudo a clasificarse como un antidepresivo tricíclo13,14. Sin embargo, la tianeptina se caracteriza por incorporar 2 heteroátomos: azufre (S) (de ahí su nombre «tia» =«azufre») y nitrógeno (N) en lugar de carbono (C) en el anillo central, y lleva una cadena aminoheptanoica lateral. El núcleo tricíclico tiene un heteroátomo donante de electrones en la posición5 y un átomo aceptor de electrones en la posición3 del anillo aromático. La cadena lateral tiene una longitud óptima de seis enlaces, fundamental para su eficacia (fig. 1). Es de destacar que estas características químicas le diferencian de otros agentes antidepresivos con núcleo tricíclico, tanto desde el punto de vista estructural como en sus características farmacodinámicas y clínicas y, por tanto, la tianeptina no es un antidepresivo tricíclico. Esta diferente estructura convierte a la tianeptina en un antidepresivo con un perfil farmacológico experimental y clínico diferencial al de otros antidepresivos.
Así, en clínica, la tianeptina muestra, además de un efecto antidepresivo, un efecto ansiolítico adicional, hecho común con otros antidepresivos, pero con la diferencia que no conlleva la presencia de sedación. Además, la tianeptina mejora el componente cognitivo y tiene actividad sobre los síntomas somáticos de la depresión, especialmente los digestivos. Puesto que la comorbilidad de depresión, ansiedad y somatización es sumamente frecuente, el empleo de tianeptina se traduce por una eficacia clínica de espectro más amplio5,15.
Aspectos farmacocinéticos de la tianeptinaLa absorción desde el tracto gastrointestinal de la tianeptina es buena, y puesto que no sufre el metabolismo de primer paso hepático, tiene una alta biodisponibilidad16. El efecto de los alimentos es modesto, produciéndose un incremento de media hora en la Tmax y una disminución de un 25% de la Cmax. La magnitud de estos efectos parece tener poca significación clínica17. La fijación a las proteínas plasmáticas es de alrededor del 95%, y lo hace especialmente a la albúmina18.
La tianeptina se elimina con rapidez, principalmente por el riñón, y tiene una vida media (T1/2) corta, de aproximadamente 2,5h. Sus principales metabolitos son análogos de la tianeptina con una cadena lateral C5 y C3 y un derivado N-desmetilado16. En pacientes con insuficiencia renal y en ancianos se observó una prolongación de 1h de la vida media de eliminación16,18. La vida media del metabolito C5 casi se triplicó en pacientes con insuficiencia renal crónica. Puesto que este metabolito C5 es farmacológicamente activo, la dosis de tianeptina debe reducirse en pacientes con insuficiencia renal. Tanto la tianeptina como su metabolito C5 son poco dializables, por lo que la hemodiálisis es un método poco eficaz para acelerar su eliminación en caso de sobredosis18.
La administración aguda de alcohol disminuyó la tasa de absorción de tianeptina y sus niveles plasmáticos en aproximadamente un 30%, pero no afectó a la farmacocinética del metabolito C5. La farmacocinética de la tianeptina en individuos con hepatitis alcohólica no se diferenció significativamente de la de los controles normales16,19.
En el anciano (72-81años) la farmacocinética de la tianeptina es similar a la de los voluntarios jóvenes, pero los niveles del metabolito C5 fueron mayores, sugiriendo la necesidad de una posible reducción de dosis20. En este sentido, la pauta posológica en mayores de 70años es de dos tomas al día (25mg) en lugar de las tres tomas (37,5mg) recomendadas en adultos21-23.
Aspectos farmacodinámicos de la tianeptinaSegún la clasificación de medicamentos ATC (Anatomical, Therapeutic, Chemical classification system), la tianeptina pertenece al grupo N06AX (Psicoanalépticos [N06]; Antidepresivos [N062]; Otros antidepresivos [N06AX]), y presenta unas características farmacodinámicas diferenciales que condicionan un perfil totalmente diferencial al de otros antidepresivos, que se pone de manifiesto desde su relación receptorial24-25, hasta sus características clínicas, pasando por aspectos marcadamente diferentes sobre mecanismos de transducción, neuroprotección, etc.1,26. La tianeptina es un antidepresivo atípico no monoaminérgico, puesto que, al contrario de la mayoría de antidepresivos comercializados, no inhibe la recaptación de monoaminas (serotonina, noradrenalina o dopamina) en el sistema nervioso central24,27.
La administración crónica de tianeptina no altera la concentración ni la afinidad de más de un centenar de receptores estudiados: receptores noradrenérgicos α1A, α1B, α2A, α2B, α2C, β1, β2; receptores dopaminérgicos D1, D2, D3, D4, D5; receptores serotoninérgicos 5-HT1, 5-HT2, 5-HT3, 5-HT4, 5-HT5A, 5-HT6, 5-HT7; receptores glutamatérgicos NMDA, AMPA, kainato; receptores benzodiazepínicos; receptores GABA-B5,24,27. El único efecto observado con la tianeptina sobre estos receptores se limita a un aumento de la sensibilidad de los receptores α1 adrenérgicos, que se manifiesta solamente en tratamiento crónico28.
Además, la tianeptina no inhibe la actividad de los sistemas enzimáticos de la monoaminooxidasa, MAO-A y MAO-B, como se ha demostrado tanto en el hipotálamo como en el hipocampo y en la corteza cerebral29. Esta limpieza receptorial y enzimática de la tianeptina, observada a nivel experimental, podría tener una traducción clínica, ya que es ampliamente reconocido que muchos de los efectos adversos de los antidepresivos convencionales se deben a su afinidad por diferentes tipos de receptores o a la capacidad de inhibición de la MAO.
En relación con la serotonina, los ISRS, los antidepresivos duales, como venlafaxina, duloxetina y devenlafaxina, así como muchos de los ADT, inhiben la recaptación de serotonina, por lo que aumentan su tasa en la hendidura sináptica. Este hecho ha sido la base de la hipótesis serotoninérgica de la depresión2,6. En base a los experimentos realizados inicialmente con tianeptina, se postuló que este antidepresivo, al contrario de los ISRS, disminuía la tasa de serotonina extracelular, por aumentar la recaptación de serotonina30,31, hecho que tuvo cierta resonancia ya que ponía en cuestión la hipótesis serotoninérgica de la depresión. Sin embargo, en la actualidad se sabe que la tianeptina no aumenta el número de transportadores de serotonina ni los niveles de ARNm del mismo en el núcleo dorsal del rafe. Además, la tianeptina presenta una muy baja afinidad por estos transportadores de serotonina, por lo que no parece probable que pueda aumentar la recaptación32. Estos datos contradictorios se deben a las limitaciones técnicas del momento, superadas en la actualidad5,33. De hecho, investigaciones posteriores han demostrado que la tianeptina, tanto en administración aguda como a largo plazo, no aumenta ni disminuye de forma significativa los niveles extracelulares de 5-HT en las estructuras corticolímbicas de ratas conscientes. Además, estudios electrofisiológicos ponen en evidencia que la administración mantenida de tianeptina no modifica la tasa de descarga espontánea de las neuronas serotoninérgicas en el rafe dorsal34, ni modifica la actividad de los receptores 5-HT1A postsinápticos, ni la eficacia de los antagonistas de autorreceptores presinápticos para aumentar la función de la terminal sináptica. Además, la administración de tianeptina, en administración tanto aguda como crónica, no modificó la tasa extracelular de serotonina, mientras que en idénticas condiciones esta aumenta tras la administración de paroxetina34.
Por todo lo expuesto, parece poder concluirse que la tianeptina no modifica la tasa de serotonina extracelular, por lo que no aumenta ni disminuye la recaptación de serotonina. Por tanto, los mecanismos serotoninérgicos no parecen participar, o en el mejor de los casos son insuficientes para explicar la eficacia antidepresiva de la tianeptina26.
Puesto que la tianeptina actúa sobre mecanismos bien diferenciados de los de los ISRS, se podría explicar su eficacia en pacientes resistentes a estos antidepresivos, como se ha puesto de manifiesto en clínica35. Asimismo, este abordaje diferencial de la depresión podría explicar su eficacia en la depresión de pacientes con Parkinson36, en los que los ISRS pueden empeorar la sintomatología motora, así como en pacientes con trastorno de estrés postraumático37,38 o en el anciano39.
Además, se ha podido observar que pacientes tratados con ISRS que presentaban como efecto adverso disfunción sexual mejoraron, manteniéndose el efecto antidepresivo40.
Por otra parte, el único efecto detectado con tianeptina, tras administración sistémica, sobre los niveles de monoaminas es un aumento moderado de la liberación de dopamina en núcleo accumbens y, a dosis más elevadas, en la corteza prefrontal29. Sin embargo, no está claro cómo la tianeptina refuerza la transmisión dopaminérgica a este nivel, ya que carece de afinidad por el transportador dopaminérgico, por lo que no inhibe la recaptación de dopamina, hecho que la diferencia por completo del amineptino41. De hecho, la tianeptina, tras administración aguda o crónica, no modifica la recaptación de dopamina o noradrenalina por los sinaptosomas corticales o del hipocampo de rata. Presumiblemente, acciones independientes de las neuronas dopaminérgicas podrían estar involucradas, como la inhibición tónica de las mismas por terminales GABAérgicas y glicinérgicas, en la moderada liberación dopaminérgica por tianeptina13,42.
Tianeptina: mecanismos opioidérgicos y efecto antidepresivoLos receptores opioides han sido implicados en diverso grado en la depresión y en su tratamiento. Sin embargo, algunos datos experimentales que implican a los receptores Delta en la ansiedad y en la depresión43 no se han acompañado de eficacia en clínica humana44. Del mismo modo, algunos estudios que se han dedicado a investigar el papel de moduladores de receptores Kappa en la depresión —ya que estos receptores son la diana de las dinorfinas que se liberan por el estrés45— no han dado resultados clínicamente relevantes46.
La tianeptina, así como su metabolito activo MC5, se comportan como agonistas de receptores opioidesMu y, en menor medida, Delta, sin afectar al receptor Kappa47,48. Un hecho destacable es que la tianeptina, pese a su afinidad sobre estos receptores, no provocó tolerancia, ya que no pierde su eficacia tras el tratamiento continuado, ni dependencia física, ya que tras la supresión o la administración de naloxona no se observó síndrome de abstinencia. Estas dos características diferencian claramente la tianeptina de otros opioides, como la morfina. Con toda probabilidad, la tianeptina, pese a actuar sobre el receptor Mu, pondría en marcha mecanismos de transducción neuronal diferentes a los inducidos por la morfina y otros opioides, ya que estos provocan tolerancia y síndrome de abstinencia tras su suspensión. Este hecho diferencial ha suscitado la posibilidad de que se puedan desarrollar antidepresivos que actúen sobre los mecanismos de transducción modificados por la tianeptina5,48.
Por otra parte, hemos de señalar que la potencia de la tianeptina sobre receptores Mu es 6 veces menor que la de morfina, y que la adicción al antidepresivo se ha limitado a casos aislados48, fundamentalmente en pacientes polidrogodependientes. De hecho, la tianeptina no provoca tolerancia ni síndrome de abstinencia, dos características ineludibles de los opioides que provocan dependencia. Además, en línea de lo comentado, se ha demostrado que dosis supraterapéuticas de tianeptina mostraron un bajo potencial de abuso49. Así, en el ratón, la tianeptina disminuyó de forma significativa la tolerancia a la morfina y suprimió el síndrome de abstinencia provocado por la administración de naloxona, por lo que se puede afirmar que la tianeptina, pese a tener afinidad por receptores opioides, se comporta como un inhibidor de la tolerancia y dependencia morfínica. De hecho, estos autores señalan que la administración de tianeptina podría beneficiar a los pacientes que necesitan la administración de morfina por tiempo prolongado50. Estas propiedades farmacológicas de la tianeptina han despertado un gran interés, no solo en el campo de la depresión, sino también en el posible desarrollo de agonistas de receptores Mu que modifiquen los mecanismos de transducción de forma similar a como lo hace la tianeptina, con el fin de conseguir analgésicos que provoquen menor dependencia respecto a los opioides clásicos48.
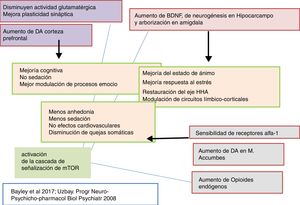
Otro hecho que indica que la tianeptina presenta características diferenciales con los opioides es que, sin modificar la actividad analgésica de la morfina, es capaz de antagonizar la depresión respiratoria experimental inducida por el opioide. Puesto que la tianeptina no se comporta como un antagonista de receptores Mu, se piensa que el antagonismo de la depresión respiratoria es indirecto y secundario a la modulación positiva de receptores AMPA, como luego comentaremos51. Según describen Bailey et al.5, las acciones antidepresivas de la tianeptina en los ratones dependen del receptor Mu, el cual podría activar, a su vez, la señalización demTOR para potenciar la señalización asociada al AMPA.
Por otra parte, Kalkman y Feuerbach52 describieron como algunos antidepresivos inhiben la inflamación y la polarización M-1 microglial. En modelos experimentales de depresión/estrés mostraron que el estrés crónico provocaba polarización M1 de macrófagos y de la microglía. En este sentido, en la forma polarizada M1, la microglía y los macrófagos generan especies reactivas de oxígeno y radicales de nitrógeno para erradicar los patógenos microbianos, pero también pueden oxidar, de forma irreversible, la tetrahidrobiopterina (BH4), lo que genera neopterin, un biomarcador reconocido de la depresión. Además, este BH4 es un cofactor crítico para la síntesis de dopamina, noradrenalina y serotonina, y su pérdida podría explicar algunos de los síntomas depresivos.
Además, se sabe que los agonistas de receptores Mu poseen propiedades antinflamatorias y que estos receptores se expresan en monocitos humanos, en macrófagos y en la microglía53-54, aumentando su expresión con la polarización M2 de la citoquina, IL455. La morfina, como agonista de receptores Mu, inhibe la liberación de TNFα por los macrófagos inducida por lipopolisacáridos de membranas bacterianas56, a la vez que disminuye la actividad fagocítica y la producción de especies reactivas de oxígeno y prostaglandinas53. Estos datos permiten postular que la tianeptina, mediante la estimulación de receptores opioides Mu, podría limitar la polarización M1 de los macrófagos y de la microglía, disminuyendo el proceso
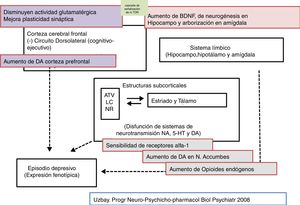
En conclusión, podemos indicar que la relación de la tianeptina con los receptores opioides Mu se caracteriza por poner en marcha mecanismos de transducción probablemente diferente a los de los opioides convencionales, hecho que puede estar implicado indirectamente en el mecanismo de su acción antidepresiva. La especial acción de la tianeptina sobre receptores opioides puede explicar la liberación de dopamina en el sistema límbico y además participar en la modulación de mecanismos glutamatérgicos. Además, la tianeptina, a través de la estimulación de los receptores opioides Mu, podría limitar la polarización M1 de macrófagos y células microgliales52. Es interesante destacar que las propiedades de la tianeptina como un opioide muy peculiar pueden contribuir a sus propiedades antidepresivas. De hecho, Nobile et al.57 destacan un interés potencial de los agonistas opioides para reducir el riesgo de empeoramiento de ideas suicidas al inicio del tratamiento antidepresivo. En este sentido, la tianeptina se asoció con un menor riesgo de ideación suicida, relación con inhibidores de la recaptación de noradrenalina y serotonina o ADT, en las primeras seis semanas de tratamiento57.
Tianeptina: mecanismos glutamatérgicos y efecto antidepresivoEn los últimos años se han acumulado una serie de datos experimentales que apoyan el papel del funcionalismo glutamatérgico, principal neurotransmisor excitatorio en el cerebro, y sus múltiples y variados receptores, ionotrópicos y metabotrópicos, en la fisiopatología de la depresión. Asimismo, se han acumulado evidencias que indican que algunos puntos del sistema funcional glutamatérgico podrían ser la diana del efecto terapéutico de algunos antidepresivos14,26,58.
La evidencia de niveles elevados de glutamato en la depresión y la eficacia antidepresiva de agentes antiglutamatérgicos sugieren que este cuadro puede estar asociado a una hiperfunción glutamatérgica. El glutamato es el principal neurotransmisor excitador en el cerebro, donde tiene una distribución amplia y ubicua. En el cerebro humano las neuronas glutamatérgicas proyectan sus axones desde la corteza a regiones subcorticales, tales como el locus coeruleus, núcleos del rafe y la substancia nigra, donde modulan vías monoaminérgicas, lo que permite al sistema glutamatérgico participar en una amplia gama de funciones fisiológicas, entre las que se encuentran la memoria y la cognición. Además, el glutamato participa en funciones fisiológicas relacionadas con la neurotroficidad y la plasticidad neuronal. Sin embargo, el glutamato en exceso, como el que se produce durante situaciones de estrés continuado, puede convertirse en una sustancia neurotóxica. Por otra parte, la presencia del glutamato en una serie de estructuras cerebrales relacionadas con la fisiopatología y la sintomatología de la depresión habla a favor de su papel en esta sintomatología. De hecho, son muchos los datos que indican que una hiperfunción glutamatérgica podría estar en la base de la depresión6,26.
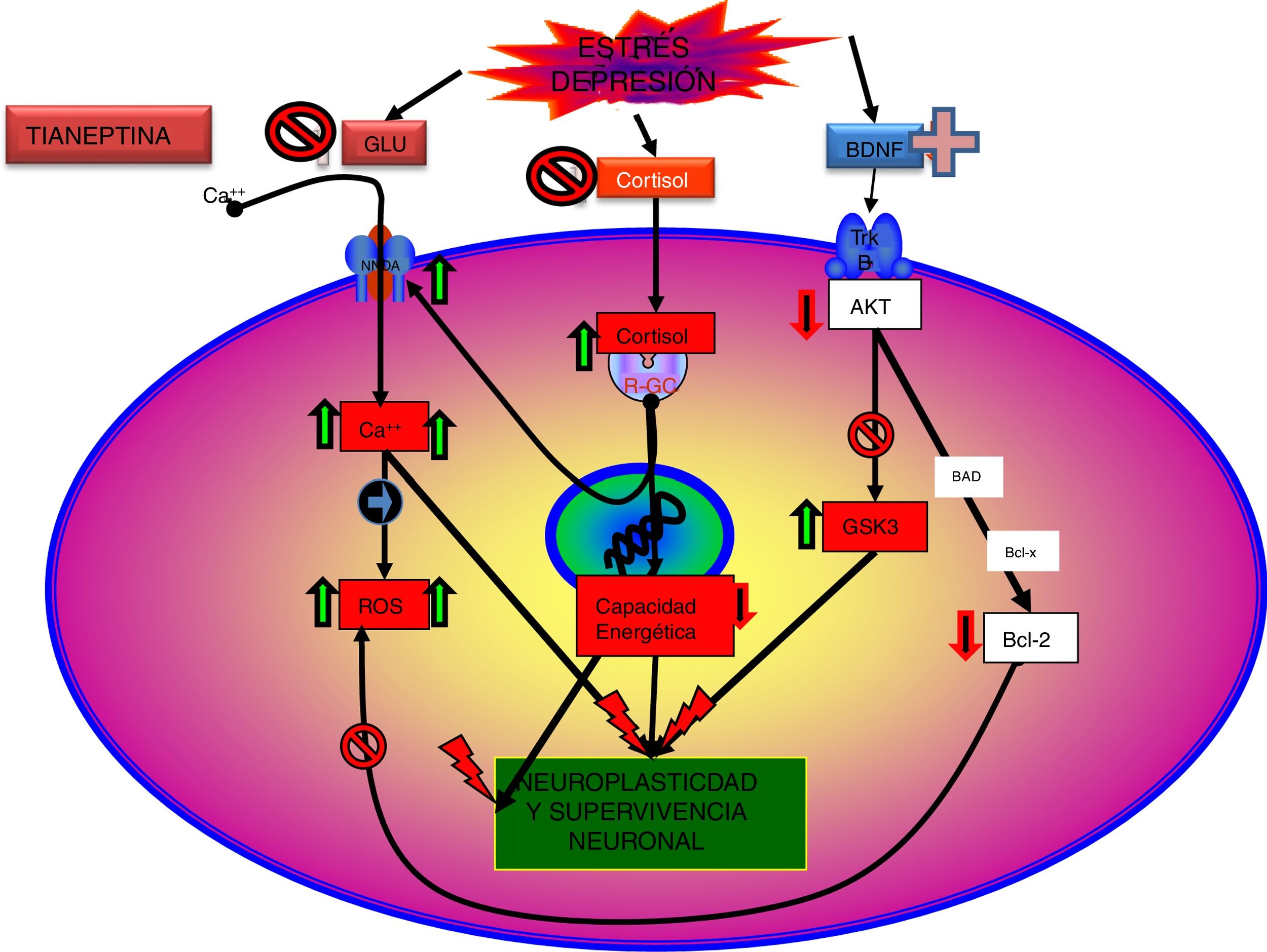
En efecto, existen evidencias que indican que el funcionalismo glutamatérgico puede estar relacionado con la depresión, y su modulación, con el efecto antidepresivo. Así, el estrés crónico y los estados depresivos suelen relacionarse generalmente con una hiperfunción de los receptores NMDA59 y los antagonistas de estos receptores suelen comportarse como antidepresivos. En este sentido, existen pruebas de que la normalización y la estabilización de la neurotransmisión glutamatérgica son objetivos de fármacos potencialmente eficaces en el tratamiento de los trastornos depresivos. Algunos antidepresivos atenúan la liberación de glutamato en las estructuras corticolímbicas59,60, y la administración a largo plazo de diferentes grupos de antidepresivos, como ADT, ISRS o IMAO, modifica a la baja la densidad o la sensibilidad de los receptores NMDA61 al desensibilizar el locus de glicina.
A nivel experimental, una serie de antagonistas de los receptores NMDA han demostrado efectos antidepresivos62. La administración de ketamina, un anestésico que antagoniza de forma no competitiva los receptores NMDA, ha mostrado efectos ansiolíticos y antidepresivos en modelos animales de ansiedad y depresión. En la actualidad existen evidencias que indican que la ketamina se comporta clínicamente como un antidepresivo de acción rápida, a la vez que reduce las ideas autolíticas. El efecto rápido antidepresivo de la ketamina la diferencia sustancialmente de los antidepresivos monoaminérgicos, que necesitan semanas para iniciar su efecto antidepresivo10.
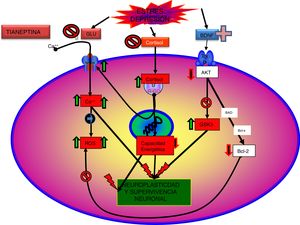
La tianeptina parece modular algunos aspectos del funcionalismo glutamatérgico. Así, el estrés agudo aumenta los niveles de glutamato extracelular en el núcleo basolateral de la amígdala, incremento que es normalizado por la administración de tianeptina. Además, la tianeptina moduló los cambios en la expresión de los transportadores gliales de glutamato inducidos por el estrés. Es importante señalar que el transportador glial es el mecanismo más importante para la finalización de la actividad del glutamato en las sinapsis excitadoras, por lo que la normalización del transportador de glutamato por la tianeptina disminuiría los niveles «tóxicos» de glutamato extracelular63.
El receptor NMDA es sumamente complejo en su funcionamiento, ya que necesita, además de glutamato, la presencia indispensable de glicina para que se produzca la apertura de su canal. En este sentido, se ha comprobado que un antagonista del locusB de la glicina (L-701.324) potencia el efecto antidepresivo experimental de la tianeptina, mientras que, por el contrario, la D-serina, un agonista del citado locusB de la glicina, antagoniza el efecto antidepresivo de la tianeptina. Estos resultados sugieren una importante participación del locusB de la glicina del receptor NMDA como diana del efecto antidepresivo experimental de la tianeptina64. Es de destacar que varios antidepresivos, como la imipramina, la fluoxetina y la reboxetina, desensibilizan también el locusB de la glicina65, lo que habla a favor de este locus como diana farmacológica antidepresiva.
Estudios electrofisiológicos en la rata han permitido comprobar que el estrés repetitivo potencia las corrientes postsinápticas excitatorias (EPSC), dependientes del receptor NMDA, en las sinapsis de asociación con las neuronas piramidales CA3. Cuando las ratas fueron tratadas con tianeptina se normalizó la relación de las corrientes mediada por el receptor NMDA respecto a las mediadas por el AMPA/kainato. Esta normalización de la relación funcional entre ambos receptores se considera que puede contribuir a las propiedades neuroprotectoras de la tianeptina frente al estrés66.
Sin desechar el papel de los receptores NMDA, cada vez existen más datos que avalan un papel más importante de los receptores AMPA en la fisiopatología y el tratamiento de la depresión60,67. Por un lado, la existencia de una alta densidad de receptores AMPA en estructuras responsables de la regulación del humor, como la corteza prefrontal y el hipocampo, apuntan a su importancia en la fisiopatología de los trastornos afectivos. Por otra, se ha comprobado que los moduladores positivos de los receptores AMPA se comportan como antidepresivos, en modelos animales de depresión, con una eficacia comparable a la de los ADT o ISRS60,68. Por otra parte, el receptor AMPA interviene en la mayoría de los procesos de transmisión rápida y parece ser un mecanismo central en la plasticidad sináptica, fenómeno al que cada vez se le da más importancia en la fisiopatología de la depresión68.
Asimismo, la fosforilización de los receptores AMPA, que como comentaremos conlleva su activación y sensibilización, parece jugar un papel importante desde el punto de vista fisiológico. En el hipocampo, algunos estados fisiológicos, como el sueño69 o el aprendizaje70, pueden alterar la fosforilización de la subunidad GluA1 de estos receptores, aumentando por tanto su actividad y expresión, lo que parece apuntar hacia un importante papel en la codificación y procesamiento de la memoria71-72.
Es conocido que la tianeptina potencia la función del receptor AMPA a través de dos mecanismos interrelacionados. Por una parte, facilitando la fosforilización de la subunidad GLuA1, y por otra, aumentando la síntesis y el tráfico de receptores AMPA hacia la membrana73,74. Ambos mecanismos aumentan la sensibilidad de los receptores AMPA72. La fosforilización de la subunidad GLuA1 en el locus de la PKA (serina 845) aumenta la eficiencia del canal controlado por el receptor AMPA al incrementar la probabilidad de apertura y el pico de entrada de la corriente75, mientras que la fosforilización del locus PKC/CaMKII (serina 831) aumenta la conductancia del canal AMPA76. Además, la fosforilización de la subunidad GluA1 del receptor AMPA aumenta la concentración de receptores en la superficie77-78. En definitiva, la tianeptina mediante la facilitación de la fosforilización de la subunidad GluA1 aumenta la eficacia del receptor AMPA haciendo que haya más canales en la superficie de la membrana y que estos sean más eficaces73. Además, se ha podido demostrar que la fosforilización inducida sobre la subunidad GluA1 del receptor AMPA por la tianeptina no altera la recuperación del receptor, por lo que, ante un estímulo sostenido, no se desensibiliza y mantiene su respuesta75.
Se ha podido comprobar que, en concordancia con los efectos electrofisiológicos de la tianeptina, este antidepresivo, facilitando la fosforilación de las subunidades GluA1 del receptor AMPA, facilita la función neuroprotectora achacada a este receptor. Es de destacar que el tratamiento con otros antidepresivos, como la fluoxetina o la imipramina, también aumenta la fosforilación del receptor AMPA27, y que este proceso molecular está muy relacionado con la plasticidad sináptica. Estos datos sugieren que los receptores AMPA están vinculados a los efectos terapéuticos y neuroprotectores de algunos antidepresivos, y en especial los de la tianeptina26,69.
Es destacable que la actividad antidepresiva experimental de la tianeptina, en el modelo de depresión de natación forzada en ratones, dependa de la presencia de residuos de serina fosforilada en la subunidad GluA1 del receptor AMPA27. La fosforilización de esta subunidad activa al receptor AMPA, por lo que la subunidad GluA1 del receptor AMPA podría ser la diana inicial responsable del efecto antidepresivo y neuroprotector de la tianeptina26,27. La importancia del receptor AMPA en los efectos antidepresivos de la tianeptina parece evidente, ya que el bloqueo de estos receptores por NBQX inhibe su actividad antidepresiva64.
El estrés agudo aumenta los niveles extracelulares de glutamato en el núcleo basolateral de la amígdala, efecto que es inhibido por la tianeptina, lo que apoya la hipótesis de que el mecanismo de acción antidepresiva de la tianeptina implica la normalización del tono glutamatérgico en la amígdala y en el hipocampo. Por el contrario, la fluoxetina aumentó los niveles de glutamato en dicho núcleo tanto en presencia como en ausencia de estrés. Este hecho pone de manifiesto otra diferencia en el mecanismo de acción de la tianeptina respecto al de los ISRS79.
En la actualidad, el funcionalismo glutamatérgico es una diana del máximo interés en la investigación y en el desarrollo futuro de nuevos fármacos antidepresivos80. La tianeptina puede considerarse el presente, ya que en su actividad antidepresiva participa su capacidad de bloquear el locusB de la glicina en el receptor NMDA y la potenciación, mediante fosforilización de la subunidad GluA1, del receptor AMPA. La interacción de la tianeptina con estos dos receptores glutamatérgicos parece desempeñar un papel clave en su acción antidepresiva64.
Tianeptina: neurotrofinas y efecto antidepresivoSe sabe que el estrés disminuye las neurotrofinas brain derived neurotrophic factor (BDNF), un importante mediador de la plasticidad neuronal, fundamentalmente en el hipocampo, lo que puede contribuir a la atrofia y a la pérdida neuronal observada en zonas claves del cerebro de algunos pacientes con depresión. Por el contrario, los antidepresivos incrementan la fosforilación de la cAMP response element binding protein (CREB), por lo que incrementan la expresión de factores neurotróficos, como el BDNF81.
En este sentido, existen datos experimentales que indican que la tianeptina puede contrarrestar los efectos neurodegenerativos del estrés al aumentar la expresión genética de diversos factores neurotróficos. En efecto, la tianeptina incrementa los niveles de BDNF y de nerve growth factor (NGF) tanto en el hipocampo82 como en la amígdala83, lo que se manifiesta morfológica, electrofisiológica y conductualmente mejorando la plasticidad amigdalar83. Además, experimentalmente, el tratamiento crónico con tianeptina demostró su eficacia y de forma paralela incrementó los niveles de BDNF en la corteza prefrontal y en el hipocampo84.
Por otra parte, en ratas sometidas a estrés continuado la administración de agentes neuroinflamatorios (lipopolisacáridos) provoca en la amígdala y en el hipocampo una disminución de los niveles de BDNF, así como un incremento de corticosterona adrenal que se acompaña de síntomas depresivos. En este modelo, la administración de los antidepresivos desipramina y fluoxetina, como controles, revierten los cambios provocados por el lipopolisacárido. La administración de tianeptina exhibió un potente efecto neuroprotector, que se acompañó de un aumento de BDNF y una disminución de corticosterona, superior al exhibido por la desipramina (inhibidor de la recaptación de noradrenalina) y al de la fluoxetina (ISRS)85.
El estrés intermitente por frío en la rata es un modelo experimental de fibromialgia que se acompaña de una disminución de niveles de BDNF y CREB fosforilado en el hipocampo y en la corteza prefrontal, junto a un aumento importante de los niveles de corticosterona. En este modelo experimental, la administración de tianeptina antagonizó la hiperalgesia, a la vez que normalizó los niveles de BDNF, del CREB fosforilado y de la corticosterona. Los autores señalan que la tianeptina podría mostrar eficacia en la depresión que cursa con dolor, y de comportarse igual en clínica podría ser una alternativa farmacológica al difícil tratamiento de la fibromialgia86.
Por todo lo expuesto, el efecto antidepresivo de la tianeptina se asoció con un incremento de los niveles de BDNF en áreas del SNC relacionadas con la depresión, por lo que se postula que esta neurotrofina pueda estar implicada en el efecto antidepresivo de la tianeptina.
Tianeptina: inflamación y efecto antidepresivoEn la compleja fisiopatología de la depresión existen cada vez más evidencias de su asociación con procesos inflamatorios en los que participan diversos inmunomediadores. En el modelo de depresión provocado por el estrés prenatal en la rata se producen alteraciones de las quimioquinas (CXCL12 y CX3CL1), así como de sus receptores (CX3CR), que son los principales reguladores de los procesos inflamatorios en el cerebro. Las alteraciones del eje de las quimioquinas tienden a normalizarse por la administración crónica de algunos antidepresivos (venlafaxina, fluoxetina, tianeptina) en el hipocampo, mientras que la tianeptina y la venlafaxina normalizaron además el nivel de CXCL12 en la corteza frontal. Además, la tianeptina normalizó los niveles de CX3CL1 y su receptor CX3CR1, tanto en el hipocampo como en la corteza frontal del cerebro. Por otra parte, tanto la fluoxetina como la tianeptina disminuyen el nivel del receptor de quimioquina CXCR7 en la corteza frontal. Además, la tianeptina moduló los niveles cerebrales de TGF-beta en el modelo animal de depresión inducido por el estrés prenatal. En este modelo la tianeptina ha mostrado eficacia antidepresiva y ansiolítica87.
Por otra parte, la inflamación y el estrés oxidativo están íntimamente relacionados entre sí y, por tanto, pueden participar en la fisiopatología de la depresión. En el modelo experimental de depresión en ratas, sometidas durante 40días a estímulos estresantes crónicos impredecibles, se produjeron alteraciones en la producción de especies reactivas de oxígeno (ROS) y de nitrogenadas (RNS) que, en condiciones normales, son controladas por elementos antioxidantes como las catalasas y la superóxido dismutasa (SOD). El estrés incrementó los niveles de malonil aldehído, un marcador oxidativo, que fue normalizado por la administración de tianeptina. Además, este antidepresivo revirtió la disminución de la actividad de la SOD en el hipocampo, la corteza prefrontal, la amígdala y el núcleo accumbens de las ratas sometidas a estrés. Así mismo, se observó que la actividad antioxidante de la catalasa disminuyó en la corteza prefrontal, en el hipocampo y en el núcleo accumbens de ratas estresadas, efecto que fue revertido por la tianeptina. Estos datos sugieren que la tianeptina tiene una acción antioxidante por incrementar la actividad de agentes antioxidantes, como la catalasa y la superóxido dismutasa. Además, estos hallazgos suponen nuevas dianas para el desarrollo de nuevos agentes antidepresivos, a la vez que ayudan a comprender la actividad farmacológica de la tianeptina, en particular con respecto a su capacidad para atenuar el estrés oxidativo88.
Tianeptina: función del eje hipotálamo-hipofiso-adrenalTanto la depresión mayor como el estrés continuado se asocian con una hiperactividad del eje hipotálamo-hipofiso-adrenal (HHA). En clínica, los pacientes deprimidos presentan niveles elevados de cortisol en plasma y en LCR que indican una hiperfunción de este eje secundaria a una desensibilización de receptores centrales de corticosteroides89. Esta hiperfunción del eje HHA se caracteriza por una hipersecreción de corticoides, tanto a nivel experimental como clínico90. En efecto, diversos tipos de estrés experimental constituyen modelos de depresión caracterizados por alteraciones neuroendocrinas, fundamentalmente una alteración del control del eje HHA, y alteraciones conductuales en el animal de experimentación. Además, la administración prenatal de corticosteroides en roedores provoca un cuadro neuroendocrino y conductual similar al observado en pacientes con depresión91. Por ello, se postula que una mala adaptación del eje HHA al estrés esté implicada en el desarrollo de una ulterior depresión92,93.
Se ha podido comprobar que muchos antidepresivos muestran eficacia en modelos experimentales de depresión por estrés. La tianeptina es capaz de antagonizar las alteraciones conductuales que provoca el estrés en el animal de experimentación, a la vez que reduce la hiperrespuesta del eje HHA94,95. Además, algunos cambios morfológicos neuronales, como la atrofia dendrítica en el hipocampo de ratas, secundarios a la elevación de corticosterona por el estrés, pueden ser prevenidos por la administración de tianeptina96.
Recientemente se ha asociado una disfunción HHA con una actividad anormal de la corteza prefrontal en pacientes deprimidos con alteraciones funcionales del hipocampo. La tianeptina atenuó la hiperactividad del eje HHA, así como las alteraciones neuronales secundarias observadas en el hipocampo y en la corteza prefrontal97. Además, se ha demostrado que el uso continuado de tianeptina tiende a «normalizar» el sistema HHA en situaciones de estrés, lo que facilita un mejor desenvolvimiento en un ambiente estresante. El tratamiento con tianeptina inhibe las modificaciones en la transcripción genética inducida por corticosterona y disminuye los niveles plasmáticos de ACTH y de corticosterona inducidos por el estrés. La tianeptina disminuye asimismo la actividad basal de las neuronas productoras del factor liberador de corticotropina (CRF) y su sensibilidad al estrés98. El conjunto de estos hallazgos indica una relación bidireccinal entre el estrés y la depresión a través de una hiperfunción del eje HHA. La tianeptina, al igual que algunos otros antidepresivos, normalizando la funcionalidad del eje HHA puede contrarrestar esta interacción negativa.
Tianeptina: hipótesis de la disfunción mitocondrial de la depresiónAdemás de la hipótesis clásica monoaminérgica de la depresión4, existen suficientes argumentos para pensar que, al menos en algunos tipos de depresión, puede estar implicada una hiperfunción del eje HHA, una disfunción del sistema inmune o un déficit de factores neurotróficos3.
Datos recientes han permitido elaborar una nueva teoría: «la hipótesis de la disfunción mitocondrial en la depresión»99,100, que no excluye, sino que más bien complementa, la hipótesis de la neuroprotección. Según esta hipótesis, una función anómala de las mitocondrias se traduciría por un descenso en la producción de ATP, con una alteración de la homeostasis del calcio, junto a un aumento de la producción de radicales libres y del estrés oxidativo, lo que facilitaría el inicio del proceso de apoptosis101. Además, en el SNC las mitocondrias pueden controlar la neuroplasticidad, incluida la diferenciación y el crecimiento neural, el remodelado dendrítico y la liberación de neurotransmisores102. Por otra parte, existe una relación entre las funciones mitocondriales y ciertos procesos epigenéticos de trascendencia en la patogenia de algunos trastornos mentales, entre los que se incluye la depresión. Por tanto, existen argumentos para pensar que una mala función mitocondrial es crucial en los trastornos metabólicos que pueden llevar a la depresión99.
De acuerdo con esta hipótesis, en la depresión se han observado cambios en la morfología y en la cadena respiratoria mitocondrial, así como un aumento de polimorfismos y mutaciones del ADN mitocondrial103, junto a una hiporregulación del ARNm nuclear y de las proteínas mitocondriales. Además, por microscopía electrónica se observan alteraciones en el número de mitocondrias y en su distribución en áreas cerebrales relacionadas con la patogenia de la depresión104. Es destacable que en cerebros de pacientes depresivos los fosfatos de alta energía y el pH se encuentren disminuidos105.
La influencia de los antidepresivos sobre la función mitocondrial podría apoyar esta teoría, en especial la tianeptina, que parece participar modificando alguno de los mecanismos implicados en la hipótesis mitocondrial de la depresión. En este sentido se ha podido comprobar que in vitro la tianeptina inhibe la actividad del complejoI mitocondrial101, mientras que, en administración crónica a ratas adultas sometidas a deprivación maternal, modula los niveles del complejoI mitocondrial y los complejosII yIII de la cadena respiratoria, a la vez que disminuye la concentración de creatinina en la amígdala y en el hipocampo84.
El estrés en la rata preñada provoca alteraciones en la biogénesis mitocondrial cerebral y en el mitoproteoma de las descendientes cuando se hacen adultas100. Como se ha comentado, este modelo experimental de depresión está muy bien caracterizado y se acompaña de alteraciones conductuales y anomalías neuroendocrinas e inmunes características de los estados depresivos106. La administración crónica de tianeptina a las ratas adultas, descendientes de ratas preñadas sometidas al estrés, se acompaña de un efecto antidepresivo y ansiolítico experimental. Estos efectos conductuales de la tianeptina se acompañaron de un aumento de la expresión de la isocitrato deshidrogenasa (IDH), paso limitante en el ciclo de Krebs, junto con un aumento de la 2-oxoglutarato deshidrogenasa (OCDHC), fundamental para la generación de energía en forma de NADH y de succinil CoA107, cuyo déficit se ha relacionado con la patogenia de la depresión108. Además, la tianeptina en el hipocampo potencia la expresión de la succinato deshidrogenasa (SDH), que es el marcador más importante de la eficiencia mitocondrial, produciendo ATP en el ciclo de Krebs y en la cadena respiratoria. Estas acciones de la tianeptina, a nivel del hipocampo y de la corteza prefrontal, se asocian a un efecto antidepresivo y ansiolítico en estos animales de experimentación107.
En conclusión, se puede afirmar que la tianeptina provoca cambios en el microproteoma que podrían estar implicados en su efecto antidepresivo, ya que son opuestos a los provocados por el estrés en modelos de depresión o de ansiedad100.
Tianeptina: neuroplasticidad, efecto citoprotector y antidepresivoHasta el momento hemos comentado una serie de aspectos relacionados con la fisiopatología de la depresión y el papel de la tianeptina que permiten relacionar los efectos de este antidepresivo con mecanismos de neuroprotección y neuroplasticidad. Esta relación no es de extrañar, dada la existencia de pruebas que asocian la depresión con pérdida de volumen del hipocampo. De hecho, el trastorno depresivo puede ser una manifestación de la degeneración de esta área. La relación entre el estrés, la depresión y la degeneración neuronal, especialmente en las neuronas piramidales CA3 del hipocampo, ha sido descrita y revisada exhaustivamente. Pruebas neurobiológicas indican que los trastornos afectivos, como la depresión mayor, se caracterizan por una contracción dendrítica de las neuronas, pérdida de células gliales y disminución de la neuroplasticidad neuronal26.
Por ello, no es de extrañar que una de las hipótesis más minuciosamente estudiadas sobre la eficacia antidepresiva de la tianeptina sean los efectos que exhibe sobre la neuroplasticidad de determinadas zonas cerebrales relacionadas con la depresión. De hecho, de acuerdo con la información bibliográfica, la tianeptina parece ser el antidepresivo que ha sido más extensamente investigado en relación con su efecto neuroprotector frente al deterioro neuronal inducido por el estrés. Algunos autores consideran a la tianeptina como el único antidepresivo capaz de inducir neurogénesis109, si bien existen otros agentes que también presentan, en distinta medida, esta capacidad110.
Los efectos más marcados de la tianeptina sobre la neurogénesis parecen deberse al aumento de la fosforilación de los receptores de glutamato, en concreto la subunidad GluA1 del receptor AMPA, y de las cinasas intracelulares dependientes de los mismos. De hecho, la fosforilación de la cinasa intracelular es la señal principal para el crecimiento y la estabilidad estructural de las dendritas. Así, la cinasa dependiente de calcio-calmodulinaII (CaMKII) participa en la estabilización de los citados cambios estructurales111.
La tianeptina parece tener efectos intensos sobre la neuroplasticidad en la capa granular del giro dentado y en la zona subgranular adyacente del hipocampo. Estas zonas tienen una gran trascendencia en los modelos experimentales de depresión112. El tratamiento con tianeptina afecta positivamente a la citogénesis y también a la apoptosis celular, y por consiguiente a todo el proceso de regeneración neuronal del giro dentado adulto. Además, la tianeptina, en concordancia con su efecto antiapoptótico, impidió la reducción de los niveles cerebrales de N-acetilaspartato inducidos por el estrés, produciendo una recuperación del trabajo global de las redes neuronales del hipocampo al mejorar sus terminaciones dendríticas y axonales, así como la función glial. Este efecto es indicativo de que la tianeptina revierte la reducción de la densidad y de la función neuroaxonal provocada por el estrés113.
Como se ha comentado, la tianeptina tiene la capacidad de «normalizar» la neurotransmisión glutamatérgica, alterada por el estrés, al antagonizar la función del receptor NMDA y potenciar la actividad del receptor AMPA. Estos efectos se han relacionado con la capacidad del antidepresivo de prevenir o revertir los cambios estructurales y celulares cerebrales provocados por el estrés. En el hipocampo y en la amígdala, la tianeptina previene la atrofia dendrítica inducida por el estrés, promueve la neurogénesis, abole la apoptosis y normaliza las concentraciones de metabolitos y el volumen del hipocampo61.
Además, la enfermedad depresiva se asocia con cambios en el volumen de la amígdala y en su capacidad de conectarse con el hipocampo. Se ha visto que el estrés crónico produce una disminución y atrofia de la arborización dendrítica hipocampal. Sin embargo, a nivel del núcleo basolateral de la amígdala se produce, de forma selectiva y no generalizada, un aumento de la arborización dendrítica de las neuronas piramidales y estrelladas que son, presumiblemente, neuronas de proyección excitatoria114. Es interesante destacar que la tianeptina previene la excesiva arborización dendrítica de las neuronas excitatorias basolaterales inducida por el estrés1, efecto que se asoció con un efecto preventivo de la ansiedad experimental en ratas macho. Recientemente, la tianeptina ha mostrado propiedades ansiolíticas en distintos modelos experimentales en los que están implicados el estrés, el miedo o la agresividad. El conjunto de estos experimentos indica que las acciones de la tianeptina sobre los cambios conductuales inducidos por el estrés podrían deberse a los cambios morfofuncionales que induce en la amígdala26. Además, se ha podido demostrar que la tianeptina puede revertir los efectos adversos del estrés en el procesamiento del hipocampo, sin afectar negativamente la función sináptica de la amígdala en modelos de estrés animal115.
La tianeptina, además de normalizar la tasa de regeneración neuronal en el cerebro, puede tener efectos citoprotectores en animales sometidos a estrés crónico. En este sentido se ha podido comprobar que la tianeptina reduce la apoptosis inducida por el estrés en la capa granular y en la zona subgranular del giro dentado, probablemente en células no neuronales. Estos efectos afectan tanto al hipocampo como a la corteza temporal. En ambas zonas la tianeptina tuvo un efecto antiapoptótico tanto en los animales estresados como en los no sometidos al estrés116. Además, la administración crónica de tianeptina tiene efecto citoprotector a nivel cortical frente a las citocinas proinflamatorias e inhibe la influencia negativa de las citocinas sobre el estado de ánimo117.
Como se ha comentado, la interacción de la tianeptina con el locus modulador de glicina del receptor NMDA podría modificar la señalización de la diana de rapamicina (mTOR) y afectar a mediadores distales como el BDNF y el receptor de AMPA5.
Por tanto, la tianeptina presenta la capacidad de controlar, de forma general, los efectos negativos del estrés crónico, y además participa en la citoprotección al inhibir las acciones nocivas de las citocinas. Estos mecanismos son potencialmente responsables de su actividad antidepresiva.
Tianeptina y efecto procognitivoLos déficits cognitivos, tales como la disminución de la atención, de la memoria y de la capacidad de resolución de problemas, son frecuentes en los pacientes con trastornos depresivos. Los mecanismos por los que se puede producir este déficit cognitivo en la depresión son diversos118. Se ha descrito que la interrupción del eje HHA, mediada por la pérdida de volumen del hipocampo, junto a cambios en la amígdala pueden subyacer en algunos de los déficits cognitivos que acompañan a la depresión mayor. Por el contrario, la prevención o la restauración de los cambios morfológicos y funcionales en el hipocampo tendrían un efecto procognitivo y facilitador de la memoria.
Se sabe que el estrés intenso agudo en ratas produce una estimulación que se dirige desde el hipocampo hacia la corteza frontal que provoca una inhibición corticofrontal, que se traduce por un deterioro cognitivo, característico de las situaciones prolongadas de estrés. La tianeptina, al actuar sobre los circuitos intrínsecos del hipocampo, invierte rápidamente los efectos inhibitorios del estrés a nivel prefrontal, lo que podría influir en sus efectos procognitivos. Estos datos sugieren que el deterioro del procesamiento de la memoria relacionada con la corteza prefrontal, observado en individuos bajo estrés, puede mejorar bajo el tratamiento con tianeptina119-120.
Diversos trabajos experimentales ponen de manifiesto el efecto procognitivo de la tianeptina. En diversos modelos de depresión el estrés que provocan los depredadores se traduce en un deterioro de la memoria, que se acompaña de cambios de la plasticidad sináptica a nivel del hipocampo. En este modelo experimental la tianeptina mejora la memoria espacial, facilita la atención focalizada en el gato, como respuesta a un estímulo significativo, y produce efectos positivos sobre el aprendizaje, la memoria de trabajo y la memoria de referencia en roedores, a la vez que aumenta la vigilancia en ratas y monos26.
En conjunto, se puede interpretar que el efecto procognitivo y la mejoría de la memoria ejercida por la tianeptina se deberían a la restauración parcial de la plasticidad funcional de las redes del hipocampo, lo que secundariamente redundaría en un mejor funcionamiento del eje HHA. Esta restauración de las redes del hipocampo, deficientes en la depresión, se puede explicar por la aceleración de mecanismos neuroadaptativos neuronales producidos por la tianeptina5,26.
A la luz de los datos experimentales que se poseen, la tianeptina tiene efectos particularmente favorables en las funciones cognitivas, que pueden estar mediados a través de su regulación al alza de la neurogénesis, de la restauración de las redes funcionales del hipocampo, lo que a su vez redundaría en un mejor funcionamiento del eje HHA.
Tianeptina como ansiolítico experimentalLos trastornos depresivos exhiben unas altas tasas de comorbilidad con la ansiedad, por lo que la coexistencia de un antidepresivo con propiedades ansiolíticas es sumamente interesante. En este sentido, existen evidencias experimentales y clínicas de la reducción de ansiedad por la tianeptina. En tratamiento agudo, la tianeptina contrarresta el efecto ansiogénico de la abstinencia a benzodiazepinas y alcohol, y resulta eficaz en modelos experimentales de ansiedad por interacción social119-120. Como se ha comentado, la acción de la tianeptina sobre la amígdala avalaría su eficacia ansiolítica.
Por otra parte, se ha demostrado que la tianeptina crónica previene la agresividad inducida por el estrés121. Además, Burghardt et al.122 demostraron que la tianeptina en tratamiento de 3 semanas fue superior a los ISRS en la reducción del miedo condicionado. Además, la tianeptina después de su administración aguda, al contrario de lo que sucede con los ISRS, no fue ansiogénica115.
Recientemente, Gassaway et al.47 han postulado que en las acciones antidepresivas y ansiolíticas de la tianeptina podrían participar su efecto agonista débil sobre receptores opioides Mu y Delta que podrían ser el interruptor inicial de la comentada modulación del sistema glutamatérgico.
ConclusionesLa revisión bibliográfica llevada a cabo ha pretendido recoger la información publicada sobre el mecanismo de acción de la tianeptina, declarando que se ha reflejado de forma honesta y transparente la información contenida en este, tal y como sugiere Catalá et al.123-124 y Dal-Ré125 para la publicación de artículos científicos.
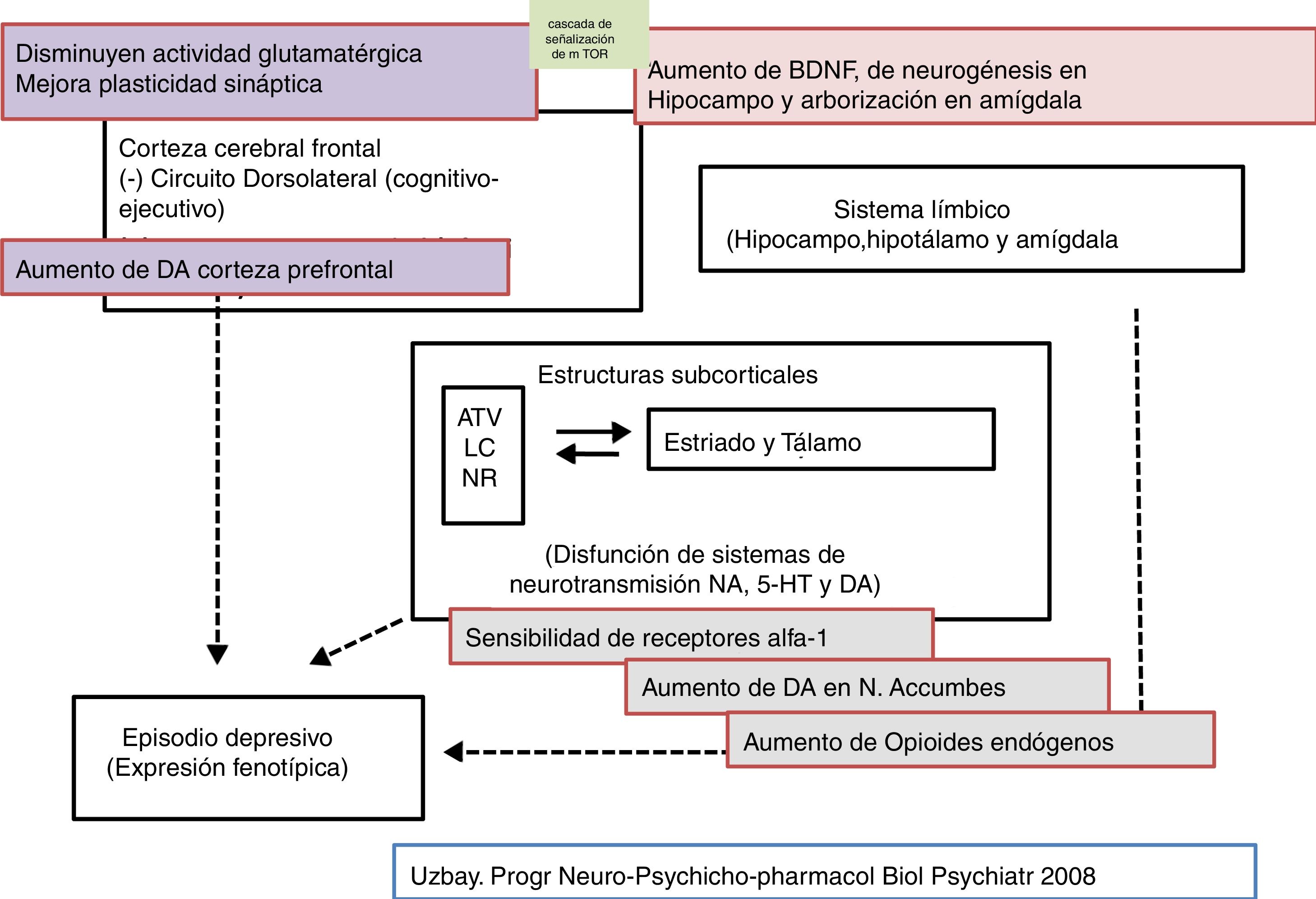
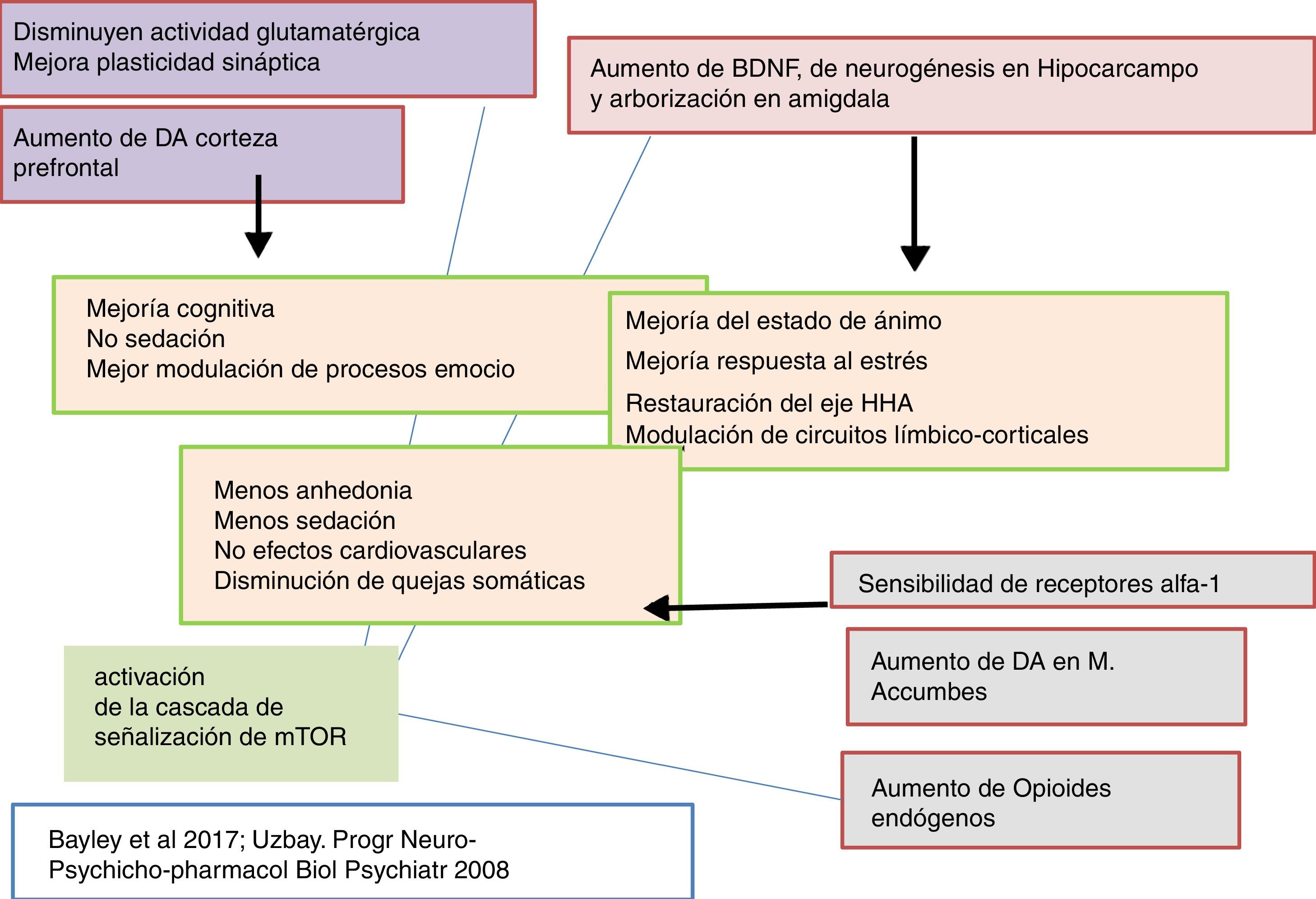
La tianeptina es un antidepresivo con un perfil farmacológico atípico y diferencial que ha desafiado la hipótesis monoaminérgica de la depresión. Asimismo, cuestiona que todos los antidepresivos tengan que poner en marcha mecanismos monoaminérgicos como elemento básico y común de su efecto terapéutico (figs. 2-4)126-127.
La base biológica generalmente aceptada de la depresión, un déficit monoaminérgico, fundamentalmente serotoninérgico y/o noradrenérgico, no puede explicar la actividad antidepresiva de la tianeptina. En la actualidad se sabe que este antidepresivo no ejerce su efecto mediante la modificación de niveles de monoaminas. Por tanto, deben existir mecanismos que van más allá de la regulación monoaminérgica para explicar sus propiedades clínicas.
Las características neurobiológicas de la tianeptina parecen implicar una interacción dinámica entre los numerosos sistemas de neurotransmisión y su capacidad de restaurar la neuroplasticidad normal en regiones límbicas, a la vez que revierten muchos de los efectos deletéreos centrales provocados por las situaciones estresantes. En este sentido, la modulación por la tianeptina de la transmisión sináptica glutamatérgica, que desempeña papeles cruciales en prácticamente todas las funciones alteradas por el estrés, parece ser la hipótesis actual que explique su eficacia terapéutica.
Los efectos de la tianeptina sobre el sistema glutamatérgico pueden representar la diana más proximal de la cascada de eventos bioquímicos que se encuentran en la base de su eficacia antidepresiva. Así, parecen existir fuertes evidencias de que la tianeptina potencia la función del receptor AMPA, afectando a la cascada de transducción intraneuronal. Puesto que la tianeptina tiene un inicio rápido de acción antidepresiva (7-14días), sería interesante examinar los mecanismos subyacentes en este efecto. Se sabe que la tianeptina potencia la función de receptores AMPA en relación con la de los receptores NMDA en circuitos neuronales relacionados con la fisiopatología de la depresión.
Independientemente de las disquisiciones sobre el mecanismo de acción de la tianeptina, no cabe duda de que nos encontramos ante un antidepresivo que actúa de forma diferente a como lo hacen el resto de antidepresivos de nuestro actual arsenal farmacológico, lo cual, salvando las distancias traslacionales entre investigación básica y clínica, puede tener una traducción desde el punto de vista terapéutico.
En este sentido, desde una perspectiva clínica, la característica principal de la tianeptina es su efecto antidepresivo, que se acompaña de un efecto ansiolítico adicional sin provocar sedación. Puesto que la comorbilidad de depresión con ansiedad es sumamente frecuente, el empleo de tianeptina en estos pacientes se traduce por una eficacia clínica de espectro más amplio. Además, una serie de datos preclínicos indican que sería atractivo estudiar, desde una perspectiva clínica, los efectos de la tianeptina en cuadros de depresión provocados por situaciones de estrés social, cuadro en los que los ISRS tienen poca eficacia.
Por otra parte, durante las últimas décadas los inhibidores de la recaptación de monoaminas han sido el mecanismo más utilizado para el tratamiento de la depresión. Es posible que esta reiteración en estos mecanismos sea la causa por la que una proporción significativa de los pacientes no responden a estos agentes. La tianeptina supone una nueva estrategia farmacodinámica que evita una acción directa sobre la terminal sináptica aminérgica para superar este mecanismo universal de los antidepresivos actuales.
La tianeptina como modulador de mecanismos glutamatérgicos es una gran promesa en el tratamiento de la depresión. Cada día existen más evidencias de que muchos pacientes con depresión se beneficiarán de los antidepresivos que exploren, entre otros, mecanismos glutamatérgicos26,47.
Conflicto de interesesC. Alamo ha colaborado en labores de formación e información mediante ponencias en actos científicos destinados a personal sanitario patrocinadas por Adamed, Exeltis, Janssen, Lundbeck, Normon, Otsuka, Pfizer, Sevier, Zambon.
P. García García trabaja en el Departamento Médico de Exeltis Healthcare S.L.
Los demás autores declaran no tener ningún conflicto de intereses.