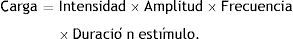El proceso de normalización y dignificación de la terapia electroconvulsiva (TEC) requiere, entre otras acciones, la difusión de la información más actualizada sobre esta técnica. Uno de los aspectos que ha alcanzado mayor sofisticación es el relacionado con el estímulo eléctrico, un conocimiento que es preciso consensuar, extender y llevar a nuestra práctica.
Se revisa en este trabajo la información disponible sobre frecuencia y número de sesiones de TEC, y la utilidad de las distintas localizaciones de electrodos; se describen y valoran los métodos de cálculo de la carga a emplear, titulación o cálculo directo con base en la edad, y se destaca la insuficiencia de las medidas globales de magnitud del estímulo, siendo preciso ampliar nuestro conocimiento sobre los parámetros que configuran la carga: tiempo, intensidad, frecuencia y amplitud de pulso.
The process of normalization electroconvulsive therapy (ECT) requires, among other actions, disseminating the latest information on this technique. One of the most complex aspects is the electrical stimulus, whose knowledge should be spread and put into practice.
In this paper we review the available information about frequency and number of ECT sessions, and efficacy of each electrode placement. We also present two approaches to determine the ECT charge: stimulus titration versus age-based method; and the limitations of the summary metrics of charge, being necessary to expand our knowledge of the parameters that configure the stimulus: duration, current amplitude frequency and pulse width.
La terapia electroconvulsiva (TEC) es un tratamiento de particular eficacia en indicaciones bien definidas1, rodeado todavía en nuestro medio de cierto estigma, y condicionado por una gestión ineficiente del recurso, un acceso no equitativo para los pacientes, una importante variabilidad en las tasas y estándares de aplicación, y una formación insuficiente de los profesionales2,3.
Diversas iniciativas vinculadas a la Sociedad Española de Psiquiatría Biológica (SEPB) han planteado la necesidad de dignificar y normalizar esta técnica en nuestro medio4. La potenciación de la investigación sobre TEC, la difusión de los hallazgos, y la elaboración de guías y consensos (como la recientemente publicada Guia de bona pràctica clínica sobre la teràpia electroconvulsiva)5 están en la base de estas acciones.
En esta línea de profundización y difusión de la información, en la siguiente revisión se abordan aspectos relacionados con la técnica de aplicación, que se recogen en las guías como orientaciones6, y suelen ser poco considerados en la práctica clínica. Se revisa la información más actualizada sobre la frecuencia y número de sesiones, localización de los electrodos y características del estímulo eléctrico, explicitando en su caso las diversas opiniones, y resumiendo de modo matizado según el criterio del autor. En general se recogen resultados obtenidos con muestras de pacientes deprimidos, especificándose los casos en que traten otras patologías. Asimismo, nos referiremos en principio a resultados de tratamientos en fase aguda, indicándose en su caso los datos sobre continuación/mantenimiento.
MetodologíaSe han revisado de modo exhaustivo los resultados de búsqueda de los artículos publicados entre 1965 y 2016 sobre el tema en Medline, Psychinfo, Embase y Cochrane, así como las principales guías sobre el tema, incluyéndose artículos en inglés, francés y español, desde originales de investigación a casos publicados, recomendaciones, consensos o revisiones narrativas. Se valoraron especialmente los trabajos experimentales, en particular los metaanálisis, las series de trabajos sobre temas por grupos definidos, y las guías periódicamente actualizadas. Los términos base de búsqueda fueron: «Electroconvulsive Therapy Instrumentation, Methods, Standards, Therapeutic use, Electrode placement, Unilateral, Stimulus intensities, Seizure duration, Pulse, Ultra-brief, Brief, Suprathreshold, Threshold, Titration, Electrical stimulus, Duration, Current amplitude, Frequency, Pulse width». La búsqueda se completó con una revisión manual y hacia atrás de los trabajos seleccionados, empleándose finalmente 160 referencias de especial interés.
ResultadosAl igual que sucede con otros muchos tratamientos médicos empíricos, no se conoce por completo el mecanismo de acción de la TEC, a pesar de los enormes avances de las últimas décadas7, y de la especial insistencia con la que ese conocimiento se le exige a esta técnica8.
Lo que sí se sabe claramente es que la TEC produce esa mejoría a través de la provocación de una crisis comicial obtenida mediante un estímulo eléctrico9. Históricamente las crisis se lograban por medios químicos, una opción que sigue defendiendo Fink para destacar el papel de la crisis frente al modo de generarla10,11. El objetivo es una crisis clínicamente eficaz, que se asocia a una duración mínima, la generalización a ambos hemisferios y un patrón electroencefalográfico de una cualidad determinada6. Para ello es preciso un estímulo apropiado: suficientemente potente para maximizar la eficacia, pero no tan elevado como para provocar efectos secundarios12.
Este balance riesgo-beneficio va a ser, como en todas las actuaciones médicas, el eje de este trabajo. Es necesario considerar variables del propio paciente como, entre otras, su edad, la medicación concomitante, situación médica, premedicación, técnica anestésica, hidratación, o niveles de O2 y CO2. Pero en este trabajo nos centraremos en las variables de la estimulación con la que se provoca la crisis: número de sesiones, intervalo entre las mismas, localización de los electrodos, y estímulo eléctrico empleado; no solo considerando la carga total, sino los parámetros eléctricos que la componen, cuya manipulación puede influir decisivamente en el resultado clínico13.
Aunque analizaremos por separado cada aspecto, las decisiones sobre la técnica que se usará con un paciente determinado en un momento concreto han de anticiparse a las sesiones como un conjunto unitario rigurosamente individualizado, en función de las características del paciente (edad, medicación, riesgo médico y anestésico, riesgo cognitivo y urgencia de respuesta…). Pero es preciso tener en cuenta, además, que la realidad asistencial incluye distintos contextos de aplicación, no siempre idóneos2, así como diversos niveles de capacitación de los profesionales implicados, o de estabilidad y conocimiento del equipo anestésico, que en ocasiones pueden orientar hacia una actuación u otra.
Número de sesionesNo es posible anticipar el número de sesiones que serán precisas durante un tratamiento agudo de TEC. En general, el tratamiento se reconsidera después de cada sesión, y se decide terminar cuando no se obtiene más mejoría. La decisión de continuar resulta del balance entre el riesgo individual, la gravedad de la situación y las expectativas de mejora.
En general, las primeras sesiones son un indicador de la respuesta esperable14: un 30% de disminución de síntomas tras las primeras 6 sesiones predice remisión completa15. Si no hay mejoría alguna en las 4-6 primeras sesiones es preciso reconsiderar la técnica empleada, revisando la adecuación de las crisis que se están obteniendo y, en su caso, la localización de los electrodos, pasando de localización unilateral (UL) a bilateral. Si tras ello no se logra mejoría será adecuado replantear la indicación12.
Aunque la mayor parte de los pacientes mejoran antes de 9 sesiones16, algunos pacientes deprimidos presentan respuestas completas tardías, por lo que resulta adecuado llegar a 12 sesiones si existe una respuesta inicial parcial17,18. En general es preciso un mayor número de sesiones para obtener la máxima mejoría en los cuadros psicóticos (en torno a 12-14 sesiones), y menos en los depresivos (6-12 sesiones).
Frecuencia de aplicaciónEl intervalo entre sesiones en un tratamiento agudo es uno de los temas en proceso de cambio en los últimos años. La práctica más frecuente ha sido aplicar 3 sesiones semanales como norma base, y esta sigue siendo la frecuencia habitual en EE.UU. y la mayor parte de países. En España, la práctica se ha mantenido estable en este aspecto durante la última década: en 2006 el 75,9% de los centros aplicaba TEC 3 veces por semana, y el 20,4% 2 veces19; en la actualidad la distribución resulta 79,6% vs. 19,5%2.
En Reino Unido se plantea desde hace tiempo la frecuencia base de 2 sesiones semanales; ya en la guía del Royal College de 199520 se aludía a ello de modo general, pero en la edición de 200412 se convierte en norma, que se mantiene en 201321. La base de este cambio fue el metaanálisis del UK ECT Review Group de 200322 que no encuentra diferencias de eficacia entre 3 y 2 sesiones semanales, pero sí más efectos cognitivos con la mayor frecuencia.
En la última década, la frecuencia de 2 sesiones semanales se ha ido extendiendo por Europa y otros países como Irlanda, India o Australia23–25. Se trata de una práctica propuesta para fase aguda, localizaciones bilaterales, cuadros depresivos y no urgente respuesta22,26; en localizaciones UL esta menor frecuencia no está claramente indicada27.
Menores frecuencias en fase aguda, como una sesión semanal, disminuyen en general la eficacia28, y si lo que buscamos es atenuar más la afectación cognitiva, será preferible manejar cargas bajas, manipular los parámetros del estímulo o usar localizaciones UL29. En situaciones urgentes (catatonía, síndrome neuroléptico maligno [SNM], manía agitada, inanición…) la afectación cognitiva será secundaria, pudiendo aumentar la frecuencia hasta sesiones diarias. Recientemente se ha propuesto la pauta diaria cuando se emplean estímulos ultrabreves con localizaciones UL, buscando adelantar la respuesta conservando la ventaja en afectación cognitiva de este tipo de estimulación30. La guía de la APA de 200131 mantenía la opción de más de una estimulación en la misma sesión —la denominada TEC múltiple monitorizada— en situaciones de riesgo vital, una actuación ya en desuso.
Localización de los electrodos de estimulaciónLa ubicación óptima de los electrodos sigue siendo un tema debatido, en estrecha relación con los avances en nuestro conocimiento de las estructuras cerebrales. Aunque se exploraron32–34 y se siguen proponiendo numerosas localizaciones que pretenden minimizar daños o aumentar eficacia en situaciones de resistencia35–37, las habitualmente empleadas siguen siendo 3:
Bilateral bifrontotemporal (BFT)Se trata de la localización clásica con los electrodos en el punto medio de la línea canto-meatal en ambos lados. Repetidamente asociada a una mayor rapidez de acción38,39 y eficacia11,22,40, también produce mayor afectación cognitiva41.
UnilateralCon distintas variantes, la más recogida en la literatura y empleada en clínica es la de D’Elia clásica: un electrodo de estimulación en el hemisferio no dominante, junto al vértex, sobre el lóbulo parietal, y el otro en el punto medio de la línea canto-meatal del mismo lado31. Desarrollada para minimizar la afectación cognitiva, suele asociarse a menor eficacia y respuesta más lenta, aunque según la técnica empleada y la población objetivo el balance puede resultar más eficiente42.
Aunque UL se plantea como estimulación en el hemisferio no dominante, la dificultad para determinar la dominancia12, y la baja prevalencia en la población de clara dominancia hemisférica derecha, sobre todo en lenguaje, supone que, en la práctica, se utiliza sistemáticamente unilateral derecho (ULD/RUL). Solo en caso de presentarse disfasia transitoria en el período postictal, se emplearía unilateral izquierdo (ULI/LUL) para prevenir la afectación de la memoria verbal29.
La estimulación UL presenta ciertas dificultades prácticas para lograr correctas impedancias por la presencia en su caso de cabello, mayor dificultad para obtener buena superficie de contacto en el electrodo parietal, o riesgo de shunt por proximidad, que se manejará respectivamente empleando gel conductor, presión sobre los electrodos con objeto no conductor, posición de la cabeza mantenida por auxiliar, y correcta ubicación y limpieza para minimizar el paso del estímulo por la superficie. Con esta localización se han descrito casos de despertar antes de finalizar el efecto de la succinilcolina43,44.
Bilateral bifrontal (BF)Aunque se han explorado distintas variantes45–49, la localización más difundida sitúa los electrodos de estimulación de modo simétrico a 5cm sobre el ángulo orbital50. El objetivo será obtener una eficacia equivalente a BFT, con una afectación cognitiva tan baja como UL, al evitar la afectación de las áreas más relacionadas con afectación cognitiva y, para algunos autores, a través de la estimulación directa de las estructuras implicadas en la depresión, la corteza frontal orbitomedial50–52.
La distribución espacial e intensidad del campo eléctrico inducido por la estimulación están condicionados en buena medida por la posición de los electrodos, lo que se traducirá en afectación —para bien o para mal— de diferentes estructuras cerebrales en diversa medida. El campo generado con poca distancia entre electrodos será más focal al abarcar directamente menos superficie, y menos intenso al producirse cierto grado de shunt en capas superficiales13. Así, en las localizaciones UL, la mayor intensidad de campo se sitúa entre los electrodos, mientras que en las bilaterales está más focalizada bajo cada electrodo53. El resultado será, en general, que las localizaciones UL tenderán a provocar menor desorientación postictal y afectación de memorias retro/anterógradas54, al no actuar sobre áreas relacionadas con afectación cognitiva —y tal vez estimulando las que se consideran áreas de interés—, aunque lo harán con menor rotundidad y tenderán a menor nivel de eficacia. Por el contrario, los estímulos BFT logran mayor mejoría psicopatológica al precio de mayor afectación cognitiva por una estimulación más intensa pero menos selectiva41.
Como decíamos, las localizaciones BF se proponen como la solución: tan eficaces como BFT y con tan pocos efectos no deseados como UL55–57; el balance ideal entre eficacia y afectación cognitiva54,58,59. Y no solo en depresión, también en manía grave, con menos efectos cognitivos60 y respuesta más rápida61, en ancianos62, y hasta en catatonía63. Se recoge además el mismo o menor riesgo cardiovascular que otras localizaciones63–65. Pero la literatura ha sido siempre contradictoria66, y sólidos trabajos de los últimos años no encuentran diferencias significativas entre BF y BFT clásica22,38, por lo que las ediciones recientes de las guías no consideran BF como alternativa habitual21.
La búsqueda de un punto de equilibrio que permitiera mantener en la localización UL la ventaja cognitiva, con una eficacia equiparable a BFT, llevó al grupo de Sackeim en Columbia a plantear ajustar individualizadamente la carga («dosis» del estímulo) empleada en función del umbral de convulsión del paciente67. En un trabajo esencial68, ese grupo demostró que con cargas bajas (1,5-2,5 veces la carga umbral [U×1,5-2,5]), la respuesta no era equiparable, pero estímulos UL mayores, a 6 veces el umbral (U×6), eran tan eficaces como BFT a 1,5 veces umbral (U×1,5), manteniendo la ventaja cognitiva. Los trabajos posteriores no siempre han confirmado estos resultados, y una década después, el también fundamental trabajo de Kellner et al.38, no encuentra diferencias en eficacia ni en cognición entre BFT con U×1,5, BF con U×1,5, y RUL con U×6. La posibilidad de que el nivel ideal en el balance esté en cargas menores como RUL a U×469 sigue abierta, y la cuestión de la carga óptima supraumbral en UL sigue siendo un tema pendiente de investigación para la guía del Royal College21.
La polémica sobre localizaciones no tendrá por lo tanto una respuesta única. No es posible afirmar rotundamente que una localización es siempre mejor, siendo preciso individualizar la decisión, aplicando al caso ese balance eficacia-daño, en función del paciente y las circunstancias concretas70.
El estímulo eléctricoLa importancia atribuida al estímulo eléctrico en TEC ha variado a lo largo de la historia de la técnica, y sigue siendo muy distinta en función de los autores. El planteamiento clásico10,71 considera que la TEC produce su efecto beneficioso a través de una convulsión, que habría sido provocada de diferentes formas, actualmente por medio de un estímulo eléctrico. La mayor o menor calidad de esa crisis supondrá mayor o menor eficacia, y esa calidad dependerá, entre otras variables, de las características del estímulo eléctrico empleado. La visión alternativa72–74 defendería que el estímulo eléctrico en sí mismo tiene un efecto terapéutico directo (como lo tiene en efectos no deseados…) sobre las estructuras cerebrales implicadas en los trastornos tratados. Las distintas técnicas de estimulación directa, eléctrica o magnética sin crisis, actualmente en expansión75–77, apoyarían esta perspectiva78.
Evidentemente ambas alternativas son compatibles y, en cualquier caso, la magnitud y la cualidad del estímulo eléctrico empleado resultan enormemente trascendentes, bien sea como herramienta para provocar una crisis terapéutica, bien como actor directo del efecto.
Medidas globales de la magnitud del estímulo. La cargaLas medidas globales de «dosis» de estímulo se emplean como una simplificación para calcular o describir el estímulo a utilizar. En la actualidad, la medida habitual es la carga suministrada (medida en miliculombios [mC]), pero recordemos que previamente fue la energía (en julios) la medida de «dosis» estándar31,79.
Superados los estímulos con ondas sinusoidales por ser fisiológicamente ineficientes y generar más efectos cognitivos80, los principales aparatos disponibles en la actualidad (MECTA Spectrum y Thymatron IV) suministran trenes de pulsos rectangulares de polaridad alterna.
La carga total administrada al paciente en una estimulación (podríamos decir los electrones administrados a las zonas estimuladas) dependerá de la intensidad de la corriente (es decir, la carga que fluye por unidad de tiempo, en miliamperios [mA]) y del tiempo de estimulación, producto a su vez de la amplitud de los pulsos administrados (en milisegundos [ms]), la frecuencia de los mismos, y la duración total del estímulo (en segundos [s]):
La carga necesaria para provocar una crisis en un paciente determinado en un momento concreto depende de un gran número de factores con diverso peso, desde la edad y el sexo, al tratamiento farmacológico habitual del paciente y los anestésicos usados, su nivel de hidratación o la técnica de ventilación durante la anestesia, entre otros muchos. Las estrategias vigentes para decidir esa carga son esencialmente 2: el cálculo anticipado de carga con base en las variables con mayor peso, y la titulación progresiva buscando el umbral. Otros métodos descritos son las estrategias mixtas, en que se empieza a titular desde cierta base81, o la carga de referencia (benchmark method)82. La dosis alta fija80, ya en desuso, se limita por la APA a situaciones excepcionales en que por fragilidad médica estén contraindicados los estímulos subconvulsivos31.
Los métodos de cálculo directo de la carga parten del mayor peso atribuido a algunas de las variables aludidas, esencialmente la edad, pero también el sexo y la localización de los electrodos. Se han llegado a investigar modelos estadísticos complejos que incluyen numerosas variables83,84, pero en la práctica perdura el planteamiento de Abrams y autores en su línea85, que se basa en la variable edad para calcular una carga que se anticipa como clínicamente eficaz para ese paciente. Esta perspectiva se ha concretado en la práctica en el método de Petrides y Fink en199686, que proponen en localizaciones bilaterales (BFT o BF) administrar una carga en mC igual a la edad del paciente multiplicado por 2,5, y en localizaciones UL 5 veces la edad. En aparatos con indicador de carga (MECTA), esa será la carga en mC que se busque, decidiendo después la intensidad, frecuencia, amplitud de pulso y tiempo que interesen.
Este método de cálculo subyace al diseño de uno de los modelos de estimulador aludidos, el Thymatron, que divide la carga máxima que el aparato puede suministrar en porcentajes: cada tramo será la carga que necesita un paciente de esa edad para responder con estímulos UL (aproximadamente su edad × 5); en BF o BFT necesitará la mitad (su edad × 2,5). El psiquiatra ha de predeterminar la amplitud de los pulsos administrados (0,25, 0,5 y 1ms), y para cada porcentaje de carga del dial el estimulador está programado para una frecuencia de pulsos y una duración total del estímulo; la programación conlleva la máxima duración para una frecuencia entre 10 y 70Hz. Las versiones actuales permiten, si se desea, individualizar, manualmente, la frecuencia, la amplitud y la duración del estímulo, siempre con una intensidad fija de 900mA.
Este método de cálculo de carga va a resultar rápido, pues propone directamente cargas terapéuticas, y sencillo, pues emplea una sola variable para calcular. Insistamos en que esta estrategia calcula directamente la carga que se anticipa como eficaz para obtener respuesta clínica en un paciente, no solo para obtener una convulsión.
Frente al método de cálculo directo de carga, se propone el método de titulación o empírico, que busca individualizar la carga que necesita un paciente concreto en unas condiciones determinadas. Dado que las variables que en ello influyen son muy numerosas y cambian en el tiempo, la estrategia pragmática será ensayar cargas hasta encontrar la apropiada. En la práctica, se trata de empezar con estímulos deliberadamente bajos hasta obtener una crisis mayor de 15s21. La carga que fue necesaria para ello será denominada «umbral» de convulsión para ese paciente en esas condiciones. Esta carga, suficiente para lograr una pequeña crisis, no bastará habitualmente para lograr efecto terapéutico, para lo cual será preciso multiplicarla en las siguientes estimulaciones por una constante, mayor en UL, menor en BFT/FB. Se obtendrá así la carga «clínicamente eficaz» para ese paciente en ese momento.
Nos encontramos de nuevo con la importancia del estímulo: no es suficiente rebasar el umbral y obtener una crisis, y no hay duraciones de crisis mínimas o suficientes para todos los pacientes. Un estímulo suficiente para superar el umbral y lograr una respuesta mínima en EEG puede no llegar a provocar una respuesta clínicamente eficaz, sobre todo en localizaciones UL87,88.
El concepto umbral sigue siendo discutido. Su definición es arbitraria y basada en evidencias modestas31,80,89,90 y contradictorias91, pero parece ser el mejor predictor de carga y respuesta de que disponemos. El rango de variación entre individuos es importante, entre 150 y 400mC según los trabajos11,91.
Sobre el umbral influyen un gran número de variables92: será mayor en los varones, edad avanzada, localizaciones bilaterales de electrodos, intensidades menores, duración del estímulo corta, mayor índice de masa corporal, privación estrogénica, hipoxemia e hipercapnia; las condiciones opuestas disminuyen el umbral67,91,93–95. El umbral aumenta con sesiones sucesivas una media del 60% (más en BL que UL)87 sin relación con mejoría clínica como se planteó96. Queremos destacar la eficiencia de la hiperventilación para disminuir umbrales elevados, pues con un esfuerzo mínimo durante la anestesia obtendremos una hiperoxigenación e hipocapnia, que permitirá usar cargas menores97.
También los fármacos son un factor importante por su peso y porque se puede incidir en él: los anestésicos propofol y pentotal elevan el umbral, a diferencia del etomidato y la ketamina98–102. Los anticomiciales, benzodiacepinas y lidocaína elevan el umbral, mientras que las metilxantinas, algunos antidepresivos y antipsicóticos, y los estimulantes lo disminuyen103,104. La suma de numerosos factores externos y la alta variabilidad individual van a suponer dificultades para predecir el umbral de un sujeto concreto en un momento determinado31.
Aunque ya se sabe que crisis largas no significan necesariamente crisis eficaces, destacamos que aumentar la carga no conlleva aumentar la duración de la crisis; las más largas se obtienen con cargas sobre el umbral, y las cargas altas acortan la duración de las convulsiones, además de generar más afectación cognitiva83,87. No solo la respuesta clínica se relaciona con el exceso de dosis respecto al umbral; parece que también los efectos cognitivos no se relacionan con la dosis absoluta sino con el exceso de dosis sobre el umbral105,106.
En conjunto parece que el cálculo de carga por titulación permitiría individualizar el estímulo para un paciente concreto en un momento y circunstancias determinados. Frente a ello, al menos teóricamente, los cálculos con fórmula basada en la edad sobredosificarían en principio a muchas mujeres jóvenes107 e infradosificarían a pacientes con localizaciones UL54, pues la edad es solo una de las muchas variables que influyen en el umbral del paciente. Como consecuencia, las principales guías oficiales sobre práctica de TEC21,31 recomiendan el cálculo de carga individualizado por titulación como práctica estándar, aunque resulte aceptable el cálculo directo por edad en situaciones de urgencia o gravedad clínica en las que no conviene alargar el tiempo de respuesta y resulta asumible el balance riesgo-beneficio de cargas altas21.
No coinciden completamente las guías en la cifra por la que multiplicar el umbral para obtener la carga clínicamente eficaz. La guía de la APA de 200131 plantea que la carga será en localización UL de entre 2,5 y 6 veces el umbral, y en bilateral entre 1,5 y 2,5 veces el umbral. La última edición de 2013 de la guía del Royal College británico21 indica en bilateral cargas de al menos 1,5 veces el umbral, y en UL reconoce que no está bien establecido, proponiendo entre 4 y 6 veces el umbral en situaciones de riesgo cognitivo. Se trata en efecto de un tema abierto a nuevas investigaciones, pues la ventaja en afectación cognitiva de la TEC UL podría perderse por encima de 4 veces el umbral108,69, pero no todos los pacientes responderán a esas cargas moderadas.
Titular dosis presenta inconvenientes objetivos en la práctica diaria, pues puede demorar la respuesta al perder en ocasiones una primera sesión en el cálculo de la carga. Además, es posible que reestimulaciones precipitadas en período refractario no obtengan respuesta109; se han planteado datos contradictorios sobre riesgos cardíacos de las estimulaciones subconvulsivas110,111, y se ha relacionado la técnica con la aparición de convulsiones tardías112. El posible incremento de afectación cognitiva parece razonablemente descartado91,113–115.
Pero además de los inconvenientes y riesgos asociados a titular, los a menudo rotundos defensores del uso sistemático del cálculo directo cuestionan su planteamiento teórico —basado en un modelo de despolarización de neurona individual frente a un modelo basado en kindling78,116— y, sobre todo, la rentabilidad del esfuerzo al comparar las cargas finalmente aplicadas por ambos métodos. Así, Petrides et al. en 200981, aplicando su método de half age antes descrito a una muestra de 402 pacientes, encuentran una carga clínicamente eficaz tan solo un 18% mayor que el umbral obtenido por titulación en la misma muestra. Cuando se multiplica por 1,5 (pues usan localizaciones BFT), la carga clínicamente eficaz por titulación resulta un 31% mayor que con su método. Apoyándose en ello, concluyen con rotundidad que su método es abiertamente superior a titular. Rasmussen117 cuestiona estas conclusiones planteando estrategias de titulación alternativas a las del grupo Consortium for Research in ECT (CORE), como incrementos menores de carga durante la titulación, que minimizan la dosis final. Es posible añadir que cargas más elevadas no son necesariamente peores si son las que precisa el paciente para obtener respuesta.
Por otra parte, Van Waarde et al. también en 2009118 llevan a cabo un metaanálisis del umbral encontrado en localización UL (68,2mC) y bilateral (111,6mC). Indican que al multiplicarlo por 6 (UL) resulta una carga parecida a los métodos de «dosis fija», considerados sobreestimuladores, y al multiplicar por 1,5-2,5 en localizaciones bilaterales, resultan cargas iguales que si se hubiera hecho un cálculo por half age. Su conclusión es que los métodos de cálculo directo de la carga siguen siendo legítimos. En 2013, los mismos autores analizan el peso de cada variable en el umbral, encontrando que la edad y localización bilateral explican el 49% de la variación, suficiente para justificar el cálculo directo119. Finalmente, este grupo ha presentado recientemente datos de un estudio prospectivo que compara ambos métodos, resultando en igual eficacia y efectos cognitivos, pero mayor número total de sesiones precisas para el método de titulación120.
Recientemente Fink11 ha vuelto a pronunciarse con rotundidad sobre el tema. En un trabajo de revisión de las publicaciones del grupo CORE entre 1997 y 2011, plantea que no hay justificación para la medida del umbral, pues sus datos no demuestran una variación de este a lo largo de las sesiones. Esta ausencia de cambio invalidaría el umbral como predictor de respuesta. Cabe destacar que el valor del umbral deriva de su capacidad de individualizar los estímulos, independientemente de su variación a lo largo de las sesiones.
Los parámetros de ajuste de la cargaSe dispone cada vez de más datos que indican que las medidas de «dosis» de estímulo globales son, como decíamos, una simplificación excesiva, y que obtendremos resultados distintos manipulando las variables del estímulo que influyen en esa carga121. El papel de los parámetros de la carga es una hipótesis intuitiva, pues entendemos que distintas amplitudes de pulso suponen diferente tiempo en que la neurona es estimulada en cada pulso, la frecuencia varía el tiempo de recuperación neuronal entre estímulos, y el tiempo total supondrá distinto número de estímulos122. Pero además, los datos demuestran que la misma «dosis» global de estímulo eléctrico (en mC o en julios) administrada en más o menos tiempo, o con amplitudes de pulso, frecuencias o intensidades diferentes, puede resultar en efectos muy distintos sobre la convulsión buscada, sobre el mecanismo que la genera78 y sobre el efecto clínico final123,124, de la misma forma que una misma dosis de fármaco se traduce en efectos distintos en diferentes formulaciones.
Los aparatos disponibles permiten una mayor o menor facilidad en la manipulación de estos parámetros. Como señalábamos, Thymatron está diseñado para manejar cargas globales, pero permite, si se desea, opciones de ajuste individualizado de frecuencia, amplitud y tiempo, no de intensidad. La individualización de los parámetros en MECTA es sin embargo inevitable por su diseño, con mandos externos establecidos al efecto.
Revisaremos brevemente la, en general, escasa información sobre estos temas, sobre los que sin duda es preciso profundizar en investigación. A menudo ni siquiera se suelen especificar estos parámetros cuando se describe la metodología de un ensayo en TEC, y cuando se consideran, su análisis suele estar interferido por otras variables como la localización de los electrodos o la frecuencia y el número de sesiones125.
A pesar de su probable efecto práctico, el tiempo de aplicación del estímulo es una de las variables menos estudiadas. Como hemos señalado, estímulos de igual carga administrados en mayor tiempo, se traducen en menores umbrales de convulsión126–128. Se plantea también que pueda relacionarse con mejores indicadores de calidad de la crisis en EEG124, y mayor duración de la misma129.
Por lo tanto, aplicando durante la titulación las cargas previstas en mayores tiempos, es posible encontrar umbrales más bajos; esto supondrá, al multiplicar por la constante correspondiente a la localización, menores cargas finalmente administradas. Aunque la trascendencia clínica de esto no esté demostrada13, parece evidente la utilidad de una actuación que permite, más allá del proceso de titulación, obtener crisis en situaciones de umbral alto alargando el tiempo de estimulación manteniendo la misma carga.
Las variaciones en la polaridad de las neuronas se relacionan con el campo eléctrico generado por el estímulo. Como señalamos, el campo varía en función del tamaño y localización de los electrodos, y es muy distinto en función de variables anatómicas individuales130; pero además va a resultar directamente proporcional al parámetro intensidad del estímulo. A pesar de ello, la intensidad es uno de los parámetros del estímulo menos estudiados, y a veces se plantea sin considerar el resto de variables131,132. Los estimuladores comerciales permiten escaso margen de maniobra en el caso de MECTA (entre 500 y 800mA), y ninguno en Tymatron (900mA).
Pero las diferencias en el área estimulada —y por lo tanto las neuronas reclutadas— en función de la intensidad son muy importantes, sobre todo para localizaciones UL, y podrían plantearse estímulos más focales con menores intensidades, que podrían traducirse en menor afectación cognitiva. Por otra parte, disponemos de datos que indican que usar intensidades elevadas permite precisar menores cargas umbral133,134. Las consecuencias clínicas de estas alternativas están por evaluar135.
La frecuencia idónea no ha sido bien establecida, pero la mayoría de los también escasos trabajos que valoran esta variable sugieren que las frecuencias bajas (20-40Hz) resultan más eficientes en la inducción de crisis, al obtenerse convulsiones con menores cargas, menos estímulos subconvulsivos, e incluso menor afectación cognitiva136–138. La trascendencia clínica de estos datos tampoco está bien evaluada, y el tiempo de estimulación puede plantearse como una variable de confusión de los resultados139.
Superadas las ondas sinusoidales de amplitudes de pulso en torno a los 10ms, desde los años ochenta empleamos pulsos cuadrados de 0,5-2ms, calificados como breves, con igual eficacia y menores efectos cognitivos73,121,140,141. El interés por experimentar amplitudes de pulso menores a 0,5ms, calificadas habitualmente como ultrabreves142, fluctúa desde entonces, siendo uno de los pocos parámetros en los que se investiga activamente. Se ha descrito eficacia de los pulsos ultrabreves en localizaciones UL143 y bilateral144, empleando estímulos muy supraumbrales (umbral×6; umbral×8, en UL), con menor efecto cognitivo agudo y a 6 meses54,145–148, aunque la mejoría aparece tras más sesiones149–151. Se ha descartado el inicial temor a más riesgo de asistolia152. Los datos sobre el umbral son contradictorios; en general se indica que es menor con ultrabreve73,149,153, aunque aumenta más durante las sesiones148. Los pulsos ultrabreves suponen más tiempo total de estimulación, lo que, junto con las localizaciones de electrodos, puede suponer un factor de confusión en el análisis de resultados125,154, además de la falta de aleatorización144, o el diseño retrospectivo150.
Pero los datos experimentales sobre eficacia y riesgo son contradictorios: empleando estímulos muy por encima del umbral (umbral×8), Spaans et al. encuentran más eficaz el pulso breve, sin mayor afectación cognitiva155, concluyendo que la literatura disponible no justifica el uso sistemático de pulsos ultrabreves156, posición que se mantiene en las guías actualizadas21. La polémica, no obstante, sigue abierta35,157, y la individualización de la decisión basada en una mayor eficacia de pulsos breves, pero una menor afectación cognitiva de ultrabreves, parece la opción deseable158.
Señalemos finalmente que, aunque la práctica que permiten los estimuladores comerciales disponibles se basa en estímulos bidireccionales de pulso cuadrado, se han investigado puntualmente otras formas de onda y otros parámetros del estímulo como la direccionalidad de los pulsos y su polaridad en unidireccionales, sugiriéndose menores umbrales de convulsión y, por lo tanto, menos cargas con pulsos unidireccionales13.
Resumen y conclusionesEl gran avance en los conocimientos sobre la técnica de estimulación en TEC, nos permite individualizar la actuación sobre un paciente y circunstancias concretas, y anticipar al momento de la sesión los ingredientes que supongan el mejor balance riesgo-beneficio.
No se han descrito herramientas para anticipar el número de sesiones que serán necesarias; el tratamiento se evalúa y reconsidera tras cada sesión, y se termina cuando no se obtiene más mejoría. Aunque la práctica habitual respecto al intervalo entre sesiones en la mayoría de países sigue siendo aplicar 3 sesiones semanales, se extiende el ajuste individual de la decisión entre 2 y 3 sesiones por semana en función de la técnica empleada, urgencia de respuesta y riesgo de afectación cognitiva.
Respecto a la localización de los electrodos, se plantea como práctica habitual comenzar empleando localización BFT con cargas modestas (umbral×1,5-2,5, o bien edad×2,5), asumiéndose una mayor eficacia global, aunque a costa de un mayor riesgo de efectos cognitivos que con UL. Pero sólidas líneas de trabajo muestran que, empleando cargas suficientemente elevadas y ajustadas al paciente, los estímulos UL pueden resultar tan eficaces como BFT, conservando la ventaja cognitiva. Los datos sobre la práctica en nuestro país sugieren la necesidad de individualizar más a menudo esta decisión planteando localizaciones UL en situaciones de riesgo o afectación cognitiva, siempre con el oportuno ajuste del estímulo (umbral×4-6, o bien edad×5). Otras localizaciones como BF no se consideran actualmente una alternativa habitual.
Tanto si consideramos el estímulo como una forma de provocar la crisis de resultado terapéutico, como si defendemos que provoca efectos directamente, la magnitud y cualidad del estímulo eléctrico resultan enormemente trascendentes. Aunque insuficientes, se siguen empleando las medidas globales de magnitud del estímulo (en este momento la carga), como una simplificación para calcular la «dosis» que usaremos. Actualmente 2 son las estrategias para decidir la carga que emplearemos en un paciente: el cálculo directo anticipado basado en las variables con mayor peso, y la titulación progresiva buscando el umbral individual.
El cálculo directo de la carga se basa en la variable edad para calcular el estímulo que se precisa. Multiplicando la edad por una constante distinta en función de la localización de los electrodos (2,5 en BFT; 5 en UL), se obtendrá directamente la carga que se presupone clínicamente eficaz para el paciente. Este cálculo se realiza automáticamente por ciertos modelos de estimulador (Thymatron), diseñados a la luz de este método, donde se indicará directamente en el dial el porcentaje de carga correspondiente a la edad para estimulación UL, y la mitad para bilateral.
Parece evidente la gran variabilidad de la carga precisa para obtener una crisis en un paciente concreto en un momento y unas condiciones determinadas, influida por un gran número de factores, además de la edad. Como consecuencia surgió el método empírico o de titulación para determinar el estímulo necesario, ensayando cargas bajas hasta encontrar la apropiada para obtener una crisis mínima en EEG de 15s, a la que se denominará carga umbral. Esta carga será en principio insuficiente para lograr efecto terapéutico; será preciso multiplicarla en las siguientes estimulaciones por una constante, mayor en UL (4-6), menor en BFT/FB (1,5-2,5). Esta será la carga «clínicamente eficaz», individualizada para ese paciente en ese momento.
La indiscutible lógica de la propuesta de individualizar la carga titulando, frente al cálculo con base en una sola variable como es la edad, se ha ido imponiendo en las principales guías oficiales sobre práctica de TEC, aunque se trata de un tema abierto y en ocasiones polémico, y ambas opciones resultan legítimas con nuestro actual conocimiento, siempre en función de las circunstancias del paciente y medio en el que se aplica.
Finalmente, las medidas globales de magnitud del estímulo como la carga son insuficientes. Parece evidente, y ha sido demostrado, que el suministro de una misma carga en distinto tiempo, o con diferente intensidad, amplitud o frecuencia de los pulsos, se traduce en distinto resultado respecto a la crisis obtenida, su eficacia y efectos secundarios. La investigación sobre estos parámetros es escasa, y la trascendencia clínica de los hallazgos no bien definida. En esquema, parece posible rebasar umbrales de convulsión con menores cargas, alargando el tiempo total en que se administra el estímulo. Sobre la intensidad hay escaso o nulo margen de actuación con los estimuladores comerciales disponibles; todo apunta, sin embargo, a que se podría focalizar más el área del estímulo con intensidades menores, y precisar menos cargas globales con intensidad mayor. Respecto a la variable frecuencia, los datos apuntan a una mayor eficiencia de las frecuencias bajas, que obtendrían crisis con menores cargas. En la misma línea se orientan los hallazgos sobre amplitudes de pulso, donde se investiga con interés la posible ventaja cognitiva de estímulos ultrabreves, menores de 0,5ms, frente a los breves de 0,5-2ms. Aunque se trata de una línea abierta, el uso sistemático de pulsos ultrabreves no parece recomendarse por una menor eficacia, aunque podría plantearse como alternativa en situaciones de franco riesgo cognitivo.
En conjunto nos encontramos con una sofisticación progresiva en el conocimiento de la estimulación empleada en TEC que, junto a otros campos de esta técnica, es preciso consensuar, difundir y llevar a nuestra práctica. Esta será una de las bases del proceso de dignificación y normalización del tratamiento en el que estamos empeñados.
FinanciaciónNo se ha contado con financiación para este trabajo.
Conflicto de interesesEl autor no presenta conflicto de intereses respecto al tema de este trabajo.