El ácido hialurónico (AH) es un glucosaminoglicano esencial de la matriz extracelular de todos los tejidos, estando en una concentración media del 0.02%. Una persona de 60kg de peso contiene aproximadamente 12g de AH; las mayores concentraciones de este ácido se encuentran en los tejidos conectivos como la piel, la cual presenta hasta un 56% de éste. El AH tiene un papel importante en la migración celular, ya que está involucrado en procesos de crecimiento, inflamación y reparación, así como estimulación de diferentes células del tejido conectivo.
ObjetivoPresentar un caso clínico de reconstrucción de la papila interdental infiltrando AH.
Caso clínicoPaciente femenino de 24 años de edad que al interrogatorio refiere ser sistémicamente sana. Presenta pérdida de la papila interdental de la zona OD 11 y 21 a causa de una gingivitis y mala técnica de cepillado. Se valora de acuerdo con la clasificación de Nordland y Tarnow para saber el grado de predictibilidad del procedimiento y de acuerdo con la clasificación de Cardaropoli, con el fin de poder realizar comparaciones antes y después del tratamiento. La paciente presentaba 5mm del punto de contacto a la cresta ósea, por lo que se realizó un infiltrado de AH en la papila durante cuatro semanas cada siete días.
ConclusiónExisten muy pocas técnicas no quirúrgicas para la regeneración de la papila interdental, dentro de ellas encontramos el uso de AH. Las investigaciones sobre esta técnica no son nuevas, sin embargo, se deben continuar y ampliar los estudios considerando diversos factores: realizarlos en poblaciones mayores con personas de distintas razas, sexo y utilizando diferentes intervalos de infiltración.
Hialuronic acid (HA) is an essential glucosaminoglycan of the extracellular matrix of all tissues; it is found at an average concentration of 0.02%. A subject weighing 60kg contains approximately 12g of HA. The greater concentrations of this acid are found in connective tissue such as the skin, which exhibits up to 56% percent of said acid. HA plays an important role in cell migration, since it is involved in processes of growth, inflammation and reparation as well as stimulation of different connective tissue cells.
ObjectiveTo present a clinical case involving interdental papilla reconstruction with HA infiltration.
Clinical case24 year old female who reported being systemically healthy. The patient exhibited loss of interdental papilla in the area of tooth number 11 and 21 caused by presence of gingivitis and poor brushing techniques. The patient was assessed according to Nordland and Tarnow classification in order to ascertain the procedure's degree of predictability; she was additionally examined according to Cardaropoli classification in order to be able to establish preand post-treatment comparisons. The patient exhibited 5mm of contact point to the bone crest, therefore, HA infiltration was undertaken into the papilla, every seven days for four weeks.
ConclusionThere are very few non-surgical techniques to regenerate interdental papillae, one of them is HA use. Research conducted on this technique is not new, nevertheless, it would be suitable to further it taking into consideration different factors; conducting them in greater-sized populations with subjects of different ethnicities and gender, and using different infiltration intervals.
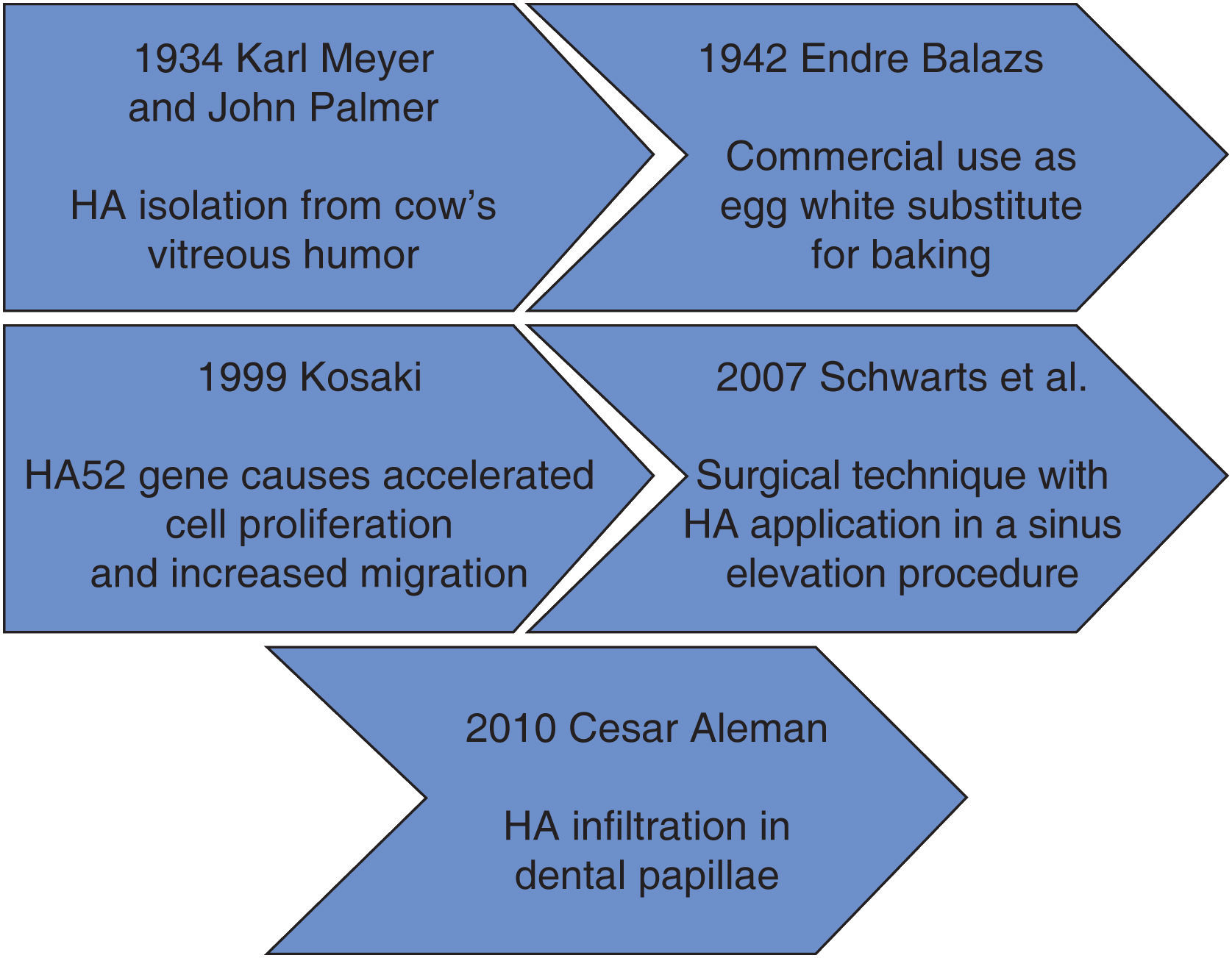
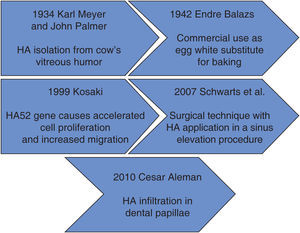
Dentro de los antecedentes históricos encontramos que en 1934 Karl Meyer y su ayudante John Palmer aislaron el ácido hialurónico (AH) del humor vítreo de los ojos de las vacas, una sustancia química desconocida para ellos. Estos investigadores afirmaban que era un componente universal del espacio extracelular y sus múltiples propiedades permiten constituir una matriz, brindando soporte al funcionamiento normal de las células y tejidos. Además, declararon que esta sustancia contenía dos restos de azúcar, uno de los cuales era el ácido urónico.1
El AH se utilizó por primera vez en 1942 por Endre Balazs, lo empleó para suplir la clara de huevo en el área de la pastelería. Balazs llevó a cabo la mayor parte de los descubrimientos del AH durante los últimos 50 años.1
En la figura 1 se muestra el proceso que se ha dado a lo largo del tiempo con el AH. En ésta se observa que en sus inicios se comercializaba como sustituto de la clara del huevo, para después ser usado como un promotor de migración celular en el área médica y sus diferentes campos.
DEFINICIÓNEl AH actualmente se define como un glucosaminoglucano lineal formado por unidades de disacáridos (GAGs) constituidas por ácido glucurónico y N-acetilglucosamina (NAcGlu). Aunque otros GAGs sulfatados como los proteoglucanos se sintetizan en el aparato de Golgi, no sucede lo mismo con el AH, el cual es ensamblado por enzimas de la membrana plasmática.2–4
Generalidades de los glucosaminoglucanosLos glucosaminoglucanos son largos polímeros compuestos por ciertos disacáridos repetidos, donde uno de ellos o ambos contienen un residuo sulfato.5 Son moléculas que ocupan un gran volumen. Gracias a su vasta hidratación la matriz extracelular se comporta como un gel, esto permite a los tejidos, poseedores de una alta proporción de glucosaminoglucanos, resistir fuertes presiones mecánicas y además, favorece una alta tasa de difusión de sustancias entre las células.6
Dentro del grupo de los glucosaminoglucanos, el único no sulfatado es el AH, es un caso especial, ya que no forma enlaces covalentes con otras moléculas de la matriz extracelular, éste se sintetiza extracelularmente por enzimas localizadas en la superficie celular denominadas ácido hialurónico-sintetasas (HAS), de las cuales existen tres isoenzimas: HAS1, HAS2 y HAS3.6,7
Se suele asociar al ácido hialurónico con las moléculas de colágeno o a proteoglucanos, confiriendo a la matriz extracelular elasticidad, resistencia y lubricación. Su función es muy importante durante el desarrollo o en lugares del organismo donde se produce una fuerte proliferación celular, ya que, facilita el desplazamiento de las células. Al ser una molécula grande y poco flexible, ocupa un volumen considerable con muchos espacios libres.6
El AH es un puente de unión para las proteínas centrales, ejemplo de esto es la proteína de unión al cartílago, el agrecán y el versicán. El ácido hialurónico sirve de eje o estructura para los grandes complejos proteoglucanos y se adhiere a los receptores de la superficie que regulan la proliferación y migración celular, como el CD44.8 El CD44 es un receptor del AH que actúa como molécula de adhesión y se expresa en leucocitos, células epiteliales, fibroblastos y células musculares.9
El papel fisiológico de este receptor es mantener la estructura orgánica y tisular a través de la adhesión célula-célula y célula-matriz. Isoformas del receptor CD44 están implicadas en la unión inicial de los leucocitos a las células endoteliales activadas por procesos inflamatorios. Se ha reportado que la unión del AH con el receptor CD44 media la adhesión inicial de las células inflamatorias al vaso que permite la extravasación en el lugar de la inflamación.10
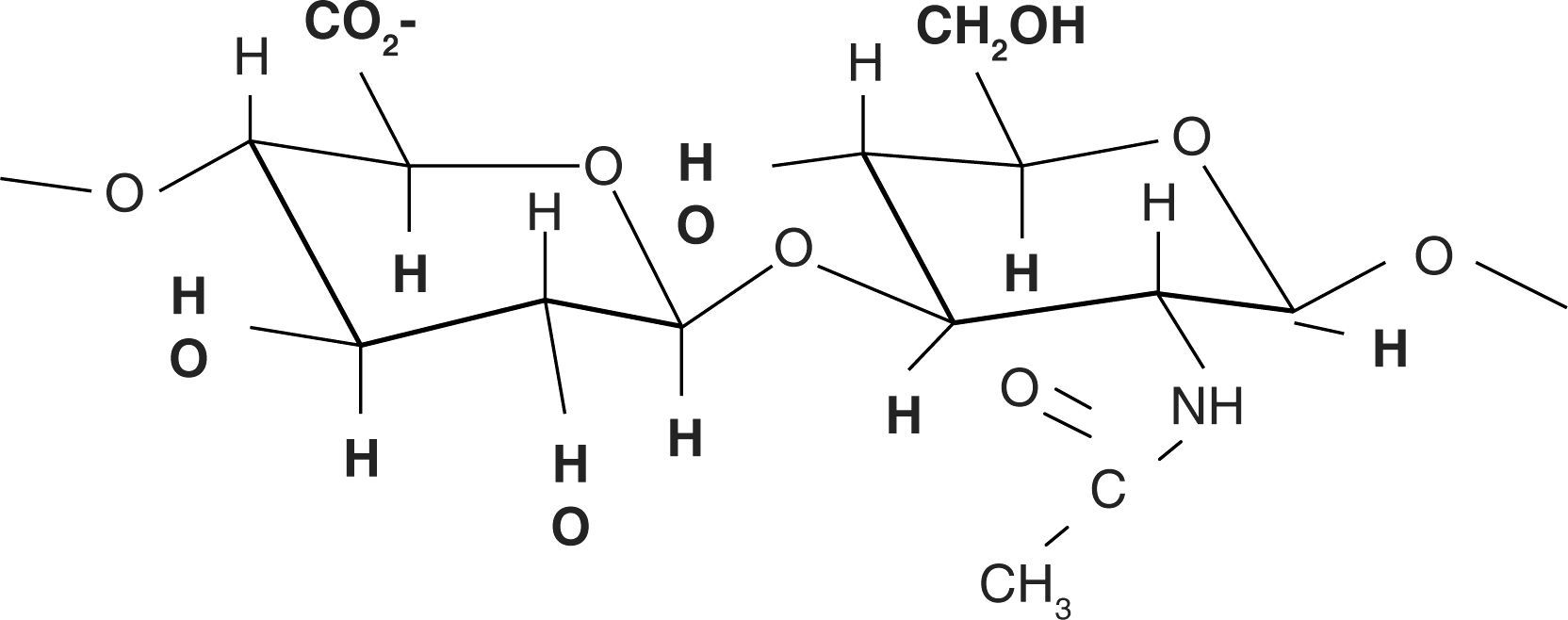
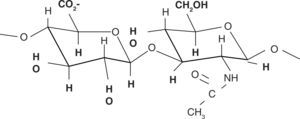
Estructura químicaSu estructura química está compuesta por una unidad disacárida que contiene ácido glucurónico y N-acetil-glucosamina, uniéndose ambos para formar una molécula polisacárida lineal y uniforme. Estas unidades de azúcares son hidrofílicas, su propiedad física más importante es la capacidad de almacenar agua aumentando más de 50 veces su peso seco, lo que les proporciona un alto grado de elasticidad, favoreciendo el intercambio de gases y de moléculas pequeñas y actuando de barrera al paso de macromoléculas y cuerpos extraños. Estas propiedades se consiguen gracias al número de grupos OH- y las cargas negativas que posee. Por tanto, es altamente hidrosoluble (Figura 2).11,12
Actividad biológicaEl AH cumple roles definitivos en la génesis, mantenimiento y resolución de la inflamación subyacente.13,14 Disminuye el tipo de prostaglandinas, que son causa de inflamación y disminuye el proceso inflamatorio; además de mejorar la disposición de la colágena, dando como resultado una mejor cicatrización y reparación de los tejidos.15,16 Es un componente del líquido sinovial, del humor vítreo y es esencial en los procesos de fertilización, pues los distintos fluidos del tracto genital femenino son ricos en él.17
Por tanto, el AH está involucrado en procesos de crecimiento e inflamación/reparación que proporciona hidratación y propiedades plásticas a las mucosas. Interviene en el proceso de reparación tisular y cicatrización. En los procesos inflamatorios se produce una despolarización que altera la arquitectura del tejido y es difícil hacer los intercambios metabólicos. Aquí es donde el AH interviene.18,19 Recientemente ha surgido información que confirma su papel antiinflamatorio y estabilizador de la matriz extracelular, por medio de un complejo proteico denominado interalfa-inhibidor.17
Las proteínas que reconocen el AH están interrelacionadas entre sí y se denominan hialurocadherinas. Algunas son catalogadas como proteínas solubles del tipo TSG6 (del inglés tumor necrosis factor-stimulated gene 6), como CTRL1 (proteínas de unión a los tejidos cartilaginosos) y otras funcionan como moléculas de adhesión celular como RHAMM –denominada también en nomenclatura especializada como CD168–. RHAMM es un receptor para AH cuya activación induce la quimiotaxis.
Muchas hialurocadherinas son proteoglucanos solubles, como el versicán o el agrecán y otras se acoplan a la membrana como los CD44. Se considera que CD44 puede ser una ruta de recaptación para degradación lisosomal. Dentro de las enzimas que degradan específicamente el AH se encuentran las hialuronidasas o hialuronoglucosaminidasas (HYAL), conservadas filogenéticamente desde las bacterias.12,20 El AH incrementa la formación de hueso estimulando los osteoblastos in vitro, a través del aumento de la migración de células mesenquimales y su diferenciación.21
Farmacocinética del AHEl AH presenta una vida media de dos a tres días y su metabolización se lleva a cabo en el hígado.22 Su mecanismo de acción consiste en organizar la disposición de la colágena favoreciendo la diferenciación celular y por lo tanto, permitiendo la cicatrización. Si no existieran concentraciones adecuadas de AH, la cicatrización sería anormal con retracción y estenosis.23
Entre las actividades específicas que realiza el AH se encuentran la migración de fibroblastos y la fibrogénesis, la regulación del nivel de proliferación y grosor de la epidermis, así como la proliferación de queratinocitos.20,24 El cuadro I muestra las funciones generales del AH.
Funciones del ácido hialurónico.
| • Interacción celular y extracelular dentro de los tejidos27 |
| • Lubrica los tejidos27 |
| • Regula la presión osmótica27 |
| • Integridad estructural y homeostasis tisular27 |
| • Modula la inflamación en las etapas iniciales27 |
| • Organiza y estabiliza la matriz del tejido de granulación27 |
| • Neutraliza reactivos del oxígeno evitando así la destrucción periodontal27 |
| • Inhibe la serina que es una proteinasa inflamatoria27 |
| • El AH de bajo peso molecular tiene un efecto angiogénico, mientras que el de alto peso molecular tiene un efecto osteoconductivo28 |
| • Tiene un efecto bacteriostático sustancial, sobre todo contra las encontradas comúnmente en las lesiones gingivales y periodontales como Aggregatibacter actinomycetemcomitans, Prevotella oris y Staphylococcus aureus. La aplicación de membranas, geles y esponjas de ácido hialurónico durante la cirugía puede reducir la contaminación bacteriana del sitio quirúrgico con la disminución del riesgo de complicaciones infecciosas posteriores y la promoción de una regeneración apropiada27 |
| • Organiza la disposición de la colágena favoreciendo la diferenciación celular, dando como resultado, una cicatrización con mínima fibrosis y disminuyendo la retracción de los tejidos16 |
| • Desempeña una importante función en la estructura de la piel, siendo responsable de la elasticidad de la misma y aportado volumen a los tejidos29 |
| • En concentraciones menores se encuentra en el ligamento periodontal, donde desempeña un papel importante en los movimientos ortodónticos ayudando en la reparación y formación de tejido nuevo alrededor del área donde se realizan los movimientos30 |
| • Tiene funciones en el llenado de espacio, lubricación y exclusión de proteínas27 |
| • Ayuda a procedimientos periodontales regenerativos por el mantenimiento de espacios y la protección de superficies27 |
El ácido hialurónico se emplea en la odontología como biomaterial, ya que es el único con la misma estructura química en todas las especies y tejidos.25 También como coadyuvante en los procesos de reparación tisular y procesos traumáticos.25 Cabe destacar que en general se usa como antiséptico y es beneficioso para la disminución del sangrado. Aunado a esto es utilizado en patología de la articulación temporomandibular traumática, degenerativa o inflamatoria, ya que mejora la función y disminuye el dolor debido a sus propiedades mecánicas (lubricación, disminuyendo el desgaste articular) y metabólicas (porque facilita la nutrición hacia las zonas avasculares del disco y cartílago condilar).25,26
Otros de los usos del AH de los que se tiene registro son procedimientos de cirugía maxilofacial, ortopedia y cirugía ortognática.31 En tratamiento estético se utiliza de manera regular debido a su capacidad de hidratar los tejidos blandos.28,32,33 En terapias periodontales la literatura reporta que este ácido ha sido empleado en gingivitis, recesiones, bolsas periodontales, injertos e implantes.28,32,34,35
Contraindicaciones del AHEl AH no se debe de aplicar cuando:
- •
El paciente tiende a desarrollar cicatrices hipertróficas.
- •
Si existen antecedentes de enfermedades autoinmunes.
- •
En niños, mujeres embarazadas o en periodo de lactancia.
- •
El paciente se encuentra bajo inmunoterapia.
- •
En pacientes con herpes activo.
- •
En pacientes alérgicos al condroitín sulfato y heparina.
- •
En pacientes con cáncer, ya que el AH provoca una proliferación celular y si se realiza en pacientes con cáncer lo que generaría serían células malignas.36,37
Las reacciones secundarias que puede generar el uso de AH son enrojecimiento en la zona, edema pequeño y sensación de sensibilidad, las cuales son poco acentuadas y desaparecen a las 24-48 horas.24
En la figura 3 se observa un cuadro sinóptico donde se resumen las características del AH.
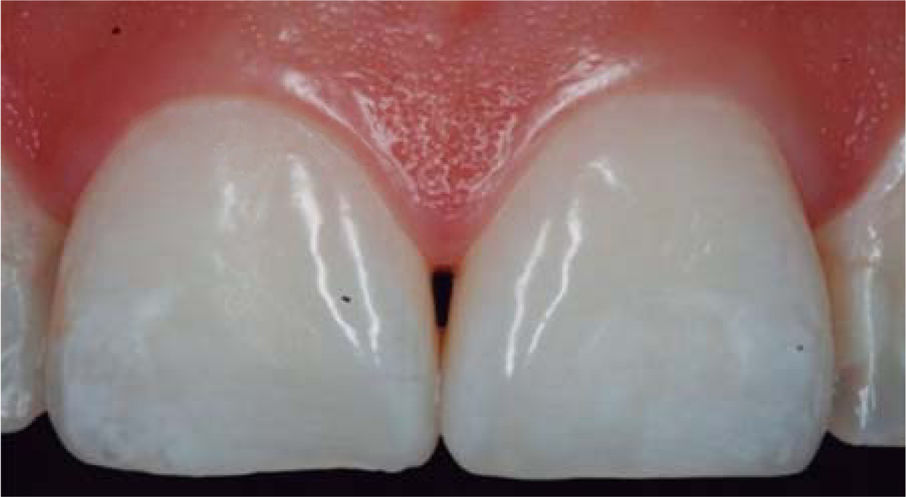
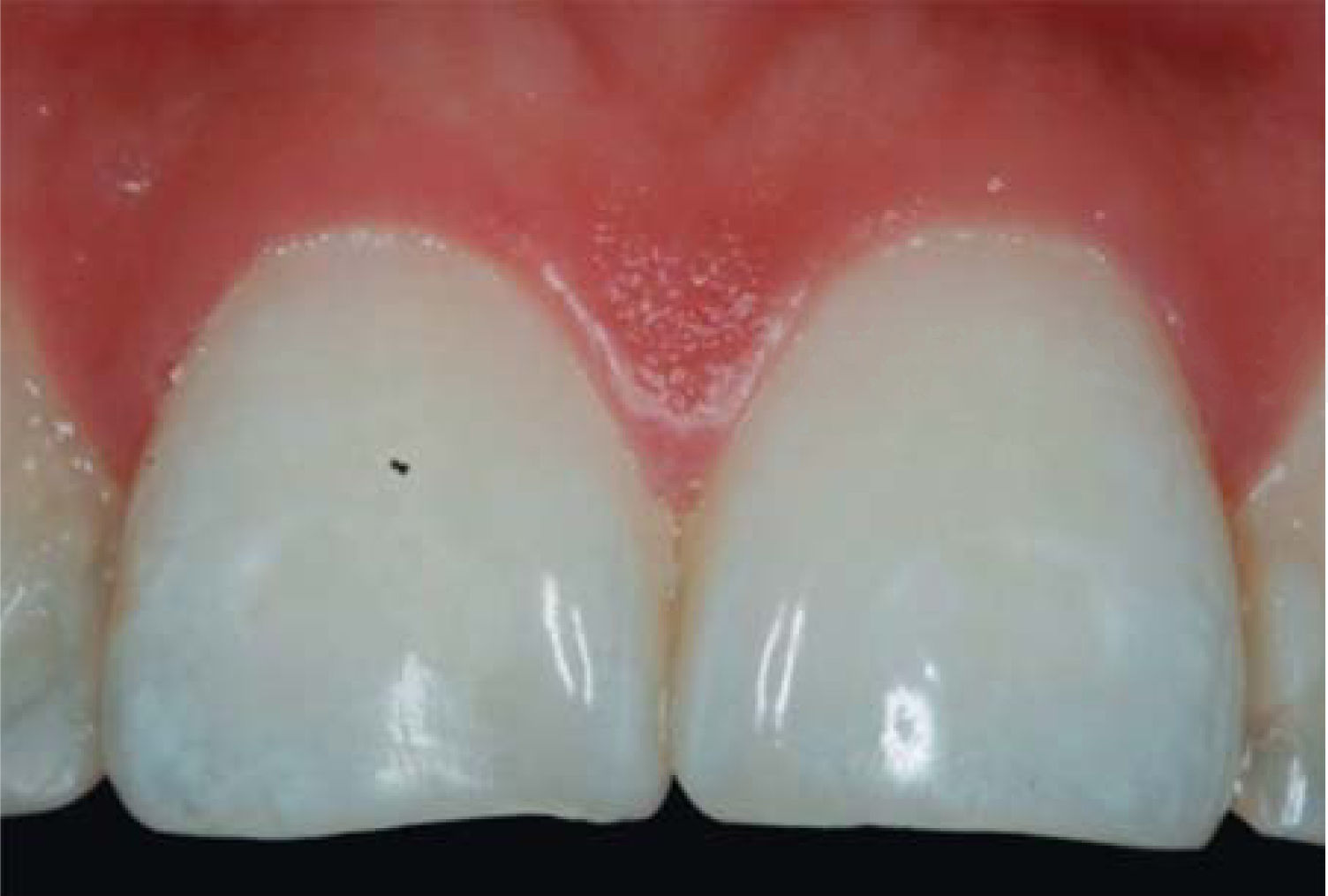
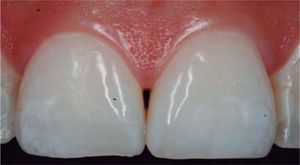
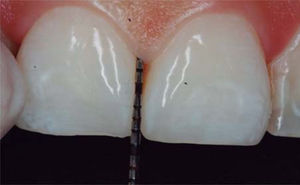
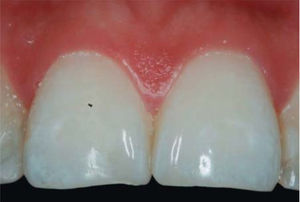
PRESENTACIÓN DEL CASO CLÍNICOPaciente femenino de 24 años de edad. En el interrogatorio, refiere estar sistémicamente sana. En la exploración clínica se observa una pérdida de la papila interdental entre centrales superiores a causa de gingivitis y una mala técnica de cepillado (Figura 4).
Se realiza diagnóstico de pérdida de la papila interdental de acuerdo con los parámetros descritos por Nordland y Tarnow. Se evalúa la distancia vertical que hay entre la cresta ósea y el punto apical del área de contacto entre las coronas y la altura del tejido blando en el área interproximal. Cuando la distancia entre la cresta ósea y el punto de contacto es igual o menor a 5mm y la altura de la papila no supera los 4mm, se podrá realizar una intervención para la reconstrucción de la papila interdental y dar solución al problema del triángulo negro de una manera predecible.
Cuando el punto de contacto está ubicado mayor a 5mm de la cresta ósea se deberán de utilizar recursos para alargar en dirección apical el área de contacto entre los dientes en vez de operar, para mejorar la topografía de la papila.38
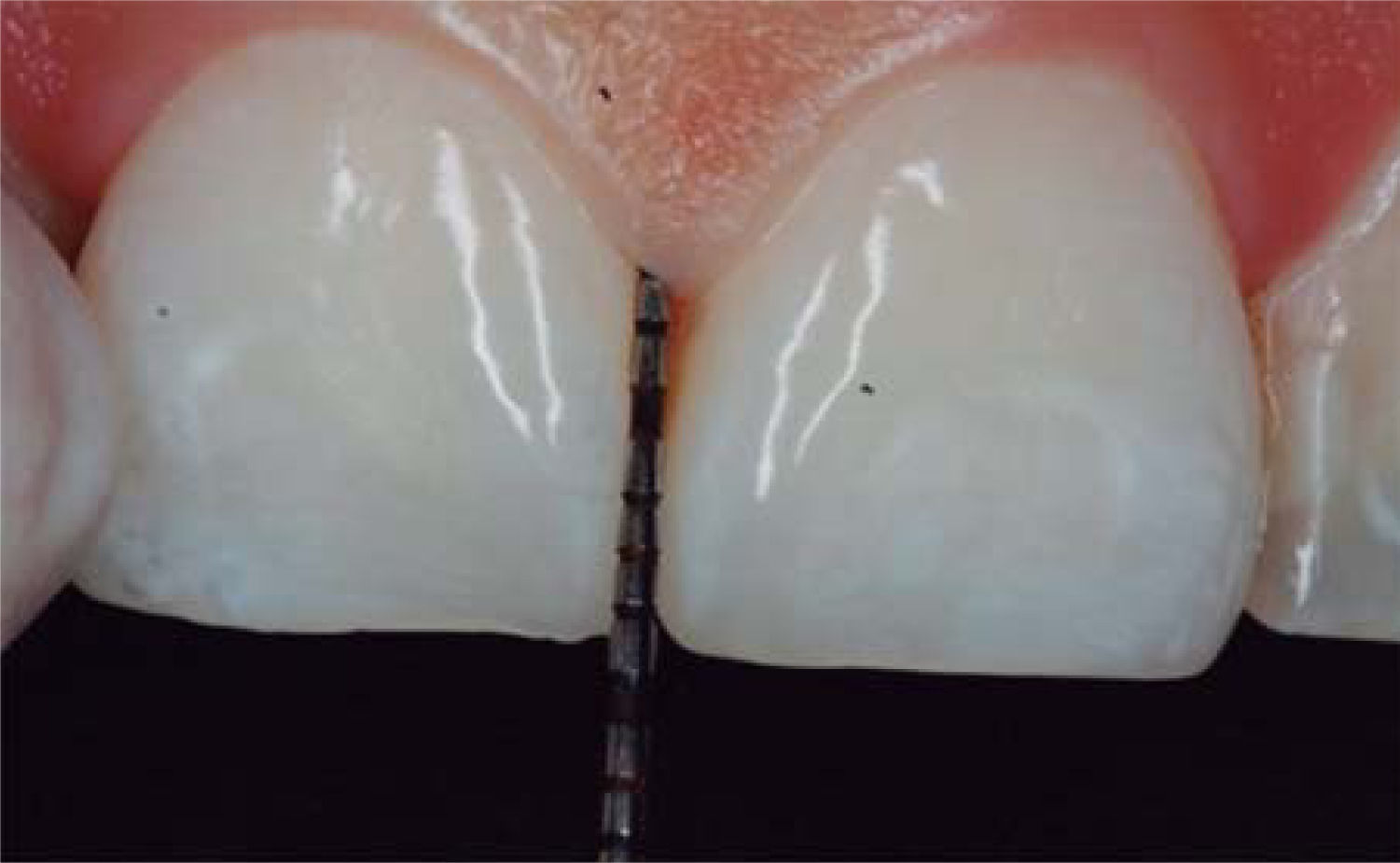
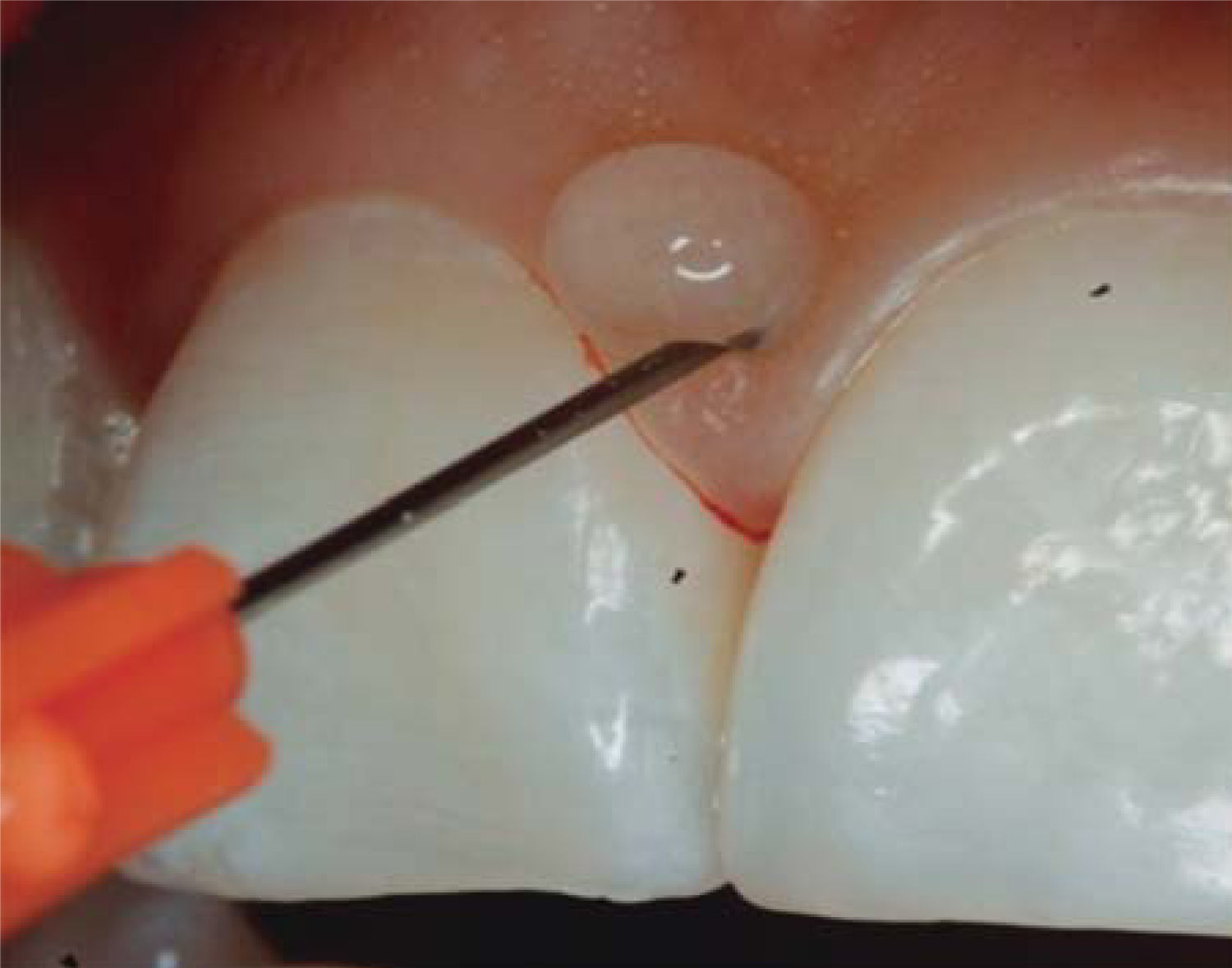
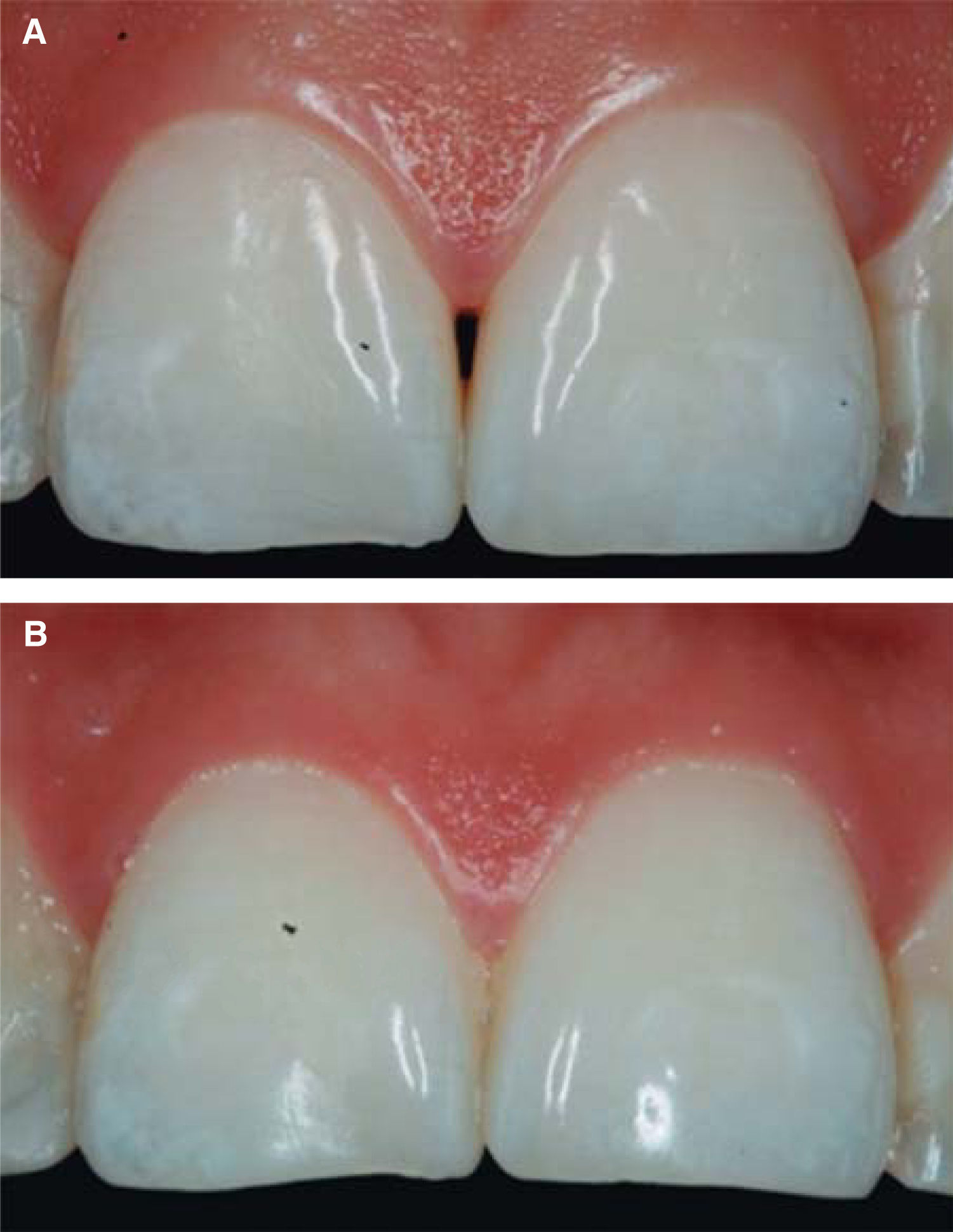
En este caso clínico se registró una medida de 5mm desde la cresta ósea hasta el punto de contacto, siendo así una paciente candidata para el tratamiento de reconstrucción de la papila interdental (Figura 5).
Se utilizó la clasificación de Cardaropoli para el diagnóstico IPP2, ya que la papila no cubre todo el espacio por debajo del punto de contacto interdental; la UCE no es visible y no se encuentra a la misma altura que las papilas adyacentes. Por lo anterior, dicha clasificación permite realizar una fácil medición de altura de la papila y observar comparaciones entre el nivel inicial y el nivel posterior al tratamiento.39
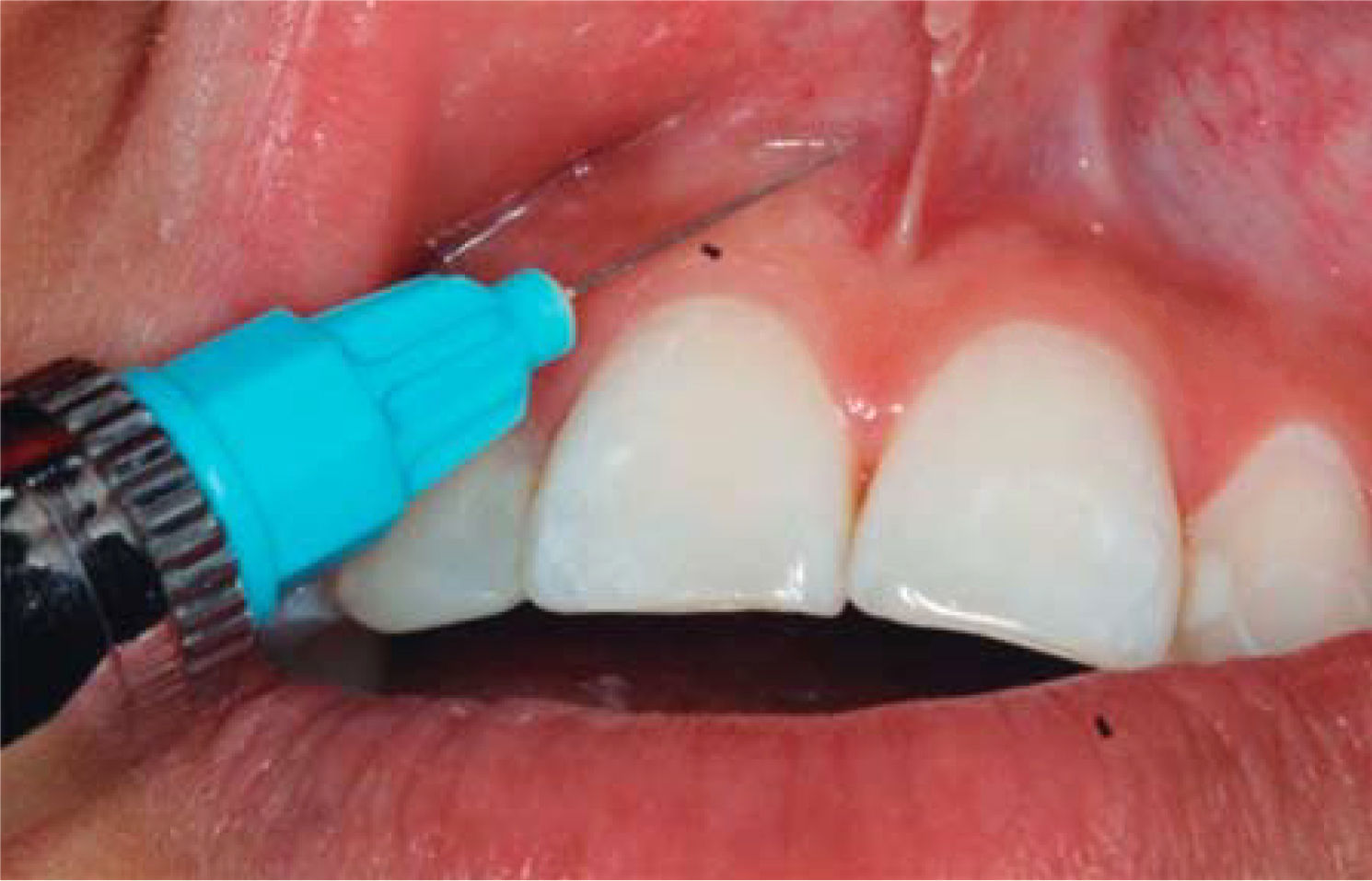
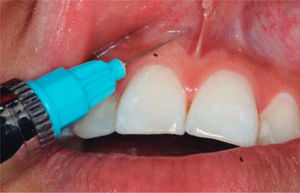
TRATAMIENTODespués de anestesiar la zona (Figura 6) se infiltra en la papila interdental 1mL de AH con una jeringa de insulina.
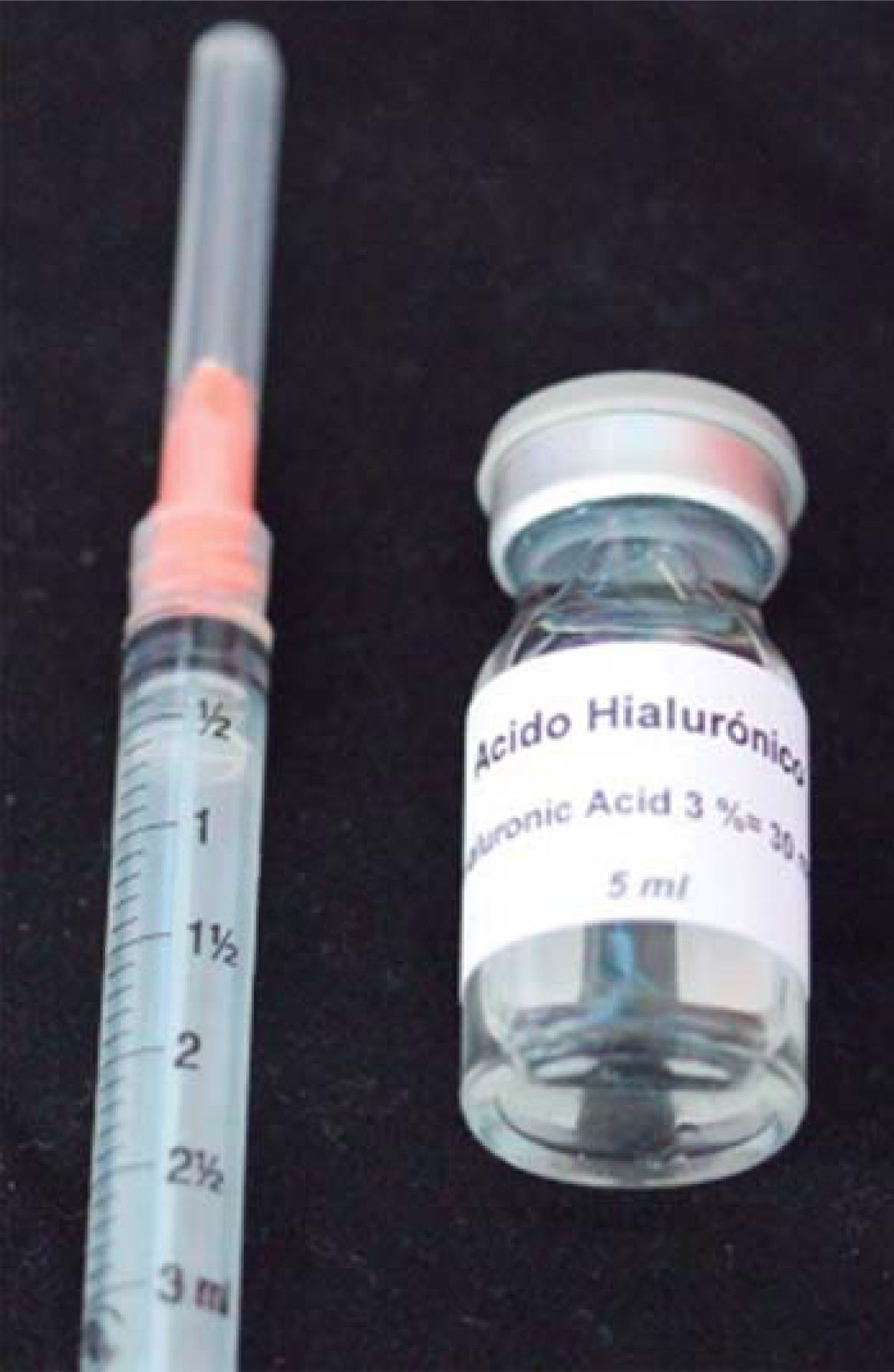
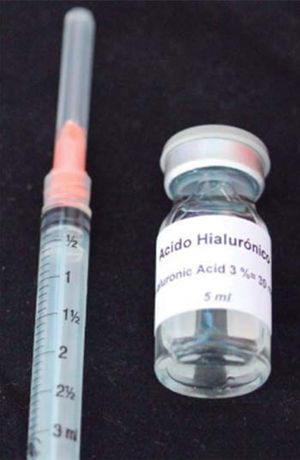
El AH que se utilizó en este caso clínico es Vbiotek México al 3%. Vbiotek México es preparado en México y proviene de Pentapharm Suiza (Pentapharm Ltd, Engelgasse 109, P.O, Box CH-4002 Basel/Switzerland) donde se produce por ingeniería genética de bacterias (estreptococos). Éste llega a la Universidad Nacional Autónoma de México (UNAM) en polvo. Dentro de los laboratorios de la Facultad de Química se prepara en gel y se integra en jeringas o frascos con diferentes concentraciones, bajo estricto control de calidad y manejo para evitar contaminaciones del producto.40
Las características del AH Vbiotek México son:
- •
Alto peso molecular.
- •
pH de 6-7.
- •
Hidratación con agua destilada.40
Se estabiliza su PH por medio de buffer de fosfatos de marca Baker en campana de flujo laminar, después es envasado y esterilizado en autoclave de acuerdo con los estándares de la FDA, durando estéril un año (Figura 7).40
Técnica de infiltración del AH:
- •
Se utiliza una jeringa de insulina.
- •
Se introduce la aguja en forma perpendicular al eje longitudinal del diente en la base de la papila.
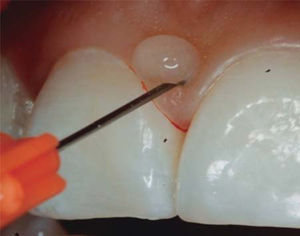
- •
Se inyecta un mililitro de AH en la papila interdental hasta observar isquemia (Figura 8).
- •
Se coloca la aguja en la punta de la papila y se realiza el mismo procedimiento.
- •
Siete días después se realiza la segunda aplicación de AH y así sucesivamente, bajo este intervalo temporal, hasta llegar a cuatro aplicaciones. En este caso las infiltraciones se realizaron a intervalos de 7, 14 y 21 días posteriores a la infiltración inicial. Esto tiene un par de razones: la herida producida en el epitelio gingival cicatriza a los siete días según la histología y fisiología de las células lábiles epiteliales del organismo humano. Además la síntesis de colágena se lleva a cabo aproximadamente de 28 a 30 días.
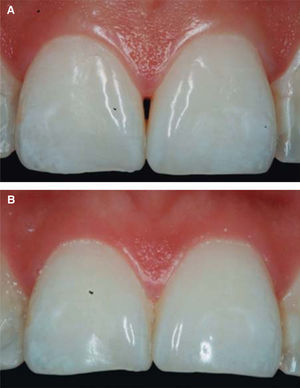
Después de realizar las cuatro infiltraciones de AH se realiza la comparación clínica, tomando como base la clasificación de Cardaropoli. En la figura 9 se puede observar la evolución de la papila, la cual cubre todo el espacio que hay por debajo del punto de contacto interdental sin triángulo negro.
RESULTADOSAl presentar la comparación clínica la papila interdental (tomando como base la clasificación de Cardaropoli), se observa al inicio del tratamiento que la papila no cubre todo el espacio interproximal. Es decir, por debajo del punto de contacto interdental (triángulo negro). Además, no está a la misma altura de las papilas adyacentes, pero la UCE aún no es visible. Por tanto se diagnosticó como IPP2. Al término del tratamiento observamos que la papila cubre todo el espacio que hay por debajo del punto de contacto interproximal y se encuentra a la misma altura de las papilas adyacentes siendo IPP1 (Figuras 10A y 10B).
Los resultados obtenidos en este caso clínico al usar AH para regenerar la papila fueron favorables, clínicamente se observa cómo la papila se desplazó coronalmente y cubrió todo el espacio existente por debajo del punto de contacto interdental donde ya no es visible el triángulo negro.
Los resultados fueron predecibles y exitosos gracias al diagnóstico fundamentado en los parámetros de Nordland y Tarnow. Con la clasificación de Cardaropoli, se puede observar una comparación clínica del antes y después del tratamiento. Se puede apreciar cómo la papila interdental aumentó y el triángulo negro ya no es visible. La papila interdental cubre perfectamente todo el espacio que hay por debajo del punto de contacto de los dientes centrales superiores.
DISCUSIÓNSe sabe que aún falta desarrollar más investigaciones sobre el uso del AH para regenerar la papila interdental ya que los estudios han sido realizados en pequeñas poblaciones.
Se deben continuar las investigaciones en poblaciones mayores con diferentes intervalos de infiltración: personas de diferente raza, edad, sexo, etcétera. De igual manera se debe de llevar un seguimiento de los casos clínicos por varios años para ver si los resultados son satisfactorios y la papila no se pierde otra vez.
CONCLUSIONESExiste una correlación entre el AH y el crecimiento de las papilas interdentales siempre que se tomen en cuenta los fundamentos científicos-clínicos, como los estudios de Nordland y Tarnow. En ellos se explica que antes de realizar la reconstrucción de una papila interdental se debe evaluar la distancia vertical entre la cresta ósea y el punto apical del área de contacto entre las coronas y la altura del tejido blando en el área interdental. Si la distancia de la cresta ósea al punto de contacto es igual o menor a 5mm, y la altura de la papila no supera los 4mm, puede justificarse una intervención para aumentar el volumen de la papila con el objetivo de resolver el problema de un triángulo negro interdental. Cabe destacar que se abre la posibilidad de emplear la técnica no quirúrgica con AH para la regeneración de las papilas interdentales de manera predecible siempre que se utilicen los parámetros ya citados.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam
Cirujana Dentista egresada de la Facultad de Odontología, UNAM.
Profesora del Departamento de Periodoncia e Implantología, División de Estudios de Posgrado e Investigación y División de Estudios Profesionales de la Facultad de Odontología. UNAM.
Profesor del Seminario de Investigación del Departamento de Periodoncia e Implantología de la División de Estudios de Pos- grado e Investigación y de la División de Estudios Profesionales, Facultad de Odontología, UNAM.