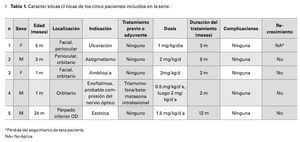
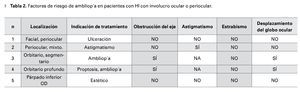
¿ Introducción
Los hemangiomas capilares o hemangiomas infantiles (HI) son los tumores benignos más comunes que afectan a la población infantil. Existen diferentes opciones de tratamiento para este tipo de lesiones dentro de las que se incluyen los esteroides administrados de diferentes formas, escisión quirúrgica, tratamiento láser y algunas otras sustancias como quimioterapéuticos. Hasta 2008, la primera línea de tratamiento para los HI era los esteroides sistémicos o intralesionales.1,2 Sin embargo, a partir del descubrimiento incidental en 2008 acerca de que el propranolol tiene un papel sobre la involución rápida y limitación del crecimiento de los HI, esta conducta está cambiando. A pesar de que el propranolol es un medicamento ampliamente probado para otros usos en cuanto a seguridad y eficacia, un protocolo para el tratamiento de los HI no ha sido universalmente aceptado debido a que aún no se ha consensuado o se han concluido los estudios comparativos con la terapia estándar actual, los esteroides.3 Por la misma razón, el propranolol no es un tratamiento actualmente acreditado por la FDA para este uso. A la fecha, no hay informes sobre los efectos en la población pediátrica mexicana.
¿ Objetivo
Presentar nuestra experiencia con el uso de propranolol en el tratamiento de HI en pacientes tratados de manera ambulatoria.
¿ Definición y epidemiología
Los hemangiomas infantiles, también llamados hemangiomas capilares, afectan a uno de cada diez niños.4,5 La población caucásica es la más frecuentemente afectada: aproximadamente 12% de los niños los presentan y son más comunes en mujeres en una proporción de 3:1. Existe una tendencia de las lesiones a ocurrir en hermanos y hay informes que señalan la afectación en trillizos.6 En cuanto a la localización, los hemangiomas son más comunes, por orden de frecuencia en: cabeza y cuello (60%), tórax, pelvis (25%) y extremidades (15%). En 80% de los pacientes se trata generalmente de lesiones únicas, el resto de los pacientes desarrollan múltiples lesiones.
Adicionalmente se han establecido asociaciones con bajo peso al nacer y prematurez. El uso de tocolíticos en mujeres que presentan trabajo de parto prematuro, puede estar relacionado con el aumento en la incidencia de HI en pacientes nacidos pretérmino.7 También se señala asociación con gestación múltiple, edad materna avanzada, historia de muestreo de vellosidades coriónicas y gestación complicada con anormalidades placentarias.8,9
¿ Historia natural
La etiología de los HI no se ha definido por completo. Algunas teorías los señalan como un defecto intrínseco, una mutación somática endotelial, la influencia de una serie de factores extrínsecos o como un tumor de origen placentario.10 Esta última es una de las más estudiadas; se han propuesto dos teorías para explicar la conexión hemangioma-placenta. La primera indica que los fibroblastos pueden proliferar hacia tejido placentario en el sitio donde el hemangioma se desarrolla. La segunda teoría indica que las células de origen placentario pueden embolizar a ciertas áreas blanco y proliferar hasta convertirse en un tumor: una especie de "placenta metastásica".11,12 En estudios moleculares se ha demostrado que las células endoteliales de los hemangiomas muestran inmunorreactividad intensa y persistente de un número de marcadores específicos que son altamente característicos de la microvasculatura placentaria como el GLUT-1. Este marcador puede distinguir a los HI de otras lesiones vasculares.13
Uno de los aspectos más reconocidos acerca de la historia natural de los hemangiomas tiene que ver con el reconocimiento de su aparición después del nacimiento (durante el primer mes de vida). Al inicio es casi indistinguible y posteriormente experimenta un crecimiento rápido e intermitente a lo largo del primer año.14 Generalmente antes de que los pacientes cumplan la primer década de vida, los HI habrán involucionado; 50% a los cinco años, 70% a los siete años, 90% a los nueve años. Sin embargo, no desaparecen por completo y pueden quedar como evidencia residual de su existencia vasos cutáneos telangiectásicos, tejido fibroadiposo, cicatrices o atrofia dérmica.15-17
En la historia natural de los HI se han reconocido tres fases: inicial, proliferativa e involutiva.13 Durante la inicial, en las primeras semanas de vida, aparece una lesión poco específica. En la fase proliferativa la lesión aumenta de tamaño y se convierte en pápulas, placas, nódulos o tumores rojo intenso con superficies lisas o lobuladas, donde el tamaño puede duplicarse o triplicarse hasta llegar a uno que se estabiliza. Durante la fase involutiva existe una regresión de la lesión que varía en aspecto y velocidad de acuerdo a la localización.
¿ Afectación ocular
En la región ocular los HI usualmente inician en el párpado pero pueden ocasionalmente ocurrir en la órbita. Cerca de 7% de los HI de los anexos oculares se originan en la órbita posterior al septum orbitario.18 Las principales complicaciones de los HI perioculares u orbitarios son la ambliopía o el riesgo de estrabismo mecánico secundario. La ambliopía puede ser causada por la deprivación que puede ocasionar la obstrucción del eje visual o por la anisometropía que induzca el propio HI. El error refractivo a menudo persiste aun cuando el hemangioma sufra regresión.19 El estrabismo generalmente es secundario a la compresión y restricción de los músculos extraoculares.
¿ Dimensiones y necesidad de tratamiento
El rango de severidad en la presentación de los hemangiomas puede ser muy variado. El tamaño de los hemangiomas puede ir de lesiones pequeñas, superficiales y benignas, a formas extensas y profundas que amenazan la función de los tejidos subyacentes. La mayoría de las lesiones no requiere tratamiento y su crecimiento es autolimitado. Sin embargo, el tratamiento se hace necesario en aquellos casos en que exista alteración de la función de órganos como es el caso de pacientes con: 1) obstrucción aérea, 2) aumento del gasto cardiaco, 3) sangrado, 4) obstrucción del eje visual o 5) ulceración de la piel (generalmente dolorosa).20 Otra indicación de tratamiento es en el caso de que los HI sean antiestéticos o con potencial de ocasionar deformidad; estos hemangiomas pueden ser calificados como de "alto riesgo".21 En el caso de afectación periocular, Shields establece que las lesiones mayores de 1 cm tienen más probabilidad de producir las complicaciones antes mencionadas.6 Para la decisión de tratamiento no es menos importante la preocupación y estrés psicológico que se presenta en los padres de los pacientes, particularmente en aquellos con hemangiomas faciales.22, 23
¿ Historia y opciones actuales de tratamiento
Los objetivos del tratamiento incluyen la reducción o erradicación del hemangioma minimizando la infección, dolor y cicatrización de la lesión.24 Se busca lograr una disminución en las complicaciones o consecuencias que el propio hemangioma puede causar con la seguridad suficiente para crear la menor cantidad de efectos adversos.
Corticoesteroides sistémicos
En 1967 fue descubierto incidentalmente el beneficio de esta familia de medicamentos al tratar un paciente con trombocitopenia con prednisolona y conseguir la mejoría de un hemangioma coexistente.25
Se han utilizado esquemas con prednisolona oral (2 a 5 mg/kg/día) o metilprednisolona intravenosa, aunque sólo han sido publicados algunos estudios aleatorizados. Otros reportes también han demostrado la eficacia de triamcinolona, dexametasona y betametasona.26
Se ha identificado que la eficacia de la terapia con corticoesteroides es mayor cuando el tratamiento se inicia durante la fase proliferativa del hemangioma.17,27 Pacientes menores de un año de edad tienen una mejor respuesta a este tratamiento probablemente por presentar lesiones en fase proliferativa.28
El tratamiento sistémico puede ser efectivo para hemangiomas de alto riesgo pero la respuesta es variable y los efectos adversos considerables y potencialmente de alto riesgo. La estabilización de la lesión en pacientes con tratamiento sistémico se ve en 70% a 90% de los casos en las dos primeras semanas y en un tercio de los pacientes experimenta regresión.28-30 Se ha identificado una relación directamente proporcional entre la dosis y la regresión de las lesiones. Sin embargo, a mayor dosis, mayores los efectos adversos.24 No importando el régimen que se indique (tipo de esteroide y dosis), un destete lento ha demostrado la prevención de la proliferación rebote de la lesión.31 Los efectos no deseados pueden presentarse en el corto y largo plazo e incluyen alteraciones en el crecimiento, disfunción del sistema inmune,32 síndrome de Cushing, cambios de personalidad, enfermedad ácido-péptica, infección, aumento de peso, hipertensión y retraso mental. Estos efectos son difíciles de monitorizar y las consecuencias pueden verse tardíamente o cuando la condición ya es irreversible.
Corticoesteroides intralesionales
Se consideran como una alternativa de tratamiento para hemangiomas más pequeños (menores a 25 mm) y superficiales, y se ha reportado respuesta al tratamiento de hasta 90%.33 Las dosis recomendadas no exceden 3 a 5 mg/kg y las sesiones se realizan en intervalos de seis a ocho semanas.34
Una variedad de combinaciones de esteroides (betametasona, triamcinolona, metilprednisolona) y de vías de administración (subdérmica, subtenon) han sido utilizadas. Una de las mezclas más comúnmente usada es la preparación 50/50 de acetónido de triamcinolona (40 mg/ml) y fosfato sódico de betametasona (6 mg/ml).35
Los efectos adversos más temidos de la terapia intralesional son la embolización y oclusión de arteria central de la retina (en el caso de los HI perioculares o intraobitarios), atrofia subcutáneagrasa, necrosis epidérmica y despigmentación del área tratada.32-37
Imiquimod
Es un fármaco que pertenece a un grupo de modificadores de respuesta inmune. Su uso tópico al 5% ha demostrado ser efectivo en el tratamiento del componente superficial de los HI infantiles en cabeza y cuello. Logra mejoría en la coloración más no en la extensión de la lesión sin efectos adversos sistémicos y pocas reacciones locales como eritema o formación de costras en la piel.38-40
Interferón alfa
Es un medicamento novedoso y costoso que inhibe el desarrollo de nuevos vasos sanguíneos a partir de vasos preexistentes.16 Se indica su uso en el tratamiento de HI agresivos y resistentes a esteroides con éxito reportado en algunas series hasta en 90% de los pacientes. El compromiso neurológico que puede producir (más comúnmente diplejía espástica) limita su uso para sólo hemangiomas de alto riesgo cuando otros tratamientos han fallado.41
Vincristina
Su uso en el tratamiento se basa en su naturaleza de alcaloide quimioterapéutico citotóxico que inhibe el crecimiento de los microtúbulos e induce apoptosis en tumores cuyas células endoteliales tienen altos contenidos de tubulina.42 Los casos de éxito reportados en el tratamiento de HI son en pacientes tratados por otros tumores que ponen en riesgo su vida. Pueden causar neuropatía periférica, constipación y malestar gastrointestinal.
Ciclofosfamida
Es un antineoplásico e inmunosupresor que se ha utilizado con éxito a bajas dosis (10 mg/kg), en pulsos y en combinación con el Interferón alfa en el tratamiento de HI orbitarios. Sin embargo, se cuestiona su eficacia como monoterapia y sus efectos a largo plazo hacen difícil la comprobación de su eficacia.43
Láser pulsado
El tratamiento con láser se limita al tratamiento de hemangiomas superficiales.44,45 Es útil en las lesiones ulceradas y en telangiectasias y eritemas residuales. No previene la progresión de lesiones superficiales a profundas y su uso se ha cuestionado por no presentar gran diferencia contra la observación de las lesiones y por su aplicación dolorosa y formación de cicatrices, atrofia e hipopigmentación de la piel.46
Propranolol
Es un betabloqueador no selectivo cuyo papel en el tratamiento de los HI fue descubierto y reportado por Léauté-Labréze y colaboradores. Se demostró la acción sistémica sobre hemangiomas proliferantes con mejoría en su consistencia y coloración con efectos definitivos, sin la presencia de efectos adversos.47
Se absorbe del tracto gastrointestinal casi por completo y hay una cantidad significativa de metabolismo de primer paso y unión al tejido hepático y hasta 90% de la dosis oral se elimina. Al menos uno de los metabolitos tiene acción biológica y cierta cantidad de propranolol intacto es eliminado a través de la orina. Se une a proteínas en 80% a 95% y se distribuye en toda la economía con niveles mayores en pulmón, riñón, cerebro y corazón.48
Su mecanismo de acción se ha estudiado ampliamente al tratarse de un fármaco que revolucionó el tratamiento del angor pectoris. A través de sus receptores adrenérgicos reduce la frecuencia y el gasto cardiaco aunque inicialmente el efecto se retrasa por vasoconstricción periférica. La conducción nodal y la refractariedad auriculoventricular son prolongadas y el flujo de sangre y presión disminuye en la mayoría de los territorios vasculares. El propranolol es un agonista parcial de los adrenoreceptores y receptores de serotonina y tiene efectos inhibitorios sobre el transportador de noerpinefrina al estimular su liberación.13
Los efectos del propranolol sobre los hemangiomas son pobremente entendidos. La fase proliferativa de las lesiones se caracteriza histológicamente por cúmulos de células endoteliales con frecuentes mitosis, un gran número de células cebadas y membranas basales multilaminadas. Dos factores proangiogénicos se ven involucrados y pueden ser blanco de los efectos del propranolol: el factor de crecimiento básico de los fibroblastos (bFGF) y el factor de crecimiento vascular endotelial (VEGF). Los niveles de ambos factores se presume que pueden disminuir, así como darse un aumento en la apoptosis de las células endoteliales en una matriz de tejido fibroadiposo en la fase de involución de los hemangiomas.14,48
Otras explicaciones potenciales del efecto terapéutico del propranolol sobre los hemangiomas incluyen a la vasoconstricción que es visible inmediatamente después de iniciado el tratamiento por el cambio en el color y reblandecimiento de la lesión. Además, el propranolol inhibe la expresión del MMP-9 (enzima degradante angiogénica y de la matriz extracelular) y la HBMEC (células endoteliales microvasculares del cerebro humano) lo que le confiere propiedades antiangiogénicas debido a la participación de estas moléculas en la angiogénesis de los tumores.49
El propranolol tiene un perfil de seguridad y efectos adversos bien documentados. Su uso en niños se había limitado hasta ahora al uso en casos de hipertensión y enfermedad cardiovascular (taquicardia supraventricular, síndrome de QT largo, insuficiencia cardiaca congestiva, tirotoxicosis, etc).50 La exposición postnatal a los beta-bloqueadores no parece tener efectos adversos significativos. Se ha utilizado por más de 40 años en lactantes con hallazgos cardiovasculares sin complicaciones que amenacen la vida y que sean resultado directo del uso de propranolol. Los efectos potenciales del propranolol incluyen bradicardia, hipotensión, hipoglicemia, exantema, reflujo o molestia gastrointestinal, fatiga y broncoespasmo. Todas ellas son raramente observadas a dosis altas incluso mayores a 2 mg/kg/día. Una historia y examen físico completos que no demuestren enfermedad cardiaca o respiratoria hacen al paciente candidato al tratamiento.13 Deben excluirse del tratamiento aquellos pacientes con hemangiomas muy grandes, con hemangiomas múltiples (que presentan afectación visceral) y con síndrome de PHACES que consiste en malformaciones cerebrales de fosa posterior, hemangiomas de la cara, anomalías arteriales, anormalidades cardiacas, anormalidades oculares y defectos del esternón.32
Timolol
Tras demostrarse el efecto positivo de los beta-bloqueadores en el tratamiento de los HI, Guo y colaboradores iniciaron el uso de la forma tópica con resultados alentadores en lesiones de párpado. Los autores trataron un HI palpebral en un paciente de cuatro meses de edad mostrando mejoría significativa, aplicando Timolol 0.5% por algunas semanas en la superficie del tumor. Se hizo extensivo a otros niños afectados por el mismo tipo de lesión sin presentarse efectos adversos locales o sistémicos.2
Cirugía
Históricamente se ha disuadido la remoción quirúrgica; sin embargo, hay casos selectos que pueden manejarse de esta forma.51,52 Una indicación para la remoción puede ser un hemangioma subcutáneo circunscrito que esté creciendo en un lactante muy pequeño, pues el impedir el crecimiento del tumor puede evitar el manejo más difícil de un tumor que sea más grande y que pueda causar más complicaciones posteriormente al encontrarse en una localización de alto riesgo. Como ejemplo, una lesión periocular puede ocasionar oclusión del eje o errores refractivos significativos.53,54 Debe evitarse el manejo quirúrgico de lesiones superficiales con involucro extenso de la epidermis.
¿ Métodos
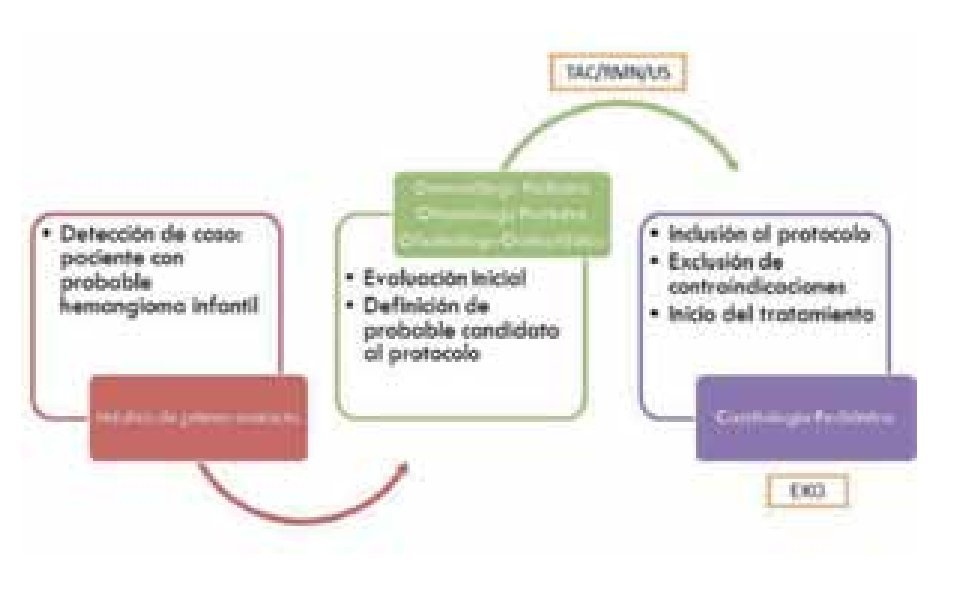
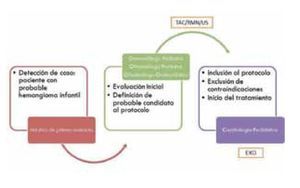
Se diseñó y realizó un estudio observacional, prospectivo, de intervención donde se incluyó a cinco pacientes con hemangiomas infantiles con diferentes indicaciones de tratamiento. La lesión fue evaluada por el dermatólogo pediatra o el oftalmólogo pediatra y oculoplástico (Figura 1). Se realizó una evaluación oftalmológica completa haciendo énfasis en los factores de riesgo presentes para el desarrollo de ambliopía, tales como obstrucción del eje visual, astigmatismo, desplazamiento del globo ocular o estrabismo. Posteriormente se definió al paciente como candidato a recibir el tratamiento y se incluyó en la serie de casos. Se realizó la evaluación completa por parte del cardiólogo pediatra para descartarse alguna contraindicación (anormalidades cardiacas incluido el síndrome de PHACE) y previa firma del consentimiento informado (donde se explicó la lógica del tratamiento y potenciales efectos adversos), se llevó a cabo la realización de un electrocardiograma basal para inicio del tratamiento.
¿ Figura 1. Protocolo y participantes.
Se inició el medicamento de manera ambulatoria con 0.5 mg/kg/día dividido en dos o tres dosis a escalarse a una dosis final de 2 o 3 mg/ kg/día dependiendo la severidad clínica (Tabla 1). Se documentó la lesión por medio de fotografías antes de iniciar el tratamiento y en cada visita subsecuente (a los 15 días y mensualmente). Se monitoreó la frecuencia cardiaca, presión arterial así como el apego y tolerancia al tratamiento. La respuesta al tratamiento fue evaluada subjetivamente considerándola como positiva cuando se presentó reducción clínica del HI en tamaño, coloración, resolución de la ulceración así como desplazamiento del globo ocular y astigmatismo. Se documentaron los efectos adversos presentados durante la evolución.
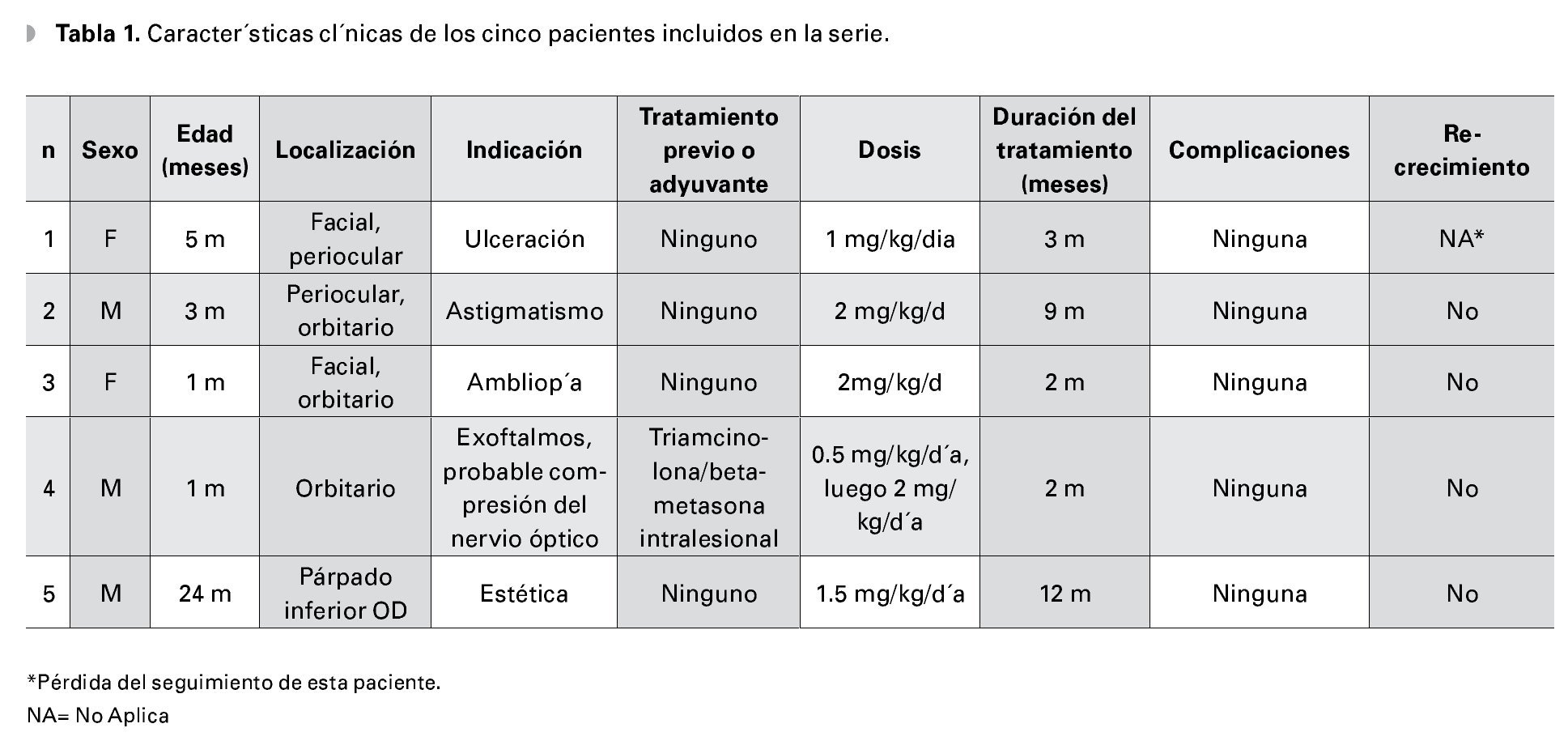
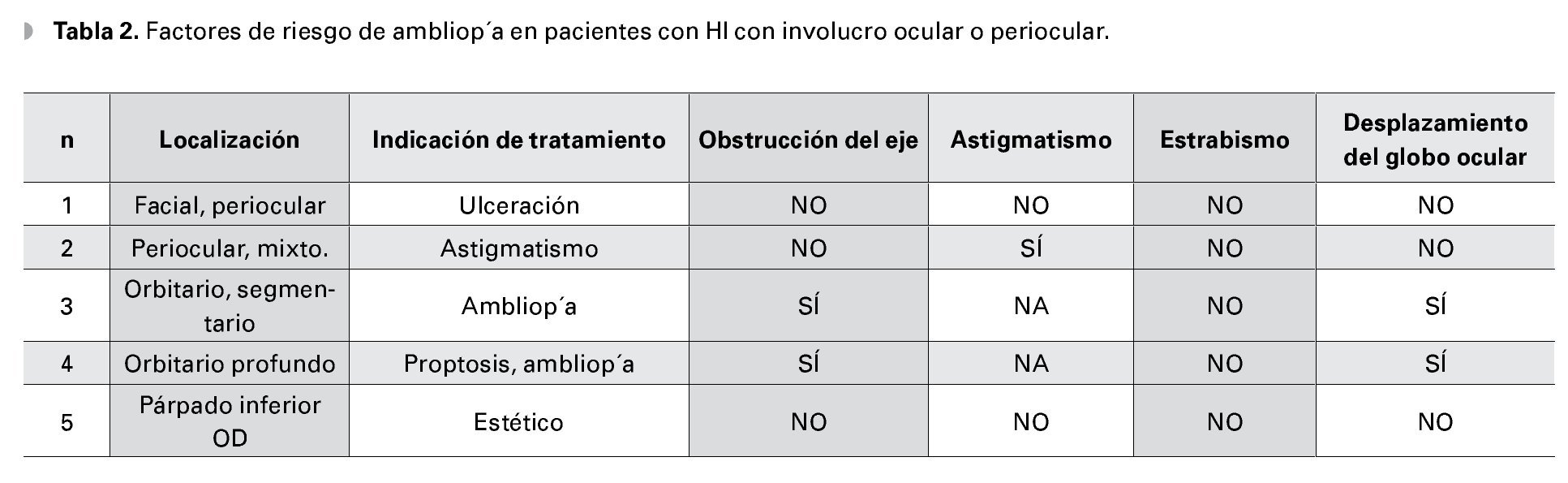
¿ ResultadosLos datos clínicos de los cinco pacientes que recibieron tratamiento con propranolol se incluyen en la Tabla 1. Tres pacientes son del sexo masculino y dos femenino. Todos los pacientes incluidos eran menores de 12 meses con edad promedio de 6.8 meses. Las indicaciones para inicio de tratamiento son señaladas en la Tabla 1 siendo la indicación más frecuente el riesgo de ambliopía. Los potenciales riesgos para ambliopía para cada uno de los pacientes se incluyen en la Tabla 2.
No todos los pacientes incluidos en la serie fueron tratados con propranolol como monoterapia. El paciente cuatro fue tratado con esteroides intralesionales (triamcinolona y betametasona 50/50).
El efecto terapéutico del tratamiento con propranolol fue demostrado rápidamente en casi todos los pacientes. El efecto más notorio fue el cambio de coloración de un tono rojo intenso a color rosado. La lesión reblandeció haciéndose más suave al tacto.
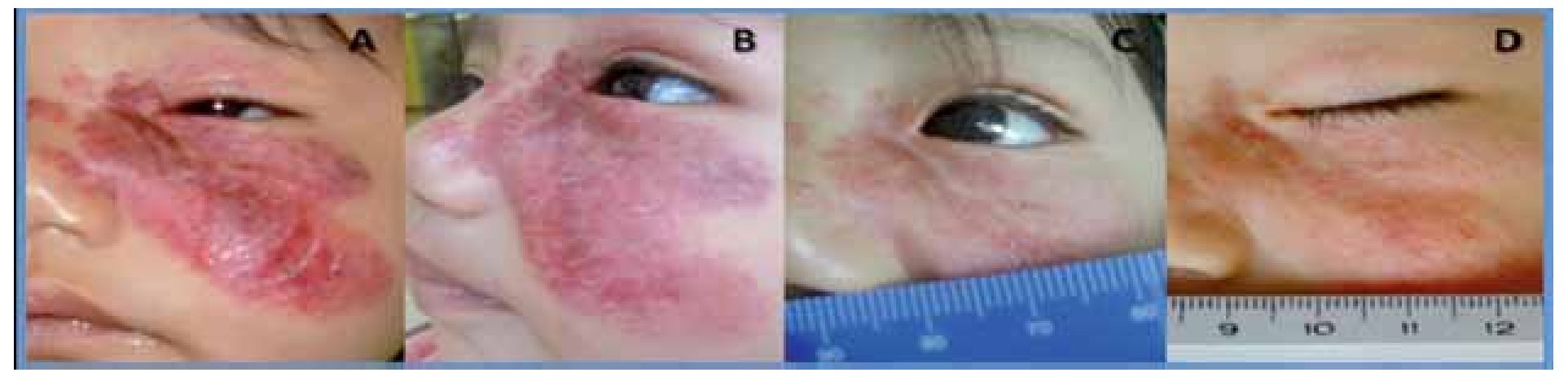
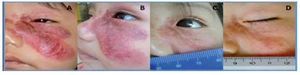
La paciente uno, cuya indicación de tratamiento fue la ulceración, experimentó el cierre de la misma a la semana de iniciada la terapia (Figura 2).
¿ Figura 2. Paciente 1. Pretratamiento (A y B); 15 días postratamiento (C) y 45 días posttratamiento (D). Mejoría en la extensión, coloración, ulceración.
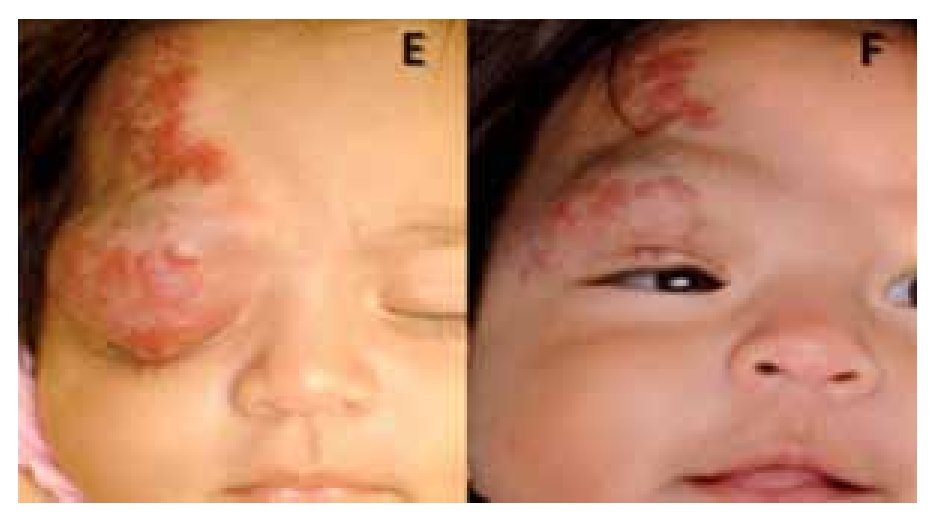
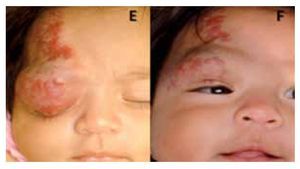
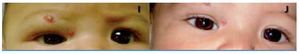
En cuanto a la obstrucción del eje visual, la apertura espontánea del párpado se documentó a la semana de iniciado el tratamiento en los pacientes tres y cuatro (Figura 3).
¿ Figura 3. Paciente 3. Obstrucción del eje visual (E); eje visual libre (F).
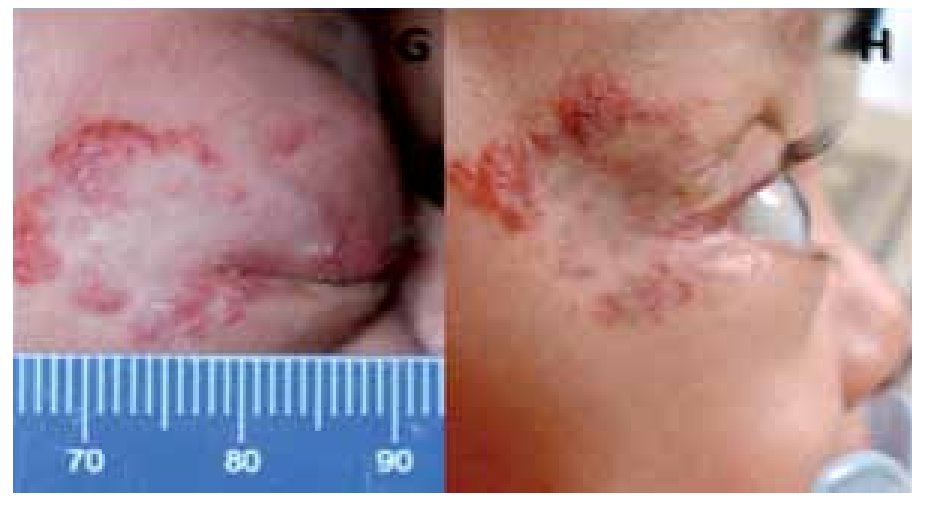
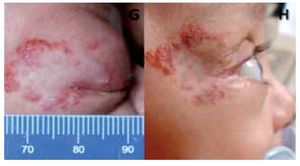
El desplazamiento del globo documentado en dos de los pacientes disminuyó considerablemente según se puede apreciar en las imágenes (Figura 4). El paciente número cuatro tuvo que recibir tratamiento adicional con esteroides intralesionales, ya estando en tratamiento con propranolol, debido a sospecha de compresión del nervio óptico y disminución en la reactividad pupilar. Se realizó oftalmoscopía indirecta y no se documentó oclusión venosa o arterial o efecto adverso local significativo a este manejo. Además, es importante señalar que se identificó que el paciente sólo se encontraba con una dosis de 0.5 mg/kg/día por lo que además de los esteroides intralesionales, el propranolol tuvo que ajustarse a la dosis de 2 mg/kg/día.
¿ Figura 4. Paciente 4. Proptosis pretratamiento (G); 60 días postratamiento (H).
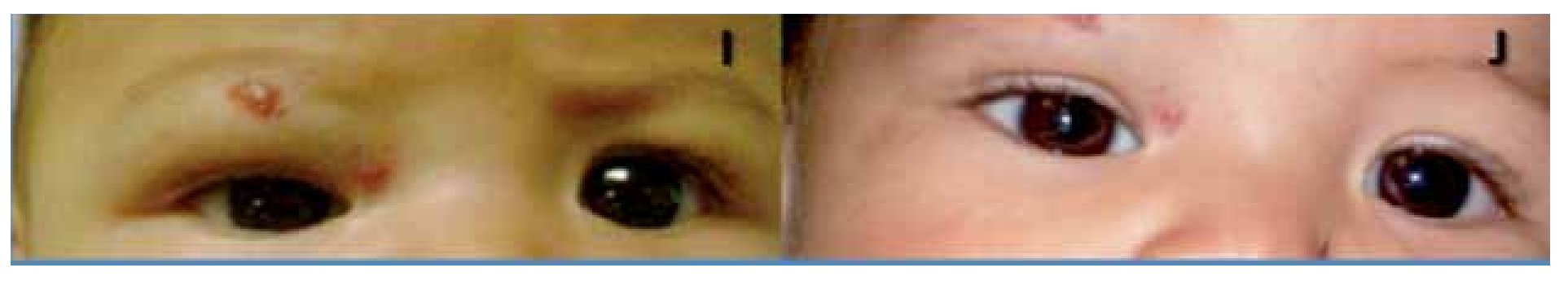
La indicación de tratamiento para el paciente número dos fue el astigmatismo inducido por la lesión orbitaria (Figura 5). Se demostró un cambio en 0.50 dioptrías de cilindro a favor de la regla (Refracción previa OD con cicloplejia: +1.00 = -3.00 x 180°; posterior al tratamiento: +0.75 = -2.50 x 180°) que puede no atribuirse al tratamiento ya que el ojo contralateral experimentó la misma evolución en su astigmatismo (Refracción previa OS con cicloplejía: +1.00 = -1.00 x 180°; posterior al tratamiento: +0.75 = -0.50 x 180°). Como se mencionó previamente, el error refractivo puede persistir a pesar de la mejoría en el HI.19
¿ Figura 5. Paciente 2. Astigmatismo inducido por el HI.
Los padres no informaron sobre algún efecto adverso durante las primeras dos semanas del tratamiento, como datos sugestivos de disnea o compromiso hemodinámico.
Al momento del término de este artículo, los pacientes dos y cinco iniciaron el destete y posterior suspensión del propranolol tras haber cumplido 12 meses de edad o 12 meses en tratamiento con evolución favorable de la lesión, sin datos de mejoría ulterior tras meses de estabilidad de la lesión o nuevo crecimiento de la lesión.
Puede mencionarse, de manera subjetiva, que todos los familiares de los pacientes tratados se mostraron satisfechos con el manejo y evolución de las lesiones.
¿ Discusión
Es de especial importancia distinguir la naturaleza de la lesión antes de iniciar el tratamiento. Los principales diagnósticos diferenciales del hemangioma infantil incluyen malformaciones vasculares (arteriales, venosas, linfáticas), otros tumores vasculares como hemangioendoteliomas epitelioides, kaposiformes o en penacho, o tumores no vasculares como rabdomiosarcoma y sarcoma mieloide. Es el dermatólogo pediatra, oftalmólogo pediatra o el oftalmólogo oculoplástico, el especialista mejor capacitado para distinguir entre las lesiones y para indicar los estudios de imagen pertinentes en caso de ser necesarios.
Todos los trabajos hasta ahora publicados causan entusiasmo respecto al uso del propranolol para el tratamiento de los HI. La eficacia del medicamento es lo más alentador y su impacto sobre el desarrollo de los hemangiomas infantiles puede ser dramático como se demuestra en extensión, aspecto, consistencia y deformidad. Por otro lado, el efecto parece ser sostenido con la misma dosis.
En la serie de casos presentada, sólo uno de los pacientes tiene antecedente de nacimiento pretérmino y no se tienen datos respecto al uso de tocolíticos durante el trabajo de parto. No se puede discutir en base a lo observado en estos pacientes si la prematurez puede jugar algún papel en la etiología de los HI.
En esta serie, todos excepto uno de los pacientes incluidos son menores a 12 meses de edad. La excelente evolución observada hace apoyar el hecho de que entre más temprano sea el tratamiento más influencia tiene sobre la fase de crecimiento del hemangioma infantil; el tratamiento presume detener su desarrollo y crecimiento que característicamente presentan durante el primer año de vida. Sin embargo, el tratamiento puede iniciarse tardíamente (después del año de edad) en los pacientes con efectos también alentadores. En otras series de casos han sido incluidos pacientes de hasta 48 meses que aún se encuentran en tratamiento.55
En ninguno de los cinco pacientes tratados se mostró nuevo crecimiento de la lesión bajo tratamiento hasta el momento donde fue realizado este trabajo. Sin embargo, existen reportes de pacientes donde se ha demostrado desarrollo de la lesión (aumento en la coloración) posterior al cese del tratamiento, dónde se ha reinstalado el uso de propranolol sistémico sin reportarse resultados en la evolución final.55
El propranolol es de fácil administración, de bajo costo y con un buen perfil de seguridad para el paciente. Son estas características las que hacen posible que el tratamiento sea administrado de manera ambulatoria. Ninguno de los cinco pacientes presentó efectos adversos significativos. El broncoespasmo y la hipoglicemia, que podrían ser de los efectos adversos más esperados, pueden ser monitorizados en casa y referidos oportunamente para tratamiento. Como se enuncia en los resultados su incidencia es muy baja y, de presentarse, pueden ser fácilmente manejados de manera ambulatoria sin necesidad de suspender los beneficios que el betabloqueador puede estar haciendo sobre la lesión del infante.
Puede reservarse el uso de los esteroides para aquellos casos que presenten riesgo para la función visual o pueden utilizarse como adyuvantes en el tratamiento de las lesiones ya sean administrados de manera sistémica o intra-lesional.
¿ Conclusiones
El propranolol, usado sistémicamente, tiene un efecto positivo en el tratamiento de hemangiomas infantiles y puede jugar un papel muy importante en el tratamiento seguro de este tipo de lesiones postulándose como una opción terapéutica ambulatoria de primera línea en pacientes afectados con estos tumores benignos. Se esperan los resultados de los estudios multicéntricos o comparativos para poder validar el papel del propranolol como un tratamiento que incluso pueda usarse como de primera línea antes que los esteroides.
Correspondencia: Dr. Juan Homar Páez Garza.
Río San Juan No. 103 (1er piso). Colonia Miravalle. Monterrey, N.L. C.P. 64660.
Teléfono: (81) 8356-1878 o 1884, fax: (81) 8356-1799.
Correo electrónico: Juan.homar.paez@itesm.mx.