Se presenta un caso de neurorretinitis unilateral como único signo de enfermedad asociada a Bartonella henselae con excelente respuesta al tratamiento antibiótico.
Caso clínicoPaciente de 12 años previamente sana, que consulta por pérdida brusca e indolora de la visión de 24 horas de evolución en su ojo derecho (OD). Al fondo de ojos se observó edema de papila en OD sin otras alteraciones. Se le solicitó tomografía computarizada (TC) de cerebro que fue normal y a los 5 días apareció una estrella macular. Al interrogatorio refería tener un gato cachorro en su hogar, por lo que luego de descartar otras causas, se sospechó una posible enfermedad por arañazo de gato y se le administró tratamiento para Bartonella con azitromicina, con resolución completa del cuadro clínico.
ConclusiónFrente a un cuadro de edema papilar en un niño se debe realizar un seguimiento clínico y oftalmológico estricto, dado que la estrella macular que define a la neurorretinitis tarda en aparecer. La neurorretinitis causada por Bartonella es una patología poco frecuente. Ante un cuadro de neurorretinitis la presencia de focos retinitis uni o bilaterales asociados puede ayudarnos a orientar el diagnóstico etiológico hacia una enfermedad por arañazo de gato. Es fundamental una correcta anamnesis y una exploración oftalmológica cuidadosa investigando dirigidamente los antecedentes de contacto, arañazo o mordedura de gato para el correcto diagnóstico y posterior tratamiento de la enfermedad. Los veterinarios deberían informar acerca de los riesgos que existen de la infestación de animales con pulgas o garrapatas y tomar medidas de control para evitarlas.
We report on a case of unilateral neuroretinitis as a single sign of Bartonella henselae associated disease with an excellent response to antibiotic therapy.
Case reportPreviously healthy 12 year-old female patient consulting for sudden and painless visual loss of 24hours of evolution in her right eye (OD). Funduscopy revealed papillary edema in OD with no other alterations. The brain computerized tomography (CT) scan ordered was normal but after 5 days a macular star was observed. The ophthalmologists inquiry revealed that she had a Kitten at home, therefore-after ruling out other causes, she was suspected of having cat scratch disease and administered treatment for Bartonella with azithromycin, with which the clinical picture resolved completely.
ConclusionWhen faced with a picture of papillary edema in a child, strict clinical and ophthalmic follow-up should be implemented, since the macular star that defines neurorretinitis takes some time to become manifest. Neurorretinitis caused by Bartonella henselae is a rare condition. In a case of neurorretinitis, the presence of associated uni or bilateral retinitis foci may help direct etiological diagnosis towards cat scratch disease. Adequate anamnesis is vital, as well as thorough subsequent treatment of the disease. Veterinarians should inform about the risks of flea or tick infestation from animals and take the necessary control measures to prevent them.
La neurorretinitis es una enfermedad que consiste en una pérdida visual de moderada a severa, edema de papila, y exudación macular en forma estrellada con variable inflamación vítrea (figs. 1–6).
Fue Theodore Leber1, en 1916, el primero en describir una entidad clínica caracterizada por pérdida de visión unilateral con edema de papila y maculopatía estrellada. Luego en 1977, Donald Gass2 le da el nombre de neurorretinitis al observar mediante angiografía fluoresceínica que no había alteración macular sino que el edema retinal se originaba en de los capilares profundos del nervio óptico.
Dentro de la etiologías infecciosas, una de las causas más frecuente de neurorretinitis es la enfermedad por arañazo de gato (EAG), aunque existen otras entidades que pueden asociar papiledema y estrella macular (ver tabla 1), como la tuberculosis (TBC), la sífilis, la toxocariasis, la histoplasmosis, leptospirosis, sarcoidosis, la enfermedad de Lyme, la hipertensión maligna, diabetes, y el aumento de la presión intracraneal. La neurorretinitis asociada a la EAG no se diferencia clínicamente de la neurorretinitis idiopática. A la toxoplasmosis habrá que tenerla en cuenta en el diagnóstico diferencial cuando la neurorretinitis se acompañe de retinitis adyacente al nervio óptico. El primer caso de neurorretinitis asociada a EAG fue descripto por Sweeney en 19703. En 1995, Wong et al.4 publican un paciente con sida y neurorretinitis con serología positiva para Bartonella henselae (B. henselae). Las manifestaciones clínicas que produce la infección por B. henselae son diversas. Entre 5-10% de los pacientes con EAG tienen compromiso ocular, manifestado como síndrome oculoglandular de Parinaud (SOGP), neurorretinitis y retinocoroiditis focal.
Causas de neurorretinitis
| Virales | Bacterianas | Parásitos | Hongos | No infecciosas |
|---|---|---|---|---|
| Epstein-Barr | Bartonella henselae | Toxoplasma gondii | Histoplasma sp. | Retinopatía hipertensiva |
| Varicela-Zoster | Mycobacterium sp | Toxocara sp | Sarcoidosis | |
| Herpes simplex | Salmonella | Poliarteritis nodosa | ||
| Influenza A | Treponema pallidum | Enfermedad inflamatoria intestinal | ||
| Hepatitis B | Leptospira sp | OACR | ||
| Parotiditis | Borrelia | Retinopatía diabética | ||
| Coxsackie B | Enf. Kikuchi |
Paciente femenina de 12 años de edad, que consultó por disminución abrupta de su agudeza visual en su ojo derecho (OD). No refiere antecedentes de importancia. En el examen oftalmológico presenta una agudeza visual inicial (AV) de 5/10 que no mejora con estenopeico en su OD y 10/10 en su ojo izquierdo (OI). Los movimientos oculares conservados y no dolorosos. En OD se observa DPAR y alteración de la visión de los colores en el eje rojo-verde. La BMC del segmento anterior era normal en ambos ojos (AO). La PIO era 12 AO. Al fondo de ojos se observa edema de papila en OD y focos blancos de retinitis pequeños, siendo el OI normal. Su refracción era +1.25 OD y +1.50 OI.
La paciente se interna para su estudio clínico-neurológico y se le solicita tomografía computarizada (TC) de cerebro y órbitas, RX tórax, y hemograma. Al examen físico se encontraba en buen estado general, febrícula de 37.5°, sin adenopatías, con examen de cabeza, cuello, tórax, abdomen y extremidades normal. Se le solicitó serología para toxoplasmosis, TBC, HIV, citomegalovirus, virus Epstein-Barr, y también para B. henselae, debido a que en el interrogatorio dirigido se constató el antecedente de un gato cachorro como mascota en el hogar de la niña.
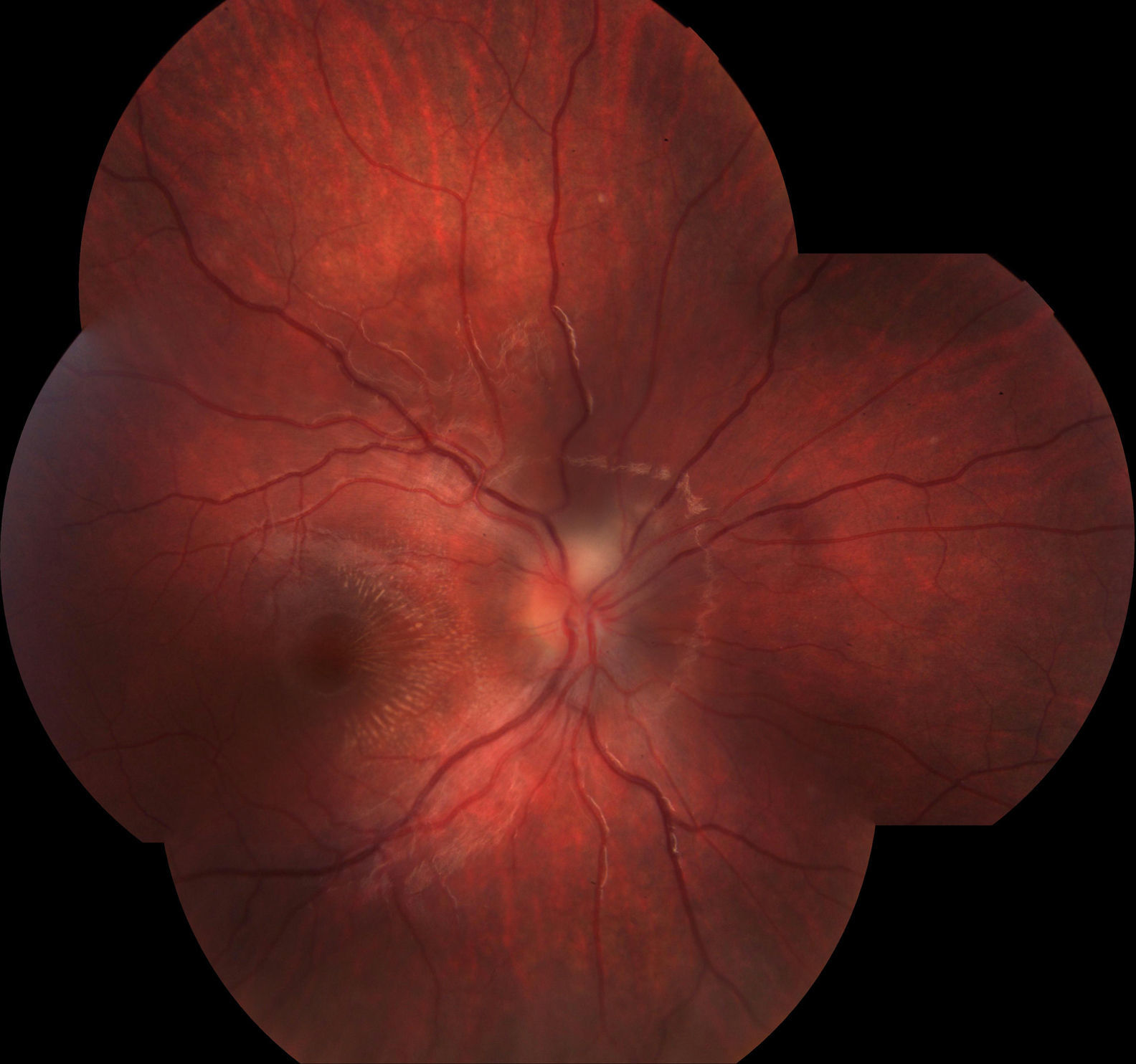
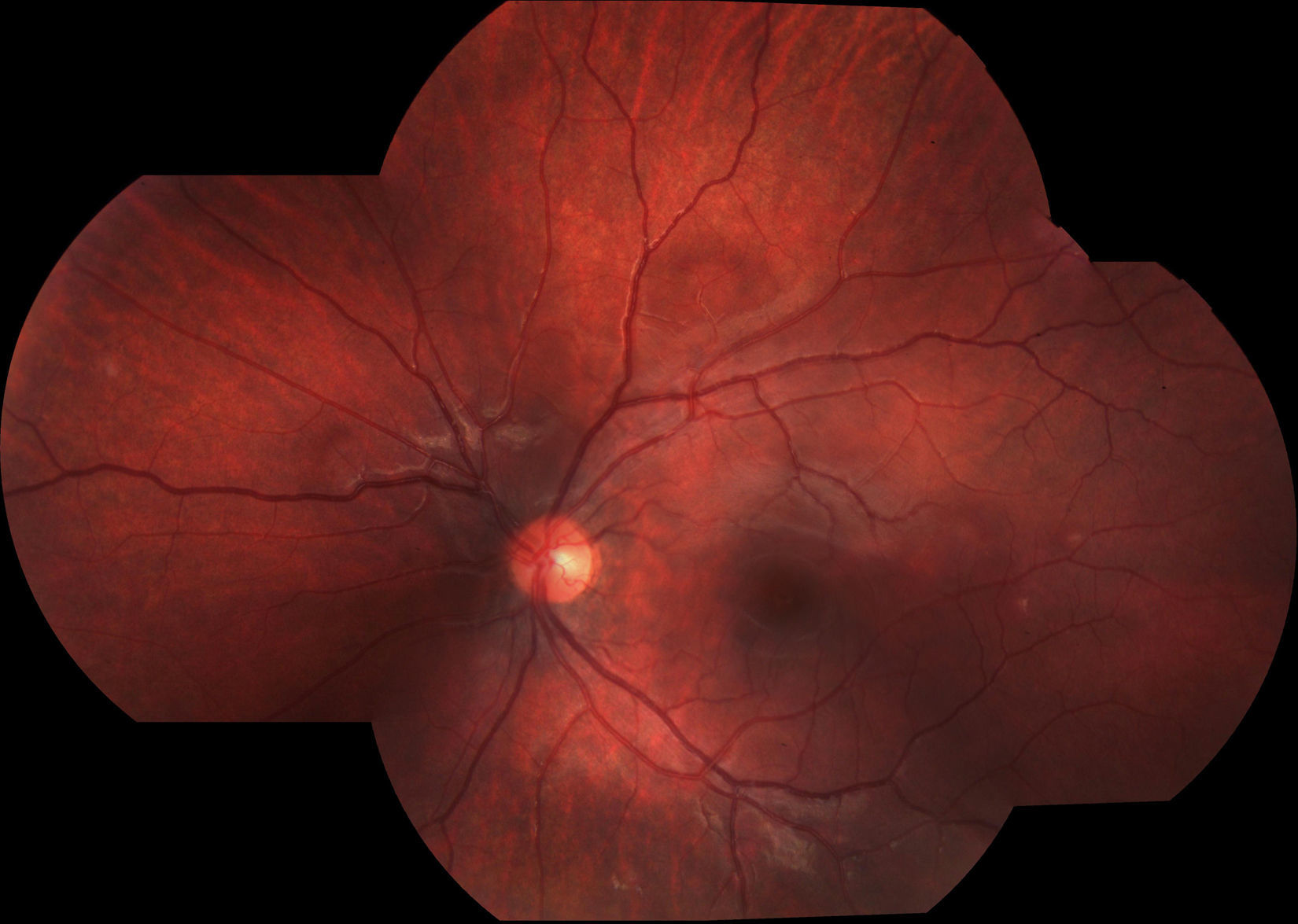
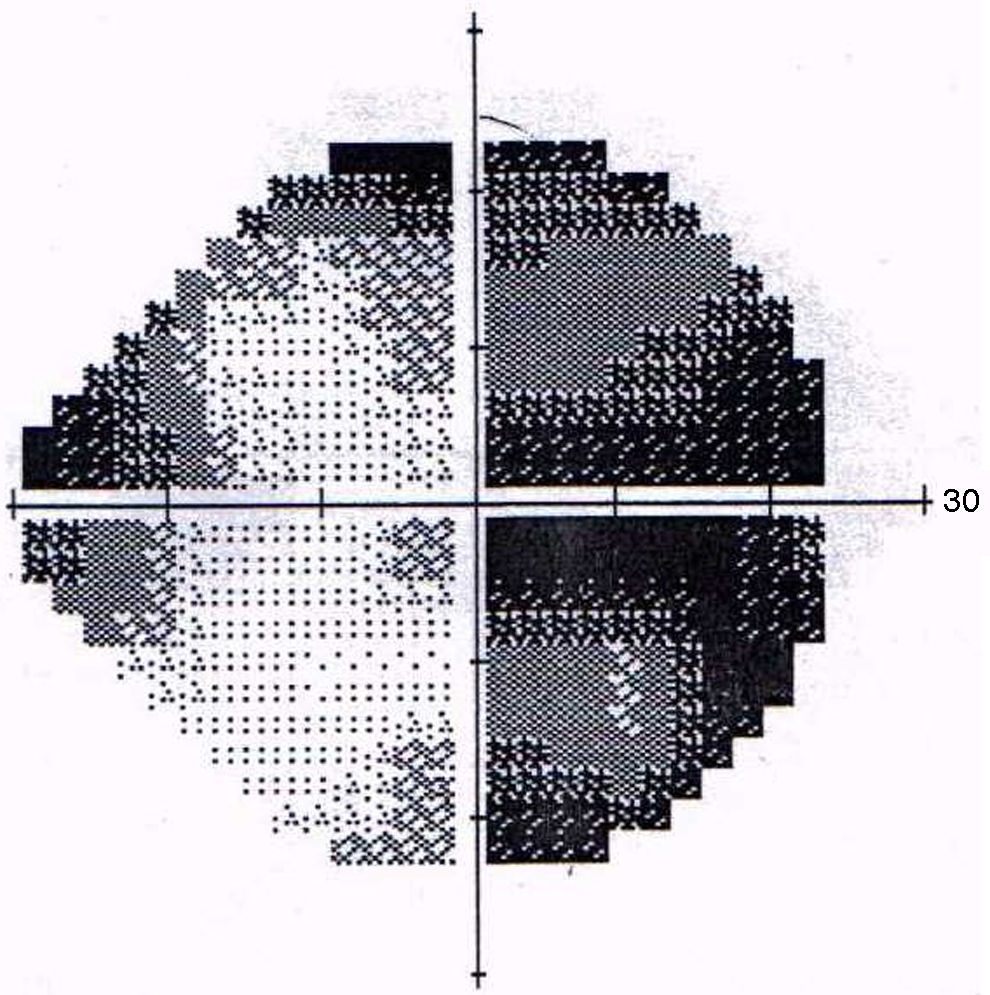
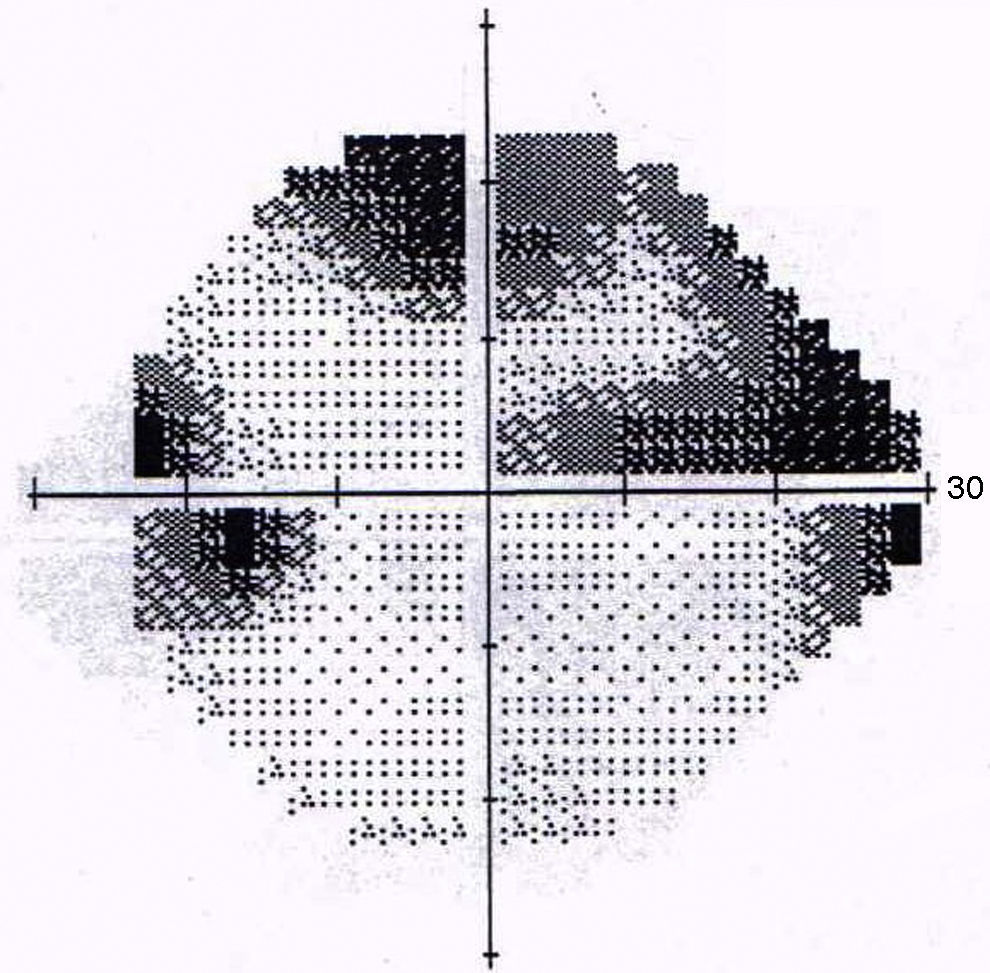
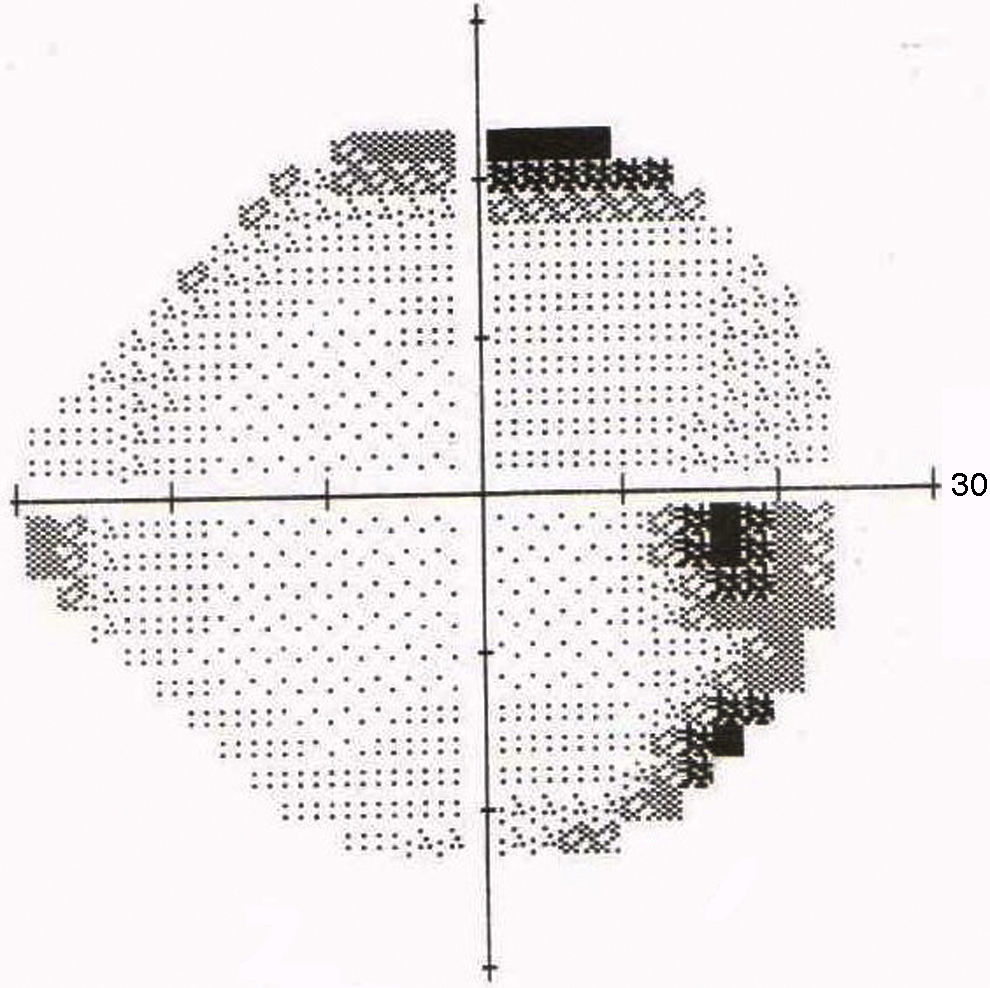
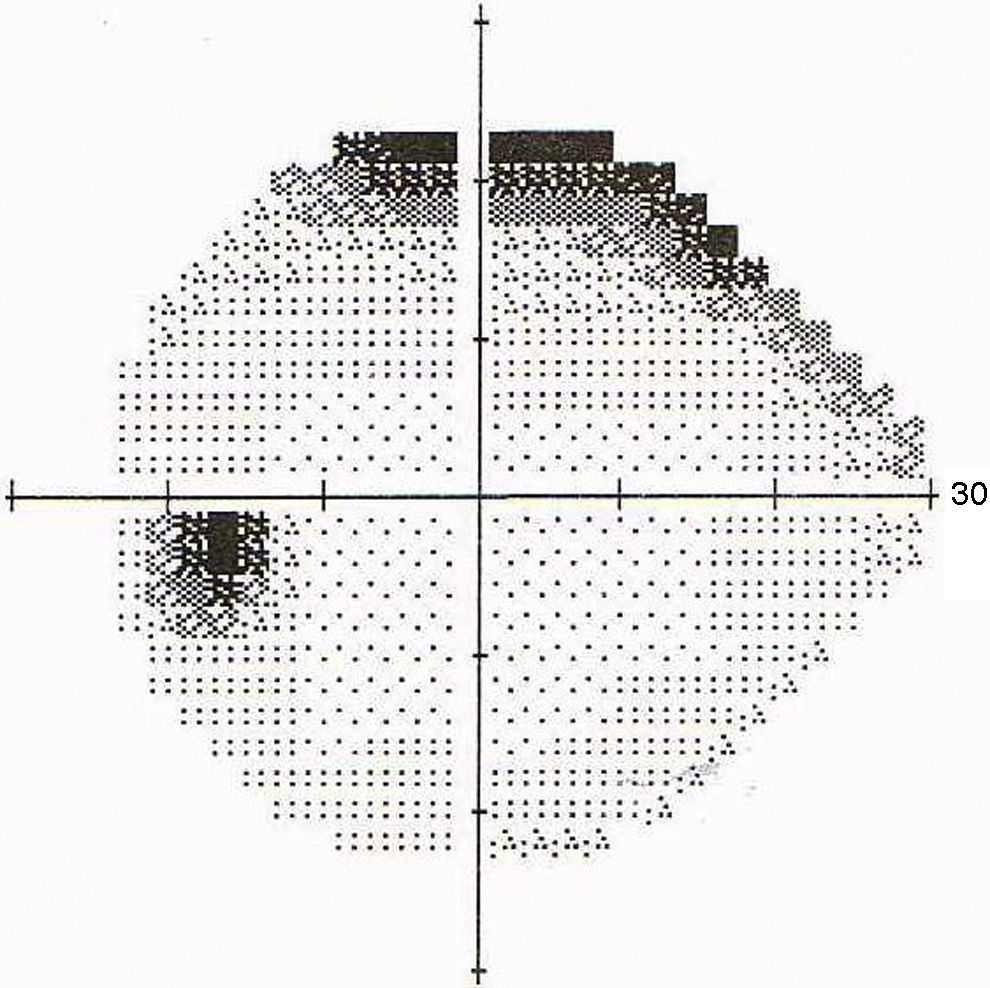
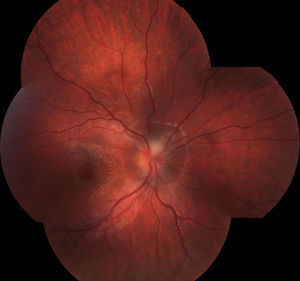
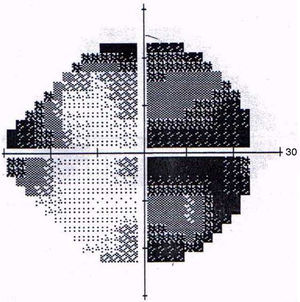
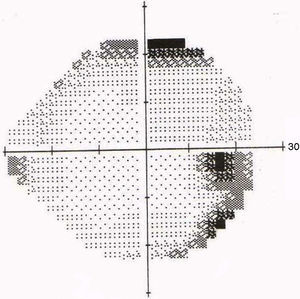
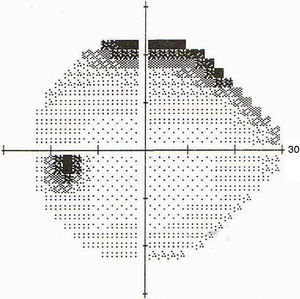
La TC fue normal y el hemograma mostraba leucocitosis leve. A las 48 horas la paciente presentaba visión de 1/10 en OD y seguía con 10/10 en OI. Se le realizaron FO en forma seriada para control y a los 5 días se observó la aparición de una estrella macular (ver figs. 1 y 2), por lo que se interpretó el cuadro como neurorretinitis. Se le realizó CV donde se observó un escotoma cecocentral en OD y defecto altitudinal AO (ver figs. 3 y 4).
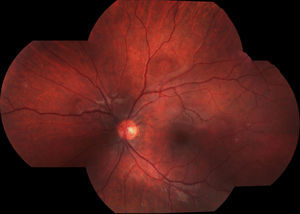
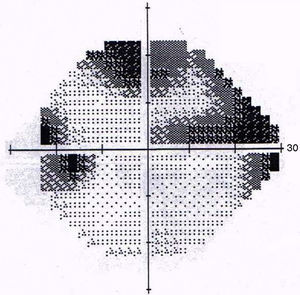
Debido a las altas sospechas de neurorretinitis por Bartonella se le indicó tratamiento con azitromicina en dosis de 500mg/día. El diagnóstico fue confirmado por la serología con técnica de inmunofluorescencia indirecta (IFI). La evolución fue favorable observándose una mejora de su AV y disminución progresiva de su edema papilar hasta la recuperación total. Asimismo, mejoró su campo visual quedando un aumento de la mancha ciega en AO (ver figs. 5 y 6). La duración del tratamiento fue de 6 semanas.
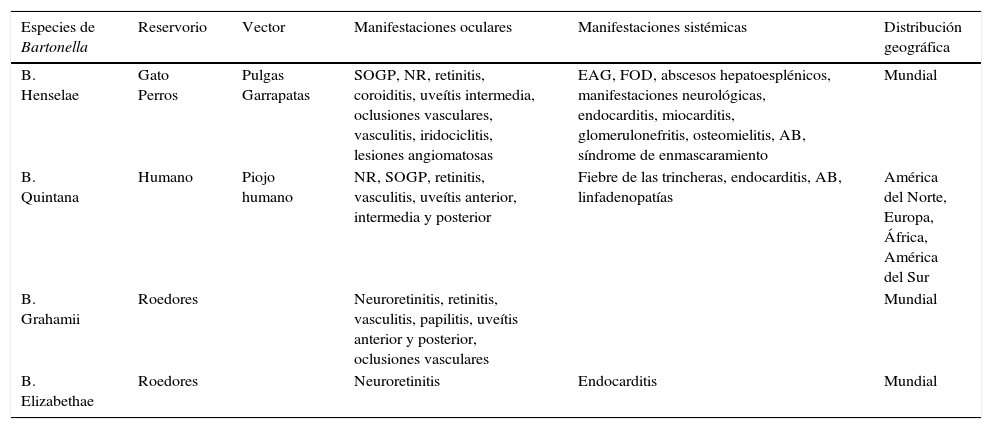
DiscusiónDe las 20 especies que existen de Bartonella, solo 4 producen enfermedad en los seres humanos, B. Bacilliformis, B. Quintana, B. Elizabethae, y B. Henseleae (ver tabla 2).
Especies de Bartonellas y sus manifestaciones clínicas
| Especies de Bartonella | Reservorio | Vector | Manifestaciones oculares | Manifestaciones sistémicas | Distribución geográfica |
|---|---|---|---|---|---|
| B. Henselae | Gato Perros | Pulgas Garrapatas | SOGP, NR, retinitis, coroiditis, uveítis intermedia, oclusiones vasculares, vasculitis, iridociclitis, lesiones angiomatosas | EAG, FOD, abscesos hepatoesplénicos, manifestaciones neurológicas, endocarditis, miocarditis, glomerulonefritis, osteomielitis, AB, síndrome de enmascaramiento | Mundial |
| B. Quintana | Humano | Piojo humano | NR, SOGP, retinitis, vasculitis, uveítis anterior, intermedia y posterior | Fiebre de las trincheras, endocarditis, AB, linfadenopatías | América del Norte, Europa, África, América del Sur |
| B. Grahamii | Roedores | Neuroretinitis, retinitis, vasculitis, papilitis, uveítis anterior y posterior, oclusiones vasculares | Mundial | ||
| B. Elizabethae | Roedores | Neuroretinitis | Endocarditis | Mundial |
Fuente: Kalogeropoulos et al.33
AB: angiomatosis bacilar; EAG: enfermedad por arañazo de gato; FOD: fiebre de origen desconocido; NR: neuroretitis; SOGP: síndrome oculoglandular de Parinaud.
La Bartonella es un bacilo aeróbico gramnegativo pleomórfico, oxidasa negativo, hemotrópico, e intracelular de crecimiento lento.
Los gatos jóvenes (menores de 12 meses) representan el reservorio natural y huésped definitivo de la B. henselae5–9. En los gatos la Bartonella produce bacteriemia por varias semanas, pero estos son asintomáticos. Adquieren la infección de pulgas y garrapatas. El hombre es un huésped accidental, y la transmisión se produce por inoculación del microorganismo a través de un arañazo o mordida de gato, y existen reportes que sugieren transmisión por picaduras de pulgas de gatos10. Los perros también se pueden infectar pero su rol como reservorio no es tan claro.
B. Hensellae causa distintas manifestaciones en los humanos, y la respuesta depende del status inmune del paciente. En los individuos inmunocompetentes la misma es de tipo granulomatosa, y supurativa. En los inmunocomprometidos la respuesta es principalmente vasoproliferativa11. La variedad de formas de presentarse la enfermedad estaría dada por la diferencia de virulencia entre las cepas de Bartonella y los diferentes mecanismos de respuesta humoral o celular activados por la misma12,13.
La presentación más típica es un cuadro conocido como EAG. Descripta en 1950 por Debré, consiste en una infección que se caracteriza por una pápula en el sitio de inoculación (rasguño o mordedura), seguida por el desarrollo de una adenopatía dolorosa y supurativa, cursando de forma asintomática o con un cuadro pseudogripal leve y autolimitado.
El compromiso ocular puede producirse por vía sistémica o por inoculación del microorganismo a las conjuntivas, y las presentaciones son variadas y de diversa gravedad14. Las manifestaciones oculares en general suceden a las sistémicas, pudiendo presentarse en ausencia de síntomas sistémicos15, como fue el caso de nuestra paciente.
La patogénesis de la afección ocular es aún desconocida. Aunque la presencia del ADN de B. henselae ha sido descripta en la retina de los pacientes con sida; no se sabe si en los pacientes inmunocompetentes las especies de B. henselae causan directamente infección ocular o si la afección es secundaria a una reacción autoinmune.
Las formas oculares más frecuentes de la infección por B. henselae son el SOGP descripto por Henri Parinaud en 188916, la neurorretinitis y los puntos blancos retino-coroideos.
La neuroretinitis clásica afecta al uno o 2% de los pacientes con infección por B. henselae17 y se caracteriza por disminución o pérdida aguda uni o bilateral de la visión, asociada a defecto pupilar aferente, alteración del campo visual y edema de papila, con extensión al área peripapilar y macular18. Al reabsorberse el componente seroso del edema se produce precipitación de lípidos en la capa plexiforme externa de la retina, disponiéndose en una forma estrellada característica (ver fig. 1). Estos fenómenos fueron descriptos ya en 1916 por Leber19. La neurorretinitis en forma bilateral es rara, y la presencia simultánea de SOGP y neurorretinitis es también poco frecuente.
Los exudados maculares pueden tardar meses en desaparecer y a veces luego de la resolución de la neurorretinitis persiste una neuropatía óptica leve. Algunos quedan con palidez del nervio óptico, discromatopsias, disminución de la sensibilidad al contraste, potenciales visuales evocados alterados y defectos pupilares aferentes persistentes20. B. quintana, grahamii y elizabethae son causa también de neurorretinitis, uveítis, vasculitis, y papilitis21–23.
Cerca de un 5% de los pacientes sintomáticos con la EAG tienen SOGP. Los pacientes presentan fiebre, conjuntivitis granulomatosa, y linfadenopatía preauricular, submandibular o cervical. Los síntomas típicos incluyen ojo rojo unilateral, sensación de cuerpo extraño y epífora. La transmisión ocurre a través de las heces de las pulgas desde las manos al ojo, ya que el rasguño directo del gato en la conjuntiva es muy raro24. B. quintana también fue encontrada como causante de SOGP en un paciente25.
Otras manifestaciones en el segmento posterior de los pacientes con B. henselae incluyen26,18,27–32 retinitis focales o multifocales, coroiditis o retinocoroiditis con o sin la presencia de neurorretinitis o edema de papila. También han sido descriptos casos de oclusiones de ramas de arterias y venas, desprendimiento de retina, agujero macular, panuveitis con engrosamiento difuso de la coroides simulando un síndrome de Vogt-Koyanagi-Harada, vitreitis, vasculitis, y papilitis.
Algo muy común en la neurorretinitis por B. henselae es la presencia de una retinitis interna multifocal aguda caracterizada por la presencia de focos blancos, profundos, pequeños (50-300μ), redondos, homogéneos de predominio en polo posterior, que se resuelven espontáneamente en 2-3 semanas. Estas lesiones están presentes en forma bilateral en el 75% de los casos, incluso en neurorretinitis unilateral; habiéndose sugerido por algunos autores que se trata de pequeños émbolos sépticos; siendo por lo tanto un marcador diagnóstico de dicha enfermedad y son un signo muy útil para diferenciarlo de la retinitis por toxoplasmosis ya que en esta última no se ven. En los pacientes inmunocomprometidos infectados con B. henselae se han observado angiomatosis bacilar retinal y lesiones vasculares subretinales. También se han descripto casos de uveítis anterior e intermedia por B. henselae y quintana y uveítis anterior por B. grahamii.
En la serie de Kalogeropoulos33 la manifestación más frecuente de Batonelosis ocular fue la uveítis intermedia en contraste con la serie de Terrada34 donde fue la uveítis posterior.
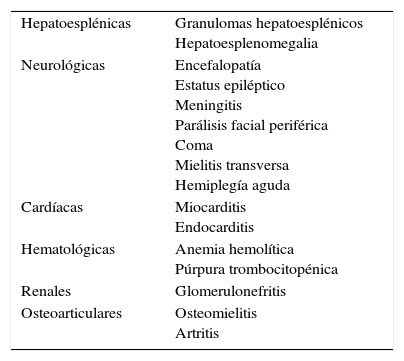
Las presentaciones atípicas o la infección generalizada, excepto en inmunodeprimidos son excepcionales. Se ha relacionado con manifestaciones neurológicas (encefalitis, parálisis facial, mielitis transversa), granulomas hepatoesplénicos, osteomielitis, endocarditis, y fiebre prolongada. Otras manifestaciones clínicas producidas por B. henselae muy pocos frecuentes son: (ver tabla 3). Hay descripto33 un caso de miocarditis luego de un año de haber presentado vitreitis por Bartonella. Se cree que es secundario a una respuesta mediada por el sistema inmune linfocitario35.
Manifestaciones clínicas muy poco frecuentes
| Hepatoesplénicas | Granulomas hepatoesplénicos Hepatoesplenomegalia |
| Neurológicas | Encefalopatía Estatus epiléptico Meningitis Parálisis facial periférica Coma Mielitis transversa Hemiplegía aguda |
| Cardíacas | Miocarditis Endocarditis |
| Hematológicas | Anemia hemolítica Púrpura trombocitopénica |
| Renales | Glomerulonefritis |
| Osteoarticulares | Osteomielitis Artritis |
El diagnóstico es clínico-epidemiológico y se confirma a través de los estudios de laboratorio que incluyen: el cultivo, la pruebas serológicas, y el examen histopatológico de las lesiones.
El cultivo de las muestras de sangre representa el método más sencillo de aislar B. henselae de los pacientes con fiebre recurrente, endocarditis o pelosis bacilar; sin embargo, no todos los pacientes son bacteriémicos. En estos casos se debe aislar la bacteria de los tejidos u órganos afectados. En el caso de los pacientes con EAG sin compromiso sistémico, se prefiere las muestras de los nódulos linfáticos.
Las pruebas serológicas detectan anticuerpos y comprenden la técnica de IFI y ELISA y reacción en cadena de polimerasas (PCR)36. La principal limitación es la aparente falta de especificidad para distinguir entre las diferentes especies de Bartonellas y otras bacterias relacionadas. Además la sensibilidad y la especificidad de ambas técnicas dependen del valor del punto de corte utilizado para considerar el examen como positivo o negativo. En el caso de la IG G anti B. henselae por IFI, con un punto de corte >1/64, la sensibilidad y la especificidad es de 88 y 99%, levemente superior al rendimiento reportado para ELISA 85 y 95%37. La determinación de IG M ha demostrado tener menor sensibilidad que la IG G, ya sea con técnica de ELISA o IFI.
La secuenciación del ADN a través de muestras de los granulomas viscerales requiere de procedimientos caros e invasivos. El estudio microbiológico es complejo y de bajo rendimiento, por tratarse de bacterias nutricionalmente exigentes y de crecimiento lento.
En nuestro paciente el diagnóstico fue confirmado por serología por IFI por aumento de los títulos de IG G.
Habot Wilner38 en su estudio retrospectivo demostró que la tomografía de coherencia óptica (OCT) puede ser una herramienta útil para el diagnóstico y seguimiento de los pacientes con neurorretinitis por EAG ya que permite ver el acúmulo de líquido subretinal incluso antes de que sea detectado clínicamente.
El tratamiento es controversial. Debido a la ausencia de estudios controlados, se desconoce la terapia con antibióticos más adecuados, así como la duración del tratamiento para las distintas manifestaciones clínicas de la infección por B. henselae. Existen varias alternativas, los antibióticos de elección son: trimetroprima-sulfametoxazol, azitromicina, ciprofloxacina, rifampicina, doxiciclina o tetraciclinas39. Con respecto a los corticoides se ha demostrado que su uso no genera ningún impacto en la evolución de la enfermedad40.
La duración recomendada del tratamiento antimicrobiano para EAG es de 5 días41,42 y para la neurorretinitis de 4-6 semanas20. Este esquema parece acortar la evolución de la enfermedad y acelerar la recuperación de la agudeza visual.
Aunque el tratamiento antibiótico en inmunocompetentes es controversial debido a la tendencia a la resolución espontánea, en los inmunodeprimidos está indicado y es eficaz ya que son susceptibles a la enfermedad sistémica. En nuestra paciente la recuperación de la AV fue completa a los 10 días de iniciado el tratamiento con azitromicina 500mg/d vía oral.
ConclusiónFrente a un cuadro de edema papilar en un niño se debe realizar un seguimiento clínico y oftalmológico estricto, dado que la estrella macular que define a la neurorretinitis tarda en aparecer. La neurorretinitis causada por Bartonella es una patología poco frecuente. Ante un cuadro de neurorretinitis la presencia de focos retinitis uni o bilaterales asociados puede ayudarnos a orientar el diagnóstico etiológico hacia una EAG. Es fundamental una correcta anamnesis y una exploración oftalmológica minuciosa investigando dirigidamente los antecedentes de contacto, arañazo o mordedura de gato para el correcto diagnóstico y posterior tratamiento de la enfermedad.
Los veterinarios deberían informar acerca de los riesgos que existen de la infestación de animales con pulgas o garrapatas y tomar medidas de control para evitarlas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.