Se caracterizaron y compararon los aparatos estomáticos de 26 especies de Asteraceae de la Reserva Ecológica del Pedregal de San Ángel, con la hipótesis de que las plantas que habitan en la cuenca de México están respondiendo a los incrementos antropogénicos de CO2 atmosférico con modificaciones en su aparato estomático. Se llevó a cabo la comparación de hojas aclaradas de ejemplares de herbario recolectados antes de la década de los setenta, con ejemplares recolectados en 2009 y 2010 en la misma zona. Los resultados mostraron que la densidad estomática está relacionada negativamente con la longitud de las células guarda (rs=−0.73, p<0.0001), como ha sido observado en otros grupos taxonómicos. Además, se encontraron diferencias significativas (p<0.05) en los aparatos estomáticos de 13 especies; tanto la disminución de la densidad estomática (5 especies) como su incremento (6 especies) está asociado o no a la disminución o aumento de la longitud de las células guarda. Estas modificaciones asociadas a los incrementos de CO2, siguen las tendencias registradas para otros grupos de plantas. En Artemisia ludoviciana, Bidens odorata y Zinnia peruviana no se detectaron modificaciones en las 2 variables evaluadas. Las respuestas estomáticas a los incrementos antropogénicos de CO2 son sumamente variables como lo demuestran los resultados obtenidos para las Asteraceae de la Reserva Ecológica del Pedregal de San Ángel.
The stomatal apparatus of 26 species of Asteraceae inhabiting the Reserva Ecológica del Pedregal de San Ángel, Mexico were characterized and compared under the hypothesis that plants living in the Mexico basin are responding to anthropogenic atmospheric CO2 increments with stomatal modifications. Leaves of herbarium specimens collected before the 70's were removed, cleared, and studied to compare with leaves of individuals collected in 2009 and 2010 in the same area. The results showed that stomatal density is negatively associated to guard cells length (rs=−0.73, p<0.0001) as observed in other taxa. In addition, significant differences (p<0.05) in the stomatal apparatus of 13 species were detected; both decrease (5 species) and increase (6) in stomatal density with or without reducing or increasing guard cell length. These changes associated with increments of CO2 follow the trends found in other groups of plants. No modifications were detected in Artemisia ludoviciana, Bidens odorata, and Zinnia peruviana. Stomatal responses to anthropogenic CO2 increments are highly variable as shown by the results with Asteraceae growing in the Reserva Ecológica del Pedregal de San Ángel.
Los estomas son aperturas especializadas de la epidermis foliar que participan en el intercambio gaseoso entre la atmósfera y los espacios aéreos internos. Su principal función es permitir la entrada de la cantidad suficiente de CO2 para optimizar la fotosíntesis y preservar la mayor cantidad posible de agua (Willmer y Fricker, 1996). Desde el siglo pasado se ha demostrado que las modificaciones de la fotoquímica ambiental tienen efectos sobre la supervivencia y adecuación de las especies vegetales (Woodward, 1987; Jarvis, 1989; Chen et al., 2001; McAinsh et al., 2001; Beerling y Royer, 2002; Dimitrova y Yurukova, 2005). En particular el aumento en las concentraciones atmosféricas de CO2 induce modificaciones en el aparato estomático, las cuales varían en intensidad y dirección, dependiendo de la especie y el periodo de exposición (McAinsh et al., 2001; Bruno et al., 2007). La respuesta al aumento de CO2 atmosférico más común encontrada hasta ahora es la reducción en la densidad estomática (Woodward, 1987; Tricker et al., 2005), pero en otras especies se han registrado incrementos (Ferris y Taylor, 1994; Dimitrova y Yurukova, 2005) o ninguna modificación (Bettarini et al., 1998; Reddy et al., 1998). La evidencia fósil indica que desde el Devónico temprano y Carbonífero (McElwain y Chaloner, 1995), el Triásico, el Jurásico y el Cretácico (Chen et al., 2001; Royer, 2001) hasta el Neógeno (Beerling y Chaloner, 1993; Van Der Burgh et al., 1993; Kürschner et al., 1996; Royer, 2001; Finsinger y Wagner-Cremer, 2009) ha prevalecido una tendencia a disminuir la densidad estomática en las especies cuando aumenta la concentración de CO2 atmosférico.
La densidad estomática definida como el número de estomas por unidad de área, varía significativamente entre hojas de un mismo individuo, entre individuos y entre especies, y es sensible al estado de maduración de la hoja, composición genética y factores ambientales (Willmer y Fricker, 1996). Además, parece estar correlacionada con otros rasgos foliares, como es el área foliar específica (Loranger y Shipley, 2010). El área foliar específica también es sensible a los cambios en la concentración atmosférica de CO2; por ejemplo, con un incremento en la concentración de CO2 hay un decremento del área foliar específica (Peñuelas y Matamala, 1990; Garbutt et al., 1990).
Desde la Revolución Industrial, el incremento en la concentración de CO2 atmosférico, mayoritariamente se atribuye a la quema de combustibles fósiles. A nivel mundial, de 1959 y hasta 1968 la tasa de incremento anual de concentraciones de CO2 era de 0.81ppm, de 1969 a 1978 la tasa de incremento anual fue de 1.24ppm, mientras que de 1999 a 2008 fue de 1.91ppm (Mauna Loa Observatory, 2010). En México, las emisiones totales de CO2 en 1990 fueron de 444 489Gg (Anónimo, 1999), mientras que para el 2002 se incrementaron a 480 409Gg (Anónimo, 2008). Además, México se ubica entre los 12 países con mayores emisiones de CO2 a escala mundial, ya que contribuye con cerca del 1.5% de las emisiones mundiales de gases de efecto invernadero (GEI) (Anónimo, 2008); de dicha contribución, se estima que para 2006 la contribución de la zona metropolitana de la cuenca de México fue de 6.7% de las emisiones nacionales de GEI (43.4millones de toneladas equivalentes de CO2). Las delegaciones Benito Juárez, Coyoacán, Cuauhtémoc y Miguel Hidalgo son las que concentran la mayor cantidad de emisiones (Anónimo, 2008). En la cuenca de México han ocurrido modificaciones drásticas en la composición atmosférica desde la década de los setenta (Fenn et al., 2002); allí mismo se han registrado en las especies vegetales cambios a nivel estructural (Terrazas y Bernal-Salazar, 2002). Este trabajo plantea la hipótesis de que el aparato estomático de las especies de Asteraceae en la Reserva Ecológica del Pedregal de San Ángel (REPSA), ubicada en la delegación Coyoacán y con altos índices de emisiones, se ha modificado con los incrementos antropogénicos del CO2 atmosférico. El objetivo del estudio fue evaluar las posibles modificaciones en el aparato estomático de 26 especies de Asteraceae, al comparar muestras de hojas actuales con las disponibles en ejemplares de herbario recolectados antes de la década de los setenta (pasado), fecha en que los registros de la composición atmosférica de la cuenca de México indican cambios substanciales (Fenn et al., 2002). También se evaluó si la distribución de las especies dentro de la REPSA (en el borde o en el interior) puede ser un factor importante en la resistencia al aumento de CO2 atmosférico.
Materiales y métodosSe seleccionaron 26 especies de Asteraceae de la REPSA pertenecientes a 19 géneros que estuvieran presentes tanto en la reserva (actuales) como en el Herbario Nacional de México (pasado). Se recolectaron 3 individuos por especie durante 2009 y 2010, cuidando de remover hojas maduras completamente desarrolladas alejadas de las inflorescencias. En el Herbario Nacional (MEXU) se seleccionaron aquellos ejemplares colectados antes de 1970 dentro del área que actualmente corresponde a la REPSA (Apéndice). Por cuestiones de preservación de los ejemplares históricos, únicamente fue posible remover una hoja por individuo de un máximo de 2 individuos por especie.
Laboratorio. Las muestras de campo se fijaron en formaldehído-ácido acético glacial-alcohol etílico (Ruzin, 1999) y se lavaron con agua corriente antes de someterse al proceso de aclaramiento con solución de NAOH del 20% a 60°C por 12h, seguido de un lavado con hipoclorito de sodio (clorox comercial) al 50% por varios minutos, hasta obtener un color blanquecino. Enseguida se lavaron y sometieron a una deshidratación en una serie de concentración ascendente de alcohol (50–96%). Las hojas permanecieron 24h en cada cambio y, posteriormente se colocaron de 2 a 90 días en una solución aclaradora BB1/4 modificada (Martínez-Cabrera et al., 2007) hasta que las láminas estuvieran completamente translúcidas. Una vez aclaradas las hojas, se colocaron en alcohol al 96% hasta eliminar los remanentes de la solución aclaradora y se continuó con la tinción con safranina alcohólica durante una hora; se deshidrataron con xilol durante 24h y finalmente se montaron en resina sintética. Este procedimiento se usó para las hojas removidas de ejemplares de herbario, donde las láminas secas se sumergieron en la solución de NAOH al 20% bajo las mismas condiciones que las actuales.
A partir de material fresco se determinó el área foliar de 5 hojas por especie, con ayuda del analizador de imágenes (ImageProPlus versión 6.1, Media Cybernetics). Posteriormente, las hojas fueron deshidratadas en la estufa (a 65°C por 48h) y pesadas en una balanza analítica. Con estos datos se calculó el área foliar específica por especie (AFE= AF/ MSH; donde: AFE= área foliar específica, AF= área foliar y MSH= masa seca de la hoja; Garnier et al., 2001). Debido a las limitaciones de material de herbario no fue posible calcular el área y la masa foliar.
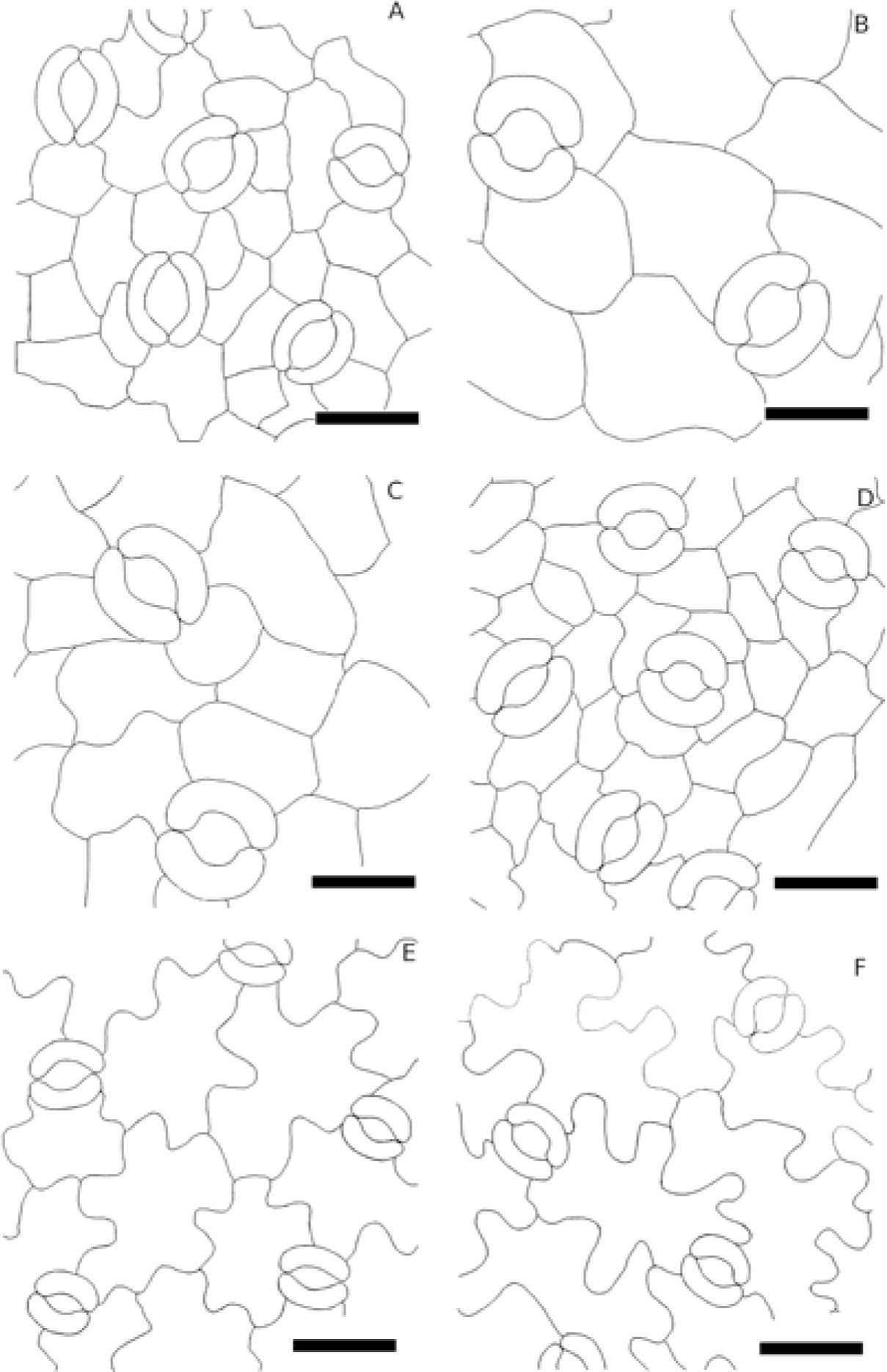
En la superficie abaxial de todas las hojas aclaradas se realizaron 50 mediciones del largo de la célula guarda y 25 conteos de un milímetro cuadrado por individuo por especie y se tomaron fotografías para ilustrar su aparato estomático con un analizador de imágenes. La información referente a la posición de las plantas dentro de la reserva se obtuvo de Céspedes (2010), que refiere que existen especies distribuidaspreferentemente en el borde (cerca de las vías de comunicación) o en el interior de la reserva (más de 10m de las vías de comunicación).
Se realizaron análisis de correlación de Pearson y Spearman para identificar el sentido de la asociación entre largo de la célula guarda, densidad de estomas, área foliar específica y posición dentro de la REPSA. Para detectar diferencias entre especies y entre tiempo de recolecta (actual vs. pasado) por especie, se practicó un análisis de varianza del modelo general lineal con el programa estadístico SAS (SAS Institute, 2008).
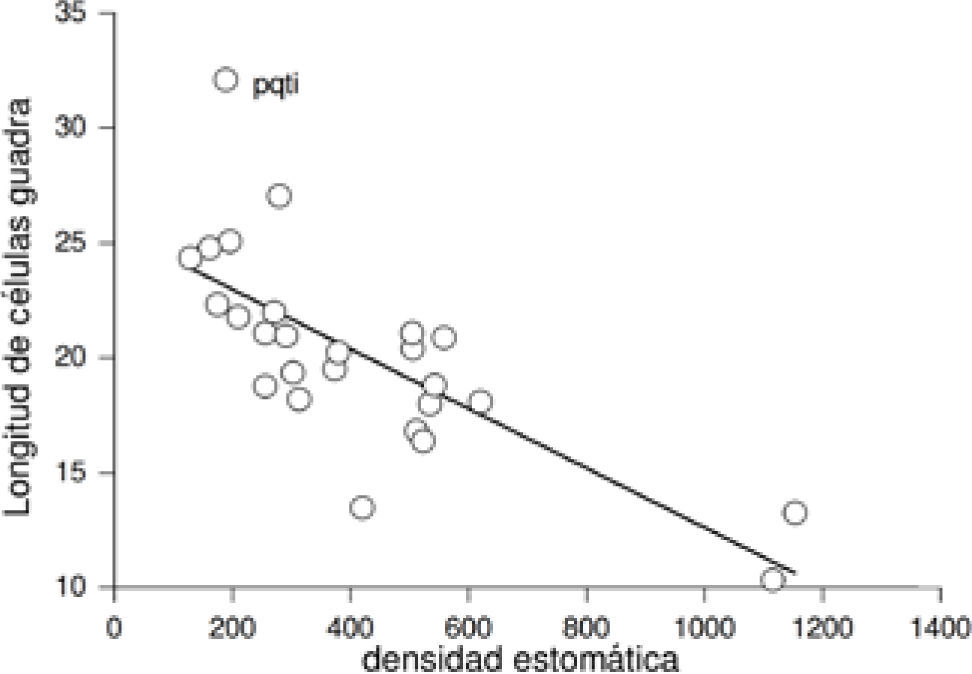
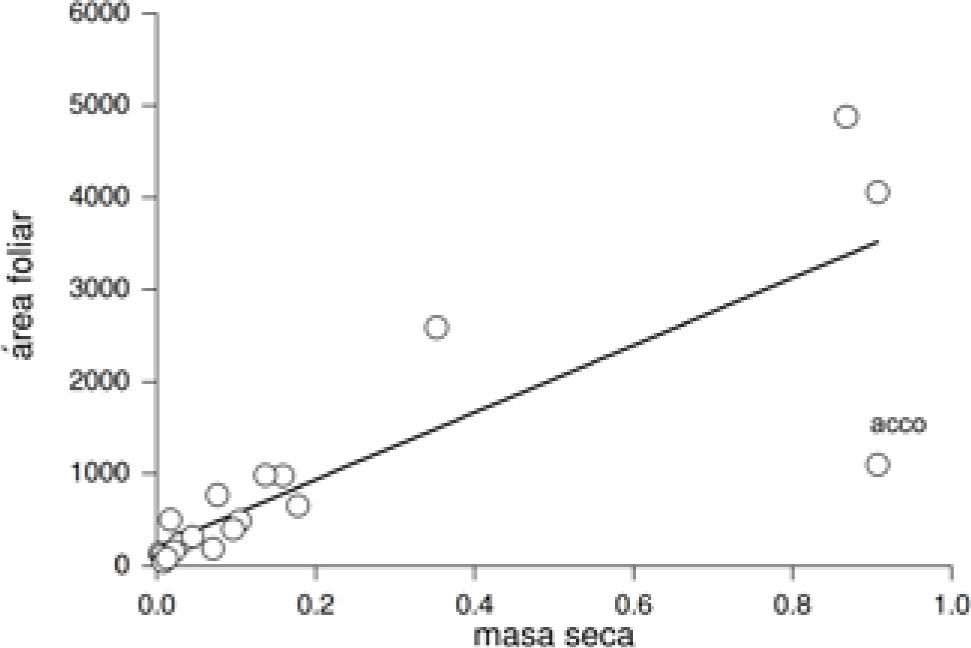
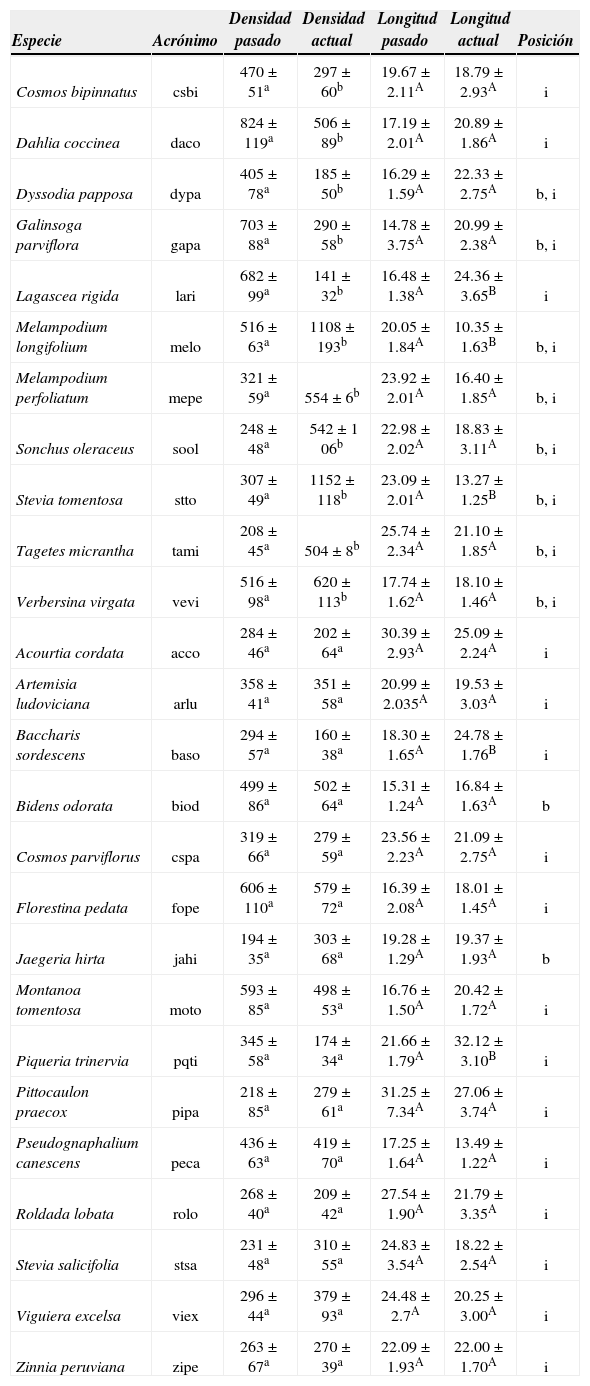
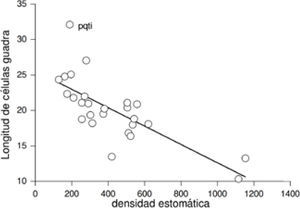
ResultadosCorrelación entre variables. Los análisis de correlación aplicados a las muestras actuales y del pasado mostraron una asociación negativa y significativa entre la densidad estomática y la longitud de las células guarda (rs=−0.73, p<0.0001, n=73 [Fig. 1], rs=−0.71, p<0.0001, n=51, respectivamente). La densidad estomática de las plantas actuales se relacionó positivamente con el área foliar específica (rs=0.23, p<0.05, n=61), pero no con el área foliar (rs=−0.095, p=0.46, n=61). Asimismo, se encontró una relación positiva y significativa entre la masa seca y el área foliar (r=0.82, p<0.0001, n=61, Fig. 2) y una relación positiva y significativa entre el área foliar específica y la posición de la especie dentro de la reserva (rs=0.51, p<0.001, n=61). El área foliar específica se encontró relacionada de forma negativa y significativa con la masa seca de la hoja (rs=−0.60, p<0.0001, n=61) y con el hábito de la planta (rs=−0.50, p<0.0001, n=61).
Relación entre densidad estomática y longitud de las células guarda en las Asteraceae de la REPSA actuales (Acrónimo de la especie en el Cuadro 1).
Relación entre área foliar y masa seca de las láminas de las hojas en las Asteraceae de la REPSA actuales (Acrónimo de la especie en el Cuadro 1).
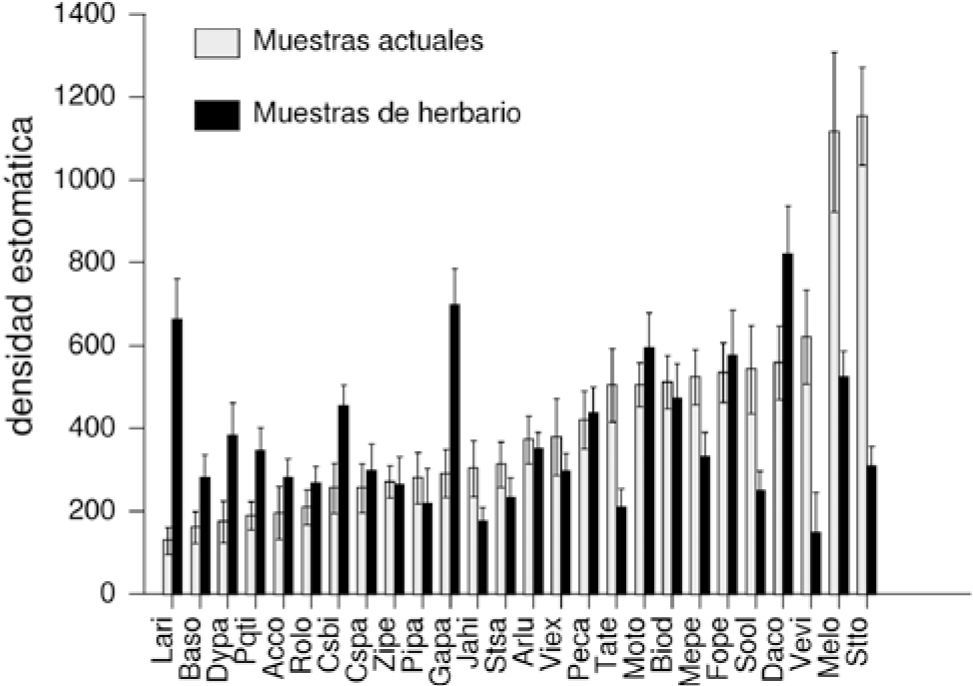
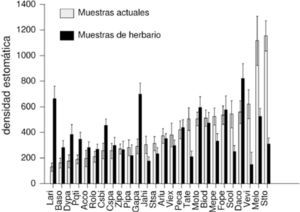
Comparación entre especímenes actuales y pasados. El análisis de varianza demostró que existen diferencias significativas para la densidad estomática de la misma especie entre los especímenes recolectados actualmente y en el pasado (F=71.43; p<0.0001; n=52). Los resultados mostraron que ocurrió al menos un cambio estadísticamente significativo en el aparato estomático de 13 especies (Cuadro 1, Fig. 3). En 5 especies (Cosmos bipinnatus, Dalia coccinea, Dyssodia papposa, Galinsoga parviflora y Lagascea rigida) disminuyó su densidad estomática; en 6 especies (Melampodium longifolium, M. perfoliatum, Sonchus oleraceus, Stevia tomentosa, Tagetes micrantha y Verbesina virgata) aumentó y en 7 no se observaron modificaciones estadísticamente significativas, pero en algunos casos las desviaciones estándar son muy amplias (Cuadro 1, Fig. 4).
Comparación de la densidad estomática y la longitud de las células guarda por especie para el pasado y presente de especies de la REPSA. Se presenta la media ± una desviación estándar. Letras diferentes indican diferencias significativas (p<0.05) entre especies para la densidad estomática (minúsculas) y la longitud de las células guarda (mayúsculas). i= especies observadas en el interior de la reserva; b= especies observadas en los bordes de la reserva. Las especies se ordenan por grupos donde se observó disminución de la densidad estomática, aumento de la densidad estomática y especies sin cambios en la densidad estomática
| Especie | Acrónimo | Densidad pasado | Densidad actual | Longitud pasado | Longitud actual | Posición |
|---|---|---|---|---|---|---|
| Cosmos bipinnatus | csbi | 470±51a | 297±60b | 19.67±2.11A | 18.79±2.93A | i |
| Dahlia coccinea | daco | 824±119a | 506±89b | 17.19±2.01A | 20.89±1.86A | i |
| Dyssodia papposa | dypa | 405±78a | 185±50b | 16.29±1.59A | 22.33±2.75A | b, i |
| Galinsoga parviflora | gapa | 703±88a | 290±58b | 14.78±3.75A | 20.99±2.38A | b, i |
| Lagascea rigida | lari | 682±99a | 141±32b | 16.48±1.38A | 24.36±3.65B | i |
| Melampodium longifolium | melo | 516±63a | 1108±193b | 20.05±1.84A | 10.35±1.63B | b, i |
| Melampodium perfoliatum | mepe | 321±59a | 554±6b | 23.92±2.01A | 16.40±1.85A | b, i |
| Sonchus oleraceus | sool | 248±48a | 542±1 06b | 22.98±2.02A | 18.83±3.11A | b, i |
| Stevia tomentosa | stto | 307±49a | 1152±118b | 23.09±2.01A | 13.27±1.25B | b, i |
| Tagetes micrantha | tami | 208±45a | 504±8b | 25.74±2.34A | 21.10±1.85A | b, i |
| Verbersina virgata | vevi | 516±98a | 620±113b | 17.74±1.62A | 18.10±1.46A | b, i |
| Acourtia cordata | acco | 284±46a | 202±64a | 30.39±2.93A | 25.09±2.24A | i |
| Artemisia ludoviciana | arlu | 358±41a | 351±58a | 20.99±2.035A | 19.53±3.03A | i |
| Baccharis sordescens | baso | 294±57a | 160±38a | 18.30±1.65A | 24.78±1.76B | i |
| Bidens odorata | biod | 499±86a | 502±64a | 15.31±1.24A | 16.84±1.63A | b |
| Cosmos parviflorus | cspa | 319±66a | 279±59a | 23.56±2.23A | 21.09±2.75A | i |
| Florestina pedata | fope | 606±110a | 579±72a | 16.39±2.08A | 18.01±1.45A | i |
| Jaegeria hirta | jahi | 194±35a | 303±68a | 19.28±1.29A | 19.37±1.93A | b |
| Montanoa tomentosa | moto | 593±85a | 498±53a | 16.76±1.50A | 20.42±1.72A | i |
| Piqueria trinervia | pqti | 345±58a | 174±34a | 21.66±1.79A | 32.12±3.10B | i |
| Pittocaulon praecox | pipa | 218±85a | 279±61a | 31.25±7.34A | 27.06±3.74A | i |
| Pseudognaphalium canescens | peca | 436±63a | 419±70a | 17.25±1.64A | 13.49±1.22A | i |
| Roldada lobata | rolo | 268±40a | 209±42a | 27.54±1.90A | 21.79±3.35A | i |
| Stevia salicifolia | stsa | 231±48a | 310±55a | 24.83±3.54A | 18.22±2.54A | i |
| Viguiera excelsa | viex | 296±44a | 379±93a | 24.48±2.7A | 20.25±3.00A | i |
| Zinnia peruviana | zipe | 263±67a | 270±39a | 22.09±1.93A | 22.00±1.70A | i |
Media y desviación estándar de la densidad estomática entre las especies de Asteraceae de la REPSA. Gris claro= pasado, gris obscuro= actual. (Acrónimos de las especies en el Cuadro 1).
Tamaño de las células guarda. El análisis de varianza mostró que existen diferencias para la longitud de las células guarda (F=49.48; p>0.0001; n=124). Una disminución en la longitud de las células guarda se registró en 2 especies (M. perfoliatum y S. tomentosa), en 3 especies (Baccharis sordescens, L. rigida y Piqueria trinervia) se presentó un aumento y 21 no presentaron cambios estadísticamente significativos (Cuadro 1, Fig. 3).
DiscusiónCorrelación entre variables. La relación negativa entre la densidad estomática y la longitud de las células guarda ha sido reportada para otros grupos de plantas (Willmer y Fricker, 1996; Kundu y Tigerstedt, 1998; Zarinkamar, 2006, 2007) y los resultados de este estudio apoyan dicha relación con las especies de Asteraceae de la REPSA estudiadas. Las correlaciones encontradas en este estudio entre masa seca-área foliar y área foliar específicamasa seca son consistentes con las registradas por Liu et al. (2008) para 23 especies de plantas de China. Los resultados sugieren que esta relación es constante para plantas recolectadas en la misma localidad bajo las mismas condiciones ambientales.
Se ha propuesto que la densidad estomática está relacionada con otros rasgos foliares como el área de la lámina (Gupta, 1961) y el área foliar específica (Loranger y Shipley, 2010). Los resultados de este estudio indican que la relación entre la densidad estomática y el área foliar no es significativa, pero la densidad estomática sí presenta una relación estadísticamente significativa con el área foliar específica. Es posible suponer que la relación entre la densidad estomática y el área foliar no es significativa debido a que es un valor absoluto muy variable, puesto que las asteráceas del pedregal presentan hojas de tamaños muy pequeños como en el caso de T. micrantha, hasta hojas de varios centímetros de área como Roldana lobata. Por otra parte, el área foliar específica es una medida compuesta que expresa la proporción de masa seca por área de la hoja, de esta manera la variación se reduce.
Es importante conocer la relación que existe entre estos rasgos foliares de las Asteraceae del Pedregal de San Ángel, puesto que los factores que modifican a la densidad estomática pueden estar afectando también al área foliar específica. Varios autores han sugerido que el área foliar específica está relacionada con algunos atributos ecológicos de la planta como el hábito y la fenología (Castro-Díez et al., 2000; Antúnez et al., 2001) y que dicha relación puede deberse a la proporción de tejidos esclerificados (Castro-Díez et al., 2000), de tal forma que las especies con poca proporción de esclerénquima tendrán una mayor área foliar específica en comparación con especies con una mayor proporción de esclerénquima. Para el caso de las Asteraceae de la REPSA, las correlaciones encontradas indican que las plantas que se encuentran en el borde de la reserva tienen una mayor área foliar específica que las plantas del interior. Lo anterior podría ser indicativo de que las especies del borde tienen una mayor cantidad de esclerénquima que podría ser una adaptación ecológica importante, ya que se encuentran expuestas a una mayor cantidad de luz y a una mayor desecación.
Los resultados de los análisis de correlación apoyan los argumentos de que existe una relación entre las variables más comúnmente medidas para estudiar los efectos de la contaminación atmosférica en las plantas (densidad y longitud de estomas y área foliar específica). Sería importante considerar otras variables anatómicas y ecológicas en futuros estudios para tener una mejor representación de los caracteres foliares que pueden ser modificados por la contaminación atmosférica y que hasta ahora no han sido considerados, como el contenido de masa seca foliar o el grosor del mesofilo.
Comparación entre especímenes actuales y del pasado Densidad estomática. Woodward (1987) demostró mediante el estudio comparativo de las densidades estomáticas de hojas de árboles recolectados a lo largo de 200 años y almacenados como ejemplares de herbario, que los cambios en los niveles de CO2 atmosférico a lo largo del tiempo afectan las densidades estomáticas de varias especies que no están filogenéticamente relacionadas. A partir de dicha publicación se ha evaluado el efecto del incremento de CO2 en el aparato estomático de un mayor número de especies, registrándose patrones contrastantes. Por ejemplo, Sánchez-Espino et al. (2000) encontraron que plantas de Phaseolus vulgaris L. disminuyeron significativamente su densidad estomática al someterse a altas concentraciones de CO2, en tanto que en el mismo experimento las plantas de Zea mays L. no modificaron su densidad estomática al aumentar el CO2.
La respuesta más común del aparato estomático al aumento de CO2 atmosférico es la disminución de la densidad estomática (Woodward, 1987; Peñuelas y Matamala, 1990; Woodward y Kelly, 1995; Woodward y Lake, 2008). El decremento en la densidad estomática se encontró también para 5 de las especies de la reserva (C. bipinnatus, D. coccinea, D. papposa, G. parviflora y L. rigida). C. bipinnatus, D. coccinea y L. rigida son hierbas perennes que se encuentran localizadas generalmente al interior de la reserva. Por su parte, D. papposa y G. parviflora son hierbas anuales cuya localización en la REPSA es tanto en el interior como en el borde. Al parecer no existe una relación clara entre su permanencia y su distribución en la REPSA.
El aumento en la densidad estomática es una respuesta que ha sido registrada tanto en Plantago lanceolata L. (Dimitrova y Yurukova, 2005) como en Ligustrum lucidum Aiton (Bruno et al., 2007) y en 6 especies de asteráceas de la REPSA. En la reserva, M. longifolium, M. perfoliatum, S. oleraceus y T. micrantha son hierbas anuales; S. tomentosa es una hierba perenne y V. virgata es un arbusto. A estas especies se les encuentra tanto en sitios en el interior (10m o más adentro del borde) o en los bordes de la reserva (Cuadro 1). Sería importante conocer su fenología, con la finalidad de evaluar si ellas se presentan al inicio o final de la temporada de lluvia y, por lo tanto, no existe un efecto de los cambios de la fotoquímica de la cuenca de México en ellas.
En 12 especies no se encontraron modificaciones del aparato estomático estadísticamente significativas. Sin embargo, nuestras observaciones al microscopio nos permitieron apreciar cambios en los aparatos estomáticos de al menos 9 especies (Acourtia cordata, B. sordescens, Jaegeria hirta, Montanoa tomentosa, P. trinervia, Pittocaulon praecox, R. lobata, S. salicifolia, Viguiera excelsa). En estas especies la media de la densidad estomática por especie es diferente para plantas actuales y del pasado, aunque las desviaciones estándar son amplias y se sobreponen (Fig. 4). El traslape de las desviaciones estándar quizás esté evidenciando la plasticidad en el número de estomas que manifiestan estas especies de Asteraceae en la REPSA. Una hipótesis alternativa es que se requiere más tiempo para observar mayores modificaciones, o bien, así es la forma en que las especies se están adaptando a la cambiante fotoquímica ambiental.
Artemisia ludoviciana, Bidens odorata, Pseudognaphalium canescens y Zinnia peruviana no mostraron modificaciones en la densidad estomática. Este patrón continuo a lo largo del tiempo también ha sido registrado previamente por Bettarini et al. (1998) para 14 especies en la porción central de Italia y para Gossypium hirsutum L. (Reddy et al., 1998). Reddy y colaboradores (1998) señalan que algunas especies no responden al aumento de CO2 a mediano y largo plazos con modificaciones en el aparato estomático, pero podrían estar respondiendo con modificaciones a niveles más internos de la hoja o con cambios en su fisiología. Por lo tanto, estas 4 especies de Asteraceae son candidatas para llevar a cabo estudios de ultraestructura del cloroplasto o de ecofisiología, con la finalidad de evaluar las ideas propuestas por estos autores.
Longitud de las células guarda. En pocos trabajos se ha evaluado el efecto de los contaminantes atmosféricos sobre el tamaño de las células que conforman la epidermis (Dimitrova y Yurukova, 2005; Bruno et al., 2007; Rai et al. 2010). Como ya se indicó, dichos estudios se enfocan principalmente a evaluar la respuesta de la densidad estomática con el aumento de CO2 atmosférico. Sin embargo, debido al escalamiento positivo entre densidad y tamaño de los estomas, se esperarían también modificaciones en la longitud de las células oclusivas debido a los cambios atmosféricos.
Dimitrova y Yurukova (2005) y Rai et al. (2010) señalan que por efecto de los contaminantes atmosféricos como las partículas suspendidas, los metales pesados y los óxidos de azufre y nitrógeno, se producen alteraciones en el desarrollo de los estomas ya sea provocando deformaciones en las células guarda o, más frecuentemente, disminuyendo de tamaño comparadas con plantas de la misma especie que se encuentran creciendo en sitios poco o nada contaminados.
Dada el área de una hoja, existe un número limitado de células de cierto tamaño que puede ocupar tal área; esto es válido tanto para células guarda como para células epidérmicas ordinarias. Por lo tanto, con base en el escalamiento negativo encontrado entre la densidad estomática y la longitud de las células guarda, se esperaba que las especies que disminuyeran su densidad estomática aumentaran la longitud de sus células guarda y viceversa. Este patrón no se cumple en todos los casos para las especies de Asteraceae de la REPSA. Por ejemplo, para las especies que disminuyeron su densidad, sólo L. rigida aumentó su longitud significativamente (p<0.0001); en C. bipinnatus no se observa ningún cambio en la longitud; en las otras especies (D. coccinea, D. papposa, G. parviflora) las diferencias no son estadísticamente significativas, pero se observó una tendencia a aumentar su longitud. M. longifolium y S. tomentosa son especies que aumentaron su densidad estomática, pero disminuyeron la longitud de las células guarda significativamente (p<0.0001). Por otra parte, M. perfoliatum, S. oleraceus y T. micrantha muestran también una tendencia a la reducción en el tamaño de las células guarda.
Se ha registrado que la densidad estomática y la longitud de las células guarda están relacionadas con la conductancia estomática y la fotosíntesis neta, así como con otras características fisiológicas de la planta (Kundu y Tigerstedt, 1998; Xu y Zhou, 2008). En consecuencia, es posible suponer que las modificaciones del aparato estomático encontradas en este estudio están afectando la fisiología de las plantas y provocando los ajustes anatómicos del aparato estomático. Estas modificaciones seguramente permiten a las plantas mantener un nivel adecuado de eficiencia fotosintética.
En la mayoría de las especies la longitud de las células guarda es diferente para plantas recolectadas recientemente y del pasado, pero como ocurre con la densidad estomática, sus desviaciones estándar se sobreponen. Este traslapo de las desviaciones estándar probablemente sea explicado por la plasticidad fenotípica de las especies. En algunos casos, como en A. cordata, se observó una reducción tanto de la densidad estomática como de la longitud de las células guarda. Por el contrario, en A. ludoviciana, B. odorata y Z. peruviana no hay cambios evidentes en la longitud de las células guarda, lo cual es consistente con el hecho de que no hubiera tampoco modificaciones en su densidad estomática. B. odorata y Z. peruviana son 2 hierbas anuales que crecen en el borde y en el interior de la reserva, respectivamente; podría suponerse que el aumento de CO2 no les afecta tanto debido a su ciclo de vida corto. Por otra parte, A. ludoviciana es una hierba perenne que crece en el interior de la reserva y sería importante evaluar si otros caracteres de la planta, como por ejemplo la pubescencia de las hojas, ayudan a atenuar el efecto del CO2 sobre el aparato estomático.
Los aparatos estomáticos de 13 de 26 especies de Asteraceae de la REPSA se han modificado a lo largo de 40 años. Debido a que estas modificaciones no pueden atribuirse a cambios macroambientales, como la posición geográfica o el tipo de material parental, es razonable suponer que son resultado de la fotoquímica atmosférica que se ha modificado substancialmente en la cuenca de México, al contener una megaciudad con altos niveles de contaminación. La respuesta estomática a los incrementos antropogénicos de CO2 es variable, como lo demuestran los resultados obtenidos. La acción conjunta de factores fisiológicos, ambientales (como la disponibilidad de agua y la exposición a la radiación) e intrínsecos de las especies (genéticos, del ciclo de vida y de la arquitectura de la planta) pueden de manera sinérgica ayudar a la planta a responder a estos cambios en la fotoquímica atmosférica.
A pesar de la variabilidad encontrada, los resultados son comparables con las tendencias reportadas por otros autores para diversos grupos de plantas. Se observó que la disminución de la densidad estomática se acompaña de modificaciones en la longitud de las células guarda. En el caso de las especies que no presentaron modificaciones, sería importante llevar a cabo estudios adicionales que consideren un mayor número de variables anatómicas que también podrían estar siendo afectadas por la contaminación atmosférica. De esta manera, se podrá descartar convincentemente que los cambios atmosféricos provocados por las actividades humanas no modifican la estructura anatómica de las plantas en la cuenca de México.
Agradecemos el apoyo al proyecto Niveles de poliploidía en las Asteraceae de la Reserva Ecológica del Pedregal de San Ángel, Ciudad Universitaria, México, Distrito Federal (PAPIIT IN214408), por parte del programa Apoyo a Proyectos de Investigación e Innovación Tecnológica. También agradecemos a la dirección de la REPSA las facilidades para llevar a cabo los recorridos y las recolectas de las Asteraceae; a Leonardo Céspedes, Óscar Hinojosa y Enrique Ortiz por su ayuda en la recolecta del material aquí utilizado.
Ejemplares de herbario utilizados en este estudio (todos ellos depositados en el Herbario Nacional de México (MEXU) Instituto de Biología, Universidad Nacional Autónoma de México.
Acourtia cordata (Cerv.) B. L. Turner.: O. Hinojosa 442, C. G. Pringle 4 360.
Artemisia ludoviciana Nutt.: N. Diego 805, O. Hinojosa 443, H. Kruse 2 687.
Baccharis sordescens D.C.: R. Hernández 2 399, O. Hinojosa 222.
Bidens odorata Cav.: D. B. Gold 631, 632; O. Hinojosa 518, F. Soto 140.
Cosmos bipinnatus Cav.: O. Hinojosa 440, Matuda 19 449.
Cosmos parviflorus (Jacq.) Pers.: O. Hinojosa 439, C. G. Pringle 6 572.
Dahlia coccinea Cav.: F. A. Barkley y J. B. Pacson 515, O. Hinojosa 446, Matuda 19 484.
Dyssodia papposa (Vent.) A.S. Hitchc.: L. Céspedes 206, N. Diego 590, N. Diego 604, O. Hinojosa 471.
Florestina pedata (Cav.) Cass.: A. Cronquist 10 316-1/2, L. Céspedes 203, O. Hinojosa 470, E. Lyones 239, E. Lyones 177.
Galinsoga parviflora Cav.: N. Diego 211; O. Hinojosa 475.
Jaegeria hirta (Lag.) Less.: O. Hinojosa 372, C. G. Pringle 7 349; F. Soto 176.
Lagascea rigida (Cav.) Stuessy: A. Cronquist 10 315-1/2, S. Fuentes 50 245, O. Hinojosa 483.
Melampodium longifolium Cerv. ex Cav.: C. G. Pringle 6 455, F. Soto 227.
Melampodium perfoliatum Kunth.: N. Diego 209, O. Hinojosa 460, F. Soto 230, Urbina 274.
Montanoa tomentosa Cerv.: A. Gómez-Pompa 122, O. Hinojosa 369, F. Miranda 707, F. Soto 556, F. Soto 593, F. Soto 607.
Piqueria trinervia Cav.: Matuda 19 454, O. Hinojosa 216, F. Soto 205.
Pittocaulon praecox (Cav.) H. Rob. et Brettell.: O. Hinojosa 505, Matuda 26 149, M. Nee 203.
Pseudognaphalium canescens (D.C.) Anderb.: O. Hinojosa 484, Lyonnet 1 685.
Roldana lobata La Llave: O. Hinojosa 448, Lyonnet 219.
Sonchus oleraceus L.: D. B. Gold 641, O. Hinojosa 456.
Stevia salicifolia Cav.: L. Céspedes 638, D. B. Gold 601, O. Hinojosa 498, Matuda 19 464, F. Soto 49.
Stevia tomentosa Kunth.: D. B. Gold 608, O. Hinojosa 433, F. Soto 149.
Tagetes micrantha Cav.: N. Diego 389, O. Hinojosa 434, Miranda 701.
Verbesina virgata Cav.: O. Hinojosa 437, E. Lyonnet 828, F. Miranda 14, F. Soto 219.
Viguiera excelsa (Willd.) Benth. et Hook. f.: O. Hinojosa 370, E. Lyonnet 559.
Zinnia peruviana (L.) L.: O. Hinojosa 508, Miranda 715, C. G. Pringle 6 520.