La técnica híbrida PET/CT ha experimentado un notable desarrollo en los últimos años, y sus indicaciones se han extendido más allá del área oncológica. El radiotrazador más utilizado es la F18-fluorodeoxiglucosa (F18-FDG), aunque una serie de nuevos radiofármacos han sido sintetizados mostrando alto rendimiento diagnóstico en ciertas patologías especificas. El presente artículo describe brevemente la utilidad clínica actual del PET/CT y los diferentes radiotrazadores disponibles, tanto en el área oncológica como no oncológica.
PET/CT hybrid image has undergone an important development in last years, and its indications spread beyond oncological area. F18-FDG is the most used radiotracer, but several others new tracers have been synthesized, showing high diagnosis accuracy in some specific situations. The present paper describes briefly the current clinical utility of PET/CT and the different radiotracers available for oncological and non oncological conditions.
Desde su implementación como técnica híbrida a fines de la década del 90‘, el PET/CT (Positron Emission Tomography/Computed Tomography) ha experimentado un crecimiento exponencial en su uso clínico, comandado por el área oncológica donde ha demostrado gran utilidad al evaluar la actividad biológica de la neoplasia más allá de sus características morfológicas, y al anticipar la respuesta al tratamiento y la ocurrencia de recidiva respecto a los métodos basados en el cambio de tamaño de las lesiones en controles sucesivos (1). El gran avance de la técnica híbrida en esta materia, ha opacado en cierta medida su desarrollo en otras áreas en la que resulta igualmente útil, tales como estudios neurológicos y cardiológicos.
El objetivo de este artículo es hacer una puesta al día de las indicaciones actuales del PET/CT, considerando la disponibilidad actual de radiofármacos en nuestro medio.
Desarrollo del PET/CTSi bien la imagen proporcionada por el PET representó un gran avance respecto a las imágenes cintigráficas de un solo fotón (cintigrafía, SPECT) en cuanto a una mejor resolución espacial y calidad de imagen, y la posibilidad de cuantificar de manera más precisa la captación, su incapacidad de localizar adecuadamente las lesiones y de reconocer algunos procesos benignos hipercaptantes -fuente de falsos positivos-, retrasó su desarrollo en la práctica clínica.
La aparición de la técnica híbrida PET/CT permitió mejorar su rendimiento al aportar información anatómica al estudio metabólico, y acortar los tiempos de adquisición, reafirmando la tremenda utilidad de esta técnica particularmente en el área oncológica. Fue posible con esto reconocer “anatómicamente” las lesiones y su relación con estructuras vecinas, y evitar falsos positivos determinados por captación fisiológica de ciertos tejidos como la “grasa parda” y por lesiones traumáticas o inflamatorias fáciles de reconocer con la tomografía computada.
Por otro lado, el desarrollo de nuevos radiotrazadores ha potenciado el uso del PET/CT especialmente en el SNC, con capacidad de estudiar distintos sistemas de neurotransmisores y receptores como Dopamina, Serotonina, Acetilcolina, Benzodiezepinas, GABA, entre otros, con amplio uso en el área de la investigación, aunque con utilidad más limitada en el ámbito clínico.
En efecto, aproximadamente el 10-30% de los PET/CT son de indicación no oncológica, principalmente patologías del SNC y estudios cardiológico de perfusión-viabilidad miocárdica. La Tabla 1 muestra un resumen de los radiofármacos disponibles en nuestro medio y sus aplicaciones clínicas.
Pet cerebral
| Radiofármaco | Indicación | Preparación del paciente |
|---|---|---|
| F18-FDG | Indicaciones - Diagnóstico diferencial de demencias - Estudio preoperatorio de epilepsia focal - Evaluación de otros cuadros epilépticos - Daño por drogas - Control de tratamiento | Ayunas 6 hrs Glicemia < 200 mg;/dl Contraindicaciones: Embarazo |
| F18-FLT (Fluorotimidina) | Marcador de proliferación celular - Caracterización de tumores primarios cerebrales - Evaluación respuesta a tratamiento | No requiere ayunas Contraindicaciones: Embarazo |
| F18-Fallypride | Estudio de receptores de dopamina D2 - Enfermedad de Parkinson - Evaluación sistema nigroestriado | No requiere ayunas Contraindicaciones: Embarazo |
| F18-Fluoro-L-DOPA (Fluorodihydroxyphenylalanine) | Estudio de integridad sistema nigroestriado - Enfermedad de Parkinson | No requiere ayunas Contraindicaciones: Embarazo |
| F18-Florbetapir | Evaluación depósito de Amiloide cerebral - Enfermedad de Alzheimer - Diagnóstico precoz demencia | No requiere ayunas Contraindicaciones: Embarazo |
| PET/CT CORPORAL | ||
|---|---|---|
| Radiofármaco | Indicación | Preparación del paciente |
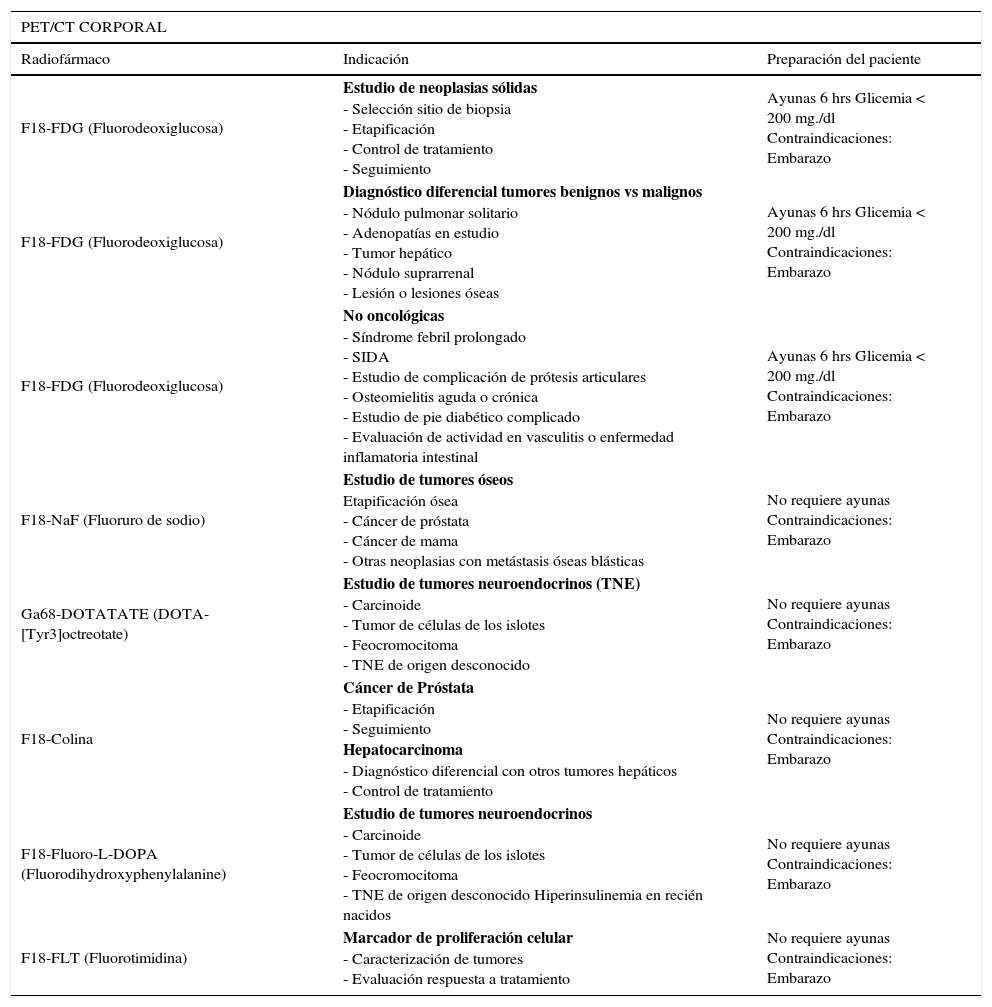
| F18-FDG (Fluorodeoxiglucosa) | Estudio de neoplasias sólidas - Selección sitio de biopsia - Etapificación - Control de tratamiento - Seguimiento | Ayunas 6 hrs Glicemia < 200 mg./dl Contraindicaciones: Embarazo |
| F18-FDG (Fluorodeoxiglucosa) | Diagnóstico diferencial tumores benignos vs malignos - Nódulo pulmonar solitario - Adenopatías en estudio - Tumor hepático - Nódulo suprarrenal - Lesión o lesiones óseas | Ayunas 6 hrs Glicemia < 200 mg./dl Contraindicaciones: Embarazo |
| F18-FDG (Fluorodeoxiglucosa) | No oncológicas - Síndrome febril prolongado - SIDA - Estudio de complicación de prótesis articulares - Osteomielitis aguda o crónica - Estudio de pie diabético complicado - Evaluación de actividad en vasculitis o enfermedad inflamatoria intestinal | Ayunas 6 hrs Glicemia < 200 mg./dl Contraindicaciones: Embarazo |
| F18-NaF (Fluoruro de sodio) | Estudio de tumores óseos Etapificación ósea - Cáncer de próstata - Cáncer de mama - Otras neoplasias con metástasis óseas blásticas | No requiere ayunas Contraindicaciones: Embarazo |
| Ga68-DOTATATE (DOTA-[Tyr3]octreotate) | Estudio de tumores neuroendocrinos (TNE) - Carcinoide - Tumor de células de los islotes - Feocromocitoma - TNE de origen desconocido | No requiere ayunas Contraindicaciones: Embarazo |
| F18-Colina | Cáncer de Próstata - Etapificación - Seguimiento Hepatocarcinoma - Diagnóstico diferencial con otros tumores hepáticos - Control de tratamiento | No requiere ayunas Contraindicaciones: Embarazo |
| F18-Fluoro-L-DOPA (Fluorodihydroxyphenylalanine) | Estudio de tumores neuroendocrinos - Carcinoide - Tumor de células de los islotes - Feocromocitoma - TNE de origen desconocido Hiperinsulinemia en recién nacidos | No requiere ayunas Contraindicaciones: Embarazo |
| F18-FLT (Fluorotimidina) | Marcador de proliferación celular - Caracterización de tumores - Evaluación respuesta a tratamiento | No requiere ayunas Contraindicaciones: Embarazo |
El término radiotrazador o radiofármaco se refiere a una molécula involucrada en algún proceso fisiológico o fisiopatológico, acoplada a un átomo radioactivo (isótopo), de tal manera que se pueda estudiar su distribución en el organismo mediante un detector de radiación. El trazador más utilizado en estudios PET es la glucosa, y el isótopo para PET de mayor disponibilidad es el Flúor-18 (F18). En el caso de estudios PET se utilizan isótopos productores de positrones como el F18, que tras su aniquilación producen dos fotones de alta energía emitidos en sentido opuesto de 180º, los que serán detectados por el anillo detector de la cámara PET. El componente CT del estudio híbrido es indispensable en la formación y corrección de la imagen PET final, proporcionando un mapa de densidades del cuerpo que permiten completar el proceso de corrección de la imagen PET. Además la imagen CT es de gran ayuda en la ubicación anatómica de las lesiones visibles en el estudio metabólico, pudiéndose también realizar una tomografía computada de mayor resolución y calidad de imagen en el mismo acto, con o sin administración de contraste iodado endovenoso.
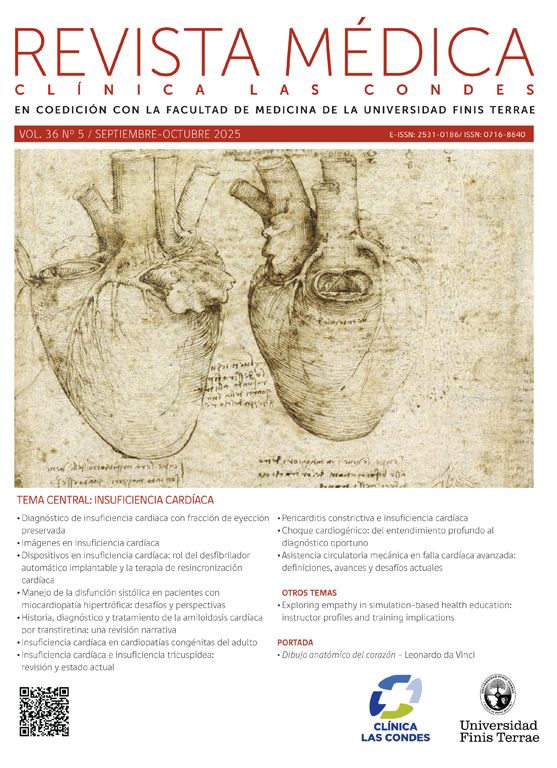
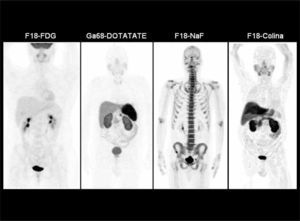
La F18-FDG (Fluorodeoxiglucosa) se comporta de manera idéntica a la glucosa, entrando a la célula por transporte activo de acuerdo a su demanda. Una vez dentro de la célula es fosforilada, bloqueándose su degradación, con acumulación de la molécula fosforilada en el citoplasma. La glucosa marcada que no es captada en los tejidos, será eliminada por la orina. La F18-FDG no produce efectos adversos ni reacciones alérgicas, y la única contraindicación absoluta es el embarazo. Para realizar el examen se requiere ayunas de 6 hrs. En diabéticos el examen puede realizarse sin problemas con glicemias menores de 200 mg/dl. Con niveles superiores el examen pierde sensibilidad, debido a que el tras torno metabólico altera los procesos normales de captación de glucosa. La captación normal de F18-FDG y otros radiatrazadores se muestra en la Figura 1.
Distribución normal del radiotrazador en distintos tipos de PET/CT corporales. F18-FDG (mayor captación cerebral, acumulación cardiaca e intestinal variable, y excreción urinaria), Ga68-DOTATATE (alta captación en hipófisis, bazo, hígado y parénquima renal), F18-NaF (acumulación en el esqueleto y excreción urinaria) y F18-Colina (captación en glándulas salivales, hígado, parénquima renal y variable en intestino). El PET/CT óseo presenta una lesión hipercaptante en hueso iliaco derecho.
Existen otros radiotrazadores disponibles en la actualidad, que aunque tienen un uso más acotado, son de utilidad en ciertas circunstancias. A continuación se mencionan los más importantes:
El F18-NaF (Fluoruro de sodio) presenta avidez sólo por el tejido óseo, proporcional a la actividad osteoblástica o formadora de hueso, uniéndose a los cristales de hidroxiapatita en la matriz ósea. Debido a esto es utilizado en el estudio de lesiones óseas blásticas o escleróticas como tumores primarios o metástasis esqueléticas. El radiofármaco que no fue captado en el hueso se elimina por la orina. El examen no requiere preparación, salvo una buena hidratación, y no produce efectos adversos ni alergias.
El Ga68-DOTATATE (DOTATyr3Thr8- octreotide) es un péptido con alta afinidad por los receptores de somatostatina, presentes normalmente en las células enterocromafines ubicadas en la submucosa del tracto gastrointestinal y traqueobronquial, y sobreexpresados en los tumores neuroendocrinos, particularmente el carcinoide. Para realizar el examen no se requiere ayunas ni otra preparación especial, aunque se debe monitorizar la presión arterial debido a los potenciales efectos vasomotores del radiofármaco.
La Colina es una amina cuaternaria involucrada en una gran variedad de procesos y sistemas del organismo, y que suele acumularse en algunos tumores debido a disregulacion de la enzima colina-kinasa que provoca aumento de la incorporación y atropamiento de colina en la membrana de las células tumorales en forma de fosfatidilcolina (lecitina). La marcación con F18 ó C11 de este compuesto ha permitido estudiar tumores con alto atrapamiento de colina como el adenocarcinoma de próstata y el hepatocarcinoma. En el caso de los tumores prostáticos, tanto las lesiones andrógeno-sensibles como andrógenoindependientes captan más Colina que FDG en condiciones aeróbicas. En condiciones de hipoxia esta relación se invierte y la captación de Colina es menor (2).
La F18-Fluorotimidina (FLT) es un análogo de timidina cuya acumulación en los tejidos se correlaciona con la actividad de la Timidina kinasa-1, involucrada en la síntesis de DNA. Una vez incorporada a la célula, es fosforilada por dicha enzima, acumulándose en el citoplasma. El PET con FLT permite evaluar en vivo el grado de proliferación celular tanto de los tejidos normales como neoplásicos, prestando gran utilidad por ejemplo en la evaluación de tumores y su respuesta al tratamiento. Ha mostrado estrecha correlación con índices proliferativos como el Ki67. Su baja captación fisiológica cerebral ha impulsado su uso en tumores cerebrales, tanto en diagnóstico como en evaluación del tratamiento.
Aplicaciones en oncologíaUna gran cantidad de publicaciones se han enfocado en explorar la utilidad del PET/CT F18-FDG en el manejo de patología oncológica, gran parte de ellos con resultados favorables para la técnica. Un estudio multicéntrico prospectivo reciente demuestra un gran impacto en el manejo de sujetos con cáncer, produciendo un cambio radical en la conducta (tratamiento curativo vs paliativo) en 42% de los pacientes, y un cambio en el tipo de tratamiento curativo (cirugía, quimioterapia o radioterapia) hasta en un 40% (3). Esta y otras publicaciones enfocadas en costo/ beneficio han llevado a ampliar la cobertura del PET/CT en el sistema de salud de Estados Unidos, bonificando en la actualidad su uso en el diagnóstico y etapificación de todas las neoplasias sólidas, excepto cáncer prostático, y para el seguimiento de una larga lista de enfermedades malignas. La codificación reciente del PET/CT por el sistema de salud en nuestro país también apuntaría en ese sentido.
No es objetivo de esta revisión analizar cada tipo de neoplasia en particular, pero en términos generales se puede afirmar que el PET/CT con F18-FDG aumenta la sensibilidad en la detección de lesiones ganglionares y de metástasis a distancia en el proceso de etapificación de los tumores sólidos, proporcionando una clasificación TNM más confiable que los métodos tradicionales (4). El sistema esquelético, hígado, bazo, planos musculares y pequeñas adenopatías son sistemas y órganos en los cuales el PET/CT logra mayor detección de lesiones, particularmente en neoplasias como el linfoma, cáncer pulmonar, cáncer de mama, melanoma y varios otros (Figura 2). Es por este motivo que los protocolos de estudio actuales han incorporado al PET/CT en el estudio inicial de gran parte de las neoplasias en adultos (5). Por otro lado, la detección de neoplasias insospechadas y/o segundos tumores primarios mediante PET/CT puede llegar al 4-5% de los pacientes en nuestro medio (6, 7), hallazgo que sin duda modifica el tratamiento y pronóstico de estos pacientes.
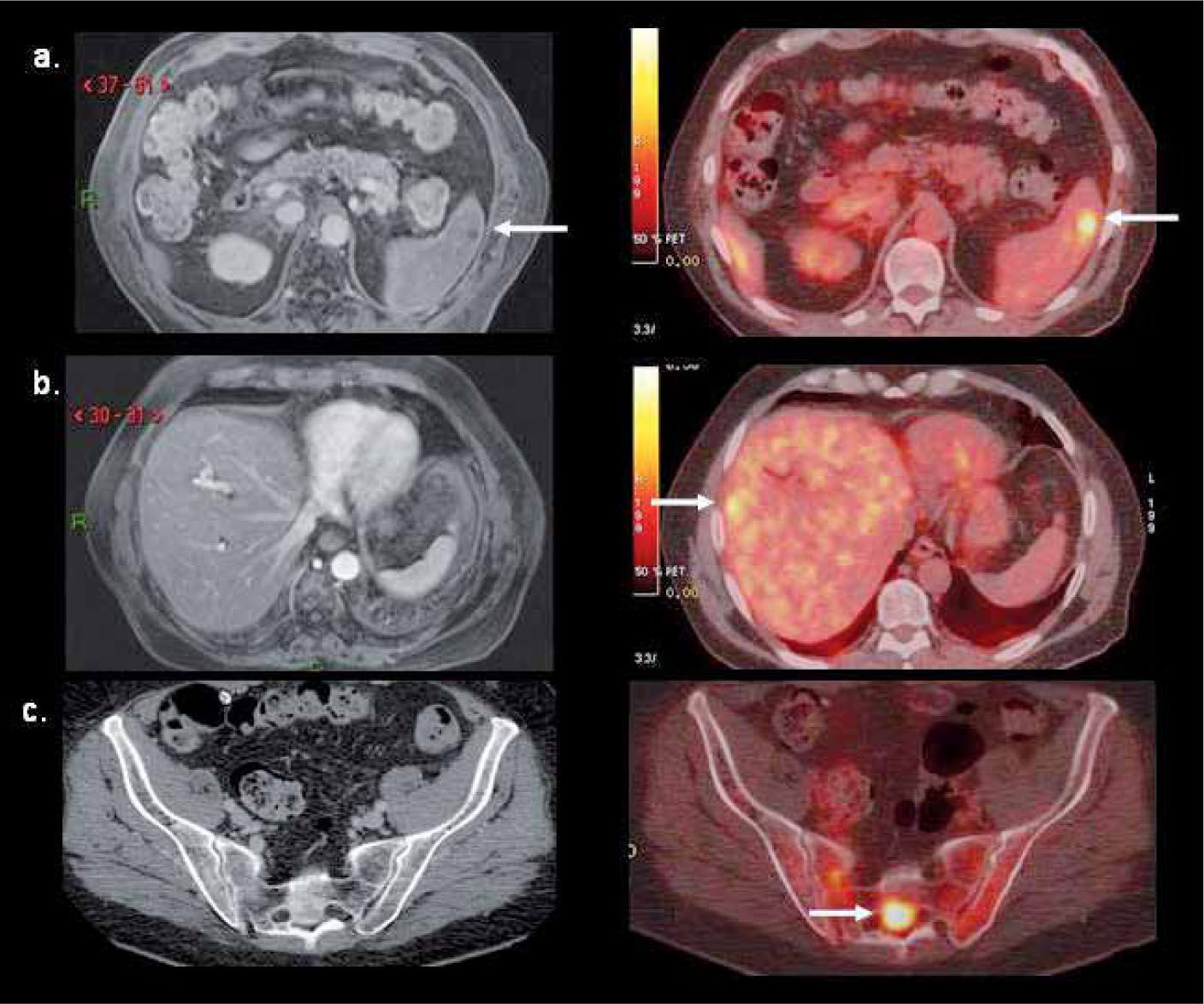
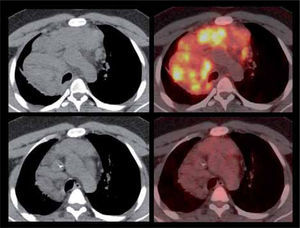
Su utilidad en control del tratamiento radica en la capacidad de medir la respuesta biológica a la quimioterapia, terapia biológica o radioterapia, independiente de las variaciones de tamaño del o las lesiones. La reducción de volumen de la lesión es un factor pronóstico poco sensible de respuesta a la terapia. En cambio el grado de disminución de la actividad metabólica si tiene una alta correlación con sobrevida libre de enfermedad. En términos generales, una reducción de 50 o 60% de la captación inicial de FDG después del 2º o 3º ciclo de quimioterapia es indicativo de respuesta al tratamiento (8). Para evitar cualquier captación inflamatoria post-tratamiento, que puede ser causa de falsos positivos, se recomienda efectuar el PET/CT 3-4 semanas después de terminada la quimioterapia, 4-6 semanas después de una cirugía, y 4-6 meses después de la radioterapia. La Figura 3 muestra un PET pre y post tratamiento con respuesta metabólica completa.
Paciente de 29 años con Linfoma de Hodgkin con masa adenopática mediastínica (fotos superiores) que luego de dos ciclos de quimioterapia presenta respuesta metabólica completa (fotos inferiores), con masas residuales inactivas (fibróticas). Dicha respuesta luego del 2º ciclo prácticamente garantiza un paciente libre de enfermedad una vez completados los restantes ciclos de quimioterapia.
En planeación de radioterapia el PET/CT F18-FDG juega un rol fundamental en patologías como el cáncer pulmonar células pequeñas, cáncer de cabeza y cuello, cáncer de esófago y cáncer anal, ocasionando un cambio del campo a irradiar en 30 a 74% de los pacientes (9). Protocolos que incluyen radioterapia guiada con PET han demostrado gran efectividad en el tratamiento de patologías como el Linfoma de Hodgkin (10).
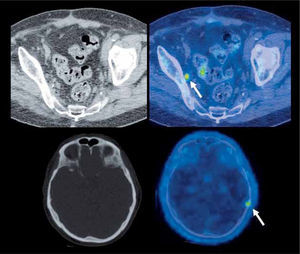
En el estudio de pacientes con cáncer de próstata, se prefiere utilizar F18-Colina, que muestra una mayor sensibilidad que la glucosa marcada, por cuanto estas lesiones suelen presentar baja acumulación de F18-FDG. La captación de Colina es altamente específica de ciertos tumores como el de próstata, y su acumulación anormal tiene alto valor predictivo de enfermedad. Diversas publicaciones han descrito una alta sensibilidad en estudios de etapificación y especialmente de reetapificación y seguimiento post-tratamiento (Figura 4). Su sensibilidad, especi ficidad y rendimiento global son de 80%, 96% y 93% en detección de metástasis ganglionar, respectivamente, permitiendo además la detección de compromiso ganglionar extraregional y metástasis a distancia con un solo examen (11). El PET/CT F18-Colina parece ser más útil en pacientes de alto riesgo, donde produce un cambio de conducta en 20% de los casos respecto a la etapificación tradicional (12). En pacientes operados con sospecha de recidiva, el PET con Colina detecta metástasis con APE desde 2,5 ng/ml, con positividad en 43% de los pacientes con APE <4.0 ng/ml y 91% de los pacientes con APE ≥ 4,0 ng/ml (13).
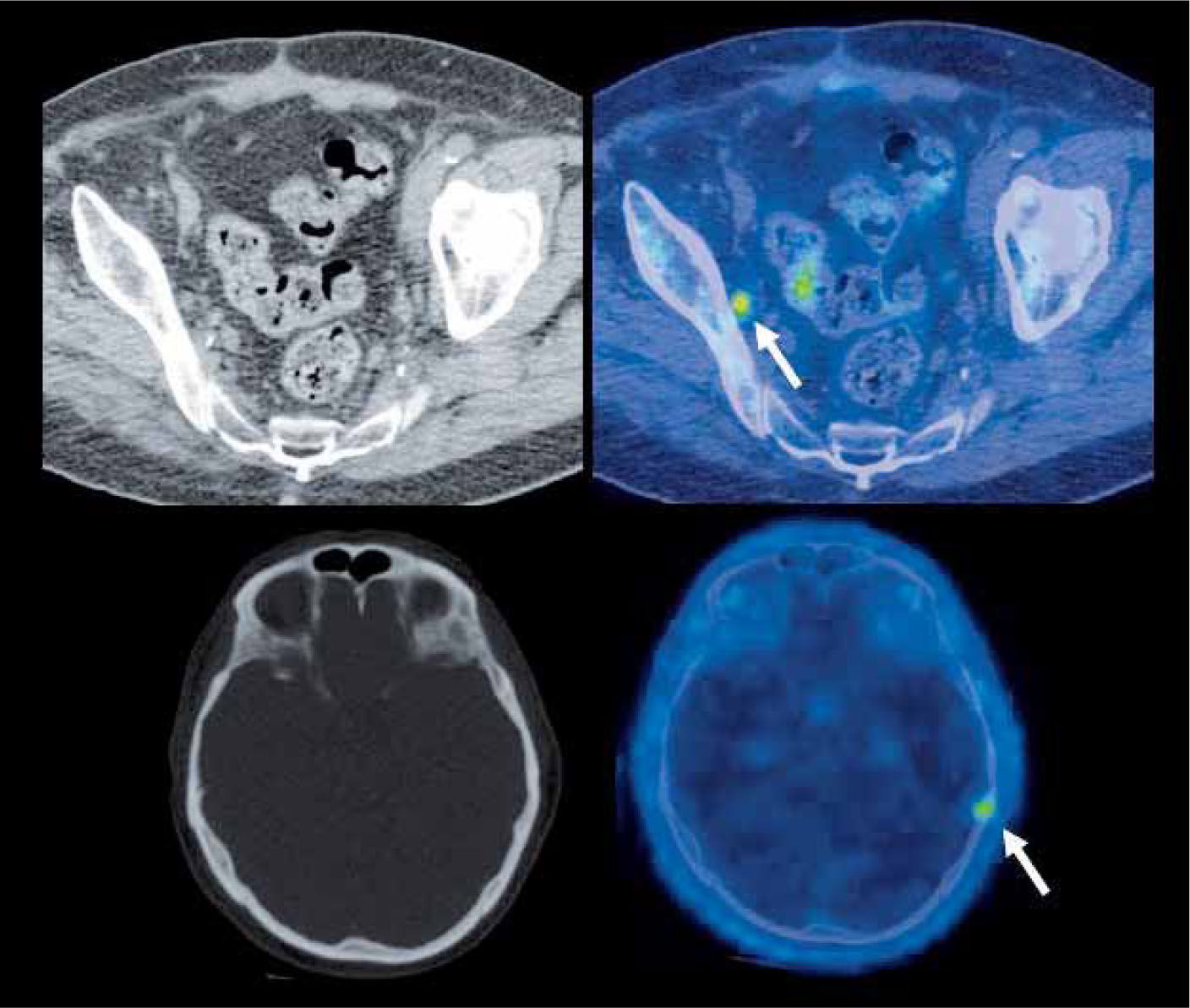
Paciente con cáncer de próstata operado que en el seguimiento experimenta aumento del APE. El PET/CT con F18-Colina detecta pequeña adenopatía obturadora derecha con alta captación de Colina marcada (flecha superior), negativa según los criterios de la TC, compatible con recidiva. Se observa además lesión hipercaptante en calota a izquierda de origen secundario (flecha inferior), tampoco evidente en la tomografía computada.
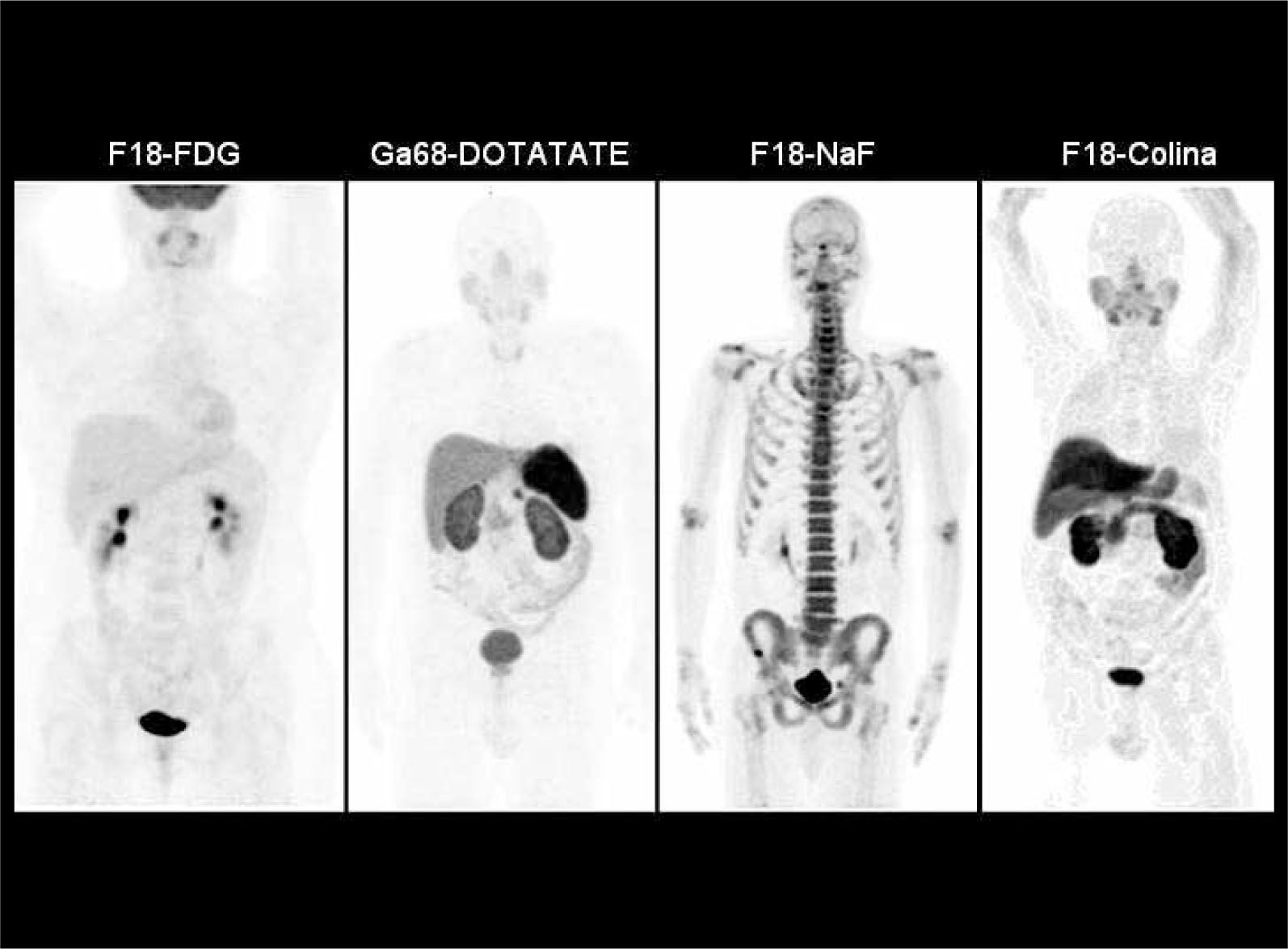
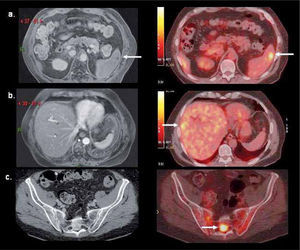
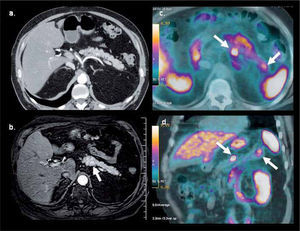
La baja captación de F18-FDG sucede también en la mayoría de los tumores neuroendocrinos, por lo que en estos tumores se recomienda utilizar G68-DOTATATE (DOTA-[Tyr3]octreotate), de alta sensibilidad especialmente en carcinoide, y una buena alternativa en tumores de células de los islotes y neoplasias neuroendocrinas de origen desconocido (14) (Figura 5). Varios autores también han destacado el alto rendimiento de la F18-Fluoro-L-DOPA (Fluorodihydroxyphenylalanine) en el estudio de estos tumores (15), así como también en la evaluación de lactantes con hiperinsulinemia (16).
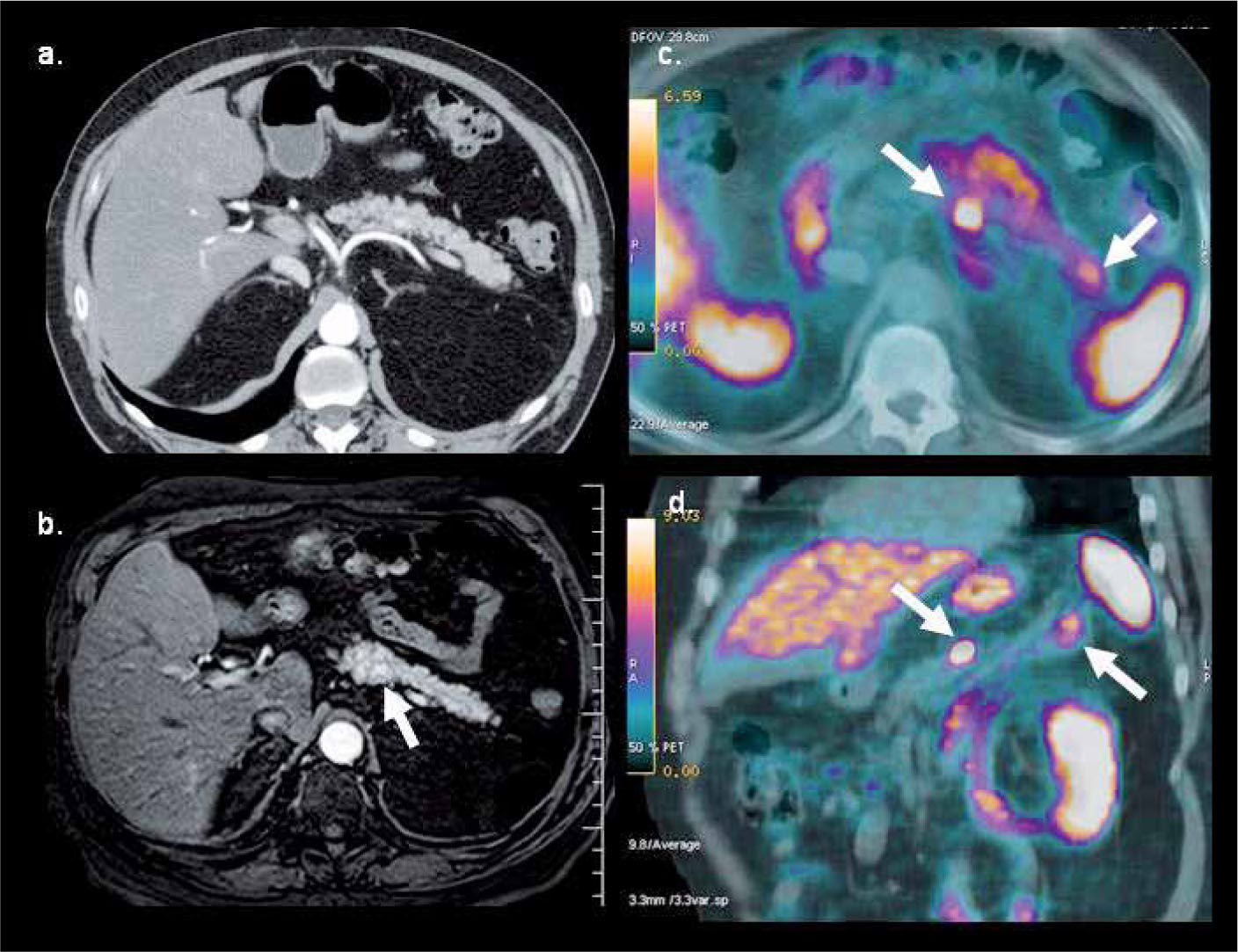
PET/CT con Ga68-DOTATATE en hombre de 64 años con gastrinemias elevadas. La tomografía computada (a) y resonancia magnética (b) muestran una sutil lesión hipervascular sospechosa en cuerpo pancreático. PET/ CT (c, d) confirma nódulo de alta captación en cuerpo pancreático y otro más pequeño en la cola, no visible con TC ni RM. La histología confrma gastrinoma de 8 mm en cuerpo y de 4 mm en cola.
Debido a que ciertos procesos inflamatorios pueden presentar captación de F18-FDG, el PET/CT ha sido utilizado con cierto éxito en algunos cuadros no oncológicos localizando un foco inflamatorio y/o infeccioso oculto, o determinando actividad y respuesta al tratamiento de enfermedades inflamatorias conocidas. En el síndrome febril prolongado o de causa desconocida, logra aportar información útil en 41% de los casos, y en caso de PET/CT negativo hace muy improbable localizar el origen morfológico de la fiebre (17). En el SIDA agiliza la detección de infecciones o tumores, y es muy útil en el diagnóstico diferencial de Toxoplasmosis vs Linfoma, ya que el primero no capta significativamente FDG y el segundo suele ser ávido de glucosa.
Puede utilizarse en enfermedad inflamatoria intestinal donde representa una eficiente manera de detectar focos inflamatorios en intestino delgado y colon, y permite controlar el tratamiento y anticipar recaídas (18). También es útil en el diagnóstico y seguimiento de vasculitis de grandes vasos -siempre y cuando se acompañe de un análisis semicuantitativo- (19), y en el estudio de una serie de procesos infecciosos (20).
PET/CT cerebralEl cerebro es uno de los tejidos que más energía consume en nuestro cuerpo, presentando por lo tanto una alta captación fisiológica de F18-FDG. Esta captación se concentra principalmente en la corteza cerebral, núcleos de la base y cerebelo. La utilidad del PET/CT se basa en que prácticamente cualquier anormalidad estructural o funcional se traducirá en un área de alteración de la captación, principalmente de hipometabolismo respecto al parénquima normal. Patologías como la epilepsia, demencia, daño por drogas, y otros producirán áreas hipometabólicas cerebrales características.
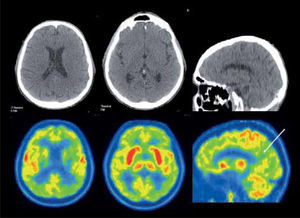
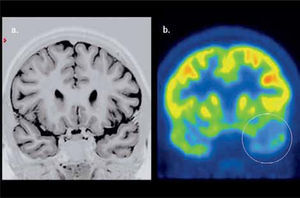
En el caso de los cuadros neurodegenerativos como el deterioro cognitivo leve, enfermedad de Alzheimer, demencia frontotemporal, demencia con cuerpos de Lewy, atrofia sistémica múltiple y enfermedad de Parkinson, el PET presenta patrones de alteración metabólica característicos utilizando F18-FDG (21) (Figura 6). El uso de PET en demencias puede disminuir los falsos positivos y falsos negativos de la evaluación clínica tradicional, afinando el diagnóstico (22). La sensibilidad del PET F18-FDG en la detección de enfermedad de Alzheimer fluctúa entre 93-96% al emplear el patrón clásico de hipometabolismo parietotemporal bilateral, con una clara ventaja sobre la RM y SPECT especialmente en enfermedad precoz (23). El desarrollo de radiofármacos específicos orientados a evaluar el depósito de amiloide cerebral, como el PIB y Florbetapir, han aumentado el rendimiento en el estudio imagenológico de la enfermedad de Alzheimer. Lo mismo ha pasado con los radiotrazadores enfocados en la neurotransmisión de dopamina en la Enfermedad de Parkinson.
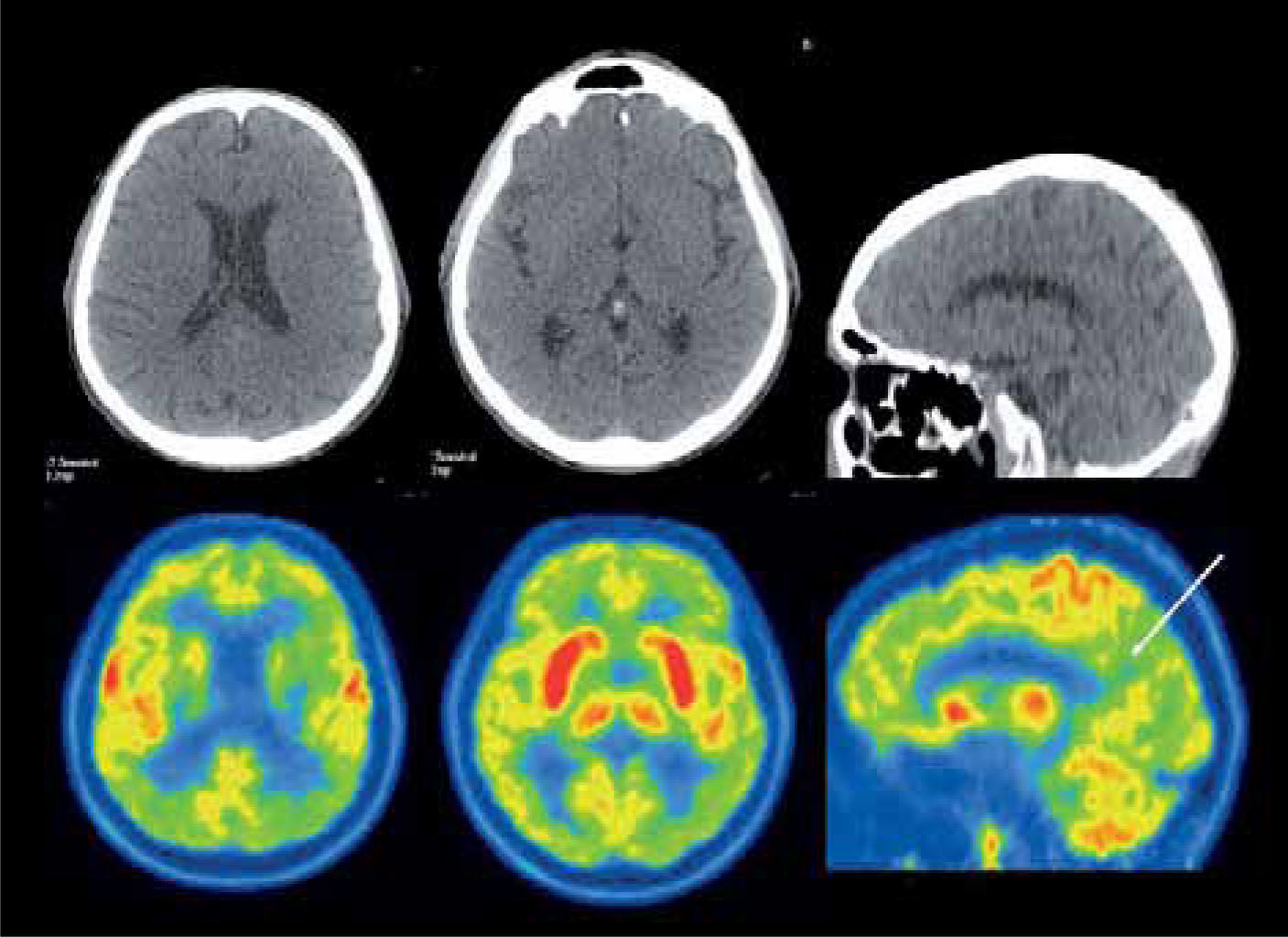
Paciente de 71 años con demencia. El PET/CT F18-FDG evidencia una severa alteración metabólica de gran parte del manto cortical incluyendo el cíngulo posterior (flecha), con preservación relativa del área motora, compatible con enfermedad de Alzheimer avanzada. Nótese la captación conservada lenticular, de núcleos caudados y tálamos.
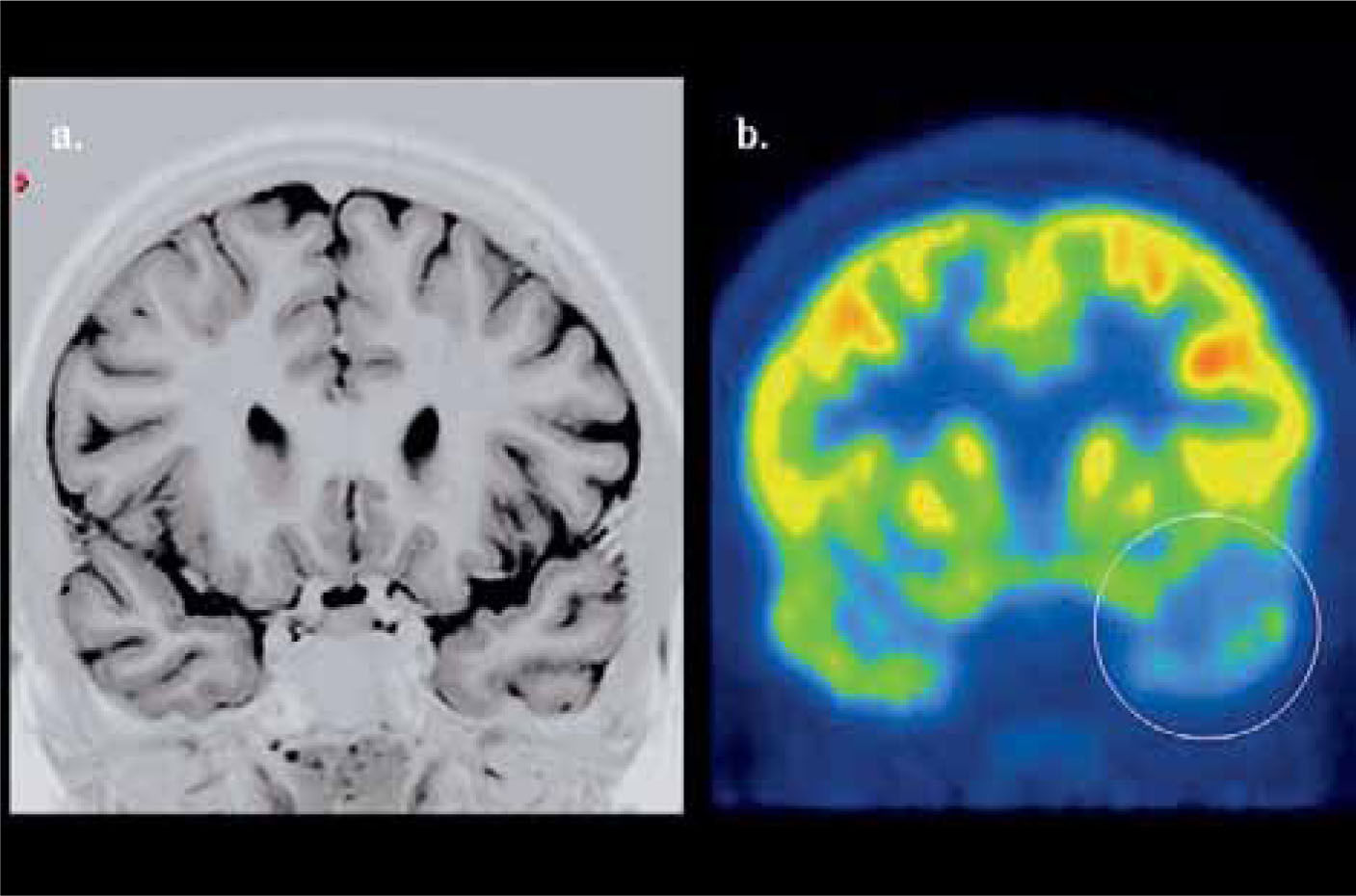
En epilepsia focal el PET F18-FDG es una importante herramienta en la localización del foco epileptógeno, y muestra una elevada correlación con los hallazgos al electroencefalograma de superficie (EEG), aún con RM negativa. El valor del PET radica precisamente en este grupo de epilepsias “no lesionales” o con hallazgos morfológicos ambiguos a la RM, y en aquellas lesiones bilaterales (esclerosis hipocampal bilateral) que por su simetría son de difícil detección. Su sensibilidad en la detección del área epileptógena es sobre 90% en foco temporal y de 30 a 70% en foco extratemporal (24). Un foco epileptógeno temporal con PET hipometabólico y RM normal se muestra en la Figura 7.
En el caso de los tumores primarios cerebrales el PET/CT tiene utilidad además de la evaluación inicial, en el seguimiento post-tratamiento, detectando la recidiva tumoral con alta sensibilidad y valor predicativo. El PET F18-FDG presenta una sensibilidad de 81-86% y especificidad de 40-94% en el diagnóstico diferencial de radionecrosis vs recidiva tumoral (25). Su rendimiento aumenta significativamente al realizar corregistro o fusión con imágenes de RM. Debido a que en etapas precoces post radioterapia puede haber una importante sobreexposición de captación por actividad inflamatoria y tumoral residual, se recomienda realizar el PET lo más alejado posible del tratamiento. Aunque no hay un consenso en el momento óptimo para controlar con PET, se acepta que al menos sean 6 semanas desde la radioterapia, fecha en que los cambios inflamatorios comienzan a disminuir en forma significativa (25).
El PET con FLT tiene la ventaja que no es captado tan ávidamente por el cerebro como la glucosa, lo que aumenta la sensibilidad en la detección de tumores encefálicos. En gliomas de alto grado es un marcador de proliferación y tiene un valor pronóstico mayor que el F18-FDG (26). Una disminución de 25% o más de la captación inicial de FLT en gliomas recurrentes es altamente predictora de ausencia de progresión y mejor sobrevida global (27).
El PET utilizando 6-[18F]Fluoro-L-dopa (FDOPA) ha sido considerado el “Gold Standard” en la evaluación de la integridad del sistema dopaminérgico nigroestriado (28, 29). Sin embargo, existen tres distintas maneras de evaluar “in vivo” los terminales neurosinápticos de dopamina:
- 1)
evaluación de la disponibilidad de transportador de dopamina presináptico (DAT).
- 2)
evaluación de la actividad de la enzima dopa decarboxilasa y del turnover de dopamina (Fluoro-L-DOPA).
- 3)
evaluación de la disponibilidad de transportadores de vesículas monoamina en el terminal (18F-dihydrotetrabenazine). Los radiotrazadores con afinidad para receptores D2 como el C11-Raclopride y F18-Fallypride, pueden detectar indirectamente los flujos de dopamina midiendo los cambios en la disponibilidad de receptores D2 en el cuerpo estriado (30).
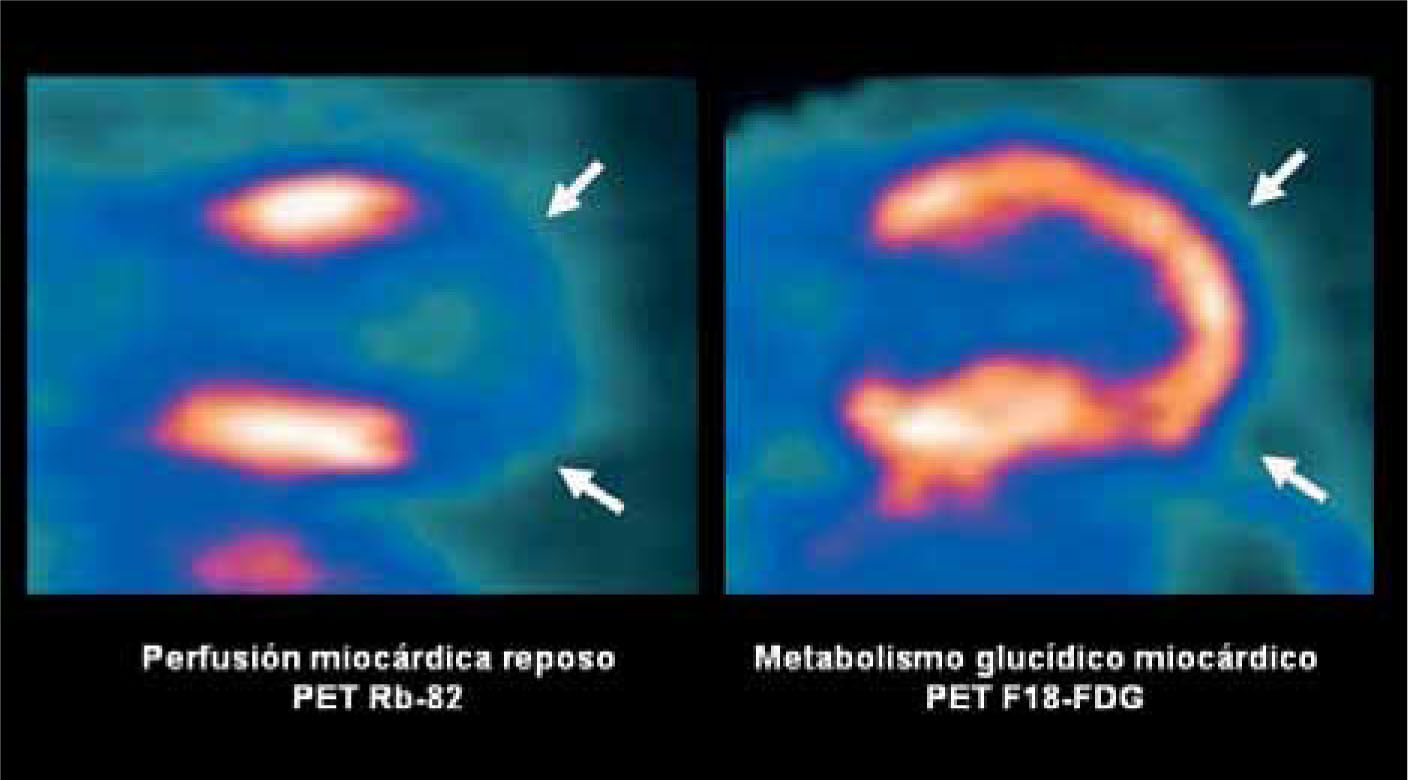
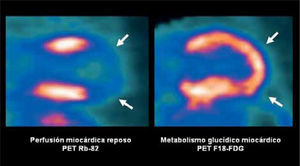
El miocardio consume ácidos grasos y glucosa para obtener energía. Este consumo persiste aún en territorios miocárdicos isquémicos cuando el tejido es viable, y no ocurre en las cicatrices o infartos establecidos. El PET utilizando azúcar marcada o F18-FDG, hace posible diferenciar miocardio viable del no viable en pacientes con coronariopatía, lo que es de vital importancia al momento de decidir la opción de revascularización. Un territorio con insuficiente riego arterial o isquémico, que demuestra captación conservada de glucosa se considera viable y puede ser rescatado (Figura 8). El miocardio infartado no concentra F18-FDG, y la revascularización en estos casos no proporcionaría beneficios funcionales.
Doble estudio con PET de perfusión y viabilidad miocárdica en paciente con antecedentes de cardiopatía coronaria e infarto. El PET de perfusión miocárdico de reposo (izquierda) muestra extensa área hipoperfundida apical correspondiente al área sospechosa de infarto, que sin embargo demuestra viabilidad en el estudio con glucosa marcada (derecha).
El autor declara no tener conflictos de interés, con relación a este artículo.