La alternativa de terapia neuroendovascular para un tratamiento del accidente vascular encefálico agudo es una área de la medicina en rápida expansión. El rescate endovascular del infarto cerebral agudo tiene como principal objetivo la rápida reperfusión del vaso ocluido utilizando la trombolisis intra-arterial cerebral y distintos métodos de trombectomía mecánica o colocación permanente de neurostent. El tratamiento neuro-endovascular de la hemorragia subaracnoidea aguda aneurismática también se ha establecido como la terapia de elección e incluye la embolización convencional con coils del aneurisma cerebral roto o utilizando técnica de embolización balón o stent asistido o colocación primaria de stent con tecnología de divertidor de flujo. Además, con la terapia endovascular se puede efectuar angioplastía farmacológica y mecánica del vasoespasmo cerebral.
Neurointerventional therapy in the treatment of acute stroke is a rapidly expanding field in medicine. The endovascular rescue of the acute brain infarct has as its primary objective rapidly re-establishing flow of the occluded cerebral vessel utilizing intra-arterial thrombolysis and/or different methods of mechanical thrombectomy or permanent neurostent placement. The neuro-endovascular therapy of acute aneurysmatic subarachnoid hemorrhage has been stablish as the treatment of choice and includes standard coil embolization of the ruptured aneurysm or balloon or stent assisted coil embolization or primary stenting With flow diverter stent technology. Also, with endovascular therapy we can performed pharmacological or mecanical angioplasty of the cerebral vasospasm.
El accidente vascular encefálico (AVE) es la tercera causa de muerte más frecuente en los países desarrollados y es la primera causa de invalidez. En Chile, el AVE representa la segunda causa de muerte (1) y la incidencia del infarto cerebral es en promedio 87/100.000 habitantes por año y aumenta progresivamente con la edad de la población hasta llegar a una incidencia de 762/100.000 habitantes por año en personas mayores a los 85 años. La hipertensión arterial es el factor de riesgo más frecuente y la fibrilación auricular la causa más frecuente del AVE en Chile (2). Aproximadamente 70-85% de los AVEs tienen un origen isquémico versus hemorrágico.
El año 1995 el US Food and Drug Administration (FDA) aprobó el medicamento Actilyse (activador del plasminógeno humano recombinante, tPA) como un agente de trombolisis cerebral intravenosa (IV) para tratar el infarto cerebral agudo dentro de las primeras 3 horas desde el inicio de los síntomas (3). Posteriormente, también se ha demostrado que el tratamiento hospitalizado del paciente con un AVE agudo en una Unidad Neuro-crítica tiene el potencial de reducir la mortalidad intrahospitaliaria y duración de hospitalización para el paciente (4). También han habido grandes avances en la terapia endovascular del AVE agudo isquémico con la trombolisis intra-arterial (IA) y trombectomía mecánica y en el AVE hemorrágico aneurismático agudo con el desarrollo de la embolización con coils del aneurisma cerebral roto. Este artículo revisa los últimos adelantos en la terapia endovascular para el AVE agudo isquémico y hemorrágico aneurismático.
Terapia endovascular del ave isquémico agudoTrombolisis CerebralLa trombolisis IV utilizando tPA es la única terapia de reperfusión establecida con evidencia clase 1, y nivel de evidencia A para el AVE isquémico agudo (5). Sin embargo, esta terapia aún deja a más de 50% de los pacientes tratados con significativas secuelas y el 17% de pacientes con infartos cerebrales severos con valores sobre 20 en la Escala de Infarto Cerebral del US National Institute of Health (NIHSS) obtuvo un nivel de secuelas leve definido por la escala modificada de Rankin Score 0-1. En este protocolo de trombolisis IV estaba indicada para pacientes dentro de las primeras 3 horas desde el inicio del cuadro clínico. Posteriormente, la ventana terapéutica se ha ampliado hasta las primeras 4.5hrs (6, 7).
La terapia endovascular para el AVE isquémico agudo se inició durante la década de los años 80 con la trombolisis IA utilizando medicamentos como Urokinasa y posteriormente tPA. Esta terapia fue posible luego el desarrollo de muy pequeños microcatéteres capaces de ser navegados hasta los vasos intracerebrales utilizando métodos angiográficos y luego inyectando localmente en el trombo vía IA el médicamente. Inicialmente, la trombolisis IA estaba indicada en pacientes que presentaban clínicamente entre 3-6 horas del inicio de cuadro clínico o que tenían alguna contraindicación para la trombolisis sistémica. Los estudios prospectivos, multicéntricos, randomizados y controlados como el PROACT-I (Prolyse in acute cerebral thromboembolism) (8), y el PROACT-II (9), como también los estudios prospectivos, multicéntricos, no controlado, como el Interventional Management of Stroke I y II (10, 11), han mostrado la validez y seguridad de la terapia endovascular dentro de una ventana terapéutica de las primeras 6 horas. En el PROACT-II se obtuvo una tasa de recanalización parcial o completa de un 66% y una satisfactoria recuperación clínica de un 40% de los pacientes tratados con un mRS <=2 versus un 25% de los controles (Figura 1). Sin embargo, también se observó un aumento al doble de la tasa de hemorragia intracerebral sintomática (6.4% NINDS versus 10.9% PROACT II). Se ha observado un mayor efectividad de reperfusión con la terapia endovascular que con la trombolisis con tPA IV (12).
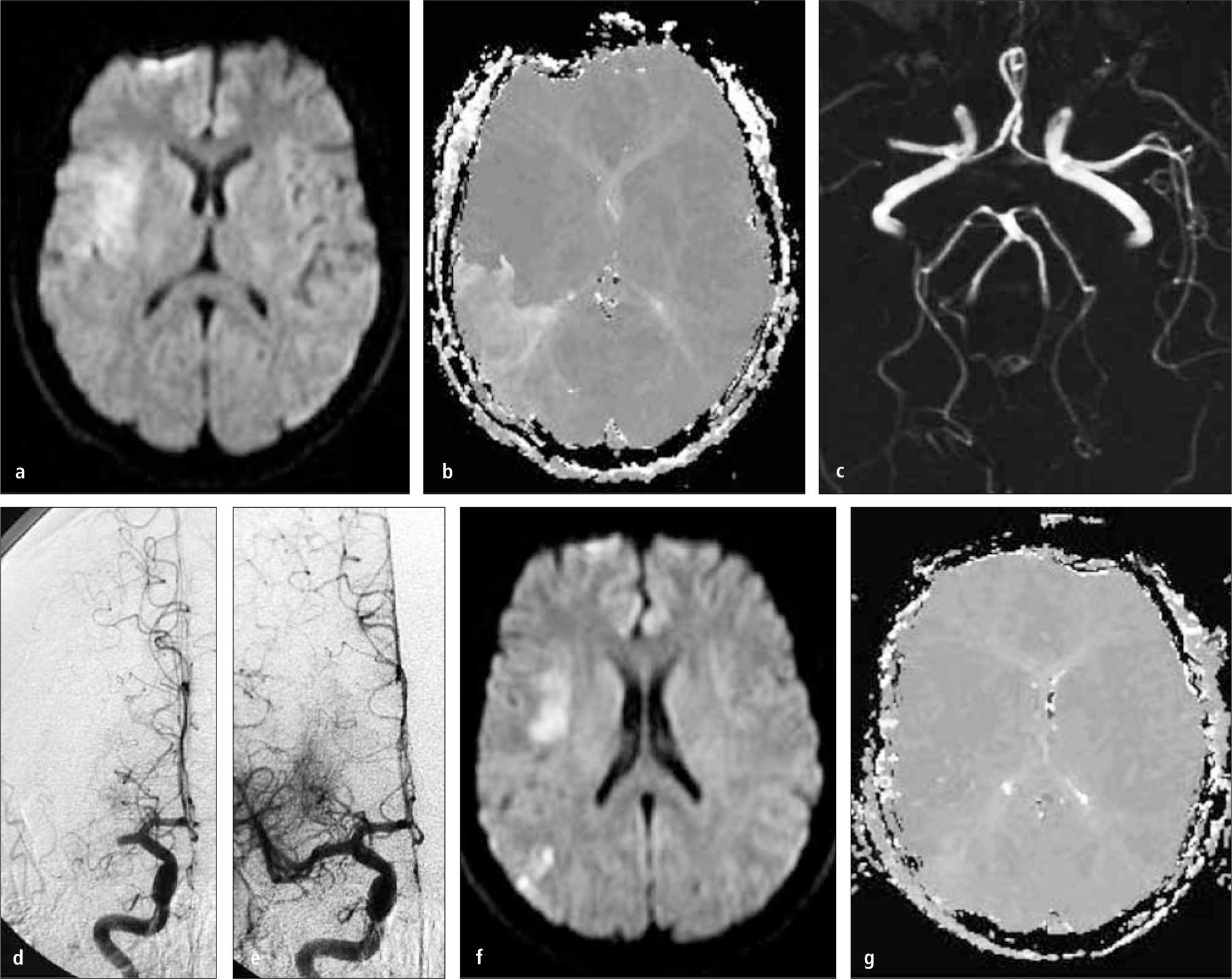
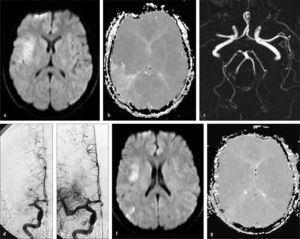
Trombolisis Cerebral Intra-arterial. (a) RM - secuencia de Difusión (DWI), muestra aumento de señal en región silviana profunda derecha compatible con infarto cerebral agudo. (b) RM - secuencia de Perfusión (PWI) muestra una gran area de baja irrigación (hipoperfusión) en el territorio silviano posterior derecho. (c) AngioResonancia Cerebral, muestra una completa oclusión de la arteria cerebral media derecha proximal. (d) Angiografia cerebral digital muestra también una completa oclusión de la arteria cerebral media derecha proximal y una satisfactoria recanalización posterior a una terapia endovascular (e). (f) Control RM DWI no muestra aumento de tamaño de infarto cerebral. (g) Control RM PWI muestra una normalización de la perfusión cerebral en el territorio silviano derecho.
El primer estudio que reportó la combinación de trombolisis IV e IA fue el Emergency Management of Stroke trial (13), que demostró una mayor tasa de recanalización y similares resultados clínicos que estudio con trombolisis IV.
En el 2007, el American Heart Association publicó en sus guías para el manejo de pacientes con un AVE isquémico agudo secundario a una oclusión de la arteria cerebral media que presentan antes de las 6 horas de evolución, que este paciente debe ser tratado con trombolisis IA si la institución donde ingresa el paciente tiene un neurointervencionista experto disponible (Evidencia Clase I) (14).
Trombectomía MecánicaEn los años 2000s también se desarrolló de la trombectomía mecánica para pacientes con persistente oclusión de grandes vasos cerebrales refractario a la trombolisis IA. Esta técnica, requiere que un dispositivo endovascular sea navegado de forma segura hasta el sitio de la oclusión arterial intracraneana y que sea capaz de atrapar el coágulo y removerlo de la circulación. En el año 2004, el primer dispositivo aprobado por la FDA para la trombectomía mecánica fue desarrollado utilizando una microguía preformada de forma de tirabuzón, llamado MERCI (Mechanical Embolus Removal in Cerebral Ischaemia) (15). El estudio Multi-MERCI (16) demostró la validez y seguridad de este dispositivo para la trombectomía mecánica en tratamiento del AVE isquémico agudo utilizando una ventana terapéutica de 8 horas. El estudio incluyó pacientes que habían recibido trombolisis IA con tPA pero sin reperfusión. Se observó un 55% de recanalización con trombectomía unicamente y 68% cuando el dispositivo fue utilizado en conjunto con otra terapia complementaria. La incidencia de hemorragia intracerebral síntomatica fue 9.8% y de complicaciones en relación a la intervención fue 5.5%. Se obtuvo un buen resultado clínico (mRS
Luego en año 2008, la FDA aprobó el segundo dispositivo de trombectomía cerebral llamado Penumbra Aspiration System, (17). El mecanismo de acción de éste es la fragmentación y aspiración del trombo. El protocolo también utiliza una ventana terapeútica de 8 horas. Los resultados del Penumbra obtuvo una tasa de recanalización de un 81.6%, y se observo un 25% de buen resultado clínico (mRS
En suma, los dos dispositivos actualmente aprobados por la FDA para trombectomía intracraneal obtienen satisfactorios resultados clínicos (mRS
Durante los últimos años, se ha utilizado el stent intracraneano para la recanalización del vaso arterial cerebral ocluido. El estudio nominado stent-assisted recanalization in acute ischemic stroke (SARIS) (19) es el único estudio donde la FDA aprueba la evaluación de un stent intracraneano en pacientes cursando un AVE isquémico agudo. Los stents utilizados fueron el Wingspan (Boston Scientific) y el Enterprise (Cordis). Los resultados son difíciles de interpretar ya que el estudio tiene solamente 20 casos. Se observó una recanalización en todos los casos, y un 60% requirió una terapia adicional como trombolisis y/o angioplastia. Un 45% de los pacientes obtuvo un buen resultado clínico (mRS “Solitaire FR with the intention for thrombectomy” (20) y “Thrombectomy Revascularization of Large Vessel Occlusion in Acute Ischemic Stroke (TREVO)” (21) están en curso. Rubiera et al (22) recientemente publicó su experiencia con 42 pacientes consecutivos con AVE isquémico agudo tratados primero con trombolisis con tPA IV dentro de las primeras 4.5 horas de inicio del cuadro clínico, en dosis habitual y si luego de 60 minutos no ocurría una recanalización del vaso ocluido, el paciente era tratado con trombolisis IA (>90%) y/o trombectomía mecánica dentro de una ventana terapéutica de 6 horas desde el inicio del cuadro clínico en territorio carotideo o 12 horas en territorio de la arteria basilar. Este grupo de paciente fue comparado de forma retrospectiva con otro grupo de 84 pacientes de control históricos tratados únicamente via IV haciendo especial énfasis en que ambos grupos de pacientes fueran comparables en los principales predictores de la evolución clínica. Este estudio demostró que a los tres meses de evolución, el grupo de pacientes con terapia combinada IV e IA obtuvo una mejor tasa de recanalización y mejoría clínica comparado con el grupo con terapia única intravenosa. Es importante notar que los pacientes en este grupo fueron inmediatamente trasladados al pabellón de angiografía luego del inicio de la terapia intravenosa para disminuir los tiempos de espera. También, que la mayoría de los pacientes no fueron sedados ni requirieron anestesia general ya que la sedación en estos pacientes ha sido asociado un factor predictor negativo (23). Un importante estudio randomizado, y prospectivo, que compara la terapia de trombolisis combinada IV y IA versus trombolisis IV es el International Management of Stroke Phase III Trial (24) está actualmente en curso.
Las tasas de recuperación clínica en pacientes tratados con trombolisis IA versus trombectomía mecánica son similares (25) y por lo tanto cada una de estas técnicas tiene que ser cuidadosamente indicada.
Selección del PacienteUn artículo por Yoo A et al (26) recientemente detalla las principales variables clínicas e imaginológicas que contribuyen a una mejor selección del paciente para la terapia endovascular cursando un AVE isquémico agudo. Estas incluyen la magnitud del déficit neurológico, el tamaño del infarto antes del tratamiento, el tiempo de evolución del infarto agudo, edad del paciente y sus comorbilidades y magnitud y ubicación de oclusión. A esta lista se puede agregar también efectividad de reperfusión.
Déficit Neurológico. Los resultados del PROACT II no demostraron una diferencia significativa en la evolución clínica en los pacientes que presentaron con un déficit neurológico menor al ingreso (NIHSS 4-10) y que fueron tratados versus en grupo de control. Por lo tanto se pude inferir de esta observación que pacientes que presentan con un compromiso clínico mayor (NIHSS >10) tienen un mayor beneficio potencial de un tratamiento precoz y efectivo de revascularización.
Tamaño del infarto cerebral antes del tratamiento. Numerosos estudios han demostrado que pacientes con un infarto cerebral final de tamaño grande, mayor a 100ml, tienen una mayor probabilidad de quedar con severas secuelas o de fallecer (27). Esta observación sugiere que el tamaño inicial es un mejor predictor de evolución que el tamaño de la penumbra isquémica. Infartos agudos con un volumen inicial menor a 70ml identificados en imágenes de Resonancia Magnética (RM) en secuencia de Difusión, tienen una mejor evolución dependiendo de la magnitud y precocidad de la reperfusión (28).
Tiempo de evolución del infarto agudo. El beneficio de la trombolisis con tPA IV disminuye a medida que pasa el tiempo de inicio del tratamiento, observándose aún el beneficio hasta las primeras 4.5hrs (29). Esta ventana de tiempo se puede prolongar hasta 8 hrs según los resultados de la terapia endovascular con trombectomía mecánica ya expuestos. Esta prolongación de la ventana terapéutica es de gran importancia ya que se estima que menos de 5% de los paciente que sufre esta patología recibe el tratamiento de trombolisis IV (30) y el tiempo es un factor determinante.
Edad del paciente. Algunos estudios muestran que pacientes mayores de 80 años que cursan con un AVE isquémico agudo tienen un peor pronóstico luego de las terapias IV y IA (31). Sin embargo, otros estudios de revisión no han demostrado un riesgo significativamente diferente en entre pacientes octogenarios y jóvenes tratados con terapia de trombolisis IV (32) o IA (33). Es por esto que la trombolisis cerebral no está contra-indicada en el adulto mayor pero si debe haber una selección muy cuidadosa de cada paciente para esta terapia. Además, la presencia de comorbilidad como Hipertensión Arterial, Diabetes Mellitus, y Fibrilación Auricular, más frecuente en pacientes mayores está asociada a un peor pronóstico.
Ubicación de oclusión. Oclusión de la carótida interna terminal tiene la peor evolución de los distintos infartos en la circulación anterior y el tronco basilar en la circulación posterior.
Evaluación imagenológica del AVE isquémico agudo. La RM incluye la secuencia de Difusión (DWI) que detecta tejido con edema citotóxico y se complementa con la secuencia de Perfusión (PWI). Importantes estudios como el EPITHET (34) y el estudio DEFUSE (35) muestran que pacientes con imágenes de “mismatch” entre DWI/PWI (lesión de menor tamaño en secuencia de DWI versus PWI) indican la presencia de tejido cerebral con oligemia potencialmente rescatable, conocido como penumbra isquémica, que es potencialmente reversible si se obtiene una reperfusión con un tratamiento de trombolisis.
Recientemente, el estudio DEFUSE II (36), un estudio prospectivo, y multicéntrico reporta los resultados de 101 pacientes que presentaron con AVE isquémico agudo (NIHSS >5), dentro de las primeras 12 horas del inicio de sus síntomas, tratados con terapia endovascular y todos evaluados con RM DWI/PWI antes de su tratamiento. Este estudio observó un beneficio significativo en la evolución clínica de pacientes con reperfusión precoz y que en su estudio de RM al ingreso tenían un “Target Mismatch” (TMM) definido como DWI:PWI mayor a 1:1.8, una lesión de DWI menor a 70ml y una lesión de PWI menor a 100ml. No se observó una asociación entre reperfusión precoz y buena evolución clínica en pacientes sin un TMM.
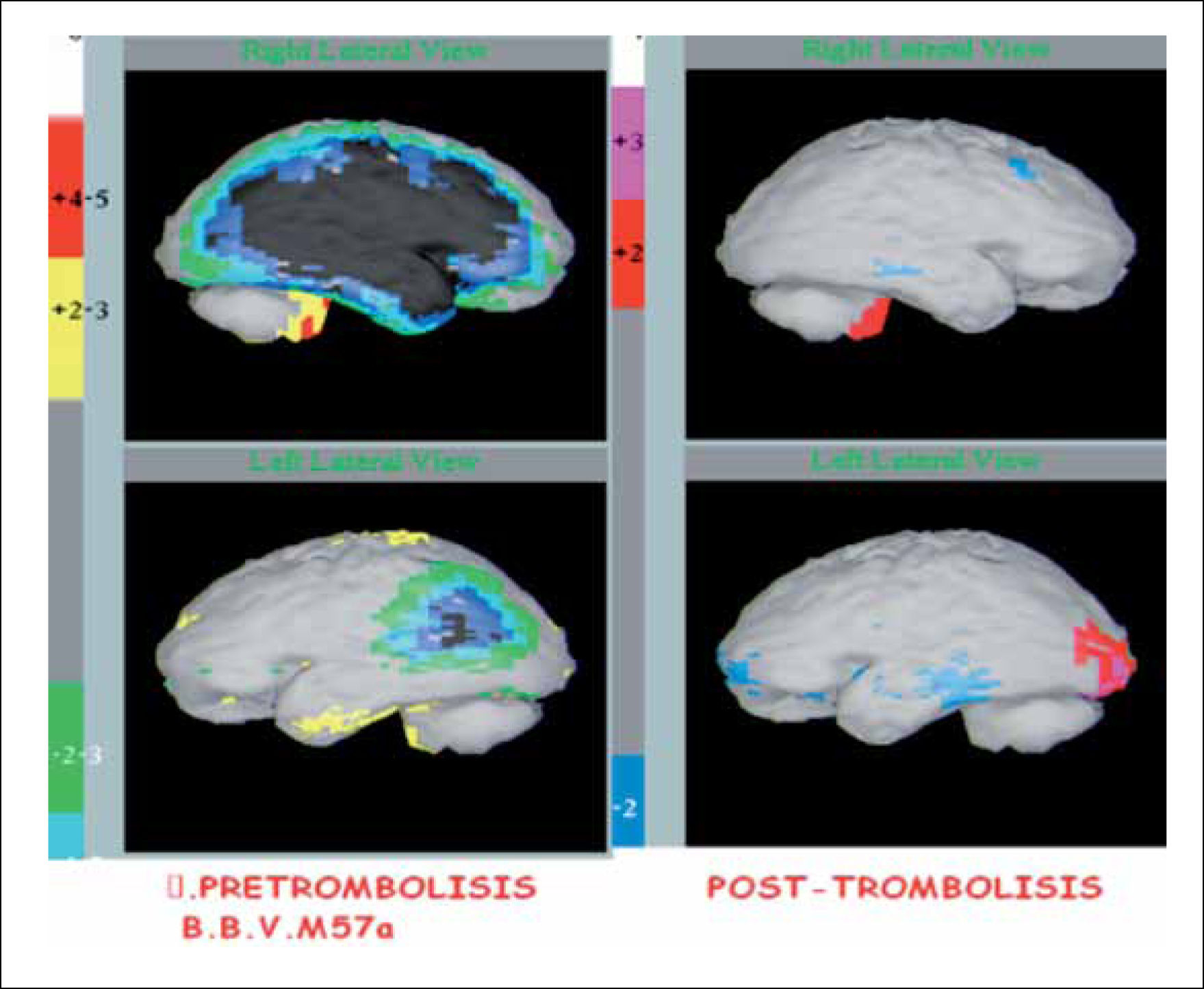
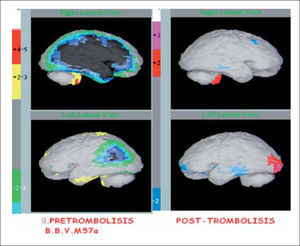
En NeuroSPECT es otro método imaginológico no-invasivo que en estudio pre-trombolisis documenta la magnitud de hipoperfusión cerebral inicial en estudio y el estudio post-trombolisis que se efectúa 24 horas más tarde precisa la magnitud de corrección de la perfusión cerebral luego de terapias de trombolisis (Figura 2). El estudio pre-tratamiento no retrasa el inicio de la terapia ya que el paciente es inyectado con el radiofármaco ya dentro del pabellón, fijando una imagen de la perfusión cerebral en ese momento y posteriormente 2 a 3 horas después se obtiene la imagen inicial cuando el tratamiento ya se ha completado (37).
NeuroSPECT cerebral en AVE isquémico agudo. Muestra imágenes de NeuroSPECT cerebral antes y un control posterior a la trombolisis cerebral donde se observa una extensa hipoperfusión (color oscuro) cerebral bilateral mayor a derecha que luego de la trombolisis se revierte completamente (color gris). El paciente tuvo una excelente evolución.
La incidencia de hemorragia subaracnoidea aneurismática (HSAa) varía según las distintas regiones del mundo y es mayor en Finlandia y Japón, menor en América del sur y Centroamérica e intermedia en el resto del mundo, con una incidencia de 9,1 por 100.000 personas por año; es mayor en el adulto que en niños y es más frecuente en mujeres que en hombres (38). La mortalidad de la HSAa ha disminuido significativamente en Norteamérica desde aproximadamente 57% durante los años 1970s hasta 25-35% al año 2002. De los sobrevivientes se estima que entre 8-20% quedan en una condición dependiente utilizando la escala modificada de Rankin. La tasa de resangrado también es alta de al menos 4% dentro en las primeras 24 horas y aproximadamente 30% dentro del primer mes y el evento de resangramiento tiene una mortalidad de un 70% (39).
El primer clipaje de aneurisma cerebral fue efectuado por el Dr. Walter Dandy en el año 1937 y la primera embolización con coils de aneurisma cerebral en una persona ocurrió en el año 1990 y hecha por el Dr. Guido Guglielmi y el Dr. Fernando Viñuela, de la Universidad de California, Los Angeles (UCLA). La terapia quirúrgica fue de elección para el aneurisma cerebral hasta que en el año 2002 se publicaron los resultados del estudio International Subarachnoid Aneurysm Trial (ISAT) (40). Este fue un estudio randomizado, prospectivo, multicéntrico que comparó los resultados de la terapia quirúrgica y endovascular en pacientes con hemorragia subaracnoidea aguda por un aneurisma cerebral roto. El estudio fue parado precozmente por los significativamente superiores resultados de la terapia endovascular versus quirúrgica, observándose una menor morbilidad y mortalidad al año (23.7% endovascular versus 30.4% quirúrgico). En base a los resultados del estudio ISAT, la terapia endovascular es actualmente ampliamente reconocida como el tratamiento de elección en pacientes con aneurisma cerebral. Todo paciente con HSAa debe ser evaluado precozmente por un equipo multidisciplinario que incluye al neurorradiólogo intervencionista, neurocirujano, neurólogo, y al médico intensivista entre otros, quienes definirán el tipo de tratamiento que requiere cada paciente.
La terapia endovascular también tiene un rol en tratamiento del vasoespasmo cerebral síntomatico secundario a HSAa (Figura 3). El vasoespasmo cerebral es más frecuente entre el 7 a 10 día de la hemorragia y resuelve espontáneamente después de los 21 días. Algunas de las recomendaciones publicadas en las recientes guías de la Sociedad Americana de Stroke (39) en relación a la terapia del vasoespasmo síntomatico incluyen:
- •
EL Doppler Transcraneal es un método diagnóstico razonable para la detección precoz del vasoespasmo cerebral.
- •
La inducción de hipertensión arterial es recomendable en el pacientes con vasoespasmo cerebral sintomático si su estado cardíaco no lo contraindique.
- •
La terapia endovascular con angioplastia cerebral y/o la infusión de medicamentos vasodilatador superselectiva intra-arterial intra-cerebral también es razonable en pacientes con vasoespasmo cerebral sintomático, particularmente sino responde a una terapia antihipertensiva.
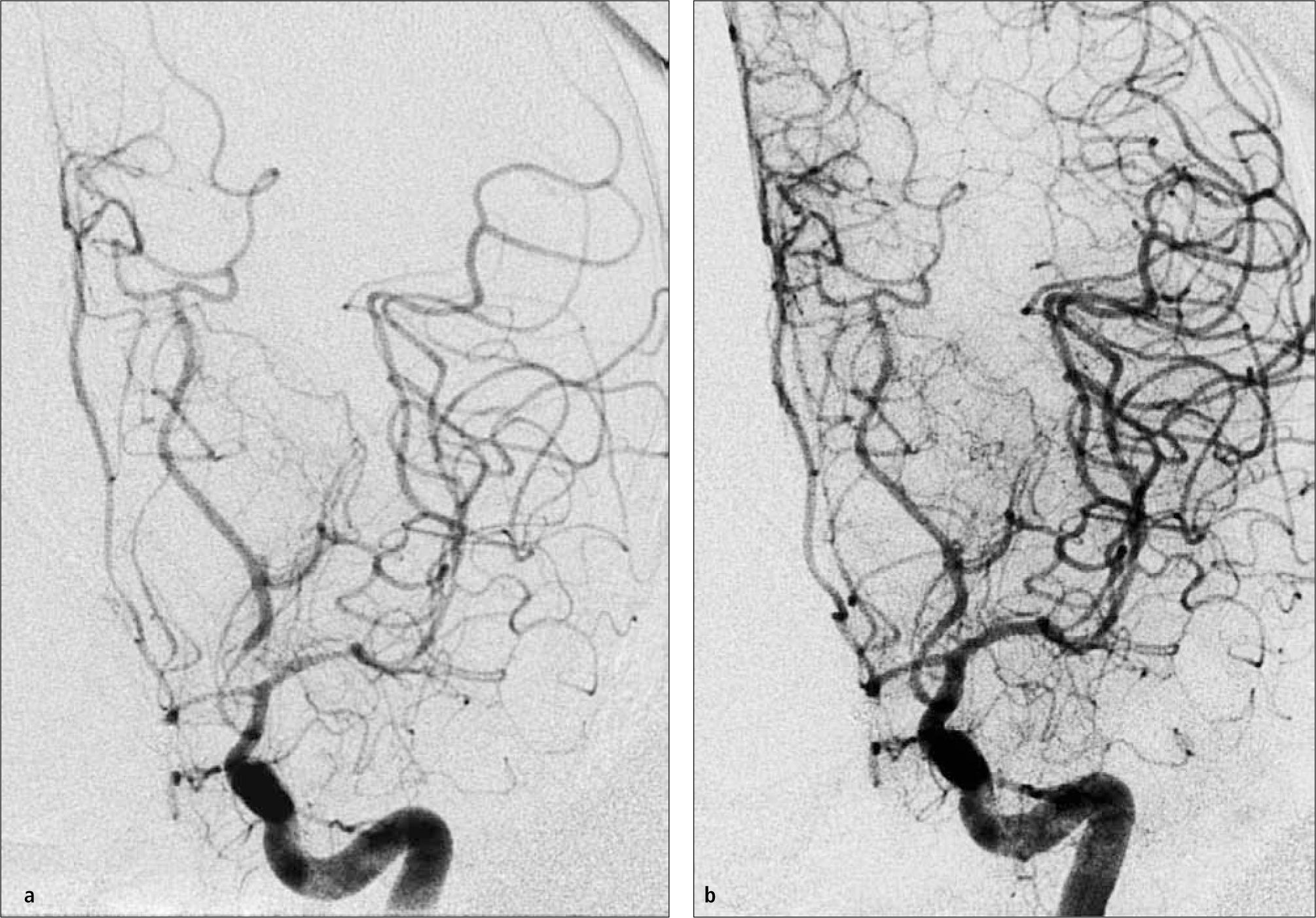
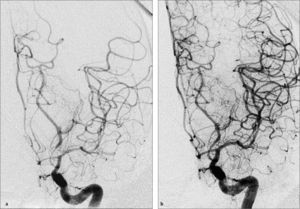
Angioplastia cerebral del vasoespasmo por hemorragia subaracnoidea. (a) Angiografia cerebral digital carotidea izquierda muestra un severo vasoespasmo de arteria cerebral media y cerebral posterior izquierda. (b) Angiografia cerebral luego de angioplastia cerebral farmacológica con Milrinona intra-arterial y angioplastia mecánica muestra un significativa mejoría en el calibre del los vasos de esta circulación.
La alternativa de terapia neuroendovascular para el tratamiento del accidente vascular encefálico agudo es una área de la medicina en rápida expansión. El rescate endovascular del infarto cerebral agudo tiene como principal objetivo la rápida reperfusión del vaso ocluido utilizando la trombolisis intra-arterial cerebral y distintos métodos de trombectomía mecánica o colocación permanente de neurostent. El tratamiento neuro-endovascular de la hemorragia subaracnoidea aguda aneurismática también se ha establecido como la terapia de elección e incluye la embolización convencional con coils del aneurisma cerebral roto o utilizando técnica de embolización balón o stent asistido o colocación primaria de stent con tecnología de divertidor de flujo. Además, con la terapia endovascular se puede efectuar angioplastía farmacológica y mecánica del vasoespasmo cerebral.
El autor declaran no tener conflictos de interés, con relación a este artículo.