La enfermedad de Parkinson es un trastorno neurodegenerativo complejo y de presentación heterogénea. Aunque aún no se dispone de ningún fármaco que enlentezca la progresión de la enfermedad, existe un arsenal terapéutico extenso y eficaz para el control sintomático en cada una de sus fases, por lo que es importante realizar un diagnóstico preciso así como un correcto manejo de fármacos que garantice un estado óptimo en los paciente que la sufren, lo que resultará en una mejora en su calidad de vida. Además, dado que es el trastorno neurodegenerativo más frecuente tras la enfermedad de Alzheimer y que su factor de riesgo principal es la edad, la enfermedad de Parkinson supone, cada vez más, un reto de salud pública en nuestras sociedades occidentales progresivamente envejecidas. Esta revisión pretende actualizar los aspectos clínicos y diagnósticos fundamentales de la enfermedad de Parkinson así como las principales estrategias terapéuticas disponibles.
Parkinson's disease is a complex and clinically heterogeneous neurodegenerative disturbance. In spite of the unavailabilty of a drug to slow disease progresion, there is a wide and effective battery of symptomatic treatments for each stage of the condition. Therefore, an accurate diagnosis and an appropriate management is mandatory to ensure an optimal state of the patients in order to improve their quality of life. In addition, Parkinson's disease is the second most frequent neurodegenerative condition after Alzheimer's disease and aging is its main risk factor. For these reasons, it has become a sociosanitary challenge in occidental gradually aging societies. This review aims to update the principal clinical and diagnostic aspects of Parkinson disease as well as the main therapeutic strategies available.
La enfermedad de Parkinson (EP) es un proceso neurodegenerativo complejo de aparición en la edad adulta y que constituye la segunda enfermedad neurodegenerativa más frecuente por detrás de la demencia tipo Alzheimer. Su etiología es desconocida y, en términos generales, la causa subyacente sería la combinación de factores ambientales y genéticos. Su base anatomopatológica se caracteriza por la pérdida progresiva de neuronas dopaminérgicas de la sustancia negra pars compacta (SNpc) del mesencéfalo, así como la presencia de inclusiones intracelulares llamadas cuerpos de Lewy, que están formados por agregados insolubles de proteína alfa-sinucleina anormalmente plegada. El resultado de dicha neurodegeneración es la denervación dopaminérgica de las proyecciones de la SNpc hacia el núcleo estriado, lo que condiciona una alteración en la fisiología normal de los ganglios basales (GB) que origina las principales manifestaciones de la enfermedad.
La EP se caracteriza clínicamente por la presencia de la tríada motora acinesia o lentitud de movimientos, temblor de reposo y rigidez y por ello ha sido clásicamente considerada y estudiada como un trastorno motor. Sin embargo, en las últimas décadas, ha aumentado el reconocimiento de manifestaciones no motoras como la apatía, el deterioro cognitivo o los síntomas disautonómicos entre otros. Estos síntomas han recibido especial atención por parte de neurólogos e investigadores debido a su elevada frecuencia e impacto en la calidad de vida de los pacientes y familiares, siendo actualmente considerados parte integral de la enfermedad. El diagnóstico de sospecha es clínico y actualmente no disponemos de marcadores biológicos específicos. Exploraciones complementarias como la Resonancia Magnética de cáneo (RMc) o el DaTSCAN permiten excluir otras causas de parkinsonismo y aportan apoyo al diagnóstico de EP.
A pesar de que no existe tratamiento curativo, disponemos de un arsenal terapéutico amplio que permite un buen control sintomático en cada una de las fases de progresión de la enfermedad.
El objetivo de este artículo es actualizar los aspectos clínico-diagnósticos y terapéuticos de una enfermedad que condiciona la calidad de vida de los que la padecen y que constituye un problema creciente de salud pública debido al envejecimiento de la población.
HISTORIA DE LA ENFERMEDAD DE PARKINSONYa 2500 años aC se describen diferentes tipos de temblores y parálisis en textos de la Medicina Ayurvérdica, que probablemente hicieran referencia a EP. Varios siglos más tarde, el médico griego Galeno se refiere en sus compendios a temblores y alteraciones de la marcha con descripciones que dominarán la literatura médica hasta la Edad Media 1. Sin embargo, la EP tal y como la entendemos actualmente nace en 1817, cuando el cirujano británico James Parkinson publica su famosa monografía “An essay on the shacking palsy” 2. El mérito de Parkinson radicó en integrar en un único trastorno manifestaciones que hasta ese momento eran consideradas diferentes entidades. Años más tarde, el eminente neurólogo francés Charcot será quién atribuirá a la enfermedad el epónimo ‘maladie de Parkinson’ y, además, enriquecerá la descripción de los aspectos clínicos 3.
A inicios del siglo XX se empiezan a dilucidar parte de sus mecanismos patogénicos con la descripción, en 1913, por el patólogo Friederich Lewy de las inclusiones citoplasmáticas denominadas cuerpos de Lewy, que contienen principalmente alfa-sinucleína y seis años después, de la degeneración de la SNpc por el neuropatólogo Konstantin Tretiakoff 4. Décadas más tarde, Arvid Carlsson demostrará que el déficit de dopamina constituye el trastorno neuroquímico subyacente a la enfermedad 5, lo cual servirá de base para los ensayos con levodopa de Birmakmayer y Hornykievicz 6 y, posteriormente, Cotzias 7, que convertirán al precursor oral de la dopamina en el eje del tratamiento de la EP hasta nuestros días.
El “milagro” de la levodopa llevó al progresivo abandono de las técnicas ablativas quirúrgicas que habían proliferado desde los años 50 8, pero fue precisamente la aparición de complicaciones derivadas de su uso crónico lo que resultó en una revitalización de las técnicas neuroquirúrgicas, inicialmente de las palidotomías realizadas por Laitinen 9 y, algo más tarde, de la neurocirugía funcional con la aparición de la estimulación cerebral profunda 10. El reciente desarrollo del ultrasonido focal de alta intensidad (High Intensity Focused Ultrasound, “HIFU”, siglas en inglés) 11, abre la puerta a un renacimiento del abordaje lesional mediante una estrategia no quirúrgica.
Estamos por tanto a punto de cumplir 200 años desde la descripción moderna de la EP y no cabe duda que las últimas décadas han sido las más fructíferas en cuanto a conocimiento y mejoría en el tratamiento de la enfermedad.
FISIOLOGÍA DE LOS GANGLIOS BASALESLa base fisiológica de la enfermedad de Parkinson es la disfunción del sistema de los ganglios de la base (GB) debido a la depleción de dopamina, su principal modulador. Los trabajos que trazaron las primeras líneas del modelo actual de los GB vieron luz a finales de los años ochenta 12,13. Los GB son núcleos subcorticales que incluyen el núcleo estriado (caudado y putamen), núcleo subtalámico (NST) y el globo pálido externo (Gpe) e interno (Gpi), con sus conexiones con la SNpc, la substancia negra pars reticulata (SNr) y el núcleo ventro-lateral del tálamo. Estos núcleos están interconectados anatómica y funcionalmente y, mediante proyecciones al tálamo y tronco cerebral (desde su output principal, el complejo Gpi/SNr), constituyen una intrincada red córtico-subcortical. Los GB están anatómicamente segregados en tres circuitos: motor, límbico y asociativo o cognitivo. La porción dorso-lateral de los GB constituye el circuito motor proyectando sobre el córtex motor primario y área motora suplementaria, la porción ventromedial de los núcleos, forma el circuito límbico y conecta con áreas límbicas corticales, y la porción anatómicamente localizada entre ambas proyecta sobre el córtex prefrontral formando el circuito asociativo 14.
Alteraciones de los ganglios basales características de la enfermedad de ParkinsonLa depleción dopaminérgica resulta en alteraciones neurofisiológicas de la actividad de los GB que subyacen a los síntomas cardinales de la enfermedad.
Debido a la pérdida de estimulación dopaminérgica se produce una potenciación de la llamada vía indirecta o “inhibidora” de la selección del programa motor sobre la directa o “facilitadora” de movimiento. La falta de dopamina se traduce en una hiperactividad (incremento de la tasa de descarga) del NST y del complejo Gpi/SNr y por lo tanto una inhibición tálamo-cortical. Este aumento en la tasa de descarga ha sido asociado a estados de depleción dopaminérgica tanto en modelos animales de EP como en registro intraoperatorio de pacientes implantados con electrodos de estimulación cerebral profunda 15–17. Consistente con estos hallazgos, las discinesias inducidas por levodopa (es decir, la manifestación clínica opuesta al estado motor parkinsoniano) se asocian a una menor actividad en Gpi y NST 18. Además, la falta de dopamina produce una tendencia de las neuronas en los GB a descargar de manera oscilatoria en lugar de la activación tónica fisiológica. Debido a las múltiples interconexiones entre los GB y la de estos con tálamo y córtex, este patrón de descarga patológico se sincroniza en todo el sistema, a diferencia de lo que sucede en condiciones fisiológicas normales en que el patrón de descarga neuronal es funcionalmente específico para cada núcleo 19. Estudios de registro de potenciales de campo locales en los GB han relacionado el estado motor parkinsoniano con un patrón de descarga de predominio en banda beta (11-30Hz) y su reversión a banda gamma (60-80Hz) tras la toma de levodopa y consecuente mejoría clínica.
A pesar de los avances en el conocimiento del modelo de los GB, persisten algunos “gaps” y paradojas sin esclarecer como el origen del temblor o la contraintuitiva mejoría de las discinesias al realizar una lesión o estimulación palidal que no tiene explicación en el modelo actual.
EPIDEMIOLOGÍA Y ETIOLOGÍA DE LA ENFERMEDAD DE PARKINSONLa frecuencia reportada de la EP varía dependiendo de los criterios diagnósticos empleados, la población estudiada o los métodos epidemiológicos utilizados. La prevalencia de esta enfermedad se estima en 0,3% de la población general y siendo aproximadamente el 1% en mayores de 60 años. La incidencia estimada es de 8 a 18 por 100.000 habitantes/año 20. Casi todos los estudios epidemiológicos han mostrado que tanto la incidencia como la prevalencia de la EP es de 1,5 a 2 veces mayor en hombres que en mujeres, lo que ha sugerido un posible efecto protector de los estrógenos 21. Por otro lado, se trata de una enfermedad de distribución universal aunque se han sugerido diferencias interétnicas como un mayor riesgo en poblaciones hispanas 22.
La mayoría de los casos de la enfermedad de Parkinson son esporádicos, siendo el envejecimiento el principal factor de riesgo. Por otra parte, son conocidas algunas formas de EP causadas por una mutación genética específica. En el caso de la EP de inicio joven (<40 años) que representan alrededor del 5% de los pacientes con EP 23, la probabilidad de un origen genético es mayor que en los de inicio más tardío y principalmente se asocian a una herencia autosómica recesiva. En los pacientes con EP de inicio anterior a los 45 años, la mutación más común es la del gen de la parkina, presente en el 50% de los casos familiares y en el 15% de los esporádicos 24. Además, algunos factores ambientales como la exposición a pesticidas o traumatismos cráneo-encefálicos repetidos han sido asociados a un aumento de riesgo, mientras que otros como el consumo de cafeína, tabaco o alcohol, o la toma de antiinflamatorios no esteroides podrían ser factores protectores 25.
El pronóstico es muy variable aunque, en términos generales, la edad avanzada en el momento del diagnóstico y la presentación como forma rígido-acinética serían factores predictores de una progresión más rápida, mientras que la forma de inicio tremórico tiene mejor pronóstico 26. Aunque el arsenal terapéutico disponible ha mejorado sustancialmente la comorbilidad de la enfermedad y alargado la supervivencia de los pacientes con EP, la mortalidad sigue siendo ligeramente mayor que la de la población general 27.
CLÍNICA DE LA ENFERMEDAD DE PARKINSONManifestaciones motorasLa EP se caracteriza por alteraciones fundamentalmente motoras 2,28. Los signos cardinales típicos son el temblor de reposo que se presenta en el 70% de los casos y es típicamente grosero y de gran amplitud, con una frecuencia de entre 4 y 6Hz; la rigidez que es característicamente en rueda dentada; y la acinesia, que se presenta tanto en movimientos espontáneos como en voluntarios, y típicamente, manifiesta con fatigabilidad y decremento progresivo de la amplitud durante movimientos repetitivos 29. Estas manifestaciones serían consecuencia de la pérdida de inervación dopaminérgica en el estriado 30. Debido a la heterogeneidad clínica de presentación, se ha intentado clasificar la enfermedad en subtipos, aunque no existe un consenso generalizado. Así, existiría la forma de predominio tremórico, con una ausencia relativa de otros síntomas, y la de predominio no tremórico que incluiría el fenotipo rigido-acinético y aquellos con inestabilidad y trastorno de la marcha (conocido como PIGD: “postural instability and gait disorder”). Además, podría definirse otro subgrupo con un fenotipo clínico mixto o indeterminado 31. Esta diferenciación tendría implicaciones pronósticas ya que el curso de la enfermedad difiere entre los subtipos, siendo los de predominio tremórico de evolución más lenta, menor incapacidad y menor riesgo de deterioro cognitivo que aquellos no tremóricos 32,33.
Manifestaciones no motorasEl reconocimiento de los síntomas no motores ha ganado relevancia en los últimos años debido a su elevada prevalencia que se incrementa conforme la enfermedad progresa (hasta el 90% según la serie) y un impacto negativo sobre la calidad de vida de los pacientes que puede ser mayor que el de las manifestaciones motoras 34,35. Éstos incluyen síntomas muy variados como apatía o depresión, alteraciones del sueño, disfunción autonómica o síntomas sensitivos (Tabla 1). Algunos síntomas como la hiposmia, el estreñimiento, la depresión, y el trastorno de conducta de sueño REM pueden preceder en varios años a las manifestaciones motoras clásicas y por lo tanto al diagnóstico de la enfermedad 36. Otros estudios sugieren también, la hipersomnia diurna, la alteración en la visión de los colores, la apatía, la fatiga y el dolor de origen “central” como posibles síntomas premotores. Es por ello que la existencia de este periodo prodrómico es importante a nivel terapéutico ya que podría aportar una potencial ventana temporal para terapias modificadoras de la progresión en el momento en el que estén disponibles, y así prevenir o retrasar el desarrollo de la enfermedad 37.
SÍNTOMAS NO MOTORES MÁS COMUNES EN LA ENFERMEDAD DE PARKINSON
| - Síntomas neuropsiquiátricos: Depresión, ansiedad, apatía. Alucinaciones (sobre todo visuales), ilusiones y delirios que pueden ser inducidos por la medicación. Deterioro cognitivo leve y demencia. Trastorno del control de impulsos y síndrome de disregulación dopaminérgica (relacionados con agentes dopaminérgicos). Ataques de pánico. |
| - Ataques de pánico que pueden aparecer en los episodios “OFF”. |
| - Trastornos del sueño: Trastornos de conducta del sueño REM, hipersomnia diurna excesiva, ataques de sueño, insomnio, síndrome de piernas inquietas y movimientos periódicos de las piernas. |
| - Síntomas sensitivos: Dolor, hiposmia, trastornos visuales (visión borrosa, diplopia, alteración en la visión de los colores). |
| - Fatiga. |
| - Disfunción autonómica: Urgencia y frecuencia miccional, nicturia, disfunción sexual, hiperhidrosis e hipotensión ortostática. |
| - Síntomas gastrointestinales: Sialorrea, disfagia, estreñimiento. |
La aparición de estos síntomas se ha relacionado con la distribución de los cuerpos de Lewy en el sistema nervioso (sistema nervioso periférico, bulbo olfatorio, tronco cerebral, sistema límbico y corteza cerebral) según el mapa de sinucleopatía descrito por Braak y Braak. Sin embargo, su sustrato patológico no se explica completamente por esta hipótesis que, además, no define la extensión de la neurodegeneración 38. Algunos de estos síntomas pueden responder a la medicación dopaminérgica como puede observarse en la fluctuaciones no motoras (ver abajo), sin embargo, en el origen de muchos otros estarían implicados otros sistemas de neurotransmisores como la serotonina, noradrenalina y acetilcolina y requieren de un tratamiento específico (Tabla 2) 34.
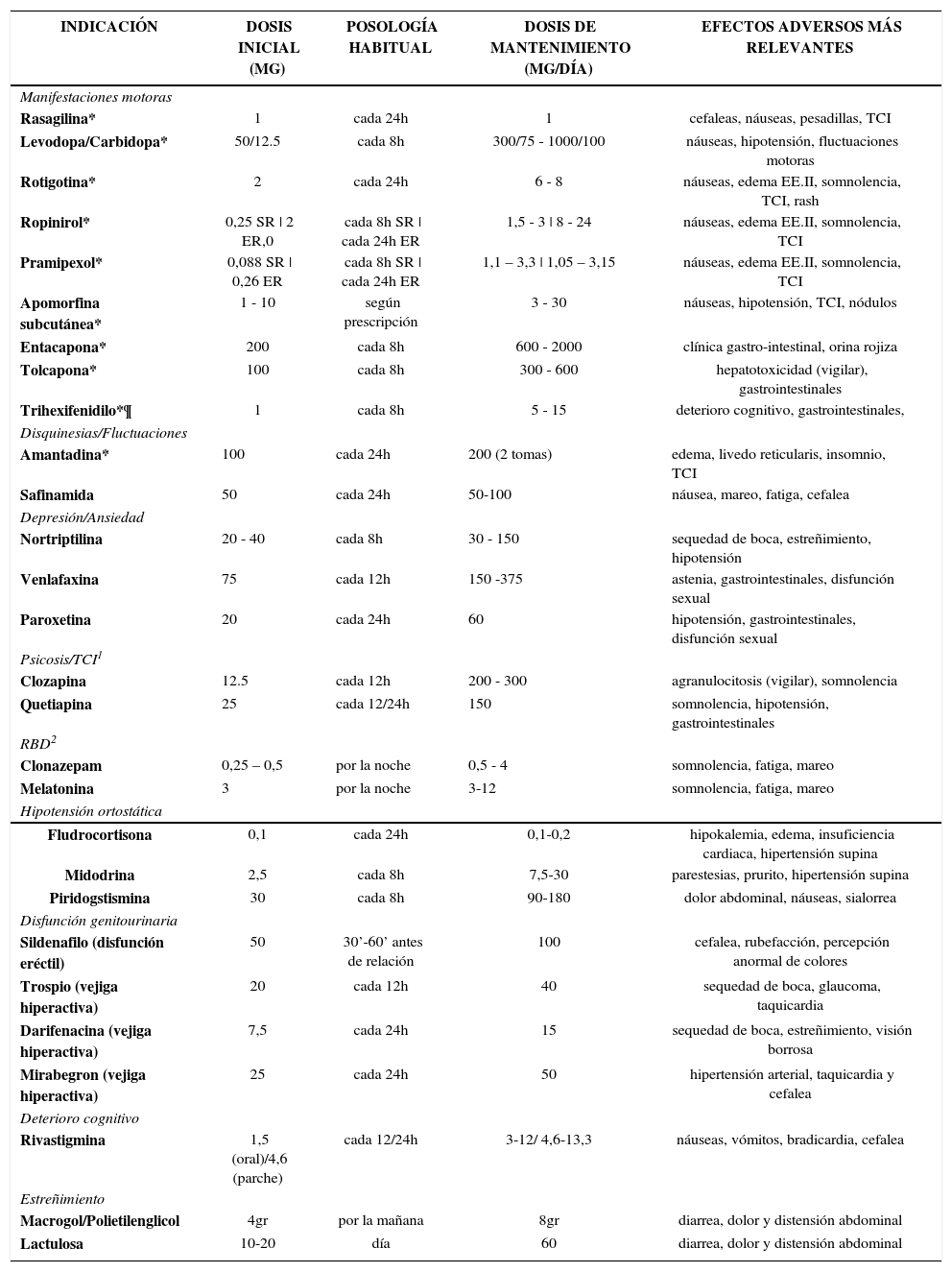
FÁRMACOS COMÚNMENTE EMPLEADOS EN EL MANEJO DE LA ENFERMEDAD DE PARKINSON
| INDICACIÓN | DOSIS INICIAL (MG) | POSOLOGÍA HABITUAL | DOSIS DE MANTENIMIENTO (MG/DÍA) | EFECTOS ADVERSOS MÁS RELEVANTES |
|---|---|---|---|---|
| Manifestaciones motoras | ||||
| Rasagilina* | 1 | cada 24h | 1 | cefaleas, náuseas, pesadillas, TCI |
| Levodopa/Carbidopa* | 50/12.5 | cada 8h | 300/75 - 1000/100 | náuseas, hipotensión, fluctuaciones motoras |
| Rotigotina* | 2 | cada 24h | 6 - 8 | náuseas, edema EE.II, somnolencia, TCI, rash |
| Ropinirol* | 0,25 SR | 2 ER,0 | cada 8h SR | cada 24h ER | 1,5 - 3 | 8 - 24 | náuseas, edema EE.II, somnolencia, TCI |
| Pramipexol* | 0,088 SR | 0,26 ER | cada 8h SR | cada 24h ER | 1,1 – 3,3 | 1,05 – 3,15 | náuseas, edema EE.II, somnolencia, TCI |
| Apomorfina subcutánea* | 1 - 10 | según prescripción | 3 - 30 | náuseas, hipotensión, TCI, nódulos |
| Entacapona* | 200 | cada 8h | 600 - 2000 | clínica gastro-intestinal, orina rojiza |
| Tolcapona* | 100 | cada 8h | 300 - 600 | hepatotoxicidad (vigilar), gastrointestinales |
| Trihexifenidilo*¶ | 1 | cada 8h | 5 - 15 | deterioro cognitivo, gastrointestinales, |
| Disquinesias/Fluctuaciones | ||||
| Amantadina* | 100 | cada 24h | 200 (2 tomas) | edema, livedo reticularis, insomnio, TCI |
| Safinamida | 50 | cada 24h | 50-100 | náusea, mareo, fatiga, cefalea |
| Depresión/Ansiedad | ||||
| Nortriptilina | 20 - 40 | cada 8h | 30 - 150 | sequedad de boca, estreñimiento, hipotensión |
| Venlafaxina | 75 | cada 12h | 150 -375 | astenia, gastrointestinales, disfunción sexual |
| Paroxetina | 20 | cada 24h | 60 | hipotensión, gastrointestinales, disfunción sexual |
| Psicosis/TCI1 | ||||
| Clozapina | 12.5 | cada 12h | 200 - 300 | agranulocitosis (vigilar), somnolencia |
| Quetiapina | 25 | cada 12/24h | 150 | somnolencia, hipotensión, gastrointestinales |
| RBD2 | ||||
| Clonazepam | 0,25 – 0,5 | por la noche | 0,5 - 4 | somnolencia, fatiga, mareo |
| Melatonina | 3 | por la noche | 3-12 | somnolencia, fatiga, mareo |
| Hipotensión ortostática | ||||
| Fludrocortisona | 0,1 | cada 24h | 0,1-0,2 | hipokalemia, edema, insuficiencia cardiaca, hipertensión supina |
| Midodrina | 2,5 | cada 8h | 7,5-30 | parestesias, prurito, hipertensión supina |
| Piridogstismina | 30 | cada 8h | 90-180 | dolor abdominal, náuseas, sialorrea |
| Disfunción genitourinaria | ||||
| Sildenafilo (disfunción eréctil) | 50 | 30’-60’ antes de relación | 100 | cefalea, rubefacción, percepción anormal de colores |
| Trospio (vejiga hiperactiva) | 20 | cada 12h | 40 | sequedad de boca, glaucoma, taquicardia |
| Darifenacina (vejiga hiperactiva) | 7,5 | cada 24h | 15 | sequedad de boca, estreñimiento, visión borrosa |
| Mirabegron (vejiga hiperactiva) | 25 | cada 24h | 50 | hipertensión arterial, taquicardia y cefalea |
| Deterioro cognitivo | ||||
| Rivastigmina | 1,5 (oral)/4,6 (parche) | cada 12/24h | 3-12/ 4,6-13,3 | náuseas, vómitos, bradicardia, cefalea |
| Estreñimiento | ||||
| Macrogol/Polietilenglicol | 4gr | por la mañana | 8gr | diarrea, dolor y distensión abdominal |
| Lactulosa | 10-20 | día | 60 | diarrea, dolor y distensión abdominal |
1TCI: Trastorno de control de impulsos. Se suele recomendar reducir o eliminar lentamente agonistas dopaminérgicos primero si el paciente toma, antes de empezar con los fármacos descritos 2RBD: Trastorno de conducta de sueño en la fase REM; SR: liberación estándar (standard release); ER: liberación retardada (extended reléase); EE.II: Extremidades inferiores *Pueden inducir alucinaciones y/o psicosis ¶ Usado para el tratamiento del temblor principalmente.
A pesar de su relevancia, los síntomas no motores en la EP son frecuentemente poco reconocidos, probablemente porque la consulta médica se centra fundamentalmente en las manifestaciones motoras, pero también porque el profesional sanitario puede no ser consciente de que estos síntomas son propios de la enfermedad. Existen escalas validadas como el NMS-Quest, SCOPA o la escala UPDRS que son de utilidad para el reconocimiento y valoración de estos síntomas 34.
Progresión de la enfermedadConforme la enfermedad avanza, las manifestaciones motoras cardinales, que habitualmente se presentan inicialmente en un solo hemicuerpo, se generalizan afectando también al lado contralateral, aunque la enfermedad suele mantener cierto grado de asimetría a lo largo de su evolución. Además, mayor denervación dopaminérgica resulta en una peor capacidad para almacenar, recaptar y liberar la levodopa ingerida, por lo que la concentración de dopamina en el cerebro se vuelve progresivamente más errática resultando en las típicas complicaciones en relación con el tratamiento dopaminérgico. Éstas incluyen las fluctuaciones motoras: deterioro fin de dosis cuando la toma de dopamina no mantiene el efecto hasta la toma sucesiva, fallo del efecto de una dosis, o bloqueos repentinos; las fluctuaciones no motoras, entre los que destacan ansiedad, sudoración profusa, bradipsiquia, fatiga y acatisia y las disquinesias: la distonia dolorosa del bloqueo matutino, las disquinesias de pico de dosis cuando el nivel de dopamina es máximo o las difásicas cuando el paciente está pasando del estado de bloqueo al estado ON o viceversa y la concentración de dopamina está en ascenso o descenso.
Con la progresión de la enfermedad aparece el deterioro de las llamadas manifestaciones axiales, que incluyen manifestaciones motoras que pueden ser gravemente incapacitantes como son la alteración de los reflejos posturales y la imantación de la marcha, la hipofonía, la disartria y la disfagia. Los estudios prospectivos muestran que, tras 20 años de evolución, el 87% de los pacientes sufre caídas y el 81% imantación 39. Estas alteraciones constituyen uno de los principales problemas en la EP avanzada ya que no suelen responder al tratamiento dopaminérgico en igual medida que las manifestaciones motoras cardinales. Mientras que las alteraciones del equilibrio pueden resultar en caídas y complicaciones secundarias a éstas, la disfagia, que inicialmente es a líquidos, puede aumentar el riesgo de neumonías por aspiración 27.
Finalmente, cabe destacar la prevalencia de la demencia en la EP, que ocurre en el 83% de los pacientes tras 20 años de enfermedad 39. Esta demencia se caracteriza por el deterioro en diferentes dominios cognitivos como son la atención, la función ejecutiva, la memoria y la función visuoespacial, junto con síntomas neuropsiquiátricos como cambios afectivos, las alucinaciones (de predominio visual), y la apatía 40. Este estadio contribuye de manera marcada a la pérdida de autonomía del paciente, lo que conlleva un alto impacto tanto en su calidad de vida como la de sus familiares 41. El deterioro cognitivo leve (DCL) en la EP se considera un factor de riesgo de demencia 42–44 y afecta al 26.7% de los pacientes con EP no dementes 45. Este estadio es heterogéneo y a pesar de no conocerse con exactitud qué subtipo de DCL predice la progresión a demencia, algunos estudios apuntan a que una disfunción cortical posterior (principalmente alteración en función visuoespacial y fluencia verbal semántica) implica mayor riesgo de demencia 46,47. Se han descrito otros factores de riesgo de la demencia en la EP, siendo los más importantes la edad, la presencia de alucinaciones visuales y además el endofenotipo rígido-acinético ya mencionado previamente 48,49.
DIAGNÓSTICO DE LA ENFERMEDAD DE PARKINSONEl diagnóstico de la EP en vida es un diagnóstico de sospecha clínica. El diagnóstico “definitivo” precisa de la confirmación de los hallazgos neuropatológicos característicos, es decir, pérdida neuronal a nivel de la SNc y la presencia de cuerpos y neuritas de Lewy, y solo puede hacerse una vez que el sujeto ha fallecido 50. No obstante, los criterios clínicos más empleados son los del Banco de Cerebros del Reino Unido (Tabla 3) y permiten definir con una precisión elevada, cercana al 75-95%, que realmente se trata de una enfermedad de Parkinson 51. Se fundamentan en:
- i.
La presencia de un parkinsonismo (definido por bradicinesia -o lentitud de movimiento- y al menos otro signo motor).
- ii.
La exclusión de otras causas justificantes, generalmente descartadas por los antecedentes del paciente y el examen físico neurológico (ver más adelante)
- iii.
La existencia de datos característicos de la enfermedad de Parkinson que apoyen este diagnóstico 50. Recientemente, la Movement Disorder Society (MDS) ha publicado unos nuevos criterios que están pendientes de ser formalmente validados 51 y que se fundamentan en los mismos principios que los criterios “clásicos” del Banco de Cerebros del Reino Unido.
CRITERIOS DEL BANCO DE CEREBROS DE REINO UNIDO PARA EL DIAGNÓSTICO DE ENFERMEDAD DE PARKINSON IDIOPÁTICA
| 1er paso – Diagnóstico del síndrome parkinsoniano |
| • Bradicinesia (lentitud en el inicio del movimiento voluntario con reducción progresiva de la velocidad y la amplitud del mismo tras una acción repetida). |
| • Además uno de los siguientes signos: |
| – Rigidez muscular. |
| – Temblor de reposo a 4-6 hercios. |
| – Inestabilidad postural no debida a afectación visual, vestibular, cerebelosa o propioceptiva primaria. |
| 2° paso – Criterios de exclusión de enfermedad de Parkinson |
| • Antecedente de ictus de repetición con una progresión escalonada de los signos parkinsonianos. |
| • Antecedente de traumatismos craneoencefálicos repetidos. |
| • Antecedente de encefalitis. |
| • Antecedente de crisis oculógiras. |
| • Tratamiento con neurolépticos al inicio de la sintomatología. |
| • Existencia de más de un familiar afecto. |
| • La enfermedad remite de forma sostenida. |
| • Afectación estrictamente unilateral después de tres años. |
| • Paresia supranuclear de la mirada. |
| • Signos cerebelosos. |
| • Afectación autonómica importante de forma precoz. |
| • Aparición de demencia de forma precoz con alteración en memoria, lenguaje y praxias. |
| • Signo de Babinski. |
| • Presencia de un tumor cerebral o hidrocefalia comunicante en un scanner cerebral. |
| • Respuesta negativa a una dosis suficiente de levodopa (una vez excluida malabsorción). |
| • Exposición a MPTP |
| 3er paso – Datos de apoyo positivos durante el seguimiento de la enfermedad |
| (Se requieren tres o más para el diagnóstico de enfermedad de Parkinson establecida) |
| • Inicio unilateral. |
| • Presencia de temblor de reposo. |
| • Curso progresivo. |
| • Asimetría mantenida con predominio de la afectación en un lado del cuerpo |
| • Respuesta excelente a levodopa (70–100%) |
| • Presencia de discinesias marcadas inducidas por levodopa. |
| • Respuesta a levodopa tras cinco o más años. |
| • Duración de la enfermedad diez o más años |
MPTP: 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine.
N.B. Estos criterios están siendo revisados y mejorados por la Movement Disorders Society actualmente (Berg 2015).
Los elementos fundamentales para llegar a este diagnóstico clínico son una anamnesis y una exploración neurológica detalladas. En la anamnesis, debemos resaltar como elementos sugestivos de EP el curso lentamente progresivo de la clínica cardinal motora (o parkinsonismo) y su distribución típicamente asimétrica 52. Es fundamental interrogar respecto a la medicación actual, ya que muchos fármacos debido a su acción bloqueante dopaminérgica pueden inducir un parkinsonismo farmacológico: los neurolépticos con la excepción de la clozapina y la quetiapina 53, algunos antieméticos como la metoclopramida, fármacos para tratar la flatulencia (cleboprida) y antivertiginosos (sulpiride y tietilperazina) entre otros 54. El parkinsonismo secundario a fármacos suele tener características distintas a la EP idiopática ya que la clínica es predominantemente rígido-acinética y su presentación simétrica.
En la exploración neurológica, aparte de objetivar las manifestaciones motoras características de la EP (temblor de reposo, rigidez, bradicinesia) para apoyar la sospecha clínica, se debe descartar la presencia de signos atípicos sugestivos de otras causas parkinsonismos, como son parálisis supranuclear de la mirada (característico de la parálisis supranuclear progresiva o PSP), la existencia de alteraciones cerebelosas o del equilibrio (típicas de la atrofia multisistema o AMS y de la PSP), déficits cognitivos clínicamente significativos de inicio precoz, signos corticales como apraxia motora o alteraciones de la sensibilidad cortical (especialmente en el síndrome/degeneración córtico basal gangliónica o DCB) y disfunción autonómica (propio de la AMS) 55. Un “ensayo terapéutico” con levodopa puede también ayudar al diagnóstico en casos dudosos, ya que la EP responde de forma significativa al tratamiento mientras que en los parkinsonismos secundarios y atípicos la respuesta suele ser más limitada.
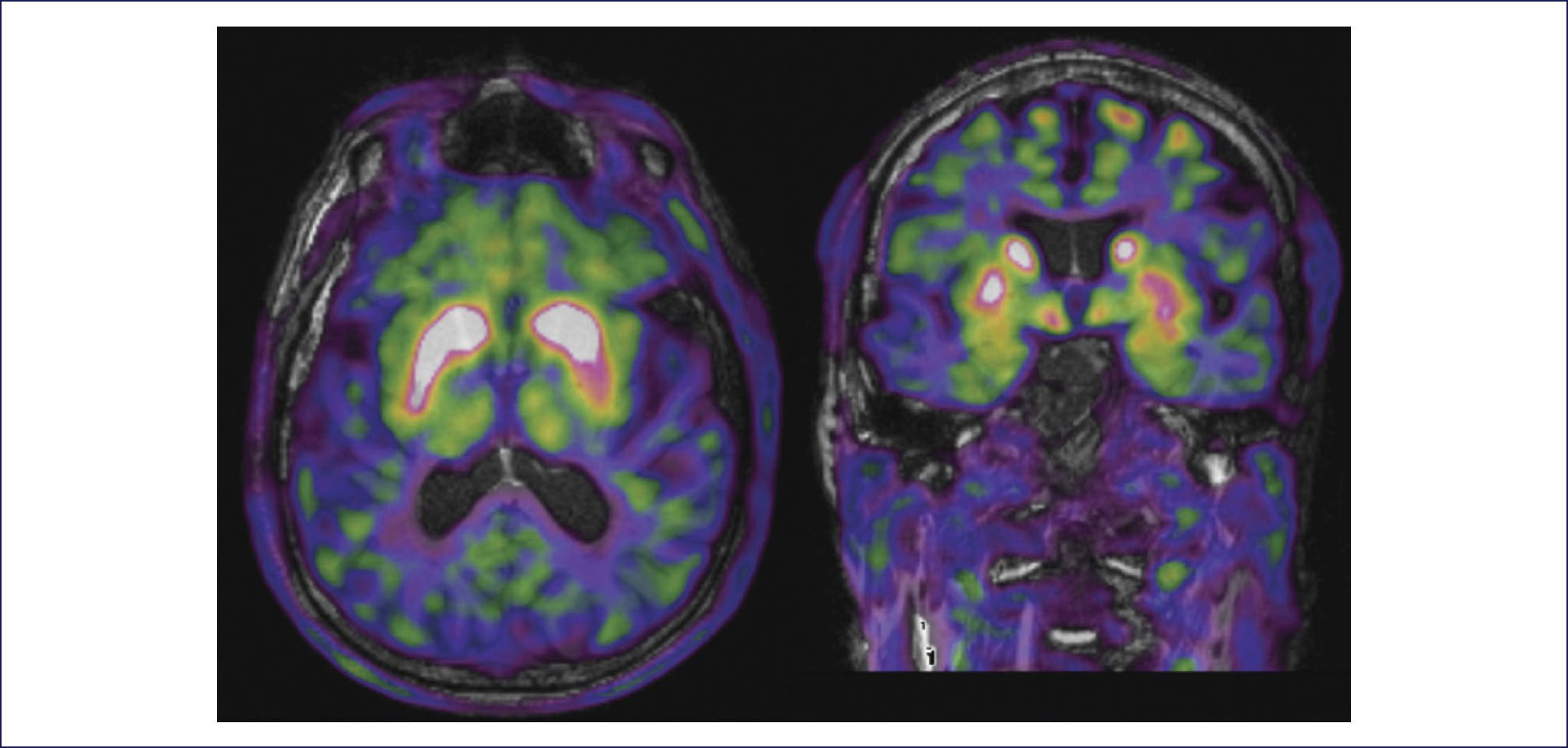
Aunque no es estrictamente necesario para el diagnóstico, a todo paciente con sospecha de EP se le debería realizar una analítica general básica con medición de hormonas tiroideas. Las guías NICE elaboradas por el instituto de salud Británico desaconsejan realizar pruebas complementarias de forma rutinaria (Royal College of Physicians (UK), 2006), sin embargo, realizar una Resonancia Magnética de cráneo puede ser de utilidad para descartar lesiones isquémicas crónicas cuando hay sospecha de un parkinsonismo vascular o en casos en que se sospeche el diagnóstico de parkinsonismo atípico, ya que existen hallazgos característicos de cada entidad que permiten orientar el diagnóstico. Estudios de neuroimagen funcional como el SPECT de transportadores de dopamina o DaTSCAN o el PET con el trazador [18F]-L-6-fluorodopa, evalúan la integridad de la vía dopaminérgica (Figura 1) y pueden ayudar en casos en que exista la duda entre una EP tremórica o temblor esencial (Royal College of Physicians (UK), 2006). Este tipo de pruebas también son útiles para descartar parkinsonismos farmacológicos 56 y en el diagnostico diferencial de EP con parkinsonismos atípicos, sobre todo si se complementan con estudios del transportador de dopamina postsináptico o IBZM 57. En algunos pacientes concretos pueden ser de utilidad otros estudios específicos como una valoración urológica (ecografía y/o estudio urodinámico) en el caso de sospecharse una disfunción vesical 58, un estudio del sistema nervioso autónomo en el caso de existir hipotensión ortostática 59 o un estudio electromiográfico en el caso de sospecharse una polineuropatía concomitante 60.
Finalmente, los estudios genéticos con análisis del probando para las mutaciones más frecuentes sólo se recomienda en casos con clara transmisión familiar con varios familiares de primer grado afectados 24.
TRATAMIENTO DE LA ENFERMEDAD DE PARKINSONLos tratamientos actualmente disponibles tienen un efecto estrictamente sintomático 61. Ningún fármaco ha demostrado efecto curativo (o neuroprotector) en los ensayos clínicos realizados hasta la fecha 62. El tratamiento de los síntomas debe estar adaptado al tiempo de evolución, fase de la enfermedad (precoz versus avanzada), al tipo de sintomatología presente y la discapacidad que conlleva (motora y no motora).
Enfermedad de Parkinson precozAspectos motoresLa levodopa o precursor oral de la dopamina es el gold-standard y fármaco más eficaz para el tratamiento de las manifestaciones motoras de la EP 63. Sin embargo, actualmente existen otras múltiples estrategias terapéuticas farmacológicas que están resumidas en la Tabla 2.
Desde la aparición de la levodopa, otros fármacos que demostrado eficacia de le enfermedad tanto en cuánto a la clínica motora como a algunos aspectos no motores. Entre ellos destacan la rasagilina (IMAO-B) y los agonistas dopaminérgicos no ergóticos como la rotigotina, pramipexol o ropinirol. Éstos últimos tiene un perfil similar sin claros efectos de clase aunque se han propugnado algunas diferencias entre ellos especialmente en cuánto a efectos adversos. Los agonistas dopaminérgicos ergóticos (cabergolina, bromocriptina, lisuride) han caído en desuso debido a un posible aumento de riesgo de fibrosis valvular cardíaca, por lo que si se utilizan, requieren controles ecográficos rutinarios 64.
Normalmente, la decisión de empezar el tratamiento se debe individualizar y consensuar con el paciente, aunque no debiera aplazarse sino existe razón para ello 65. En estadios iniciales de la enfermedad puede comenzarse con rasagilina en monoterapia. Sin embargo, debido a que su efecto sintomático es relativamente reducido, ante una afectación clínica con repercusión en la vida del paciente, se puede combinar con agonistas dopaminérgicos o levodopa o empezar directamente con éstos como tratamiento.
Le elección de iniciar agonistas o levodopa suele hacerse en función de la edad. Los primeros se usan de inicio sobre todo en personas menores de sesenta años, mientras que la levodopa de inicio se reservaría para sujetos de mayor edad. Esta práctica buscaría diferir las complicaciones motoras inherentes al uso de esta última 65. Sin embargo, recientemente, se ha demostrado que el desarrollo de complicaciones motoras depende del tiempo de evolución de la enfermedad y no del tiempo desde el inicio de la levodopa 66, por lo que no se debe retrasar su administración si el paciente lo requiere para un buen control clínico 67.
A medida que la enfermedad va progresando y en función del beneficio sintomático obtenido, la dosis se va optimizando según el rango terapéutico habitual de cada fármaco (Tabla 2) y, cuando esto ya no es posible en monoterapia, es habitual asociar otro fármaco o, en el caso que no se esté administrando, iniciar tratamiento con levodopa 61. Existen fórmulas publicadas que determinan las dosis de todos estos fármacos en dosis equivalente de levodopa y que ayudan a la hora de ajustar el tratamiento 68.
Es recomendable advertir a los pacientes que deben ingerir la levodopa antes de las comidas y sin contenido gástrico ya que la digestión interfiriere con su absorción pudiendo volverla más errática y consecuentemente afectar su eficacia 69. Si no se obtiene beneficio a pesar de haber alcanzado una dosis adecuada durante un periodo de tiempo suficiente (p.e. 600mg de levodopa por un periodo al menos de 12 semanas) es razonable considerar un diagnóstico alternativo y realizar exploraciones complementarias si es necesario 70.
En la Tabla 2 se pueden encontrar las complicaciones más frecuentemente asociadas a los tratamientos médicos utilizados en la EP. El efecto adverso más frecuente en fármacos con efecto dopaminérgico son las náuseas o vómitos. Para evitarlos, se aconseja premedicar con domperidona cada ocho horas al inicio del tratamiento y durante el periodo de aumento de dosis (generalmente un mes) 71. Este antiemético no presenta efectos secundarios motores a diferencia de otros como la metoclopramida, que pueden empeorar el parkinsonismo. Tras 30 años de experiencia clínica no se han observado efectos secundarios importantes, sin embargo, en los últimos años existe una alarma en algunos países por un posible riesgo de cardiotoxicidad. Por ello, es recomendable mantener la dosis mínima necesaria y retirar la medicación progresivamente cuando el paciente tolere bien la medicación dopaminérgica 72. La somnolencia diurna secundaria a la levodopa también es relativamente frecuente y puede ser consecuencia de su efecto hipotensor. Por ello, en pacientes que la sufran se recomienda realizar tomas sistemáticas de la presión arterial y si se objetiva una disminución significativa, reducir hipotensores en el caso que el paciente los esté tomando, utilizar medias compresivas y/o asociar domperidona.
Aspectos no motoresEn general, antes de iniciar un medicamento específico para el tratamiento de manifestaciones no motoras, la primera medida a tomar es la optimización de los fármacos dopaminérgicos. Algunos síntomas no motores como la apatía o el dolor pueden estar causados a un estado hipodopaminérgico en el contexto de una pauta de tratamiento insuficiente y se ha demostrado que pueden mejoran tras administrar agonistas o levodopa 73,74. Si la clínica no mejora tras un ajuste terapéutico con fármacos dopaminérgicos, se debe iniciar tratamiento específico. La Tabla 2 recoge los fármacos generalmente empleados para cada problema.
Enfermedad de Parkinson avanzadaComo se ha comentado anteriormente, a medida que la enfermedad progresa la ventana terapéutica para conseguir un buen control sintómatico sin efectos adversos o complicaciones derivadas del tratamiento médico se estrecha 75. En un primer momento, el uso de fármacos de liberación prolongada, la fragmentación de las dosis de levodopa oral o añadir terapias potenciadores del efecto de la levodopa como tolcapona, entacapona, selegilina o rasagilina pueden aminorar las fluctuaciones, disminuyendo los estados de “on” con discinesias o alteraciones comportamentales y los “off” o deterioro de fin de dosis 76–79. Más recientemente, el safinamida ha mostrado aumentar en tiempo en “on” sin un incremento de las disciniesas 80, por lo que podría ser útil como tratamiento adyuvante a la levodopa en pacientes fluctuantes. Para los bloqueos, especialmente si se presentan de manera impredecible o repentina, también es útil la administración puntual de inyecciones subcutáneas de apomorfina, un potente agonista dopaminérgico de efecto rápido pero corta duración 81. Sin embargo, esta mejoría suele ser temporal y, a los pocos meses, se requiere un enfoque terapéutico distinto con lo que llamamos terapias “avanzadas”.
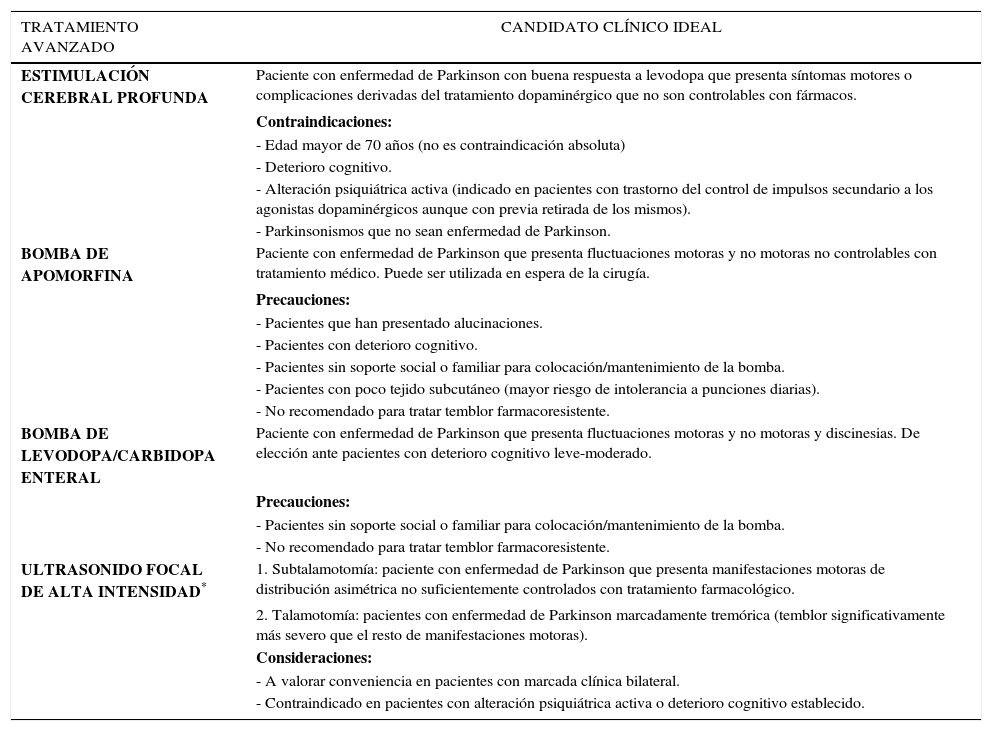
Actualmente existen cuatro tratamientos que se pueden aplicar a pacientes que no son óptimamente controlables con terapia médica convencional. La tabla 4 recoge estos tratamientos y sus indicaciones principales.
TERAPIAS AVANZADAS EN ENFERMEDAD DE PARKINSON
| TRATAMIENTO AVANZADO | CANDIDATO CLÍNICO IDEAL |
|---|---|
| ESTIMULACIÓN CEREBRAL PROFUNDA | Paciente con enfermedad de Parkinson con buena respuesta a levodopa que presenta síntomas motores o complicaciones derivadas del tratamiento dopaminérgico que no son controlables con fármacos. |
| Contraindicaciones: | |
| - Edad mayor de 70 años (no es contraindicación absoluta) | |
| - Deterioro cognitivo. | |
| - Alteración psiquiátrica activa (indicado en pacientes con trastorno del control de impulsos secundario a los agonistas dopaminérgicos aunque con previa retirada de los mismos). | |
| - Parkinsonismos que no sean enfermedad de Parkinson. | |
| BOMBA DE APOMORFINA | Paciente con enfermedad de Parkinson que presenta fluctuaciones motoras y no motoras no controlables con tratamiento médico. Puede ser utilizada en espera de la cirugía. |
| Precauciones: | |
| - Pacientes que han presentado alucinaciones. | |
| - Pacientes con deterioro cognitivo. | |
| - Pacientes sin soporte social o familiar para colocación/mantenimiento de la bomba. | |
| - Pacientes con poco tejido subcutáneo (mayor riesgo de intolerancia a punciones diarias). | |
| - No recomendado para tratar temblor farmacoresistente. | |
| BOMBA DE LEVODOPA/CARBIDOPA ENTERAL | Paciente con enfermedad de Parkinson que presenta fluctuaciones motoras y no motoras y discinesias. De elección ante pacientes con deterioro cognitivo leve-moderado. |
| Precauciones: | |
| - Pacientes sin soporte social o familiar para colocación/mantenimiento de la bomba. | |
| - No recomendado para tratar temblor farmacoresistente. | |
| ULTRASONIDO FOCAL DE ALTA INTENSIDAD* | 1. Subtalamotomía: paciente con enfermedad de Parkinson que presenta manifestaciones motoras de distribución asimétrica no suficientemente controlados con tratamiento farmacológico. |
| 2. Talamotomía: pacientes con enfermedad de Parkinson marcadamente tremórica (temblor significativamente más severo que el resto de manifestaciones motoras). | |
| Consideraciones: | |
| - A valorar conveniencia en pacientes con marcada clínica bilateral. | |
| - Contraindicado en pacientes con alteración psiquiátrica activa o deterioro cognitivo establecido. |
Del que existe una experiencia clínica más dilatada es de la bomba de perfusión subcutánea de apomorfina. Se trata de un dispositivo que aporta de manera continua una dosis regulable de apomorfina a través de una aguja subcutánea que normalmente se coloca a nivel del abdomen. Este tratamiento ha mostrado eficacia tanto en el tratamiento de la clínica motora de la EP 82 como de las complicaciones derivadas del uso de levodopa 83, así como aspectos no motores como el sueño 84, síntomas gastrointestinales 85 o urinarios 86. Sus principales complicaciones potenciales son la inducción de síndrome confusional, alucinaciones y trastorno del control de impulsos, por lo que debe evitarse en pacientes con alteración cognitiva y utilizarse con precaución en pacientes con antecedente de trastorno del control de impulsos; y la aparición de nódulos subcutáneos en los lugares de punción, para evitarlos se recomienda variar diariamente la posición de la aguja y una buena higiene de la zona de punción. Éstos pueden ser tratados realizando masajes o con ultrasonidos en los lugares de inyección 87. Otro tratamiento “avanzado” es la bomba de infusión intestinal de gel de levodopa/carbidopa (LCIG de su acrónimo en inglés). Tras la realización de una gastrostomía percutánea para la colocación de una sonda a nivel del duodeno, ésta se conecta con una bomba de perfusión que administra de manera continua levodopa en forma de gel. El fundamento de este tratamiento es evitar el paso de la medicación por el estómago, permitiendo una absorción menos errática del fármaco y, por lo tanto, una estimulación dopaminérgica continua. Basándose en este mecanismo, la LCIG ha mostrado mejorar las fluctuaciones motoras y reducir discinesias 88, así como ser eficaz en el tratamiento de síntomas no motores como el sueño, la fatiga o síntomas gastrointestinales 89. La principal limitación de esta terapia son las complicaciones locales o de funcionamiento del dispositivo como la migración de la sonda o infección de punto de entrada, que, aunque son tratables y poco graves, pueden llegar a tasas de hasta el 63% 90.
Un abordaje conceptualmente distinto es la estimulación cerebral profunda (ECP) de núcleos del cerebro. Tras mostrar eficacia en el talámo para el control de distintos tipos de temblor (incluido el temblor de la EP) a principios de los 90 91, la estimulación bilateral del NST mostró mejoría de todas las manifestaciones motoras de la EP 92. Actualmente, la ECP es un tratamiento aceptado y aplicado en todo el mundo, y ha mostrado, en ensayos randomizados y controlados, superioridad frente al tratamiento médico en cuánto a mejoría de manifestaciones motoras y calidad de vida 93–95. Por otro lado, la ECP del GPi, aunque tendría una eficacia menor que la del NST para las manifestaciones motoras, tiene un mayor efecto directo sobre las discinesias, que en el caso de la ECP del NST mejoran secundariamente al decremento de levodopa 96. Aunque se ha considerado que la estimulación del GPi presenta menor tasa de complicaciones neuropsiquiátricas, evidencias recientes ponen en tela de juicio esa conclusión 97,98. Entre las posibles complicaciones, las potencialmente más graves son la hemorragia cerebral sintomática y la infección del material implantado. Su frecuencia de presentación, es sin embargo, relativamente baja, con unas tasas del 2,1% y 1,2-15,2% respectivamente 99. La mortalidad periprocedimiento se sitúa aproximadamente en el 1,1% 99, incluyendo un leve aumento del riesgo de suicidio especialmente cuando se presenta depresión postoperatoria 100. Un efecto adverso potencialmente importante tras la cirugía es la aparición del llamado “síndrome hipodopaminérgico” que manifiesta en forma de apatía, depresión y ansiedad y que es secundario a la disminución de fármacos dopaminérgicos permitida por la mejoría motora de la estimulación 101,102. Para revertirlo es necesario reintroducir o volver a aumentar las dosis de fármacos con acción dopaminérgica ya que el aumento de parámetros de estimulación tiene poco o nulo efecto sobre dicha sintomatología 73.
Finalmente, es posible que estemos viviendo un renacer de los abordajes cerebrales lesionales para el tratamiento de la EP gracias al reciente desarrollo del ultrasonido focal de alta intensidad guiado por RM (HIFU). Este procedimiento, basado en la realización de termolesiones por confluencia de haces de ultrasonido en un punto del cerebro guiadas por RM, ha mostrado ser seguro y eficaz para el tratamiento del temblor esencial y parkinsoniano con la realización de talamotomía 11,103,104 y, actualmente, se están realizando lesiones en el NST con resultados prometedores. Las principales ventajas de esta técnica son que, al no tratarse de un tratamiento quirúrgico, se reduce drásticamente la invasividad y las posibles complicaciones derivadas de un acto quirúrgico, así como la duración del periodo de convalecencia post-tratamiento, que es virtualmente inexistente. Además, el ultrasonido permite incrementar la temperatura de la diana elegida en un rango en que se observa el efecto clínico transitorio sin provocar una lesión definitiva. Con esto se monitorizan en tiempo real tanto los efectos beneficiosos como los adversos, antes de provocar la ablación, por lo que, en caso necesario, se reajusta el lugar de sonicación y se localiza la diana terapéutica óptima minimizando el riesgo de secuelas neurológicas permanentes. La principal limitación actual es la unilateralidad de los abordajes lesionales, dado que, como muestra la experiencia previa con cirugía esteroatáxica clásica, las ablaciones bilaterales podrían llegar a un aumento del riesgo de complicaciones neurológicas permanentes como disartria 105. Sin embargo, al no tener un abordaje quirúrgico, la menor invasividad de esta técnica podría potencialmente permitir la realización de lesiones bilaterales sin efectos adversos neurológicos.
CONCLUSIÓNLa EP condiciona la calidad de vida de las personas que la sufren y se está convirtiendo en un problema de salud pública progresivamente mayor debido a su elevada frecuencia. Conocer los aspectos clínicos de la enfermedad, así como el manejo diagnóstico y estrategias terapéuticas aparece como una obligación del neurólogo, con el objetivo de ofrecer la mejor asistencia a sus pacientes con un menor coste sobre el conjunto de la sociedad. A pesar de que una posible curación se vislumbra lejana, el enlentecimiento de la progresión o un mejor control terapéutico con nuevas terapias farmacológicas o avanzadas como el HIFU son el objetivo para el futuro a corto plazo.
Los autores declaran no tener conflictos de interés, en relación a este artículo.