La anfotericina B liposomal es una formulación lipídica del fármaco antifúngico anfotericina B con algunas características diferenciales en su comportamiento farmacológico que implican algunas ventajas clínicas de gran interés. Entre estas se encuentra la notable mejoría de la tolerabilidad sistémica y renal. Esta mejora se debe a la gran estabilidad del liposoma, promovida por su carga negativa, la presencia de colesterol y la notable termoestabilidad de los restantes lípidos que lo componen. En esta situación, la anfotericina B parece liberarse del liposoma cuando se fija al ergosterol de la membrana de la célula micótica, y no de forma espontánea. Por ello, casi no existe anfotericina B libre en el plasma ni en los tejidos, aunque parece que su disponibilidad es mayor cuando existe una infección fúngica. Como consecuencia, cuando se estudia el comportamiento farmacocinético, las concentraciones y disponibilidad de la anfotericina B liposomal son muy elevadas, y su volumen de distribución reducido en comparación con las restantes formulaciones.
Liposomal amphotericin B is a lipid formulation of the antifungal drug amphotericin B with some distinguishing characteristics in its pharmacological behavior that entail some clinical differences of great interest. The significant improvement in the systemic and renal tolerability is one of them. This fact is related to the great stability of the liposome, promoted by its negative charge, the presence of cholesterol and the remarkable thermo-stability of the remaining lipids that compose it. In this situation, amphotericin B seems to be released from the liposome not spontaneously but when the liposome binds to the ergosterol in the fungal cell membrane. For this reason, there is almost no free amphotericin B in plasma or tissues, although it seems that its availability is greater when there is fungal infection. As a consequence, when the pharmacokinetic behavior is studied, the concentration and availability of liposomal amphotericin B are very high, and its volume of distribution is reduced in comparison with the other formulations.
La anfotericina B (AmB), introducida en la terapéutica en el año 1958, fue el primer fármaco antifúngico de uso sistémico. Presenta un peso molecular total de 924g/mol y una estructura química peculiar que consiste en un anillo monocíclico polieno-lactona unido a una micosamina. Esta estructura genera un carácter anfofílico que dificulta su solubilidad en agua. La primera versión de este fármaco antifúngico, disponible en las décadas iniciales y hoy en día casi en desuso, era una formulación con desoxicolato (AmB-D) que formaba micelas en solución acuosa. La comprobación inicial de que la administración de AmB-D en soluciones comerciales de lípidos mejoraba de forma importante la tolerancia de los pacientes generó el desarrollo comercial de diversas formulaciones lipídicas de este fármaco: liposomal (AmBisome®, Gilead, Dublín, Irlanda), complejo lipídico (Abelcet®, Sigma-Tau Pharma Source, Inc., Indianápolis, IN, EE. UU.) y dispersión coloidal (Amphotec®, Amphocil®, Ben Venue Laboratories, Bedford, OH, EE. UU.). En la actualidad, en nuestro país están disponibles las dos primeras.
Existen diferencias de gran importancia en los componentes lipídicos de las formulaciones de AmB. En la formulación liposomal (AmB-L), a la que dedicaremos este capítulo, la AmB está incorporada a liposomas unilaminares esféricos de 45-80nm de diámetro que contienen fosfatidilcolina, colesterol, diestearoil fosfatidilglicerol (DSPG) y AmB, en una relación molecular de 2:1:0,8:0,48. La fracción lipídica de la formulación complejo lipídico (AmB-CL) está formada por L-α-dimiristoilfosfatidilcolina y L-α-dimiristoilfosfatidilglicerol, que junto con la AmB generan una estructura en forma de banda de tamaño mucho mayor que los liposomas, ya que alcanza 1.600-11.000nm de longitud. En estas diferencias en la composición de los lípidos parecen concentrarse las notables disimilitudes en el comportamiento de las formulaciones, puesto que AmB-L presenta gran estabilidad en su tránsito a través del organismo, lo que condiciona la casi inexistente liberación de AmB hasta entrar en contacto con el ergosterol. Esta característica condiciona, tal y como se comentará, unas propiedades farmacocinéticas claramente diferentes a las de las restantes formulaciones, que se traducen en una semivida de eliminación prolongada, un volumen de distribución reducido y concentraciones plasmáticas muy elevadas. AmB-CL es menos estable, puesto que sus componentes lipídicos presentan una temperatura de transición/fusión alcanzable en las condiciones terapéuticas de uso, lo que genera la posibilidad de la liberación temprana del fármaco antifúngico, una mayor concentración de AmB libre en plasma y, con ello, que existan pocas diferencias farmacocinéticas con AmB-D7.
Mecanismo de acciónAproximadamente ocho moléculas de AmB interaccionan a través de la cadena hidrofóbica (cadena poliénica) con un número similar de moléculas de ergosterol, lo que genera la aparición de poros en la membrana de la célula fúngica. Las cadenas hidrofílicas (cadena polihidroxílica) se sitúan en la cara interna de los poros. La presencia de estos poros facilita la salida rápida de iones de potasio, que termina afectando a la glucólisis intracelular con el consiguiente movimiento de magnesio y entrada de hidrogeniones, que generan la acidificación del citoplasma y, finalmente, la muerte celular5,20,24. La peroxidación lipídica y la inhibición de la protón-ATPasa son otros mecanismos de actuación de la AmB16.
La AmB dentro del liposoma se encuentra fijada, a través del grupo amino, al grupo fosfato del DSPG. La unión entre los residuos estearil del DSPG y la porción poliénica del anillo macrólido del fármaco antifúngico es, incluso, más fuerte. Cada grupo de ocho moléculas de AmB forma un complejo con el DSPG y el colesterol del liposoma en una interacción similar a la que se produce entre la AmB y el ergosterol22. Es destacable que los liposomas sin AmB se fijan a la membrana celular pero no producen ningún efecto sobre la célula, mientras que los que contienen AmB son capaces de destruir la célula tras la fijación inicial, lo que apunta a que tras la fijación se produce la liberación del fármaco antifúngico que, una vez libre, ejerce su efecto farmacológico6,24. La presencia del colesterol en el liposoma estabiliza el conjunto y lo protege frente a la destrucción generada por las lipoproteínas de alta densidad (HDL), con lo que prácticamente no se produce liberación de AmB tras la incubación de los liposomas con suero6.
Se ha demostrado, utilizando liposomas marcados con sulforodamina, que la AmB se acumula en aquellas zonas en las que existe una infección fúngica. La utilización de liposomas marcados con oro ha demostrado la capacidad del liposoma para fijarse a la membrana interna del hongo y penetrar en el interior de su citoplasma8. Más recientemente se ha descrito que el liposoma solo penetra en el interior del citoplasma cuando contiene AmB y, además, la célula expuesta al fármaco presenta ergosterol en su membrana celular31.
FarmacocinéticaEn un estudio realizado para evaluar el comportamiento farmacocinético de AmB-L, esta se administró a 36 pacientes que presentaban neutropenia febril a dosis de 1; 2,5; 5 y 7,5 mg/kg. Se constató la ausencia de linealidad con los valores del área bajo la curva, que se situaban respectivamente en 32, 71, 294 y 534 μg·h/ml, lo que evidencia una reducción del aclaramiento plasmático con las dosis más elevadas33. Otro estudio con escalado de dosis de 10; 12,5 y 15mg/kg volvió a mostrar la ausencia de linealidad, con la presencia de saturación a partir de 10 mg/kg32.
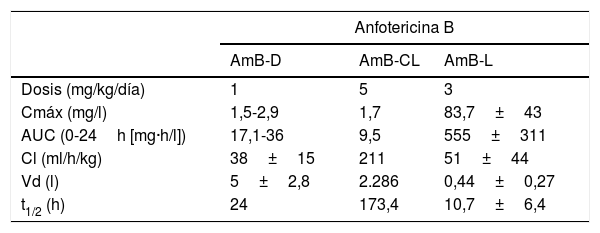
En la tabla 1 se muestran algunas características comparativas entre AmB-D, AmB-L y AmB-CL1,9,19. La administración en sujetos sanos de AmB-L (2 mg/kg) y AmB-D (0,6 mg/kg) dieron lugar a un perfil ajustable a un modelo tricompartimental con valores de semivida de eliminación terminales muy prolongados, 152 y 127h, respectivamente. Sin embargo, las concentraciones plasmáticas de AmB fueron mucho más elevadas con la forma liposomal (Cmáx 22,9±10 vs. 1,4±0,2 μg/ml)13. Después de la administración de dosis múltiples de AmB-L (5 mg/kg/día), la concentración plasmática máxima se sitúa próxima a los 100 mg/l. Estas concentraciones son muy superiores a los 2 mg/l alcanzados con AmB-D y AmB-CL y se explican por la presencia del antifúngico dentro del liposoma. El volumen de distribución es reducido, 0,1-0,2 l/kg, mientras que la semivida de eliminación inicial oscila entre 5 y 10 h21,32 y la terminal rebasa las 150 h. Las diferencias son importantes en comparación a la AmB-D y la AmB-CL, que presentan volúmenes de distribución elevados y, con ello, tiempos de semivida de eliminación también más elevados3,4.
DistribuciónEl 95-99% de la AmB que no está unida al liposoma se encuentra fijada a las proteínas plasmáticas, principalmente a las lipoproteínas de baja densidad (LDL), albúmina y α-glucoproteína12. La gran mayoría de la AmB persiste en plasma fijado dentro del liposoma, el 97% a las 4 h de la administración. La escasa cantidad de fármaco libre, no unido a proteínas ni dentro del liposoma, puede resultar clave para explicar la reducción de la toxicidad de esta formulación16.
El patrón de distribución de AmB-L fue evaluado en material de necropsia en un estudio. Las concentraciones más elevadas se encontraron en el hígado, aproximadamente 100 μg/g, y las más reducidas en el miocardio y el cerebro, aproximadamente 1 μg/g30. La distribución en líquido cefalorraquídeo es reducida, alcanzando concentraciones que representan el 0,1% de las plasmáticas29 pero que pueden aumentar cuando la AmB se administra junto con inhibidores de la glucoproteína P, como verapamilo o itraconazol38. En un modelo de ratón con meningoencefalitis por Candida albicans por vía hematógena en el que se utilizaron dosis estándar de AmB-D y varias formulaciones lipídicas de AmB, fue AmB-L la que alcanzó mayor concentración cerebral, produciendo una reducción importante de la carga micótica en el cerebro18. En líquido de lavado broncoalveolar las concentraciones son menores a las determinadas en el parénquima pulmonar (0,4-1,6 μg/ml)36. También son reducidas en líquido ascítico y líquido pleural34,35. La concentración biliar máxima tras la administración de AmB-L se aproxima a 60 mg/l2, mientras que en pacientes con trasplante hepático son menores (1,28 mg/l)37. En su distribución por el organismo, la AmB-L es recaptada por las células del sistema reticuloendotelial, probablemente de una manera no lineal ya que a dosis superiores a 7,5 mg/kg las concentraciones plasmáticas alcanzadas son inferiores a las esperadas33. Es muy llamativa la escasa capacidad de AmB-L para alcanzar concentraciones elevadas en el parénquima renal, que puede tener su origen en la inhibición de la proteína de transferencia de lípidos. De esta forma se impide la transferencia de AmB-L desde las HDL a las LDL, y con ello se dificulta el acceso a unas células que, como las renales, carecen de receptores para las HDL27. En cambio, AmB en su forma libre se fija preferentemente a las LDL, lo que facilitaría la captación renal dado que las células renales presentan una alta tasa de receptores LDL.
El pequeño tamaño de los liposomas y su distribución de cargas evita el reconocimiento y la captación por parte del sistema de fagocitos. Este hecho explica las elevadas concentraciones plasmáticas alcanzadas, fijadas al liposoma, mientras que la fracción libre es mínima. La escasa presencia de AmB libre podría ser, al menos en parte, responsable de las diferencias que se han descrito entre las distintas formulaciones de AmB en la capacidad de liberar citocinas proinflamatorias: mientras la formulación en dispersión coloidal induce una elevación de IL-1β, TNF-α, MCP-1 y MIP-1β, próxima al fenómeno inflamatorio, AmB-L y AmB-CL reducen o no afectan a la IL-1β ni al TNF-α. Además, estas mismas características reducen la respuesta inflamatoria generada por citocinas tras la estimulación de receptores TL2-TL415, con atenuación de la toxicidad propia de la administración intravenosa del fármaco27.
EliminaciónEl aclaramiento total de AmB-D y AmB-L en voluntarios sanos fue similar. Sin embargo, los aclaramientos renal y fecal de la formulación lipídica fueron casi 10 veces inferiores. El 63% de la AmB-D fue eliminada en las heces (42,5%) y la orina (21%), con una eliminación del fármaco superior al 90% a lo largo de los siete días siguientes a la administración. En el caso de AmB-L, el porcentaje eliminado a través de la orina es inferior al 10%, y en la primera semana solo un 4,5% de la dosis administrada es detectada14. No obstante, las concentraciones alcanzadas en el parénquima renal son adecuadas para el tratamiento de las infecciones renales28. No se han detectado metabolitos del fármaco, lo que excluye, por el momento, que el metabolismo participe en su eliminación.
Farmacocinética en niñosLa farmacocinética en niños, incluyendo neonatos, fue estudiada en 40 pacientes inmunodeprimidos que fueron tratados con diferentes dosis: 2,5; 5 y 7,5mg/l. No se apreciaron diferencias importantes en comparación con los datos obtenidos de pacientes adultos26.
Farmacocinética/farmacodinamiaLas características farmacocinéticas y farmacodinámicas de AmB-D se estudiaron inicialmente en un modelo de candidiasis invasiva en ratón; se determinó que la eficacia se correlaciona con los valores de Cmáx/CMI, asociándose el efecto fungicida con valores superiores a 10mg/kg11. Este efecto precisa dosis entre 4,8 y 7,6 veces inferiores cuando se administra en dosis única, frente a dosis fraccionadas11. Estos datos, que fueron obtenidos con la formulación convencional, fueron reproducidos con las formulaciones lipídicas, aunque se mostraban entre 5 y 7 veces menos potentes, de ahí la diferencia en la posología de las distintas formulaciones10. En un estudio realizado en niños la mayor eficacia se observó con valores de Cmáx/CMI>4023.
Oxigenación por membrana extracorpóreaNo existen estudios sistemáticos y la casuística publicada es controvertida. En un paciente sometido a oxigenación por membrana extracorpórea durante la administración de AmB-L a dosis de 3mg/kg se registraron concentraciones plasmáticas de 5,8 y 6,2 mg/l a las 13 y 18 h de la administración; dichas concentraciones se encuentran dentro del margen de eficacia del fármaco25. No obstante, en otros casos parece que la técnica de oxigenación por membrana extracorpórea conllevó la alteración de las propiedades farmacocinéticas de la AmB, con reducción de sus concentraciones y la necesidad de administrar dosis elevadas, aproximadamente el doble de la dosis convencional17,39. Considerando el peso molecular, la fijación a proteínas, la liposolubilidad y las restantes características de la AmB, es probable que pueda sufrir cierto grado de fijación a la membrana de la oxigenación extracorpórea, con lo que será preciso valorar la necesidad de administrar dosis más elevadas de las habituales.
Interacciones con otros fármacosAmB no es metabolizada ni es sustrato de enzimas microsomales, de ahí que a diferencia de otros fármacos antifúngicos, como los azoles, no esté implicada en interacciones con otros fármacos a través de este mecanismo. Se han descrito riesgos potenciales de aumento de la nefrotoxicidad con el uso asociado con otros fármacos nefrotóxicos, y riesgos asociados con la posible toxicidad por la administración conjunta con otros fármacos que produzcan hipopotasemia1,9.
ConclusiónLa concentración en plasma de AmB-L (AmBisome®) alcanza valores muy elevados que se explican por la persistencia de AmB en el liposoma en la sangre del paciente. Esta característica se relaciona con la menor intervención de las células del sistema reticuloendotelial (sistema fagocítico mononuclear) en su eliminación, la gran estabilidad del liposoma, su pequeño tamaño y la probabilidad de que exista saturación en la velocidad de aclaramiento del sistema reticuloendotelial.
En comparación con la AmB-D, la AmB-L produce una exposición de AmB mucho más elevada, un volumen de distribución reducido y una marcada disminución de la velocidad de excreción de AmB en orina y en heces. Además, la fracción no fijada que circula en plasma es muy reducida, señalando la lentitud de la liberación de la AmB contenida en el liposoma. Resulta de especial interés señalar que la imprescindible liberación de AmB necesaria para que ejerza su efecto fungicida se produce una vez internalizado el liposoma cargado tras la fijación inicial, por la unión de AmB con el ergosterol. De hecho, en ausencia de ergosterol y/o de AmB no se produce la penetración del liposoma. Se trata, por consiguiente, de una formulación que alcanza parte de los objetivos de un fármaco antifúngico ideal, ya que al efecto fungicida se añade un comportamiento farmacocinético que reduce la presencia de fármaco libre allí donde no se precisa, fármaco libre que es responsable de generar los efectos adversos frecuentes ligados a la administración de otras formulaciones de AmB que cursan con concentraciones de AmB libres en proporción más elevada.
Por último, la ausencia de interacciones farmacocinéticas, la administración en dosis única diaria facilitada por la larga semivida de eliminación, la presencia de concentraciones intracerebrales activas y la ausencia de riesgo relacionado con la prolongación del intervalo QT electrocardiográfico constituyen, entre otros, factores sobreañadidos de importancia práctica.
FinanciaciónEste artículo ha sido financiado por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesEl autor ha participado en cursos de formación, mesas redondas y reuniones de asesoría con Pfizer, MSD y Gilead. Este artículo ha sido financiado por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.