Las micosis invasivas se han convertido en una causa importante de morbimortalidad en pacientes críticos, enfermos con neoplasias, inmunodeficiencias y otras enfermedades en las que se produce una alteración de las defensas. Candida albicans continúa siendo el agente patógeno más frecuente, pero los avances en el diagnóstico, la prevención y el tratamiento de las candidiasis invasivas están causando un cambio etiológico importante. Dentro de las micosis emergentes destacan aquellas producidas por hongos filamentosos como Aspergillus, Lomentospora/Scedosporium, Fusarium o los mucorales. Las aspergilosis invasivas son difíciles de diagnosticar, y aunque hay herramientas disponibles de diagnóstico, su uso no está generalizado y su eficacia varía según los grupos de pacientes. La sospecha clínica en pacientes de alto riesgo, el diagnóstico con técnicas de imagen y la detección de biomarcadores como 1,3-β-D-glucano y galactomanano son de gran ayuda. En otras micosis los recursos diagnósticos son más reducidos, pero la radiología, los estudios anatomopatológicos y el diagnóstico microbiológico pueden ser útiles. La alta mortalidad de estas micosis obliga a realizar en muchos casos un tratamiento empírico precoz. El voriconazol es el tratamiento de elección en la mayoría de las aspergilosis, escedosporiasis, fusariosis y otras hialohifomicosis. El tratamiento de las mucormicosis y de las micosis causadas por Lomentospora prolificans o por hongos dematiáceos es más complicado. La anfotericina B es activa contra muchos mucorales, pero la combinación de dos o más antifúngicos puede ser una alternativa en muchas micosis refractarias a la anfotericina B. Entre los retos clínicos actuales se encuentra mejorar tanto el diagnóstico como el tratamiento de estas micosis, junto con la adecuada prevención en los pacientes con alto riesgo de padecerlas.
Invasive fungal infections have become a major cause of morbimortality in intensive care patients, persons suffering from cancer or immune deficiencies, and other diseases with impaired immunity. Candida albicans remains the most frequent fungal pathogen, but advances in the diagnosis, prevention and treatment of invasive candidiasis are leading to important etiological changes. Among the emerging invasive mycoses, are those caused by filamentous fungi, such as Aspergillus, Lomentospora/Scedosporium, Fusarium or the Mucorales. Invasive aspergillosis is difficult to diagnose, and although there are diagnostic tools available, their use is not widespread, and their effectiveness vary depending on the group of patients. Clinical suspicion in high-risk patients, radiological diagnosis and the use of biomarkers, such as 1,3-β-D-glucan and galactomannan, can be of great help. However, diagnostic resources are limited in other mycoses, but radiology, pathological studies and the microbiological diagnosis can be useful. The high mortality of these mycoses requires early empirical antifungal treatment in many cases. Voriconazole is the first choice for treatment of the majority of aspergillosis, scedosporiasis, fusariosis and other hyalohyphomycoses. The treatment of mucormycoses, Lomentospora prolificans infections or mycoses by dematiaceous fungi are more complicated. Amphotericin B is active against many mucoralean fungi, but the combination of two or more antifungal agents could be a therapeutic alternative in many amphotericin B-refractory mycoses. Current clinical challenges include improving the diagnosis and the treatment of these mycoses, along with improving the adequate prevention in patients at high risk of suffering from them.
Las micosis invasivas son un reto médico importante, sobre todo en la población creciente de pacientes con inmunodeficiencias o alteraciones de las barreras y mecanismos defensivos. Durante décadas, Candida albicans ha sido el principal agente etiológico de estas enfermedades, y la candidiasis invasiva la causa de morbimortalidad más importante. Sin embargo, el conocimiento de la patogenia y de la epidemiología de las candidiasis invasivas se está ampliando continuamente, permitiendo delimitar los principales grupos de pacientes en riesgo de sufrirlas, así como las enfermedades subyacentes y los factores médicos y quirúrgicos predisponentes más prominentes. Esto ha facilitado unas prácticas eficaces de prevención y atenuación de las complicaciones. El conocimiento más amplio de las candidiasis ha permitido también grandes avances diagnósticos y terapéuticos. Entre los avances diagnósticos destacan, desde el punto de vista clínico, las clasificaciones diagnósticas para iniciar un tratamiento empírico, como el Candida score, la mejora sustancial en las técnicas de imagen con el empleo de la tomografía axial computarizada de alta resolución, la resonancia magnética y la tomografía por emisión de positrones, y el empleo de biomarcadores no basados en el cultivo, como 1,3-β-D-glucano o manano, o los anticuerpos antimanano o antimicelio, que permiten anticipar el diagnóstico presuntivo e, incluso, el diagnóstico de certeza en algunos casos4,5,7,22,24,35. Estos avances se han acompañado de la disponibilidad de nuevos fármacos de alta eficacia antifúngica, como las candinas (anidulafungina, caspofungina y micafungina) o los triazoles de espectro extendido (voriconazol y posaconazol)19,31,34.
Sin embargo, en este escenario actual, con una población de pacientes inmunodeprimidos en continuo aumento y con un uso cada vez más certero y eficaz de la prevención y el tratamiento de las candidiasis invasivas causadas por C. albicans, se observa un creciente número de pacientes con infecciones invasivas por Aspergillus, mucorales, Fusarium, Lomentospora/Scedosporium, otras especies de Candida diferentes a C. albicans y otros hongos levaduriformes, como Cryptococcus, Trichosporon, Magnusiomyces (Saprochaete) o Geotrichum. La patogenia y la epidemiología de estas micosis emergentes es peor conocida, y su diagnóstico más complicado, ya que no tienen unas características clínicas y radiológicas específicas y muchos de estos hongos poseen propiedades fisiológicas y relacionadas con el cultivo poco conocidas, lo que plantea dificultades para su identificación en el laboratorio1,7–9,39.
En un reciente estudio poblacional, realizado en 29 hospitales españoles, de la epidemiología y la resistencia a los antifúngicos de aislamientos de hongos filamentosos de muestras clínicas de tejidos, sangre y aparato respiratorio (FILPOP), Alastruey-Izquierdo et al. encontraron una prevalencia media de 1,6 aislamientos por millón de habitantes1. El género fúngico aislado con mayor frecuencia fue Aspergillus, representando el 86,3% de los aislamientos clínicos. Ninguno de los restantes géneros aislados superaba el 5% de los aislamientos: Lomentospora/Scedosporium (4,7%), mucorales (2,5%), Penicillium (2,2%) y Fusarium (1,2%). Dentro de Aspergillus, Aspergillus fumigatus (48,5% de los aislamientos), Aspergillus flavus (8,4%), Aspergillus terreus (8,1%), Aspergillus tubingensis (6,8%) y Aspergillus niger (6,5%) fueron las especies más prevalentes. Alrededor del 12% de los aislamientos de Aspergillus se consideraron especies crípticas, con el consiguiente problema diagnóstico. Esta imagen etiológica observada en el estudio FILPOP se completa con lo observado por Pemán et al. en el estudio sobre fungemias, donde Fusarium era el único género de hongos filamentosos aislado en hemocultivos de 1.357 episodios clínicos de 44 hospitales españoles30. Un hecho relevante del estudio FILPOP es que la resistencia a la anfotericina B (10,8% de los aislamientos) y a los azoles de espectro ampliado (∼12%) se observaba sobre todo entre los aislamientos de Lomentospora/Scedosporium, los mucorales y las especies crípticas de Aspergillus1.
AspergilosisLas aspergilosis son infecciones oportunistas cosmopolitas que se adquieren habitualmente por inhalación de conidios aerovagantes (tabla 1). Los focos primarios son el pulmón y los senos paranasales. Los conidios germinan e invaden los tejidos cuando no son fagocitados por los macrófagos alveolares o los leucocitos polimorfonucleares ni detenidos por el sistema inmune. Estos defectos defensivos se observan en pacientes con inmunodeficiencias, que constituyen el grupo de riesgo principal. También se han descrito brotes epidémicos de aspergilosis nosocomial en pacientes sometidos a cirugía cardiovascular en quirófanos contaminados por Aspergillus. La exposición ambiental a las conidiosporas de los sistemas de ventilación o procedentes de obras de renovación de los hospitales pueden ser causa de brotes nosocomiales. La neutropenia importante (<500células/mm3) y prolongada (más de 10 días), una función fagocítica deficitaria y las alteraciones de la inmunidad celular son los principales factores predisponentes para el desarrollo de aspergilosis invasiva, sobre todo de una neumonía aguda rápidamente progresiva, que se disemina si la neutropenia persiste (tabla 2).
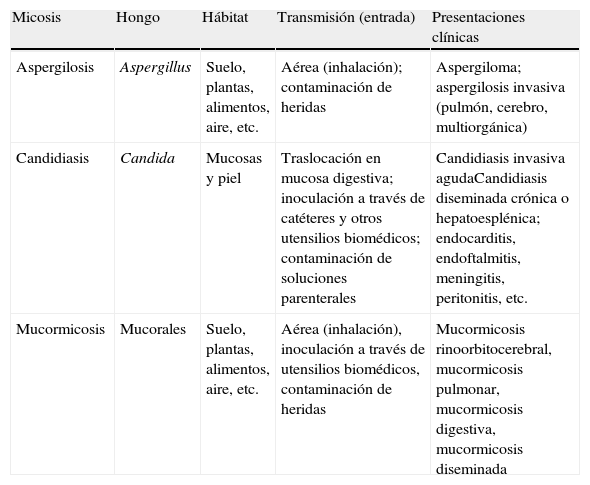
Características ecológicas de las principales micosis oportunistas
| Micosis | Hongo | Hábitat | Transmisión (entrada) | Presentaciones clínicas |
| Aspergilosis | Aspergillus | Suelo, plantas, alimentos, aire, etc. | Aérea (inhalación); contaminación de heridas | Aspergiloma; aspergilosis invasiva (pulmón, cerebro, multiorgánica) |
| Candidiasis | Candida | Mucosas y piel | Traslocación en mucosa digestiva; inoculación a través de catéteres y otros utensilios biomédicos; contaminación de soluciones parenterales | Candidiasis invasiva agudaCandidiasis diseminada crónica o hepatoesplénica; endocarditis, endoftalmitis, meningitis, peritonitis, etc. |
| Mucormicosis | Mucorales | Suelo, plantas, alimentos, aire, etc. | Aérea (inhalación), inoculación a través de utensilios biomédicos, contaminación de heridas | Mucormicosis rinoorbitocerebral, mucormicosis pulmonar, mucormicosis digestiva, mucormicosis diseminada |
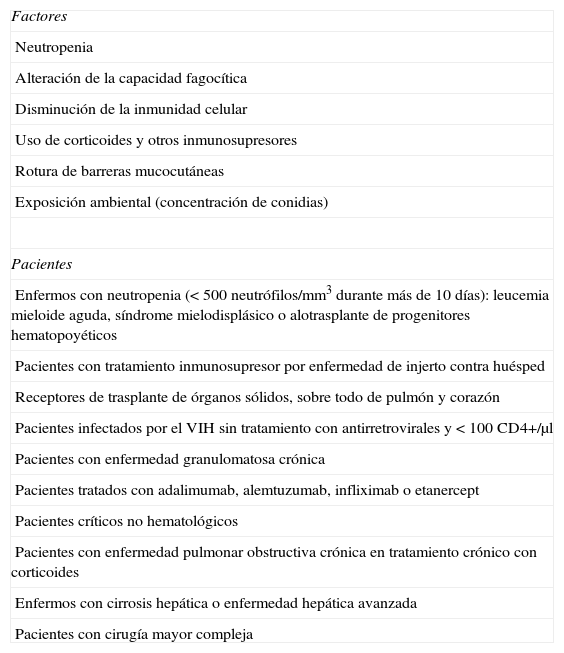
Factores y pacientes en riesgo de sufrir una aspergilosis invasiva
| Factores |
| Neutropenia |
| Alteración de la capacidad fagocítica |
| Disminución de la inmunidad celular |
| Uso de corticoides y otros inmunosupresores |
| Rotura de barreras mucocutáneas |
| Exposición ambiental (concentración de conidias) |
| Pacientes |
| Enfermos con neutropenia (<500neutrófilos/mm3 durante más de 10días): leucemia mieloide aguda, síndrome mielodisplásico o alotrasplante de progenitores hematopoyéticos |
| Pacientes con tratamiento inmunosupresor por enfermedad de injerto contra huésped |
| Receptores de trasplante de órganos sólidos, sobre todo de pulmón y corazón |
| Pacientes infectados por el VIH sin tratamiento con antirretrovirales y<100CD4+/μl |
| Pacientes con enfermedad granulomatosa crónica |
| Pacientes tratados con adalimumab, alemtuzumab, infliximab o etanercept |
| Pacientes críticos no hematológicos |
| Pacientes con enfermedad pulmonar obstructiva crónica en tratamiento crónico con corticoides |
| Enfermos con cirrosis hepática o enfermedad hepática avanzada |
| Pacientes con cirugía mayor compleja |
Se ha estimado una incidencia de aspergilosis invasiva del 7% en pacientes con leucemias agudas mieloides, del 11,3% en trasplantes alogénicos y del 1,6% en trasplantes autógenos de progenitores hematopoyéticos. Se observan muy pocas aspergilosis invasivas en los trasplantes de riñón y páncreas (<5%), pero son más frecuentes en los de corazón, pulmón e hígado (1-16%). También son factores de riesgo la malnutrición, el tratamiento con corticoides, la infección por el VIH, la diabetes, las enfermedades pulmonares crónicas y los tumores sólidos33,34.
La mortalidad de las aspergilosis invasivas es inaceptablemente elevada, con tasas del 40 al 50%, y se relaciona tanto con el estado clínico del paciente, habitualmente grave, como con las dificultades diagnósticas y terapéuticas existentes. Las técnicas radiológicas convencionales son de poca utilidad en el diagnóstico. La tomografía axial computarizada de alta resolución tiene un marcado valor en el diagnóstico y seguimiento de la aspergilosis invasiva porque permite una mejor definición de las estructuras pulmonares, siendo posible detectar lesiones antes de que aparezcan los signos en la radiografía de tórax convencional. Los nódulos pequeños mal definidos pueden confluir y han sido considerados altamente representativos de la aspergilosis angioinvasiva porque pueden reflejar la trombosis de las pequeñas arterias con infarto hemorrágico del parénquima pulmonar. El signo del halo es precoz, del cuarto al décimo día, y transitorio porque dura unos cinco días, y se observa sobre todo en los pacientes oncohematológicos asociado a una respuesta favorable al tratamiento y una mayor supervivencia. Sin embargo, en los pacientes receptores de órgano sólido o con enfermedad pulmonar obstructiva crónica la semiología radiológica puede ser muy diferente al observarse signos de traqueobronquitis, cavitaciones múltiples e infiltrados paracavitarios. No hay que olvidar que el tamaño de las lesiones radiográficas por Aspergillus puede aumentar de forma muy significativa en la primera semana de tratamiento antifúngico debido al síndrome de inmunorreconstitución, coincidente con la resolución de la neutropenia. La tomografía por emisión de positrones también puede ser utilizada para diagnosticar la afectación pulmonar por Aspergillus y otros hongos filamentosos, así como para detectar focos subclínicos extrapulmonares y monitorizar el tratamiento antifúngico4,33,34.
El diagnóstico definitivo de la aspergilosis invasiva se basa en la evidencia anatomopatológica en combinación con el aislamiento del agente causal mediante cultivo, aunque en muchas ocasiones el diagnóstico histológico es el único disponible (bien por carecer de un material apropiado para el cultivo, bien por falta de viabilidad del hongo en la muestra). Las técnicas histológicas son rápidas, económicas, permiten demostrar la reacción tisular y, en ocasiones, también la identificación presuntiva del agente causal17,26,31. La recuperación de Aspergillus de una muestra de biopsia o de fluidos corporales habitualmente estériles debe interpretarse como diagnóstica de aspergilosis invasiva (aunque la mayoría de las especies de Aspergillus, salvo Aspergillus terreus, se aíslan de manera infrecuente en los hemocultivos). La observación microscópica en muestras clínicas de hifas hialinas tabicadas con ramificaciones en ángulos de unos 45° también es indicativa de aspergilosis, a pesar de que otros mohos hialinos también pueden presentar similar morfología. Aspergillus crece con facilidad en cualquier medio de cultivo micológico que no incluya actidiona. Aunque la identificación de la especie implicada se basa en las características morfológicas de las colonias crecidas en el agar glucosado de Sabouraud u otros medios de cultivo y de la morfología microscópica de los aislamientos, la identificación de Aspergillus se ve facilitada con el empleo de técnicas moleculares basadas en la amplificación de determinadas secuencias de ADN por PCR (ITS, β-tubulina, calmodulina, actina, etc.) o por espectrometría de masas (MALDI-TOF MS)4,5,7,12,31,36. Esta identificación molecular es cada vez más necesaria para diferenciar aquellas especies crípticas de Aspergillus que tienen una menor sensibilidad a polienos y azoles. La detección de 1,3-β-D-glucano y galactomanano en suero y lavado broncoalveolar facilita el diagnóstico temprano de aspergilosis invasiva en pacientes con inmunodeficiencias graves, aunque su utilidad es variable según el grupo concreto de pacientes, y las enfermedades y factores subyacentes que les predisponen a sufrir una aspergilosis. Tienen una utilidad mayor en pacientes con neoplasias hematológicas y receptores de precursores hematopoyéticos, mientras que su validez se reduce en enfermos críticos y en receptores de trasplante de órgano sólido7,25,32,35,42. La detección de ADN de Aspergillus en las muestras clínicas es una técnica prometedora, pero necesitada de una adecuada estandarización6,27,36.
La prevención de las aspergilosis invasivas es fundamental en los pacientes de riesgo más alto, que deben ser alojados en habitaciones que estén dotadas de sistemas de filtrado de aire para minimizar la exposición a los conidios de Aspergillus. También deben establecerse medidas protectoras para evitar la exposición a Aspergillus a través de la ropa, los alimentos o las visitas, tanto del personal sanitario como de familiares. Además, se deben realizar todas las medidas necesarias para que el paciente se recupere de la neutropenia o disminuya la inmunodepresión que padece.
El voriconazol por vía intravenosa durante varias semanas, y posteriormente por vía oral, es el tratamiento farmacológico de elección de la aspergilosis invasiva (tabla 3). Como alternativa en pacientes que no toleran el voriconazol o cuando este no es efectivo, una formulación lipídica de anfotericina B o una candina por vía intravenosa pueden ser eficaces. En las lesiones pulmonares extensas o cavitadas y en las aspergilosis diseminadas con afectación cerebral debe considerarse el tratamiento combinado de voriconazol con anfotericina B liposómica o con una candina. Siempre que sea posible, se aconseja medir la concentración sérica de voriconazol para evitar la infradosificación y la toxicidad farmacológica. En infecciones por Aspergillus flavus y Aspergillus terreus se debe considerar la posible resistencia de estas especies a la anfotericina B. Otras especies, como Aspergillus lentulus y Aspergillus calidoustus, tienen una sensibilidad disminuida aL voriconazol y a otros triazoles, por lo que el tratamiento debe realizarse con anfotericina B o candinas. La terapia con anfotericina B inhalada puede ser útil como adyuvante del tratamiento sistémico. La resección quirúrgica es muy importante para eliminar áreas necróticas, lesiones perivasculares, del sistema nervioso central o de aspergilomas que cursen con hemoptisis15,19,20,33,40.
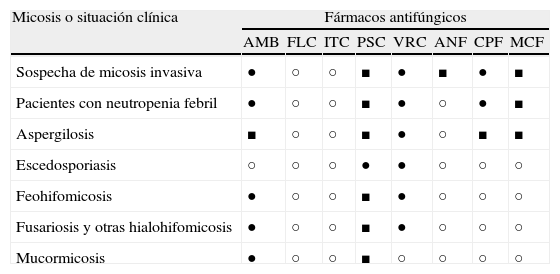
Indicaciones terapéuticas de las micosis más relevantes por hongos filamentosos
| Micosis o situación clínica | Fármacos antifúngicos | |||||||
| AMB | FLC | ITC | PSC | VRC | ANF | CPF | MCF | |
| Sospecha de micosis invasiva | ● | ○ | ○ | ■ | ● | ■ | ● | ■ |
| Pacientes con neutropenia febril | ● | ○ | ○ | ■ | ● | ○ | ● | ■ |
| Aspergilosis | ■ | ○ | ○ | ■ | ● | ○ | ■ | ■ |
| Escedosporiasis | ○ | ○ | ○ | ● | ● | ○ | ○ | ○ |
| Feohifomicosis | ● | ○ | ○ | ■ | ● | ○ | ○ | ○ |
| Fusariosis y otras hialohifomicosis | ● | ○ | ○ | ■ | ● | ○ | ○ | ○ |
| Mucormicosis | ● | ○ | ○ | ■ | ○ | ○ | ○ | ○ |
AMB: anfotericina B; ANF: anidulafungina; CPF: caspofungina; FLC: fluconazol; ITC: itraconazol; MCF: micafungina; PSC: posaconazol; VRC: voriconazol.
Tratamiento: de primera elección (AI-AII) (●); tratamiento alternativo (AIII, BI-BIII) (■); no indicado (C) (○).
Grados de evidencia para realizar las recomendaciones diagnósticas: 1) fortaleza de la recomendación: A (tratamiento útil o fiable, que permite recomendar su uso), B (tratamiento de utilidad moderada, que hace recomendar su uso en algunas ocasiones), y C (tratamiento desaconsejado). 2) Calidad de la evidencia: i (evidencia obtenida de uno o más estudios multicéntricos bien diseñados de casos y controles o de cohortes), ii (evidencia obtenida de uno o más estudios de casos y controles o de cohortes realizados en un centro único, de múltiples series o de resultados relevantes de series no controladas), y iii (evidencia obtenida de opiniones de expertos, basadas en experiencias clínicas o estudios descriptivos).
Fuente: Chowdhary et al.9, 2014; Cornely et al.10, 2014; Fortún et al.15, 2011; Pappas et al.29, 2013; Pontón33, 2008; Pontón y Quindós34, 2009; Revankar y Sutton37, 2010; Tortorano et al.39, 2014; Walsh et al.40, 2008.
Las infecciones causadas por hongos filamentosos diferentes de Aspergillus afectan sobre todo a personas con inmunodeficiencias, pero su incidencia es mucho menor. Destacan las escedosporiasis y las fusariosis, pero hay un número cada vez mayor de micosis causadas por hongos septados hialinos y dematiáceos que se describen esporádicamente21,23,28,34,37. La entrada de estos hongos suele ser a través de la piel (en muchas ocasiones por traumatismos) o por inhalación de conidios, siendo los senos paranasales y el pulmón los lugares donde se desarrollan los cuadros infecciosos. En personas con inmunodeficiencias, se han descrito otras alteraciones orgánicas únicas o múltiples por diseminación hematógena. Cuando las infecciones son causadas por hongos hialinos se denominan hialohifomicosis, y feohifomicosis cuando las causan hongos dematiáceos. Entre los hongos filamentosos con hifas septadas hialinas, sin pigmentación, destacan Acremonium, Beauveria, Fusarium, Paecilomyces, Penicillium, Pseudallescheria, Purpureocillium, Sarocladium, Scedosporium, Scopulariopsis y Trichoderma. Algunos desarrollan una conidiación adventicia en los tejidos, con posterior diseminación por la sangre, dando lugar a múltiples lesiones cutáneas y aislándose en los hemocultivos11,16,38. Los hongos dematiáceos tienen hifas septadas y conidios de pigmentación oscura. Entre los dematiáceos destacan Alternaria, Aureobasidium, Bipolaris, Cladophialophora, Curvularia, Exophiala, Exserohilum, Hortaea, Lomentospora, Phialophora y Rhinocladiella. La mayoría de estas micosis plantean grandes problemas diagnósticos, y la identificación de la especie implicada en muchos casos solo se podrá conseguir con métodos moleculares34,37. La identificación correcta es importante por las grandes diferencias en la sensibilidad a los fármacos empleados en el tratamiento de estas micosis4–6,36.
No hay recomendaciones claras sobre el tratamiento antifúngico que se debe emplear, pero se ha observado que la resección quirúrgica de las lesiones localizadas ayuda a reducir la carga fúngica y mejora el pronóstico. La recuperación de la neutropenia y de la inmunodeficiencia, junto con la reducción de los factores predisponentes y tratamientos concomitantes, son fundamentales para la curación de los pacientes. Scedosporium apiospermum y Scedosporium aurantiacum son sensibles al voriconazol y al posaconazol, y el tratamiento con voriconazol, solo o con una candina, puede ser exitoso. El posaconazol es una alternativa terapéutica en los casos en los que no es efectivo el tratamiento anterior (tabla 3). Lomentospora prolificans (Scedosporium prolificans) es un hongo multirresistente a los antifúngicos habituales y para su tratamiento se requiere la combinación de voriconazol con otros fármacos (terbinafina, una candina, miltefosina, colistina o interferón-γ), sin que pueda garantizarse un resultado satisfactorio8,9,39.
Fusarium suele ser resistente a la anfotericina B y son frecuentes las recurrencias en las fusariosis tratadas con este antifúngico. El voriconazol es más activo y ha dado buenos resultados en fusariosis que no respondían a anfotericina B, aunque también el posaconazol se puede utilizar como tratamiento de rescate (tabla 3). Sin embargo, se han descrito fracasos terapéuticos en las fusariosis por el complejo Fusarium solani. La combinación de antifúngicos puede ayudar en el tratamiento de las fusariosis recalcitrantes. Las combinaciones de anfotericina B y voriconazol, de voriconazol y caspofungina u otra candina o terbinafina, o de anfotericina B con una candina o azitromicina, han sido utilizadas con éxito en casos concretos14,15,39.
El tratamiento de otras hialohifomicosis y feohifomicosis es complicado y las indicaciones terapéuticas no están bien establecidas29,34,39. El estudio de la sensibilidad in vitro a los antifúngicos de los aislamientos clínicos obtenidos puede ayudar en la elección de estos. El pronóstico de todas estas micosis es extremadamente grave, y la ausencia de un tratamiento antifúngico óptimo hace que la adopción de medidas preventivas en los pacientes de alto riesgo sea obligatoria.
MucormicosisLas mucormicosis son enfermedades poco frecuentes, pero su incidencia ha aumentado en pacientes con diabetes mellitus y cetoacidosis, y en los receptores de trasplantes de órganos, en ocasiones en asociación con el uso creciente de candinas, fluconazol, itraconazol o voriconazol, que no son activos frente a los mucorales. Las mucormicosis suelen ser difíciles de diagnosticar y de tratar, por lo que se asocian a una elevada mortalidad (50-90%), según el tipo de enfermo. La mayoría de las mucormicosis están causadas por el género Rhizopus, pero otros géneros como Lichtheimia (Absidia), Apophysomyces, Cunninghamella, Mucor, Rhizomucor y Saksenaea se describen con cierta frecuencia3,18,41. Durante mucho tiempo ha predominado la creencia equivocada de que el tratamiento antifúngico de las mucormicosis es el mismo con independencia de la especie implicada. Sin embargo, se ha observado que existen variaciones cualitativamente importantes en la actividad in vitro de los fármacos antifúngicos frente a los mucorales, que podrían permitir diferentes aproximaciones terapéuticas10,13,18,41.
Las mucormicosis se adquieren por inhalación, ingesta, contaminación de heridas o inoculación traumática de esporangiosporas ambientales (tabla 1). La presencia hospitalaria de esas esporas y su diseminación a través de los sistemas de aire acondicionado o por el polvo que se genera durante las obras de construcción es un problema importante para los pacientes hospitalizados con inmunodeficiencias. Las mucormicosis son enfermedades muy parecidas en su presentación clínica a las aspergilosis, pero su progresión es más agresiva. La diabetes mellitus descompensada (cetoacidosis diabética) o mal controlada, las inmunodeficiencias, la mielosupresión, las neoplasias hematológicas y la insuficiencia renal son enfermedades que predisponen a sufrir una mucormicosis. Los pacientes que reciben tratamientos prolongados o con dosis altas de corticoides, los que reciben múltiples transfusiones de sangre o los dializados con sobrecarga de hierro, debido al empleo de deferoxamina (un quelante de hierro y aluminio), también son más propensos a desarrollar mucormicosis2,13,34.
Las mucormicosis tienen un pronóstico aciago que exige tomar medidas diagnósticas y terapéuticas intensivas. Las técnicas radiológicas convencionales son de poca utilidad en el diagnóstico de las mucormicosis invasivas, sobre todo en pacientes con neutropenia profunda y prolongada. Sin embargo, la tomografía axial computarizada de alta resolución y la resonancia magnética son bastante útiles en el diagnóstico de las formas clínicas rinoorbitocerebrales, pulmonares, digestivas y diseminadas. Sin embargo, es muy difícil diferenciar una mucormicosis pulmonar de una aspergilosis pulmonar invasiva, ya que ambas producen una angioinvasión, trombosis y necrosis perivascular. Las imágenes incluyen la presencia de micronódulos, de un nódulo solitario o de múltiples nódulos, masas, consolidaciones, abscesos, derrame pleural, cavitaciones y hemorragias. El signo del halo es precoz, y como hallazgo tardío puede aparecer una cavitación (signo del menisco o de semiluna). El derrame pleural y los infiltrados pulmonares nodulares múltiples pueden orientar al diagnóstico de una mucormicosis10,13,34.
El diagnóstico de laboratorio se basa en la toma de biopsias de los tejidos infectados para realizar un examen microscópico directo, la evaluación anatomopatológica y el cultivo microbiológico. La confirmación etiológica precisa el aislamiento del hongo mediante cultivo o la demostración de la presencia del ADN fúngico mediante técnicas moleculares. En el examen microscópico directo se observan hifas hialinas anchas, no tabicadas, con ramificaciones irregulares en ángulo recto (90°), como si fuesen cintas que se pliegan y retuercen, a diferencia de las hifas de Aspergillus, Lomentospora, Scedosporium o Fusarium, que son más estrechas y uniformes, tabicadas y con ramificaciones dicótomas en ángulo agudo (<45°). También pueden emplearse técnicas de inmunohistoquímica mediante anticuerpos monoclonales que permiten diferenciar los mucorales de otros hongos filamentosos, como Aspergillus, Lomentospora, Scedosporium o Fusarium. El aislamiento en cultivo es fundamental para apoyar los hallazgos histológicos, conocer la identidad del agente etiológico y estudiar su sensibilidad in vitro a los antifúngicos. Para mejorar el rendimiento de las muestras clínicas cultivadas en el laboratorio, estas se deben desmenuzar y cortar con un bisturí con sumo cuidado, y así evitar la rotura de las hifas de los mucorales, que son muy frágiles. No deben triturarse ni homogeneizarse. Los mucorales crecen en pocas horas (18-48h) en forma de colonias algodonosas que cubren toda la superficie de la placa13,17,26. La identificación clásica se basa en el análisis microscópico del micelio y de las esporas asexuales y sexuales que producen. La incubación a temperaturas diferentes, como 25, 30 y 37°C, puede ser útil para identificar algunos de los principales géneros de los mucorales. La esporulación puede estimularse sembrando los aislamientos obtenidos en medios de cultivo deficientes en nutrientes. Sin embargo, algunos mucorales, como Apophysomyces y Saksenaea, son esporuladores muy pobres e incluso pueden no esporular si las condiciones de cultivo no son óptimas. Lamentablemente, el 1,3-β-D-glucano no se detecta en las muestras clínicas de los pacientes con mucormicosis porque no está presente en la pared de los mucorales. La amplificación de secuencias de ADN mediante PCR y su posterior secuenciación permiten identificar el mucoral presente en los tejidos o en el cultivo; no obstante, en tejidos fijados con parafina se puede degradar el ADN, lo que imposibilita la correcta amplificación mediante PCR5,10,17,31,33.
Para el tratamiento de la mucormicosis se recomienda una formulación lipídica de anfotericina B, combinada o no con una candina, acompañada de amplio desbridamiento quirúrgico del tejido necrótico (tabla 3). Además, se debe corregir la enfermedad de base o los factores predisponentes, sobre todo la acidosis metabólica, y disminuir la dosis de corticoides que recibe el paciente. El tratamiento debe mantenerse hasta que desaparece la sintomatología y se resuelven las lesiones visualizadas por técnicas radiológicas. Una alternativa terapéutica es el empleo de posaconazol, solo o en combinación con una candina, terbinafina o anfotericina B. En ocasiones, también puede ser útil el empleo de interferón-γ o factores estimulantes de colonias, y de oxígeno hiperbárico, así como deferiprona y deferasirox en pacientes con cetoacidosis o sobrecarga de hierro10,13,34.
ConclusionesLa frecuencia de las micosis por hongos filamentosos está aumentando en grupos de pacientes muy concretos que habitualmente presentan una inmunodeficiencia en mayor o menor grado. La mayoría de estas enfermedades enfermedades se observan en pacientes con neoplasias hematológicas o en receptores de progenitores hematopoyéticos. Sin embargo, algunas de estas micosis emergentes pueden describirse en pacientes con otras enfermedades, como la diabetes descompensada, o en asociación con factores médicos, como el tratamiento prolongado con corticoides. En la mayoría de los casos el diagnóstico es difícil, y es importante que el clínico sospeche su presencia en pacientes con factores de riesgo o con profilaxis con antifúngicos, con manifestaciones compatibles con una micosis, pero sin datos de imagen o laboratorio que la respalden. La alta mortalidad de las aspergilosis, las fusariosis y, sobre todo, de las mucormicosis y escedosporiasis, hace necesario el inicio precoz del tratamiento. El voriconazol juega un papel determinante en el éxito del tratamiento de aspergilosis, escedosporiasis, fusariosis y otras hialohifomicosis. En las mucormicosis, es la anfotericina B en formulación lipídica la más utilizada, y el posaconazol, una alternativa prometedora. Sin embargo, en algunas infecciones por mucorales, en muchas feohifomicosis y en las micosis causadas por Lomentospora prolificans, no existe un tratamiento adecuado, aunque se ha descrito la eficacia en casos clínicos concretos de diferentes combinaciones entre anfotericina B, voriconazol y candinas u otros antifúngicos.
Un diagnóstico rápido y certero de estas micosis, la adecuada prevención y el alcance de un tratamiento eficaz son retos importantes para los profesionales de la salud enfrentados a las micosis invasivas por hongos filamentosos.
FinanciaciónGuillermo Quindós ha recibido financiación en los cinco últimos años de proyectos concedidos por la Universidad del País Vasco/Euskal Herriko Unibertsitatea (UFI11/25), Gobierno Vasco/Eusko Jaurlaritza (GIC12 210-IT-696-13), Gobierno de España (PI11/00203 y SAF2013-47570-P), Fundación Jesús de Gangoiti, Astellas Pharma, Merck, Sharp & Dohme y Pfizer S. L. U.
Conflicto de interesesJavier Pemán ha participado en los cinco últimos años en el asesoramiento y en conferencias científicas de Astellas Pharma, Gilead Sciences, Teva, Merck, Sharp & Dohme y Pfizer S. L. U.
Guillermo Quindós ha participado en los cinco últimos años en el asesoramiento y en conferencias científicas de Astellas Pharma, bioMérieux España, Elsevier, Esteve Hospital, Gilead Sciences, Merck, Sharp & Dohme y Pfizer S. L. U.