El tratamiento de las onicomicosis precisa de herramientas necesarias para su diagnóstico. Una adecuada interpretación de los resultados de los estudios realizados mediante examen directo micológico nos proporciona la seguridad de pautar un adecuado tratamiento contra la onicomicosis. El acceso restringido a métodos precisos de diagnóstico para la onicomicosis ha condicionado la forma de actuar frente a esta patología tan prevalente, contribuyendo a la cronicidad de la misma y al empleo de tratamientos prolongados que llevan aparejados elevados costes y numerosos efectos colaterales, especialmente con el empleo de antimicóticos por vía sistémica. El objetivo de la nota clínica es ofrecer una herramienta válida, de bajo coste y fácil accesibilidad para diagnosticar la onicomicosis.
El diagnóstico de la onicomicosis aborda de principio a fin la toma de muestra y la técnica de examen directo mediante microscopía utilizando hidróxido de potasio, así como sus variaciones más comunes.
Pese a que en la actualidad existen técnicas con mayor sensibilidad, la técnica de examen directo sigue siendo una herramienta diagnóstica válida, de fácil ejecución y coste-efectiva.
Onychomycosis treatment demands the necessary tools for its diagnosis. A proper interpretation of the results of the studies performed obtained by direct mycological analysis ensures that the treatment against onycomchosis is right. The restricted access to methods of diagnosis has conditioned our way of action to deal with this problem, creating a reputation of incurable diseases or requiring long-term and costly treatments with many side-effects. This clinical note provides a scientifically valid tool, low-cost and easy accessibility for the diagnosis of onychomycosis.
The present paper describes the technique for diagnosis from the beginning to the end with sample taking and direct exam technique by microscopy using potassium hydroxide, as well as its most common variations.
Althougth there are techniques of greater sensitivity, the technique described remains as a valid diagnosis tool, easy to implement and cost-effective.
La realización de un diagnóstico microbiológico correcto resulta imprescindible para tratar de forma eficaz a pacientes con onicomicosis. El propósito de esta nota clínica es aportar una herramienta útil para el podólogo en el diagnóstico de pacientes con infección ungueal por hongos. El diagnóstico de la onicomicosis debe basarse en el reconocimiento visual clínico y en el diagnóstico de la lesión, bien mediante una toma de muestra con examen directo al microscopio o mediante cultivo de la lesión. Un diagnóstico certero de la onicomicosis es clave para abordar con éxito la patología.
La técnica de examen directo (TED) es un procedimiento sencillo, destinado a detectar mediante la observación al microscopio las estructuras fúngicas presentes en la muestra afectada mediante el uso de reactivos como el hidróxido de potasio (KOH) con o sin colorantes, teniendo una sensibilidad superior al cultivo en laboratorio1.
Pese a ser una técnica fácil de realizar, requiere de cierta destreza y experiencia del observador frente al microscopio en la interpretación de los resultados.
TécnicaLa TED consta de 4 pasos:
- 1.
Toma de muestra en el paciente.
- 2.
Preparación de la disolución.
- 3.
Preparación de la muestra.
- 4.
Visualización de la muestra al microscopio.
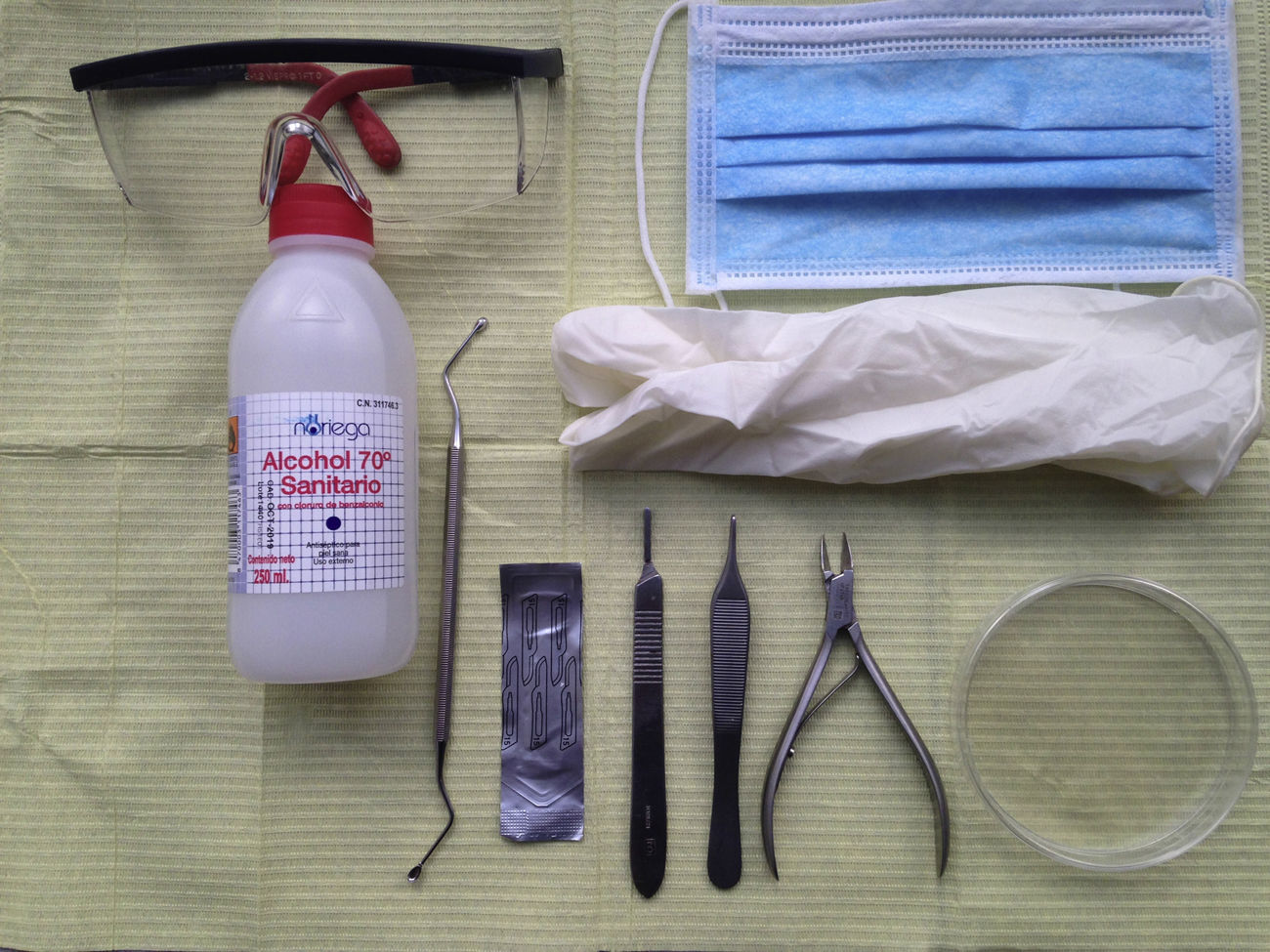
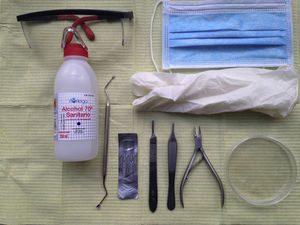
Material para la toma de muestra (fig. 1):
- •
Alcohol de 70% y gasas.
- •
Cucharilla de Martini u hoja de bisturí n.° 15.
- •
Placa de Petri.
- •
Guantes, mascarillas y gafas.
- •
Mango de bisturí, alicates, pinzas y fresa de uña*.
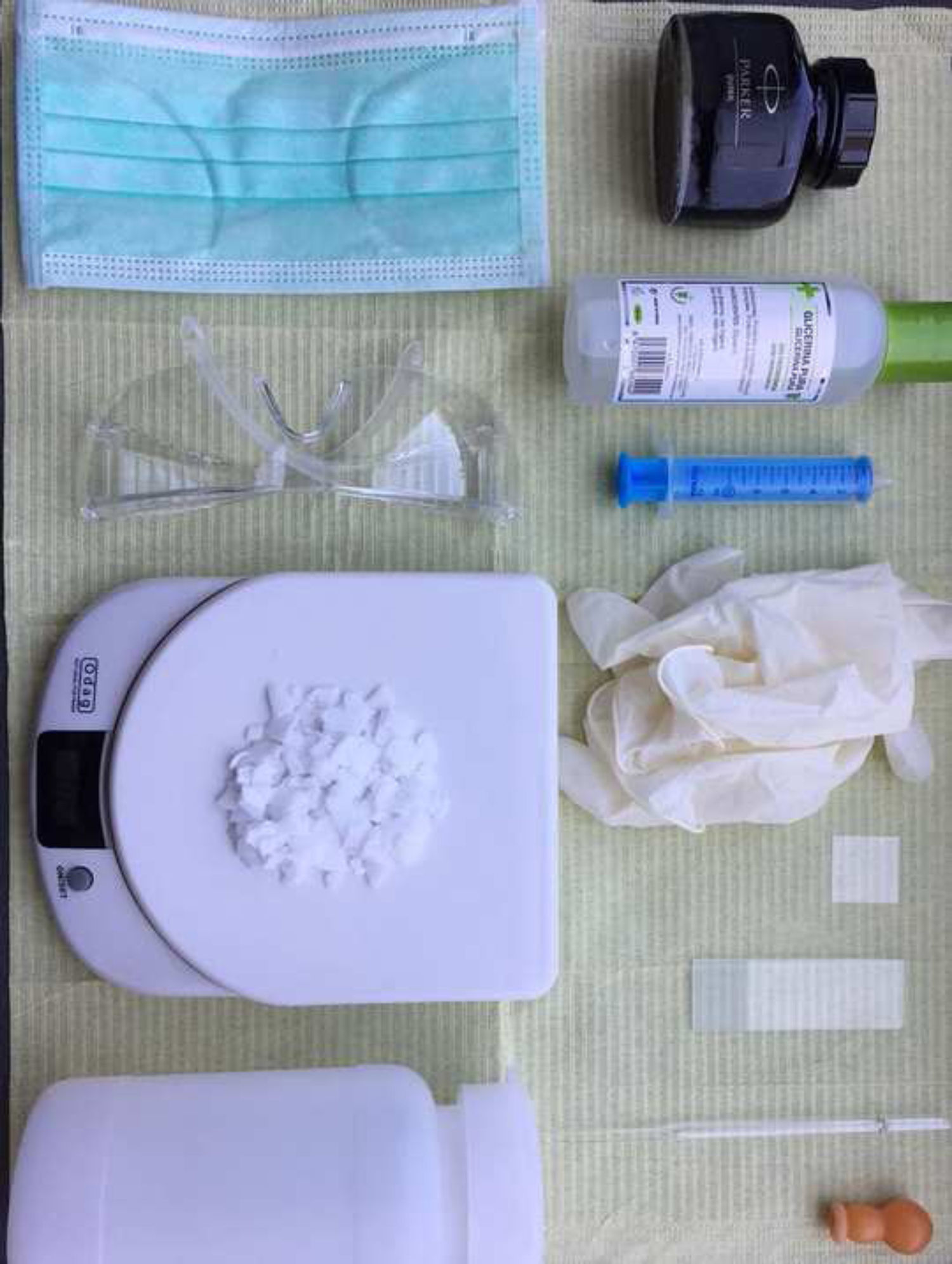
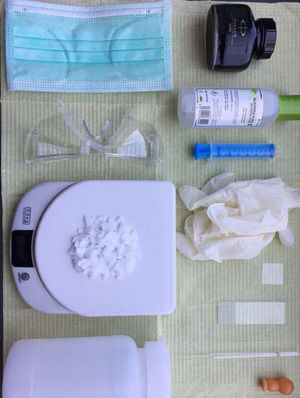
Material para la disolución y visualización (fig. 2):
- •
Microscopio: objetivo 10 aumentos (10×), objetivo 40 aumentos (40×).
- •
Guantes, mascarillas, gafas y jeringuilla de 10ml.
- •
Portas, cubre-portas y pipetas.
- •
Recipiente de plástico.
- •
Agua destilada.
- •
KOH - potasa cáustica.
- •
Báscula o peso.
- •
Mechero Bunsen.
- •
Glicerol y tinta Quick Parker.
- •
Muestra recogida.
La preparación previa de los pacientes y una buena obtención de la muestra son pasos importantes para asegurar el éxito del estudio. Los pacientes deben evitar el uso de polvos, cremas y esmaltes de uñas en los días previos al estudio y extremar las medidas de higiene de las uñas utilizando jabones y cepillos con el objetivo de remover la contaminación existente y acudir al laboratorio con calzado cerrado2,3. Es importante descartar que el paciente haya realizado algún tratamiento para la onicomicosis en las 2-3 semanas previas a la toma de la muestra.
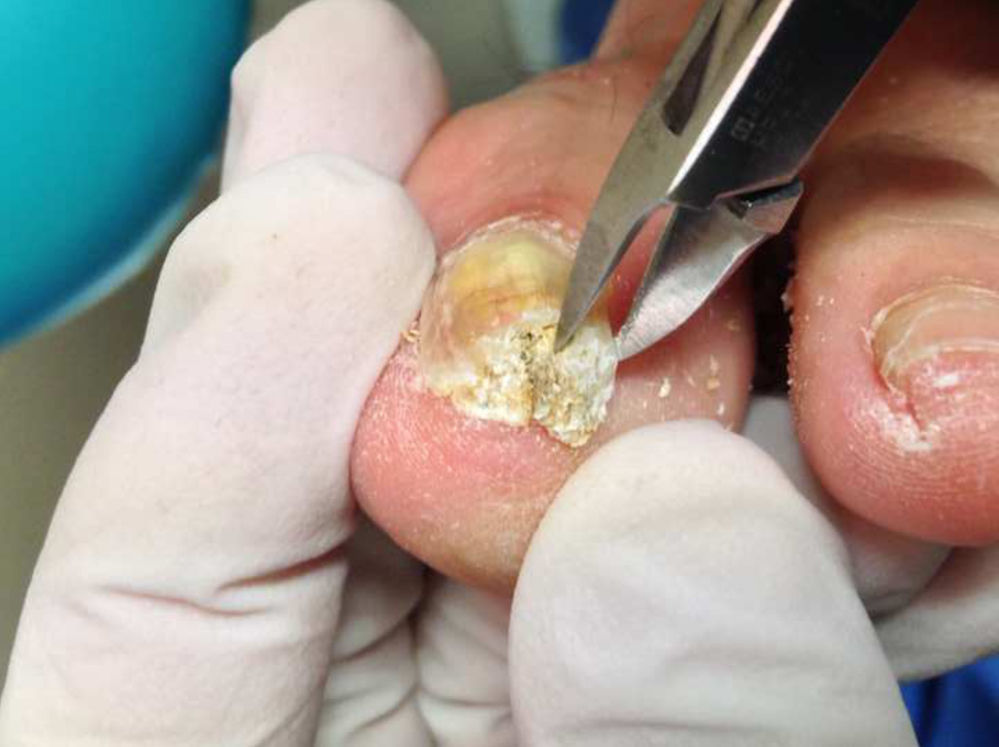
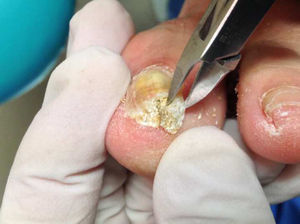
Previo a la toma de muestra se debe realizar una limpieza y desinfección de la zona afectada utilizando una gasa estéril impregnada con alcohol de 70°. Es importante realizar todos estos pasos en condiciones de máxima asepsia. Una vez limpia la lámina ungueal, se accederá a la zona para la toma de muestra. En el caso de onicomicosis distrófica total, esta debe ser profunda y superficial en caso de la onicomicosis blanca. Debe descartarse el primer raspado para evitar el riesgo de contaminación4 (fig. 3).
El tamaño de la muestra debe ser abundante, ya que si es insuficiente podría provocar falsos negativos en la interpretación del resultado. A su vez, es importante que la muestra esté lo más fraccionada posible, casi polvo, para que la disolución elimine la queratina con facilidad (fig. 4).
La muestra recogida será depositada sobre una placa de Petri3,5,6 debidamente identificada con los datos del paciente, la fecha y el número de foto.
Preparación de la disoluciónUna vez tomada la muestra, se prepara la disolución a la que se va a someter. La disolución básica está constituida por agua destilada y potasa cáustica (KOH). Existe variación en la concentración del porcentaje de KOH, pudiendo ser desde el 10% hasta el 40%. La diferencia es la rapidez con que el KOH elimina la queratina. A mayor concentración mayor eliminación de queratina de la muestra, sin alterar la morfología del hongo gracias a la presencia de quitina en su pared.
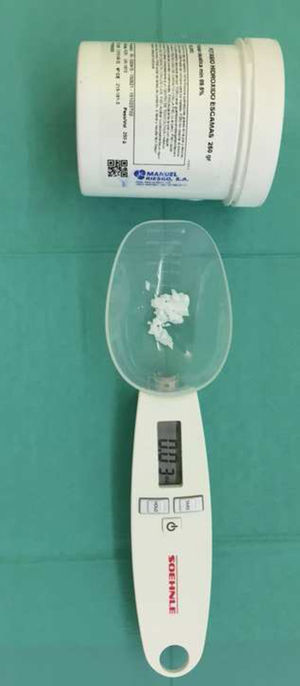
El KOH suele presentarse en polvo, escamas o lentejas (fig. 5). Para su visualización en el microscopio se utilizará KOH al 30%. Para ello se diluirán 3g de KOH en 10ml de agua destilada (3gKOH+10ml agua destilada). Se aconseja realizar poca cantidad debido a la degradación del compuesto con el tiempo. El proceso se realizará con la máxima precaución, ya que el KOH es un material corrosivo. Se utiliza un bote de plástico, no de cristal: el cristal crea una precipitación del compuesto provocando fallos en la función del mismo. Para alargar la vida del compuesto se puede utilizar glicerol, siendo la disolución 3g de KOH en 8ml de agua destilada y 2ml de glicerol (3gKOH+8ml agua destilada+2ml glicerol). La adición de glicerol previene la degradación de los elementos fúngicos, evitando la formación de cristales y la deshidratación de la preparación entre porta y cubre-porta, convirtiéndola en semipermanente.
Preparación de la muestraCon una pipeta se echará una gota de la disolución en el porta y se depositará la muestra. Posteriormente se tapará con un cubre-porta y se extenderá de forma homogénea presionando suavemente para deshacer las burbujas de aire, eliminando el exceso de disolución con una gasa. Se esperará a que el KOH elimine la queratina (fig. 6). Este proceso se puede acelerar calentando la muestra suavemente con un mechero Bunsen o dejándola en una zona caliente 24h (fig. 7).
Para una mejor visualización de los hongos se puede utilizar colorante, como tinta Parker o azul de lactofenol. La preparación de esta disolución se realizará en una proporción 1:2, es decir, se añadirá una parte de tinta sobre dos partes de la disolución de KOH. En el caso de no disponer de tinta azul-negra, la reemplazamos por tinta negra Quink Parker o, en su defecto, otro color de tinta, pero debe ser permanente. El procedimiento es el mismo que el KOH glicerol (3gKOH+8ml de agua destilada+2ml glicerol+5ml tinta). Se debe tener precaución, ya que esta preparación puede enmascarar el pigmento melánico de los hongos dematiáceos.
Los errores más comunes que se cometen en la preparación de la muestra suelen ser: calentar la muestra con un mechero tradicional, ya que habitualmente no se dispone de un mechero Bunsen; en este caso, se dejará la muestra en zona caliente 24h. Impregnar la muestra de huellas digitales y artefactos. No calcular bien las cantidades de la disolución y utilizar botes de cristal.
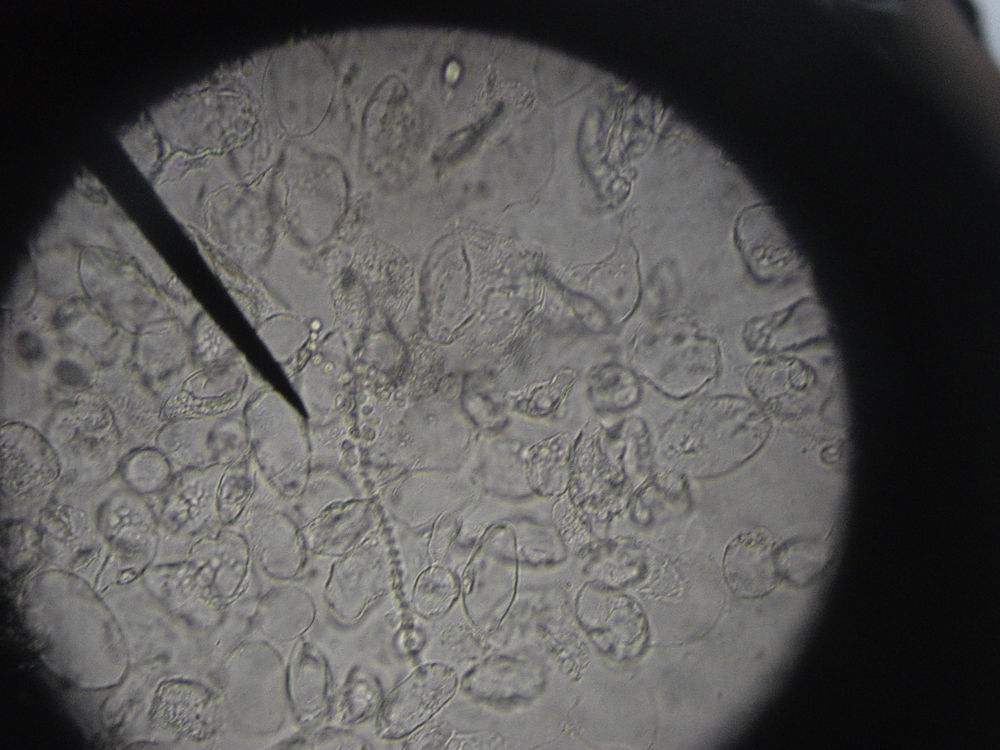
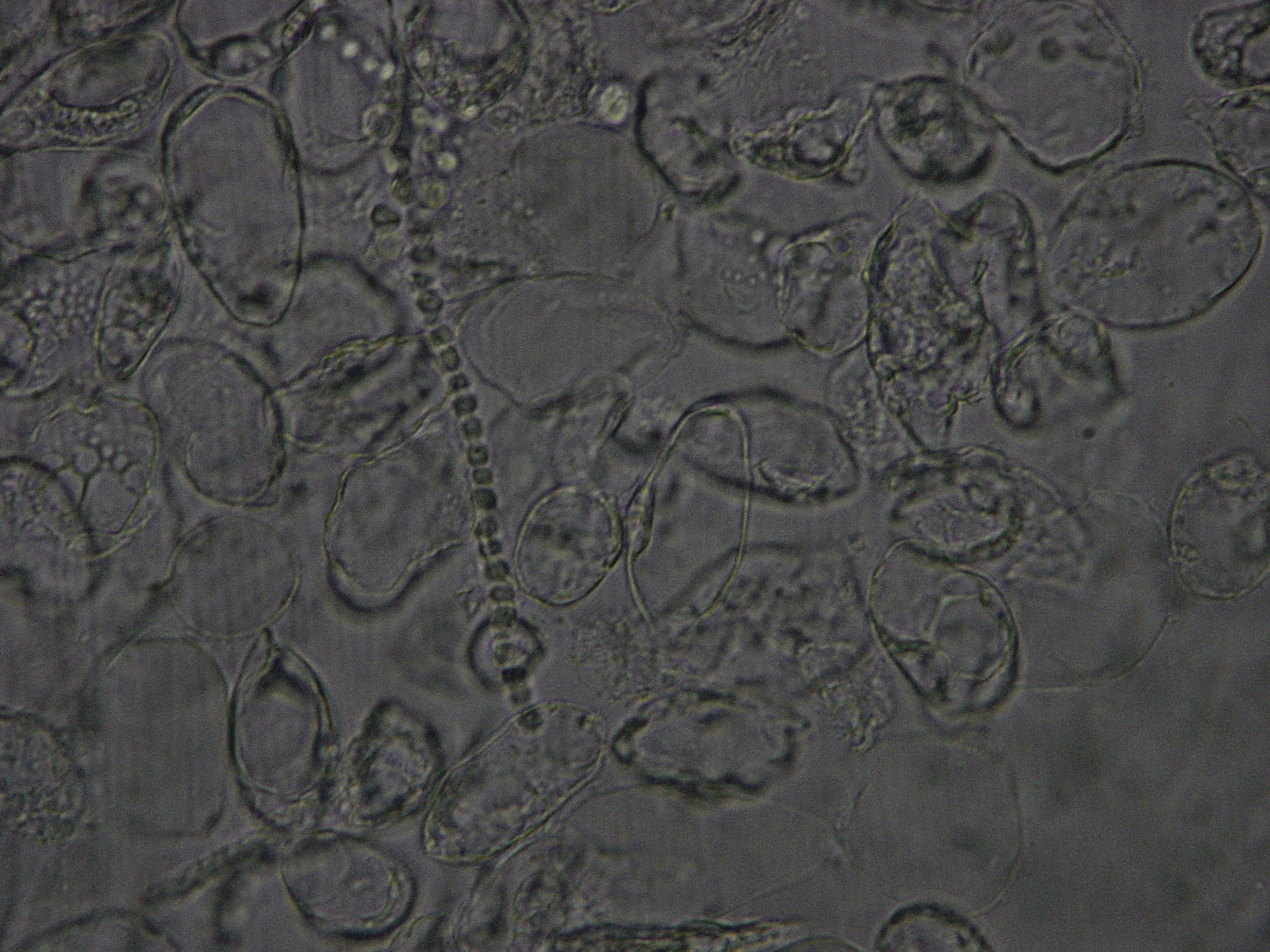
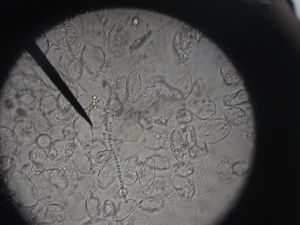
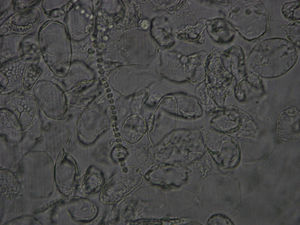
Visualización de la muestra al microscopioUna vez colocada la muestra preparada con la disolución en el microscopio, con el objetivo de 10 aumentos se recorrerá la muestra hasta tener sospecha de identificar hifas. Una vez que se han localizado, se estudiarán en profundidad con el objetivo de 40 aumentos4,7 y se corroborará la sospecha de onicomicosis del paciente (figs. 8 y 9). Para poder visualizar las células epiteliales se reducirá la iluminación mediante la disminución del condensador. Se necesitará experiencia para la identificación y diferenciación de los hongos, pudiendo encontrar en la muestra dermatofitos manifestados como hifas hialinas, tabicadas y ramificadas de 4 a 6μm de diámetro. Las levaduras se visualizarán como elementos esféricos u ovalados (blastosporos), pudiendo presentar brotes y/o pseudohifas. Los hongos miceliales se verán como hifas hialinas o pigmentadas, tabicadas o no, de diámetro irregular según el hongo al que corresponda.
Los dermatofitos son responsables de más del 90% de las micosis que afectan a las uñas de los pies, siendo la especie de mayor prevalencia Trichophyton rubrum, seguida por T. mentagrophytes var. interdigitale, T. tonsurans, Epidermophyton floccosum y T. schoenleinii2,5,8-10.
Los estudios científicos existentes demuestran una alta sensibilidad en la toma de muestra directa con microscopio frente al cultivo en laboratorio. Karimzadegan et al.11 en su estudio reflejan una sensibilidad del 76,5% de la toma de muestra con microscopía directa, frente al 53,2% de toma de cultivo en laboratorio.
Una muestra escasa, pobre y poco homogénea puede producir un bajo recuento de elementos fúngicos viables, pudiendo desencadenar un diagnóstico erróneo de falso negativo. El empleo de medios de siembra que inhiben el crecimiento de algunos hongos, como es la ciclohexidamina, y la acción inhibitoria sobre el crecimiento del hongo de la flora bacteriana coexistente pueden ser muestras de diagnóstico erróneo.
Descrita la herramienta para el diagnóstico de onicomicosis, considerando que el 40-60% de la sospecha clínica de una onicomicosis da resultados positivos, no debe olvidarse que la TED no muestra una especificidad clara si no se tiene gran experiencia en su visualización; de lo contrario, solo se limita a indicar si la muestra está o no infectada12,13. Sin embargo, la pobreza morfológica que muestran los hongos en su fase parasitaria hace difícil su identificación; en este caso, debe complementarse el diagnóstico realizando un cultivo en laboratorio.
En conclusión, el podólogo tiene a su alcance una herramienta de diagnóstico coste-efectiva, rápida, accesible y aplicable al 100% en clínica. Siguiendo el protocolo descrito de la toma de muestra, con cierta experiencia en la preparación y visualización de las muestras, esta herramienta puede ser de gran utilidad para la práctica clínica diaria.
FinanciaciónNo existen fuentes de financiación públicas o privadas en la realización de la presente nota clínica.
Conflicto de interesesDeclaro que no presentamos ningún conflicto de intereses relevante en esta nota clínica.
A Luis Alou por la cesión de imágenes.
En la medida de lo posible se intentará no utilizar la fresa de uñas para acceder a la zona profunda de la lámina, ya que existe la posibilidad de dañar la muestra por aumento de temperatura debido a la fricción del pulido de la uña.