La infección protésica es una de las complicaciones más graves en cirugía ortopédica, por lo que es importante detectar factores relacionados con su aparición. Las revisiones sistemáticas (RS) pronósticas detectan y evalúan factores relacionados con enfermedades, lo que permite una mejor predicción de los riesgos y la implementación de medidas preventivas. Aunque estas RS pronósticas son cada vez más frecuentes, su campo metodológico presenta algunas lagunas de conocimiento.
ObjetivoRealizar una revisión de RS de factores pronósticos para infección protésica y describir la evidencia sintetizada. Secundariamente, evaluar el riesgo de sesgo y la calidad metodológica.
Material y métodosBúsqueda bibliográfica en 4bases de datos (en mayo de 2021) para identificar RS pronósticas que evaluaran factores pronósticos para infección protésica. Evaluamos el riesgo de sesgo mediante ROBIS y la calidad metodológica con la herramienta modificada AMSTAR-2. Se realizó un estudio de solapamiento entre RS.
ResultadosIncluimos 23 RS que valoraban 15 factores asociados con la infección protésica; de ellos, 13 mostraron asociación significativa. Los más estudiados fueron obesidad, corticoides intraarticulares, tabaquismo y glucemia elevada. El solapamiento entre RS fue elevado para obesidad y muy alto para corticoides intraarticulares, tabaquismo y glucemia elevada. El riesgo de sesgo fue considerado bajo en 8 RS (34,7%), pero la herramienta de evaluación metodológica demostró una baja calidad en general.
ConclusionesLa identificación de factores procedimentales modificables ofrecen mejores resultados a los pacientes. Sin embargo, muchas RS son redundantes. La evidencia en factores pronósticos en cirugía ortopédica es débil debido al alto riesgo de sesgo y a la calidad metodológica limitada.
Prosthetic joint infection is one of the most serious complications in orthopedics. Prognostic systematic reviews (SR) detecting and assessing factors related to prosthetic joint infection, allow better prediction of risk and implementation of preventive measures. Although prognostic SR are increasingly frequent, their methodological field presents some knowledge gaps.
PurposeTo carry out an overview of SR assessing risk factors for prosthetic joint infection, describing and synthesizing their evidence. Secondarily, to assess the risk of bias and methodological quality.
Material and methodsWe conducted a bibliographic search in 4databases (May 2021) to identify prognostic SR evaluating any risk factor for prosthetic joint infection. We evaluated risk of bias with the ROBIS tool, and methodological quality with a modified AMSTAR-2 tool. We computed the overlap degree study between included SR.
ResultsTwenty-three SR were included, studying 15 factors for prosthetic joint infection, of which, 13 had significant association. The most frequently studied risk factors were obesity, intra-articular corticosteroids, smoking and uncontrolled diabetes. Overlapping between SR was high for obesity and very high for intra-articular corticoid injection, smoking and uncontrolled diabetes. Risk of bias was considered low in 8SRs (34.7%). The modified AMSTAR-2 tool showed important methodological gaps.
ConclusionsIdentification of procedural-modifiable factors, such as intra-articular corticoids use, can give patients better results. Overlapping between SR was very high, meaning that some SR are redundant. The evidence on risk factors for prosthetic joint infection is weak due to high risk of bias and limited methodological quality.
La cirugía protésica es una de las cirugías más frecuentes en el campo de la ortopedia. En España, según datos del grupo Atlas de la variabilidad de la práctica médica, en 2017 la tasa estandarizada de prótesis totales de rodilla (PTR) fue de 25 casos por 10.000 habitantes, con una variabilidad entre regiones sanitarias del 27%, y para prótesis totales de cadera (PTC) de 10 casos por 10.000 habitantes, con una variabilidad del 20%1. Entre las comunidades autónomas con mayores tasas se sitúan Andalucía, Cataluña, País Vasco y Valencia. En Cataluña existe un registro de artroplastias según el cual se realizaron 9.246 PTR y 4.772 PTC en el 20192.
La infección es una de las complicaciones más graves en la cirugía protésica. La incidencia de infecciones protésicas varía según la articulación. En cirugía protésica de rodilla primaria oscila entre el 1-2% según las series3-5 y aumenta hasta el 10% en la cirugía de revisión3,4; en cirugía de cadera y hombro las tasas son algo mejores y en algunas series no superan el 1%6. Según los datos del servicio Vigilància de les infeccions nosocomials als hospitals de Catalunya (VINCat) y el Programa de prevenció de les infeccions quirúrgiques a Catalunya (PREVINQCat), las tasas de infección en la comunidad autónoma de Cataluña son del 1-2% en rodilla y del 1% en cadera2. Estas complicaciones suponen un elevado coste económico y de recursos sanitarios, que pueden llegar a significar una elevación de 10 veces su coste inicial7. Por ello, detectar los factores pronósticos relacionados con la aparición de estas infecciones tiene implicaciones clínicas y de gestión de recursos sanitarios8.
Existen factores pronósticos inherentes al paciente, modificables o no, como la obesidad o el tabaquismo; otros se encuentran relacionados con el acto quirúrgico, como el cambio de partes móviles en las prótesis9,10, y otros tienen relación con las características del microorganismo causante de la infección.
El interés por los estudios de factores pronósticos, incluyendo el campo de las infecciones protésicas, ha aumentado en los últimos años. Estos estudios buscan identificar factores pronósticos con el objetivo de prever el curso y resultado de los pacientes en un determinado estado de salud11; es decir, quieren identificar los factores asociados a la aparición de una condición o evento, comprender el curso de una afección a lo largo del tiempo, sus determinantes o la probabilidad de un resultado. La información sobre el pronóstico se ha vuelto cada vez más importante para las decisiones basadas en la evidencia en la atención médica y es clave para una medicina personalizada, de precisión y basada en riesgos12.
Los estudios de factor pronóstico presentan particularidades con relación a su diseño y las herramientas metodológicas para evaluar el riesgo de sesgo en comparación con estudios de intervenciones o de pruebas diagnósticas11-13. Las revisiones sistemáticas (RS) de factores pronósticos son un campo metodológico actualmente en desarrollo14-17, si bien hay aún lagunas de conocimiento18-22. Por ejemplo, no existe ninguna herramienta específica para valorar la calidad metodológica de este tipo de revisiones pronósticas. Sí que existen herramientas en este sentido para revisiones de estudios de intervención, como el A measurement tool to assess systematic reviews (AMSTAR-2)21.
El objetivo de este trabajo fue el de realizar una revisión de RS que valoraban factores pronósticos para la aparición de la infección protésica articular, a fin de describir y sintetizar la evidencia. Nuestro objetivo secundario fue desarrollar una modificación de la herramienta AMSTAR-2 para evaluar el riesgo de sesgo y la calidad metodológica de RS de tipo pronóstico.
Material y métodosEsta revisión de revisiones se llevó a cabo siguiendo las propuestas metodológicas establecidas y se reportó siguiendo las normas de reporte PRISMA 202021,23,24. Se elaboró previamente un protocolo que fue registrado en Open Science Framework (Registration DOI: 10.17605 / OSF.IO / HZSQB).
BúsquedaRealizamos una búsqueda electrónica en PubMed, Cochrane Library, Embase y Epistemonikos para identificar las RS publicadas el 5 de mayo de 2021 o con anterioridad. Revisamos la bibliografía de las RS incluidas para identificar otras RS potencialmente elegibles. No hubo restricciones de idioma. La estrategia de búsqueda fue diseñada con la ayuda de un documentalista con experiencia y se basó en los siguientes operadores booleanos: «artroplastias articulares», «reemplazo articular», «artroplastia», «infección articular protésica», «infección artroplastia», «infección articular» y «revisión sistemática». La estrategia de búsqueda electrónica completa se proporciona en el anexo 112.
Criterios de inclusión y exclusiónLos criterios de inclusión se describen a continuación según la estructura PICO. Incluimos RS de estudios de cualquier diseño, realizados en pacientes operados de prótesis en cualquier articulación (población), en los que se comparaba a pacientes con un factor pronóstico (factor índice pronóstico) con pacientes sin el factor estudiado (comparación) y se observó la incidencia de infección protésica, ya fuera aguda o crónica (resultados). Se consideraron solo las RS que hicieron su búsqueda bibliográfica en al menos 2bases de datos, que contenían un método explícito detallado y que evaluaron la calidad de los estudios incluidos.
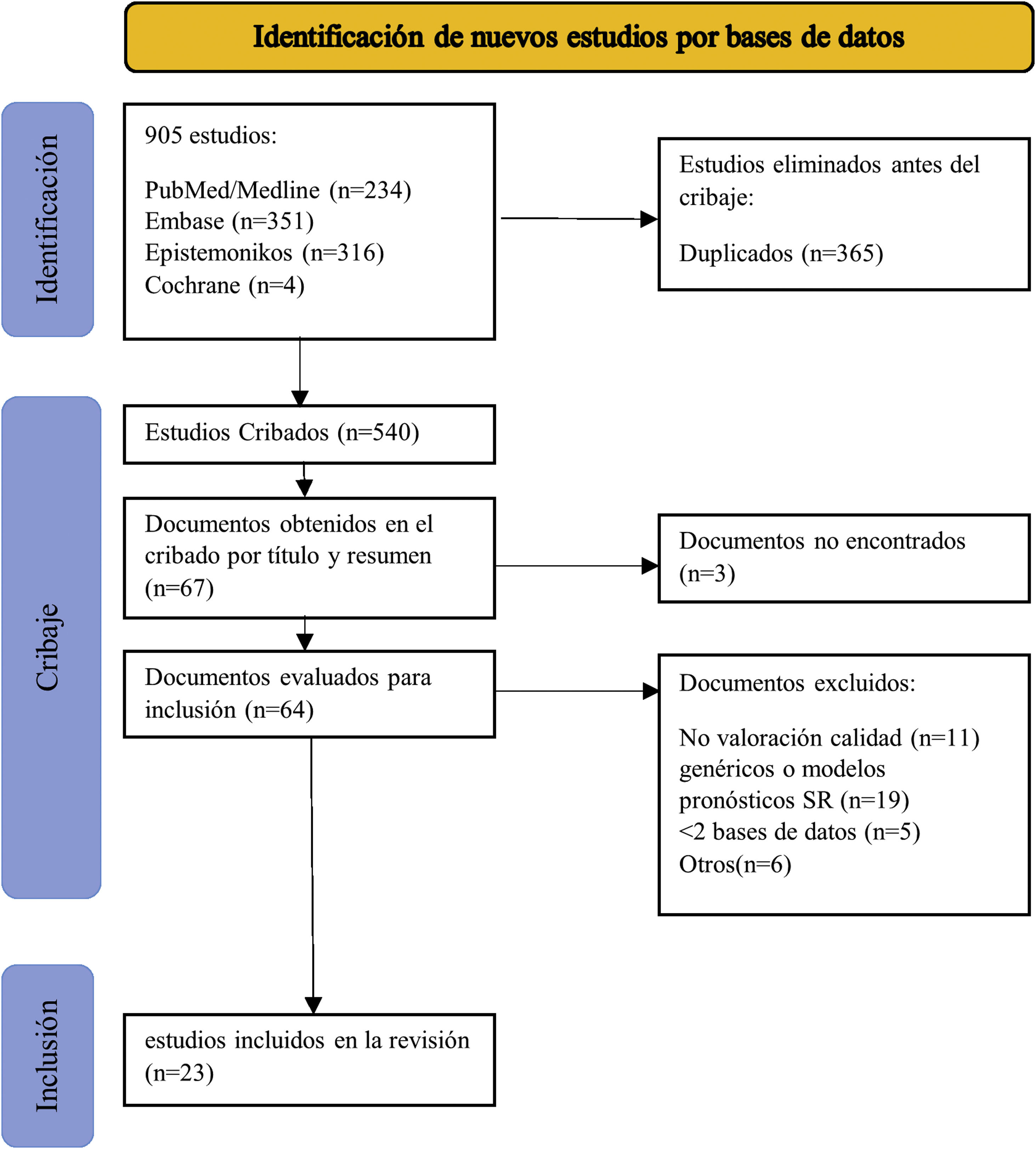
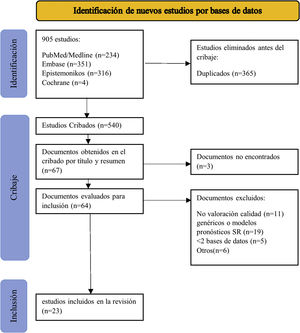
Definimos factor pronóstico como cualquier medida que, entre los pacientes con cierta enfermedad inicial, se asocia con un resultado concreto11. Ampliamos la definición de factor pronóstico al uso de medicamentos utilizados antes de la cirugía porque pueden influir en el riesgo preoperatorio de desarrollar una infección tras protetización. No se establecieron limitaciones por idioma ni por tipo de estudios que hubiera incluido la RS. Se excluyeron los estudios de modelos predictivos o escalas pronósticas y RS que incluyeran más de un factor (RS pronósticas generales) porque incluir todo tipo de estudios pronósticos supondría una bibliografía inalcanzable para analizar en un único estudio. Los resultados se importaron inicialmente a Mendeley para eliminar los duplicados. Los artículos duplicados se importaron al programa Rayyan (revisión sistemática inteligente) para finalizar el proceso de selección25. Dos investigadores independientes (MSM y AM) revisaron los títulos y resúmenes y, en consecuencia, los textos completos de acuerdo con los criterios de inclusión y exclusión. Las discrepancias se resolvieron por consenso. La figura 1 muestra el proceso de selección de estudios.
Dos investigadores (MSM y JCMP) extrajeron los datos por duplicado. Las discrepancias se resolvieron por consenso. Recopilamos los siguientes datos: primer autor, año de publicación, período de búsqueda, número de estudios incluidos y su identificación, diseño de los estudios incluidos, características de la población, factor pronóstico estudiado, medidas de resultado de infección protésica (RR, OR, HR), metaanálisis (MA) y análisis de subgrupos o de sensibilidad, índice de heterogeneidad (I2) de los estudios incluidos en el MA, las guías de reporte y la financiación. También recopilamos la información para evaluar el riesgo de sesgo y la calidad metodológica.
Extracción de datosDos investigadores independientes (MSM y JCMP) evaluaron el riesgo de sesgo de RS utilizando la herramienta Risk of bias in systematic reviews (ROBIS)22. Esta escala, en una primera fase, evalúa 4dominios de posible conflicto en la RS de estudios pronósticos: criterios de elegibilidad de los estudios en la RS, identificación y selección de los estudios, extracción de datos y síntesis de los resultados. En una segunda fase, evalúa el riesgo general de sesgo teniendo en cuenta cómo se han abordado los posibles conflictos en los dominios. Las discrepancias se resolvieron por consenso.
Síntesis de la informaciónElaboramos una descripción narrativa de los datos extraídos, clasificando los factores pronósticos en modificables o no modificables, e individuales (los que dependen del paciente) o procedimentales (los que dependen del clínico).
Analizamos los datos extraídos para desarrollar un mapa de evidencia de solapamiento, mediante tablas cruzadas de las RS incluidas y de los estudios individuales para determinar el grado de superposición entre las RS incluidas26. Calculamos el porcentaje de superposición y el área cubierta corregida (ACC) de las RS incluidas (fig. 2), solo sobre aquellos factores pronósticos estudiados en al menos 2RS. Definimos solapamiento leve si el ACC oscilaba entre 0-5%, moderado entre 6-10%, alto entre 11-15% y muy alto cuando superaba el 15%.
Calidad metodológicaLa herramienta AMSTAR-2 se utiliza para evaluar la calidad metodológica de RS de estudios aleatorizados y no aleatorizados de intervenciones sanitarias. Esta herramienta consta de 16 dominios de valoración, de los cuales 7 son críticos y 9 no lo son.
Los dominios críticos son los siguientes: el 2, registro del protocolo previo al inicio de la RS; el 4, adecuación de la búsqueda bibliográfica; el 7, justificación de exclusión de los estudios primarios; el 9, riesgo de sesgo de los estudios primarios; el 11, idoneidad de los métodos del metaanálisis; el 13, consideración del riesgo de sesgo al interpretar los resultados y el 15, evaluación de la presencia y posible impacto de sesgo de publicación.
En cuanto a los dominios no críticos encontramos: el 1, la pregunta incluye los componentes PICO; el 3, se explican los motivos del diseño de estudio seleccionado para la inclusión en la RS; el 5, realización del cribado por duplicado; el 6, extracción de datos por duplicado; el 8, explicación de los estudios incluidos con suficiente detalle; el 10, reporte del financiamiento de cada estudio primario; el 12, evaluación del riesgo de sesgo sobre los resultados del metaanálisis; el 14, correcta explicación sobre la posible heterogeneidad entre estudios primarios y el 16 reporte de los conflictos de interés al realizar la RS. Esta herramienta no tiene la intención de generar una puntuación general21.
No disponemos de ninguna herramienta similar para RS que incluya únicamente estudios pronósticos. Por ello, modificamos la herramienta AMSTAR 2 para explorar la calidad metodológica de las diferentes RS pronósticas incluidas. Nuestra versión modificada consta de 16 elementos con cambios en 2ítems, uno crítico y otro no crítico. Como modificaciones, en el ítem 1 agregamos el tiempo y los tipos de estudios primarios incluidos en la pregunta relacionada con los criterios de inclusión (PICOT-S), y en el ítem 9 se introdujo la evaluación del sesgo utilizando una herramienta para estudios de pronóstico (Quality In Prognosis Studies, QUIPS27 o la escala Newcastle Ottawa, NOS28, según corresponda).
ResultadosBúsquedaIdentificamos 905 registros en la búsqueda principal publicados hasta el 5 de mayo de 2020. Después de eliminar los duplicados, examinamos 540 RS según título y resumen. De los 67 estudios restantes, se excluyeron 3por no encontrar el texto completo, ni siquiera después del contacto directo con los autores. Revisamos el texto completo de 64 RS, eliminamos 11 por no evaluar la calidad metodológica de los estudios primarios, 19 por ser modelos predictivos o RS de pronóstico generales, 5por buscar solo en una base de datos y 6por otras razones que se especifican en el anexo 2. Tras la revisión de la bibliografía de las RS incluidas, no identificamos otros estudios que cumplieran con nuestros criterios de elegibilidad. Finalmente, incluimos 23 RS (fig. 1)29-51.
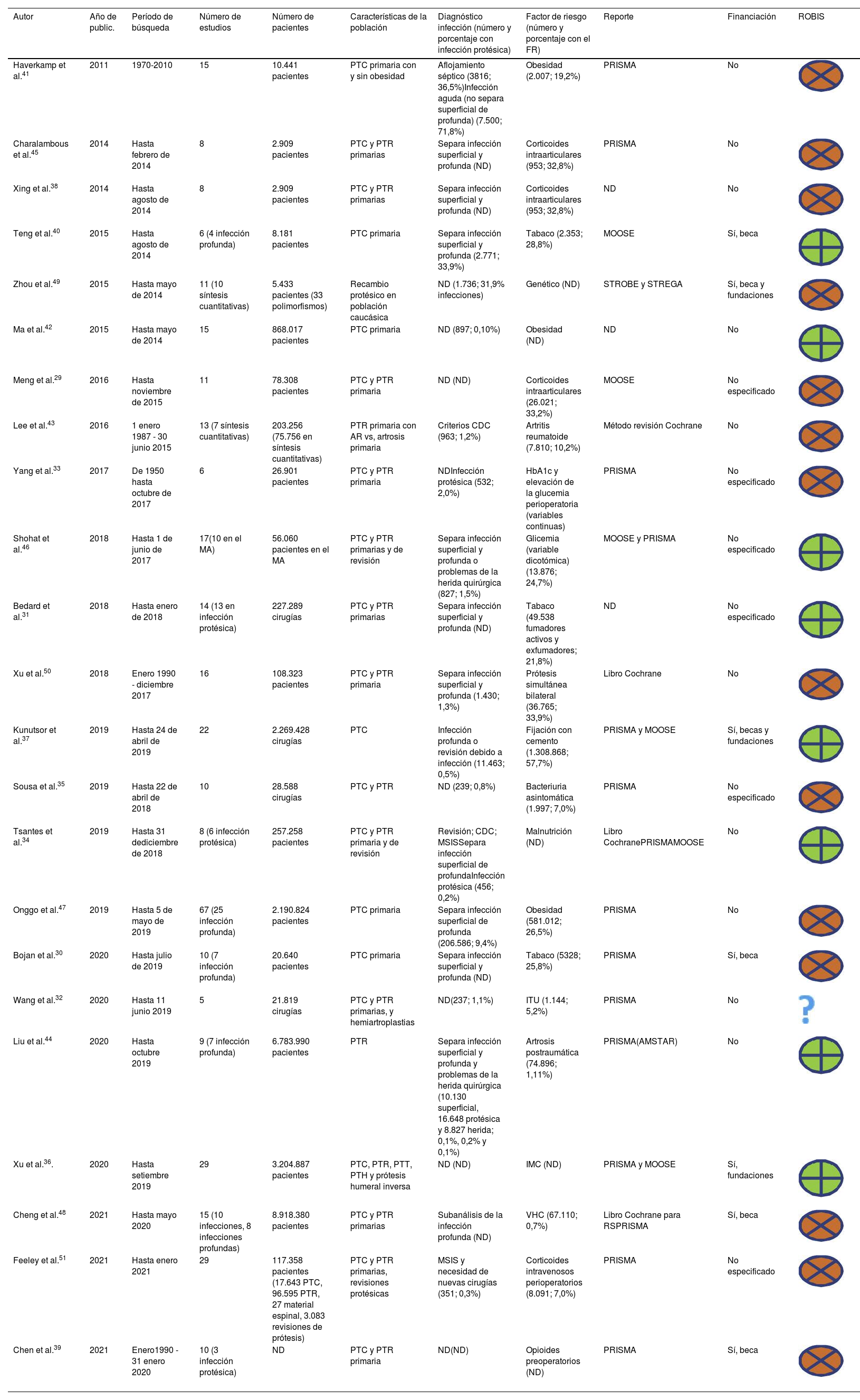
Características de las revisiones sistemáticasLas 23 RS incluidas en esta revisión se publicaron entre 2011 y 2021, la cantidad de estudios primarios incluidos en cada RS varía entre 5 y 29, y el rango de participantes varió entre 2.909 y 8.363.266. El tipo de estudio primario incluido fue en su mayoría observacional retrospectivo, tanto de cohortes como de casos y controles. Seis RS incluyeron cohortes prospectivas junto con estudios retrospectivos y solo 3RS incluyeron ensayos clínicos aleatorizados. La tabla 1 muestra las características generales de las 23 SR incluidas.
Características generales de las revisiones sistemáticas incluidas
| Autor | Año de public. | Período de búsqueda | Número de estudios | Número de pacientes | Características de la población | Diagnóstico infección (número y porcentaje con infección protésica) | Factor de riesgo (número y porcentaje con el FR) | Reporte | Financiación | ROBIS |
|---|---|---|---|---|---|---|---|---|---|---|
| Haverkamp et al.41 | 2011 | 1970-2010 | 15 | 10.441 pacientes | PTC primaria con y sin obesidad | Aflojamiento séptico (3816; 36,5%)Infección aguda (no separa superficial de profunda) (7.500; 71,8%) | Obesidad (2.007; 19,2%) | PRISMA | No | |
| Charalambous et al.45 | 2014 | Hasta febrero de 2014 | 8 | 2.909 pacientes | PTC y PTR primarias | Separa infección superficial y profunda (ND) | Corticoides intraarticulares (953; 32,8%) | PRISMA | No | |
| Xing et al.38 | 2014 | Hasta agosto de 2014 | 8 | 2.909 pacientes | PTC y PTR primarias | Separa infección superficial y profunda (ND) | Corticoides intraarticulares (953; 32,8%) | ND | No | |
| Teng et al.40 | 2015 | Hasta agosto de 2014 | 6 (4 infección profunda) | 8.181 pacientes | PTC primaria | Separa infección superficial y profunda (2.771; 33,9%) | Tabaco (2.353; 28,8%) | MOOSE | Sí, beca | |
| Zhou et al.49 | 2015 | Hasta mayo de 2014 | 11 (10 síntesis cuantitativas) | 5.433 pacientes (33 polimorfismos) | Recambio protésico en población caucásica | ND (1.736; 31,9% infecciones) | Genético (ND) | STROBE y STREGA | Sí, beca y fundaciones | |
| Ma et al.42 | 2015 | Hasta mayo de 2014 | 15 | 868.017 pacientes | PTC primaria | ND (897; 0,10%) | Obesidad (ND) | ND | No | |
| Meng et al.29 | 2016 | Hasta noviembre de 2015 | 11 | 78.308 pacientes | PTC y PTR primaria | ND (ND) | Corticoides intraarticulares (26.021; 33,2%) | MOOSE | No especificado | |
| Lee et al.43 | 2016 | 1 enero 1987 - 30 junio 2015 | 13 (7 síntesis cuantitativas) | 203.256 (75.756 en síntesis cuantitativas) | PTR primaria con AR vs, artrosis primaria | Criterios CDC (963; 1,2%) | Artritis reumatoide (7.810; 10,2%) | Método revisión Cochrane | No | |
| Yang et al.33 | 2017 | De 1950 hasta octubre de 2017 | 6 | 26.901 pacientes | PTC y PTR primaria | NDInfección protésica (532; 2,0%) | HbA1c y elevación de la glucemia perioperatoria (variables continuas) | PRISMA | No especificado | |
| Shohat et al.46 | 2018 | Hasta 1 de junio de 2017 | 17(10 en el MA) | 56.060 pacientes en el MA | PTC y PTR primarias y de revisión | Separa infección superficial y profunda o problemas de la herida quirúrgica (827; 1,5%) | Glicemia (variable dicotómica) (13.876; 24,7%) | MOOSE y PRISMA | No especificado | |
| Bedard et al.31 | 2018 | Hasta enero de 2018 | 14 (13 en infección protésica) | 227.289 cirugías | PTC y PTR primarias | Separa infección superficial y profunda (ND) | Tabaco (49.538 fumadores activos y exfumadores; 21,8%) | ND | No especificado | |
| Xu et al.50 | 2018 | Enero 1990 - diciembre 2017 | 16 | 108.323 pacientes | PTC y PTR primaria | Separa infección superficial y profunda (1.430; 1,3%) | Prótesis simultánea bilateral (36.765; 33,9%) | Libro Cochrane | No | |
| Kunutsor et al.37 | 2019 | Hasta 24 de abril de 2019 | 22 | 2.269.428 cirugías | PTC | Infección profunda o revisión debido a infección (11.463; 0,5%) | Fijación con cemento (1.308.868; 57,7%) | PRISMA y MOOSE | Sí, becas y fundaciones | |
| Sousa et al.35 | 2019 | Hasta 22 de abril de 2018 | 10 | 28.588 cirugías | PTC y PTR | ND (239; 0,8%) | Bacteriuria asintomática (1.997; 7,0%) | PRISMA | No especificado | |
| Tsantes et al.34 | 2019 | Hasta 31 dediciembre de 2018 | 8 (6 infección protésica) | 257.258 pacientes | PTC y PTR primaria y de revisión | Revisión; CDC; MSISSepara infección superficial de profundaInfección protésica (456; 0,2%) | Malnutrición (ND) | Libro CochranePRISMAMOOSE | No | |
| Onggo et al.47 | 2019 | Hasta 5 de mayo de 2019 | 67 (25 infección profunda) | 2.190.824 pacientes | PTC primaria | Separa infección superficial de profunda (206.586; 9,4%) | Obesidad (581.012; 26,5%) | PRISMA | No | |
| Bojan et al.30 | 2020 | Hasta julio de 2019 | 10 (7 infección profunda) | 20.640 pacientes | PTC primaria | Separa infección superficial y profunda (ND) | Tabaco (5328; 25,8%) | PRISMA | Sí, beca | |
| Wang et al.32 | 2020 | Hasta 11 junio 2019 | 5 | 21.819 cirugías | PTC y PTR primarias, y hemiartroplastias | ND(237; 1,1%) | ITU (1.144; 5,2%) | PRISMA | No | |
| Liu et al.44 | 2020 | Hasta octubre 2019 | 9 (7 infección profunda) | 6.783.990 pacientes | PTR | Separa infección superficial y profunda y problemas de la herida quirúrgica (10.130 superficial, 16.648 protésica y 8.827 herida; 0,1%, 0,2% y 0,1%) | Artrosis postraumática (74.896; 1,11%) | PRISMA(AMSTAR) | No | |
| Xu et al.36. | 2020 | Hasta setiembre 2019 | 29 | 3.204.887 pacientes | PTC, PTR, PTT, PTH y prótesis humeral inversa | ND (ND) | IMC (ND) | PRISMA y MOOSE | Sí, fundaciones | |
| Cheng et al.48 | 2021 | Hasta mayo 2020 | 15 (10 infecciones, 8 infecciones profundas) | 8.918.380 pacientes | PTC y PTR primarias | Subanálisis de la infección profunda (ND) | VHC (67.110; 0,7%) | Libro Cochrane para RSPRISMA | Sí, beca | |
| Feeley et al.51 | 2021 | Hasta enero 2021 | 29 | 117.358 pacientes (17.643 PTC, 96.595 PTR, 27 material espinal, 3.083 revisiones de prótesis) | PTC y PTR primarias, revisiones protésicas | MSIS y necesidad de nuevas cirugías (351; 0,3%) | Corticoides intravenosos perioperatorios (8.091; 7,0%) | PRISMA | No especificado | |
| Chen et al.39 | 2021 | Enero1990 - 31 enero 2020 | 10 (3 infección protésica) | ND | PTC y PTR primaria | ND(ND) | Opioides preoperatorios (ND) | PRISMA | Sí, beca |
CDC: Control Disease Center; HbA1c: hemoglobina glicosilada; IMC: índice de masa corporal; ITU: infección del tracto urinario; MOOSE: Meta-analysis Of Observational Studies in Epidemiology; MSIS: Musculoskeletal Infection Society; ND: no disponible; PRISMA: Preferred Reporting Items for Systematic Reviews and Meta-Analyses; PTC: prótesis total de cadera; PTH: prótesis total humeral; PTR: prótesis total de rodilla; PTT: prótesis total de tobillo; publ.: publicación; RS: revisión sistemática; STREGA: Strengthening in the Reporting of Genetic Association studies; STROBE: Strengthening in the Reporting of Observational studies in Epidemiology; VHC: virus de la hepatitis C.
Las RS incluidas evaluaron la calidad y el riesgo de sesgo de los estudios primarios mediante las siguientes herramientas: herramienta del Grupo Cochrane Collaborative Back Review (CCBG)52, escala Newcastle-Ottawa (NOS) en estudios no aleatorizados en MA22, índice metodológico para estudios no aleatorizados (MINORS)53 y la escala de Downs y Black54. Ninguna RS utilizó una escala específica para estudios pronósticos27.
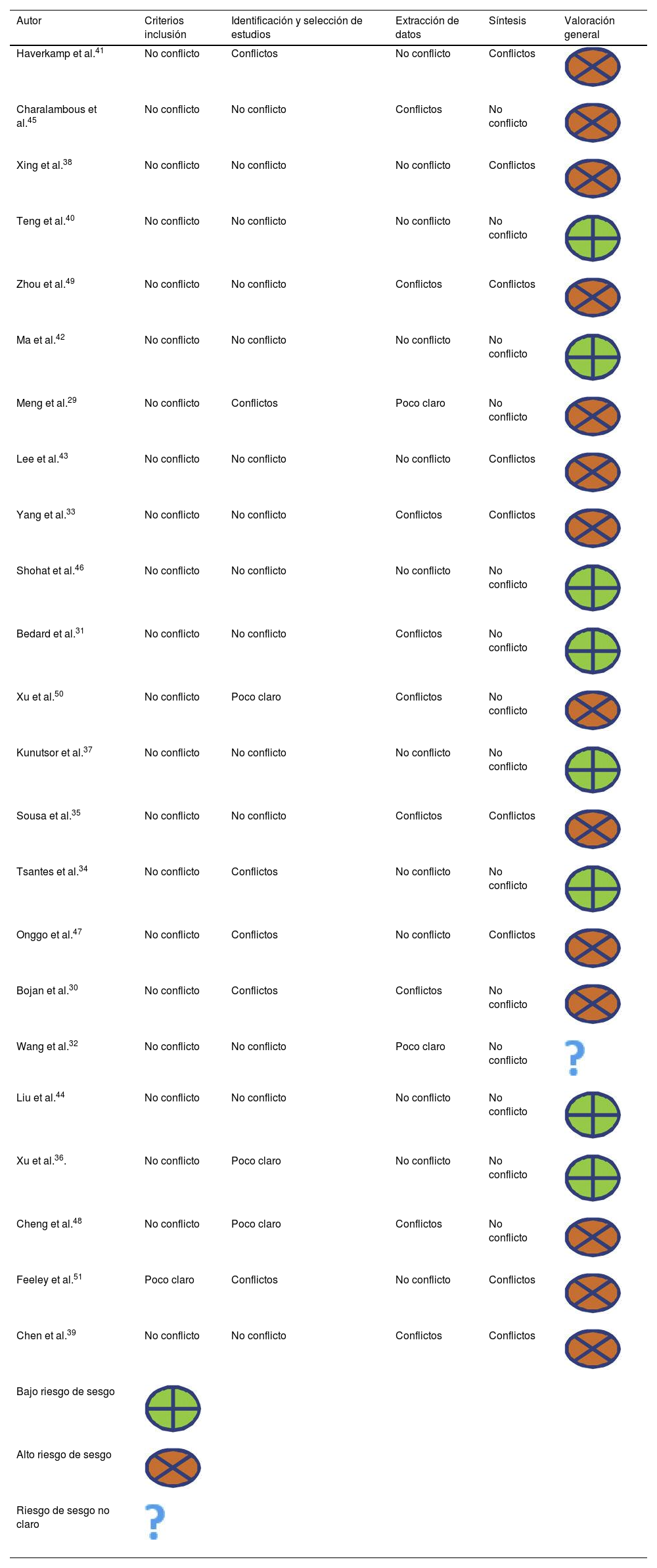
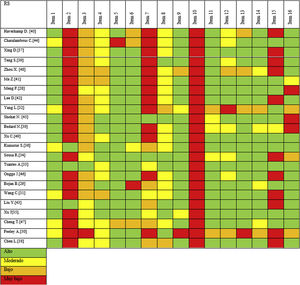
Al examinar el riesgo de sesgo, solo 8de las 23 RS (34,7%) incluidas presentaban un riesgo de sesgo bajo31,34,36,37,40,42,44,46. De las otras 15, una no detalló de forma transparente la evaluación final del sesgo32. Las 14 revisiones restantes tenían un alto riesgo de sesgo porque al menos un dominio mostraba conflictos graves no resueltos en la fase de evaluación general del sesgo29,30,33,35,38,39,41,43,45,47-51. De estas 14 RS, 10 presentaron conflictos en al menos 2dominios. En general, 5RS de 23 mostraron conflictos en el dominio 2 de selección e identificación de estudios, 8en el dominio 3 de extracción de datos y 9en el dominio 4 de síntesis. Ninguna RS presentó conflictos en el dominio 1, ya que todas las RS presentaron de forma clara y adecuada los criterios de elegibilidad de los estudios primarios incluidos. La tabla 2 muestra la evaluación del riesgo de sesgo para los dominios 1 a 4, con una fase final de evaluación general del riesgo.
Valoración riesgo de sesgo mediante ROBIS
| Autor | Criterios inclusión | Identificación y selección de estudios | Extracción de datos | Síntesis | Valoración general |
|---|---|---|---|---|---|
| Haverkamp et al.41 | No conflicto | Conflictos | No conflicto | Conflictos | |
| Charalambous et al.45 | No conflicto | No conflicto | Conflictos | No conflicto | |
| Xing et al.38 | No conflicto | No conflicto | No conflicto | Conflictos | |
| Teng et al.40 | No conflicto | No conflicto | No conflicto | No conflicto | |
| Zhou et al.49 | No conflicto | No conflicto | Conflictos | Conflictos | |
| Ma et al.42 | No conflicto | No conflicto | No conflicto | No conflicto | |
| Meng et al.29 | No conflicto | Conflictos | Poco claro | No conflicto | |
| Lee et al.43 | No conflicto | No conflicto | No conflicto | Conflictos | |
| Yang et al.33 | No conflicto | No conflicto | Conflictos | Conflictos | |
| Shohat et al.46 | No conflicto | No conflicto | No conflicto | No conflicto | |
| Bedard et al.31 | No conflicto | No conflicto | Conflictos | No conflicto | |
| Xu et al.50 | No conflicto | Poco claro | Conflictos | No conflicto | |
| Kunutsor et al.37 | No conflicto | No conflicto | No conflicto | No conflicto | |
| Sousa et al.35 | No conflicto | No conflicto | Conflictos | Conflictos | |
| Tsantes et al.34 | No conflicto | Conflictos | No conflicto | No conflicto | |
| Onggo et al.47 | No conflicto | Conflictos | No conflicto | Conflictos | |
| Bojan et al.30 | No conflicto | Conflictos | Conflictos | No conflicto | |
| Wang et al.32 | No conflicto | No conflicto | Poco claro | No conflicto | |
| Liu et al.44 | No conflicto | No conflicto | No conflicto | No conflicto | |
| Xu et al.36. | No conflicto | Poco claro | No conflicto | No conflicto | |
| Cheng et al.48 | No conflicto | Poco claro | Conflictos | No conflicto | |
| Feeley et al.51 | Poco claro | Conflictos | No conflicto | Conflictos | |
| Chen et al.39 | No conflicto | No conflicto | Conflictos | Conflictos | |
| Bajo riesgo de sesgo | |||||
| Alto riesgo de sesgo | |||||
| Riesgo de sesgo no claro |
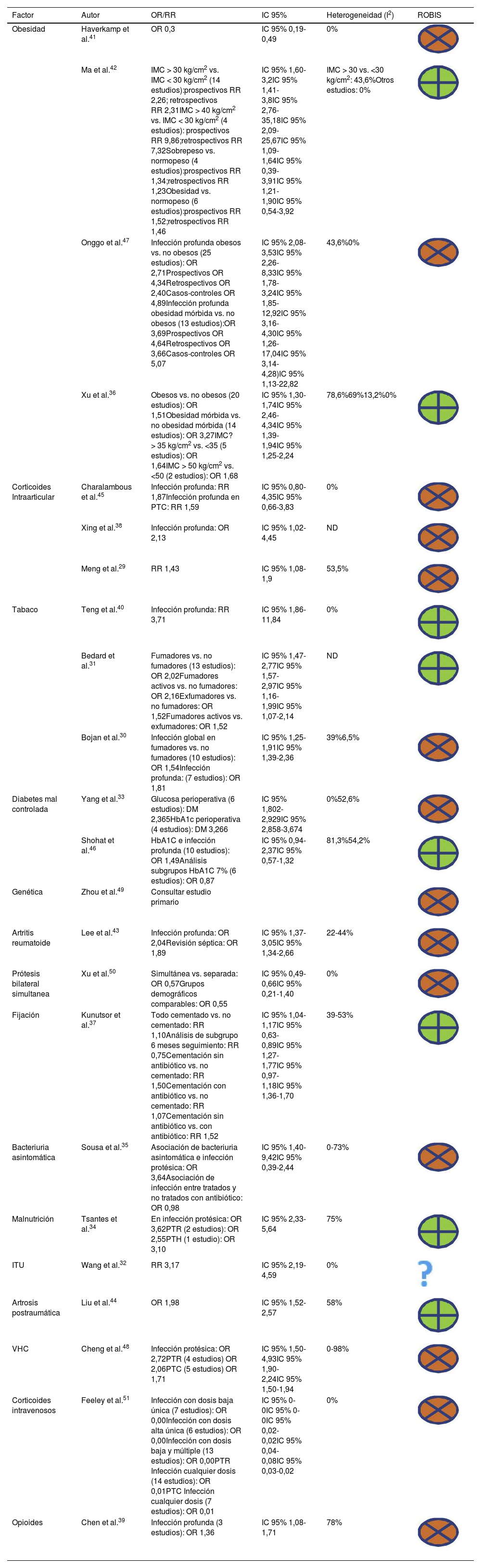
Incluimos un total de 15 factores pronósticos diferentes, en la tabla 3 se resumen la odds ratio (OR) o el riesgo relativo (RR) encontrados para cada factor para infección protésica. Los factores de pronósticos más frecuentes fueron obesidad en 4RS36,41,42,47, corticoides intraarticulares en 3RS29,38,45, tabaquismo en otras 330,31,40 y falta de control diabetes en 2RS33,46. El resto de los factores se evaluaron en una sola RS cada uno: presencia de ciertos polimorfismos genéticos49, artritis reumatoide43, cirugía simultánea50, fijación protésica37, bacteriuria asintomática35, infección del tracto urinario (ITU)32, desnutrición34, artrosis postraumática44, virus de la hepatitis C (VHC)48, administración de corticoides intravenosos51 e ingesta de opioides39. En el estudio de Zhou et al.49, se estudiaron 33 polimorfismos distintos y se buscó una posible asociación de cada uno de ellos con infección protésica. En la tabla 4 se muestran los factores pronósticos estudiados en cada RS.
Revisión de la odds ratio y del riesgo relativo para los diferentes factores de riesgo/pronósticos
| Factor | Autor | OR/RR | IC 95% | Heterogeneidad (I2) | ROBIS |
|---|---|---|---|---|---|
| Obesidad | Haverkamp et al.41 | OR 0,3 | IC 95% 0,19-0,49 | 0% | |
| Ma et al.42 | IMC > 30 kg/cm2 vs. IMC < 30 kg/cm2 (14 estudios):prospectivos RR 2,26; retrospectivos RR 2,31IMC > 40 kg/cm2 vs. IMC < 30 kg/cm2 (4 estudios): prospectivos RR 9,86;retrospectivos RR 7,32Sobrepeso vs. normopeso (4 estudios):prospectivos RR 1,34;retrospectivos RR 1,23Obesidad vs. normopeso (6 estudios):prospectivos RR 1,52;retrospectivos RR 1,46 | IC 95% 1,60-3,2IC 95% 1,41-3,8IC 95% 2,76-35,18IC 95% 2,09-25,67IC 95% 1,09-1,64IC 95% 0,39-3,91IC 95% 1,21-1,90IC 95% 0,54-3,92 | IMC > 30 vs. <30 kg/cm2: 43,6%Otros estudios: 0% | ||
| Onggo et al.47 | Infección profunda obesos vs. no obesos (25 estudios): OR 2,71Prospectivos OR 4,34Retrospectivos OR 2,40Casos-controles OR 4,89Infección profunda obesidad mórbida vs. no obesos (13 estudios):OR 3,69Prospectivos OR 4,64Retrospectivos OR 3,66Casos-controles OR 5,07 | IC 95% 2,08-3,53IC 95% 2,26-8,33IC 95% 1,78-3,24IC 95% 1,85-12,92IC 95% 3,16-4,30IC 95% 1,26-17,04IC 95% 3,14-4,28)IC 95% 1,13-22,82 | 43,6%0% | ||
| Xu et al.36 | Obesos vs. no obesos (20 estudios): OR 1,51Obesidad mórbida vs. no obesidad mórbida (14 estudios): OR 3,27IMC?> 35 kg/cm2 vs. <35 (5 estudios): OR 1,64IMC > 50 kg/cm2 vs. <50 (2 estudios): OR 1,68 | IC 95% 1,30-1,74IC 95% 2,46-4,34IC 95% 1,39-1,94IC 95% 1,25-2,24 | 78,6%69%13,2%0% | ||
| Corticoides Intraarticular | Charalambous et al.45 | Infección profunda: RR 1,87Infección profunda en PTC: RR 1,59 | IC 95% 0,80-4,35IC 95% 0,66-3,83 | 0% | |
| Xing et al.38 | Infección profunda: OR 2,13 | IC 95% 1,02-4,45 | ND | ||
| Meng et al.29 | RR 1,43 | IC 95% 1,08-1,9 | 53,5% | ||
| Tabaco | Teng et al.40 | Infección profunda: RR 3,71 | IC 95% 1,86-11,84 | 0% | |
| Bedard et al.31 | Fumadores vs. no fumadores (13 estudios): OR 2,02Fumadores activos vs. no fumadores: OR 2,16Exfumadores vs. no fumadores: OR 1,52Fumadores activos vs. exfumadores: OR 1,52 | IC 95% 1,47-2,77IC 95% 1,57-2,97IC 95% 1,16-1,99IC 95% 1,07-2,14 | ND | ||
| Bojan et al.30 | Infección global en fumadores vs. no fumadores (10 estudios): OR 1,54Infección profunda: (7 estudios): OR 1,81 | IC 95% 1,25-1,91IC 95% 1,39-2,36 | 39%6,5% | ||
| Diabetes mal controlada | Yang et al.33 | Glucosa perioperativa (6 estudios): DM 2,365HbA1c perioperativa (4 estudios): DM 3,266 | IC 95% 1,802-2,929IC 95% 2,858-3,674 | 0%52,6% | |
| Shohat et al.46 | HbA1C e infección profunda (10 estudios): OR 1,49Análisis subgrupos HbA1C 7% (6 estudios): OR 0,87 | IC 95% 0,94-2,37IC 95% 0,57-1,32 | 81,3%54,2% | ||
| Genética | Zhou et al.49 | Consultar estudio primario | |||
| Artritis reumatoide | Lee et al.43 | Infección profunda: OR 2,04Revisión séptica: OR 1,89 | IC 95% 1,37-3,05IC 95% 1,34-2,66 | 22-44% | |
| Prótesis bilateral simultanea | Xu et al.50 | Simultánea vs. separada: OR 0,57Grupos demográficos comparables: OR 0,55 | IC 95% 0,49-0,66IC 95% 0,21-1,40 | 0% | |
| Fijación | Kunutsor et al.37 | Todo cementado vs. no cementado: RR 1,10Análisis de subgrupo 6 meses seguimiento: RR 0,75Cementación sin antibiótico vs. no cementado: RR 1,50Cementación con antibiótico vs. no cementado: RR 1,07Cementación sin antibiótico vs. con antibiótico: RR 1,52 | IC 95% 1,04-1,17IC 95% 0,63-0,89IC 95% 1,27-1,77IC 95% 0,97-1,18IC 95% 1,36-1,70 | 39-53% | |
| Bacteriuria asintomática | Sousa et al.35 | Asociación de bacteriuria asintomática e infección protésica: OR 3,64Asociación de infección entre tratados y no tratados con antibiótico: OR 0,98 | IC 95% 1,40-9,42IC 95% 0,39-2,44 | 0-73% | |
| Malnutrición | Tsantes et al.34 | En infección protésica: OR 3,62PTR (2 estudios): OR 2,55PTH (1 estudio): OR 3,10 | IC 95% 2,33-5,64 | 75% | |
| ITU | Wang et al.32 | RR 3,17 | IC 95% 2,19-4,59 | 0% | |
| Artrosis postraumática | Liu et al.44 | OR 1,98 | IC 95% 1,52-2,57 | 58% | |
| VHC | Cheng et al.48 | Infección protésica: OR 2,72PTR (4 estudios) OR 2,06PTC (5 estudios) OR 1,71 | IC 95% 1,50-4,93IC 95% 1,90-2,24IC 95% 1,50-1,94 | 0-98% | |
| Corticoides intravenosos | Feeley et al.51 | Infección con dosis baja única (7 estudios): OR 0,00Infección con dosis alta única (6 estudios): OR 0,00Infección con dosis baja y múltiple (13 estudios): OR 0,00PTR Infección cualquier dosis (14 estudios): OR 0,01PTC Infección cualquier dosis (7 estudios): OR 0,01 | IC 95% 0-0IC 95% 0-0IC 95% 0,02-0,02IC 95% 0,04-0,08IC 95% 0,03-0,02 | 0% | |
| Opioides | Chen et al.39 | Infección profunda (3 estudios): OR 1,36 | IC 95% 1,08-1,71 | 78% |
DM: diferencia de medias; IC: intervalo de confianza; IMC: Índice de masa corporal; ITU: infección del tracto urinario; ND: no disponible; OR: odds ratio; PTC: prótesis total de cadera; PTH: prótesis total humeral; PTR: prótesis total de rodilla; RR: riesgo relativo; RS: revisión sistemática; VHC: virus de la hepatitis C.
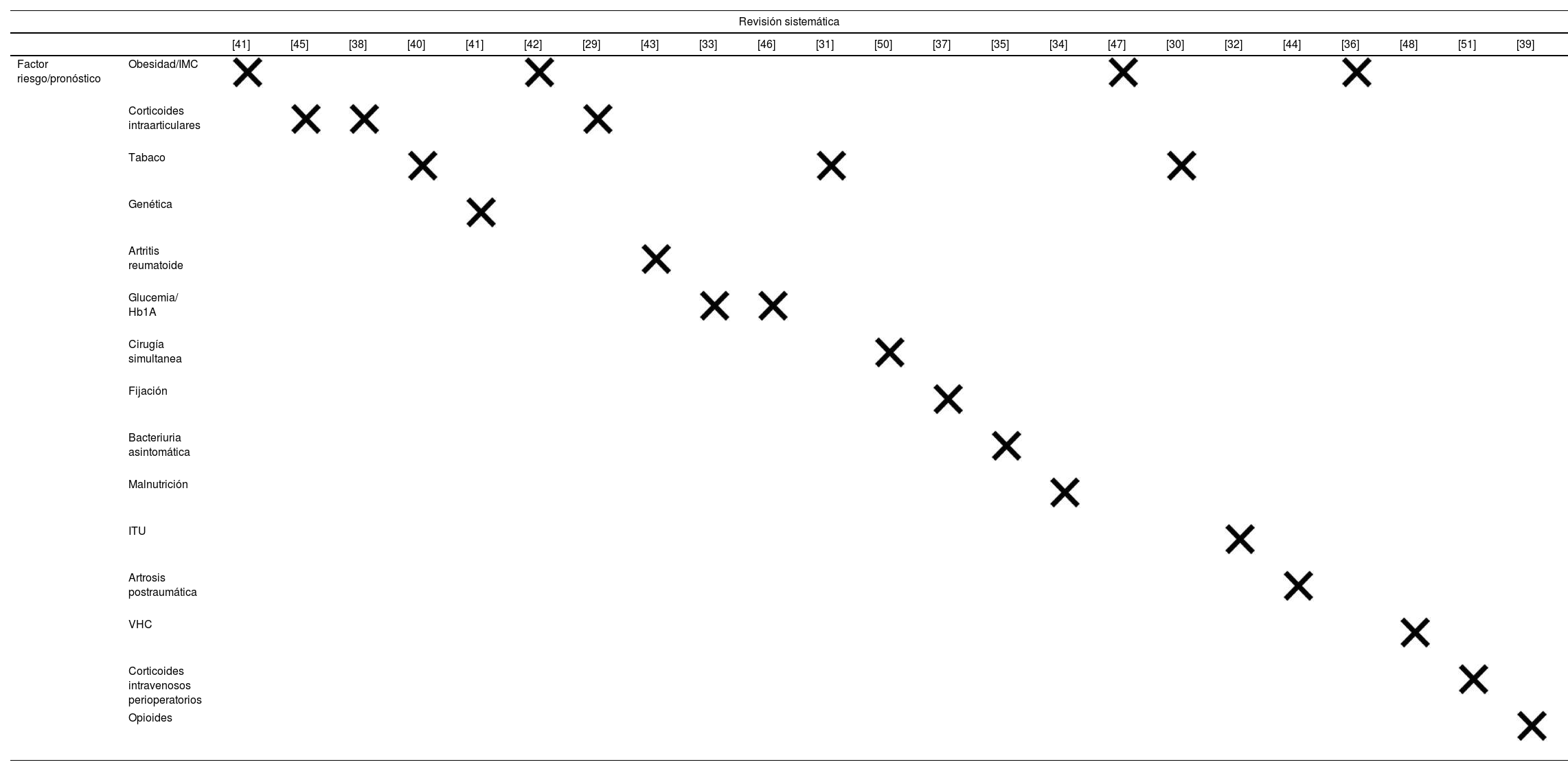
Solapamiento entre revisiones sistemáticas y factores de riesgo/pronósticos
| Revisión sistemática | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| [41] | [45] | [38] | [40] | [41] | [42] | [29] | [43] | [33] | [46] | [31] | [50] | [37] | [35] | [34] | [47] | [30] | [32] | [44] | [36] | [48] | [51] | [39] | ||
| Factor riesgo/pronóstico | Obesidad/IMC | |||||||||||||||||||||||
| Corticoides intraarticulares | ||||||||||||||||||||||||
| Tabaco | ||||||||||||||||||||||||
| Genética | ||||||||||||||||||||||||
| Artritis reumatoide | ||||||||||||||||||||||||
| Glucemia/ Hb1A | ||||||||||||||||||||||||
| Cirugía simultanea | ||||||||||||||||||||||||
| Fijación | ||||||||||||||||||||||||
| Bacteriuria asintomática | ||||||||||||||||||||||||
| Malnutrición | ||||||||||||||||||||||||
| ITU | ||||||||||||||||||||||||
| Artrosis postraumática | ||||||||||||||||||||||||
| VHC | ||||||||||||||||||||||||
| Corticoides intravenosos perioperatorios | ||||||||||||||||||||||||
| Opioides | ||||||||||||||||||||||||
IMC: índice de masa corporal; ITU: infección del tracto urinario; VHC: virus de la hepatitis C.
Grado de solapamiento en obesidad: [Solapamiento %: 16/60 = 26,6%; AC: 84/60×4 = 0,35; ACC: (84-60)/(60×4-60) = 0,133 = 13,3%]
Grado de solapamiento en corticoides intraarticulares: [Solapamiento %: 8/12 = 66,6%; AC: 27/12×3 = 0,75; ACC: (27-12)/(12×3-12) = 0,625 = 62,5%]
Grado de solapamiento en tabaco: [Solapamiento %: 4/18 = 22,2%; AC: 25/18×3 = 0,462; ACC: (25-18)/(18×3-18) = 0,194 = 19,4%]
Grado de solapamiento en glucemias mal controladas: [Solapamiento %: 4/19 = 21,05%; AC: 23/19×2 = 0,605; ACC: (23-19)/(19×2-19) = 0,2105 = 21%]
Con respecto al grado de superposición entre las revisiones, el ACC para obesidad, corticosteroides intraarticulares, tabaquismo y diabetes no controlada fue del 13,3%; 62,5%; 19,4% y 21% respectivamente (tabla 4; ver anexos 3, 4, 5 y 6, respectivamente), todos ellos con un alto o muy alto grado de superposición. En las revisiones que evaluaron el uso de corticosteroides intraarticulares, la ACC general fue del 62,5%, aunque 2de las 3revisiones mostraban una superposición total (ACC del 100%).
Clasificamos los 15 factores pronósticos en modificables o no modificables e individuales o procedimentales. Los factores modificables fueron obesidad, tabaquismo, bacteriuria asintomática, ITU, desnutrición, inyección intraarticular e intravenosa de corticoides, ingesta de opioides, tipo de fijación y cirugía simultánea. Los factores no modificables fueron la artrosis postraumática y la genética o ciertos polimorfismos. Existe otro grupo de factores no modificables pero controlables, como la diabetes no controlada, la artritis reumatoide o el VHC. Los factores caracterizados como individuales incluyeron obesidad, tabaquismo, diabetes no controlada, bacteriuria asintomática, ITU, desnutrición, artrosis postraumática, genética, artritis reumatoide o VHC. Los factores de procedimiento fueron la inyección intraarticular e intravenosa de corticoides, la ingesta de opioides, el tipo de fijación y la cirugía simultánea.
La evidencia y los resultados de asociación entre cada factor pronóstico y la infección protésica se resumen de forma narrativa a lo largo de la RS:
- -
Obesidad: las 4RS que evaluaron la obesidad mostraron un mayor riesgo de infección protésica asociado a este factor. Ma et al.42 encontraron que esta asociación persiste al categorizar por niveles de índice de masa corporal (IMC) y diseño del estudio (prospectivo/retrospectivo), y al comparar pacientes con sobrepeso y con peso normal.
- -
Uso intraarticular de corticoides: las 3RS mostraron resultados ligeramente discrepantes, aunque todas apuntaron hacia un mayor riesgo de infección protésica relacionado con el factor, la significación estadística varía entre RS. Charalambous et al.45 proporcionaron resultados no concluyentes.
- -
Tabaquismo: las 3RS incluidas concluyeron que los fumadores activos tienen mayor riesgo de presentar una infección profunda tras un remplazo articular primario. Bedard et al.31 también demostraron un mayor riesgo entre los exfumadores en relación con los pacientes que nunca habían fumado antes. También demostraron que en los fumadores el riesgo de infección disminuye al dejar de fumar.
- -
Diabetes no controlada: en las 2RS incluidas vemos un aumento del riesgo de infección protésica relacionado con la elevación del nivel de glucosa en sangre o en los valores de HbA1c. El mayor riesgo se asoció con la elevación de la glucosa en sangre durante el perioperatorio, pero no con la HbA1c en el preoperatorio. La heterogeneidad entre los estudios incluidos fue alta: del 81%46.
- -
Otros factores estudiados: la artritis reumatoide, la bacteriuria asintomática, la desnutrición, la ITU, la artrosis postraumática, el VHC y el uso de opioides preoperatorios se asociaron a un mal pronóstico en pacientes con prótesis. Seis polimorfismos genéticos de los 33 estudiados en la RS por Zhou et al.49 se asociaron con un mayor riesgo de infección protésica, mientras que otros actuaron como factores protectores o no se pudo establecer la relación causal. La cementación de la prótesis articular también se ha detectado como un factor de mal pronóstico para infección protésica, sin embargo, en el análisis por subgrupos se observa que esta relación desaparece si la cementación se realiza con antibióticos37. Por último, 2de los factores, como son el uso de corticoides intravenosos durante la cirugía y la cirugía simultánea de prótesis bilateral de cadera o rodilla, no se asociaron significativamente con infección protésica50,51. Si bien la cirugía simultánea bilateral de prótesis de cadera o rodilla inicialmente se presentó como un factor protector, al analizarlo según grupos comparables vimos que no existe tal relación50.
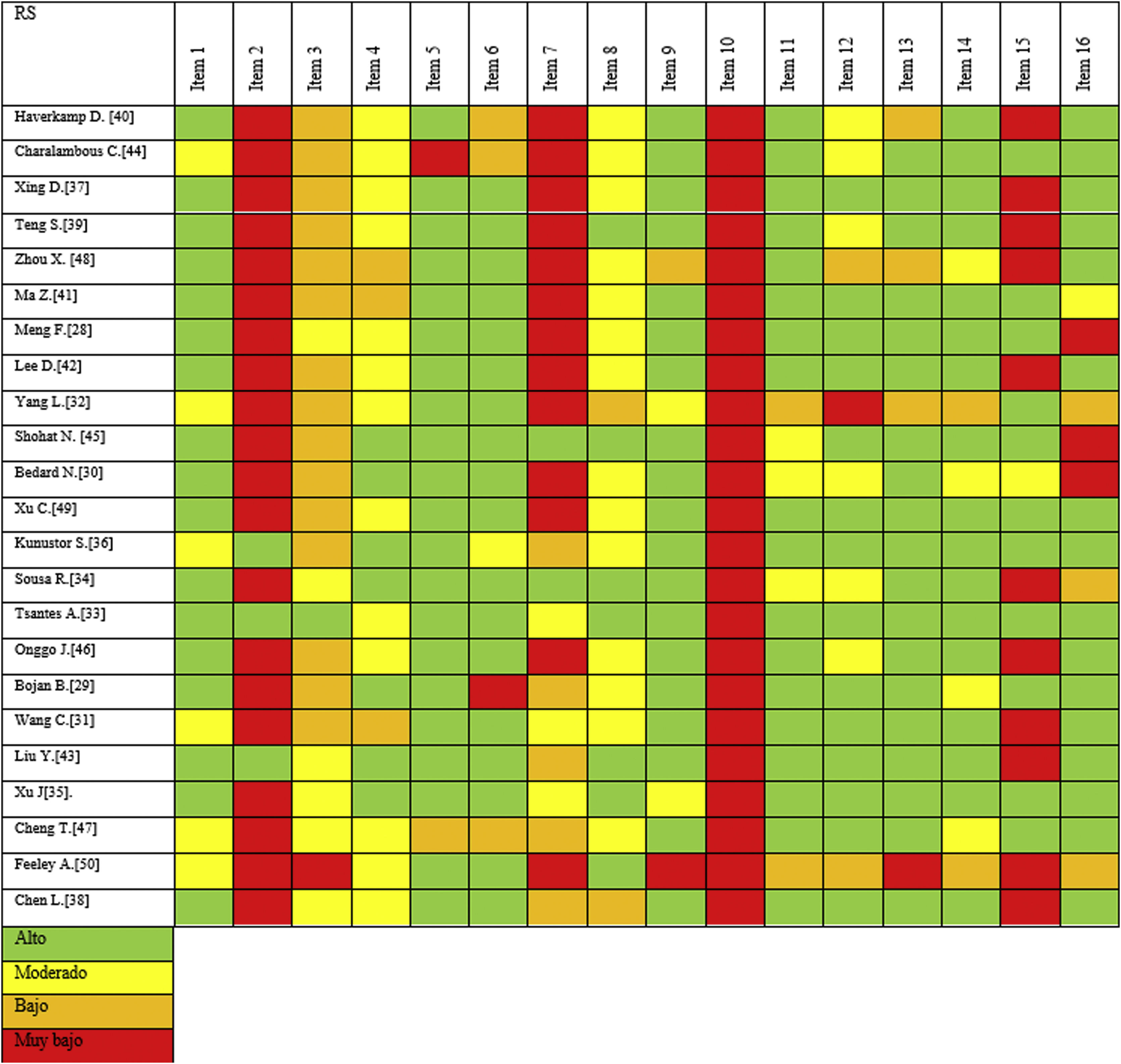
Realizamos la evaluación metodológica mediante la herramienta AMSTAR-2, modificando los ítems 1 y 9. La figura 3 presenta gráficamente el AMSTAR 2 revisado. Aunque, en general, todos las RS incluidas mostraron lagunas metodológicas importantes, las RS más recientes mostraron una mejor calidad metodológica. Por ejemplo, como se muestra en el ítem 7, donde la mayoría de los estudios no informan, o solo informan muy brevemente, de las razones de exclusión de los estudios primarios; solo 2RS proporcionaron información detallada sobre los motivos de exclusión de cada estudio31,33. Los otros 2elementos modificados (es decir, 1 y 9) se consideraron de calidad de moderada a adecuada. Además, otros 2ítems mostraron resultados extremadamente deficientes, con solo 3RS que informaron de la implementación de un protocolo (el 2) y ninguno informó sobre la financiación de los estudios primarios incluidos (el 10).
Otros ítems presentaron puntuaciones bajas o moderadas, como la justificación del diseño (el 3), la exhaustividad con la que se realizó la búsqueda bibliográfica (el 4) y el detalle con el que se transcribe la información de los estudios primarios (el 8). Once de las 23 RS incluidas no realizaron una adecuada investigación del sesgo de publicación, evaluado con el ítem 15.
DiscusiónSegún nuestro conocimiento, esta revisión de RS es la primera que evalúa los factores pronósticos relacionados con la infección protésica y examina la calidad metodológica de las diferentes RS pronósticas. Identificamos 13 factores pronósticos relacionados con infección protésica: obesidad, inyección intraarticular de corticoides, tabaquismo, diabetes no controlada, artritis reumatoide, bacteriuria asintomática, desnutrición, ITU, artrosis postraumática, VHC, ingesta preoperatoria de opioides, algunos polimorfismos genéticos y cementación sin antibióticos. No se encontró asociación entre infección protésica y 2factores adicionales: uso de corticoides intravenosos perioperatorios y cirugía bilateral simultánea.
Con esta síntesis narrativa pudimos clasificar los factores en modificables y no modificables, individuales o procedimentales. Esta clasificación permite al clínico detectar aquellos factores pronósticos que pueden modificarse en la práctica diaria para proporcionar mejores resultados a los pacientes, como la inyección intraarticular de corticoides.
Las RS nos permiten resumir en un solo estudio los resultados de varios estudios primarios y así integrar la información disponible de varios artículos con el objetivo de reforzar la investigación. Las revisiones de RS contribuyen a una mejor comprensión de los estudios superpuestos entre RS que abordan preguntas similares24. Así, encontramos 3RS que estudian el uso de corticoides intraarticulares y obtienen resultados diferentes. Charalambous et al.45 demostraron que no existe asociación entre la inyección intraarticular de corticosteroides antes de la cirugía y la infección protésica. Sin embargo, Meng et al.29 y Xing et al.38 mostraron asociación. Al estudiar el solapamiento en los estudios primarios utilizados en cada una de estas 3RS, vemos un grado de solapamiento muy alto (CCA=62%). Vale la pena señalar que las 2revisiones con una superposición del 100% presentaron resultados contradictorios. Una posible explicación es el uso de diferentes estimadores de asociación como OR y RR: la OR es más adecuada para estudios de casos y controles, como sucede en nuestro caso, y el RR para estudios de cohortes55.
Las RS incluidas que estudian obesidad, tabaquismo o diabetes no controlada también mostraron un solapamiento muy alto o alto, con un ACC del 13,3%; 19,4% y 21%, respectivamente. En todos ellos, los resultados indicaron que estos factores están relacionados con la infección protésica y se consideran factores pronósticos.
Al igual que en otros estudios primarios, la investigación secundaria que utiliza RS cuenta con una serie de guías y manuales para asegurar un correcto reporte, evitar sesgos y así mejorar la calidad metodológica. Las RS pronósticas presentan particularidades respecto a las RS de intervención o diagnóstico. Al iniciar un estudio pronóstico, la pregunta de investigación debe considerar el tiempo de estudio y el diseño del estudio. Por lo tanto, las preguntas se formulan de acuerdo con las siglas PICOT-S (población, intervención o comparación, resultado, tiempo y diseño del estudio)19. Otros puntos importantes para asegurar un correcto desarrollo de la RS pronóstica están todavía en desarrollo, como un repertorio específico para la búsqueda de estudios primarios o estrategias de búsqueda más sensibles11. Además, existe un mayor riesgo de sesgo de publicación en este tipo de RS frente a las RS de intervención, dado que los estudios observacionales no se registran prospectivamente de la misma forma que los ensayos aleatorizados. En cuanto a los manuales específicos, solo existen para RS de intervención. Se han publicado varias referencias que ayudan a elaborar una RS pronóstica, pero aún no existe una guía completa19. La evaluación del riesgo de sesgo en las RS pronósticas se puede hacer mediante la herramienta ROBIS, que es una herramienta específica para evaluar el sesgo en todo tipo de RS (intervención, diagnóstico, etiológico o pronóstico)22.
En general, el riesgo de sesgo en la RS pronóstica en el campo ortopédico es alto. En las RS incluidas en este estudio, este sesgo se debe principalmente a una incorrecta extracción de datos o síntesis de la información, cuyo punto más débil son los estudios de sesgo de publicación. En algunos casos, la no realización de estas exploraciones se justifica por el escaso número de estudios primarios incluidos en la RS.
Otro vacío en la investigación pronóstica es la necesidad de una herramienta para evaluar la calidad metodológica. El AMSTAR-2 es una herramienta específica para RS de intervención que incluye tanto estudios aleatorizados como no aleatorizados21. Ante esta situación y con el fin de evaluar la calidad metodológica de nuestras RS pronósticas, modificamos la herramienta. Los cambios consistieron en rectificar la pregunta de investigación para incluir los términos tiempo de estudio y diseño del estudio, según las siglas PICOT-S, en el ítem 1. El otro cambio se hizo en uno de los dominios críticos: el ítem 9 para incluir escalas de evaluación de sesgos dedicadas a estudios pronósticos (casos y controles o cohortes). Al aplicar esta herramienta AMSTAR-2 modificada para estudio pronóstico, observamos una baja calidad metodológica. Algunos de los elementos de esta herramienta mejoraron con el tiempo. Esto puede suceder porque coincide con la publicación de ciertos trabajos que buscan mejorar la calidad19. Otros ítems, sin embargo, no han mejorado, como sería el reporte de la financiación de los estudios primarios incluidos en las RS. En el ítem 3, nuestro grupo consideró que la justificación de los diseños de los estudios incluidos no era suficientemente sólida. Aunque el mejor diseño para abordar la evidencia del pronóstico son los estudios observacionales, en ciertas circunstancias se pueden usar ensayos clínicos aleatorizados37. Este trabajo aporta una herramienta que, aunque aún debe ser validada, permite la valoración metodológica de RS pronósticas: a través de ella pueden iniciarse estudios de desarrollo y validación.
Este trabajo presenta algunas limitaciones56. Primero, limitamos los criterios de elegibilidad a los estudios que evaluaron un solo factor pronóstico específico, excluyendo a aquellos que exploraron múltiples factores o modelos predictivos. Segundo, como en cualquier investigación secundaria, la calidad de nuestros resultados va a depender de la calidad de las RS incluidas y de los estudios primarios incluidos; debido al riesgo de sesgo de la mayoría de las RS incluidas y las limitaciones metodológicas y posibles solapamientos, las conclusiones de esta revisión son limitadas.
Entre las fortalezas de este trabajo se encuentran el registro prospectivo del protocolo, la evaluación rigurosa del riesgo de sesgo y la calidad metodológica, y una estrategia de búsqueda diseñada por un especialista en información con experiencia. Además, proporcionamos una contribución al revisar AMSTAR-2 para RS pronósticas de manera que pueda ser aplicada en un futuro para un trabajo exploratorio.
Es importante conseguir una mejor evidencia sobre los factores que influyen en la recuperación de un proceso quirúrgico, como la implantación de una artroplastia articular. Por ello, la utilización de registros permitiría analizar con mayor claridad, no solo el número total de artroplastias implantadas en una región, sino también las distintas complicaciones, como la infección asociada a estas intervenciones. Estos registros son ampliamente utilizados en países nórdicos como Suecia o Dinamarca pero, aunque en España se ha discutido en varios foros, no disponemos de él56.
ConclusionesLa identificación de factores pronósticos modificables permite adoptar medidas en el ámbito clínico que contribuyan a mejores resultados en los pacientes tratados mediante cirugía de reemplazo articular. Más importante aún, la identificación de los factores modificables procedimentales puede dar a nuestros pacientes una mejor oportunidad en este tipo de cirugía. Encontramos una superposición importante entre RS, lo que indica que nuestra investigación en cirugía ortopédica es redundante. Se requieren mayores esfuerzos para reducir el riesgo de sesgo y mejorar la calidad metodológica de este tipo de RS en nuestro ámbito.
Nivel de evidenciaNivel de evidencia II.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
A Ivan Solà por su ayuda como documentalista para la búsqueda bibliográfica.